丙烯酰胺(acrylamide,AM)是一种有机化合物,具有显著的神经毒性、生殖毒性及染色体毒性等,已被国际癌症研究组织列为2A类致癌物[1]。丙烯酰胺是美拉德反应、天冬酰胺合成、脂肪酸氧化等多种反应途径的副产物[2],其含量还与产品颜色和气味具有一定的相关性[3]。研究表明丙烯酰胺广泛存在于油炸马铃薯[4]、烘焙咖啡[5]、烤肉[6]等经过煎炸、焙烤的高温加工食品中。烤鸡胸肉作为高温加工食品中的一员已成为人们日常生活中非常重要的美食,如何降低或者抑制烤鸡胸肉在高温加工过程中丙烯酰胺的合成,促进人们健康饮食具有重要意义。
美拉德反应是引起烤鸡中丙烯酰胺的主要成因,因此选择一种具有抗氧化能力的添加剂,阻止羰氨反应底物/中间体氧化以及吸收链式反应中的自由基,从而抑制丙烯酰胺的形成具有重要意义[7]。多酚、黄酮和有机酸类物质阻断链式反应具有明显的效果,被用于热加工前对原料辅助处理,抑制丙烯酰胺的形成[8]。沙棘和酸浆富含多酚和黄酮类等物质[9],且成分具有一定的相似性[10],体外抗氧化活性显著。其中,沙棘果的羟自由基的IC50值能达到0.45 mg/mL[11],在抑制丙烯酰胺的产生上具有较大的潜力。沙棘和酸浆果提取物的气味不明显,相较于黑胡椒、百里香等具有刺激性气味的添加物,对产品风味的影响更小。并且,果实提取物比单一添加剂更能减轻消费者的抵触情绪。
鸡胸肉具有高蛋白低脂的特点,烘烤类鸡肉制品备受市场追捧。在肉制品领域,现有研究更多关注于如何抑制加工过程中丙烯酰胺的产生,例如调整工艺、降低加工温度、热水漂烫或浸渍液预处理等,还有在原料内掺入具有抗氧化效果的添加剂,都对丙烯酰胺的产生有不等的抑制效果[12]。但关于烘烤肉制品在贮藏过程中丙烯酰胺的报道较少,尤其是沙棘果和酸浆果提取物作用于鸡胸肉后,烤鸡胸肉在贮藏过程中丙烯酰胺含量变化规律未见报道。我国和欧盟已出台相关规范控制各类食品中丙烯酰胺的含量,如何降低热加工鸡胸肉中丙烯酰胺含量迫在眉睫。基于上述原因,本研究采用沙棘果和酸浆果提取物预浸渍鸡胸肉,参考对熟肉食品贮藏产生主要影响的因素,控制贮藏温度、贮藏时间及是否真空包装为变量,揭示烤鸡胸贮藏30 d过程中丙烯酰胺及外观品质的变化规律,为沙棘果和酸浆果提取物抑制丙烯酰胺的形成提供科学依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉来自于草原兴发绿鸟鸡;抗坏血酸、槲皮素(分析纯),上海阿拉丁生化科技股份有限公司;丙烯酰胺标准品、13C3丙烯酰胺标准品(1 000 μg/mL甲醇溶液),曼哈格(上海)生物科技有限公司;沙棘果提取物,兰州沃特莱斯生物科技有限公司;酸浆果提取物,陕西百草鑫田生物科技有限公司。
1.2 仪器与设备
PM100高效液相色谱仪,日立仪器有限公司;460型自动真空包装机,北京日上公司;30型烘烤炉,诸城市众运工贸有限公司;XHF-DY内切式匀浆机,宁波新芝生物科技有限公司;SX-500全自动高压灭菌锅,日本TOMY Digital Biology;HC-2518R高速冷冻离心机,安徽中科中佳科学仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D3循环水式真空泵,巩义市子华仪器有限公司;KQ-300E超声波清洗机,昆山市超声仪器有限公司;CR-20手持式色差仪,日本柯尼卡美能达。
1.3 实验方法
1.3.1 烤鸡胸肉样品的制作方法
制备浸渍液:分别称取沙棘和酸浆果提取物0.05、0.10、0.20、0.50 g于1 L容量瓶中,纯水定容,得到质量浓度为0.05、0.10、0.20、0.50 g/L的沙棘和酸浆果浸渍液。
鸡胸肉预处理:冷冻鸡胸肉置于流动的自来水中解冻,将鸡胸肉切割成质量为(5.00±0.10) g的小块,分别置于不同浓度的沙棘和酸浆果浸渍液中浸泡15 min。等体积纯水浸泡组作为对照,浸泡结束沥干水分备用。
制备烤鸡胸肉:烤箱预热至180 ℃,将样品均匀放置在烤箱内中心点附近烤制30 min,取出冷却并置于铝箔复合真空袋内抽真空,121 ℃灭菌锅中15 min,自然冷却并开始贮藏。铝箔复合真空袋真空抽气时间为10、30 s,其中10 s抽气组作为残留氧对照组。鸡胸肉分别在4 ℃和25 ℃下贮藏30 d,每隔15 d取样检测,3组平行样品。
1.3.2 丙烯酰胺的检测
丙烯酰胺的提取:烤鸡胸肉中丙烯酰胺的提取参考李潇潇[12]方法。准确称取已破碎处理的烤鸡胸肉样品1.000 g于离心管内,依次加入16 mL超纯水及10 mg/L13C3丙烯酰胺内标工作液10 μL,亚铁氰化钾溶液(10%,体积分数)和乙酸锌溶液(20%,体积分数)各2 mL。10 000 r/min匀浆30 s后的样品置于0 ℃高速离心机中8 000 r/min离心15 min。上清液中加入5 mL正己烷洗涤2次,得到丙烯酰胺粗提液。1 mL粗提液加入已被3 mL甲醇活化的SPE柱中,并用4 mL 80%(体积分数)甲醇水溶液洗脱,减压抽干收集全部过滤液和洗脱液,在35 ℃旋转蒸发仪中蒸干,用2 mL色谱级甲醇溶解沉淀物,在0.22 μm有机系针头过滤器过滤,待测。
检测参数:高效液相色谱仪配备Shim-pack GIST C18-AQ型色谱柱(5 μm, 4.6 mm×250 mm),检测波长为210 nm。色谱柱温为40 ℃,进样体积为20 μL,流动相为95%超纯水和5%的甲醇溶液等梯度洗脱,流速为0.6 mL/min。
1.3.3 烤鸡胸肉色差的测定
烤鸡胸肉颜色的测定参考肉孜·阿木提等[13]方法。采用标准校准白板CR-A43(L/93.80;a/0.315 6;b/0.331 9)对色差仪进行校准,然后将烤鸡胸肉样品置于测量口进行测量,读取色差中的L*、a*、b*值,重复测量3次。以样品0 d的数据为L0、a0、b0由公式(1)~公式(3)计算得到色差值:
ΔL=L*-L0
(1)
Δa=a*-a0
(2)
Δb=b*-b0
(3)
1.3.4 抗氧化能力的测定
维生素C、槲皮素、沙棘果和酸浆果提取物抗氧化能力的测试参考林继辉等[14]方法。分别称取一定量的维生素C、槲皮素、沙棘果和酸浆果提取物,分别配制成质量浓度为0.05、0.1、0.2、0.3、0.4、0.5 g/L乙醇溶液。
DPPH自由基清除能力的测定:DPPH工作液浓度为125 μmoL/L。试管中分别加入待测液和DPPH工作液各2 mL,充分振荡后静置30 min等待反应完成,分别测定各反应液于517 nm处吸光值,甲醇作空白对照。DPPH自由基清除率的计算如公式(4)所示:
DPPH自由基清除率![]()
(4)
式中:Ac为甲醇加2 mL DPPH工作液的吸光值;Ai、Aj分别为待测液加入2 mL DPPH和2 mL甲醇测得的吸光值。
氧化自由基吸收能力[15](oxygen radical absorbance capacity,ORAC):配制504 nmol/L的荧光素钠指示液(pH=7.4 PBS),将12.515 mg Trolox和231.46 mg 2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-azobis-2-methyl-propanimidamide dihydrochloride,AAPH)分别用PBS溶液溶解并定容至50 mL备用。在96孔板中依次加入样品稀释液、PBS溶液或Trolox标准液各25 μL,在37 ℃下孵育10 min后加入AAPH溶液150 μL,混匀并开始计时。在485 nm的激发波长及538 nm的发射波长下记录2 h内的读数,间隔为2 min。样品的ORAC值由公式(5)计算得出:
样品的ORAC值![]()
(5)
式中:AUCSample、AUC+AAPH和AUCTrolox分别为样品、AAPH和Trolox荧光衰减曲线下的净面积。
1.4 数据处理
采用ChromAssist Data Station的自动积分模式计算样品中丙烯酰胺的峰面积(S),结合丙烯酰胺标准曲线按公式(6)计算鸡胸肉中丙烯酰胺的含量(X,mg/kg),样品质量为m(g):
(6)
采用Minitab 19对数据统计和方差分析(LSD法),Origin 2013制图。
2 结果与分析
2.1 不同天然抗氧化剂抗氧化能力对比分析
抑制或者阻断合成丙烯酰胺所需的相关中间体和活性基团是提升烤鸡胸肉贮藏品质的重要手段。酸浆果和沙棘果提取物中存在具有DPPH自由基清除能力的多酚和黄酮类物质,且沙棘果黄酮质量浓度为0.5 g/L时,DPPH自由基和羟自由基的清除率分别约为22%和58%,优于同等浓度的维生素C溶液[14]。维生素C和槲皮素在肉制品、谷物类食品等加工过程抑制丙烯酰胺具有显著的效果[16]。4种天然抗氧化剂的DPPH自由基清除率和氧化自由基清除能力分别如图1-A和图1-B所示。由图1-A可知,自由基清除能力随着浓度的增加呈现出上升的趋势。DPPH自由基清除能力大小为维生素C>槲皮素>酸浆果提取物>沙棘果提取物。由图1-B可知,4种天然抗氧化剂在质量浓度为0.5 g/L下氧化自由基吸收能力为维生素C>酸浆果提取物>沙棘果提取物>槲皮素,酸浆和沙棘果提取物的氧化自由基吸收能力分别为11.57 mmol TE/g和10.93 mmol TE/g。这说明抗氧化剂对2种自由基的吸收能力体现出差异性,沙棘和酸浆果提取物虽然对DPPH自由基的吸收效果不及对照物,但对氧化自由的吸收仍有一定竞争力。

A-DPPH自由基清除能力;B-氧化自由基吸收能力
图1 四种天然抗氧化剂抗氧化能力
Fig.1 Comparative of antioxidant capacity of four natural antioxidants
注:B图中沙棘果和酸浆果提取物质量浓度为0.5 g/L。
2.2 不同浓度沙棘果和酸浆果提取物对鸡胸肉中丙烯酰胺的影响
维生素C是评估抗氧化性时常用的基准物质,槲皮素是比芦丁抗氧化活性更强的黄酮类代表物质,两者在肉制品、谷物类食品等加工过程抑制丙烯酰胺(acrylamide,AM)具有显著的效果,研究发现浓度为0.6%维生素C和槲皮素溶液处理甘薯片对AM的抑制能力分别为78.93%和88.29%[16]。本实验中以未浸渍、纯水浸渍、0.1 g/L槲皮素和0.1 g/L维生素C浸渍为空白对照,贮藏时间为0 d,对比研究0.05~0.5 g/L不同质量浓度沙棘果和酸浆提取物抑制鸡胸肉中丙烯酰胺的影响如图2所示,未浸渍的鸡胸肉中丙烯酰胺含量为65.82 mg/kg,而纯水浸渍处理的鸡肉中丙烯酰胺含量略低于未处理组,约为61.70 mg/kg。而低浓度维生素C处理组丙烯酰胺含量仅为35.08 mg/kg,远低于未处理组。低浓度槲皮素处理组AM含量为45.88 mg/kg,略高于同浓度维生素C处理组,但显著低于未处理组。随着沙棘果提取物浸渍浓度的增加,鸡胸肉中丙烯酰胺含量呈现出先降低后增加的趋势。与沙棘提取处理组不同,随着酸浆果提取物浸渍浓度的增加,鸡胸肉中丙烯酰胺含量由43.03 mg/kg增加到50.54 mg/kg,后降低到38.78 mg/kg。质量浓度为0.2 g/L时,沙棘果和酸浆果提取物的抑制率约为25.9%,随着浓度增加,沙棘的抑制能力减弱,但仍然优于空白和对照组,这可能是由于抗氧化剂在一定浓度范围内具有促氧化作用这一抗氧化悖论现象的出现导致[17],植物提取物中的活性基团在某些情况下可以充当丙烯醛途径的反应底物,从而增加AM的产生量,作为抑制剂添加,但在高浓度或(和)低浓度下表现出对AM产生的促进作用[18]。这种现象与物质的性质有关,并不在固定浓度出现。此外,沙棘果提取物和酸浆果提取物的抑制AM产生能力低于维生素C组,高于空白组和纯水组。纯水组的AM产生量低于空白组,这可能是鸡胸肉在浸渍过程中汁液溢出,且表皮处可以进行羰氨反应的底物出现微量损失[19]。以空白组对照,质量浓度为0.1 g/L时槲皮素水溶液和维生素C浸渍对鸡胸肉中AM产生的抑制率分别为26.1%、43.5%,酸浆果提取物整体表现出更强的抑制能力。除0.05 g/L外,酸浆果提取物浓度越高,抑制能力越强。
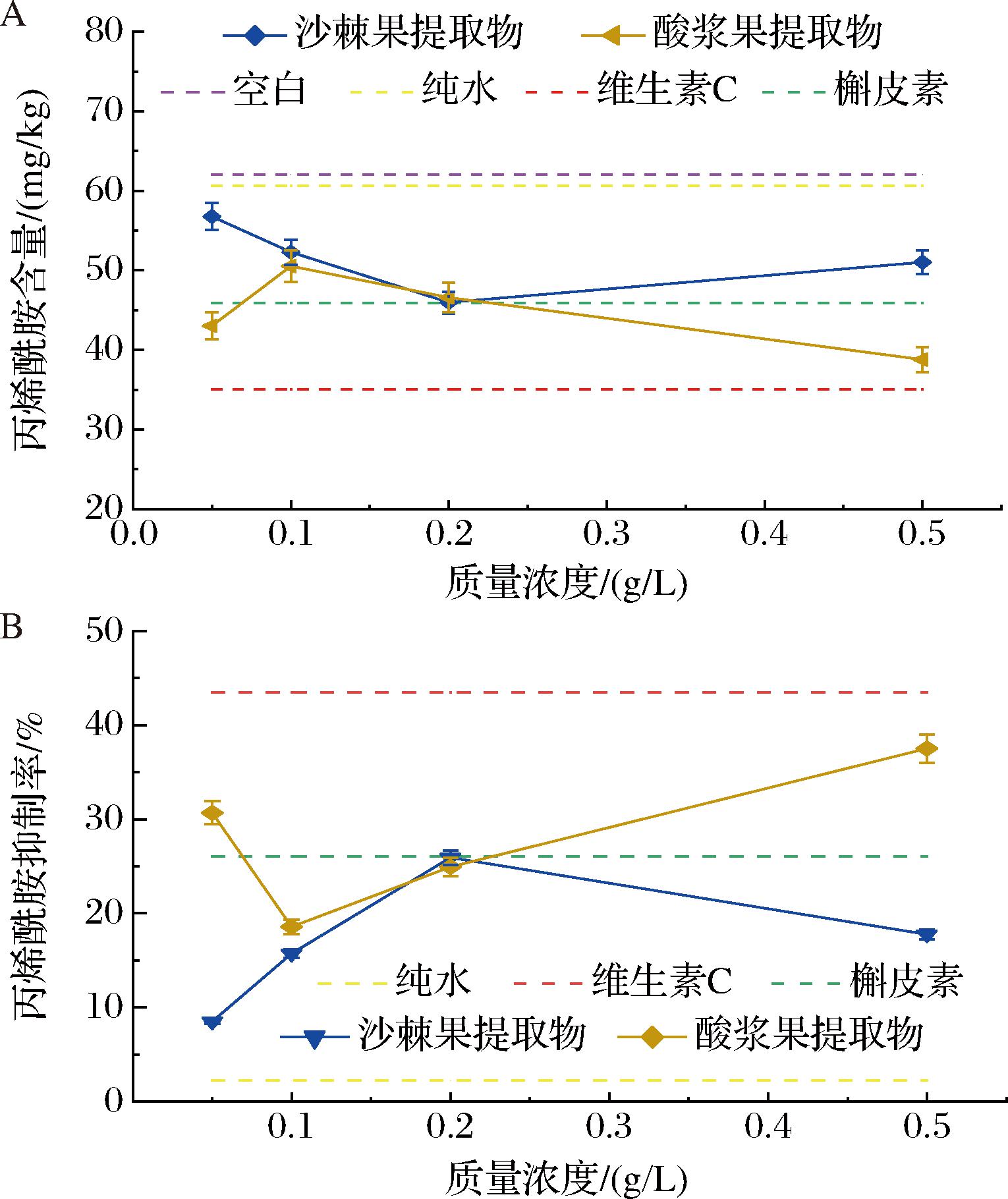
A-抑制剂处理后丙烯酰胺含量;B-抑制剂对丙烯酰胺的抑制率
图2 不同浓度沙棘果和酸浆果提取物对抑制鸡胸肉中丙烯酰胺的影响
Fig.2 Effects of different concentrations Hippophae rhamnoides L. and Alkekengi officinarum Moench fruits extracts on inhibition of acrylamide
注:抑制率计算以空白组的丙烯酰胺量为基准。
2.3 贮藏条件对鸡胸肉中丙烯酰胺的影响
以各组内0 d的丙烯酰胺含量为基准,计算贮藏期内各点的丙烯酰胺增量,得到丙烯酰胺增量图和增加速率图如图3所示。由图3-A可知,0.1 g/L不同添加剂处理鸡胸肉贮藏30 d后,25 ℃下丙烯酰胺的含量升高至110.15~147.62 mg/kg,增幅为64.27~110.15 mg/kg;4 ℃下丙烯酰胺的含量升高至78.93~133.72 mg/kg,增幅为28.39~73.04 mg/kg。25 ℃下丙烯酰胺的增量大于4 ℃,温度促进丙烯酰胺增量的增加。与其他实验组相比,且沙棘果和酸浆果提取物增量变化程度最为明显,明显抑制了丙烯酰胺的产生。由图3-B可知,4 ℃下,随着贮藏时间的延长,维生素C、槲皮素、空白和纯水组中丙烯酰胺增加速率呈现出不断增加的趋势,其中维生素C处理组的AM含量增速在20 d时达到2.15 mg/(kg·d),期间始终保持实验组的最快增速。酸浆果提取物中丙烯酰胺增加速率呈现出先增加后减少的趋势,由15 d时的1.24 mg/(kg·d)到30 d时回落至0.96 mg/(kg·d)。这是由于贮藏前期反应底物丰富,自由基反应活跃,烤鸡胸胸肉体系内仍在产生丙烯酰胺,15 d内除沙棘组外,各组丙烯酰胺增加速率趋势一致。15 d后酸浆果提取物的抑制效果开始凸显,丙烯酰胺仍在产生,但增速明显降低。沙棘果提取物中丙烯酰胺增加速率呈现出先降低后增加的趋势。贮藏15 d内均为负增长,而后由-0.82 mg/(kg·d)在30 d时升至1.23 mg/(kg·d)。这说明沙棘对丙烯酰胺的抑制比其余各组更早发挥作用,在贮藏前期就能有效降低烤鸡胸肉体系内的丙烯酰胺含量,这可能是由于抑制机制的不同造成的,沙棘果提取物能更早干预链式反应,竞争反应基团或吸收自由基。在30 d贮藏期内,酸浆果提取物在抑制丙烯酰胺增加速率具有明显的优势。
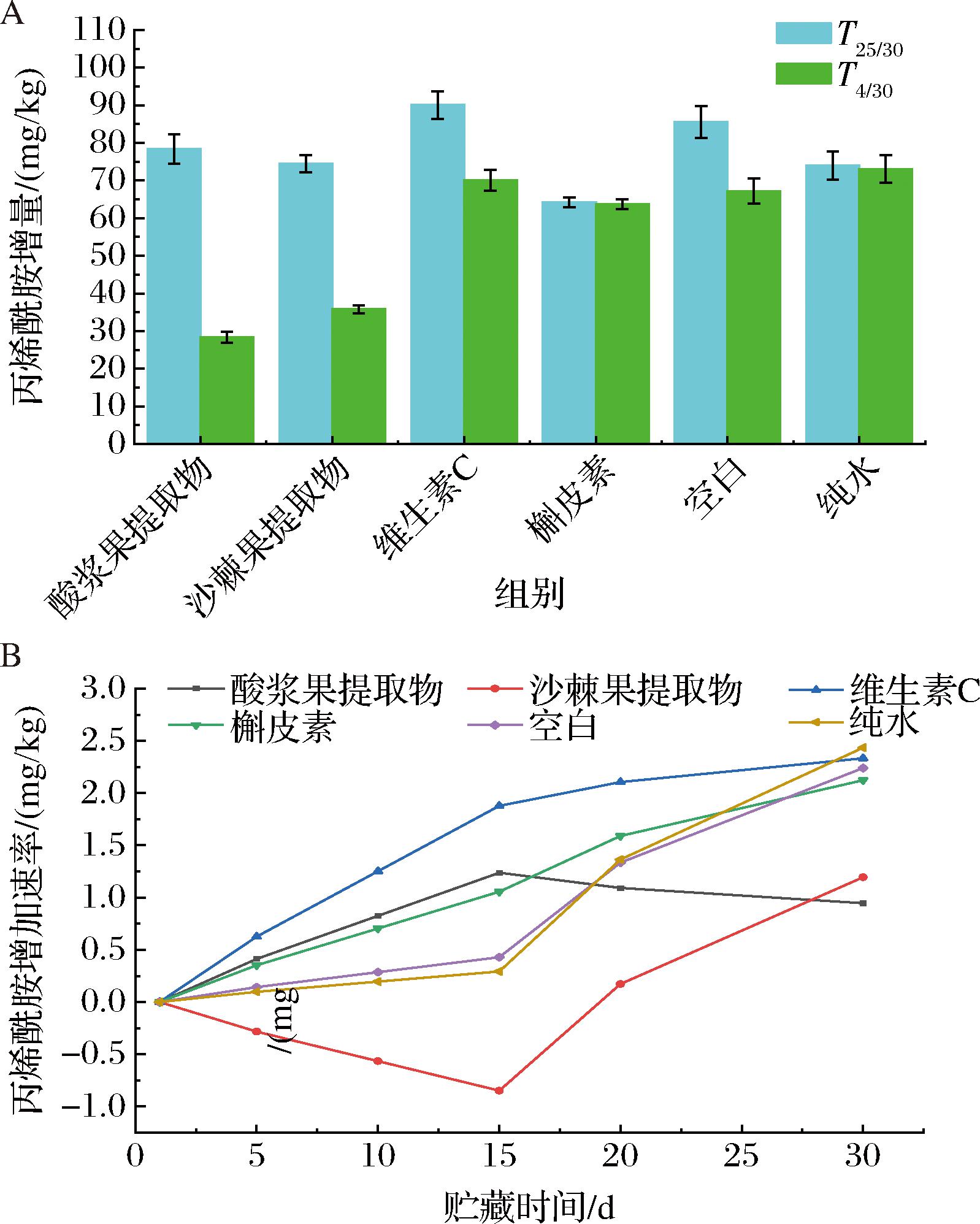
A-30 d内丙烯酰胺含量增量;B-4 ℃贮藏下丙烯酰胺的增加速率
图3 贮藏条件对抑制鸡胸肉中丙烯酰胺的影响
Fig.3 Effects of different storage temperature on inhibition of acrylamide in chicken breast meat
注:酸浆果提取物、沙棘果提取物、维生素C、槲皮素、空白和纯水处理组中丙烯酰胺的初始值分别为50.54、52.30、35.08、45.88、62.06、60.68 mg/kg。
本研究发现空白组、纯水组处理鸡胸肉贮藏过程中丙烯酰胺增量较大,而酸浆果及沙棘果提取物组在4 ℃贮藏下丙烯酰胺增量较小,且低于25 ℃,说明其在抑制丙烯酰胺产生过程中可能存在冷协同现象。低温下水分对体系内各类相关反应的阻力更大,当反应半径有限时,相较于维生素C和槲皮素这类单一的抑制剂,可能更利于复杂组分的提取物发挥对丙烯酰胺的抑制作用。且在4 ℃下,酸浆果及沙棘果提取物在抑制丙烯酰胺产生能力优于维生素C和槲皮素,酸浆果和沙棘果提取物应用于鸡胸肉烤制在一定程度上可以抑制丙烯酰胺的产生,其中酸浆果提取物效果更佳。
鸡肉在烤制过程中蛋白质及水解产物氨基酸与还原糖和其他化合物发生美拉德反应等反应产生丙烯酰胺,且鸡肉在贮藏过程中蛋白质水解反应仍比较活跃,促进丙烯酰胺产生的相关代谢路径仍然存在,导致烤鸡肉在贮藏过程中丙烯酰胺呈现出不断增加的趋势,影响烤肉的品质。本研究中鸡肉经过烤制,美拉德反应主要集中于鸡肉表层,鸡肉深层组织内部仍存在美拉德等其他反应所需的中间产物和活性自由基团,导致烤制鸡胸肉在贮藏过程中持续产生丙烯酰胺。温度越高,丙烯酰胺增量越多,低温能抑制导致丙烯酰胺产生的相关路径。随着贮藏时间延长,产生丙烯酰胺所需的反应物和活性基团逐渐减少,因此本研究25 ℃下丙烯酰胺含量高于4 ℃,且贮藏15 d前增加速率高,而15 d后增速减缓。
2.4 残氧量对烤鸡胸肉中丙烯酰胺的影响
以各组内0 d的丙烯酰胺含量为基准,计算贮藏期内各点的丙烯酰胺增量,得到不同真空抽气时间对鸡胸肉中丙烯酰胺含量的影响如图4所示,在4 ℃贮藏下,鸡胸肉经过抽气10 s处理贮藏30 d后丙烯酰胺含量为132.73 mg/kg,增量大于抽气30 s样品组的129.24 mg/kg,说明抽气时间时间越长,包装袋内氧气含量越低,丙烯酰胺增量减少,低残氧量有助于抑制丙烯酰胺的产生。在25 ℃贮藏下,鸡胸肉经过抽气10 s处理贮藏30 d后,即Cp10/25/30丙烯酰胺含量为150.21 mg/kg,增量略低于Cp30/25/30的147.62 mg/kg,但是明显高于4 ℃贮藏下的样品组,出现这种现象的原因可能是来自于温度的影响大于残氧量的影响。此外,在不同抽气时间、不同温度下,酸浆果提取物预处理鸡胸肉中丙烯酰胺的增量低于沙棘果提取物组,且4 ℃贮藏下明显优于空白组和纯水组。PALEOLOGOS等[20]报道了油炸鸡肉制品包装袋中氧气的存在能降低抗氧化剂的作用效果,从而促进丙烯酰胺的产生。
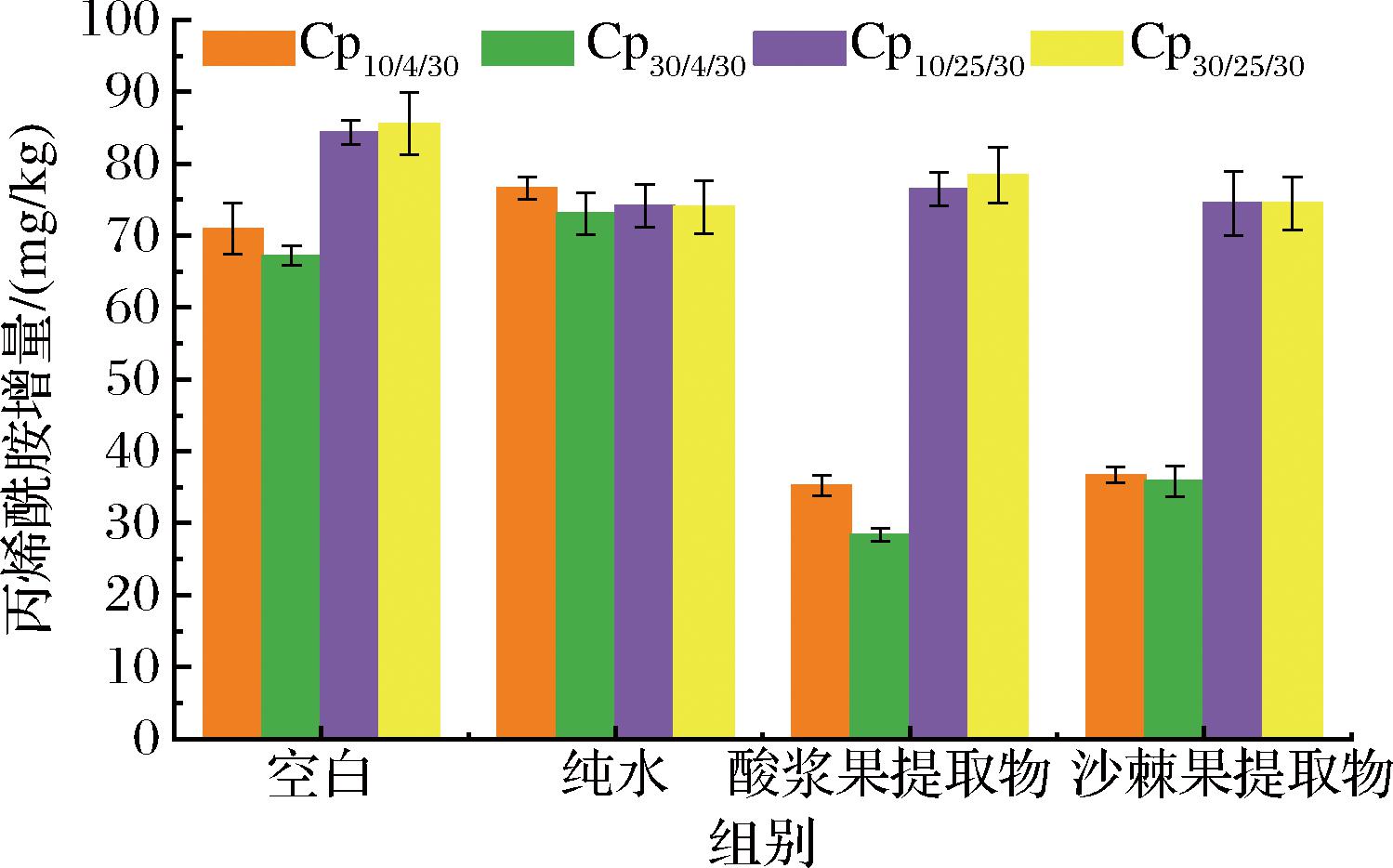
图4 不同真空抽气时间对鸡胸肉中丙烯酰胺含量的影响
Fig.4 Effect of different vacuum pumping time on acrylamide content in chicken breast
注:图例Cpa/b/c中a表示抽气时间,s;b表示贮藏温度,℃;c表示贮藏时间,d。抽气10 s空白和纯水、酸浆果提取物、沙棘果提取物处理组中丙烯酰胺的初始值分别为65.82、61.70、54.41、58.39 mg/kg,抽气30 s各组初始值为62.06、60.68、50.54、52.30 mg/kg。
2.5 沙棘果和酸浆果提取物对鸡胸肉外观品质的影响
沙棘果和酸浆果提取物等其他预处理条件下鸡胸肉色差值如表1所示,25 ℃下,沙棘果和酸浆果提取物处理所得鸡胸肉的ΔL值和Δa值明显低于空白组、纯水和维生素C组,高于槲皮素组。显著性分析结果表明,酸浆果提取与其他组之间的ΔL值皆存在显著性差异,与空白、纯水组和沙棘果提取物组之间的Δa和Δb值差异显著。沙棘果提取物与酸浆果提取物的ΔL值、Δa值、Δb值皆存在显著性差异。由此推测25 ℃贮藏下,酸浆果提取物预处理鸡胸肉能比沙棘果获得更佳的外观品质。4 ℃下,沙棘果提取物处理所得鸡胸肉的ΔL值高于空白组、纯水组和槲皮素组;Δa低于空白组和酸浆果提取物组;Δb值高于空白组、纯水组、维生素C和槲皮素组。酸浆果提取物组处理所得鸡胸肉的ΔL值高于维生素C和槲皮素组;Δa值高于纯水组、维生素C组、槲皮素和沙棘提取物组;Δb值高于所有对照组。显著性分析结果表明,沙棘果提取物与槲皮素和酸浆果提取物组处理所得鸡胸肉的ΔL值差异显著,与纯水组、维生素C和槲皮素组之间的Δa差异显著,与空白组、纯水组、维生素C和槲皮素组之间的Δb差异显著。酸浆果提取物与所有对照组所得鸡胸肉的ΔL值差异显著,与纯水组、维生素C组和槲皮素组之间的Δa差异显著,与空白组、纯水组、维生素C组和槲皮素组之间的Δb差异显著。沙棘果提取物和酸浆果提取物的ΔL差异显著,Δa和Δb值差异不显著。由此推测4 ℃贮藏下,酸浆果提取物预处理鸡胸肉能与沙棘果提取所得鸡胸头外观品质差异不明显。此外,由图5-A和图5-B可知,4 ℃和25 ℃下,不同预处理所得鸡胸肉的色差ΔL、Δa和Δb值与丙烯酰胺含量之间不存在显著的关联性。可以认为抑制剂溶液浸渍处理不会影响样品的外观色泽。
表1 不同预处理条件下烤鸡胸肉色差值30 d内变化
Table 1 Changes in color difference of roasted chicken breast meat
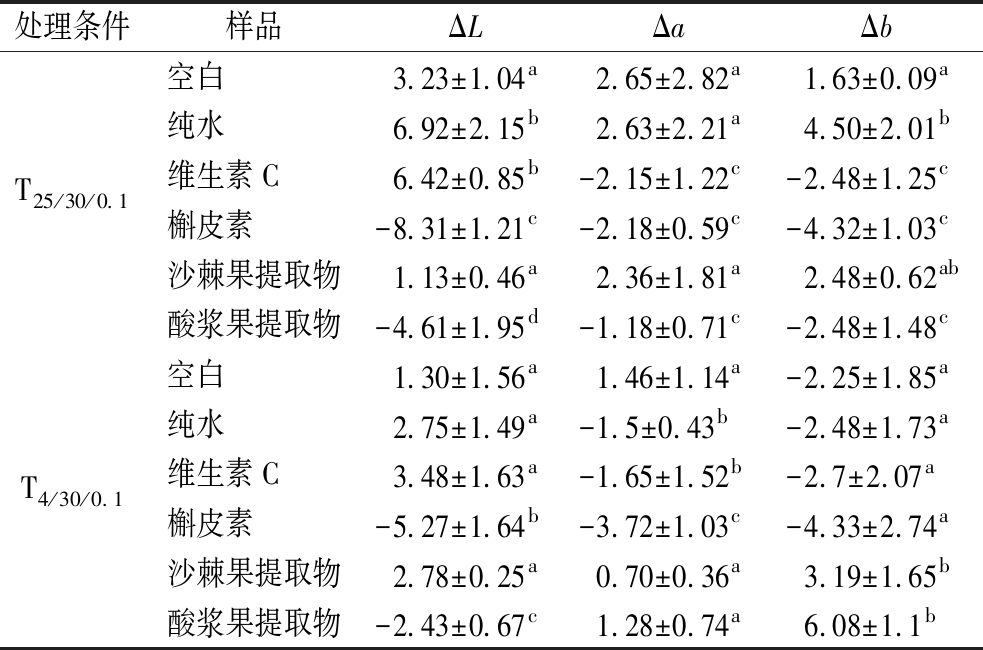
处理条件样品ΔLΔaΔb空白3.23±1.04a2.65±2.82a1.63±0.09a纯水6.92±2.15b2.63±2.21a4.50±2.01bT25/30/0.1维生素C6.42±0.85b-2.15±1.22c-2.48±1.25c槲皮素-8.31±1.21c-2.18±0.59c-4.32±1.03c沙棘果提取物1.13±0.46a2.36±1.81a2.48±0.62ab酸浆果提取物-4.61±1.95d-1.18±0.71c-2.48±1.48c空白1.30±1.56a1.46±1.14a-2.25±1.85a纯水2.75±1.49a-1.5±0.43b-2.48±1.73aT4/30/0.1维生素C3.48±1.63a-1.65±1.52b-2.7±2.07a槲皮素-5.27±1.64b-3.72±1.03c-4.33±2.74a沙棘果提取物2.78±0.25a0.70±0.36a3.19±1.65b酸浆果提取物-2.43±0.67c1.28±0.74a6.08±1.1b
注:不同字母表示差异在0.05水平上显著。Ta/b/c中a、b、c分别表示贮藏温度(℃)、贮藏时间(d)、实验组质量浓度(g/L)。

A-25 ℃贮藏时相关性;B-4 ℃贮藏时相关性
图5 贮藏30 d内丙烯酰胺含量与外观色差的关联性
Fig.5 The correlation between acrylamide content and appearance color difference during 30 days storage
外观品质也是是衡量烤鸡肉品质的一个重要指标。除了酸浆果提取物和槲皮素预处理所得烤鸡胸肉贮藏过程中,其他样品组ΔL出现明显的升高,这是因为中心部位水分较多、不断发生迁移,表面发生返潮,呈现出表面明亮度增加。而酸浆果提取物和槲皮素组促进类黑素物质的生产,导致鸡胸肉表面亮度降低。G MEZ-NARV
MEZ-NARV EZ等[3]研究表明a*值可以作为反映丙烯酰胺含量的间接指标。而本研究发现色差值ΔL、Δa、Δb值在25 ℃和4 ℃下皆与丙烯酰胺关联性不显著,可能源于样品的差异性,及受贮藏时间和温度的影响,影响了色差值和丙烯酰胺含量的相关性。
EZ等[3]研究表明a*值可以作为反映丙烯酰胺含量的间接指标。而本研究发现色差值ΔL、Δa、Δb值在25 ℃和4 ℃下皆与丙烯酰胺关联性不显著,可能源于样品的差异性,及受贮藏时间和温度的影响,影响了色差值和丙烯酰胺含量的相关性。
3 结论与讨论
以空白、纯水组、维生素C和槲皮素为对照组,沙棘果和酸浆果提取物应用于烤鸡肉预处理,沙棘果和酸浆提取物皆有助于减低烤鸡胸肉中丙烯酰胺含量,提高烤鸡胸肉外观品质,同时延长真空抽气时间和降低贮藏温度肉外观品质。4 ℃冷藏虽然能够减缓烤鸡胸肉中丙烯酰胺的增加速率,但是延长烤鸡胸肉贮藏时间可能带来潜在安全问题,丙烯酰胺在烤鸡胸肉加工过程中原理及监控措施仍需进一步研究。
[1] IRAC. IARC Monographs on the Evaluation of Carcinogenic Risks to Human. Lyon: IARC Press,2002.
[2] VERMA V, SINGH V, CHAUHAN O P, et al.Comparative evaluation of conventional and advanced frying methods on hydroxymethylfurfural and acrylamide formation in French fries[J].Innovative Food Science &Emerging Technologies, 2023, 83:103233.
[3] G MEZ-NARV
MEZ-NARV EZ F, MES
EZ F, MES AS M, DELGADO-ANDRADE C, et al.Occurrence of acrylamide and other heat-induced compounds in panela:Relationship with physicochemical and antioxidant parameters[J].Food Chemistry, 2019, 301:125256.
AS M, DELGADO-ANDRADE C, et al.Occurrence of acrylamide and other heat-induced compounds in panela:Relationship with physicochemical and antioxidant parameters[J].Food Chemistry, 2019, 301:125256.
[4] KUMARI A, BHATTACHARYA B, AGARWAL T, et al.Integrated approach towards acrylamide reduction in potato-based snacks:A critical review[J].Food Research International, 2022, 156:111172.
[5] ANESE M, NICOLI M C, VERARDO G, et al.Effect of vacuum roasting on acrylamide formation and reduction in coffee beans[J].Food Chemistry, 2014, 145:168-172.
[6] GHOLAMI F, RAHMAN A, MOSTAGHIM T.Effects of rosemary and thyme extracts on acrylamide formation in fried beef[J].International Journal of Scientific Research in Science and Technology, 2017, 3:352-360.
[7] TOYDEMIR G, GULTEKIN SUBASI B, HALL R D, et al.Effect of food processing on antioxidants, their bioavailability and potential relevance to human health[J].Food Chemistry:X, 2022, 14:100334.
[8] ABEYRATHNE E D N S, NAM K, HUANG X, et al.Plant- and animal-based antioxidants’ structure, efficacy, mechanisms, and applications:A review[J].Antioxidants, 2022, 11(5):1025.
[9] CHEN G J, WANG J R, LI Y H.Extracts of sorghum bran, grape seed, and green tea:Chromatographic comparison of phenolic profiles and mitigation effect on acrylamide in antioxidant-fortified bread[J].Food Chemistry Advances, 2022, 1:100082.
[10] JIA W, GUO A A, ZHANG R, et al.Mechanism of natural antioxidants regulating advanced glycosylation end products of Maillard reaction[J].Food Chemistry, 2023, 404:134541.
[11] 李欣, 白露露, 易珂, 等.酸浆的化学成分及药理作用研究进展[J].天然产物研究与开发, 2022, 34(2):324-343.
LI X, BAI L L, YI K, et al.Research progress on chemical constituents and pharmacological effects of Physalis alkekengi L.var.franchetii(Mast.)Makino[J].Natural Product Research and Development, 2022, 34(2):324-343.
[12] 李潇潇. 肉制品中丙烯酰胺形成规律的研究[D].天津:天津科技大学, 2016.
LI X X.Study on the formation of acrylamide in meat products[D].Tianjin:Tianjin University of Science and Technology, 2016.
[13] 肉孜·阿木提, 史勇, 吕仲明.便携式烤肉炉不同烤制条件对烤肉品质的影响分析[J].包装与食品机械, 2017,35(5):25-29.
ROUZI A M T, SHI Y, LYU Z M.Meat quality analysis under different roasting conditions based on portable barbecue stove[J].Packaging and Food Machinery, 2017,35(5):25-29.
[14] 林继辉, 陈琳榕, 冯庆玲, 等.沙棘果总黄酮提取工艺及抗氧化性研究[J].云南民族大学学报(自然科学版), 2024, 33(2):178-185.
LIN J H, CHEN L R, FENG Q L, et al.Study on extraction technology and antioxidant activity of total flavonoids from sea buckthorn fruit[J].Journal of Yunnan University of Nationalities (Natural Sciences Edition), 2024, 33(2):178-185.
[15] LIN L Z, ZHUANG M Z, ZOU L W, et al.Structural characteristics of water-soluble polysaccharides from Rabdosia serra (MAXIM.) HARA leaf and stem and their antioxidant capacities[J].Food Chemistry, 2012, 135(2):730-737.
[16] 潘牧, 李俊, 王辉, 等.丙烯酰胺抑制剂筛选及其在油炸过程中对甘薯片品质的影响[J].食品科技, 2021, 46(4):233-237.
PAN M, LI J, WANG H, et al.Acrylamide inhibitors screening and effect of the optimal inhibitor on quality of sweet potato crisps during frying[J].Food Science and Technology, 2021, 46(4):233-237.
[17] PEDRESCHI F, BUSTOS O H, MERY D, et al.Color kinetics and acrylamide formation in NaCl soaked potato chips[J].Journal of Food Engineering, 2007, 79(3):989-997.
[18] 刘李春, 蒋玉洁, 申明月, 等.天然抗氧化剂对红烧肉烹饪过程中热加工危害物形成的控制[J].食品科学, 2021, 42(15):50-57.
LIU L C, JIANG Y J, SHEN M Y, et al.Inhibitory effect of natural antioxidants on the formation of thermal processing hazards in red braised pork[J].Food Science, 2021, 42(15):50-57.
[19] VIKLUND G Å I, OLSSON K M, SJÖHOLM I M, et al.Acrylamide in crisps:Effect of blanching studied on long-term stored potato clones[J].Journal of Food Composition &Analysis, 2010, 23(2):194-198.
[20] PALEOLOGOS E K, KONTOMINAS M G.Effect of processing and storage conditions on the generation of acrylamide in precooked breaded chicken products[J].Journal of Food Protection, 2007, 70(2):466-470.