乳酸菌是最常见的益生菌,是公认的安全级生物制剂(generally recognized as safe,GRAS)[1]。乳酸菌可通过发酵产生各种有机酸、过氧化氢和多肽等抑菌物质,抑制细菌病原菌和真菌病原菌的生长,从而延缓食品腐败变质,延长食品货架期[2]。乳酸菌能将食品中的碳水化合物分解为有机酸,导致食品的pH值下降。较强的酸性不仅能减少食品原始带菌量,还能赋予食品风味和坚硬的质地。在食品加工贮藏过程中,乳酸菌作为化学制剂,常应用于食品的贮藏保鲜[3]。肠膜明串珠菌(Leuconostoc mesenteroides)归属于乳杆菌目(Lactobacillales)、明串球菌属(Leucanostoc)[4]。L.measenteroides广泛应用于生产乳制品、益生元添加剂和细菌素,其具有提高发酵乳制品的风味和延长食品贮藏期的功效,又具有降低胆固醇、改善高血脂、抗氧化和提高免疫力等作用。目前,有很多利用L.measenteroides防治果蔬采后病害和抑制食品腐败的相关报道。胡珊等[5]从荔枝果肉中筛选出一株L.measenteroides,其发酵的荔枝果汁既丰富了果汁的营养物质和风味口感,又延长了果蔬汁的保质期。刘毕琴等[6]从传统泡菜中筛选出了1株L.measenteroides AP7,发现其产细菌素,对食源性致病菌和引起泡菜过酸化的细菌有较好的抑制效果,在酸性食品的发酵和防腐有应用潜力。然而,其作为生物抑菌剂应用时普遍存在定殖差、活性不稳定等问题,开发挖掘高效且稳定的乳酸菌抑菌剂在食品贮藏保鲜方面始终是研究热点之一。
西梅又称欧洲李(Prunus domestica L.),是近年由国外引进的新型水果,品种众多、营养丰富[7],但西梅属于呼吸跃变型果实,采后生理代谢旺盛,若贮藏不当,常温放置6 d,果实开始严重失水萎蔫,损失率高达20%~30%,影响其食用价值和商品价值[8]。因此寻找安全有效的保鲜方式延长西梅的贮藏期具有重要意义。目前,西梅采后贮藏保鲜的常用方法是以低温环境与化学保鲜剂相结合、气调保鲜等技术[9],但随着人们生活水平的提高,对于食品的安全问题愈加重视,寻找更加天然、安全、高效的保鲜剂成为果蔬贮藏保鲜的研究热点。生物保鲜技术,是指利用天然或人工控制的微生物菌群和(或)其产生的代谢物质来延长果蔬的贮藏期和提高果蔬安全性的方法。生物保鲜物质来源于生物体自身组成成分或其代谢产物,具有天然、无味、无毒、保鲜效果好等特点,此外生物保鲜物质一般都可被降解,避免了二次污染[10]。微生物资源在自然生态系统中广泛分布,有多种代谢途径,应用于果蔬保鲜有较大的潜力。
1 材料与方法
1.1 材料与试剂
材料:西梅采购于2023年8月25日,市售,为新疆主栽品种“法兰西”,选取相同成熟度、无病无损伤的果实作为试材。
试验菌株:L.measenteroides分离自水飞蓟植株;狭卵链格孢菌(Alternaria angustiovoidea)分离自西梅霉果;大肠埃希菌[Escherichia coli,CMCC(B)44102]由新疆微生物资源保藏管理中心提供。
试验试剂:木瓜蛋白酶、脂肪酶、胰蛋白酶、蛋白酶K、过氧化氢酶和胃蛋白酶,上海源叶生物有限公司;NaCl、NaOH、乳酸、MRS液体培养基、MRS固体培养基、PDA固体培养基、LB液体培养基、NA固体培养基,北京鼎国生物。
1.2 仪器与设备
SX-500型高压灭菌锅,日本TOMY公司;FA-2204型电子天平,上海衡平仪器仪表厂;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;Avanti JXN-30型高速冷冻离心机,贝克曼库尔特国际贸易(上海)有限公司;GY-4型硬度计,艾德堡仪器有限公司;PR-PAL-1型数显糖度计,日本Atago公司;905型自动电位滴定仪,瑞士万通公司;SPX-100B-Z型恒温恒湿箱,上海岐昱实业有限公司;SW-CJ-1FD型超净工作台,苏州净化设备有限公司;79-3型磁力搅拌器,郑州宝晶电子科技有限公司。
1.3 实验方法
1.3.1 菌种的筛选、保藏与鉴定
将匀浆后的水飞蓟植株10 g放入100 mL无菌蒸馏水中,即为10-1稀释液,振荡2 min后,依次用无菌蒸馏水以10倍稀释法逐管稀释至10-6浓度,将10-6稀释液均匀涂布于无菌的MRS琼脂培养基上。培养观察。挑取菌落形态不同的菌株,分别接种于接有A.angustiovoidea和E.coli的平板上培养观察,用接种环挑取具有明显拮抗作用的单菌落重悬于10%(质量分数)脱脂乳中,经冷冻干燥后-80 ℃保藏。采用16S rRNA基因序列比对的方法对菌株进行鉴定。
1.3.2 菌株MG12发酵上清液的制备
菌株MG12连续活化2代后,在MRS液体培养基中培养,30 ℃、160 r/min下培养24 h得到菌株MG12种子液,吸取2%(体积分数)种子液复接于MRS液体培养基,培养48 h,共发酵2 L。4 ℃ 8 000 r/min,离心15 min弃去菌体,0.22 μm微孔滤膜过滤后4 ℃保存备用。
1.3.3 不同浓度菌株MG12发酵上清液的抑菌活性
对真菌病原菌的抑制效果:分别配制含1/2、1/4、1/8和1/16浓度菌株MG12无菌发酵液的PDA培养基,用添加同体积无菌水的PDA培养基为对照。培养基凝固后,在中心接入直径为8 mm的A.angustiovoidea菌块,28 ℃恒温培养4~5 d观察菌落生长情况。
对细菌病原菌的抑制效果:采用琼脂扩散法测定不同浓度菌株MG12发酵上清液(原浓度、1/2、1/4、1/8和1/16浓度)对的抑菌活性。将活化好的大肠杆菌,接种至LB液体培养基,30 ℃、120 r/min振荡培养24 h,将100 μL指示菌种子液(OD600=0.2)用无菌玻璃珠涂布于凝固好的NA平板。打孔后加100 μL无菌发酵液,30 ℃放置12 h,测量透明圈直径(去除孔径8 mm),每组做3个平行。
1.3.4 排除有机酸和过氧化氢对抑菌作用的干扰
有机酸排除试验:用0.1 mol/L乳酸将未接种的MRS液体培养基调至pH值3.86,与菌株MG12发酵上清液pH值相同,用E.coli作为指示菌,通过琼脂扩散法进行抗菌试验。
过氧化氢排除试验:将过氧化氢酶加入菌株MG12发酵上清液,使过氧化氢酶质量浓度为1 mg/mL,37 ℃水浴4 h,用E.coli作为指示菌,通过琼脂扩散法进行抗菌试验。
1.3.5 菌株MG12抑菌活性的稳定性
1.3.5.1 不同温度处理后抑菌活性的稳定性
菌株MG12上清液分别在4、25、37、100和121 ℃下处理30 min,最后用无菌蒸馏水调至相同体积,测定抑菌活性,每组做3个平行。
1.3.5.2 不同pH处理后抑菌活性稳定性
用1 mol/L的HCl和NaOH将菌株MG12发酵上清液调成不同的pH值(3~11),每个处理做3个平行。4 ℃放置12 h后再调回pH值4.0,作为待测液测定抑菌活性。对照组为加入无菌水的原样品。
1.3.5.3 不同酶处理后的抑菌活性的稳定性
分别将胰蛋白酶、胃蛋白酶、脂肪酶、蛋白酶K和木瓜蛋白酶(质量浓度为1 mg/mL)加入菌株MG12发酵上清液中,37 ℃放置2 h后测定抑菌活性,对照组为不经酶处理的发酵上清液[11]。
1.3.5.4 不同紫外辐照时长处理后抑菌活性的稳定性
将上清液倒入到无菌的培养皿中,用磁力搅拌器缓慢搅拌培养皿中的上清液,并置于30 W紫外灯下分别照射1、2、3、4 h后,作为待测液备用。以未经紫外照射处理的上清液为对照组。
1.3.6 菌株MG12发酵上清液对西梅贮藏品质的影响
1.3.6.1 发酵液处理对西梅采后发病率的影响
选取质量、大小相近、表面完好无损的西梅,每组约500 g,做3个重复。在无菌操作台上,配制不同浓度的菌株MG12发酵上清液(原浓度、1/2、1/4、1/8、1/16浓度的菌株MG12发酵上清液),浸泡样品5 min,以蒸馏水处理为对照组,晾干后用封口袋密封并做好标记,相对湿度(relative humidity,RH)70%~80%条件下,放于25 ℃中保存,每隔3 d将坏果挑出计算发病率,计算如公式(1)所示:
发病率![]()
(1)
1.3.6.2 菌株MG12发酵液处理对西梅采后失重率的影响
采用称重法测定西梅样品的失重率[12],每隔3 d取样测定样品质量,计算如公式(2)所示:
失重率![]()
(2)
1.3.6.3 发酵液处理对西梅采后硬度的影响
每隔3 d随机选取3个西梅样品,在果实赤道处选取3个位置作为测量点,使用水果硬度计(0.1 cm2探针)对样品的硬度变化进行测定,每个样品平行测定3次并记录数据,以平均值表示果实的硬度。
1.3.6.4 发酵液处理对西梅采后可溶性固形物(total soluble solids,TSS)含量的影响
使用数显糖度仪测量西梅汁液的可溶性固形物含量[13]。将果肉组织放入研钵中研磨成匀浆,过滤后将汁液直接滴于数显糖度计上进行测定,每个处理重复3次。
1.3.6.5 发酵液处理对西梅采后可滴定酸(titritable acidity,TA)含量的影响
称取5.0 g西梅样品,在研钵中研磨匀浆,于50 mL容量瓶中定容并摇匀。静置提取30 min后过滤。吸取20 mL滤液于滴定管中,使用瑞士万通905自动电位滴定仪进行测定,其中,滴定溶液为0.1 mol/L NaOH,滴定终点为pH值8.3。
1.4 数据统计与分析
采用Origin 2021对数据进行统计,SPSS 27.0软件对数据进行方差分析。
2 结果与分析
2.1 菌种的筛选与鉴定
菌株MG12经16S rRNA基因序列测定,并上传至NCBI获得GenBank登录号为PP178159,该序列与L.mesenteroides JCM9700(GenBank登录号LC096223)的16S rRNA基因序列相似度最高,同源性达99.8%(图1),初步认为MG12为L.mesenteroides的分离株,暂命名为L.mesenteroides MG12。
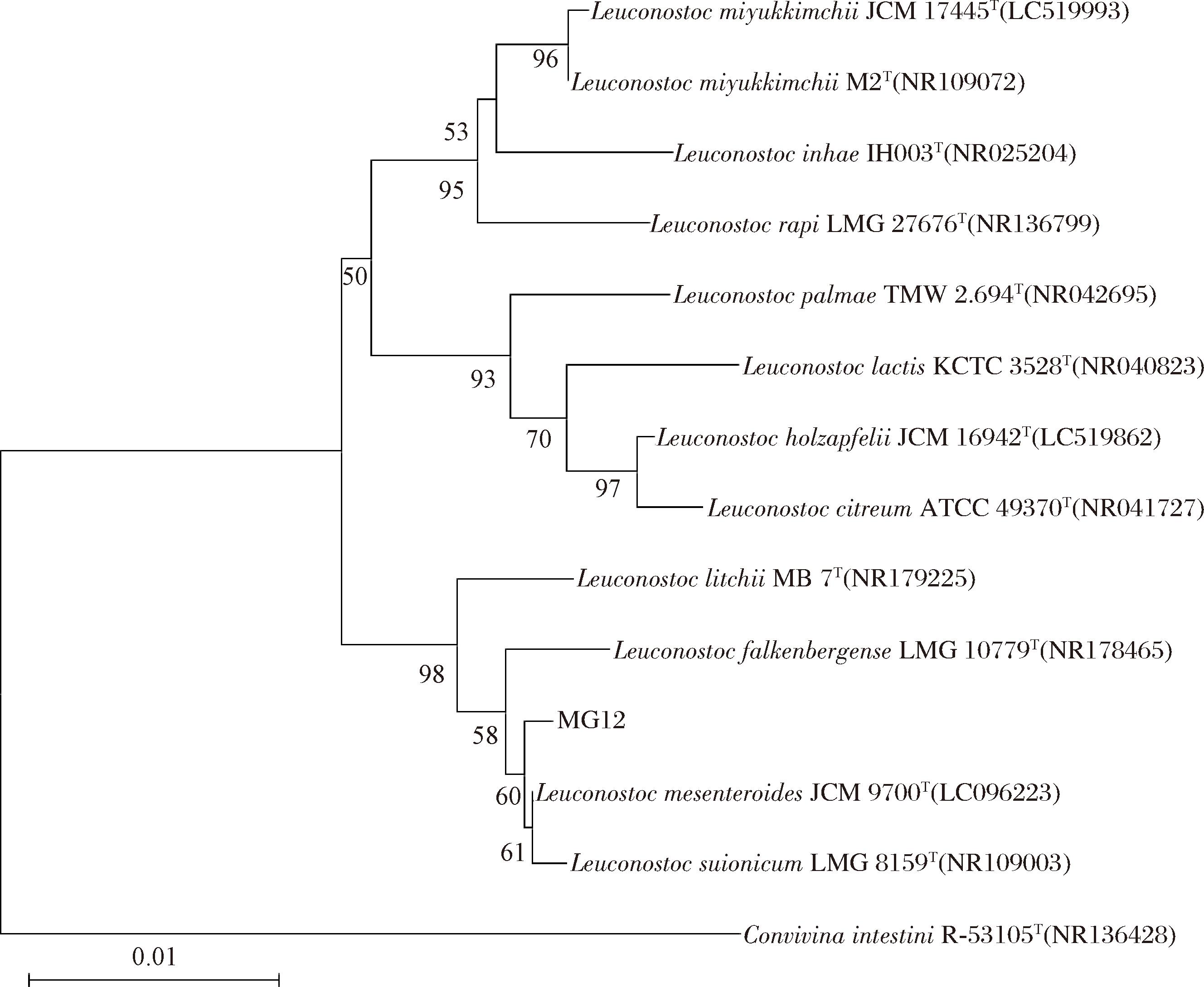
图1 菌株MG12的系统进化树
Fig.1 Phylogenetic tree of strain MG12
2.2 不同浓度菌株MG12发酵上清液的抑菌活性
如图2所示,随着发酵液浓度的升高,菌株MG12发酵液对大肠杆菌的抑菌效果也逐渐增强,原浓度发酵液抑菌圈直径最大,为(17.76±0.11) mm;1/8浓度发酵液对大肠杆菌的抑菌效果较弱,1/16浓度发酵液对大肠杆菌的作用效果不明显,几乎看不到抑菌圈。

图2 菌株MG12发酵上清液对大肠杆菌的抑制效果
Fig.2 Inhibition of Escherichia coli by fermentation broth from strain MG12
如图3所示,菌株MG12发酵上清液经无菌过滤稀释加入PDA培养基中,可显著抑制A.angustiovoidea生长,与对照组相比,加入了菌株MG12发酵上清液处理组,菌丝生长缓慢,稀薄。在不加发酵液的对照组中,A.angustiovoidea生长旺盛,菌丝向外扩展迅速。其中,加入1/2和1/4浓度的菌株MG12发酵上清液,A.angustiovoidea未见生长,加入1/8浓度和1/16浓度的菌株MG12发酵上清液,A.angustiovoidea菌落半径较对照显著降低,分别比对照的半径小16.25 mm和12.53 mm。
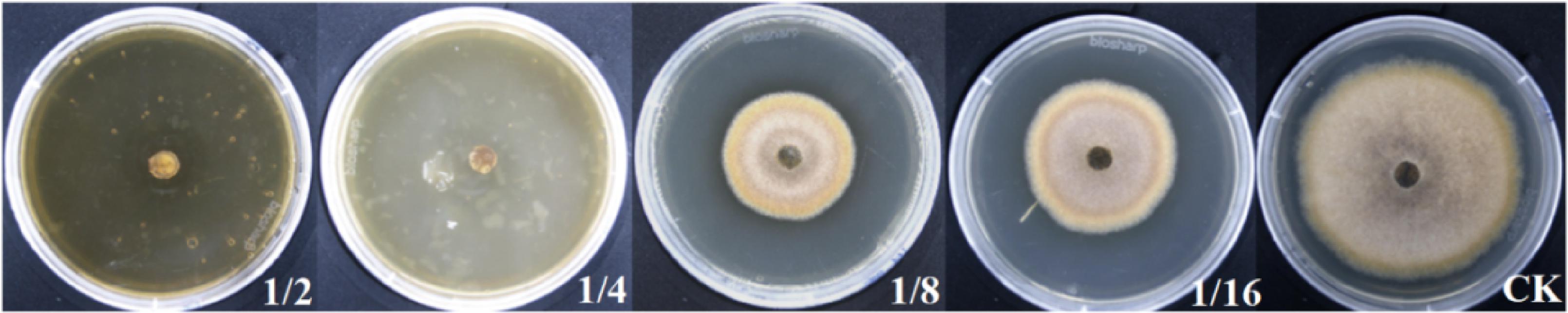
图3 菌株MG12发酵上清液对A.angustiovoidea的抑制效果
Fig.3 Inhibition of A.angustiovoidea by fermentation broth from strain MG12
综上所述,L.mesenteroides MG12发酵液可有效抑制细菌病原菌和真菌病原菌的生长。
2.3 排除有机酸和过氧化氢对抑菌物质的干扰
如图4所示,用0.1 mol/L乳酸将未接种的MRS液体培养基调至pH值3.86后,未出现抑菌圈,说明该抑菌物质不是乳酸,可以排除其影响。经过氧化氢酶处理后,抑菌圈比未处理的发酵上清液抑菌圈小,说明发酵上清液中主要的抑菌物质不是过氧化氢,可能是其他物质。
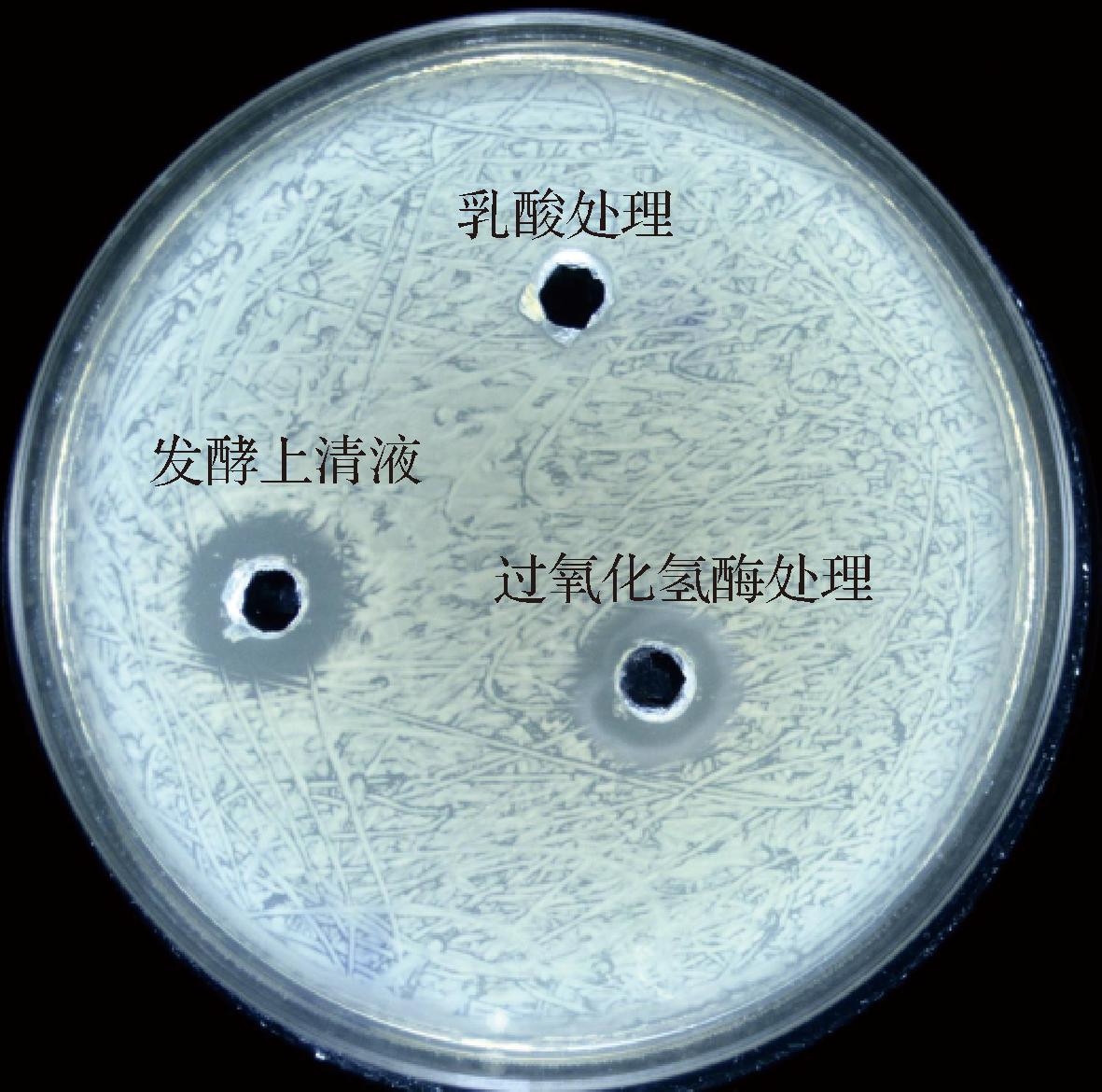
图4 有机酸和过氧化氢的排除试验
Fig.4 Exclusion test for organic acids and hydrogen peroxide
2.4 菌株MG12发酵上清液稳定性
热稳定性实验(图5-a):为了避免发酵液在贮藏过程中受到温度影响,降低活性甚至失活。将菌株MG12发酵液过滤除菌后分别置于4、25、37、100和121 ℃中处理,进行抑菌活性测定,结果表明不同温度处理后菌株MG12发酵液的抑菌活性都维持在较高水平,说明该抑菌物质热稳定性较强。
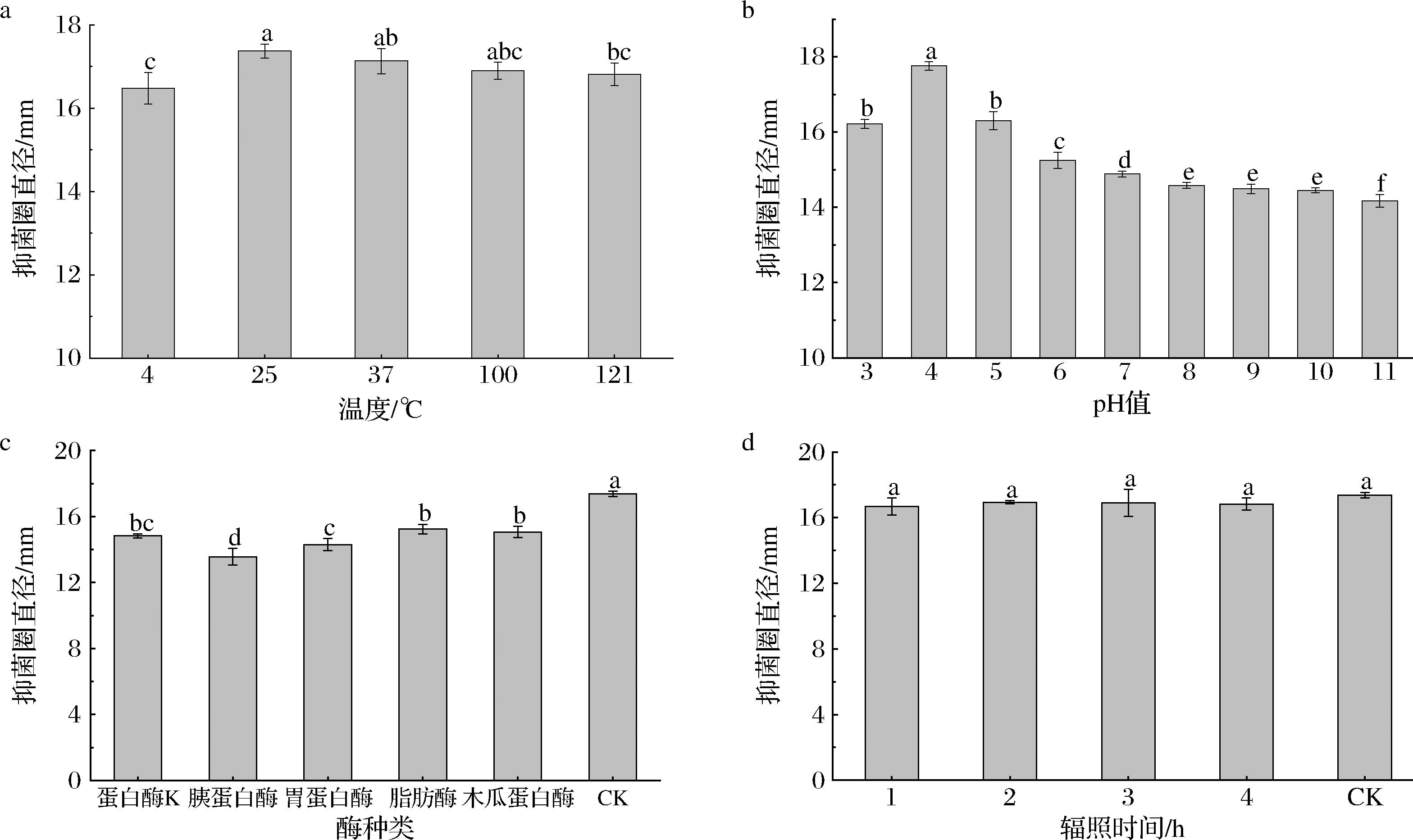
a-温度;b-pH值;c-酶种类;d-辐照时间
图5 不同处理下菌株MG12发酵上清液稳定性
Fig.5 Effect of different treatments on inhibition activity of fermentation broth from strain MG12
注:不同小写字母表示差异显著(P<0.05)(下同)。
pH敏感性实验(图5-b):菌株MG12发酵液的抑菌活性在pH值为4时,抑菌活性最强,抑菌圈直径为(17.76±0.11) mm。在强酸和强碱条件下,抑菌活性显著降低,但仍然保留较好的抑菌效果,pH值11时抑菌圈直径为(14.17±0.17) mm,与pH值为4时相比,抑菌圈直径下降了20.21%。
酶敏感性试验(图5-c):将发酵液经几种不同的蛋白酶处理,菌株MG12发酵液被蛋白酶K、胰蛋白酶、胃蛋白酶、脂肪酶和木瓜蛋白酶处理过后,发现其抑菌活性均有不同程度的减小,抑菌圈直径分别减少了14.68%、21.93%、17.73%、12.26%和13.30%。
紫外辐照处理(图5-d):菌株MG12发酵液在不同时长的辐照处理后,抑菌结果如图所示,经过1、2、3、4 h紫外灯照射,抑菌活性没有明显变化,说明菌株MG12发酵液紫外辐照稳定性良好。
2.5 菌株MG12发酵上清液对西梅贮藏的影响
由图6可知,6组条件下,随着贮藏时间的延长,发病率均逐渐增加,25 ℃贮藏6 d时,不同浓度菌株MG12无菌发酵液处理组的西梅未出现病果,直至第9天,1/16浓度发酵上清液处理组和对照组西梅出现病果,发病率分别为3.71%和9.26%。贮藏15 d时,原浓度发酵上清液处理组比对照组的发病率低的37.03%(P<0.05)。贮藏期不同浓度菌株MG12无菌发酵液处理具有一定的防腐保鲜作用。
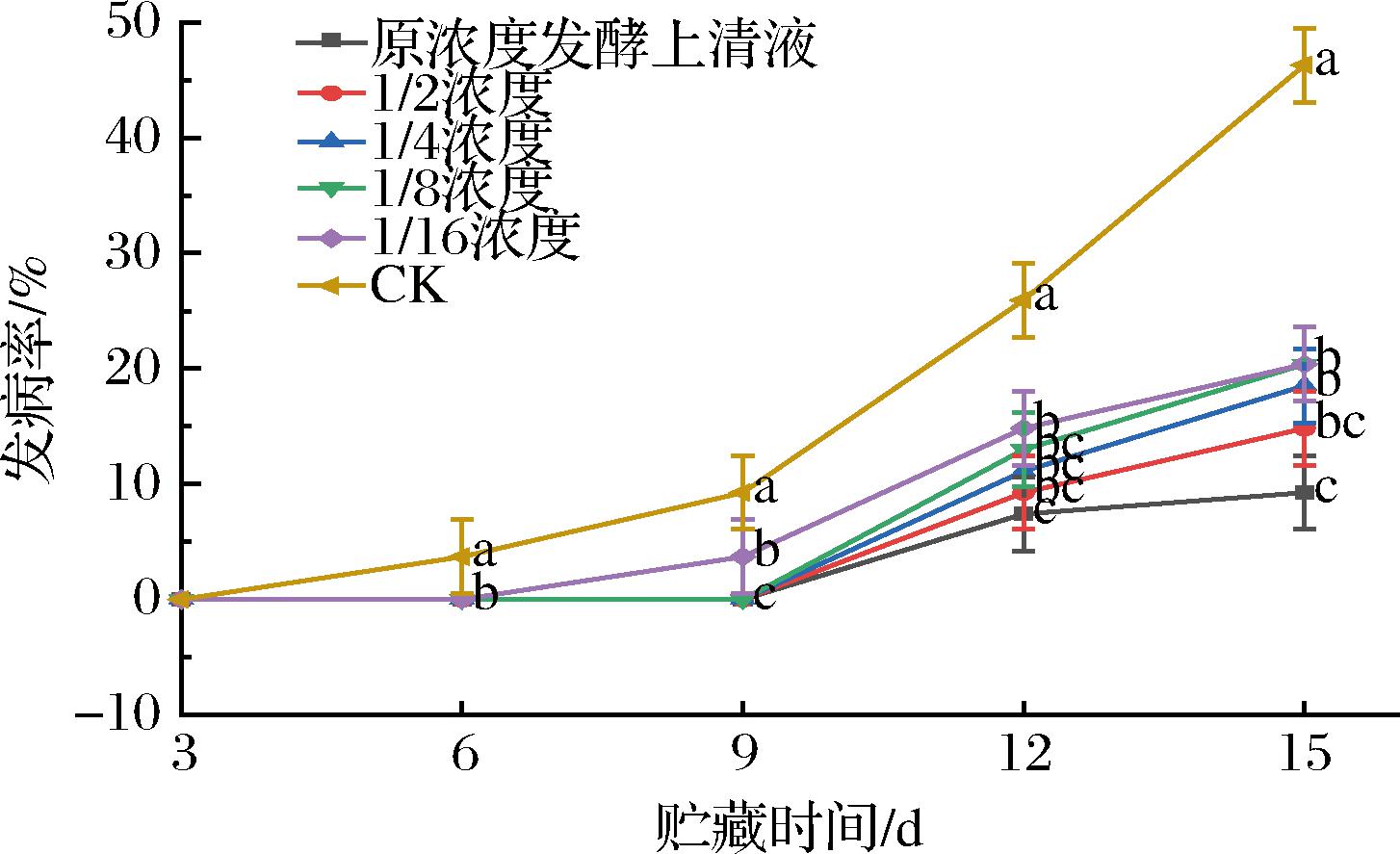
图6 发酵液处理对西梅采后发病率的影响
Fig.6 Effect of fermentation broth treatment on incidence of postharvest plums
失重率通常与果实的新鲜度密切相关。失重率较高时,果实口感变差,甚至会导致果实腐烂。西梅在贮藏期间由于呼吸作用不断蒸腾失去水分,失重率与果实自身的代谢速率有关,并且与果实的腐败速率呈正相关。
从图7可以看出,菌株MG12发酵液处理组和对照组的失重率在贮藏过程中均呈不断上升的趋势,然而原浓度发酵上清液处理组的失重率在贮藏期间均低于对照组。贮藏15 d时,6组处理失重率分别为6.08%、7.11%、7.69%、8.43%、10.19%和11.25%,原浓度发酵上清液处理组比对照组失重率低5.17%。这可能是由于果实在常温贮藏期间,乳酸菌发酵液的处理在一定程度上降低了果实的呼吸代谢强度,因此导致发酵液处理组的失重率显著低于对照组。
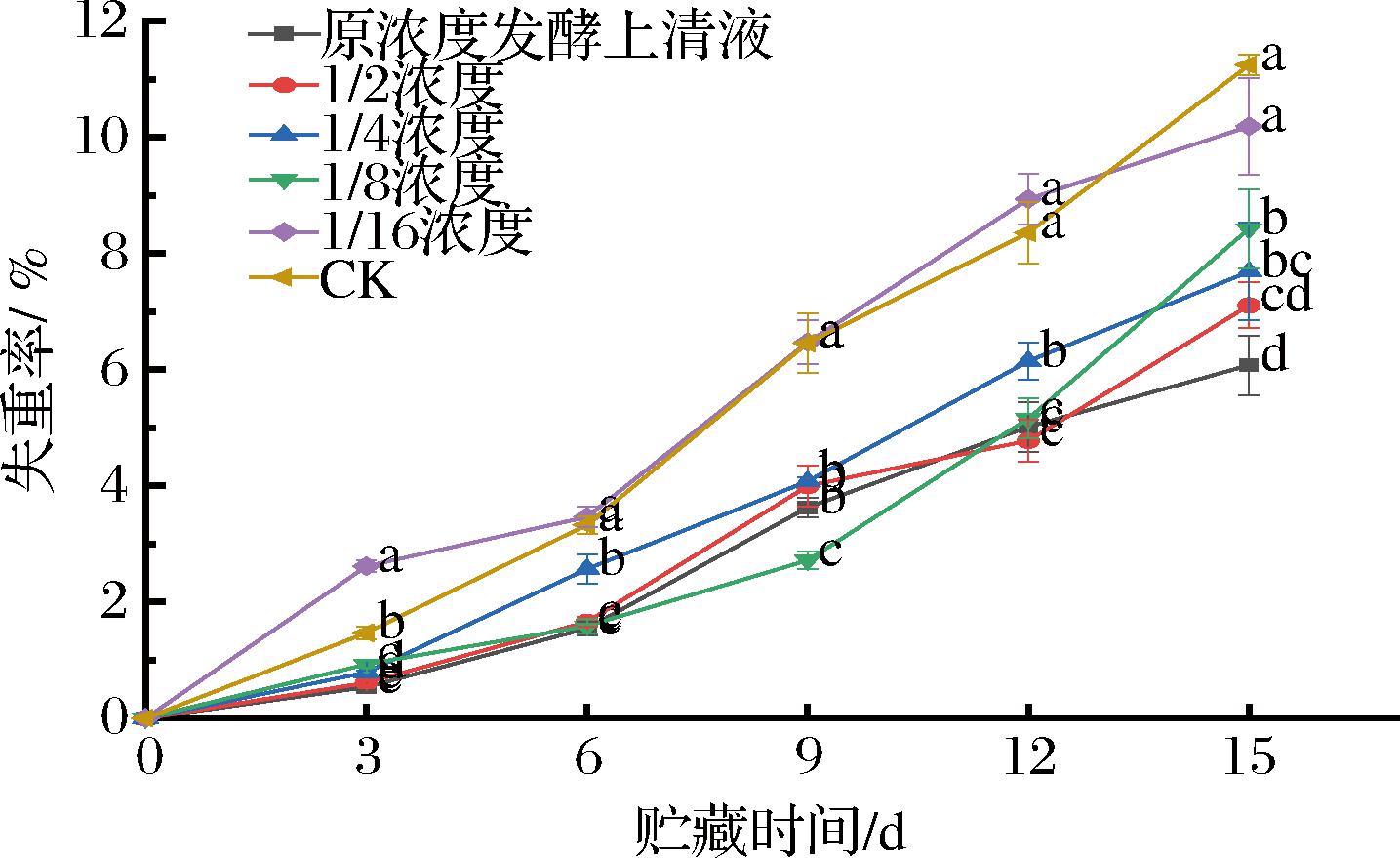
图7 发酵液处理对西梅采后失重率的影响
Fig.7 Effect of fermentation broth treatment on weight loss of postharvest plums
硬度是判断果实成熟度和贮藏品质的重要指标之一,TSS和TA含量是果实的主要呈味物质。如图8所示,随着贮藏时间的延长,对照组和处理组西梅硬度均呈下降趋势,但在15 d贮藏期内发酵液处理组西梅果实的硬度均高于对照组。在贮藏第15天时,原浓度发酵液组硬度是对照组的2.28倍,由此说明菌株MG12发酵液处理可延缓果实硬度的下降,原浓度发酵液组效果最显著。
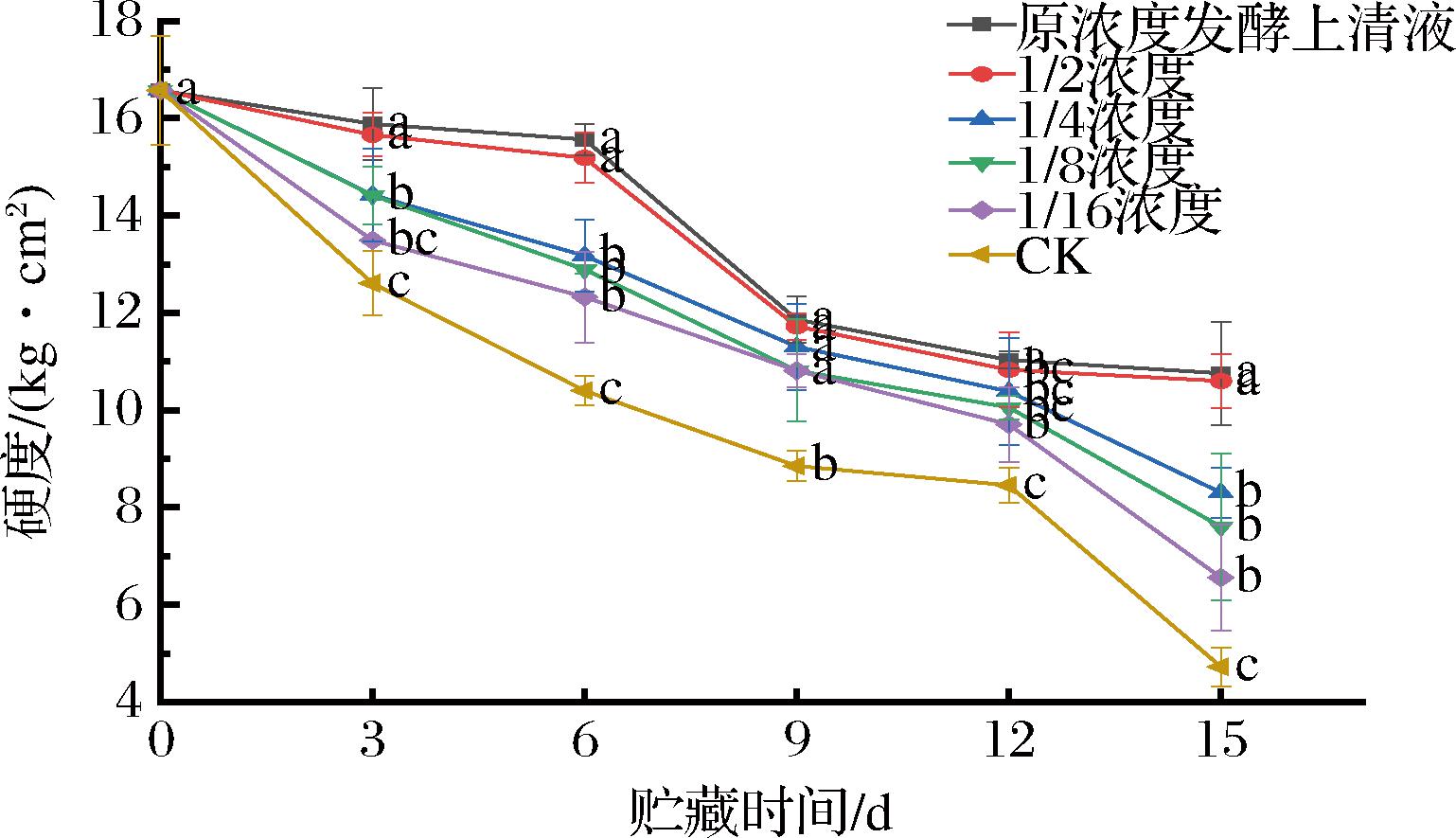
图8 发酵液处理对西梅采后硬度的影响
Fig.8 Effect of fermentation broth treatment on hardness of postharvest plums
如图9所示,在西梅果实贮藏期间TSS含量随着后熟逐渐增加,增加到一定程度之后随着衰老又逐渐下降。随着贮藏时间的延长,6组西梅的TSS含量的变化趋势一致,呈现出在贮藏前期上升后期下降的趋势。在达到15 d贮藏时间时,原浓度发酵液组的西梅TSS含量达到21.2%,比对照组高5.73%,说明菌株MG12发酵液处理有效延缓了TSS含量的减少,一定程度上维持了贮藏的品质。
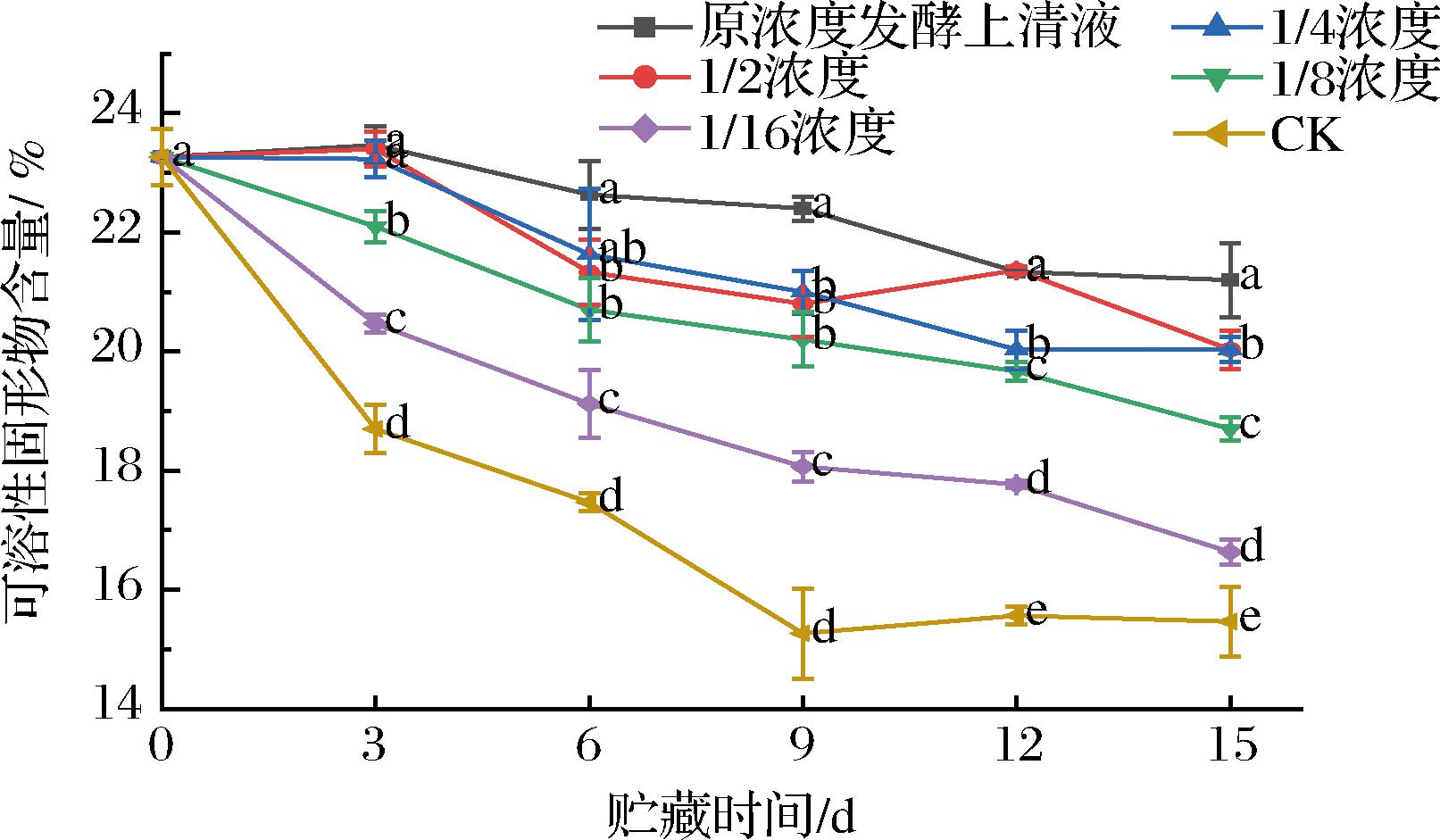
图9 发酵液处理对西梅采后可溶性固形物含量的影响
Fig.9 Effect of fermentation broth treatment on TSS content of postharvest plums
如图10所示,在整个贮藏期间,西梅果实TA含量呈现下降趋势。在贮藏到15 d时原浓度发酵液组的TA含量比对照组高11%。这说明菌株MG12发酵液处理抑制了可滴定酸分解,有效保持了西梅贮藏期的风味和口感。
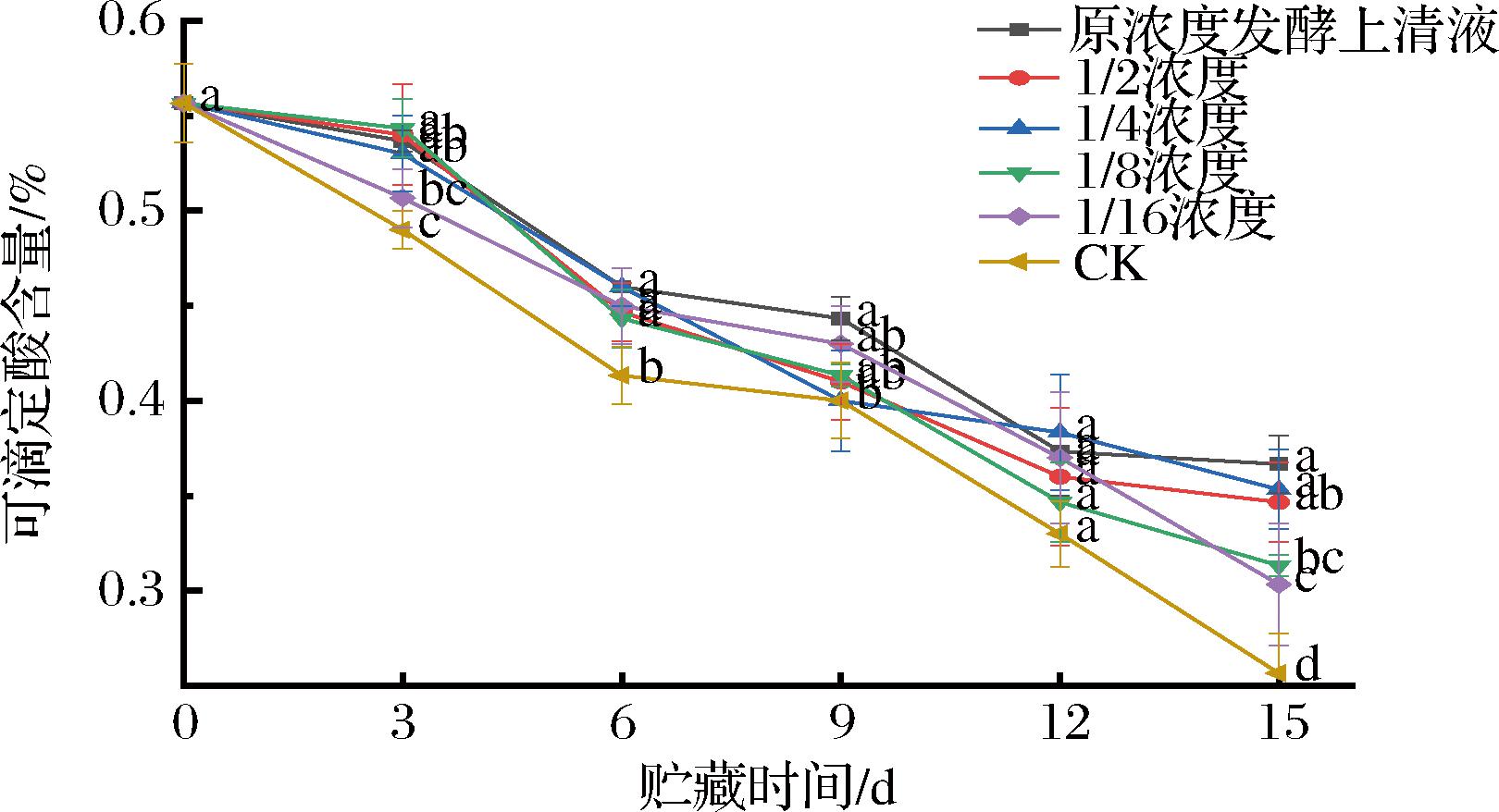
图10 发酵液处理对西梅采后可滴定酸的影响
Fig.10 Effect of fermentation broth treatment on TA content of postharvest plums
综上所述,菌株MG12发酵液处理能延缓西梅果实贮藏品质的降低,并且原浓度发酵液处理组效果最优。
3 结论与讨论
乳酸菌的抑菌机理主要包括:a)其发酵产生的代谢物质,如有机酸、细菌素、过氧化氢等,这些代谢物质通过增加生物膜的通透性来抑制腐败和病原微生物的生长[14];b)乳酸菌可以通过群体感应从而抑制有害菌的生长和生物膜的形成[15];c)乳酸菌可通过发酵食品产生抑菌肽或通过与有害菌群竞争[16]等方式来抑制有害菌生长。本研究通过有机酸和过氧化氢的排除试验,结合蛋白酶处理后抑菌活性显著降低,初步推测该抑菌物质中蛋白质类占主导地位。王虹军等[17]探究了植物乳杆菌细菌素的抑菌稳定性,排除酸和过氧化氢的干扰后,该抑菌物质仍具有活性,与本研究结果一致。L.mesenteroides为兼性厌氧、不产芽孢的革兰氏阳性球形乳酸菌,广泛存在于蔬菜、泡菜、果酒及发酵乳制品中[18],研究证实,明串珠菌的代谢产物有多种酸、过氧化物、细菌素及其他抑菌物质,具有高产酸能力、抗氧化能力和拮抗致病菌等能力,从而能够防止果蔬腐败变质、延长果蔬的贮藏期。目前,明串珠菌常用于发酵乳制品、泡菜、青贮果酒,还广泛应用于保健剂和血浆代用品。马锞等[19]从龙眼中分离得到一株L.mesenteroides dgnkzx002,其菌体+(0.1%壳聚糖+2%柠檬酸)+1.5%乳酸钠可防止果实水分损失及病害菌侵袭,可应用于果蔬的生物保鲜。本研究采用L.mesenteroides MG12发酵液对采后西梅进行保鲜,原料简单、提取方便、较菌体更易大规模生产,并且不采用食品添加剂,更加绿色安全。李祎等[20]从发酵泡菜中筛选出一株L.mesenteroides DH,该菌分泌的胞外抑菌物质对多种致病菌有拮抗作用。朱传胜等[21]从发酵酸黄瓜中筛选到一株产细菌素的L.mesenteroides,可抑制单核增生李斯特氏菌,并且该菌的热稳定性很强,121 ℃处理30 min后相对抗菌活性仍为93.77%,与本研究的结果一致。TRIAS等[22]分析了11株明串珠菌(Leucanostoc)对李斯特菌的抑菌实验,发现这11株明串珠菌一般通过产生有机酸、细菌素和过氧化氢等抑菌物质来抑制病原微生物的生长[23],具有广阔的应用前景,与本文的研究相一致。相关研究表明,乳酸菌抑菌物质的分子质量越小其在高温下稳定性越高,如分子质量为6~17 ku的细菌素一般可经100 ℃处理30 min而不失活[24],本研究从水飞蓟分离到明显具有抑制A.angustiovoidea和E.coli的内生菌,经初步鉴定其为L.mesenteroides,暂命名为L.mesenteroides MG12,该菌序列与L.mesenteroides JCM9700的16S rDNA基因序列相似度最高,同源性达99.8%,肠膜明串珠菌亚种(L.mesenteroides subsp.dextranicum)最早是1912年由Beijerinck命名,其中模式菌L.mesenteroides JCM9700由Sakamoto M.和Ohkuma M.在2015年分离发现。进一步对L.mesenteroides MG12发酵液进行了抑菌特性和稳定性分析,发现该菌发酵液在100 ℃和121 ℃处理30 min时,仍有明显的抑菌活性。同时该菌的发酵液表现出较好的pH稳定性,其在pH值为4时,抑菌圈直径达到最大,在pH值为11时,抑菌活性显著降低,但仍然保留较好的抑菌效果。周倩玉等[25]的研究表明在强酸性和强碱性条件下,乳酸菌抑菌物质仍保留抑菌活性,并且在酸性条件下发挥最佳的抑菌作用,表明两者可能存在类似的抑菌物质。王虹军等[17]对植物乳杆菌细菌素进行了稳定性分析,发现其经胰蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶及蛋白酶K的处理后,抑菌活性分别保留84%、98%、67%、91%、88%和98%,与本研究结果类似,初步推测L. mesenteroides MG12发酵液的抑菌物质可能是细菌素。
西梅果实酸甜可口,营养丰富,深受消费者喜爱,然而新鲜西梅含糖量较高,组织柔软,采后易受机械损伤和微生物病害的影响,导致果实成熟软化速度加快,严重影响其运输和销售,因此,亟需寻找一种抑制西梅腐败、延缓西梅成熟软化的保鲜方式。L. mesenteroides液作为一种天然安全的抑菌剂,可以替代化学制剂以提高安全性。马锞等[19]从龙眼果实中分离得到一株L. mesenteroides dgnkzx002,其菌体对龙眼炭疽病菌及龙眼采后果皮中酶活力都有抑制作用。胡文锋等[26]探L. mesenteroides复合保鲜剂对龙眼冷藏过程中品质变化的影响,表明肠膜明串株菌发酵液处理不仅降低了贮藏期间龙眼果实的呼吸作用,延缓了果实营养成分的流失,还能有效降低失重率、显著提高果实的商品率。胡光耀[27]探究了乳酸菌发酵上清液对葡萄采后的保鲜作用,结果显示乳酸菌发酵上清液提高了果实的硬度、还原糖含量和可滴定酸含量,降低了果实的水分蒸腾和腐烂率。刘晓茜[28]发现嗜酸乳杆菌NX2-6可延缓樱桃番茄的腐烂,减少樱桃番茄失重率,延缓果实萎蔫。
综上所述,L. mesenteroides MG12发酵液可有效抑制病原菌,并且稳定性较好,可减少西梅贮藏过程中的腐败变质、维持西梅果实水分含量、硬度、可溶性固形物及可滴定酸水平,原浓度发酵上清液处理对西梅果实品质维持效果最佳,在果蔬生物保鲜中有良好应用前景。
[1] WIDYASTUTI Y, ROHMATUSSOLIHAT, FEBRISIANTOSA A.The role of lactic acid bacteria in milk fermentation[J].Food and Nutrition Sciences, 2014, 5(4):435-442.
[2] SALAS M L, MOUNIER J, VALENCE F, et al.Antifungal microbial agents for food biopreservation-a review[J].Microorganisms, 2017, 5(3):37.
[3] 张金磊, 陈兴煌.乳酸菌发酵液在食品贮藏保鲜中的应用研究进展[J].中国调味品, 2020, 45(10):158-162.
ZHANG J L, CHEN X H.Application and research progress of lactic acid bacteria fermentation broth in food storage and preservation[J].China Condiment, 2020, 45(10):158-162.
[4] 成文玉, 金红星, 胡炎华, 等.明串珠菌筛选与分类的研究进展[J].中国酿造, 2010, 29(3):7-9.
CHENG W Y, JIN H X, HU Y H, et al.Research development of screening and classification of Leuconostoc[J].China Brewing, 2010, 29(3):7-9.
[5] 胡珊, 黄皓, 梁卫驱, 等.荔枝内生乳酸菌的筛选、鉴定及发酵效果分析[J].南方农业学报, 2019, 50(1):137-143.
HU S, HUANG H, LIANG W Q, et al.Screening, identification and fermentation effects of endogenous Lactobacillus strains isolated from Litchi[J].Journal of Southern Agriculture, 2019, 50(1):137-143.
[6] 刘毕琴, 陈骏飞, 罗义勇, 等.发酵蔬菜来源具抑菌活性明串珠菌的筛选及其细菌素基因簇挖掘[J].食品工业科技, 2024,45 (11):142-150.
LIU B Q, CHEN J F, LUO Y Y, et.al.Screening of Leuconostoc strains with antibacterial activity from fermented vegetables and mining of bacteriocin gene cluster[J].Science and Technology of Food Industry, 2024,45 (11):142-150.
[7] 陈树鹏, 陈晓维, 余元善, 等.西梅的营养价值及加工研究进展[J].中国果菜, 2023, 43(6):15-21.
CHEN S P, CHEN X W, YU Y S, et al.Research progress in nutritional value and processing of Prunus domestica L[J].China Fruit &Vegetable, 2023, 43(6):15-21.
[8] 张芳. 欧李果实采后营养品质的变化及贮藏保鲜方法的研究[D].呼和浩特:内蒙古农业大学, 2020.
ZHANG F.Study on the changes of nutrient quality and fresh-keeping methods of postharvest cerasus humilis[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[9] 李忠, 王向未, 董成虎.不同处理方式对西梅贮藏品质的影响[J].保鲜与加工, 2023, 23(4):16-19.
LI Z, WANG X W, DONG C H.Effects of different treatments on the storage quality of Prunus domestica L[J].Storage and Process, 2023, 23(4):16-19.
[10] 马彩霞, 闫亚美, 米佳, 等.生物保鲜技术在果蔬中的应用与发展[J].宁夏农林科技, 2023, 64(2):20-24; 38.
MA C X, YAN Y M, MI J, et al.Application and development of biological technology in the fresh-keeping of fruits and vegetables[J].Journal of Ningxia Agriculture and Forestry Science and Technology, 2023, 64(2):20-24;38.
[11] 黄伟, 张丽娟, 秦新政, 等.贝莱斯芽胞杆菌JK19发酵液稳定性及抑菌物质初步分析[J].中国生物防治学报, 2022, 38(1):73-80.
HUANG W, ZHANG L J, QIN X Z, et al.Preliminary analysis of stability and antimicrobial substances in fermentation broth of Bacillus velezensis JK19[J].Chinese Journal of Biological Control, 2022, 38(1):73-80.
[12] 李明杨. 抗链格孢乳酸菌的筛选及其对库尔勒香梨品质及生理的影响[D].阿拉尔:塔里木大学, 2018.
LI M Y.Screening of the Lactic acid bacteria against Alternaria and its effects on quality and physiology of Korla fragrant pear[D].Ala’er:Tarim University, 2018.
[13] 王迪. 高二氧化碳处理调控鲜切梨果实品质机制的研究[D].杭州:浙江大学, 2020.
WANG D.Regulatory mechanism of high carbon dioxide treatment on quality of fresh cut pears[D].Hangzhou:Zhejiang University, 2020.
[14] 赵娜, 刘鑫, 石和平, 等.乳酸菌抗菌物质分类及作用机理[J].农产品加工, 2015(10):58-60.
ZHAO N, LIU X, SHI H P, et al.The classification and antibacterial mechanism of antimicrobial substances produced by lactic acid bacteria[J].Farm Products Processing, 2015(10):58-60.
[15] 周幸, 阿热爱·巴合提, 李平兰.微生物群体感应系统与食品防腐保鲜[J].生物加工过程, 2020, 18(2):184-192.
ZHOU X, AREAI B, LI P L.Quorum sensing system and food preservation[J].Chinese Journal of Bioprocess Engineering, 2020, 18(2):184-192.
[16] SIEDLER S, BALTI R, NEVES A R.Bioprotective mechanisms of lactic acid bacteria against fungal spoilage of food[J].Current Opinion in Biotechnology, 2019, 56:138-146.
[17] 王虹军, 田星, 陈芝娟.具有抑菌活性植物乳杆菌细菌素生物稳定性研究[J].海南师范大学学报(自然科学版), 2022, 35(3):282-286;296.
WANG H J, TIAN X, CHEN Z J.Biostability of bacteriocin with antimicrobial activity produced by Lactobacillus plantarum[J].Journal of Hainan Normal University (Natural Science), 2022, 35(3):282-286;296.
[18] 李文斌, 宋敏丽, 高荣琨.肠膜明串珠菌的研究和应用进展[J].食品工程, 2006(4):3-4;11.
LI W B, SONG M L, GAO R K.Research and application process of Leuconostoc mesenteroides[J].Food Engineering, 2006(4):3-4;11.
[19] 马锞, 徐匆, 黄应维, 等.肠膜明串珠菌复合生物保鲜剂对龙眼果实的保鲜作用[J].广东农业科学, 2015, 42(15):65-71.
MA K, XU C, HUANG Y W, et al.Bio-preservation of Longan fruits by complex preservative with Leuconostoc mesenteroides dgnkzx002[J].Guangdong Agricultural Sciences, 2015, 42(15):65-71.
[20] 李祎, 吴晓敏, 杜航, 等.一株肠膜明串珠菌的分离鉴定及其抑菌特性[J].微生物学通报, 2021, 48(12):4776-4788.
LI Y, WU X M, DU H, et al.Isolation, identification, and antibacterial characterization of Leuconostoc mesenteroides[J].Microbiology China, 2021, 48(12):4776-4788.
[21] 朱传胜, 高玉荣, 徐国栋.对单增李斯特菌有抑制作用的乳酸菌的筛选鉴定及其细菌素的研究[J].现代食品科技, 2014, 30(5):87-91;86.
ZHU C S, GAO Y R, XU G D.Screening of lactic acid bacteria for production of anti-Listeria bacteriocin[J].Modern Food Science and Technology, 2014, 30(5):87-91;86.
[22] TRIAS R, BADOSA E, MONTESINOS E, et al.Bioprotective Leuconostoc strains against Listeria monocytogenes in fresh fruits and vegetables[J].International Journal of Food Microbiology, 2008, 127(1-2):91-98.
[23] 杜琨. 乳酸菌细菌素抑菌特性及在食品中的应用研究进展[J].中国酿造, 2022, 41(7):16-20.
DU K.Research advances of antimicrobial properties of bacteriocins from lactic acid bacteria and the application in food[J].China Brewing, 2022, 41(7):16-20.
[24] 胡美丽, 王俊钢, 李宇辉.产细菌素乳酸菌在食品中的应用[J].食品安全质量检测学报, 2022, 13(14):4657-4664.
HU M L, WANG J G, LI Y H.Application of bacteriocin produced by Lactobacillus in food[J].Journal of Food Safety &Quality, 2022, 13(14):4657-4664.
[25] 周倩玉, 郦萍, 王利君, 等.西藏干酪源植物乳杆菌产细菌素的分离纯化及特性研究[J].中国食品学报, 2023, 23(8):24-31.
ZHOU Q Y, LI P, WANG L J, et al.Studies on separation and purification of a bacteriocin produced by Lactobacillus plantarum from Tibetan cheese and its characteristic[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(8):24-31.
[26] 胡文锋, 黄应维, 徐匆, 等.肠膜明串珠菌复合保鲜剂对龙眼冷藏过程中品质变化的影响[J].现代食品科技, 2013, 29(7):1523-1527.
HU W F, HUANG Y W, XU C, et al.Effect of composite biological preservative containing Leuconostoc mesenteroides on quality changes of cold-stored Longan[J].Modern Food Science and Technology, 2013, 29(7):1523-1527.
[27] 胡光耀. 抑制葡萄采后真菌乳酸菌的筛选及其保鲜应用[D].长沙:湖南农业大学, 2019.
HU G Y.Screening and fresh-keeping application of fungal lactic acid bacteria after grape harvest[D].Changsha:Hunan Agricultural University, 2019.
[28] 刘晓茜. 嗜酸乳杆菌NX2-6培养基优化及在樱桃番茄保鲜中的应用[D].南京:南京农业大学, 2015.
LIU X Q.The optimization of Lactobacillus acidophilus NX2-6 medium for antibacterialxproduction and its application in the cherrytomatoes preservation[D].Nanjing:Nanjing Agricultural University, 2015.