柚子作为柑橘属水果,在我国的种植面积广、产量高,因其营养丰富、易于贮藏和运输,享有“天然罐头”之称。柚子除鲜食外,目前加工产品主要以果汁和罐头为主,在加工过程中会产生大量的柚皮等副产物,柚皮中富含多种生物活性物质如果胶、纤维素、精油及黄酮,但由于现有加工技术手段的局限性,柚皮未被充分利用,造成资源浪费和环境污染[1]。因此,亟需开发先进的柚皮深加工技术,以提高其资源利用率和附加值。果胶作为柚子皮中的主要成分之一,被广泛应用于医药、食品、化妆品等领域。果胶是一种天然的大分子杂多糖,主要分布在植物的细胞壁与细胞间质中,其结构主要由同型半乳糖醛酸聚糖(homogalacturonoglycan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rhamnus galacturonide Ⅰ,RG-Ⅰ)、鼠李半乳糖醛酸聚糖Ⅱ(rhamnus galacturonoglycan Ⅱ,RG-Ⅱ)构成[2]。HG结构被称为“光滑区”,RG结构被称为“毛发区”。其中,RG-I区域由重复的鼠李半乳糖醛酸二糖[α-(1,4)-D-GalA-α-(1.2)-L-Rha]单元组成主干[3],约20%~80%的鼠李糖的C-4位置会被不同中性糖侧链取代,同时C-2和C-3位置也可能连接侧链,如阿拉伯半乳聚糖、β-1,4-半乳聚糖、α-1,5-阿拉伯聚糖。
在果胶的传统提取方法中,酸、碱及酶法被广泛应用,然而,这些方法存在效率低、能耗高等问题。近年来,亚临界萃取、微波、超声等联合提取技术逐渐兴起,为果胶提取提供了新的思路。介质阻挡放电(dielectric barrier discharge,DBD)等离子体技术,作为一种新兴的物理加工技术,已在纺织、材料科学、环境工程等领域展现出其独特的优势[4],在多糖的降解与改性、食品加工等领域的应用也逐渐增多[5]。目前研究发现DBD等离子体技术可以有效破坏植物细胞壁结构,增加植物材料的亲水性,提高植物中活性成分的提取率[6]。已有研究通过DBD等离子体技术成功提高多酚、花青素、精油等活性物质的提取率[7]。在果胶研究方面,DBD等离子体技术因具有绿色环保、低能耗、操作简单等优点,多应用于果胶的降解和改性研究。张颂[8]发现DBD等离子体技术可以有效提高芦柑果胶的提取率,还能对HG结构的半乳糖醛酸选择性降解,从而保留RG-Ⅰ结构域。因此,DBD等离子体技术在果胶提取方面的应用确有效果,除此之外相关研究未见文献报道。
本研究旨在探索DBD等离子体技术在柚皮RG-Ⅰ型果胶提取中的应用潜力,通过单因素及正交试验优化提取工艺,进一步对提取得到的果胶进行理化性质和功能特性的深入分析,旨在为柚皮资源的高值化开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜蜜柚,广东省梅州市集贸市场;盐酸、95%(体积分数)乙醇,广州化学试剂厂;氢氧化钠,广东广试试剂科技有限公司;甲醇(色谱级)、乙腈(色谱级),天津市彪仕奇科技发展有限公司;磷酸二氢钾,福晨(天津)化学试剂有限公司;D-葡萄糖标准品、D-半乳糖标准品、D-甘露糖标准品、L-鼠李糖标准品、D-半乳糖醛酸标准品、D-阿拉伯糖标准品、L-岩藻糖标准品,均为色谱级,上海源叶生物科技有限公司;柑橘属商品果胶,生物工程(上海)股份有限公司。
1.2 仪器与设备
ALC-210.4电子天平,德国ACCULAB公司;HWS-24数显恒温水浴锅,上海一恒科学仪器有限公司;DF-101S型数显恒温水浴磁力搅拌器,上海力辰邦西仪器科技有限公司;ST85B3-1真空冷冻干燥机,美国Millrock公司;CR22GⅢ冷冻离心机,日本日立公司;高压电场低温等离子体冷杀菌试验系统CPS-Ⅰ,南京屹润等离子科技有限公司;LC-20A高效液相色谱仪,日本岛津公司;2500A型粉碎机,永康市红太阳机电有限公司。
1.3 实验方法
1.3.1 原材料处理
将新鲜蜜柚果皮和果肉分离,取果皮经60 ℃烘箱烘干,采用高速粉碎机将干燥后的果皮粉碎,再将粉碎的柚皮粉过80目筛后得到的柚皮粉末,置于4 ℃冰箱备用。
1.3.2 柚皮RG-I型果胶的制备
将柚皮粉末与低浓度氢氧化钠溶液按料液比1∶20(g∶mL)混合,将其在恒温水浴磁力搅拌器中进行恒温水浴搅拌,再经DBD等离子体处理。其中,DBD等离子体装置在试验中的详细参数为:极板间距30 mm,高压放电电压130 kV,高压放电频率50 Hz,放电持续时间60 s,放电间隙时间10 s,放电次数根据试验需要进行设定。处理后的混合液经离心机在9 000 r/min转速下离心15 min,收集上清液,并向其加入果胶提取液2倍体积的95%乙醇,混匀后在4 ℃冰箱中静置过夜,使果胶自然析出,将醇沉后的果胶悬浮物经离心机在5 000 r/min转速下离心20 min,弃去溶液,收集沉淀物为果胶粗提取物。将果胶粗提物用去离子水溶解,再经去离子水透析(Mw 3 500 Da)48 h,以除去其中的低聚糖和钠离子。将透析后溶液经旋转蒸发仪浓缩,再将浓缩液进行冷冻干燥,得到果胶提取物。
柚皮果胶的提取率的计算如公式(1)所示:
果胶提取率![]()
(1)
式中:m1为果胶的质量,g;m0为柚皮粉的质量,g。
1.3.3 提取工艺优化
1.3.3.1 单因素试验
以果胶的提取率作为评价指标,同时分析RG-I结构域含量的变化。以提取时间20、40、60、80 min,提取温度35、45、55、65 ℃,DBD处理时间0、5、10、15、20、25 min,提取液中氢氧化钠质量浓度0.2、0.4、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4 g/L为影响因素进行单因素试验。
1.3.3.2 正交试验
根据单因素试验结果以及正交试验设计原理,确定氢氧化钠浓度(A)、提取温度(B)、DBD处理时间(C)3个因素,另设置空白列作为方差分析的误差列,以果胶的提取率为指标,采用SPSS软件设计出三因素三水平的正交试验,因素与水平表如表1所示。每组试验设置3个平行。
表1 正交试验因素与水平设计表
Table 1 Orthogonal test factors and horizontal design table
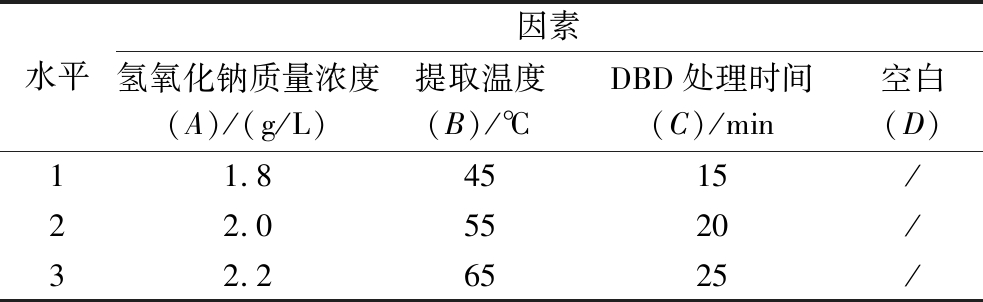
水平因素氢氧化钠质量浓度(A)/(g/L)提取温度(B)/℃DBD处理时间(C)/min空白(D)11.84515/22.05520/32.26525/
1.3.4 单糖组成成分的测定
参考许涵婷等[9]的方法,进行改良后得到的1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone,PMP)结合高效液相色谱(high performance liquid chromatography,HPLC)法用于果胶的单糖组成成分测定。
称取果胶样品10 mg于螺纹顶空瓶中,加入2 mL三氟乙酸溶液(2 mol/L),密封,于100 ℃恒温水浴水解10 h,冷却至室温后经旋转蒸发仪去除残余三氟乙酸,再加入2 mL甲醇并继续旋干,重复操作2次以完全去除三氟乙酸,用水定容至1 mL,待用。
准确称取7种单糖标品,包括D-葡萄糖(D-glucuronic)、D-半乳糖(D-galactose)、D-甘露糖(D-mannose)、L-鼠李糖(L-rhamnose)、D-半乳糖醛酸(D-galacturonic acid)、D-阿拉伯糖(D-arabinose)、L-岩藻糖(L-fucose),配制3 mg/mL的单糖标品溶液。混标溶液由7种单糖标品溶液各取200 μL,定容至2 mL。取200 μL待衍生化溶液(果胶水解液、单糖标品溶液、标品混合溶液)于5 mL离心管中,加入400 μL 0.5 mol/L PMP甲醇溶液和600 μL 0.3 mol/L NaOH溶液,涡旋混匀后于70 ℃恒温水浴反应1 h。反应结束后,水冷却至室温后,再加入600 μL 0.3 mol/L HCl溶液调节pH至中性。然后加入1 mL氯仿萃取,充分涡旋混匀,5 000 r/min转速下离心5 min,取上清液,重复萃取3次后,将上清液过0.22 μm微孔膜后,备用。
HPLC条件为:仪器:高效液相色谱仪岛津;检测器:二级管阵列检测器(photo-diode array,PDA);色谱柱:Agilent ZORBAX Eclipse XDB-C18 (4.6 mm×250 mm, 5 μm);柱温:35 ℃;紫外检测波长:250 nm;流动相:A相为0.02 mol/L磷酸盐缓冲溶液(用氢氧化钠调节pH至6.86),B相为纯乙腈;洗脱方式:等度洗脱,A∶B=85∶15(体积比);流速:1 mL/min;时间:65 min;进样量:10 μL。
单糖组成含量:根据混合液中单糖标准品的峰面积与对应浓度计算各单糖的响应因子,通过响应因子计算样品中各单糖组成成分的相对含量,均以mol%表示。
其中RG-I结构含量和HG结构含量根据文献[10]方法按公式(2)和公式(3)进行计算:
RG-I/mol%=2Rha/mol%+Gal/mol%+Ara/mol%
(2)
HG/mol%=GalA/mol%-Rha/mol%
(3)
1.3.5 果胶的热稳定性
称取适量的样品,采用TG热重分析仪在氮气环境下对果胶进行热稳定性分析,其中温度为40~600 ℃、加热速率为10 ℃/min。
1.3.6 果胶的乳化性质
参考杨涛[11]的方法测定果胶的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)。将12 mL质量浓度为10 mg/mL的果胶溶液和3 mL玉米油在离心管中混合,并在转速20 000 r/min下高速均质2 min。在第0和10 min时,将乳液底部的50 μL乳液加入到5 mL质量浓度为1 mg/mL的SDS溶液中,涡旋混匀,于紫外分光光度计500 nm下记录吸光度。根据吸光度结果代入公式(4)~公式(6)计算EAI和ESI:
(4)
(5)
(6)
式中:T是浊度,m-1;A0和A10分别是第0 min和第10 min时稀释后乳液的吸光度值;D是稀释因子,100;L是光程,0.01 m;φ是形成乳液的油相分数,0.2;c是10 000 g/m3;0.1是转化系数。
1.3.7 果胶的流变学性质
1.3.7.1 果胶的表观黏度
配制不同浓度的果胶溶液,用流变仪检测不同浓度果胶的表观黏度,测试条件为:40 mm平板,测试温度25 ℃,剪切速率为100 s-1,测定时间为60 s。
1.3.7.2 果胶的流变特性
配制不同浓度的果胶溶液,用流变仪检测不同浓度果胶的表观黏度随剪切速率的变化情况,测试条件为:40 mm平板,测试温度25 ℃,剪切速率为1~100 s-1。
1.3.8 果胶的体外抗氧化活性
1.3.8.1 ABTS阳离子自由基清除率的测定
将7 mmol/L的ABTS溶液(50 mL)和140 mmol/L的过硫酸钾溶液(0.88 mL)混合,在室温、避光的条件下静置过夜,形成ABTS储备液。用0.01 mol/L的磷酸盐缓冲液(pH 7.4)将其稀释成工作液(于734 nm波长处吸光度为0.7±0.02)。配制不同浓度的果胶溶液,取10 μL,加入200 μL ABTS阳离子自由基溶液,室温条件下避光振荡30 s后反应6 min,用酶标仪测定波长734 nm处吸光度。以Trolox为标准品,测定不同质量浓度的Trolox对ABTS阳离子自由基的清除率,绘制标准曲线,标准曲线方程为y=0.389 7+0.105 8x,R2为0.999 7。
实验同时设试剂空白组、对照组和样品空白组。清除率的计算如公式(7)所示:
ABTS阳离子自由基清除率![]()
(7)
式中:A1为对照组吸光度;A0为试剂空白组吸光度;Ai为样品组吸光度;Aj为样品空白组吸光度。
1.3.8.2 氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)指数的测定
参考徐维盛等[12]方法,采用荧光酶标仪测试不同果胶的ORAC。用移液枪吸取不同浓度的20 μL果胶样品或Trolox标准液加于96孔黑色酶标板中,再加入100 μL荧光素钠盐工作液,并在37 ℃下暗处孵育10 min,然后加入20 μL2,2’-偶氮二异丁基脒二盐酸盐(2,2’-azobis-2-methyl-propanimidamide,AAPH)工作液(除不需要添加AAPH孔外),迅速启动反应。在激发波长485 nm,发射波长538 nm的条件下,进行连续的荧光强度测定。每2 min测定一次,每次测定前振动孔板5 s,在荧光强度衰减呈基线后停止测定。
将相应时间点各孔的绝对荧光强度数据与无AAPH组空白荧光强度进行比较,折算成各孔的相对荧光强度f,以此由公式(8)计算积分面积:
AUC=0.5×[2×(f1+f2+…+fn-1+fn)-f1-fn]×CT
(8)
式中:AUC为荧光衰退曲面下的面积;fn是第n次读取荧光值的相对荧光强度;CT表示每次循环间隔时间。
标品或者待测样的荧光保护面积(Net AUC)等于标品或样品作用下的衰退曲线面积(AUCsample)减去空白对照作用孔的荧光衰退(AUCblank)而得的荧光衰退曲线的延迟部分面积;样品的ORAC值,由其荧光衰退曲线的保护面积与标品Trolox的保护面积相比而得。结果表示为每毫克样品的Trolox当量(μmol/L TE/mg样品),计算如公式(9)所示:
(9)
式中:AUCSample为样品的荧光衰退曲面下的面积;AUCTrolox为标品的荧光衰退曲面下的面积;AUCblank为空白对照的荧光衰退曲面下的面积;MSample为样品的质量浓度,mg/L;MTrolox为标品的摩尔浓度,mol/L。
1.4 数据分析
每组实验至少重复3次,采用IBM SPSS Statistics 26软件进行数据分析,数据结果以“平均值±标准偏差”表示,显著性分析中,不同字母表示不同组数据间存在显著差异(P>0.05),利用Origin软件进行图像绘制。结果中经过DBD技术辅助提取得到的果胶编号为DAP。未经过DBD技术辅助提取得到的果胶编号为AP。商品果胶编号为CP。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 提取时间对柚皮果胶提取率和RG-I含量的影响
由图1可知,随着提取时间的延长,果胶的提取率增加缓慢。WANDEE等[13]研究发现果胶提取时间的延长有利于溶液中的羟基离子诱导细胞壁的膨胀,破坏纤维素与其他多糖之间的分子间氢键,从而促使果胶从细胞壁中溶出。而本试验结果表明,随着提取时间的延长果胶提取率的增加幅度并不明显,这与黄莹星[14]在提取柠檬果胶时的研究结果相似,即果胶提取率随着提取时间的延长而增加,但增加的幅度有限,这可能是因为果胶溶出充分,在提取液体系中趋向饱和。果胶中RG-Ⅰ结构域的占比呈现波动的趋势,在提取时间为60 min时,RG-Ⅰ的比例达到最高,为(53.04±0.29) mol%。由于果胶的提取率和其中的RG-Ⅰ结构比例随提取时间的延长增加不显著,因此不将提取时间作为正交试验的主要因素。
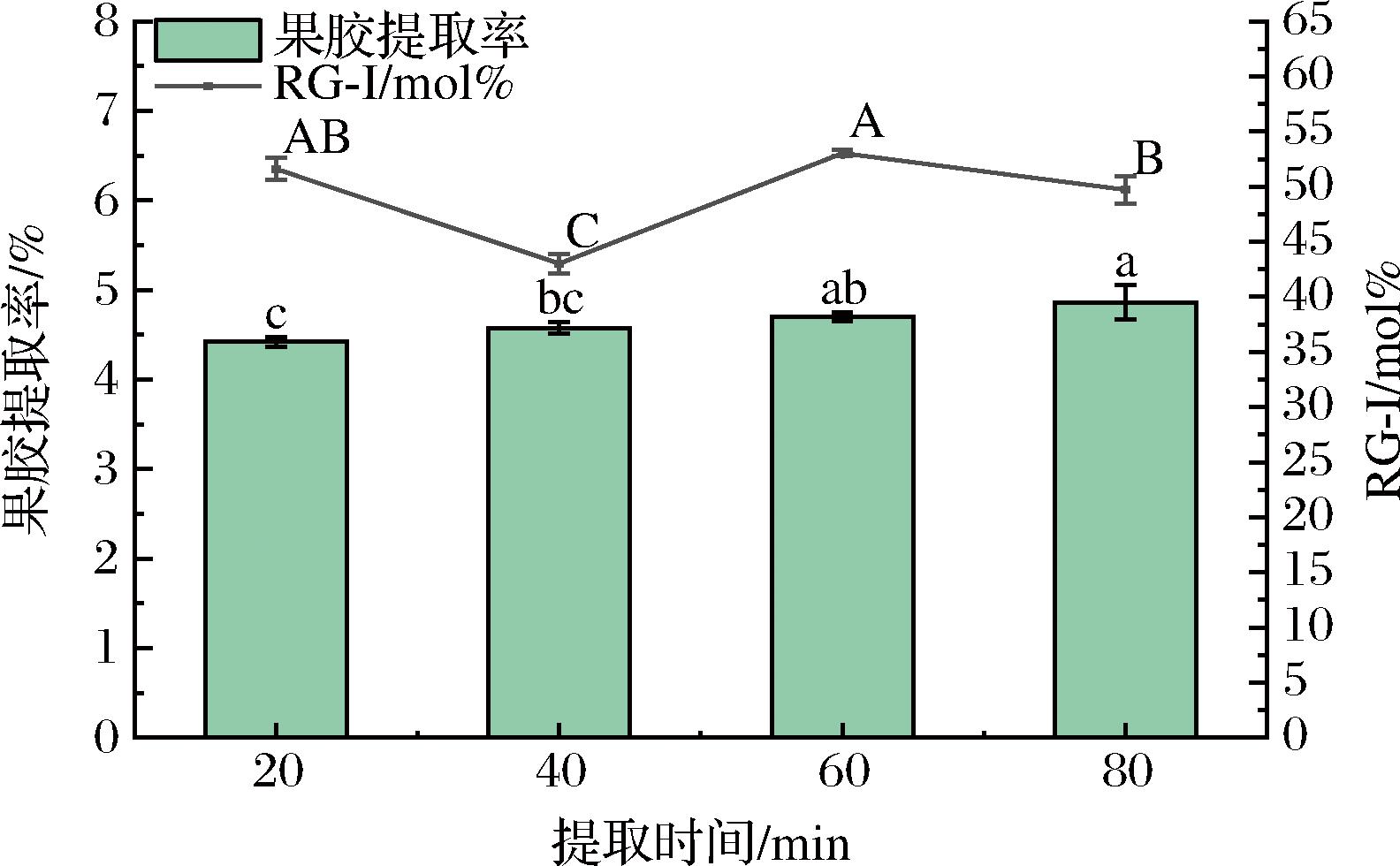
图1 提取时间对果胶提取率与RG-Ⅰ结构含量的影响
Fig.1 Effect of extraction time on pectin extraction rate and RG-Ⅰ structural content
注:图中同一系列字母不同代表组间差异显著(P<0.05)(下同)。
2.1.2 提取温度对柚皮果胶提取率和RG-Ⅰ含量的影响
由图2可知,果胶提取率随着提取温度的升高呈现先上升后下降的趋势,在55 ℃时,果胶提取率达到最大,表明提取温度对果胶的溶出影响显著。RG-Ⅰ结构含量也呈现相似的变化趋势,在55 ℃时占比达到(61.22±0.04)%。在35~55 ℃时,随着温度的升高,促进了碱溶液对细胞壁上的纤维素、半纤维素和果胶的溶胀作用,导致细胞壁破裂[15],从而提高了提取液对果胶的渗透速率和溶解度,有效提升了果胶的提取效率。然而,当温度超过55 ℃时,高温结合碱溶液可能会引起果胶链的降解,生成难以回收的低聚糖[16],从而导致果胶提取率的下降。
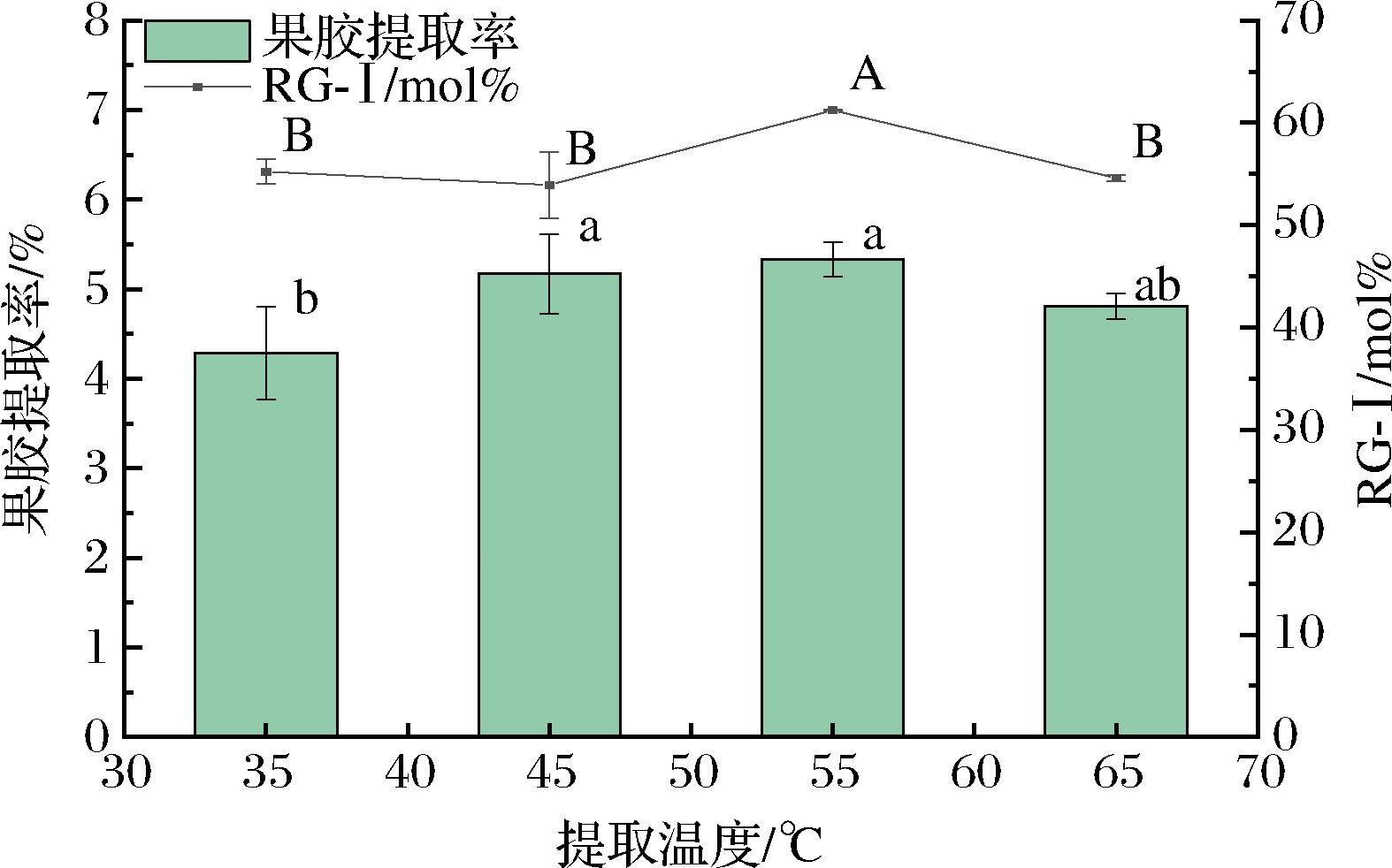
图2 提取温度对果胶提取率与RG-Ⅰ结构含量的影响
Fig.2 Effect of extraction temperature on pectin extraction yield and RG-Ⅰ structural content
2.1.3 DBD处理时间对柚皮果胶提取率和RG-Ⅰ含量的影响
由图3可知,果胶提取率随着DBD处理时间的延长呈现出先上升后下降的趋势,表明在一定时间范围内,DBD技术可以有效促进柚皮中果胶的溶出。然而,处理时间过长反而会导致果胶提取率的下降,这可能是由于长时间的等离子体处理导致生成臭氧等活性离子引起溶液中溶出的果胶发生降解,形成低分子质量的多糖,在后续醇沉步骤中无法完全沉降,从而导致果胶提取率降低。与此同时,RG-Ⅰ结构含量随着等离子体处理时间的延长变化并不明显。GUO等[17]的研究显示,DBD技术处理可以有效地降解西瓜果胶的分子主链,减少分子质量,并改变其形态结构,但对侧链的影响较小。此外,张颂[8]在研究DBD技术对柑橘果胶提取的影响时也发现,长时间的DBD处理会降低果胶的提取率,这与本试验结果相一致。
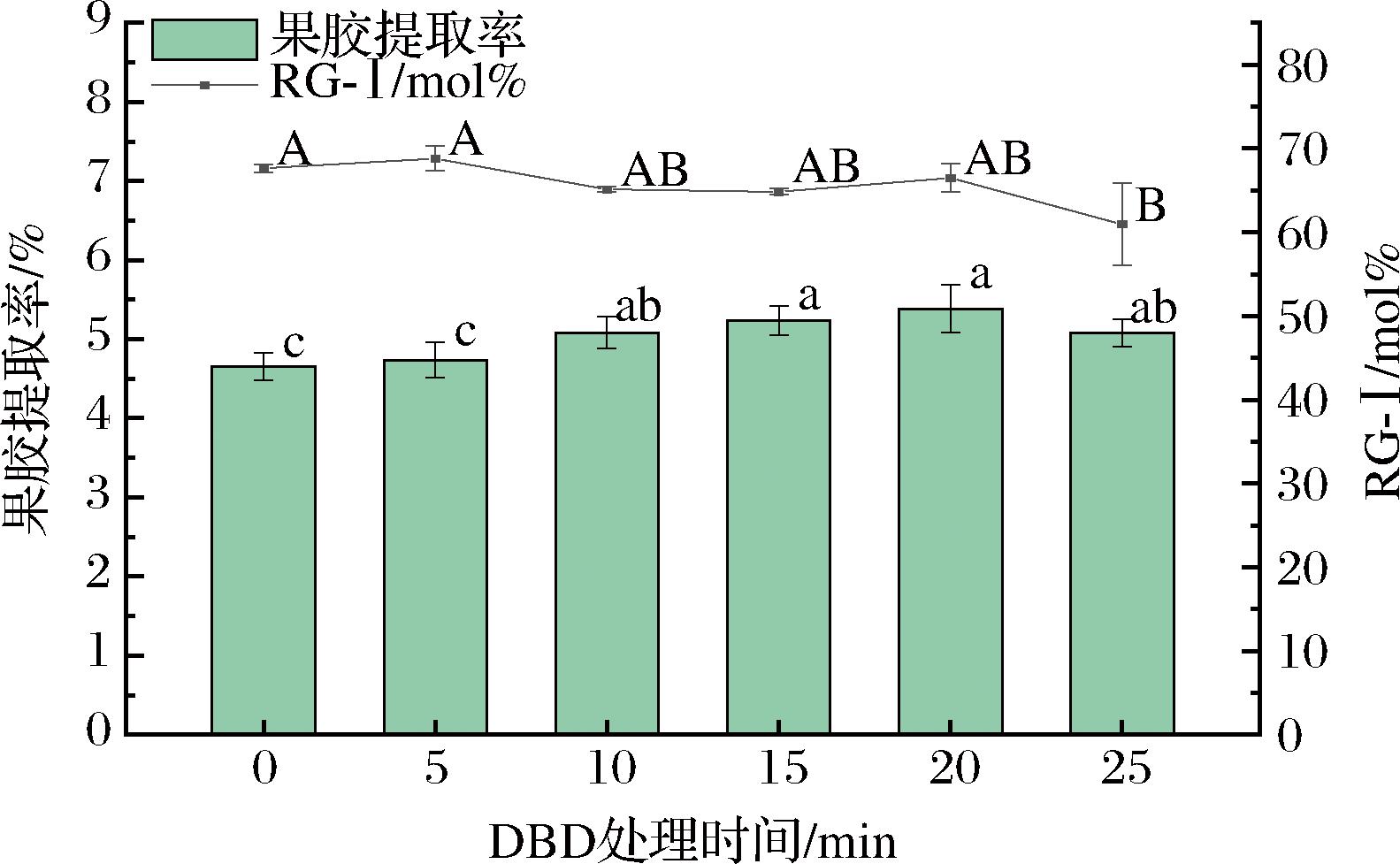
图3 DBD处理时间对果胶提取率与RG-Ⅰ结构含量的影响
Fig.3 Effect of DBD treatment time on pectin extraction yield and RG-Ⅰ structural content
2.1.4 氢氧化钠浓度对柚皮果胶提取率和RG-Ⅰ含量的影响
在低浓度的氢氧化钠条件下,随着氢氧化钠质量浓度从0.2 g/L增加到2.0 g/L,果胶的提取率显著提高(图4),这表明氢氧化钠质量浓度的增加有助于果胶的溶解。在高浓度氢氧化钠的条件下,即2.0~2.4 g/L时,果胶的提取率未见明显提高。WANDEE等[13]发现相同浓度下氢氧化钠溶液提取的果胶得率高于使用盐酸溶液的方法,但是提取液中碱浓度过高会导致果胶提取率下降,可能是由于高浓度碱环境促使果胶部分分解为小分子糖,无法被醇沉,从而导致果胶提取率降低。HU等[18]研究也发现氢氧化钠浓度的增加并未提高果胶提取率,而是导致果胶侧链的断裂,进而影响果胶的提取率。该结论与本文的实验结果相吻合。随着氢氧化钠质量浓度的增加,RG-Ⅰ结构含量的比例先增加然后逐渐下降,这表明虽然碱浓度有助于促进RG-Ⅰ果胶的提取,但过高的浓度则会降低其含量。
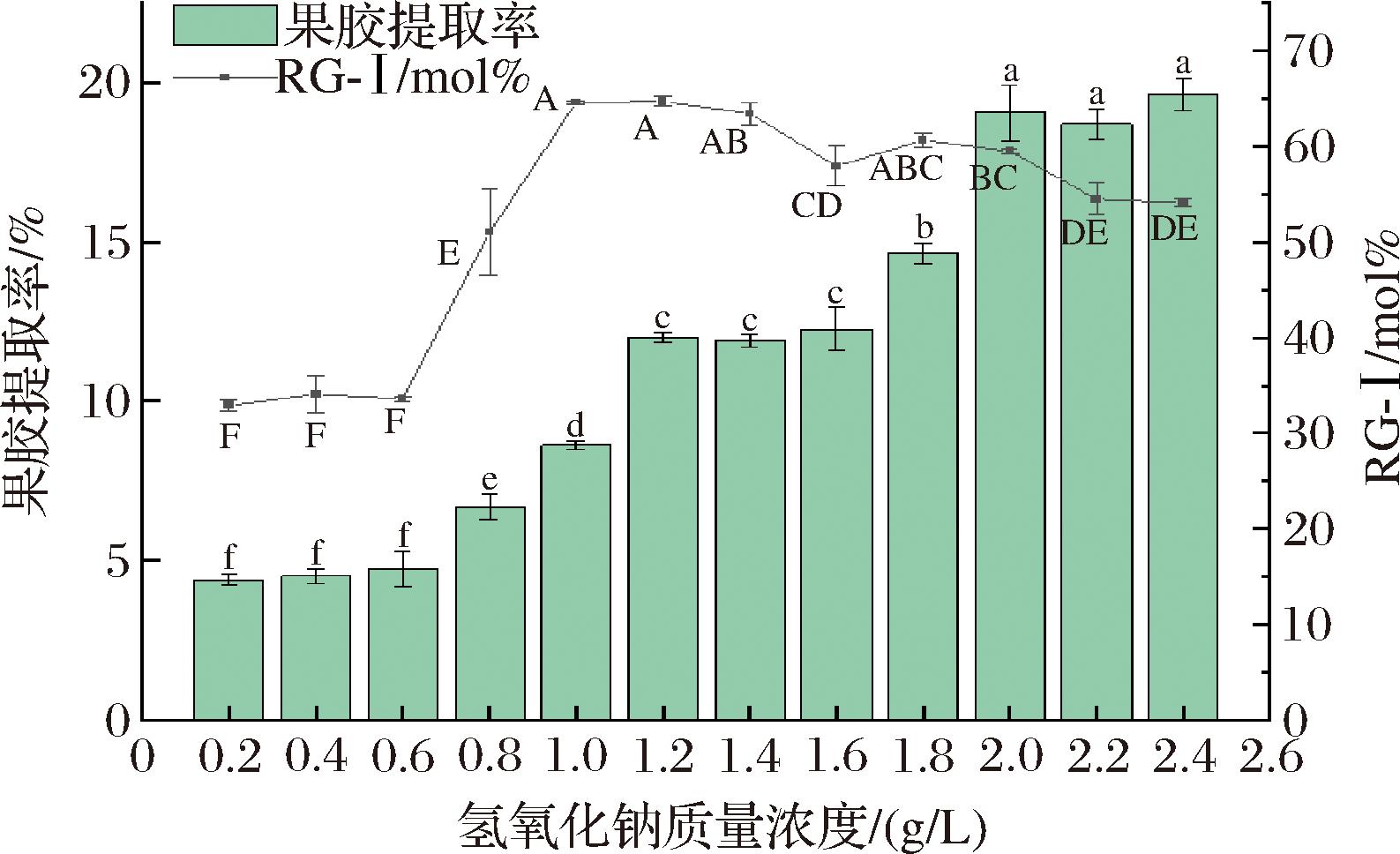
图4 氢氧化钠浓度对果胶提取率与RG-Ⅰ结构含量的影响
Fig.4 Effect of sodium hydroxide concentration on pectin extraction yield and RG-Ⅰ structural content
2.2 正交试验优化柚皮RG-Ⅰ型果胶提取工艺的结果
由表2、表3可知,在柚皮RG-Ⅰ型果胶的提取过程中,各因素对果胶提取率的影响程度顺序为:氢氧化钠质量浓度>提取温度>DBD处理时间。因此,通过试验优化确定的最佳提取条件为A3B3C1,即氢氧化钠质量浓度2.2 g/L,提取温度65 ℃,DBD处理时间15 min。
表2 正交试验结果
Table 2 Results of orthogonal tests
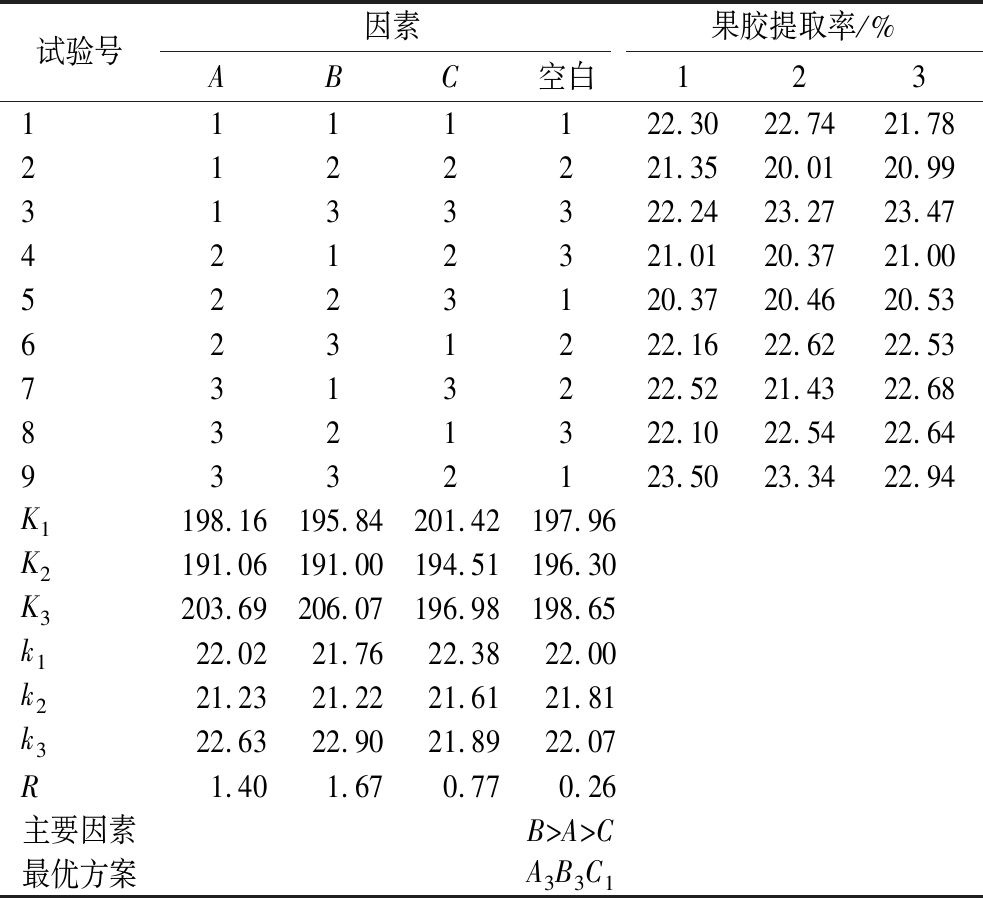
试验号因素果胶提取率/%ABC空白1231111122.3022.7421.782122221.3520.0120.993133322.2423.2723.474212321.0120.3721.005223120.3720.4620.536231222.1622.6222.537313222.5221.4322.688321322.1022.5422.649332123.5023.3422.94K1198.16195.84201.42197.96K2191.06191.00194.51196.30K3203.69206.07196.98198.65k122.0221.7622.3822.00k221.2321.2221.6121.81k322.6322.9021.8922.07R1.401.670.770.26主要因素B>A>C最优方案A3B3C1
表3 正交试验方差分析表
Table 3 Analysis of variance by orthogonal test
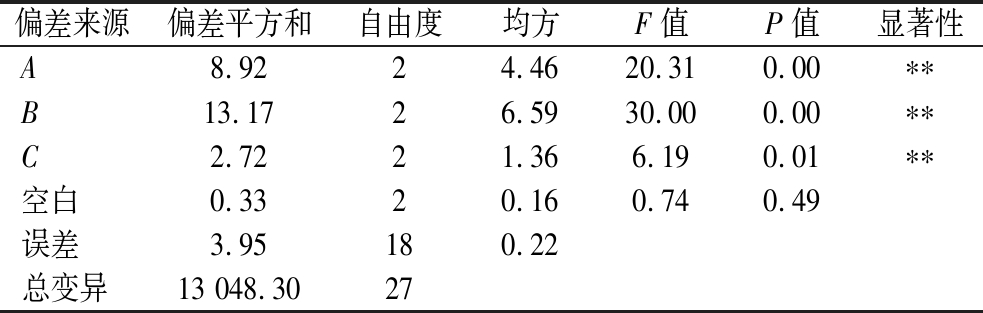
偏差来源偏差平方和自由度均方F值P值显著性A8.9224.4620.310.00∗∗B13.1726.5930.000.00∗∗C2.7221.366.190.01∗∗空白0.3320.160.740.49误差3.95180.22总变异13 048.3027
注:*表示P<0.05,**表示P<0.01。
在上述优化条件下进行的验证性试验显示,果胶的提取率达到了(24.85±0.64)%。同时,所提取的柚皮果胶中RG-Ⅰ结构域的占比为(61.14±0.09)%。同等条件下,无DBD等离子体技术进行辅助,通过碱溶液进行柚皮果胶提取,其提取率为(21.21±0.29)%,RG-Ⅰ结构域的占比为(55.70±0.07)%。结果表明,DBD等离子体技术可以显著提高柚皮果胶的提取率和RG-Ⅰ结构域比例。
目前DBD等离子体技术的提取机理尚不完全清楚,但普遍认为的可能机制为2种,一种是认为植物细胞壁结构被破坏,从而促进活性成分的扩散;另一种则是认为等离子体处理会提高植物性物料表面的亲水性,从而提高亲水活性成分的溶解与扩散[19]。本研究试验中的工作气体为空气,因此在放电过程中产生活性氧和活性氮的混合粒子集合。活性粒子与柚皮中植物细胞壁的分子发生碰撞,与其发生氧化反应,破坏分子内部的化学键,使长链的细胞壁分子被氧化降解成小片段,并引发细胞壁的水解和聚合反应,从而破坏植物细胞壁结构[20]。此外DBD等离子体在击穿空气的同时也会产生冲击波,对其细胞壁产生机械破坏[21]。因此,细胞壁中的果胶成分更容易摆脱细胞壁中纤维素之类的大分子的束缚,更容易溶解在提取液中,从而使果胶的提取率提高。DBD等离子体在放电过程中还会产生高能电子、正离子和自由基等活性物质,这些活性物质会在植物材料表面发生反应,使其表面产生亲水的官能团,如羧基、酰胺等,提高植物材料表面成分的亲水性,从而促进其溶出[22]。此外这些活性物质也会侵蚀柚皮粉颗粒的表面,形成孔洞,破坏植物细胞壁,促使果胶的溶出[22]。
2.3 果胶的单糖组成成分分析
果胶的单糖组成反映果胶的结构特征,对性质与生物活性具有重要影响。如表4所示,不同果胶之间的单糖组成存在显著差异,表明它们在结构上具有不同特性。DAP中半乳糖醛酸的含量相对较低,而3种果胶之间鼠李糖的含量差异较小,DAP中的HG结构含量相对较低。CP中的半乳糖是3种果胶中含量最高的,而阿拉伯糖和岩藻糖含量最低,DAP中阿拉伯糖是三者中含量最高的。通过分析发现3种果胶均属于RG-Ⅰ型果胶,其中DAP中的RG-Ⅰ结构比例最高,达到(61.14±0.09)%。通过计算果胶的线性化程度[GalA/(Fuc+Rha+Ara+Gal+Xyl)],发现CP的线性化程度最高,而DAP最低。Rha/GalA比值反映了果胶中RG结构与HG结构的比例,其结果与HG结构和RG-Ⅰ结构的比例呈现相关性。在所有样品中,DAP的Rha/GalA值最大,表明其RG结构比例最高,而HG结构比例最低。此外,(Ara+Gal)/Rha值反映了RG-Ⅰ结构的侧链分支程度,DAP的RG-Ⅰ结构的侧链分支最大,其次是AP,CP则最低。
表4 不同果胶的单糖组成
Table 4 Monosaccharide composition of different pectins

单糖组成/mol%APDAPCP甘露糖3.51±0.03b4.33±0.04a2.19±0.01c鼠李糖9.15±0.24b9.65±0.17b10.32±0.04a半乳糖醛酸38.07±0.25a33.52±0.73b39.48±0.26a葡萄糖5.35±0.20b5.98±0.16b11.22±0.18a半乳糖8.69±0.10c11.08±0.02b23.59±0.12a阿拉伯糖28.71±0.47b30.77±0.27a10.48±0.24c岩藻糖6.52±0.07a4.68±0.43b2.74±0.16cHG28.91±0.15a23.87±0.56b29.16±0.22aRG-I55.70±0.07b61.14±0.09c54.69±0.24aRha/GalA0.24±0.01c0.29±0.00a0.26±0.00b(Ara+Gal)/Rha4.09±0.17a4.34±0.10a3.30±0.04cGalA/(Fuc+Rha+Ara+Gal+Xyl)0.72±0.01b0.60±0.02c0.84±0.01a
注:表中上标同一系列字母不同代表同一单糖不同来源的差异显著(P<0.05)。
2.4 果胶的热稳定性分析
热重分析(thermogravimetry analysis,TG)可以反映物质在连续加热下的质量损失情况,通过热重分析评估不同果胶的热分解过程。由图5-a中可以看出,3种果胶的TG曲线分为3个阶段。第一阶段,初始温度40~180 ℃,是水分的蒸发阶段,其中AP与DAP的质量损失高于CP,AP与DAP的质量损失约为13%,而CP的质量损失约10%,说明AP与DAP的水分含量(吸附水或结合水)高于CP。第二阶段,180~380 ℃,3种果胶的质量损失最为显著,主要涉及果胶主要成分的热分解,该阶段AP与DAP的质量损失均为55%左右,CP的质量损失为60%左右。最后一个阶段为380~600 ℃,该阶段的果胶质量损失相对较小。最终3种果胶残余质量为AP 31.47%,DAP 30.98%,CP 29.16%。
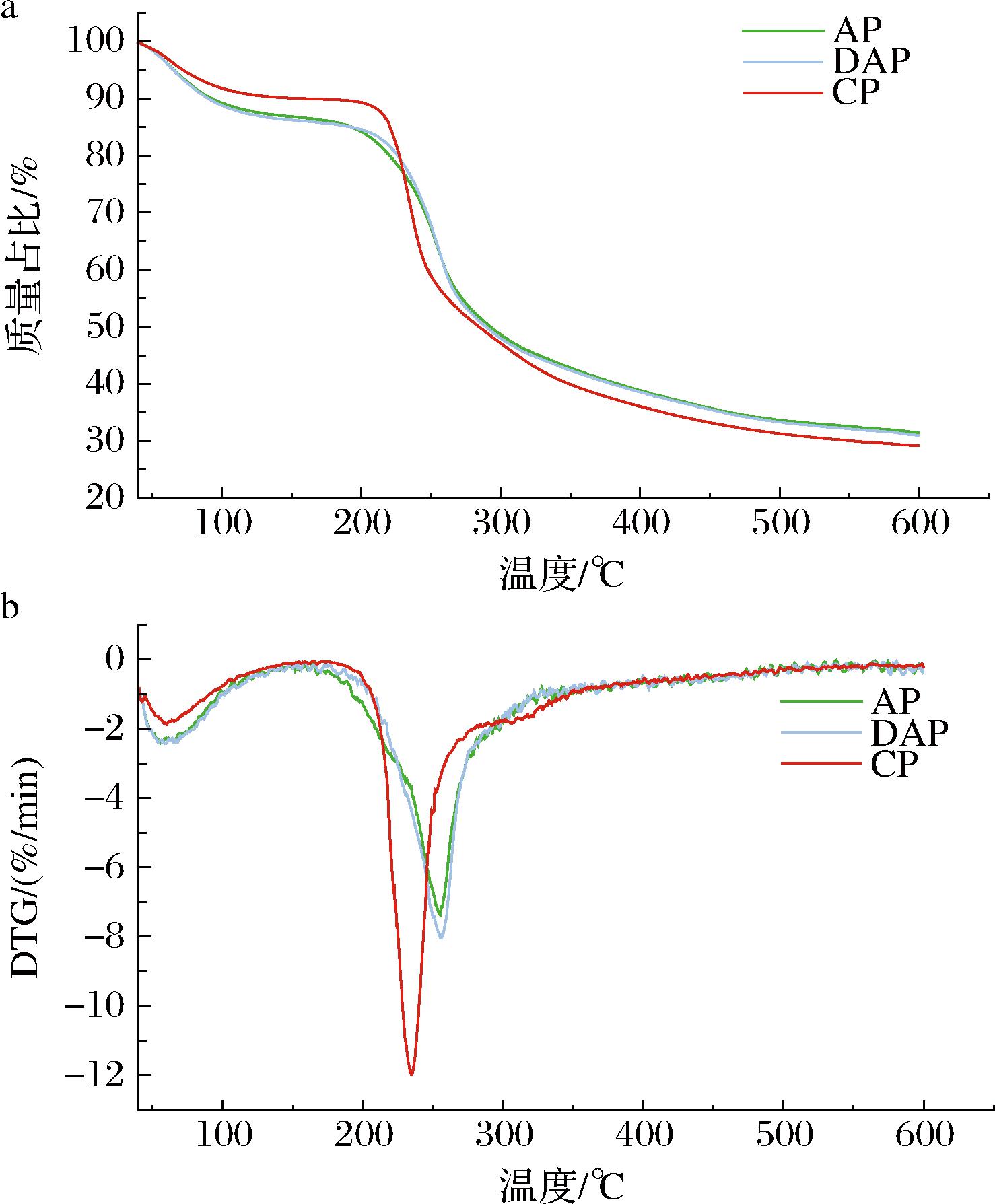
a-果胶的热重图;b-果胶的微分热重图
图5 不同果胶的热重图和微分热重图
Fig.5 Thermogram and differential thermogram of different pectins
由图5-b微分热重曲线(derivative thermogravimetry,DTG)可以得出,不同果胶的最大热解速率对应的峰值温度,AP与DAP的峰值温度较为接近,分别为255.05 ℃、256.27 ℃。而CP的峰值温度则相对较低,约为234.60 ℃。当质量损失10%时,CP的降解温度最高,而AP与DAP的降解温度较低,这可能是由于AP和DAP中含有的较多的水分。当质量损失为25%或50%时,CP的降解温度反而低于AP和DAP,表明AP和DAP的热稳定性优于CP(表5)。
表5 不同果胶的热重分析结果
Table 5 Results of TGA of different pectins
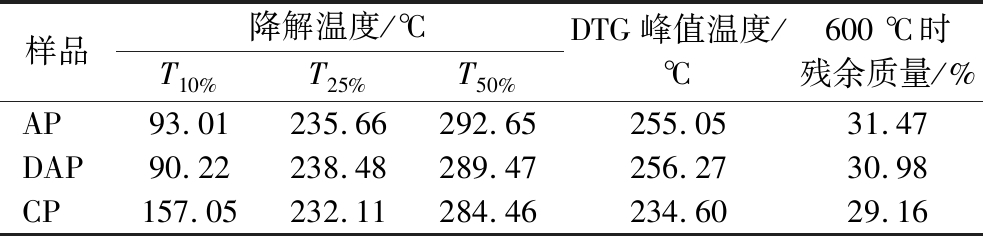
样品降解温度/℃T10%T25%T50%DTG峰值温度/℃600 ℃时残余质量/%AP93.01235.66292.65255.0531.47DAP90.22238.48289.47256.2730.98CP157.05232.11284.46234.6029.16
注:T10%、T25%、T50%分别代表质量损失10%、25%、50%时对应的温度。
2.5 果胶的乳化特性分析
EAI反映乳化剂的乳化性能,是指单位质量的乳化剂稳定乳液中油滴的总界面面积,ESI则是表征乳液稳定性的指标。如表6所示,DAP的EAI值显著高于AP和CP,表明其乳化能力优于AP和CP。但是在乳液稳定性方面,CP的ESI值显著高于AP和DAP,而且AP和DAP的ESI并无显著性差异,说明CP的乳液稳定性最好,AP和DAP的乳液稳定性相差不显著,但DAP的稳定性相对优于AP。结果表明果胶的结构会影响其乳化特性。已有研究报道果胶中的RG-Ⅰ结构与HG结构的比例以及RG-Ⅰ结构的侧链长度会影响果胶的乳化特性[23]。DAP的RG-Ⅰ结构比例与侧链分支程度最大,且线性化程度最小,更容易吸附在油水界面上,阻止油滴的聚集,因此DAP的乳化性能最好。但是正因为DAP的侧链分支程度大,线性化程度小,所以其侧链之间更容易发生缠绕,不足以稳定吸附后的油水界面。因此DAP的乳液稳定性并不是最好的。同样的,尽管CP乳化活性相对较低,但由于RG-Ⅰ结构能够稳定油水界面,且线性化程度大,侧链分支程度低,也不易造成相互缠绕,使得乳液液滴能够在一定距离内更好地保持相对稳定,因此具有良好的乳液稳定性。
表6 不同果胶的乳化特性
Table 6 Emulsification characteristics of different pectins
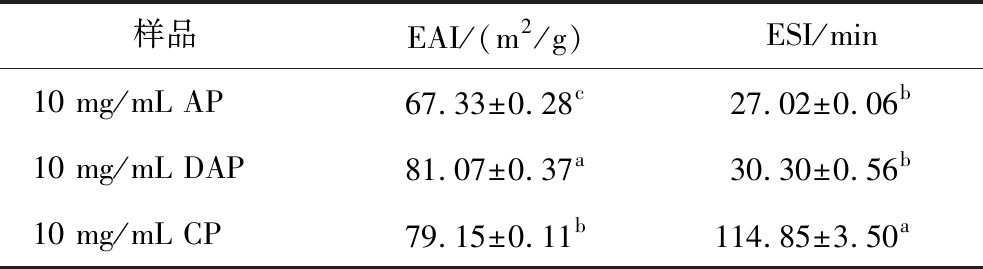
样品EAI/(m2/g)ESI/min10 mg/mL AP67.33±0.28c27.02±0.06b10 mg/mL DAP81.07±0.37a30.30±0.56b10 mg/mL CP79.15±0.11b114.85±3.50a
2.6 果胶的流变特性分析
果胶的表观黏度是衡量果胶增稠性、稳定性的重要指标。如图6-a所示,3种果胶溶液的表观黏度与其浓度呈正相关,均随着果胶溶液浓度的增加而提高。其中CP的表观黏度均高于AP和DAP。如图6-b所示,果胶溶液的表观黏度随着剪切速率的增加而减弱,表现出剪切变稀现象,说明3种果胶溶液均为剪切变稀的假塑性流体。剪切速率的增加可以减少果胶分子之间以及侧链之间的相互作用,导致果胶链之间发生解缠,破坏了果胶链形成的网状结构,并使果胶链沿着剪切方向排列,从而降低表观黏度[24]。一方面,果胶溶液的黏度随果胶浓度的增加而增加,主要是由于溶剂与多糖分子之间的摩擦造成的能量损失,因此果胶浓度的增加会提高其表观黏度。另一方面,CP的表观黏度高于AP和DAP,是因为其线性化程度大,破坏其分子之间的相互作用力并使其逐渐排列在剪切方向上所需要的能量最多。其次AP与DAP在浓度为10 mg/mL和20 mg/mL 时展现相反的表观黏度趋势,可能是因为DAP的支链丰富,且多于AP,在10 mg/mL时其产生的分子间与分子内的相互作用力要大于AP,因此浓度为10 mg/mL时DAP的表观黏度大于AP。但随着果胶浓度的增加,由于AP的线性化程度大,分子链间产生相互作用以及其支链间的相互作用要强于DAP,所以呈现出AP的表观黏度大于DAP。
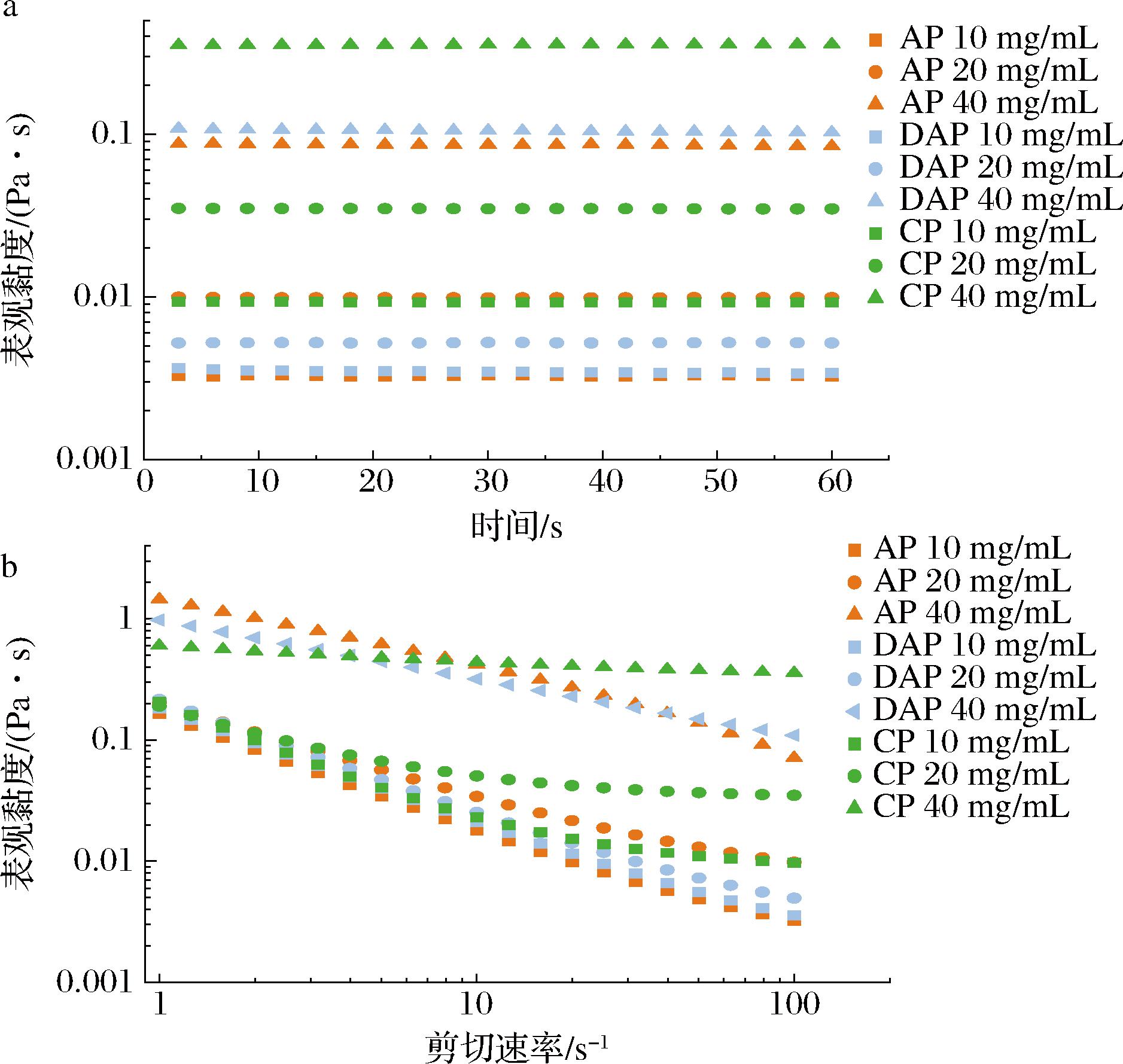
a-不同果胶的表观黏度;b-不同果胶的流变特性
图6 不同果胶的表观黏度变化曲线
Fig.6 Curves of the apparent viscosity of different pectins
2.7 果胶的体外抗氧化能力分析
采用ABTS法和ORAC法评估不同果胶之间的抗氧化活性(图7)。如图7-a所示,果胶的ABTS阳离子自由基清除率随着果胶浓度的提高而增强。在相同浓度条件下,DAP的ABTS阳离子自由基清除率最高,其次为AP,CP的清除率最低。通过分析比较3种果胶的Trolox当量,发现3种果胶的ABTS当量差异性并不显著,但是DAP的Trolox当量相对较高。此外,各果胶的氧自由基吸收能力从大到小分别为DAP、CP、AP,且各果胶之间的ORAC值差异显著。表明DAP果胶具有最佳的体外抗氧化活性。一般来说,果胶的半乳糖糖醛酸含量越高,分子质量越低,甲酯度越低,其抗氧化活性越高[25]。AP和CP的半乳糖醛酸含量高于DAP,但两者的抗氧化活性均比DAP差,这可能是因为DAP的线性化程度低,更容易暴露出果胶链中的活性基团,便于清除或接受自由基,从而表现出更优的抗氧化活性。
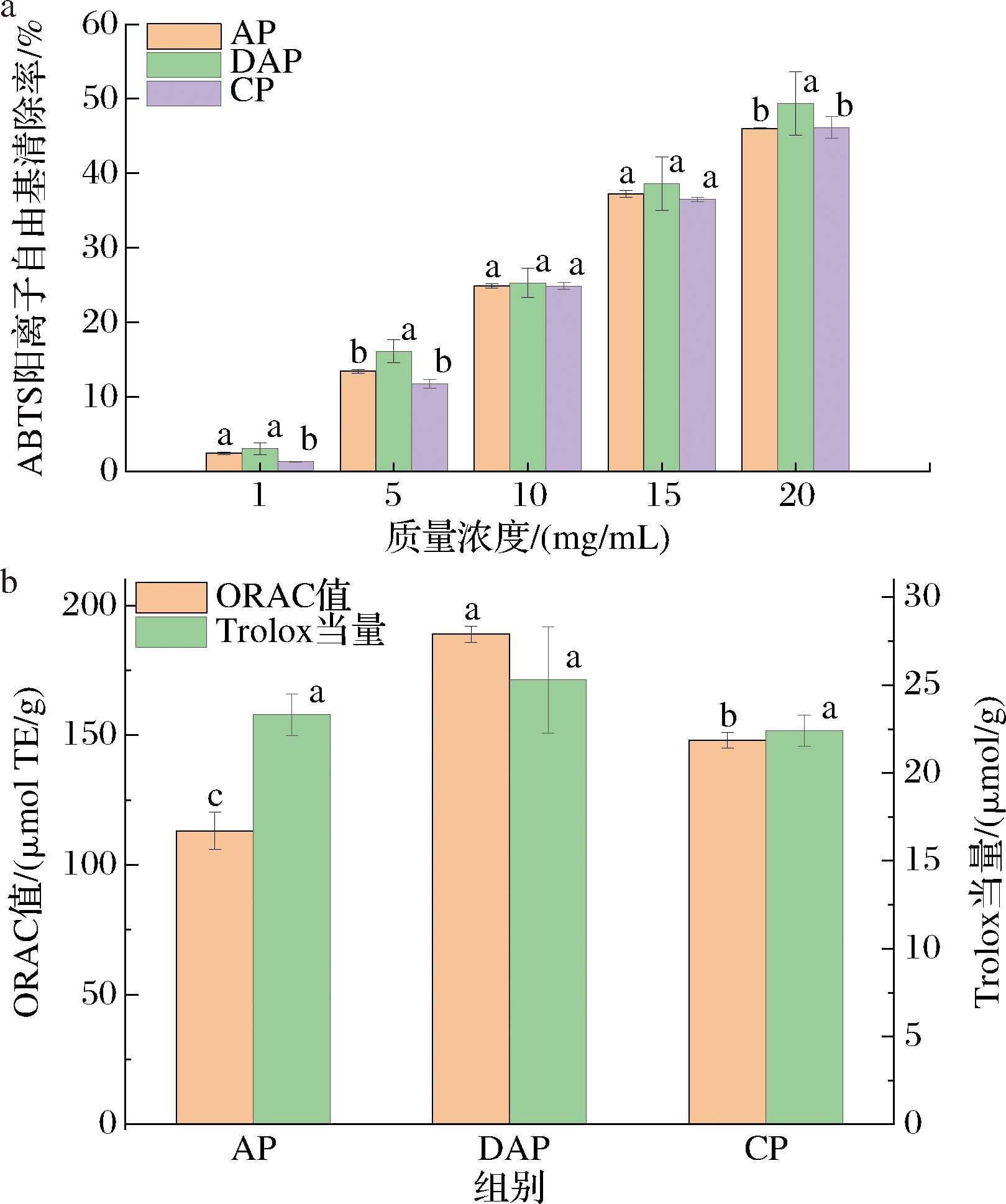
a-不同果胶的ABTS阳离子自由基清除能力;b-不同果胶的ORAC值和Trolox当量
图7 不同果胶的抗氧化能力
Fig.7 Antioxidant capacity of different pectins
3 结论
本研究的内容主要是对低温等离子体技术辅助提取柚皮RG-Ⅰ型果胶工艺的优化以及对其性质进行表征,得到结论如下:
a)通过单因素试验和正交试验,确定了柚皮RG-Ⅰ型果胶的最佳提取条件:提取温度65 ℃,DBD处理时间15 min,氢氧化钠质量浓度2.2 g/L。经验证性试验表明,果胶的提取率为(24.85±0.64)%,RG-Ⅰ结构域含量为(61.14±0.09)%,显著高于单纯碱溶液提取的果胶。说明DBD等离子体技术能显著提高柚皮RG-Ⅰ型果胶的提取率。
b)DAP中的单糖组成含量由高到低依次为半乳糖醛酸、阿拉伯糖、半乳糖、鼠李糖、葡萄糖、岩藻糖、甘露糖,其果胶分子具有最低的线性化程度,但RG-Ⅰ结构含量最高,达到(61.14±0.09) mol%,并且RG-Ⅰ结构的侧链分支程度最高。在热稳定性方面,AP和DAP均优于CP。就乳化特性而言,DAP表现最佳,尽管其乳化稳定性不如CP,但仍优于AP。在流变性质上,AP、DAP和CP均表现为剪切变稀的非假塑性流体,其中CP的表观黏度最高。在抗氧化活性评估中,DAP在ABTS阳离子自由基清除能力和氧自由基吸收能力方面均表现最佳。以上结论表明DBD等离子体技术可以提取到富含RG-Ⅰ结构的果胶,本研究优化提取条件并对果胶性质进行系统表征,为利用DBD等离子体技术提取柚皮RG-Ⅰ型果胶提供理论依据。
[1] 高歌. 超高压技术在红柚汁加工与柚皮果胶提取中应用研究[D].北京:中国农业大学, 2018.
GAO G. Study on the application of ultra-high pressure technology in the processing of red pomelo juice and the extraction of pectin from pomelo peel[D]. Beijing: China Agricultural University, 2018.
[2] CUI J F, ZHAO C Y, FENG L P, et al.Pectins from fruits:Relationships between extraction methods, structural characteristics, and functional properties[J].Trends in Food Science &Technology, 2021, 110:39-54.
[3] WU D M, ZHENG J Q, MAO G Z, et al.Rethinking the impact of RG-I mainly from fruits and vegetables on dietary health[J].Critical Reviews in Food Science and Nutrition, 2020, 60(17):2938-2960.
[4] WANG J, XING C R, XIA J, et al.Degradation of carbendazim in aqueous solution by dielectric barrier discharge cold plasma:Identification and toxicity of degradation products[J].Food Chemistry, 2023, 403:134329.
[5] WANG Z W, JIA H, YANG J Y, et al.Inactivation of Alicyclobacillus contaminans in apple juice by dielectric barrier discharge plasma[J].Food Control, 2023, 146:109475.
[6] XI J, WANG Y, ZHOU X B, et al.Cold plasma pretreatment technology for enhancing the extraction of bioactive ingredients from plant materials:A review[J].Industrial Crops and Products, 2024, 209:117963.
[7] HEYDARI M, CARBONE K, GERVASI F, et al.Cold plasma-assisted extraction of phytochemicals:A review[J].Foods, 2023, 12(17):3181.
[8] 张颂. 介质阻挡放电等离子体对柑橘果胶的提取及降解研究[D].烟台:烟台大学, 2018.
ZHANG S.Study on extraction and degradation of citrus pectin by dielectric barrier discharge plasma[D].Yantai:Yantai University, 2018.
[9] 许涵婷, 唐语谦, 胡腾根, 等.荔枝果渣可溶性膳食纤维去结合酚前后结构和功能性质的比较[J].现代食品科技, 2023, 39(8):206-212.
XU H T, TANG Y Q, HU T G, et al.Comparison of the structure and functional properties of soluble dietary fiber from lychee pomace before and after the removal of bound phenolics[J].Modern Food Science and Technology, 2023, 39(8):206-212.
[10] 胡薇薇. 声压联合辅助提取Ⅰ型鼠李半乳糖醛酸(RG-Ⅰ)果胶多糖机制研究[D].杭州:浙江大学, 2021.
HU W W. Study on the mechanism of extraction of pectin polysaccharide from rhamnuronic acid type Ⅰ (RG-Ⅰ) by combined sound pressure[D]. Hangzhou: Zhejiang University, 2021.
[11] 杨涛. 豆渣转化为食品级高效皮克林稳定剂的途径及机理[D].广州:华南理工大学, 2021.
YANG T. Ways and mechanism of transforming bean dregs into food-grade efficient Pickering stabilizer[D]. Guangzhou: South China University of Technology, 2020.
[12] 徐维盛, 李东, 刘静, 等. ORAC法对12种水果总抗氧化能力评价研究[J]. 食品工业, 2014, 35(1): 247-250.
XU W S, LI D, LIU J, et al. Study on antioxidant activities of 12 kinds of fruit[J]. The Food Industry, 2014, 35(1): 247-250.
[13] WANDEE Y, UTTAPAP D, MISCHNICK P.Yield and structural composition of pomelo peel pectins extracted under acidic and alkaline conditions[J].Food Hydrocolloids, 2019, 87:237-244.
[14] 黄莹星. 柠檬皮高酯果胶的分步提取及其性能研究[D].广州:华南理工大学, 2020.
HUANG Y X. Step-by-step extraction of high-ester pectin from lemon peel and its properties[D]. Guangzhou: South China University of Technology, 2020.
[15] BROXTERMAN S E, SCHOLS H A.Interactions between pectin and cellulose in primary plant cell walls[J].Carbohydrate Polymers, 2018, 192:263-272.
[16] DRANCA F, VARGAS M, OROIAN M.Physicochemical properties of pectin from Malus domestica ![]() pomace as affected by non-conventional extraction techniques[J].Food Hydrocolloids, 2020, 100:105383.
pomace as affected by non-conventional extraction techniques[J].Food Hydrocolloids, 2020, 100:105383.
[17] GUO Z L, WU S Z, ZHENG H, et al.Effects of dielectric barrier discharge plasma modification on structure, physicochemical and functional properties of watermelon peel pectin[J].Food Hydrocolloids, 2024,147:109350.
[18] HU W W, YE X Q, CHANTAPAKUL T, et al.Manosonication extraction of RG-Ⅰ pectic polysaccharides from citrus waste:Optimization and kinetics analysis[J].Carbohydrate Polymers, 2020, 235:115982.
[19] KESHAVARZI M, NAJAFI G, GAVLIGHI H A, et al.Enhancement of polyphenolic content extraction rate with maximal antioxidant activity from green tea leaves by cold plasma[J].Journal of Food Science, 2020, 85(10):3415-3422.
[20] MELOTTI L, MARTINELLO T, PERAZZI A, et al.Could cold plasma act synergistically with allogeneic mesenchymal stem cells to improve wound skin regeneration in a large size animal model?[J].Research in Veterinary Science, 2021, 136:97-110.
[21] ![]() , MARAS M, BARBA F J, et al. Innovative technologies for the recovery of phytochemicals from Stevia rebaudiana Bertoni leaves:A review[J].Food Chemistry, 2018, 268:513-521.
, MARAS M, BARBA F J, et al. Innovative technologies for the recovery of phytochemicals from Stevia rebaudiana Bertoni leaves:A review[J].Food Chemistry, 2018, 268:513-521.
[22] KARUNANITHI S, GUHA P, SRIVASTAV P P.Cold plasma-assisted microwave pretreatment on essential oil extraction from betel leaves:process optimization and its quality[J].Food and Bioprocess Technology, 2023, 16(3):603-626.
[23] ZHAO J Y, HONG T, HOU Y J, et al.Comparison of structures and emulsifying properties between water-extracted pectins from Fructus aurantii[J].International Journal of Biological Macromolecules, 2023, 242:125005.
[24] XU F Z, ZHANG S K, WATERHOUSE G I N, et al.Yeast fermentation of apple and grape pomaces affects subsequent aqueous pectin extraction:Composition, structure, functional and antioxidant properties of pectins[J].Food Hydrocolloids, 2022, 133:107945.
[25] QI X D, YU Y, WANG X Y, et al.Structural characterization and anti-oxidation activity evaluation of pectin from Lonicera japonica Thunb[J].Frontiers in Nutrition, 2022, 9:998462.