我国畜禽屠宰血液副产物随着畜禽产物需求增加逐年激增,在2023年总产量超800万t,深加工转化不够,衍生产品种类匮乏,给经济社会可持续发展带来了巨大挑战[1]。如何在节能、清洁、环保的前提下,对畜禽血液进行“多组分利用、多层次加工、多环节增值”的精深加工与绿色循环利用,是当前我国现代农业与食品领域的科技热点。在畜禽养殖环境承载力有限的条件下,加强对已有血液副产物资源的精深加工和高值化利用具有重要的经济和社会效益。
血红蛋白(hemoglobin, Hb)是血液中蛋白的主要成分,具有极高的利用价值,已经被应用于急诊医学(作为无细胞氧载体)[2]、医疗保健(作为铁补给剂、食源性抗氧化肽)[3]、食品加工(食品级着色)[4]等领域。而脱去血红素的Hb被称作脱铁血红蛋白(apohemoglobin, ApoHb)也称珠蛋白(globin),ApoHb结构完整时,周围的4条多肽链仍因分子作用力相互结合,原本结合血红素的非极性氨基酸残基富集的区域因疏水作用呈现出一个空腔[5]。这一空腔可以负载具有营养功能的疏水性小分子物质,在提高水溶性的基础之上,避免或减少环境因素(氧气、光、热)的接触和刺激[6],进而达到对功能因子保护和运载的目的。ApoHb因其无毒安全,来源广泛的特点,也开始在功能食品,医疗负载药物等领域展露锋芒[7-8]。
从血液分离ApoHb需要脱除血红素,同时尽量保持原有蛋白构象稳定,即保持其运载活性。常用有机试剂丙酮和甲基乙基酮(methyl ethyl ketone, MEK)进行洗脱[9-10](图1),然而,上述有机试剂往往存在安全风险高、成本昂贵以及提取效果不佳等问题,而且加工与食用安全性差,后处理难度大,难以达到食品级工业应用标准要求,相关绿色、便捷、安全的洗脱方法亟待开发[11]。乙醇可溶解众多难溶于水的物质,作为加工助剂和食品添加剂,在发酵、酿造等食品加工领域有广泛应用[12],乙醇对血红素具有较高亲和性,是其良好溶剂之一,而在酸性条件下,分子内静电斥力导致蛋白质分子的展开,蛋白质结构变得松散,珠蛋白的近组氨酸残基端发生质子化,血红素和珠蛋白之间的结合被破坏,根据相似相溶原理,血红素更倾向溶解于乙醇中,随后被洗脱。如图2所示,本研究拟通过研究不同浓度酸性乙醇制备ApoHb的效果,探究ApoHb的结构与运载特性,旨在验证乙醇洗脱法制备ApoHb的可行性,从而为可食用ApoHb原料制备提供新策略与借鉴。
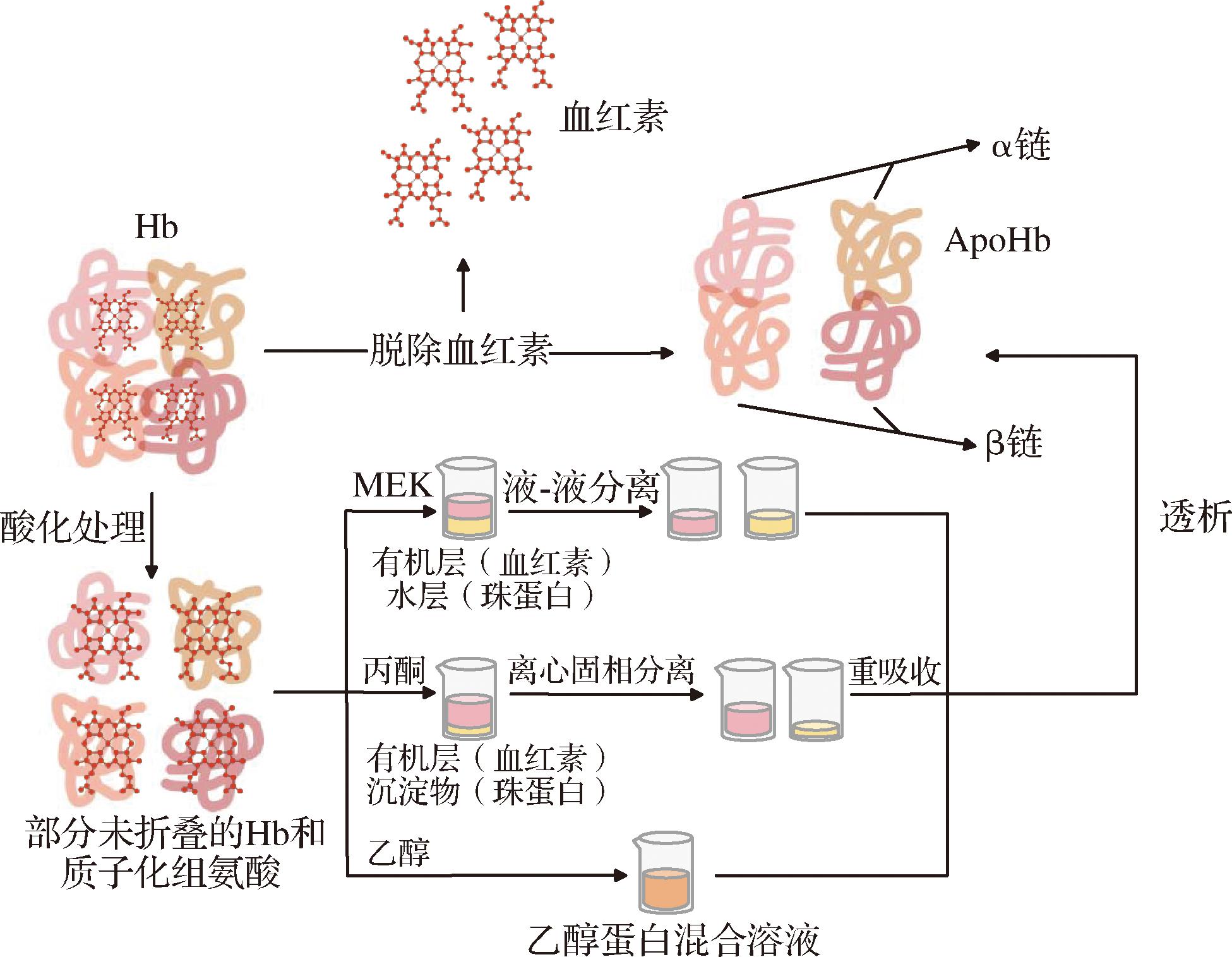
图1 用MEK、丙酮以及乙醇从血红蛋白中
分离活性脱铁血红蛋白的过程示意图
Fig.1 The process of separating active ApoHb from Hb using MEK, acetone and ethanol
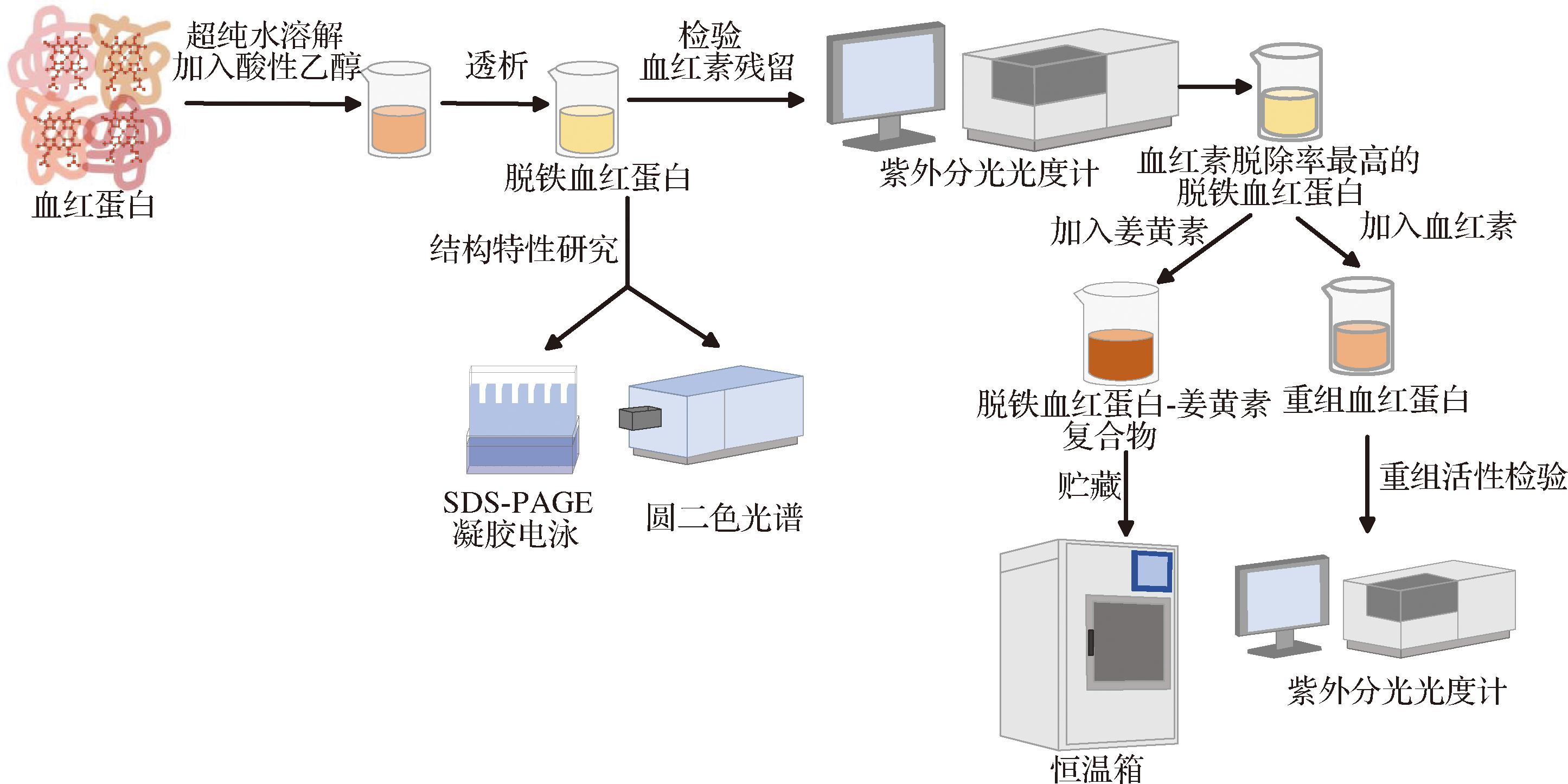
图2 用不同体积分数的酸性乙醇从血红蛋白中分离活性脱铁血红蛋白,探究其活性、结构特性以及负载特性的实验流程图
Fig.2 The experimental process of separating active ApoHb from Hb using acidic ethanol of different concentrations to investigate its activity, structural characteristics and complexation characteristics
1 材料与方法
1.1 材料与试剂
牛血液血红蛋白,无水乙醇,氯化血红素,无水硫酸铜,国药集团化学试剂上海有限公司;姜黄素,上海百灵威化学技术有限公司;SDS-PAGE 凝胶快速配制试剂盒,酒石酸钾钠,上海泰坦科技股份有限公司;Marker 1610374/1610394 (分子质量:10~250 kDa),伯乐生命医学产品上海有限公司;透析袋HZX193-19(MD34分子质量3 500 Da),海门市麦斯诺实验器材经营部。
1.2 仪器与设备
Multifuge X1R热电贺利氏高速冷冻离心机,美国赛默飞世尔科技有限公司;Mini-PROTEAN Tetra型电泳槽,伯乐生命医学产品上海有限公司;Chirascan VX型圆二色光谱仪,英国应用光物理公司;Tanon 1600多功能凝胶图像分析系统,上海天能科技有限公司;台式单通道型酸度计,梅特勒托利多仪器上海有限公司;UV-2600i紫外分光光度计,岛津企业管理中国有限公司;Milli-Q®台式纯水系统,默克化工技术有限公司。
1.3 实验方法
1.3.1 脱铁血红蛋白的制备
pH和血红蛋白浓度的确定参考PIRES等[11]的方法。将血红蛋白粉末用超纯水充分溶解后,加入到酸性乙醇(pH值为3)中,得到乙醇体积分数分别为0、25%、50%、75%、80%、90%梯度乙醇提取液,其中HCl浓度为3 mmol/L,血红蛋白质量浓度为2 mg/mL。将得到的样本分别放进已经被充分活化的透析袋中,在 4 ℃下,用同体积分数乙醇溶液作为透析液连续透析36 h,前12 h每6 h更换一次透析液,之后每12 h更换一次透析液。随后,使用 1.6 mmol/L NaHCO3透析 1 h,以除去 HCl,再用水洗脱多次,除去乙醇,洗脱期间透析袋倒置多次,保证除杂彻底。取出袋内溶液,4 ℃离心10 min(8 000 r/min),取上清液,统计所得样品的体积并使用双缩脲法测定蛋白质浓度。
1.3.2 脱铁血红蛋白残留血红素检测
精密称取 0.018 0 g 血红素,用 0.1 mol/L 的氢氧化钠溶液完全溶解,转移至100 mL容量瓶中,定容至刻度,摇匀。再分别吸取上述溶液 1.0、2.0、3.0、4.0、5.0 mL 置于 100 mL 容量瓶中,用 0.1 mol/L氢氧化钠溶液稀释至刻度,摇匀,以溶剂0.1 mol/L 氢氧化钠溶液为空白,在 405 nm 波长处测定紫外吸收值,得线性回归方程。通过紫外分光光度计检测透析后溶液在波长 405 nm 处的紫外吸收值,计算并比较血红素残留量。结合血红素标准曲线计算Hb在不同浓度酸性乙醇中血红素的脱除率。
1.3.3 SDS-PAGE凝胶电泳
对未处理的 Hb 和不同体积分数乙醇透析得到的ApoHb使用SDS-PAGE分析蛋白纯度及分子质量。根据Hb分子质量,选用5%(体积分数)的浓缩胶和12%(体积分数)的分离胶,将蛋白溶液浓度统一控制在 0.8 mg/mL。
参考本实验室前期的方法[13]进行电泳实验,将样品缓冲液与不同蛋白样品按1∶1比例加入到合适的离心管中,再加入一定量的β-巯基乙醇,将样品在通风橱中煮沸 3 min,冷却至室温后加入一定量的溴酚蓝溶液。使用移液枪将经处理过的样品转移进样品槽,Marker加入 10 μL,蛋白样品加入 15 μL。连接电极接通电源后,初始电压90 V,待条带于分离胶和浓缩胶分界线时,调整电压至110 V,冰浴中运行2~3 h。考马斯亮蓝染色3 h,脱色过夜,至胶除条带外呈透明色,即脱色完成。将得到的凝胶通过图像处理软件Image J进行强度分析。
1.3.4 圆二色光谱分析
蛋白二级结构的测定参考MOULTON等[14]的方法并作一定的修改。将在酸性乙醇中透析得到的不同的 ApoHb 样品在去离子水中稀释到浓度大约10 μmol/L。同时使用去离子水将Hb溶解至10 μmol/L。室温条件下,在光谱仪上进行远紫外圆二色光谱扫描。光谱范围设置为300~500 nm。通过对比 Hb 和 不同种类ApoHb 在 222 nm 处的 α-螺旋峰来确定脱铁血红蛋白的 α-螺旋含量的变化。利用CDPro软件对蛋白二级结构(α-螺旋、β-折叠、β-转角、无规卷曲)进行分析并计算含量。
1.3.5 脱铁血红蛋白重组检测
将血红素与ApoHb重新复合,由重组血红蛋白(recombinant hemoglobin, rHb)的重组率来检验ApoHb的活性。将不同种蛋白溶液取样稀释10倍,使用紫外分光光度作吸收峰检测得 405 nm 处血红素紫外吸收峰值。分别取不同组样品蛋白溶液至烧杯中,用0.01 mol/L NaOH 配制 5 mg/mL 的血红素(Mw=651.94)溶液,匀速搅拌下缓慢滴加血红素溶液至蛋白溶液中至溶液有沉淀析出,计算血红素的加入量(过量 1.5 倍)。在此过程中,样品将全程处于低温环境中。滴加完成,继续搅拌,等待反应1 h。反应结束后,用 1 mol/L NaOH 和 0.1 mol/L NaOH 调节溶液pH值至10,此时溶液变为黑褐色。继续低温搅拌 20 min,透析去除过量和未与ApoHb结合的血红素。用量筒收集rHb,测量每个样品的总体积,取样稀释至同浓度后作紫外光谱扫描,测量405 nm处光吸收值,代入血红素标准曲线中计算血红蛋白重组率,如公式(1)所示:
(1)
式中:A为血红蛋白重组率,%;C1为血红蛋白中血红素含量;C2为rHb中血红素含量;C3为ApoHb中血红素残留量。
1.3.6 脱铁血红蛋白负载姜黄素
准确称取0.01 g的姜黄素(curcumin, Cur),用无水乙醇溶解,并定容至 100 mL,得到 100 μg/mL 的姜黄素溶液。然后用乙醇稀释使姜黄素溶液浓度变为 1、2、3、4、5 μg/mL,分别测定其吸光值,绘制姜黄素浓度标准曲线。
脱铁血红蛋白负载姜黄素时均在避光条件下进行,将溶于无水乙醇的姜黄素(3 mg/mL)分别滴加至乙醇体积分数为80%制备的ApoHb 溶液中,在室温(25 ℃)条件下快速搅拌,使姜黄素溶液的最终浓度为 150 μg/mL。避光反应 1 h 后调节 pH 至中性,加入过量乙醇,使游离姜黄素充分溶解在乙醇溶液中,而ApoHb-Cur复合物在溶解过程中析出。再经10 000 r/min,20 min,4 ℃离心后,分离上清液和沉淀,测量上清液体积,再将上清液稀释10倍,充分振荡。测定 425 nm 下的紫外吸收值,结合姜黄素含量标曲计算不同溶液中姜黄素的浓度。
1.3.7 ApoHb负载稳定性分析
将ApoHb-Cur 复合物样品分为6组,贮存在4 ℃、常温和 37 ℃的避光和不避光环境中,探究光照和温度对ApoHb-Cur复合物样品稳定性的影响,每隔7 d进行一次保留率检测,对比观察不同条件下样品的姜黄素保留率变化。
1.4 数据处理
在每次的实验中均设置3组对照,结果以“平均值±标准差”表示,使用软件OriginPro 2023b进行科研绘图。使用软件 GraphPad Prism 10 对数据进行 one-way ANOVA 差异显著性分析,不同字母表示不同组别间存在差异(P<0.05)。
2 结果与分析
2.1 不同乙醇体积分数制备脱铁血红蛋白效果分析
如图3所示,加入酸性乙醇的蛋白溶液透析后颜色变得澄清透明,不同乙醇体积分数的蛋白溶液颜色变化不同。血红素是血红蛋白中的显色基团,所以血红素的脱除程度可以通过透析后蛋白溶液颜色的深浅反映,其中使用80%乙醇洗脱得到的蛋白溶液颜色最浅,推测其血红素脱除率最高。如图4所示,通过测定样品蛋白溶液在220~540 nm处的紫外吸收光谱,探究不同浓度乙醇对Hb脱除血红素的影响。血红素在400~450 nm处具有尖锐的吸收峰[15],图4中展示蛋白溶液的最大紫外吸收峰出现在405 nm处,该处的吸收峰可表征不同透析蛋白溶液中血红素含量,对比Hb在405 nm处吸收峰的值可计算得血红素的脱除率。

图3 乙醇体积分数为0、25%、50%、75%、80%、90%的蛋白溶液透析后颜色图
Fig.3 The color of protein solutions with ethanol concentrations of 0%, 25%, 50%, 75%, 80%, and 90% after dialysis
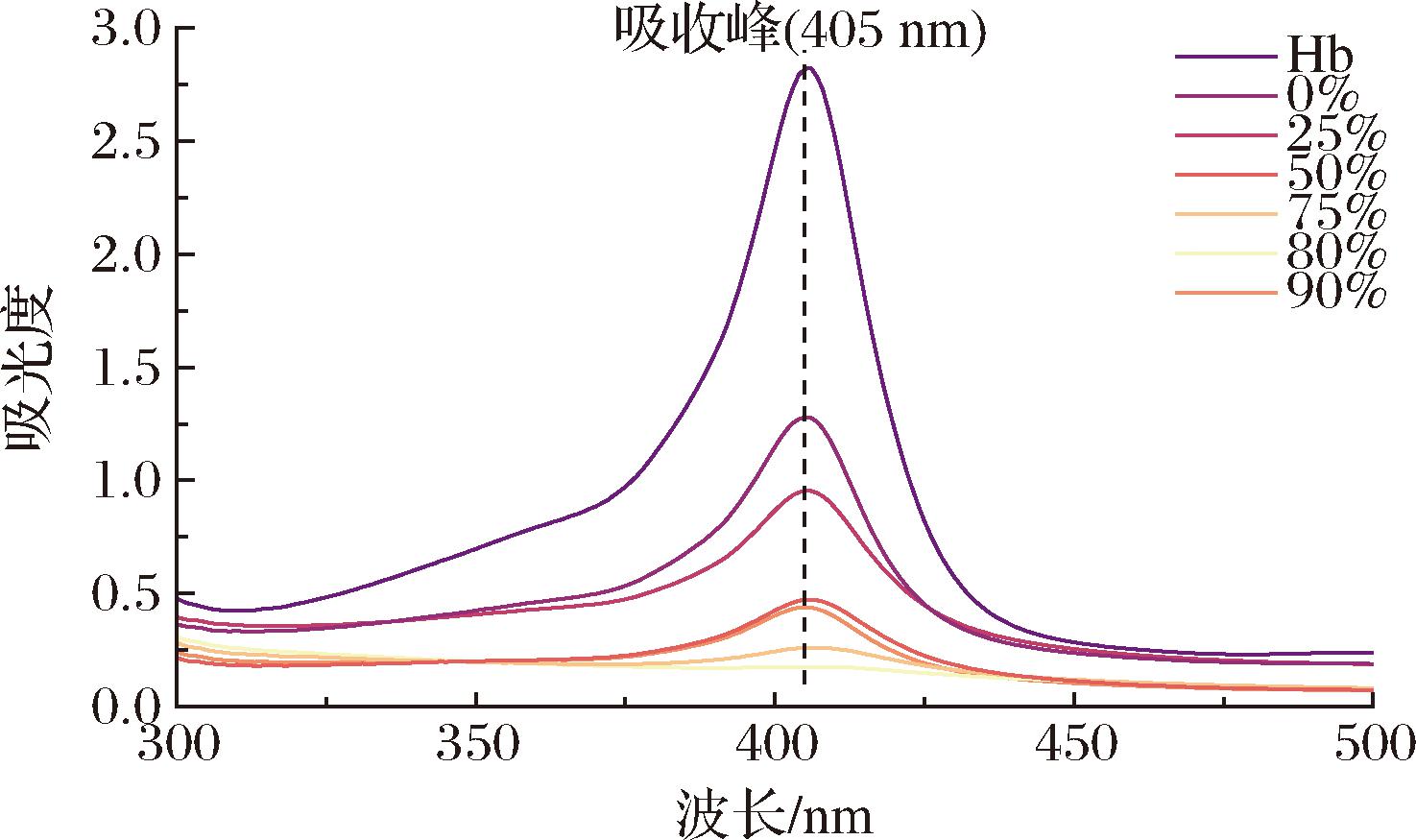
图4 Hb与乙醇体积分数0、25%、50%、75%、80%、90%的ApoHb样品紫外吸收峰
Fig.4 UV Absorbance spectra of Hb and ApoHb with ethanol concentrations of 0%, 25%, 50%, 75%, 80%, and 90%
由图5可知,乙醇体积分数为80%时血红素的脱除效果最佳,脱除率达91.21%。当乙醇体积分数<80%时,血红素的脱除率随乙醇体积分数的升高而升高;当乙醇体积分数>80%时,血红素的脱除率随乙醇体积分数的升高而降低。将Hb加入酸性乙醇,在低pH条件下蛋白质结构伸展,珠蛋白的近组氨酸残基端发生质子化[16],血红素与珠蛋白间的结合被破坏,Hb的结构变得松散,血红素与珠蛋白均以游离的形式存在。根据相似相溶,游离血红素更容易溶解在乙醇中,在随后的透析过程中游离血红素被洗脱除去。所以,当乙醇体积分数不高时,血红素的脱除率随乙醇体积分数的升高而升高。但当乙醇体积分数过高时,Hb可能发生了结构重排,蛋白质变性导致结构发生改变,使血红素和珠蛋白发生了不可逆的交联[17],阻碍血红素的脱除。实验中,当乙醇体积分数为80%时血红素脱除率最高,即为血红素脱除的最佳条件,因而,后续姜黄素负载实验采用80%乙醇处理制备的ApoHb样品。
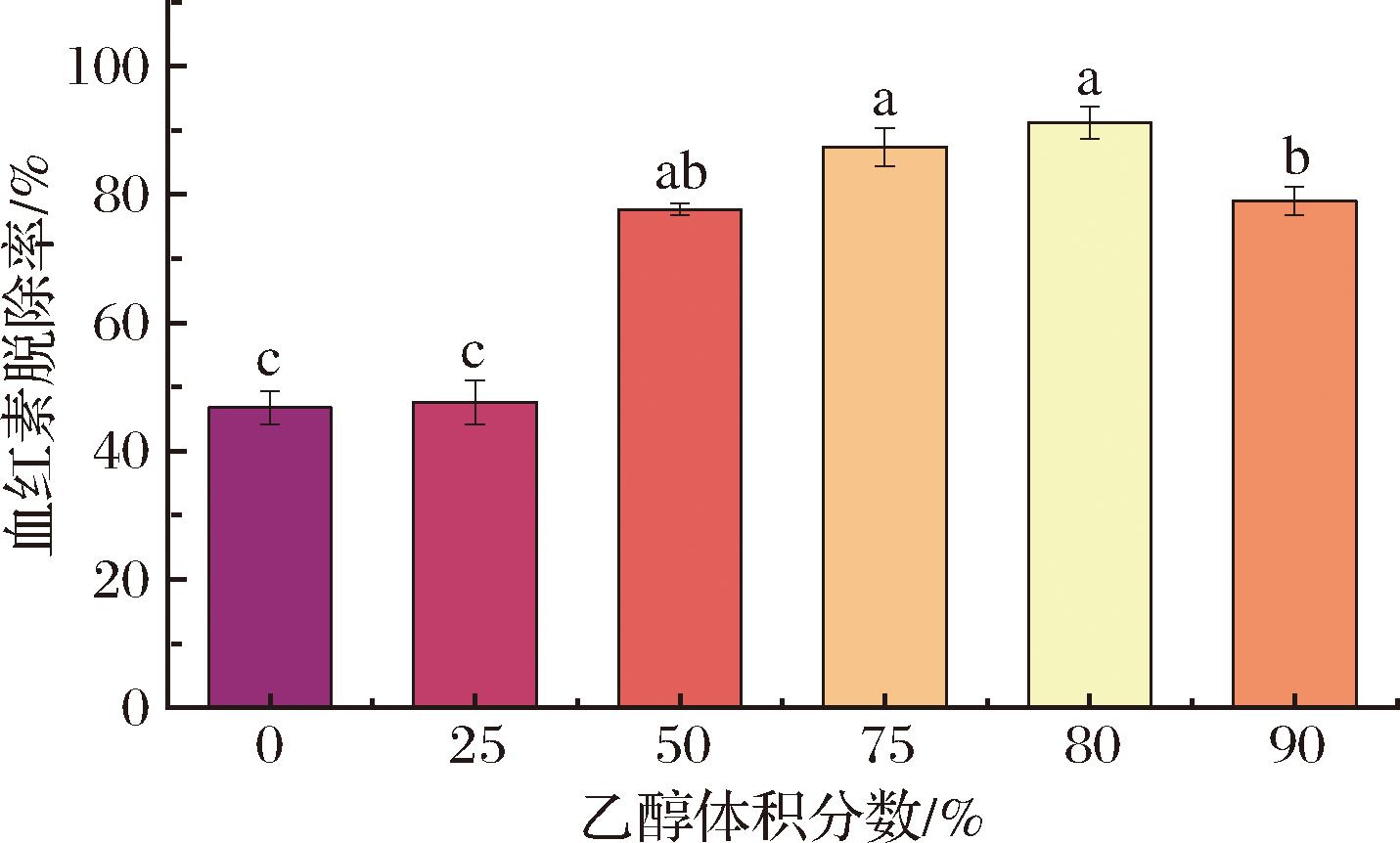
图5 乙醇体积分数为0、25%、50%、75%、80%、90%的脱铁血红蛋白血红素脱除率
Fig.5 The heme removal rate of ApoHb with ethanol concentrations of 0%, 25%, 50%, 75%, 80%, and 90%
注:不同字母表示不同组别间存在差异(P<0.05)。
2.2 脱铁血红蛋白结构分析
2.2.1 蛋白分子质量分析
通过SDS-PAGE凝胶电泳检测ApoHb样品中的分子质量。在SDS作用下蛋白去折叠变性展开,变为α-蛋白链和β-蛋白链。变性蛋白质被SDS包裹并带上负电荷,向阳极移动。如图6所示,随着电泳的进行,电泳条带逐渐集中到15 kDa和30 kDa左右,推测接近30 kDa的电泳条带为αβ二聚体,接近15 kDa的电泳条带为单体α亚基或者β亚基。ApoHb的αβ二聚体理论分子质量约为30 kDa,接近30 kDa的电泳条带可能归因于Hb在酸性条件下连续洗脱发生变性,受分子内静电斥力作用蛋白质分子结构伸展,更倾向于形成αβ二聚体,四聚体Hb去卷积形成αβ二聚体。而α或者β亚基的理论质量约为15 kDa,推测接近15 kDa的电泳条带来自蛋白质变性解离形成的单体α亚基或者β亚基。在先前使用切向流过滤技术制备ApoHb的研究中[11],在电喷雾离子化质谱分析中酸性条件下Hb和ApoHb表现出相同的质谱,都检测到了单体组分,本实验乙醇体积分数为0%、25%、50%、75%、80%、90%的ApoHb电泳同样检测到单体组分,且未检测到四聚体,由此可知是酸性条件使蛋白质四聚体发生解聚,产生二聚体和单体[18],血红素随之被释放至溶液中,而组成四聚体Hb的4条多肽链间由二硫键相连接,因蛋白质变性结构改变而发生的二硫键断裂无法自发再形成,故酸性条件下Hb和ApoHb溶液中均未检测到四聚体。通过图像处理软件Image J进行强度分析,测得乙醇体积分数80%的ApoHb蛋白纯度约为68%,说明透析得到的ApoHb大部分的蛋白亚基与原血红蛋白相比并未发生显著变化。
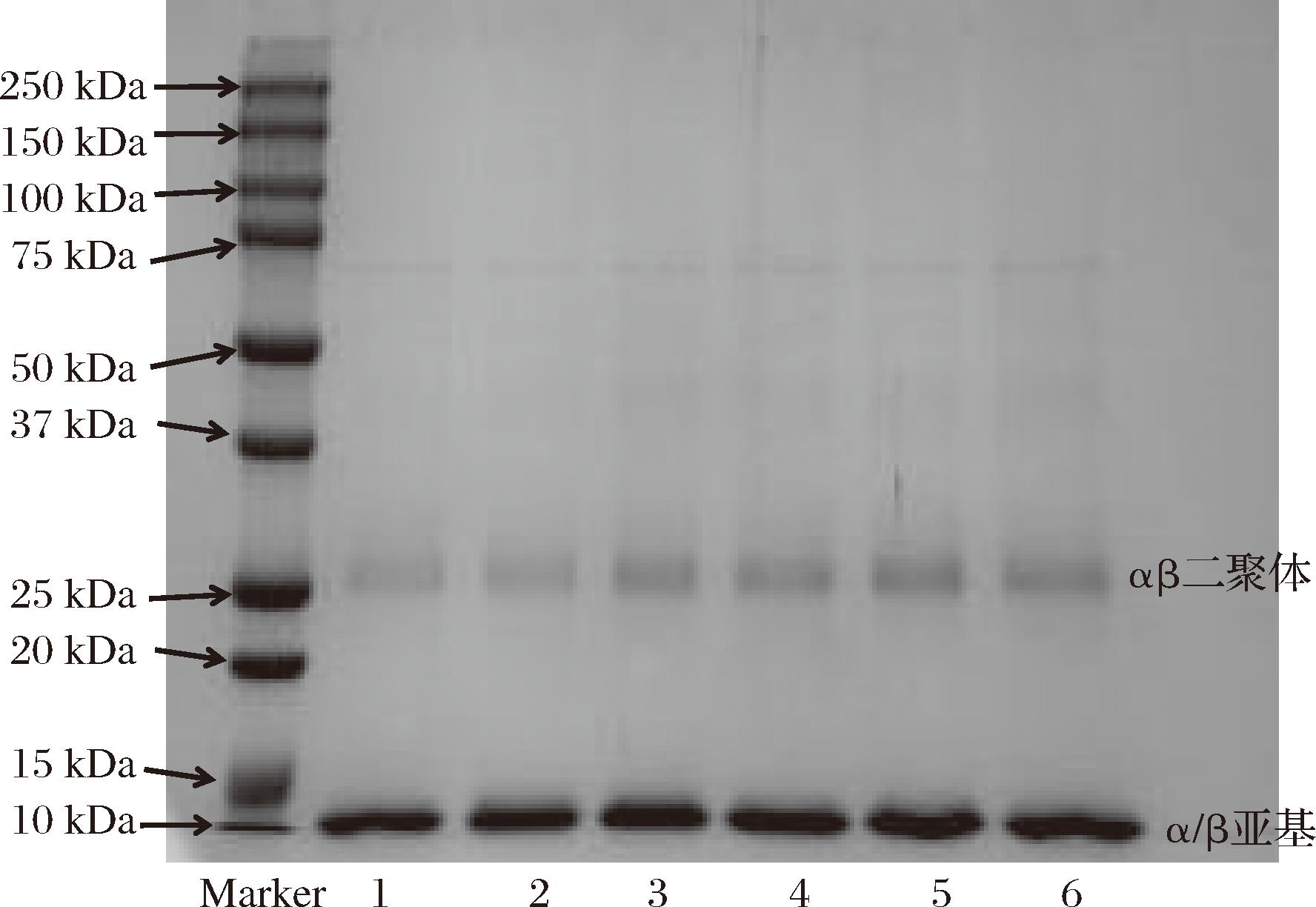
1-6泳道-分别对应乙醇体积分数为0、25%、50%、75%、80%、90%的脱铁血红蛋白; Marker-蛋白标准品
图6 SDS-PAGE 凝胶电泳结果
Fig.6 SDS-PAGE results
2.2.2 蛋白质二级结构分析
根据ApoHb的圆二色性分析其二级结构。圆二色性常用椭圆度来表示,它是平面偏振光离开样品池的角度。蛋白质分子的不对称性及其结构的不同可由圆二色性的差异表现,故可通过测椭圆度来得到蛋白质的结构信息。不同体积分数乙醇透析得到的ApoHb,摩尔椭圆率有明显变化。如图7所示,在波长200~260 nm内所有蛋白样品均在208 nm以及222 nm处都出现明显负吸收峰值,此处峰值为 α-螺旋结构的吸收峰。图8体现了不同乙醇体积分数ApoHb溶液的各种二级结构占比,与Hb相比,不同乙醇体积分数的脱铁血红蛋白无规卷曲和β-转角的二级结构比例无显著性差异(P>0.05),α-螺旋和β-折叠的二级结构比例有显著性差异(P<0.05),不同乙醇体积分数的脱铁血红蛋白之间二级结构比例变化无显著性差异(P>0.05)。在蛋白脱去血红素的过程中,螺旋、转角和无规卷曲结构含量降低,折叠结构含量升高。血红素通过改变α-螺旋和β-折叠结构影响珠蛋白的构象[5],然而在不同乙醇体积分数下ApoHb样品的二级结构占比近似相同,故推测乙醇体积分数对其二级结构的影响极小。对比Hb和乙醇体积分数0%的ApoHb样品,后者在无乙醇作用下血红素脱除率低,但依旧体现出与其他组别近似的二级结构占比(螺旋、转角和无规卷曲结构含量降低,折叠结构含量升高),由此推测是在酸性条件下的连续洗脱导致蛋白质的变性,肽链部分展开,蛋白质的结构变得松散,引起的二级结构转变。
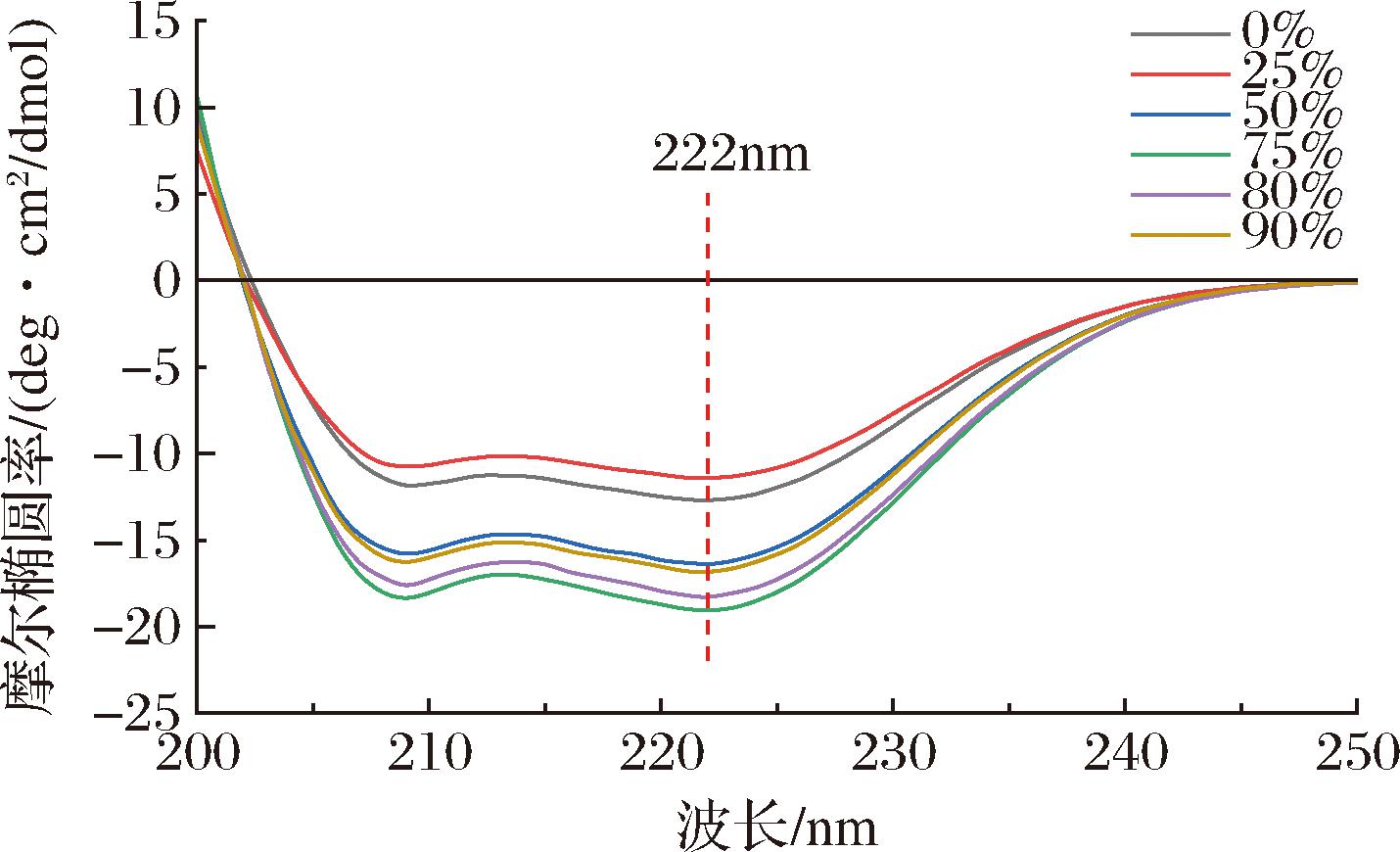
图7 乙醇体积分数为0、25%、50%、75%、80%、90%的脱铁血红蛋白样品远紫外圆二色光谱图
Fig.7 Far-UV circular dichroism of ApoHb with ethanol concentrations of 0%, 25%, 50%, 75%, 80%, and 90%
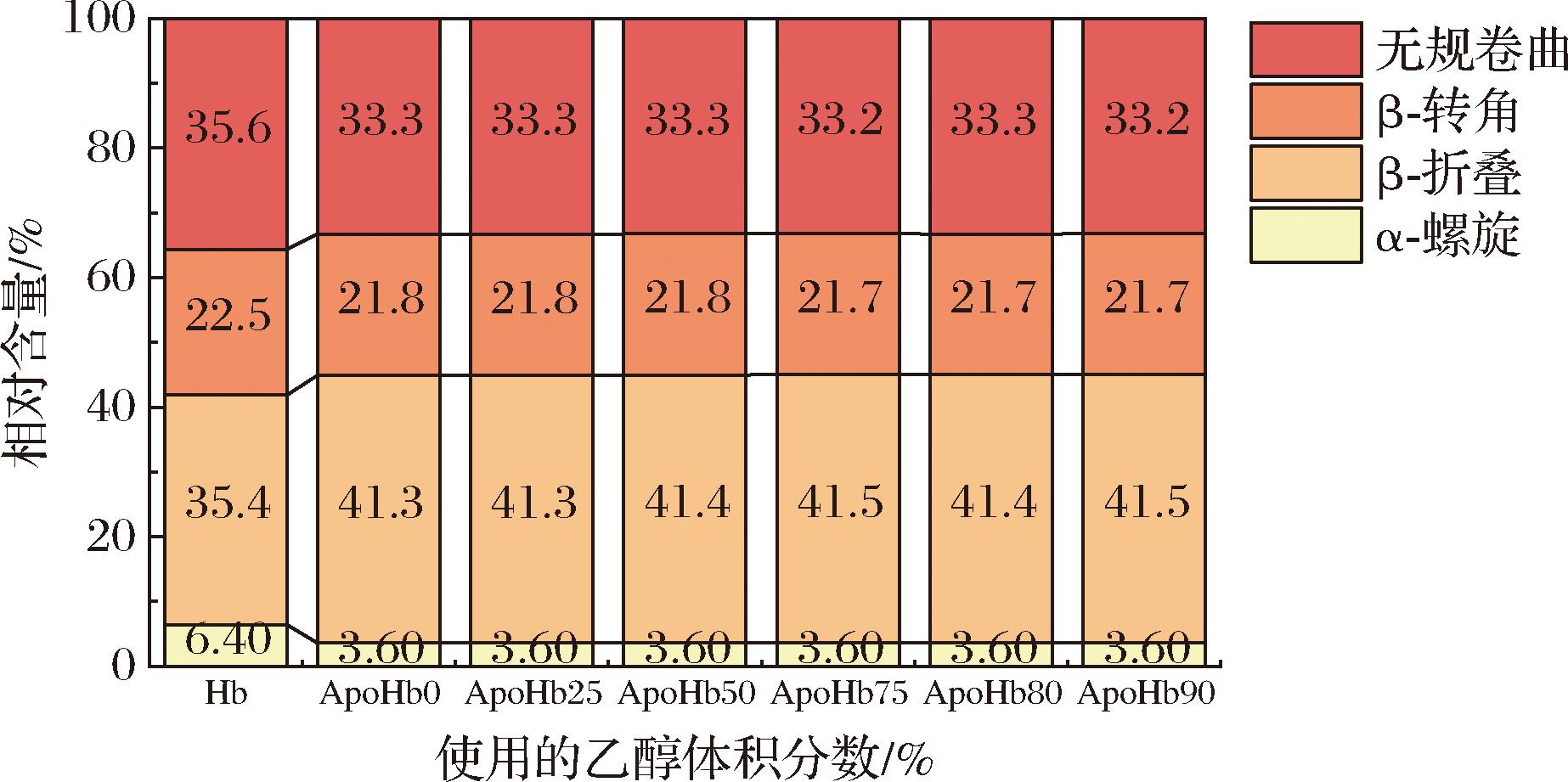
图8 乙醇体积分数为0、25%、50%、75%、80%、90%的脱铁血红蛋白样品的二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)比例示意图
Fig.8 The proportions of secondary structure elements(α-helix、β-sheet、β-turn and random coli) in ApoHb with ethanol concentrations of 0%, 25%, 50%, 75%, 80%, and 90%
2.3 脱铁血红蛋白的负载特性验证
2.3.1 血红素重组结果分析
由rHb 的重组率来检验 ApoHb 的活性,将 80% 乙醇体积分数的 ApoHb 溶液取样稀释后滴加血红素,制备 rHb 并测定其吸光度,代入血红素标准曲线y=0.058 1x+0.046 4计算得重组率为 38.67%。从热力学角度而言,血红素与珠蛋白相互作用的热力学函数 ΔG<0,反应自发进行,且结合的主要作用力是疏水相互作用[5]。首先,在酸性条件下连续洗脱过程中Hb 中 β-链的甲硫氨酸残基氧化生成甲硫氨酸亚砜[19]。甲硫氨酸是含有特异性甲硫键的氨基酸,甲硫键疏水性极强,氧化后蛋白构象发生变化,氧化生成的甲硫氨酸亚砜具有较高的亲水性,因此,蛋白分子内疏水相互作用减弱,血红素与ApoHb的空腔亲和力降低,从而降低了重组率。另外,蛋白质三维结构的稳定性依赖于蛋白质内部非极性氨基酸残基之间的疏水相互作用,在将 ApoHb 溶液稀释时蛋白重新折叠,因氨基酸残基发生氧化修饰导致部分变性蛋白可能错误折叠,无法恢复具有正常稳定性的构象,因此也无法与血红素重新结合[20]。不仅如此,在透析过程中,可能仍有未被脱除的血红素存在于溶液中,游离的血红素和珠蛋白与血红素-珠蛋白复合物间形成动态平衡[8, 11]。在蛋白重新折叠的过程中,部分非特异性结合的血红素可能与珠蛋白 α 亚基或 β 亚基错误结合,形成半色素或者其他类型复合物,它们暴露出更多蛋白质疏水区域,结合了更多血红素分子[21],影响珠蛋白与血红素的正常结合,无法形成具有理想活性的 rHb。但从二级结构的角度而言,血红素通过改变 α-螺旋和 β-折叠结构影响珠蛋白的构象,使珠蛋白肽链发生收缩,疏水性提高[22],重新加入血红素的过程使珠蛋白构象向着有利于收缩且疏水性提高的方向发展,即α-螺旋含量升高,β-折叠含量降低[5],这一变化使重组率提高。并且,本方法在血红素与珠蛋白重新结合反应结束后,回调pH降低溶液碱性,有助于rHb的稳定性[23],提高重组率。
2.3.2 脱铁血红蛋白-姜黄素复合物稳定性分析
将Hb加入酸性乙醇制备ApoHb过程中,蛋白质结构伸展,在血红素脱除后,恢复溶液至中性pH,珠蛋白结构恢复,疏水的血红素结合口袋暴露,可以负载功能性小分子。姜黄素是一种具有良好健康效应的活性小分子,具有治疗疾病与保护代谢等多种药理作用,但姜黄素难溶于水且稳定性差,大大降低了它的生物利用度[24]。通过构建脱铁血红蛋白-姜黄素(ApoHb-Cur)复合物,不仅可以探究ApoHb的运载特性,还可以提高姜黄素的生物利用度。将姜黄素溶解于无水乙醇后滴加到蛋白溶液中,避光反应后测定ApoHb-Cur复合物溶液在425 nm下的吸光值,根据姜黄素标准曲线y=0.156 2x-0.013计算得在乙醇体积分数80%的ApoHb中姜黄素的负载率为55.58%。血红素通过改变α-螺旋和β-折叠结构影响珠蛋白的构象,使珠蛋白肽链发生收缩,疏水性提高[22],但对脱铁血红蛋白二级结构分析时发现脱铁血红蛋白的α-螺旋含量降低,β-折叠含量升高,因此脱铁血红蛋白肽链的收缩能力下降,疏水性也降低。另外,重新折叠形成结合口袋的珠蛋白因内部非极性氨基酸残基发生氧化修饰,导致疏水相互作用减弱。姜黄素与珠蛋白之间的作用力主要是疏水相互作用,因此二级结构的变化和氧化修饰的发生不利于负载。此外,乙醇体积分数80%的ApoHb血红素脱除率高但未全部脱除,部分与血红素发生不可逆交联的珠蛋白无法再负载姜黄素。但是,在包埋反应后调节pH至中性,在中性pH下净静电推斥能量小于其他相互作用的能量,且pH接近蛋白质等电点,蛋白质较稳定,所形成的ApoHb-Cur复合物稳定性较好,有助于保证一定的负载率。
将ApoHb-Cur复合物样品分为6组,分别贮存在4 ℃、常温和37 ℃的避光和不避光条件下,6组ApoHb-Cur复合物样品保留率如图9所示,贮藏于37 ℃不避光条件下样品的保留率随时间延长显著下降(P<0.05),贮藏于37 ℃避光条件下样品的保留率在3~4、4~5周的变化差异不具有统计学意义(P>0.05),其余则显著下降(P<0.05);贮藏于常温不避光条件下样品的保留率在4~5周的变化差异不具有统计学意义(P>0.05),其余则显著下降(P<0.05);贮藏于常温避光条件下样品的保留率在4~5、5~6周的变化差异不具有统计学意义(P>0.05),其余则显著下降(P<0.05);贮藏于4 ℃不避光条件下样品的保留率在3~4、5~6周的变化差异不具有统计学意义(P>0.05),其余则显著下降(P<0.05);贮藏于4 ℃避光条件下样品的保留率在2~3、5~6、6~7周的变化差异不具有统计学意义(P>0.05),其余则显著下降(P<0.05)。21 d内,6组不同贮藏条件下的ApoHb-Cur复合物保留率均下降。在同样的光照环境中,温度为4 ℃时复合物的保留率最高,温度为37 ℃时复合物的保留率最低,并且在低温条件下保留率的下降幅度更小。贮藏于4 ℃环境中,避光与否对样品稳定性影响不显著,贮藏于常温和37 ℃环境中,避光贮藏的样品保留率普遍高于非避光贮藏样品。综上所述,低温且避光的环境有利于复合物的贮藏。
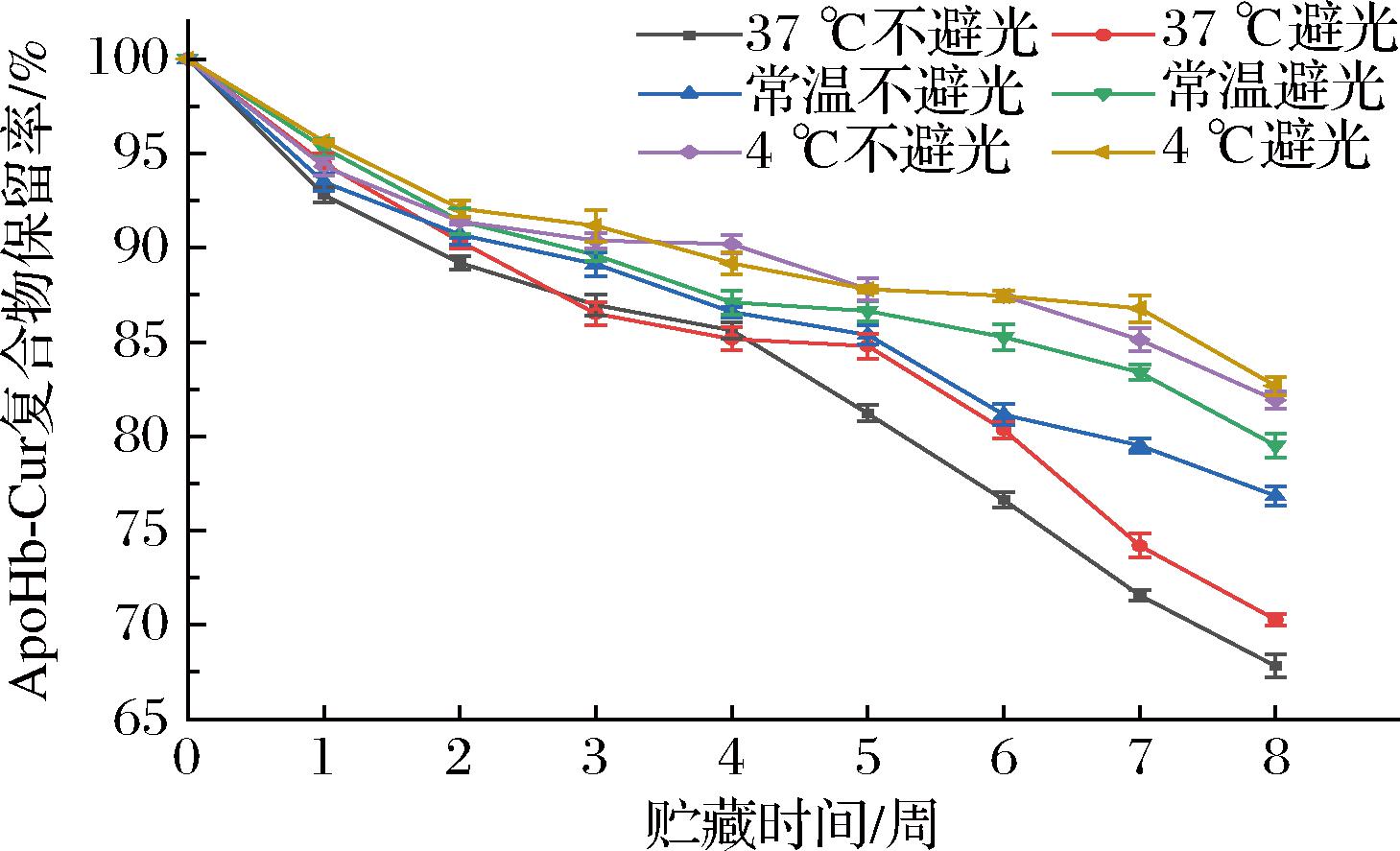
图9 乙醇体积分数为80%脱铁血红蛋白制备的姜黄素复合物在4 ℃、常温和37 ℃的避光和不避光条件下贮藏8周的保留率变化
Fig.9 Changes in retention rate of the ApoHb-Cur prepared with ApoHb with ethanol concentrations of 80% stored at 4 ℃, room temperature and 37 ℃ under light and non-light conditions for 8 weeks
温度较高或处于不避光条件下,ApoHb-Cur复合物样品的稳定性降低,蛋白结构松散,与姜黄素结合变弱,导致负载的姜黄素逸出。另外,溶液中可能存在游离姜黄素和珠蛋白与ApoHb-Cur复合物的动态平衡,随着时间延长以及受温度影响,游离的ApoHb可能会形成聚集体,使平衡偏移产生更多游离姜黄素,导致保留率降低。贮藏于4 ℃环境中,复合物受光照因素影响较弱,ApoHb聚集体形成的可能性较低,保留率较高,而在温度较高或者不避光的环境下,游离的ApoHb更易聚集,因此其保留率也更低[25]。
3 结论
研究结果表明,利用乙醇洗脱法,当乙醇体积分数为80%时血红素的脱除率达91.21%,效果最佳。通过SDS-PAGE凝胶电泳检测ApoHb样品中的分子质量可知,酸性条件使四聚体Hb发生解离,产生α-β二聚体和α、β单体,血红素随之被释放到溶液中。根据ApoHb的圆二色性分析其二级构象变化发现,Hb在酸性条件下连续洗脱后,蛋白质分子中的肽链部分展开,二级结构从α-螺旋、β-转角和无规卷曲向β-折叠转变。另外,所得ApoHb经重新添加血红素制备rHb,其重组率约38.67%,负载活性保持良好。在ApoHb-Cur复合物贮藏实验中,乙醇体积分数为80%时ApoHb的姜黄素负载率为55.58%,验证了ApoHb具有优良的负载小分子功能因子的能力,且低温避光条件更有利于复合物贮藏,证实ApoHb在特医食品和医药领域具有良好的运载应用潜力。本研究建立了乙醇洗脱法制备脱铁血红蛋白的合理性策略,相关结果可为禽畜血液副产物资源高值化利用提供理论依据。
[1] 张露娟. 畜禽血液在食品工业中的应用[J].农产品加工, 2019(10):58-62.
ZHANG L J.The application of livestock and poultry blood in food industry[J].Farm Products Processing, 2019.
[2] 李菂, 韩樾夏, 杨芳.血红蛋白氧载体的研究与应用进展[J].中国材料进展, 2022, 41(5):338-344.
LI D, HAN Y X, YANG F.Research and application progress of hemoglobin oxygen carrier[J].Materials China,2022,41 (5):338-344.
[3] 祝超智, 温耀涵, 许龙, 等.牛血红蛋白肽的酶解工艺优化及其亚铁螯合物结构、稳定性研究[J].食品工业科技,2024,45(8):75-87.
ZHU C Z, WEN Y H, XU L, et al.Optimization of enzymatic hydrolysis of bovine hemoglobin peptide and study on structure and stability of ferrous chelate[J].Science and Technology of Food Industry,2024,45(8):75-87.
[4] 马晓庆, 刘洋, 孙杨赢, 等.磷酸化亚硝基猪血红蛋白代替亚硝酸盐部分作用及其对乳化肠品质的影响[J].食品科学, 2022, 43(4):46-52.
MA X Q, LIU Y, SUN Y Y, et al.Effect of phosphorylated nitroso porcine hemoglobin as partial nitrite substitute on the quality of emulsified sausage[J].Food Science, 2022, 43(4):46-52.
[5] 朱宏星, 王道营, 徐为民, 等.肌红蛋白血红素辅基与珠蛋白相互作用机制[J].肉类研究, 2020, 34(07):7-12.
ZHU H X, WANG D Y, XU W M, et al.Mechanism of interaction between heme prosthetic group of myoglobin and globin[J].Meat Research, 2020, 34(7):7-12.
[6] 徐逸婷. 基于蛋白质载体的高效诊断与治疗体系的构建及应用[D]. 长沙: 湖南大学, 2021.
XU Y T. Construction and application of efficient diagnosis and treatment system based on protein vector[D]. Changsha: Hunan University, 2021.
[7] TOLDR F, REIG M, MORA L.Management of meat by- and co-products for an improved meat processing sustainability [J].Meat Science, 2021, 181(2):108608.
F, REIG M, MORA L.Management of meat by- and co-products for an improved meat processing sustainability [J].Meat Science, 2021, 181(2):108608.
[8] 吴素娟, 刘战民, 王兆明, 等.食品加工对血红蛋白结构和功能特性影响的研究进展[J].食品科学, 2021, 42(21):256-262.
WU S J, LIU Z M, WANG Z M, et al.Recent progress on understanding the effect of food processing on structural and functional properties of hemoglobin[J].Food Science, 2021, 42(21):256-262.
[9] FANELLI A R, ANTONINI E, CAPUTO A.Studies on the structure of hemoglobin I.Physicochemical properties of human globin[J].Biochimica et Biophysica Acta, 1958, 30(3):608-615.
[10] TEALE F W.Cleavage of the haem-protein link by acid methylethylketone[J].Biochimica et Biophysica Acta, 1959, 35:543-543.
[11] PIRES I S, BELCHER D A, HICKEY R, et al.Novel manufacturing method for producing apohemoglobin and its biophysical properties[J].Biotechnology and Bioengineering, 2020,117(1):125-145.
[12] 刘广文, 王立学.食用酒精产业发展简要分析[J].食品安全导刊, 2022(9):164-166.
LIU G W, WANG L X.Brief analysis of the development of edible alcohol industry[J].China Food Safety Magazine, 2022(9):164-166.
[13] WANG Y, CHEN X, ZHOU P, et al.Beef tenderization without exacerbating the cooking loss:The way of enzymatic deamidation [J].Food Bioscience, 2024, 58:103806.
[14] MOULTON D P, MCDONALD M J.Kinetics of human apohemoglobin dimer dissociation[J].Biochemical and Biophysical Research Communications, 1994, 199(3):1278-1283.
[15] ASCOLI F, ROSSI FANELLI M R, ANTONINI E.Preparation and properties of apohemoglobin and reconstituted hemoglobins[J].Methods in Enzymology, 1981, 76:72-87.
[16] BOYS B L, KONERMANN L.Folding and assembly of hemoglobin monitored by electrospray mass spectrometry using an on-line dialysis system[J].Journal of the American Society for Mass Spectrometry, 2007, 18(1):8-16.
[17] VALLELIAN F, PIMENOVA T, PEREIRA C P, et al.The reaction of hydrogen peroxide with hemoglobin induces extensive α-globin crosslinking and impairs the interaction of hemoglobin with endogenous scavenger pathways[J].Free Radical Biology &Medicine, 2008, 45(8):1150-1158.
[18] KONERMANN L.Addressing a common misconception:Ammonium acetate as neutral pH “Buffer” for native electrospray mass spectrometry[J].Journal of the American Society for Mass Spectrometry, 2017, 28(9):1827-1835.
[19] BUEHLER P W, VALLELIAN F, MIKOLAJCZYK M G, et al.Structural stabilization in tetrameric or polymeric hemoglobin determines its interaction with endogenous antioxidant scavenger pathways[J].Antioxidants &Redox Signaling, 2008, 10(8):1449-1462.
[20] NAGAI M, NAGAI Y, AKI Y, et al.Effect of reversed heme orientation on circular dichroism and cooperative oxygen binding of human adult hemoglobin[J].Biochemistry, 2008, 47(2):517-525.
[21] ROSS W F, TURNER R B.The heme-globin linkage of hemoglobin[J].Journal of Biological Chemistry, 1941, 139(2):603-610.
[22] 王晓霞, 聂智华, 马力通, 等.多光谱法和分子对接模拟法研究美满霉素与牛血清白蛋白的相互作用[J].光谱学与光谱分析, 2020, 40(5):1503-1508.
WANG X X, NIE Z H, MA L T, et al.Study on the interaction between minocycline and bovine serum albumin by multi spectral method and molecular docking simulation[J].Spectroscopy and Spectral Analysis, 2020, 40(5):1503-1508.
[23] 吴宇森. pH诱导蛋白质组装包埋姜黄素的研究[D]. 广州: 华南理工大学, 2022.
WU Y S. Study on pH-induced protein assembly and embedding curcumin[D]. Guangzhou: South China University of Technology, 2022.
[24] 郭玉, 任迪峰, 郭子烟, 等. 姜黄素增溶技术研究进展[J]. 食品与发酵工业, 2024, 50(14):342-348.
GUO Y, REN D F, GUO Z Y, et al. Research progress on technology to improve solubility of curcumin[J]. Food and Fermentation Industries, 2024, 50(14):342-348.
[25] ROGARD M, WAKS M. Studies on hemoglobin Tryptophany1 contact residues in the haptoglobin·hemoglobin complex[J]. European Journal of Biochemistry, 1977, 77(2):367-373.