益生菌是一类有益健康的微生物,当摄入足够量的活菌时,能够明显改善人体健康[1]。益生菌的益生功能包括降低胆固醇、增强免疫力、维持肠道菌群的平衡等[2-4],有研究表明,益生菌能发挥作用的建议摄入量在106 CFU/g以上[5]。植物乳杆菌是其中一种常见的益生菌[6]。由于益生菌活菌在人体肠道内定殖后才能发挥益生作用,而受到高温、高压、胃肠道等环境的影响后极易使其变性失活[7],因此提高产品中益生菌的存活率,以及保证益生菌安全通过消化道变得尤其重要。包埋是保护益生菌常用的方法,目前大多是以多糖、蛋白质为壁材,通过将作为芯材的益生菌包埋从而有效抵抗各种不良环境带来的影响[8]。
多糖和蛋白质可以水凝胶的形式将益生菌包埋,水凝胶是一种结构稳定的三维网络亲水性物质,具备良好的生物相容性和生物可降解性,近年来得到了广泛的运用[9]。常见的多糖水凝胶如海藻酸钠(sodium alginate,SA),能够在Ca2+的诱导下迅速成胶[10],近几十年来一直是热门的包埋壁材材料,但是单一的海藻酸钠凝胶有着稳定性较差、益生菌包埋死亡率高以及不耐胃液消化等缺点,因此应用受限。研究者尝试将海藻酸钠与其他物质进行复合,从而增强凝胶的性质[11],但在益生菌包埋和保护方面仍存在不足。
猪血浆蛋白(porcine plasma protein,PPP)是一种优质的动物蛋白,具有来源广、价格低、安全无毒、营养丰富等特点。前期研究表明,PPP可在葡萄糖酸-δ-内酯(glucono-δ-lactone,GDL)和微生物转谷氨酰胺酶(microbial transglutaminase,MTGase)的作用下形成质构良好的冷凝胶[12-13],并可高效包埋和保护疏水性生物活性小分子物质[14],但该产品造型困难,且单一蛋白凝胶也存在局限性。本文将PPP和SA复合,充分结合PPP凝胶保护能力强和SA凝胶可调控性高的优点制备出一种新型的复合冷凝胶珠,同时以植物乳杆菌为模型,探究PPP-SA复合凝胶珠对植物乳杆菌的包埋和保护效果,为益生菌类产品设计提供数据和思路。
1 材料与方法
1.1 材料与试剂
植物乳杆菌选自实验室保藏;海藻酸钠(食品级),润嘉生物科技有限公司;猪血浆蛋白,襄阳维恩生物科技有限公司;微生物转谷氨酰胺酶,江苏宜明生物有限公司;葡萄糖酸-δ-内酯,宜昌安琪酵母股份有限公司;猪源胃蛋白酶(1∶15 000),上海阿拉丁生化科技有限公司;猪源胰蛋白酶(1∶4 000),上海源叶生化试剂有限公司;胆盐3号,上海国药集团化学试剂有限公司;其余试剂均为分析纯。
1.2 仪器与设备
TGL-18M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;HH-6B数显恒温水浴锅,常州国华仪器制造有限公司;TA-XT plus质地分析仪,英国Stable Micro System公司;SCIENTZ-10 ND冷冻干燥机,宁波新芝生物科技股份有限公司;LDZX-50 FBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;DNP-9052电热恒温培养箱,上海精宏实验设备有限公司;JSM6390LV扫描电子显微镜,日本电子JEOL株式会社;FA-25D高速剪切分散乳化机,上海弗鲁克流体机械制造有限公司。
1.3 实验方法
1.3.1 植物乳杆菌的培养
将冷冻的植物乳杆菌株接种到MRS液体培养基中,在37 ℃条件下进行二次活化,活化时间均为24 h。取培养液离心15 min(4 ℃和5 770×g),弃上清液,保留菌泥沉淀物,并用8.5 g/L的无菌生理盐水洗涤2次,重悬于2 mL无菌生理盐水中,用菌落计数法对菌悬液进行活细胞计数,此时菌悬液中的密度约为109~1010 CFU/mL。
1.3.2 复合凝胶珠的制备
将PPP完全溶解在超纯水(UP水)中,得到100 g/L的溶液,然后在5 770×g和4 ℃下离心10 min,再用截留分子质量为7 kDa的透析袋在4 ℃条件下透析上清液。最后,将透析后的PPP 溶液冷冻干燥,在4 ℃下密封保存。
将冻干的PPP粉末溶解在UP水中,用1.0 mol/L HCl将pH值调至6.5,然后在85 ℃的水浴锅中加热15 min,加热结束后立即在冰水浴中冷却至室温,PPP质量浓度为50 g/L,备用。
根据实验设计,分别将0.2%(体积分数)现配的MTGase溶液(100 g/L)、0.3% GDL(固体试剂)、SA(固体粉末)以及2%(体积分数)的菌悬液加入到PPP溶液中,常温下混合搅拌均匀。用无菌注射器吸取混合溶液,逐滴加入到5 g/L的CaCl2溶液中,固化时间为30 min,再用无菌UP水清洗凝胶珠2次,将多余的Ca2+除去,最后放置在超净台中过夜,使其中的蛋白成胶。对照样品为SA凝胶珠(诱导剂为Ca2+)和PPP凝胶(诱导剂为GDL和MTGase)。
1.3.3 质构分析和持水力的测定
使用带有P/0.5 R圆柱形探头的TA-XT plus分析仪测量凝胶珠的机械性能。使用空白一次性培养皿和1 000 g砝码进行高度和重量校准。采用两次压缩模式测定凝胶珠的硬度和回弹性,压缩率为75%,使用自动触发器,触发力为5 g,测试前后的速度均为1.0 mm/s,测试速度为0.1 mm/s[15]。
根据参考文献中所述的离心方法并稍加修改后对凝胶的持水力(water holding capacity,WHC)进行测定。称取定量的凝胶珠在9 020×g下离心15 min,去除水分,将离心后与离心前的凝胶珠质量之比记录为WHC[13]。
1.3.4 包埋率测定
包埋率根据参考文献[16]测的方法定,称取1 g凝胶珠与9 mL PBS(pH 7.2)混合,在高速剪切分散乳化机中剪切(10 000 r/min,1 min)。最后,将用无菌生理盐水适度稀释后的凝胶悬浮液涂布在MRS固体培养基上,在37 ℃恒温培养箱中培养48 h。对照组是无需添加到凝胶中的等量菌悬液。
1.3.5 微观结构分析
用扫描电子显微镜观察凝胶珠的微观结构。将新鲜凝胶珠放在-80 ℃下预冻12 h后进行冷冻干燥。冻干后的凝胶珠用导电胶固定并喷涂金粉后进行观察。加速电压为20 kV。
1.3.6 溶胀性测定
模拟胃肠消化液按照参考文献[17]中的方法制备,模拟胃液(simulated gastric fluid,SGF,pH 2.0)由8.5 g/L氯化钠和3.0 g/L胃蛋白酶组成,模拟肠液(simulated intestinal fluid,SIF,pH 7.5)由8.5 g/L氯化钠、1 g/L胰蛋白酶和 4.5 g/L 胆盐组成。测定溶胀性[18]是将新鲜的凝胶珠分别浸泡在室温下不含胃蛋白酶的SGF和不含胰蛋白酶的SIF中120 min,然后取出并用滤纸轻轻擦拭表面,凝胶珠溶胀后变化的质量与溶胀前的质量之比记为溶胀率。
1.3.7 模拟消化和贮藏稳定性
按照1.8中的方法制备SGF和SIF,本实验需要胃蛋白酶和胰蛋白酶[17]。SGF和SIF使用微孔尺寸为0.22 μm的滤膜进行灭菌。首先,分别制备无菌SGF和SIF,然后将1 g凝胶珠加入9 mL SGF中,对照组是1 g凝胶珠加入9 mL无菌生理盐水中,在37 ℃和100 r/min的摇床上振荡120 min。消化120 min后离心(5 770×g,5 min),收集沉淀物并与9 mL SIF混合,继续在37 ℃和100 r/min的摇床上振荡120 min,模拟胃肠道消化过程。测定存活细菌的方法与测定包埋率相同,分别对实验组凝胶样品和对照组样品进行计数。
将包埋植物乳杆菌的凝胶珠冷冻干燥,并放置于在4 ℃的冰箱中密封保存60 d,每15 d对植物乳杆菌进行一次活菌计数。
1.4 数据处理及统计分析
所有实验均测定3次,结果表示为“平均值±标准差”。使用SPSS 25的Duncan检验对实验数据进行统计分析,显著性差异定义为P<0.05,用OriginPro 2021软件绘图。
2 结果与分析
2.1 复合凝胶珠的质构和持水力
图1-a和图1-b分别表示的是PPP-SA复合凝胶的硬度、弹性和持水力结果,变量为SA浓度,以SA凝胶和PPP凝胶(质构测定时PPP凝胶切成凝胶珠大小)作为对照。很明显,复合凝胶珠的硬度、弹性和持水力都随着SA浓度的增大而提高,并且均要高于2个对照样品,这说明复合凝胶珠有着更强的网络结构。海藻酸钠与Ca2+结合,发生的是非共价相互作用[19],而猪血浆蛋白主要是由MTGase诱导发生的共价相互作用[20],当二者复合时,凝胶中可能同时存在这2种相互作用,因此复合凝胶在硬度、弹性和持水力方面有了较为显著的提升。
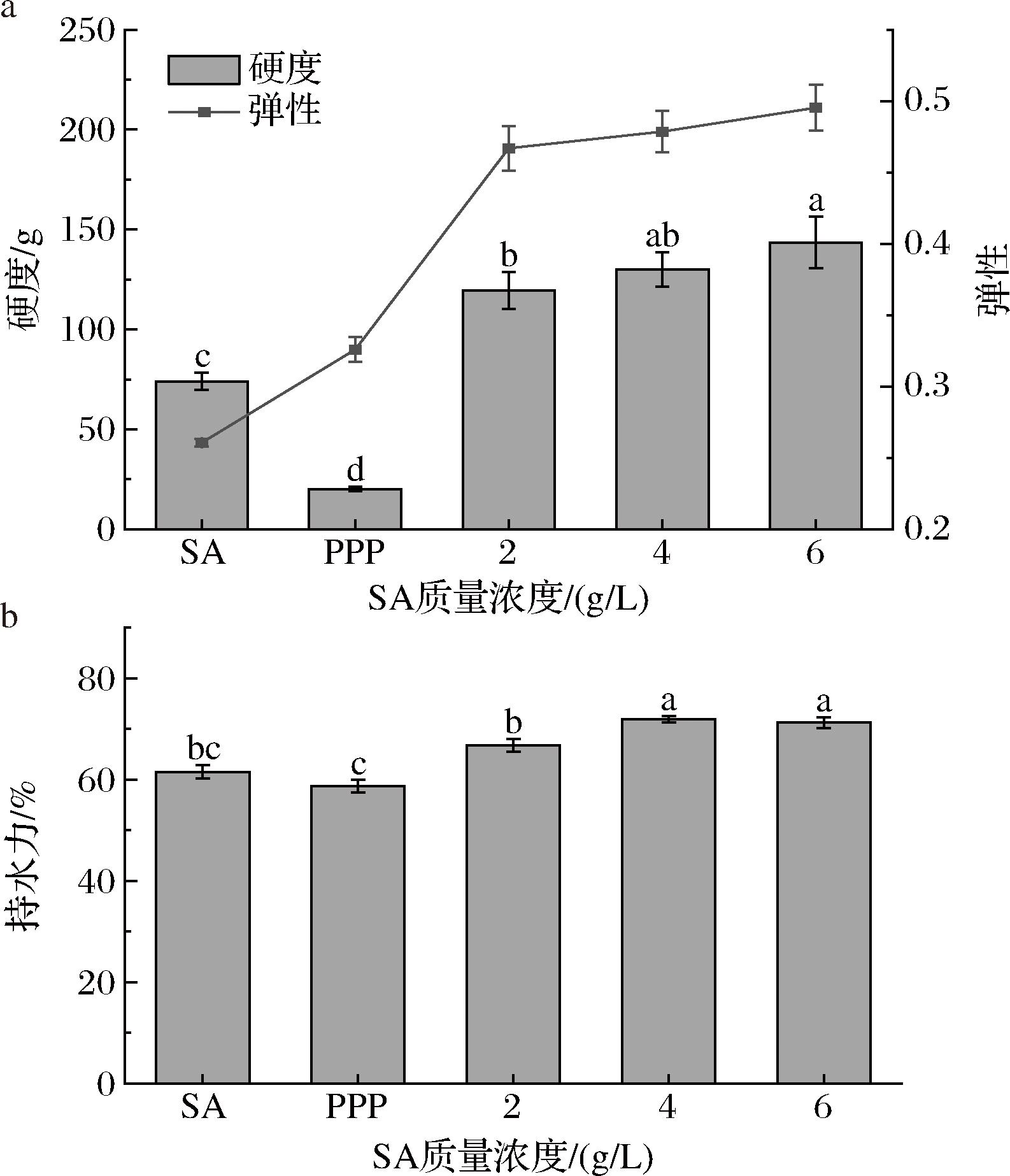
a-凝胶珠的硬度和弹性;b-凝胶珠的持水力
图1 SA 浓度对复合凝胶珠质构及持水力的影响
Fig.1 Effect of sodium alginate concentration on the texture and water holding capacity of composite gel beads
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 复合凝胶珠的包埋率
凝胶包埋植物乳杆菌后得到的包埋率结果如表1所示。SA凝胶的包埋率远低于其他凝胶样品组,仅有76.05%,PPP凝胶的包埋率最高,达到了95.20%,对植物乳杆菌的包埋率显著高于SA凝胶。对于复合凝胶样品,随着SA浓度的增大,包埋率却有所降低,这可能是因为SA的加入使得成胶前的复合凝胶溶液变得稠密,不利于菌悬液的扩散,导致植物乳杆菌未被包埋在凝胶珠中,这与周莉等[21]和徐鹏翔等[22]的研究结果相类似。综合2.1节的结果,当SA质量浓度4 g/L时,复合凝胶珠的质构、持水力和包埋率都处于较高水平,因此后续实验样品使用的是SA浓度为4 g/L的复合凝胶珠。
表1 不同SA浓度对复合凝胶珠包埋率的影响
Table 1 Effect of different SA concentrations on the encapsulation efficiency of composite gel beads

指标SA 4 g/LPPP 50 g/LPPP 50 g/L-SA 2 g/LPPP 50 g/L-SA 4 g/LPPP 50 g/L-SA 6 g/L包埋前活菌数(lg CFU/g)9.42±0.04Aa9.42±0.04Aa9.42±0.04Aa9.42±0.04Aa9.42±0.04Aa包埋后活菌数(lg CFU/g)7.17±0.08Bb8.97±0.01Ba8.94±0.01Ba8.91±0.01Ba8.85±0.01Ba包埋率/%76.05±0.90d95.20±0.14a94.85±0.15ab94.51±0.09b93.95±0.08c
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 复合凝胶珠的结构
图2-a中是复合凝胶珠的宏观图,其形状大多接近规则的球形,主要归功于SA与Ca2+的作用,而且表面光滑,无粘连,比表面积大,拥有更强的环境适应性及控制释放能力。图2-b是SA凝胶珠无孔隙、凹凸不平的表层,它的横切面(图2-c)具备网络状结构,但壁薄且不规则。复合凝胶珠与之相比则有变化,首先表层(图2-d)依旧是一个无孔的密闭结构,却变得更加平整,其次横切面(图2-e)网络中的孔洞壁厚且规则均一,在凝胶强度上明显要高于SA凝胶珠,这对植物乳杆菌的包埋及保护也更有利。图2-f是对复合凝胶珠网络的3 000倍放大图,可看到植物乳杆菌贴在孔壁上,它们呈现杆状的形态,也有不少被包埋在凝胶结构里,证实了凝胶珠对包埋植物乳杆菌的有效性。

a-复合凝胶珠宏观图;b-SA凝胶珠表面图;c-SA凝胶珠横切面图;d-复合凝胶珠表面图;e-复合凝胶珠横切面图;f-复合凝胶珠横切面中的植物乳杆菌图
图2 不同凝胶珠样品的结构图
Fig.2 Structure of different gel bead samples
2.4 复合凝胶珠的溶胀性
如图3-a和图3-b所示,SA凝胶珠在模拟胃肠液(不含蛋白酶)中的溶胀变化最大,在SGF中表现为溶解缩水,SIF中则是膨胀吸水,溶胀率均大于40%,受模拟胃肠液影响很大。PPP凝胶在2种模拟消化液中仅有不到5%的溶胀率,足以证明其稳定性的良好,同时能更少地与外界溶液进行交换,这对于植物乳杆菌来说能够起到很好的保护作用。在复合凝胶珠中,溶胀率位于2个对照组之间,因此可以认为,SA凝胶珠中有了PPP凝胶的加入,在一定程度上减少了复合凝胶珠的溶胀率,使其变得稳定。研究表明,凝胶的溶胀行为也决定其释放性能[23],即溶胀率越高,释放率就越高。而PPP-SA复合凝胶珠在SGF中溶胀率较低,能够保护包埋的植物乳杆菌,到了SIF后溶胀率有所提高,从另一方面来看有利于植物乳杆菌在消化道下端的释放,以便发挥益生作用。
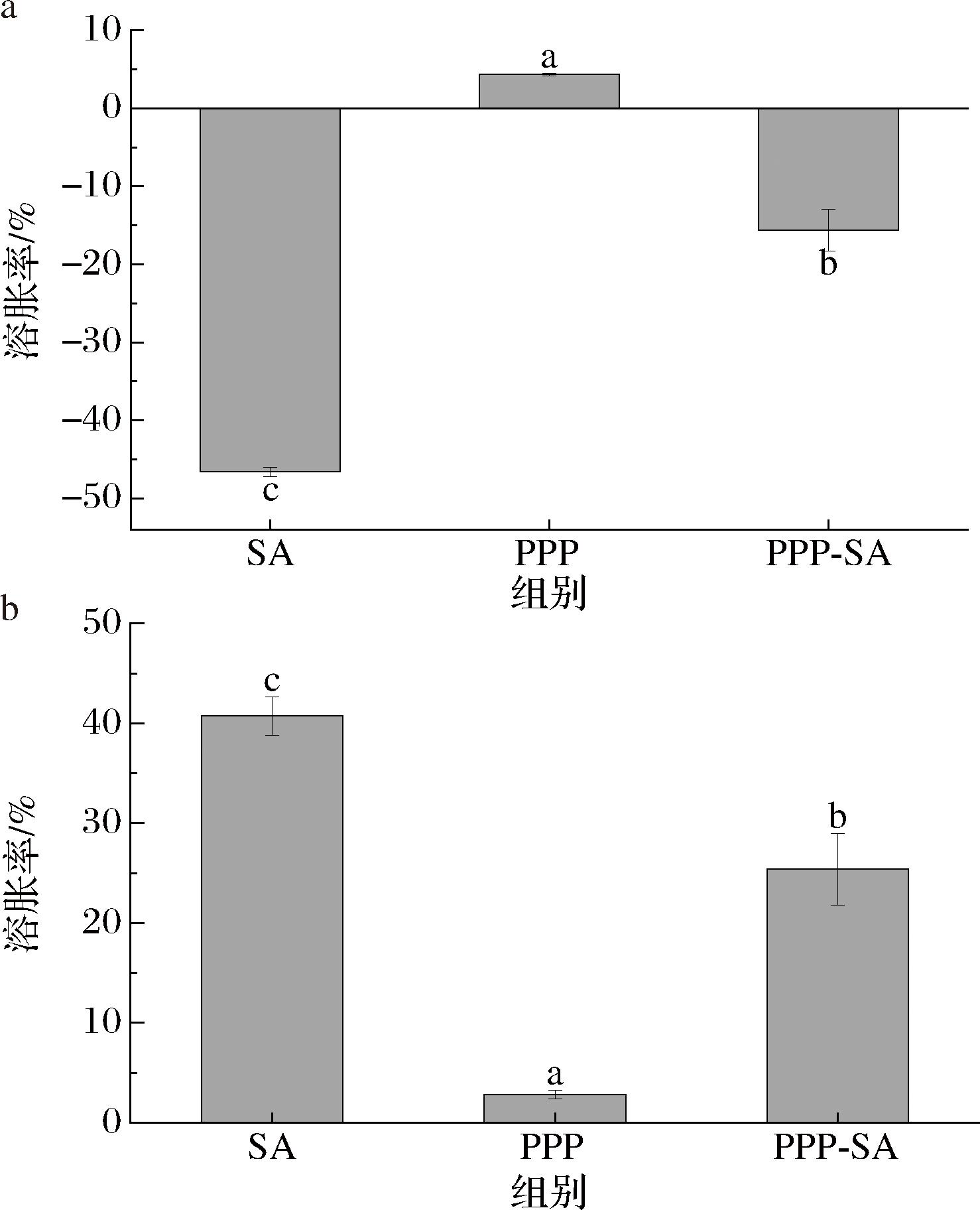
a-不含胃蛋白酶的SGF;b-不含胰蛋白酶的SIF
图3 不同凝胶样品在模拟消化液中的溶胀率
Fig.3 Swelling rates of different gel samples in simulated digestive fluid
2.5 复合凝胶珠的抗消化性
由表2可知,SA凝胶珠在模拟胃肠液消化过程中均无保护作用,在SGF阶段植物乳杆菌就已经全部死亡,可能的原因之一是形成凝胶的浓度不高(SA质量浓度为4 g/L),凝胶强度不高,此外根据SA凝胶珠高溶胀率的结果,可以判断出在SGF消化过程中未能有效阻止外界溶液进出,从而引起植物乳杆菌的全部死亡。另外,PPP凝胶对植物乳杆菌的保护作用就很显著,存活率均高于90%,很大程度上减少了强酸环境、蛋白酶[24]和胆盐[25]的破坏作用,靠的是PPP稳定的凝胶结构。复合凝胶珠中因为有PPP的存在,SGF消化后植物乳杆菌的存活率为90.80%,连续消化后可达89.19%,证明复合凝胶珠对植物乳杆菌的保护能力强(表3),有与之类似效果的是海藻酸钠与乳铁蛋白复合微胶囊[26]和海藻酸钠与乳清蛋白复合微胶囊[21]对益生菌的保护,均优于单一凝胶样品。
表2 不同凝胶样品中植物乳杆菌在SGF消化后的存活率
Table 2 Survival of Lactobacillus plantarum in different gel samples after SGF digestion
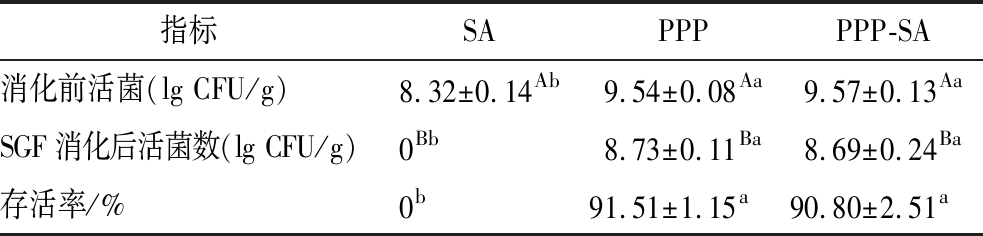
指标SAPPPPPP-SA消化前活菌(lg CFU/g)8.32±0.14Ab9.54±0.08Aa9.57±0.13AaSGF消化后活菌数(lg CFU/g)0Bb8.73±0.11Ba8.69±0.24Ba存活率/%0b91.51±1.15a90.80±2.51a
表3 不同凝胶样品中植物乳杆菌在SGF和
SIF连续消化后的存活率
Table 3 Survival of Lactobacillus plantarum in different gel samples after sequential SGF and SIF digestion
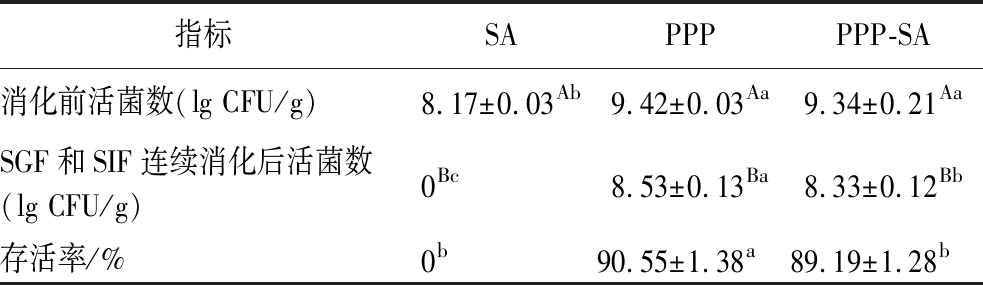
指标SAPPPPPP-SA消化前活菌数(lg CFU/g)8.17±0.03Ab9.42±0.03Aa9.34±0.21AaSGF和SIF连续消化后活菌数(lg CFU/g)0Bc8.53±0.13Ba8.33±0.12Bb存活率/%0b90.55±1.38a89.19±1.28b
2.6 复合凝胶珠的贮藏稳定性
为探究植物乳杆菌复合凝胶珠的贮藏稳定性,把冻干后的样品在4 ℃条件下密封贮藏60 d,依然以PPP凝胶和SA凝胶珠为对照样品。由图4可知,SA凝胶珠中的菌落数显著下降,在贮藏60 d后损失的菌落数达到了3.72 lg CFU/g,与之相比,PPP凝胶中的菌落仅损失1.18 lg CFU/g,复合凝胶珠中菌落损失数为1.09 lg CFU/g。由此可知,PPP凝胶对植物乳杆菌的保护能力要强于SA凝胶珠,复合凝胶珠为最佳。邹强等[27]的实验研究表明,海藻酸钠凝胶的贮藏稳定性低于乳清蛋白凝胶,本实验结果也如此,通过共价相互作用形成的蛋白凝胶的结构和致密性,要强于通过离子相互作用形成的多糖凝胶,能更有效减少外界不良环境带来的影响。在PPP-SA凝胶珠中既存在离子相互作用又存在共价相互作用,因此植物乳杆菌很可能同时被复合体系中的SA凝胶和PPP凝胶包埋,故贮藏稳定性最好,在长时间贮藏中仍旧能保持足够高的活菌数。
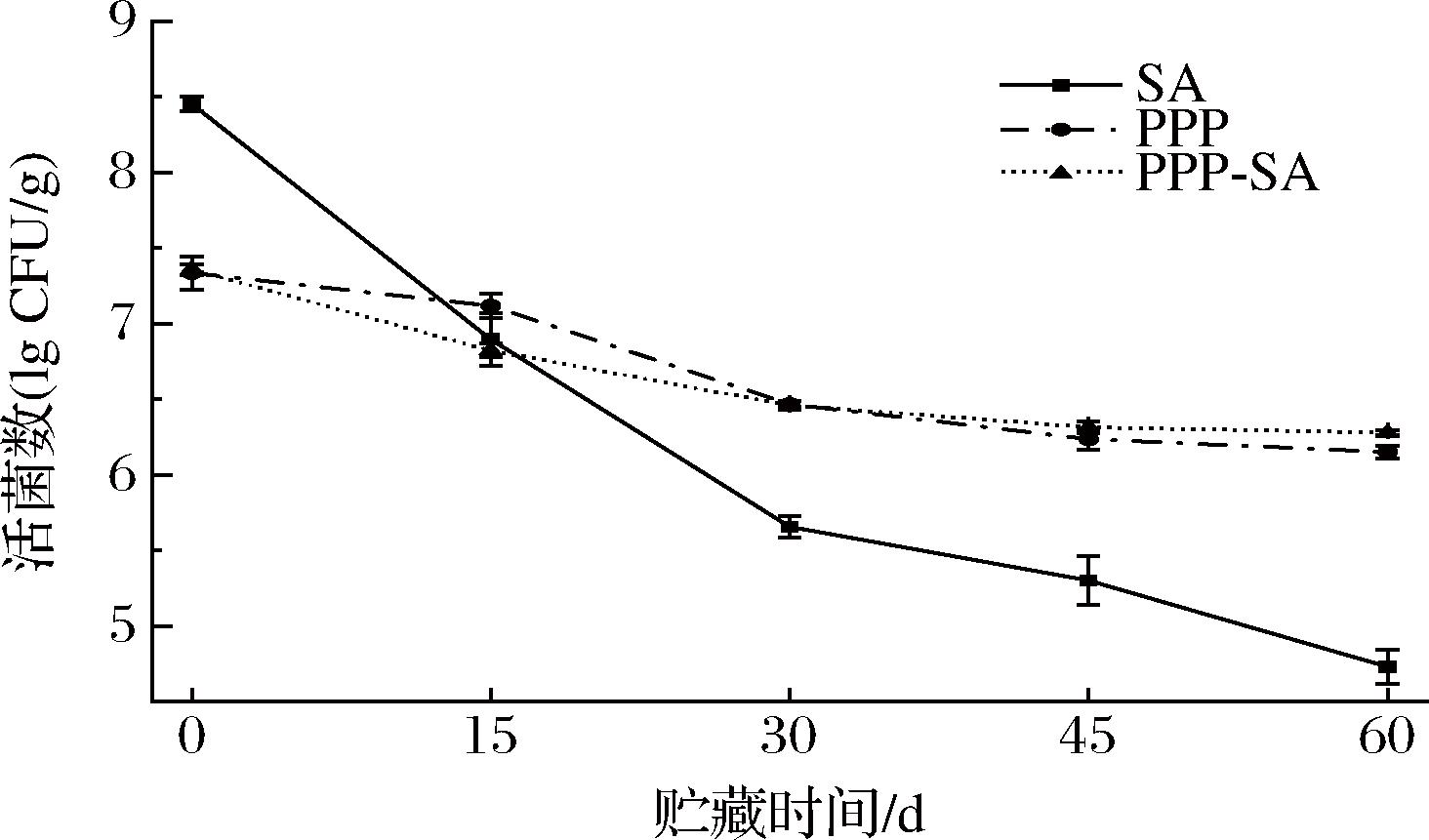
图4 不同凝胶样品的贮藏稳定性
Fig.4 Storage stability of different gel samples
3 结论与讨论
综合以上实验结果,PPP-SA复合凝胶珠可高效包埋植物乳杆菌,包埋率高达94%以上,与此同时,复合凝胶珠自身的硬度、弹性及持水力等性能也高,具备凝胶的优良特性。另一重点是保护能力强,不仅能很大程度地抵抗人体胃肠道中不良环境的影响,而且贮藏时间长,使得植物乳杆菌的存活率得到了极大的提高,最终顺利在人体内发挥作用。因此,该复合凝胶完全可以成为一种新型的载体,用于包埋植物乳杆菌或其他种类的益生菌,拓宽益生菌类产品在功能性食品和生物医药领域上的应用。
[1] FAO/WHO.Guidelines for the evaluation of probiotics in food:Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food[R]. London Ontario, Canada:FAO/WHO, 2002.
[2] CHAUVI RE G, COCONNIER M H, KERNEIS S, et al.Competitive exclusion of diarrheagenic Escherichia coli (ETEC) from human enterocyte-like Caco-2 cells by heat-killed Lactobacillus[J].FEMS Microbiology Letters, 1992, 91(3):213-217.
RE G, COCONNIER M H, KERNEIS S, et al.Competitive exclusion of diarrheagenic Escherichia coli (ETEC) from human enterocyte-like Caco-2 cells by heat-killed Lactobacillus[J].FEMS Microbiology Letters, 1992, 91(3):213-217.
[3] PEREIRA D I A, GIBSON G R.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Applied and Environmental Microbiology, 2002, 68(9):4689-4693.
[4] GILL H S, RUTHERFURD K J, CROSS M L.Dietary probiotic supplementation enhances natural killer cell activity in the elderly:An investigation of age-related immunological changes[J].Journal of Clinical Immunology, 2001, 21(4):264-271.
[5] LIU H, GONG J, CHABOT D, et al.Improved survival of Lactobacillus Zeae LB1 in a spray dried alginate-protein matrix[J].Food Hydrocolloids, 2018, 78:100-108.
[6] DE VRIES M C, VAUGHAN E E, KLEEREBEZEM M, et al.Lactobacillus plantarum:Survival, functional and potential probiotic properties in the human intestinal tract[J].International Dairy Journal, 2006, 16(9):1018-1028.
[7] MOHAMMAD N A, ZAIDEL D A, MUHAMAD I I, et al.Biopolymeric encapsulation of probiotics for improved release properties in the gastrointestinal digestion system[J].IOP Conference Series:Materials Science and Engineering, 2020, 778(1):012033.
[8] HANSEN L T, ALLAN-WOJTAS P M, JIN Y L, et al.Survival of Ca-alginate microencapsulated Bifidobacterium spp.in milk and simulated gastrointestinal conditions[J].Food Microbiology, 2002, 19(1):35-45.
[9] LIU H, CAI Z W, WANG F, et al.Colon-targeted adhesive hydrogel microsphere for regulation of gut immunity and flora[J].Advanced Science, 2021, 8(18):2101619.
[10] JI R, WU J H, ZHANG J L, et al.Extending viability of Bifidobacterium longum in chitosan-coated alginate microcapsules using emulsification and internal gelation encapsulation technology[J].Frontiers in Microbiology, 2019, 10:1389.
[11] 常诗晗, 武俊瑞, 李紫晶, 等.复合海藻酸钠益生菌微胶囊研究进展[J].食品工业科技, 2024, 45(3):372-377.
CHANG S H, WU J R, LI Z J, et al.Research progress on probiotic microcapsules by compound sodium alginate[J].Science and Technology of Food Industry, 2024, 45(3):372-377.
[12] LI R X, YUAN J L, DING C S, et al.Bovine serum albumin cold-set emulsion gel mediated by transglutaminase/glucono-δ-lactone coupling precursors:Fabrication, characteristics and embedding efficiency of hydrophobic bioactive components[J].LWT, 2022, 153:112550.
[13] ZHANG Y, YUAN J L, FAN C, et al.Fabrication and characteristics of porcine plasma protein cold-set gel:Influence of the aggregates produced by glucono-δ-lactone acidification on microbial transglutaminase catalysis[J].Food Hydrocolloids, 2021, 115:106597.
[14] YUAN J L, DING C S, LI C L, et al.Protective, controlled-release and embedding mechanism of porcine plasma protein cold-set gel on quercetin:An effective carrier of hydrophobic compounds[J].Food Bioscience, 2022, 47:101672.
[15] CAI R, PAN S Y, LI R X, et al.Curcumin loading and colon release of pectin gel beads:Effect of different de-esterification method[J].Food Chemistry, 2022, 389:133130.
[16] YAN W J, JIA X, ZHANG Q P, et al.Interpenetrating polymer network hydrogels of soy protein isolate and sugar beet pectin as a potential carrier for probiotics[J].Food Hydrocolloids, 2021, 113:106453.
[17] ZHAO M, HUANG X, ZHANG H, et al.Probiotic encapsulation in water-in-water emulsion via heteroprotein complex coacervation of type-a gelatin/sodium caseinate[J].Food Hydrocolloids, 2020, 105:105790.
[18] DENG R X, MARS M, VAN DER SMAN R G M, et al.The importance of swelling for in vitro gastric digestion of whey protein gels[J].Food Chemistry, 2020, 330:127182.
[19] CHING S H, BANSAL N, BHANDARI B.Alginate gel particles-a review of production techniques and physical properties[J].Critical Reviews in Food Science and Nutrition, 2017, 57(6):1133-1152.
[20] GASPAR A L C, DE G ES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins:A review[J].Food Chemistry, 2015, 171:315-322.
ES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins:A review[J].Food Chemistry, 2015, 171:315-322.
[21] 周莉, 王晓瑞, 谭静, 等.海藻酸钠-乳清蛋白复合益生菌微胶囊的构建及性能评价[J].中国食品添加剂, 2020, 31(4):108-113.
ZHOU L, WANG X R, TAN J, et al.Construction and performance evaluation of sodium alginate whey protein composite probiotics microcapsules[J].China Food Additives, 2020, 31(4):108-113.
[22] 徐鹏翔, 吴彩娥, 范龚健, 等.银杏蛋白-海藻酸钠制备包埋植物乳杆菌微胶囊及其性能研究[J].林业工程学报, 2019, 4(5):70-77.
XU P X, WU C E, FAN G J, et al.Preparation and characteristic evaluation of Lactobacillus plantarum microcapsules developed with the Ginkgo seed protein and sodium alginate[J].Journal of Forestry Engineering, 2019, 4(5):70-77.
[23] FENG C, SONG R X, SUN G H, et al.Immobilization of coacervate microcapsules in multilayer sodium alginate beads for efficient oral anticancer drug delivery[J].Biomacromolecules, 2014, 15(3):985-996.
[24] NAWONG S, OONSIVILAI R, BOONKERD N, et al.Entrapment in food-grade transglutaminase cross-linked gelatin-maltodextrin microspheres protects Lactobacillus spp.during exposure to simulated gastro-intestinal juices[J].Food Research International, 2016, 85:191-199.
[25] GRILL J P, PERRIN S, SCHNEIDER F.Bile salt toxicity to some bifidobacteria strains:Role of conjugated bile salt hydrolase and pH[J].Canadian Journal of Microbiology, 2000, 46(10):878-884.
[26] 王道滇, 马月星, 魏光强, 等.海藻酸钠-乳铁蛋白复合益生菌微胶囊的制备及性能研究[J].中国奶牛, 2023(2):43-51.
WANG D D, MA Y X, WEI G Q, et al.Preparation and performance study of sodium alginate-lactoferrin composite probiotic microcapsules[J].China Dairy Cattle, 2023(2):43-51.
[27] 邹强, 梁华忠, 龚春雪, 等.海藻酸钠和乳清蛋白作为益生菌包埋壁材的比较[J].食品科学, 2014, 35(15):207-211.
ZOU Q, LIANG H Z, GONG C X, et al.Comparison of alginate and whey protein as two different coating materials used for probiotic microencapsulation[J].Food Science, 2014, 35(15):207-211.