荔枝(Litchi chinensis Sonn.)是著名的岭南佳果,因其鲜红的果皮、独特的风味以及丰富的营养物质(如碳水化合物、维生素、矿物质、膳食纤维、氨基酸和多酚)而广受人们的喜爱[1]。同时荔枝果实也具有丰富的药用特性,比如缓解疼痛、改善睡眠和记忆以及增强免疫力等[2]。然而,荔枝作为一种易腐性高的非跃变果实,在收获后的贮藏过程中会发生迅速的生理变化,导致贮藏期较短,产生巨大的浪费,严重限制其产品的销售能力和产业的发展。一些传统的方法,包括SO2熏蒸和化学杀菌剂(如苯甲胺和原氯酸)浸泡均可以有效地延缓果皮褐变,保留红色,减少收获荔枝果实病害的发生[3]。然而,随着人们对药物残留表现出越来越深的担忧后,SO2熏蒸和化学杀菌剂的使用受到越来越多的限制[4],因此,目前维持采后荔枝贮藏品质方法的研究更多集中在安全无毒的处理方向。如,GUO等[5]使用氯化钙处理采后荔枝,发现氯化钙处理可以显著提高荔枝果皮中Ca2+和纤维素的含量,进而维持荔枝果实的细胞壁结构,延缓果皮褐变的发生。又比如,ALI等[6]研究发现,荔枝果实采后施用蛋氨酸可显著提高抗氧化活性,减少褐变,保持贮藏品质,当然,天然植物提取物[7]、一氧化氮[8]、褪黑素[9]和新型壳聚糖[10]等也均被证明可以有效维持采后荔枝贮藏品质,然而这些研究主要集中在果皮褐变方面,而关于果肉营养品质的研究相对较少。
植物从营养组织、花朵和水果中释放出各种挥发性化合物,使植物能够与周围环境交流[11]。在植物挥发物中,茉莉酸甲酯(methyl jasmonate, MeJA)是茉莉酸(jasmonic acid, JA)在茉莉酸羧甲基转移酶的作用下转化而来[12]。作为一种天然的植物调节剂,MeJA已被证实是一种重要的信号分子,可诱导植物细胞中的氧化应激和次生代谢物的积累[13],进而有效提高采后果蔬的抗病性[14]。比如在收获前或收获后施用MeJA均可以有效抑制灰霉菌腐烂的发生[15]。其中值得注意的是,也有研究证明,MeJA处理可以调控采后果蔬中糖代谢途径以维持良好的贮藏品质。如MeJA能显著提高采后番茄果实的淀粉酶(amylase, AM)、蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)、蔗糖合成酶(sucrose synthase, SS)和中性转化酶(neutral invertase, NI)的转录水平,同时降低酸性转化酶(acid invertase, AI)的转录水平,促进番茄果实淀粉的降解和蔗糖的积累,抑制番茄果实葡萄糖和果糖含量的增加,进而增强番茄果实的耐寒性,维持番茄果实低温贮藏过程中的品质[16]。然而,目前关于MeJA处理是否可以调控采后荔枝果实糖代谢的研究还未有报道。
因此,为探究MeJA处理对荔枝贮藏过程中营养品质变化及糖代谢的影响,本研究分别以10、50、100 μmol/L的MeJA处理‘桂味’荔枝作为处理组,并以清水处理为对照组,观察荔枝低温贮藏过程中可溶性固形物(total suspended solids, TSS)含量、好果率、可溶性糖、有机酸、抗氧化物等贮藏品质以及糖代谢相关酶活性的变化。以期为未来MeJA在采后荔枝及其他果蔬贮藏中的应用提供理论依据。
1 材料与方法
1.1 实验材料和处理方法
荔枝果实从广西贺州市荔枝园采摘,并在2 h内运回实验室。选择形状和颜色相同、没有病虫害和机械损伤的荔枝果实,用0.1%杀菌剂(咪鲜胺)浸泡3 min捞出,自然晾干后荔枝果实随机分为4组(每组240个果实):a)对照组(CK):浸泡在蒸馏水中3 min;b)3个MeJA处理组:分别浸泡在10、50、100 μmol/L MeJA溶液中3 min。4组荔枝取出后密闭贮藏于自密封袋中,进行3 h的室温熏蒸。自然晾干后将其放入聚乙烯袋中(每袋20个),在低温[4 ℃,(85±5)%相对湿度]下贮藏20 d。每5 d取样一次果肉,每次3袋(共计60个),将样品在液氮中速冻后贮存于-80 ℃超低温冰箱。
1.2 实验方法
1.2.1 好果率、失重率和TSS含量的测定
每个重复随机取10个果,参考王银红等[17]的方法,基于褐变面积进行好果率的评定;而TSS含量测定参考郭靖等[18]的方法进行测定,设置3个重复。
1.2.2 总酚、类黄酮、DPPH自由基清除速率和谷胱甘肽含量的测定
总酚、类黄酮、DPPH自由基清除速率和还原型谷胱甘肽(reduced glutathione,GSH)含量的测定参考LUO等[3]的方法进行,其中总酚采用FoLin-CiocaLteu法进行测定,并以没食子酸为标准计算;类黄酮含量测定采用铝离子比色法,并以芦丁为标准计算;GSH含量和DPPH自由基清除速率测定采用比色法测定。
1.2.3 有机酸含量和可溶性糖含量的测定
荔枝果肉有机酸和可溶性糖含量的测定参照SU等[1]的方法使用高效液相色谱进行测定。
1.2.4 荔枝糖代谢相关酶的提取和活性的测定
糖代谢相关酶的提取:取1 g荔枝果肉,加入1 mL的预冷50 mmol/L pH 7.5 4-(2-羟乙基)-1-哌嗪乙磺酸-NaOH提取缓冲液[内含1 mmol/L EDTA、5 mmol/L MgCl2、2.5 mmol/L二硫苏糖醇、0.5 mg/mL BSA、0.05%(体积分数)曲拉通X-100,10%(体积分数)甘油],4 ℃下13 000 r/min离心15 min。吸取1 mL上清液于PD-10(SephadexTM G-25M,GE Health-care)脱盐柱中脱盐,用2 mL试管收集冲洗液作为酶提取液,于4 ℃待用。每个样品重复3次。以脱盐的酶提取液测定酶活性。AI、NI和SS活性测定参照帅良等[19]的方法进行,而SPS酶活测定参考WANG等[20]的方法进行。
1.3 统计与分析
用Excel 2010进行均值和标准误差等数据的处理,选用SPSS 19.0软件中的‘分析-比较平均值-单因素ANOVA检验’进行显著性分析,采用Origin 2021软件进行相关性分析及绘图。
2 结果与分析
2.1 MeJA处理对荔枝外观品质、失重率、TSS含量和好果率的影响
外观品质、失重率、TSS含量和好果率均是评判采后荔枝贮藏品质的重要指标,TSS含量和好果率的下降及失重率的上升均标志着荔枝商品价值的下降。由图1-A可知,在贮藏20 d时,CK组的果皮呈现明显的褐变,而不同浓度的MeJA均抑制了褐变的发生,其中50 μmol/L和100 μmol/L的处理效果显著优于10 μmol/L处理组和CK组(P<0.05)。这与DESHI等[21]结果一致,再次证明了MeJA对褐变的抑制作用。由图1-B可知,不同处理组荔枝果实的失重率均呈现逐渐上升的趋势,其中CK组失重率上升最为迅速,20 d失重率达到(5.43±0.12)%。相对CK组,不同浓度的MeJA处理均可以有效抑制失重率的上升(P<0.05),20 d时10、50、100 μmol/L MeJA的失重率分别为CK组的91.45%、72.37%和77.35%。由图1-C可知,不同处理组荔枝果实的TSS含量均呈现先上升而后逐渐下降的趋势,其中CK组TSS含量下降最为明显,20 d TSS含量仅为(14.72±0.10)%。相对CK组,不同浓度的MeJA处理均可以有效抑制TSS含量的下降(P<0.05),20 d时10、50、100 μmol/L MeJA的TSS含量分别为CK组的104.21%、110.39%和108.22%。由图1-D可知,不同处理组荔枝果实的好果率均呈现逐渐下降的趋势,其中CK组好果率下降最为明显,20 d时,几乎无好果,好果率仅为3.33%。相对CK组,不同浓度的MeJA处理均可以有效维持贮藏品质,延缓褐变的发生(P<0.05),20 d时10、50、100 μmol/L MeJA的好果率分别为CK组的2倍、23倍和24倍。由外观品质、失重率、TSS含量和好果率的结果可以发现,不同浓度的MeJA均可以有效维持采后荔枝的贮藏品质,其中50 μmol/L的MeJA处理效果优于10、100 μmol/L的MeJA处理组和CK组,因此后续实验采用50 μmol/L的MeJA处理组开展进一步实验。
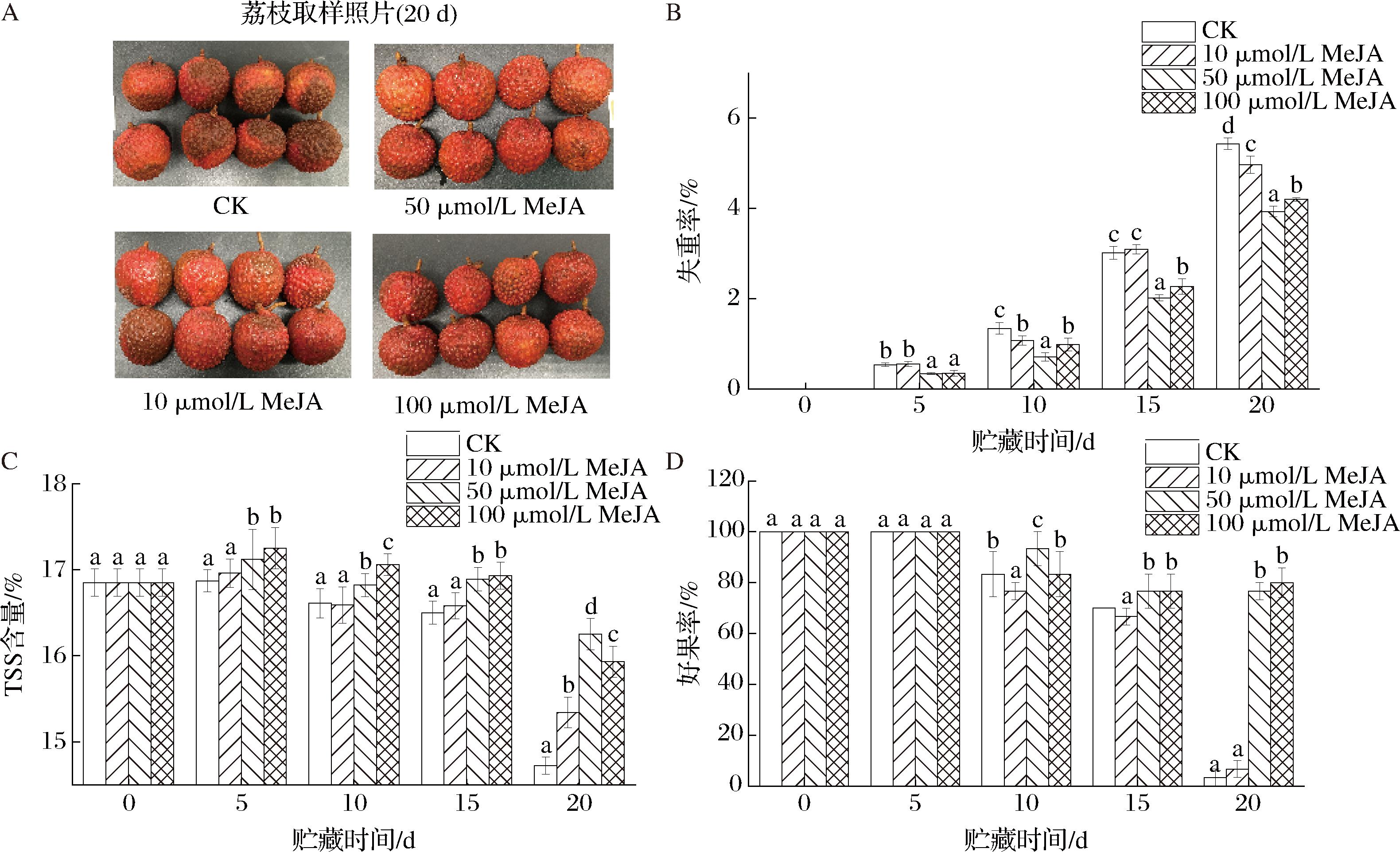
A-荔枝外观品质;B-失重率;C-TSS含量;D-好果率
图1 MeJA处理对荔枝外观品质、失重率、TSS含量和好果率的影响
Fig.1 Effects of MeJA treatment on appearance quality, weight loss rate, TSS content, and good fruit rate of litchi
注:a,b,c,d被用于表示同一时间不同组数据的差异性,字母相同表示无显著差异(P>0.05),而字母不同表示有显著差异(P<0.05)(下同)。
2.2 MeJA处理对荔枝果肉DPPH自由基清除速率、总酚含量、类黄酮含量和GSH含量的影响
DPPH自由基清除速率、总酚含量、类黄酮含量和GSH含量均是评判采后荔枝果肉非酶抗氧化能力的重要指标。由图2-A可知,不同处理组荔枝果实的DPPH自由基清除速率整体上均呈现逐渐下降的趋势,其中CK组DPPH自由基清除速率下降最为明显,由0 d的(80.97±1.98)%下降至20 d的(54.36±0.46)%。相对CK组,MeJA处理可以有效抑制DPPH自由基清除速率的下降(P<0.05),在20 d时DPPH自由基清除速率为(62.06±1.30)%,是CK组的114.17%。由图2-B可知,不同处理组荔枝果实的总酚含量整体上均呈现逐渐下降的趋势,其中CK组总酚含量下降最为明显,由0 d的(1.05±0.01) mg/g下降至20 d的(0.84±0.01) mg/g。相对CK组,MeJA处理可以有效抑制总酚含量的下降(P<0.05),在20 d时总酚含量为(0.93±0.01) mg/g,是CK组的111.56%。由图2-C可知,CK组荔枝果实的类黄酮含量整体上呈现逐渐上升的趋势,由0 d的(95.67±1.35) mg/kg上升至20 d的(126.24±2.70) mg/kg。相对CK组,MeJA处理可以显著增加类黄酮含量(P<0.05),特别是在贮藏5 d时类黄酮含量为(151.17±0.01) mg/kg,是CK组的158.01%。由图2-D可知,不同处理组荔枝果实的GSH含量整体上均呈现逐渐下降的趋势,其中CK组GSH含量下降最为明显,由0 d的(0.40±0.01) mg/g下降至20 d的(0.26±0.02) mg/g。相对CK组,MeJA处理可以有效抑制GSH含量的下降(P<0.05),在20 d时GSH含量为(0.33±0.01) mg/g,是CK组的123.80%。

A-DPPH自由基清除速率;B-总酚含量;C-类黄酮含量;D-GSH含量
图2 MeJA处理对荔枝果肉DPPH自由基清除速率、总酚含量、类黄酮含量和GSH含量的影响
Fig.2 Effects of MeJA treatment on DPPH free radical scavenging rate, total phenolic content, flavonoid content, and GSH content of litchi pulp
2.3 MeJA处理对荔枝果肉酒石酸、抗坏血酸、柠檬酸和苹果酸含量的影响
酒石酸、抗坏血酸、柠檬酸和苹果酸均是荔枝果肉重要的有机酸,不仅可以给荔枝果肉带来独特的风味,还具有明显的抗氧化作用。由图3-A可知,不同处理组荔枝果实的酒石酸含量整体上均呈现逐渐下降的趋势,其中CK组酒石酸含量下降最为明显,由0 d的(1.25±0.01) mg/g下降至20 d的(1.05±0.02) mg/g。相对CK组,MeJA处理可以有效抑制酒石酸含量的下降(P<0.05),在20 d时酒石酸含量为(1.08±0.01) mg/g,是CK组的111.75%。由图3-B可知,不同处理组荔枝果实的抗坏血酸含量均呈现逐渐下降的趋势,其中CK组抗坏血酸含量下降最为明显,由0 d的(0.15±0.003) mg/g下降至20 d的(0.10±0.001) mg/g。相对CK组,MeJA处理可以有效抑制抗坏血酸含量的下降(P<0.05),特别是在贮藏第10天时抗坏血酸含量为(0.14±0.001) mg/g,是CK组的115.88%。由图3-C可知,不同处理组荔枝果实的柠檬酸含量均呈现逐渐下降的趋势,其中CK组柠檬酸含量下降最为明显,由0 d的(6.07±0.63) mg/g下降至20 d的(0.34±0.02) mg/g。相对CK组,MeJA处理可以有效抑制柠檬酸含量的下降(P<0.05),特别是在贮藏第20天时柠檬酸含量为(1.13±0.01) mg/g,是CK组的329.83%。由图3-D可知,不同处理组荔枝果实的苹果酸含量均呈现逐渐下降的趋势,其中CK组苹果酸含量下降最为明显,由0 d的(5.65±0.27) mg/g下降至20 d的(3.93±0.09) mg/g。相对CK组,MeJA处理可以有效抑制苹果酸含量的下降(P<0.05),特别是在贮藏第20天时苹果酸含量为(4.41±0.04) mg/g,是CK组的111.99%。
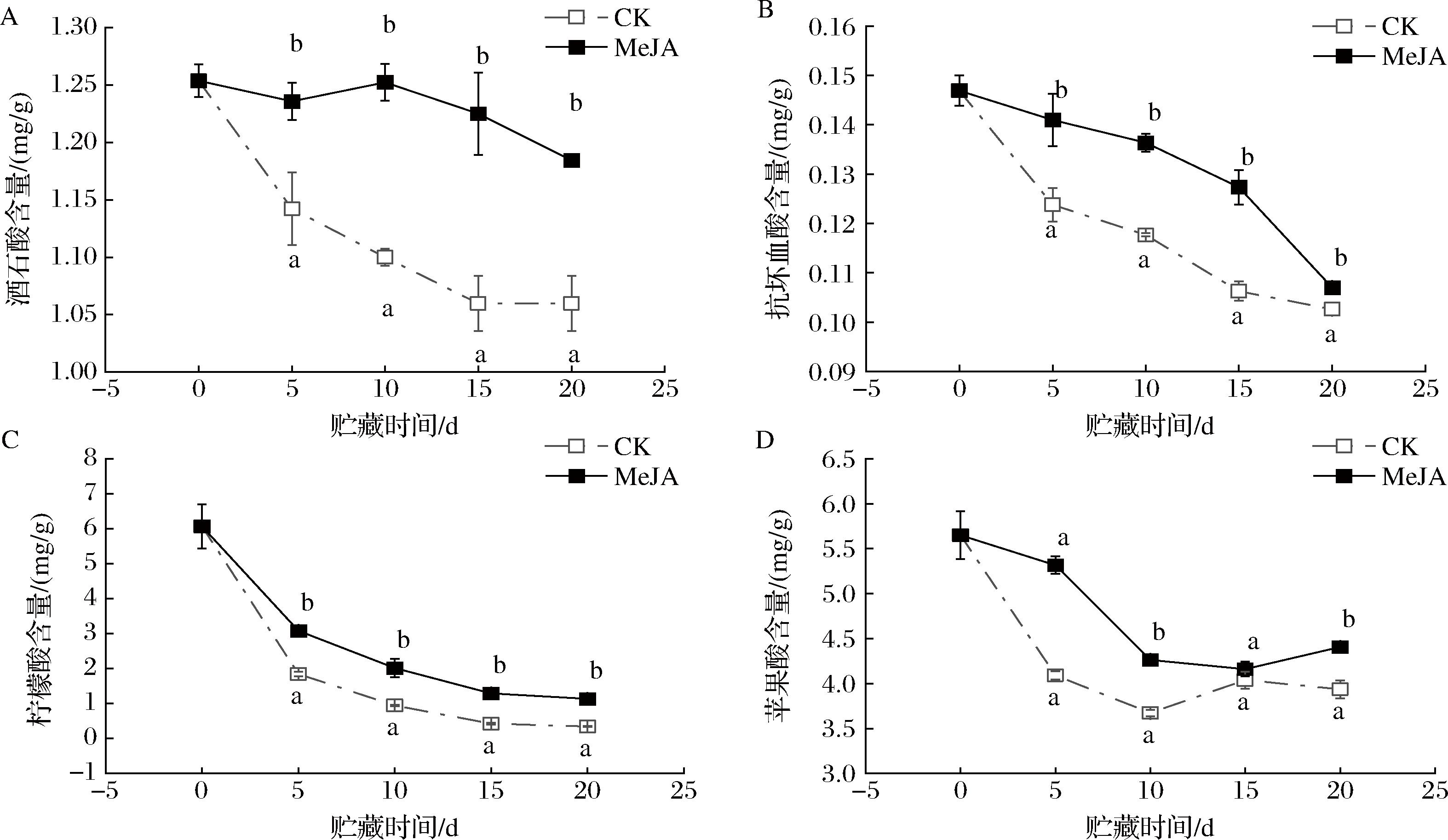
A-酒石酸含量;B-抗坏血酸含量;C-柠檬酸含量;D-苹果酸含量
图3 MeJA处理对荔枝果肉酒石酸、抗坏血酸、柠檬酸和苹果酸含量的影响
Fig.3 Effects of MeJA treatment on tartaric acid, ascorbic acid, citric acid, and malic acid contents of litchi pulp
2.4 MeJA处理对荔枝果肉总糖、蔗糖、葡萄糖和果糖含量的影响
蔗糖、葡萄糖和果糖均是荔枝果肉重要的可溶性糖,不仅可以给荔枝果肉带来独特的风味,还是重要的能量代谢底物。由图4-A可知,不同处理组荔枝果实的总糖含量整体上均呈现逐渐下降的趋势,其中CK组总糖含量下降最为明显,由0 d的(160.51±1.95) mg/g下降至20 d的(128.43±2.52) mg/g。相对CK组,MeJA处理可以有效抑制总糖含量的下降(P<0.05),在20 d时总糖含量为(141.63±1.45) mg/g,是CK组的110.27%。由图4-B可知,不同处理组荔枝果实的蔗糖含量整体上均呈现逐渐下降的趋势,其中CK组蔗糖含量下降最为明显,由0 d的(59.10±0.95) mg/g下降至20 d的(36.11±2.16) mg/g。相对CK组,MeJA处理可以有效抑制蔗糖含量的下降(P<0.05),在20 d时蔗糖含量为(41.92±0.61) mg/g,是CK组的116.09%。由图4-C可知,不同处理组荔枝果实的葡萄糖含量整体上均呈现先上升后逐渐下降的趋势,其中CK组葡萄糖含量最先在5 d时候达到峰值(50.61±1.15) mg/g,而后逐渐下降至(41.53±0.51) mg/g(20 d)。相对CK组,MeJA处理组的荔枝果实在10 d时候达到峰值(49.22±0.76) mg/g,而后逐渐下降至(46.28±1.17) mg/g(20 d)。由此可知,MeJA处理可以有效抑制蔗糖向葡萄糖转化。由图4-D可知,不同处理组荔枝果实的果糖含量整体上均呈现先上升后逐渐下降的趋势,其中MeJA处理组荔枝果肉的果糖含量在整个贮藏期间均高于CK组。这与SU等[1]的实验结果差异较大,可能与贮藏温度不同有关。
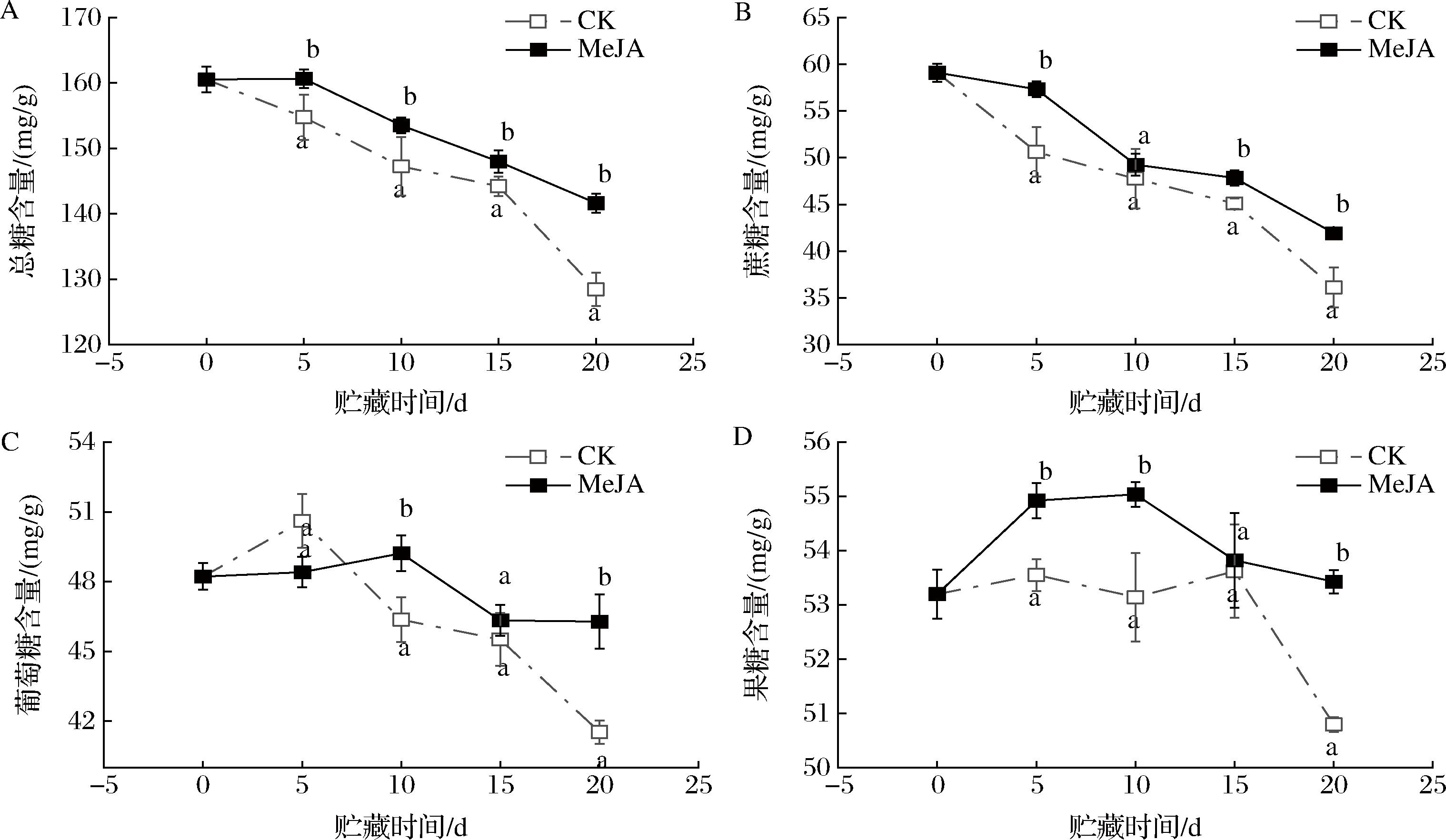
A-总糖含量;B-蔗糖含量;C-葡萄糖含量;D-果糖含量
图4 MeJA处理对荔枝果肉总糖、蔗糖、葡萄糖量和果糖含量的影响
Fig.4 Effects of MeJA treatment on total sugar, sucrose, glucose, and fructose contents of litchi pulp
2.5 MeJA处理对荔枝果肉NI、AI、SS和SPS酶活性的影响
NI、AI、SS和SPS均是采后荔枝果实糖代谢的重要调节酶,其酶活性对荔枝果实的贮藏品质有着显著的影响。由图5-A可知,CK组荔枝果实的NI酶活性整体上呈现逐渐上升的趋势,由0 d的(1.02±0.16) U/μg上升至20 d的(1.68±0.09) U/μg。相对CK组,MeJA处理可以显著抑制NI酶活性的上升(P<0.05),特别是在贮藏20 d时NI酶活性为(0.72±0.05) U/μg,是CK组的42.77%。由图5-B可知,CK组荔枝果实的AI酶活性整体上呈现逐渐上升的趋势,由0 d的(0.98±0.05) U/μg上升至20 d的(3.15±0.42) U/μg。相对CK组,MeJA处理可以显著抑制AI酶活性的上升(P<0.05),特别是在贮藏20 d时AI酶活性为(1.04±0.11) U/μg,是CK组的32.96%。由图5-C可知,CK组荔枝果实的SS酶活性整体上呈现先上升后逐渐下降的趋势,最先在10 d时候达到峰值(2.47±0.15) U/μg,而后逐渐下降至(1.23±0.25) U/μg(20 d)。与CK组相似,MeJA处理组荔枝果实的SS酶活性也在10 d时候达到峰值(1.32±0.03) U/μg,而后逐渐下降至(0.43±0.02) U/μg(20 d),但是MeJA处理组荔枝果实的SS酶活性在整个贮藏期间显著低于CK组(P<0.05)。由图5-D可知,CK组荔枝果实的SPS酶活性整体上呈现逐渐上升的趋势,由0 d的(5.98±0.19) U/μg上升至20 d的(6.93±0.04) U/μg。相对CK组,MeJA处理可以显著上调SPS酶活性(P<0.05),特别是在贮藏20 d时SPS酶活性为(7.90±0.17) U/μg,是CK组的114.06%。
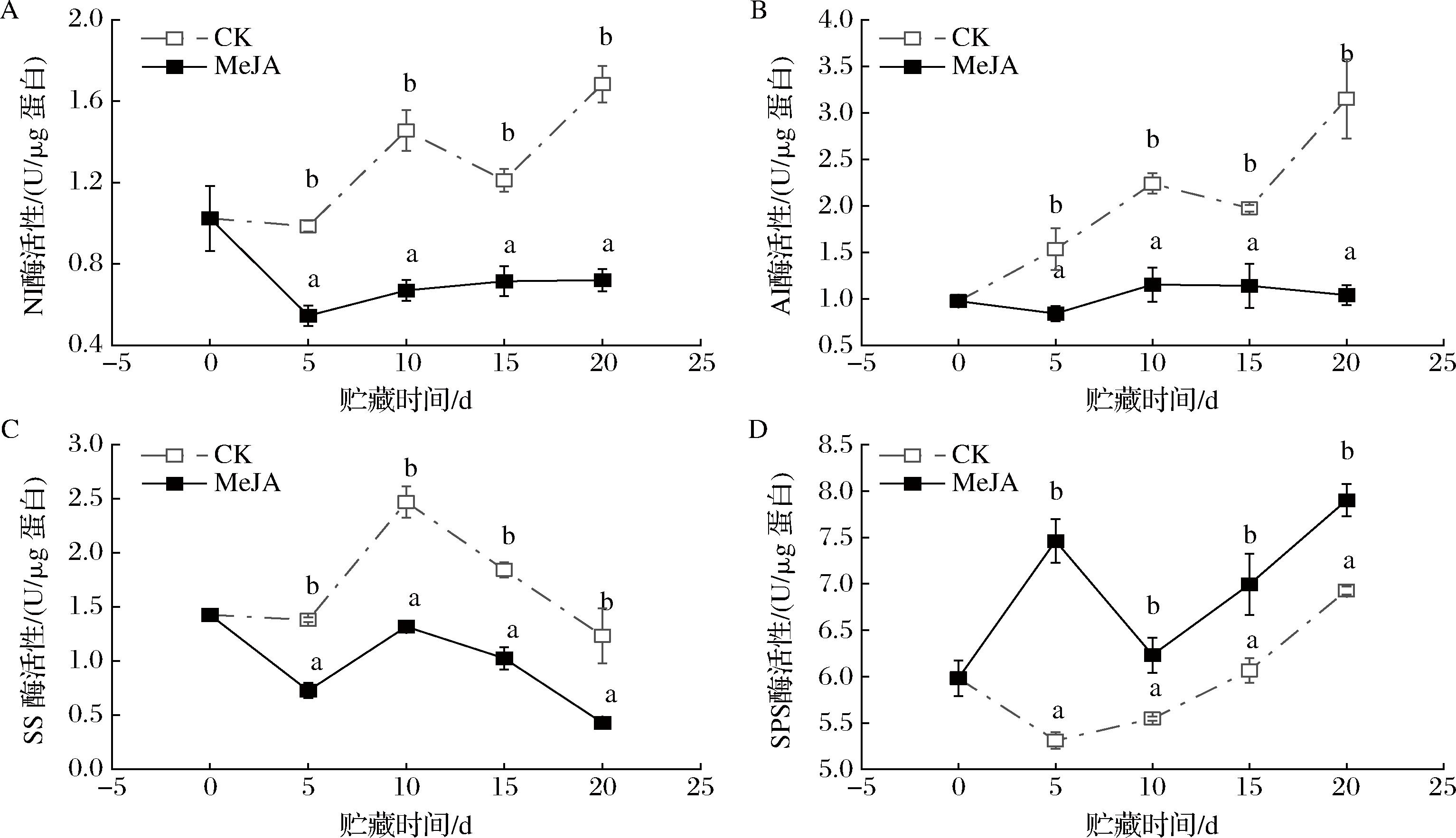
A-NI酶活性;B-AI酶活性;C-SS酶活性;D-SPS酶活性
图5 MeJA处理对荔枝果肉NI、AI、SS和SPS酶活性的影响
Fig.5 Effects of MeJA treatment on NI, AI, SS, and SPS activites of litchi pulp
2.6 相关性分析
为了探究MeJA处理对荔枝贮藏品质及糖代谢影响的可能机理,对不同处理组荔枝果实的生理指标进行相关性分析(图6)。结果表明,TSS含量与AI酶活性、NI酶活性、贮藏时间和失重率呈现显著负相关(P<0.05),而与总糖含量、果糖含量、葡萄糖含量、蔗糖含量、酒石酸含量、抗坏血酸含量、GSH含量、DPPH自由基清除速率、总酚含量和好果率呈现显著正相关(P<0.05),这表明可溶性糖、有机酸和酚类物质是构成荔枝果肉TSS含量的重要物质,这与以往的研究结果是一致的,表明本实验的结果具有普遍性。同时蔗糖作为龙眼果肉重要的营养和风味物质,与AI酶活性、失重率和贮藏时间呈现显著负相关(P<0.05),而与TSS含量、好果率、总酚含量、DPPH自由基清除速率、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量和总糖含量呈现显著正相关(P<0.05),这表明蔗糖代谢不仅受到糖代谢关键酶活性的影响,还与果肉的非酶抗氧化能力有关。
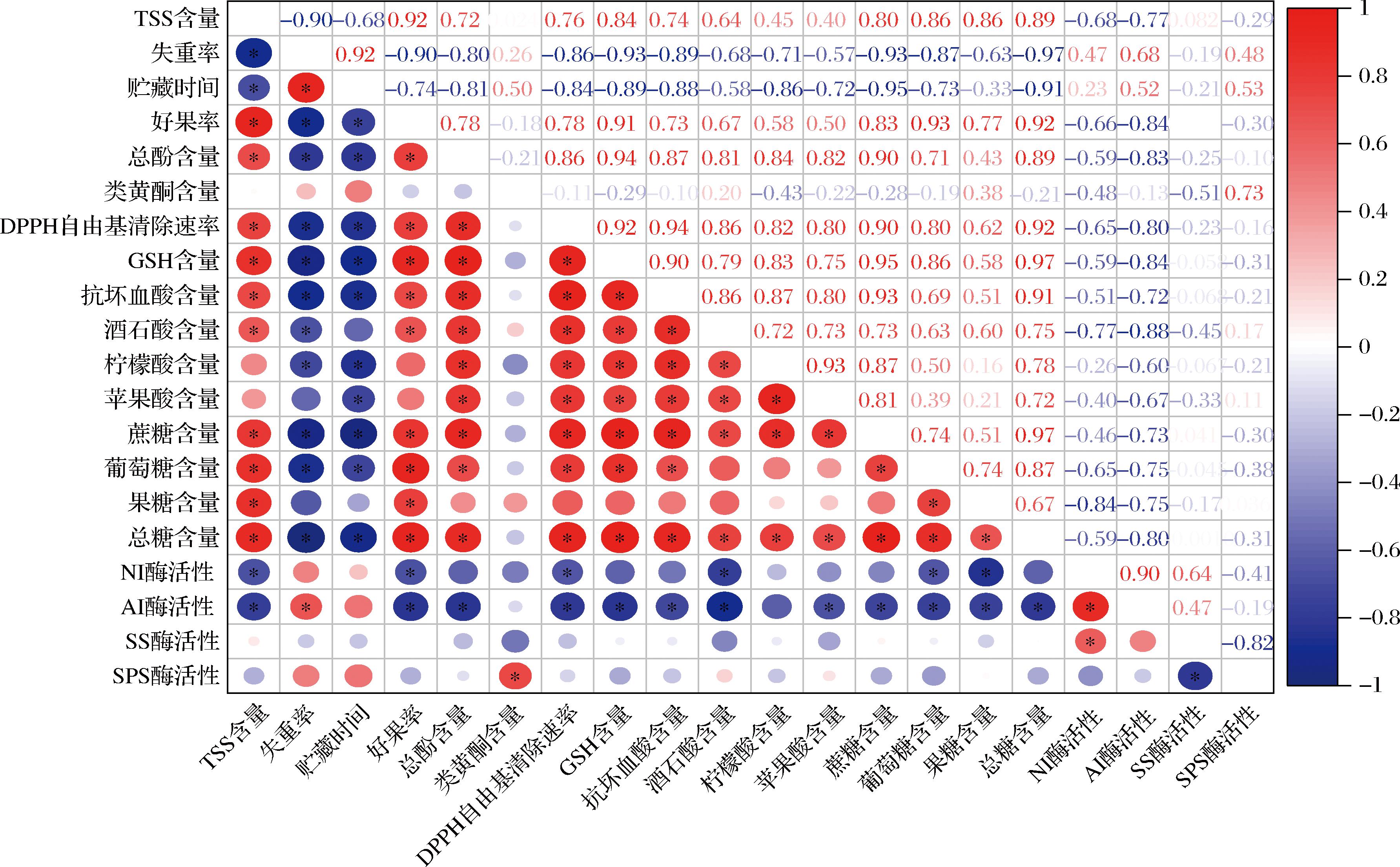
图6 不同指标相关性分析结果
Fig.6 Correlation analysis results of different indicators
注:*代表差异显著(P<0.05)。
2.7 主成分分析
对荔枝贮藏过程中贮藏品质及糖代谢相关指标数据标准化处理之后进行主成分分析,第1、2和3主成分特征值分别为12.377、3.385和1.938,第1、2和3主成分贡献率分别为65.14%、17.815%和10.202%,前3个主成分特征值均大于1且累积贡献率达到93.16%,可见前3个主成分可以说明荔枝贮藏过程中贮藏品质及糖代谢相关指标有关数据的变化趋势,完全符合主成分分析的基本要求,因此取前3个主成分进行数据分析。用3个变量Y1、Y2和Y3代替原来的19个指标,得出线性组合为(其中Z1~Z19均为标准化变量,且依次代表失重率、TSS含量、好果率、总酚含量、类黄酮含量、DPPH自由基清除速率、GSH含量、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量、蔗糖含量、葡萄糖含量、果糖含量、总糖含量、NI酶活性、AI酶活性、SS酶活性和SPS酶活性):
FAC1=-0.075 Z1+0.071 Z2+0.074 Z3+0.075 Z4-0.01 Z5+0.077 Z6+0.079 Z7+0.074 Z8+0.07 Z9+0.064 Z10+0.061 Z11+0.076 Z12+0.07 Z13+0.056 Z14+0.079 Z15-0.056 Z16-0.072 Z17-0.013 Z18-0.014 Z19
FAC2=-0.087 Z1+0.001 Z2+0.025 Z3+0.004 Z4-0.253 Z5-0.005 Z6+0.045 Z7+0.027 Z8-0.1 Z9+0.074 Z10-0.009 Z11+0.067 Z12+0.028 Z13-0.104 Z14+0.044 Z15+0.196 Z16+0.111 Z17+0.252 Z18-0.269 Z19
FAC3=0.088 Z1-0.217 Z2-0.166 Z3+0.127 Z4-0.122 Z5+0.069 Z6+0.018 Z7 +0.102 Z8+0.098 Z9+0.279 Z10+0.317 Z11+0.067 Z12-0.188 Z13-0.301 Z14-0.03 Z15+0.117 Z16+0.015 Z17-0.175 Z18+0.15 Z19
由图7-A可知,TSS含量、好果率、总酚含量、DPPH自由基清除速率、GSH含量、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量、蔗糖含量、葡萄糖含量、果糖含量和总糖含量聚集在PC1(65.143%)正轴上,失重率、NI酶活性和AI酶活性在PC1(65.143%)负轴上,表明PC1(65.143%)越大,TSS含量、好果率、总酚含量、DPPH自由基清除速率、GSH含量、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量、蔗糖含量、葡萄糖含量、果糖含量和总糖含量越高,而失重率越小,故定义PC1为贮藏品质指标;同时SS酶活性聚集在PC2(17.815%)正轴上,SPS酶活性和类黄酮含量聚集在PC2(17.815%)负轴上,表明PC2(17.815%)越高,SS酶活性越高,而SPS酶活性和类黄酮含量越低,故定义PC2为糖代谢指标。令人感到意外的是,没有指标聚集在PC3(10.202%)两端,因此随后不对图8中PC3(10.202%)的变化做过多的分析(图7-B)。
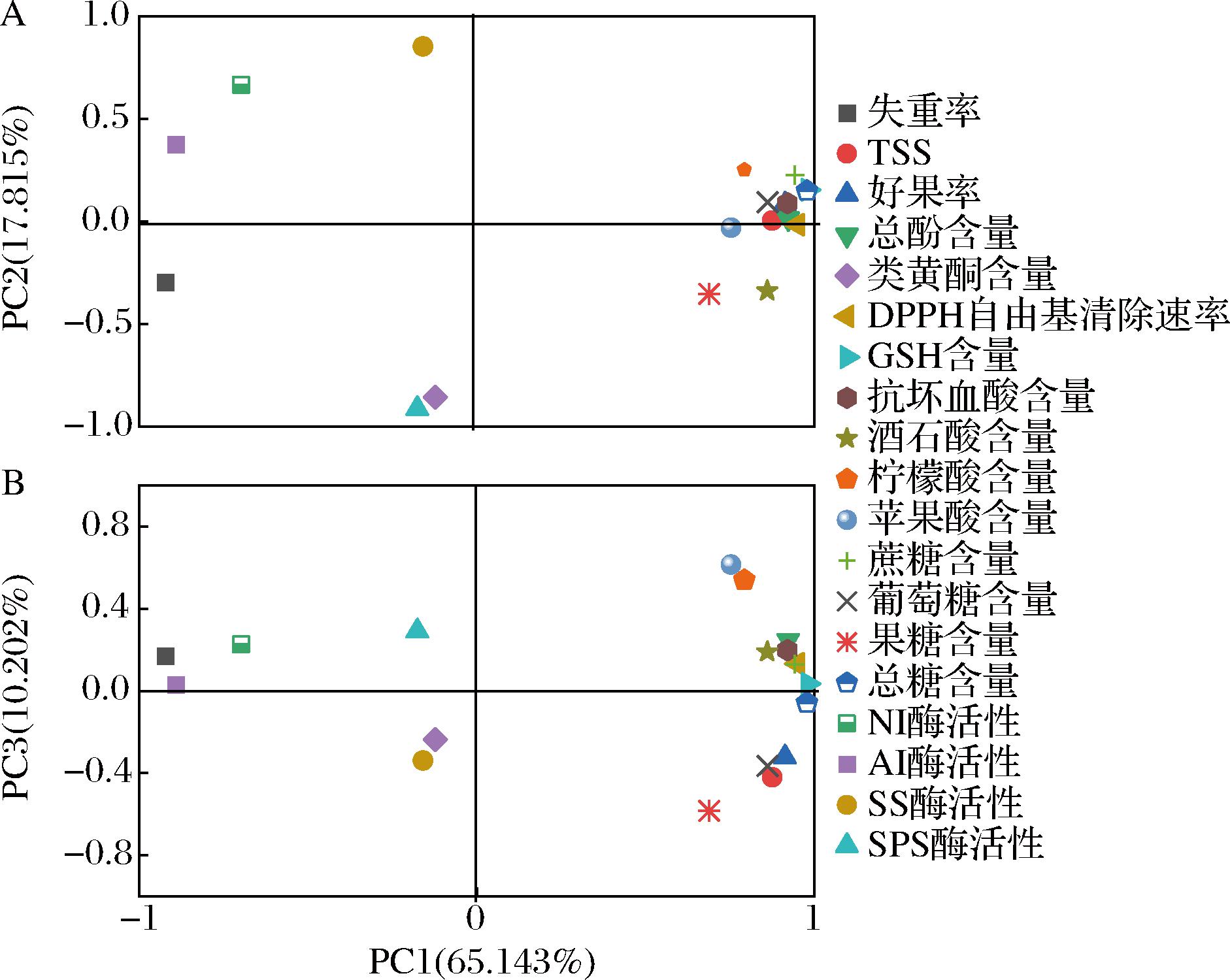
图7 不同指标主成分分析的因子载荷图
Fig.7 Factor loading plots for principal component analysis of different indicators
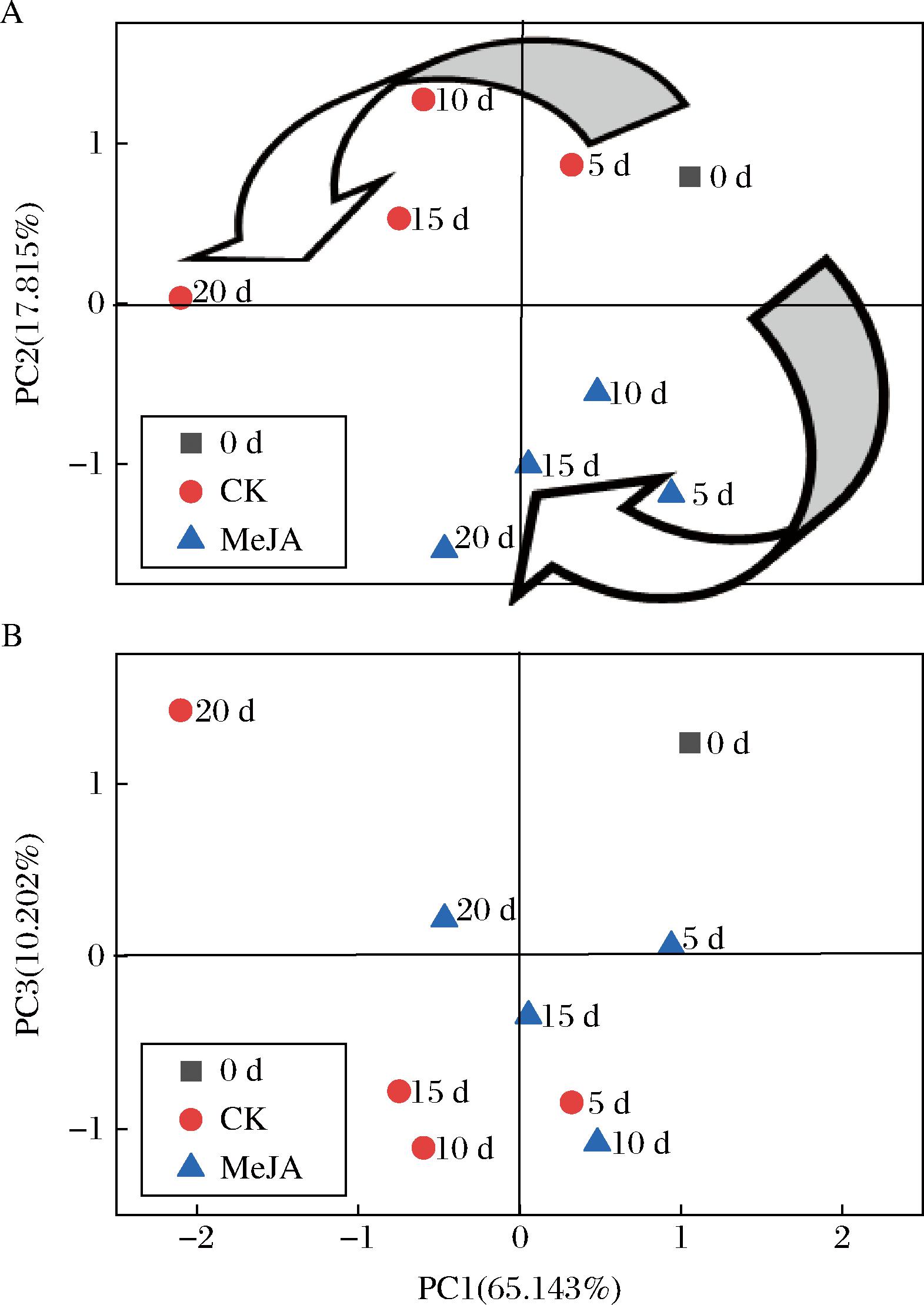
图8 不同指标主成分分析的因子得分图
Fig.8 Factor score plots of principal component analysis for different indicators
由图8可知,不同处理组变化趋势既有相似处又有明显差异。相似之处是整体均由PC1(65.143%)正轴变化至PC1(65.143%)负轴,结合图7来看,这伴随着TSS含量、好果率、总酚含量、DPPH自由基清除速率、GSH含量、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量、蔗糖含量、葡萄糖含量、果糖含量和总糖的下降及失重率的升高。这表明,在低温贮藏下,TSS含量、好果率、总酚含量、DPPH自由基清除速率、GSH含量、抗坏血酸含量、酒石酸含量、柠檬酸含量、苹果酸含量、蔗糖含量、葡萄糖含量、果糖含量和总糖均会逐渐下降,MeJA处理不会改变其变化趋势。明显差异首先表现在由PC1(65.143%)正轴变化至PC1(65.143%)负轴的变化速率以及程度,由图8可以明显发现,相对CK组,MeJA处理明显抑制了该变化。不同处理组差异其次表现为象限的改变,由图8-A可知,CK组主要由第一象限向第二象限改变,而MeJA处理组主要由第一象限向第四象限改变。结合图7发现,MeJA处理组可以维持较高的SPS酶活性和类黄酮含量,一方面提供较高的抗氧化能力;另一方面促进低温下蔗糖的合成,以维持较高的贮藏品质。
3 结论
荔枝表观品质、失重率、好果率和TSS含量等指标因简单易得而被广泛用于评价荔枝采后贮藏品质的好坏[22-23]。如TECHAVUTHIPORN等[24]为了观察短期缺氧处理对采后荔枝贮藏品质的影响,通过测定TSS含量和失重率等指标进行评判。又比如王银红等[17]为了评价对‘糯米糍’、‘妃子笑’、‘淮枝’和‘桂味’4个荔枝品种采后低温贮藏品质指标差异,通过测定荔枝表观品质、失重率、好果率和TSS含量等指标进行评判。因此本实验已以荔枝表观品质、失重率、好果率和TSS含量4项指标评判MeJA处理对荔枝贮藏过程中品质的影响,结果发现不同浓度的MeJA均可以有效维持采后荔枝的贮藏品质,其中50 μmol/L的MeJA处理效果最佳,因此后续实验采用50 μmol/L的MeJA处理组和CK组开展进一步的实验。
流行病学证据表明,富含水果和蔬菜的饮食可以降低患这些疾病的风险,这是因为水果和蔬菜中的富含酚类、GSH和有机酸等多种有益物质。先前的研究表明,酚类化合物对水果和蔬菜的抗氧化能力贡献最大,因此酚类被认为是促进人类健康的重要抗氧化来源[25]。此外,也有研究表明,某些酚类物质可以有助于水果风味和香气的形成[26]。ZHANG等[27]指出,荔枝果实细胞中的酚类物质以自由状态和束缚状态存在,前者占总酚类物质的大多数。其中游离酚类物质包括2种酚酸(咖啡酸和绿原酸)和3种黄酮类化合物[(+)-儿茶素、(-)-表儿茶素和芦丁][1]。因此,本研究通过测定总酚含量、类黄酮含量、GSH含量和DPPH自由基清除速率来进行荔枝贮藏品质和抗氧化能力的评判,结果发现MeJA处理可以有效维持采后荔枝的总酚含量、类黄酮含量、GSH含量和DPPH自由基清除速率,这与MeJA在秋葵、枇杷和木瓜等果蔬中的结果一致。
荔枝的风味主要取决于果肉中糖和酸的组成和浓度。有机酸是水果风味的重要组成部分,通过影响水果风味、口味、营养和保健价值影响水果整体品质。近年来,有机酸在不同果实品种生长发育过程中的积累和代谢已被大量报道。已经证明,荔枝果实中的有机酸成分主要包括苹果酸、琥珀酸、酒石酸、柠檬酸、乳酸、乙酸、草酸、富马酸和丙酮酸[28],其中苹果酸和柠檬酸是荔枝果实中最丰富的有机酸[1],这与本研究结果一致。同时本研究也发现,MeJA处理可以有效维持采后荔枝果肉中的有机酸含量,进而延缓采后荔枝的商品货架期。
新鲜水果中糖的数量和种类直接影响其质量和风味。荔枝果肉主要含有还原糖(果糖和葡萄糖)和蔗糖,占鲜重的15%~20%,这与本研究中‘桂味’荔枝果肉中总糖含量相似,当然不同品种荔枝果实的糖组成差异很大。同时本研究也发现,MeJA处理可以有效维持采后荔枝果肉中的总糖和蔗糖含量,进而维持采后荔枝果肉的风味和营养价值,这与MeJA在辣椒、桃子、葡萄和番茄[16]中的应用结果一致,充分说明了MeJA在维持采后果蔬贮藏品质方面具有良好的应用前景。
叶片的光合作用产物主要以蔗糖的形式经过长距离运输从源组织到库组织,因此蔗糖代谢酶活性显著影响着果实中蔗糖的积累和其他还原糖的组成。蔗糖代谢酶包括SS、SPS和转化酶(invertase,INVs)。INVs可分为AI和NI。AI存在于液泡和细胞壁之间,而NI存在于细胞质中。这些酶调节蔗糖和还原糖之间的转换,以控制水果中的可溶性糖的组成和含量。例如,之前对桃子的研究表明,二硫苏糖醇处理可提高SS和SPS酶活性,降低AI酶活性,导致二硫苏糖醇处理后的果实中蔗糖含量增加[29]。而本实验研究发现,MeJA处理可以显著抑制AI、NI和SS酶活性,提高SPS酶活性,进而维持较高的总糖和蔗糖含量。
目前的数据表明,MeJA处理有效地防止荔枝果皮褐变,减缓失重率上升,维持较高的可溶性糖含量,抑制有机酸、酚类物质和GSH含量的下降,使得荔枝在贮藏20 d时仍维持较高的贮藏品质。研究结果进一步表明,MeJA应用可能是维持荔枝果实感官品质、风味和营养特性的有效途径。
[1] SU Z H, HU M J, GAO Z Y, et al.Apple polyphenols delay senescence and maintain edible quality in litchi fruit during storage[J].Postharvest Biology and Technology, 2019, 157:110976.
[2] YAO P F, GAO Y, SIMAL-GANDARA J, et al.Litchi (Litchi chinensis Sonn.):A comprehensive review of phytochemistry, medicinal properties, and product development[J].Food &Function, 2021, 12(20):9527-9548.
[3] LUO T, LI S S, HAN D M, et al.The effect of desulfurization on the postharvest quality and sulfite metabolism in pulp of sulfitated “Feizixiao” litchi (Litchi chinensis Sonn.) fruits[J].Food Science &Nutrition, 2019, 7(5):1715-1726.
[4] WERMUND U, GOYARD J, JAHIEL M, et al.The effect of different fumigation protocols and packaging material on litchi fruit from Madagascar with regard to quality and shelf life[J].Acta Horticulturae, 2014(1029):371-377.
[5] GUO X M, LI Q, LUO T, et al.Postharvest calcium chloride treatment strengthens cell wall structure to maintain litchi fruit quality[J].Foods, 2023, 12(13):2478.
[6] ALI S, KHAN A S, MALIK A U, et al.Pre-storage methionine treatment inhibits postharvest enzymatic browning of cold stored ‘Gola’ litchi fruit[J].Postharvest Biology and Technology, 2018, 140:100-106.
[7] LI L, YAN X Y, LI J.The prolonging effect of natural plant extracts on the storage period of postharvest litchi[J].Horticultural Science and Technology, 2021, 39(2):254-262.
[8] LIU J L, ZHANG W L, HU M J, et al.Nitric oxide is involved in melatonin-induced cold tolerance in postharvest litchi fruit[J].Postharvest Biology and Technology, 2023, 196:112157.
[9] XIE J, QIN Z Y, PAN J L, et al.Melatonin treatment improves postharvest quality and regulates reactive oxygen species metabolism in “Feizixiao” litchi based on principal component analysis[J].Frontiers in Plant Science, 2022, 13:965345.
[10] JIANG X J, LIN H T, SHI J, et al.Effects of a novel chitosan formulation treatment on quality attributes and storage behavior of harvested litchi fruit[J].Food Chemistry, 2018, 252:134-141.
[11] WANG S Y, SHI X C, LIU F Q, et al.Effects of exogenous methyl jasmonate on quality and preservation of postharvest fruits:A review[J].Food Chemistry, 2021, 353:129482.
[12] NU EZ-G
EZ-G MEZ V, BAENAS N, NAVARRO-GONZ
MEZ V, BAENAS N, NAVARRO-GONZ LEZ I, et al.Seasonal variation of health-promoting bioactives in broccoli and methyl-jasmonate pre-harvest treatments to enhance their contents[J].Foods, 2020, 9(10):1371.
LEZ I, et al.Seasonal variation of health-promoting bioactives in broccoli and methyl-jasmonate pre-harvest treatments to enhance their contents[J].Foods, 2020, 9(10):1371.
[13] LI J H, AZAM M, NOREEN A, et al.Application of methyl jasmonate to papaya fruit stored at lower temperature attenuates chilling injury and enhances the antioxidant system to maintain quality[J].Foods, 20, 12(14):274.
[14] ZHOU F H, JIANG A L, FENG K, et al.Effect of methyl jasmonate on wound healing and resistance in fresh-cut potato cubes[J].Postharvest Biology and Technology, 2019, 157:110958.
[15] LI T T, SHI D D, WU Q X, et al.Sodium para-aminosalicylate delays pericarp browning of litchi fruit by inhibiting ROS-mediated senescence during postharvest storage[J].Food Chemistry, 2019, 278:552-559.
[16] ZHOU J X, MIN D D, LI Z L, et al.Effects of chilling acclimation and methyl jasmonate on sugar metabolism in tomato fruits during cold storage[J].Scientia Horticulturae, 2021, 289:110495.
[17] 王银红, 张珮, 江靖, 等.四个荔枝品种采后低温贮藏品质指标差异分析及评价[J].食品工业科技, 2019, 40(22):288-293;299.
WANG Y H, ZHANG P, JIANG J, et al.Analysis and evaluation on the differences of indexes of postharvest quality in four litchi cultivars during low-temperature storage[J].Science and Technology of Food Industry, 2019, 40(22):288-293;299.
[18] 郭靖, 陈于陇, 王萍, 等.不同调湿包装对荔枝贮藏品质的影响[J].食品与发酵工业, 2021, 47(6):169-175.
GUO J, CHEN Y L, WANG P, et al.The effect of different packaging methodology on litchi quality during storage[J].Food and Fermentation Industries, 2021, 47(6):169-175.
[19] 帅良, 林德胜, 廖玲燕, 等.不同贮藏温度对百香果果实糖酸组分变化的影响[J].核农学报, 2023, 37(12):2408-2416.
SHUAI L, LIN D S, LIAO L Y, et al.Effect of different storage temperatures on the sugar and acid components of passion fruit[J].Journal of Nuclear Agricultural Sciences, 2023, 37(12):2408-2416.
[20] WANG L, SHAN T M, XIE B, et al.Glycine betaine reduces chilling injury in peach fruit by enhancing phenolic and sugar metabolisms[J].Food Chemistry, 2019, 272:530-538.
[21] DESHI V, HOMA F, TOKALA V Y, et al.Regulation of pericarp browning in cold-stored litchi fruit using methyl jasmonate[J].Journal of King Saud University - Science, 2021, 33(5):101445.
[22] DHAMI K S, SAGAR V R.Combinational effect of chemical treatments on quality of litchi (Litchi chinensis) during storage[J].The Indian Journal of Agricultural Sciences, 2021, 91(11):2394-3319.
[23] 蒋侬辉, 黄泽鹏, 刘伟, 等.电商物流包装贮运对‘翡脆’荔枝贮藏品质的影响[J].食品工业科技, 2019, 40(18):249-254.
JIANG N H, HUANG Z P, LIU W, et al.Effect of E-commerce logistics packaging and transportation on the storage quality of ‘Feicui’ litchi[J].Science and Technology of Food Industry, 2019, 40(18):249-254.
[24] TECHAVUTHIPORN C, JARERAT A, NIMITKEATKAI H.Short-term anoxic treatment of litchi fruit (Litchi chinensis Sonn.cv.Hong Huey) delays pericarp browning and maintains physicochemical quality during storage[J].The Horticulture Journal, 20, 92(3):207-215.
[25] OSORIO-ESQUIVEL O, ALICIA-ORTIZ-MORENO, VALENTE B  , et al.Phenolics, betacyanins and antioxidant activity in Opuntia joconostle fruits[J].Food Research International, 2011, 44(7):2160-2168.
, et al.Phenolics, betacyanins and antioxidant activity in Opuntia joconostle fruits[J].Food Research International, 2011, 44(7):2160-2168.
[26] TOM S-BARBER
S-BARBER N F A, ESP
N F A, ESP N J C.Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables[J].Journal of the Science of Food and Agriculture, 2001, 81(9):853-876.
N J C.Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables[J].Journal of the Science of Food and Agriculture, 2001, 81(9):853-876.
[27] ZHANG R F, ZENG Q S, DENG Y Y, et al.Phenolic profiles and antioxidant activity of litchi pulp of different cultivars cultivated in Southern China[J].Food Chemistry, 2013, 136(3-4):1169-1176.
[28] WANG H C, HUANG H B, HUANG X M, et al.Sugar and acid compositions in the arils of Litchi chinensis Sonn.:Cultivar differences and evidence for the absence of succinic acid[J].The Journal of Horticultural Science and Biotechnology, 2006, 81(1):57-62.
[29] ZHAO Y Y, TANG J X, BRUMMELL D A, et al.Abscisic acid alleviates chilling injury in cold-stored peach fruit by regulating the metabolism of sucrose[J].Scientia Horticulturae, 2022, 298:111000.