淡水鱼因其丰富的营养和独特的风味受到广大消费者青睐。据2023年《中国渔业年鉴》数据显示,2022年河北省淡水鱼产量最高的为鲤鱼,为10.7万t,但是用于加工的所有淡水鱼量仅为1.31万t,因此鲤鱼加工还有很大的发展空间。
将生物发酵技术运用于淡水鱼产品加工已受到广泛的研究和关注,尤其是能够缩短生产周期并提高产品安全性的定向接种发酵技术,不断被应用到实际生产中。随着发酵的进行,发酵鱼制品的各项理化指标也随之发生变化,其中最主要的是pH值和蛋白质的变化[1]。发酵菌种通过降低鱼肉pH值达到抑制腐败菌生长的目的。石建喜等[2]研究表明,接种了混合发酵剂的鲢鱼鱼肉在发酵过程中,其pH值在48 h内下降至4.23,同时氨基态氮和挥发性盐基氮(total volatile basic nitrogen,TVB-N)不断增加。胡永金[3]研究发现接种微生物菌株组的鱼肉蛋白发生严重水解,表现为非蛋白氮(nonprotein nitrogen,NPN)含量显著上升。ADAMS等[4]发现接种了乳酸菌和木糖葡萄球菌的鲢鱼香肠的蛋白发生了降解,并具有良好的质构特性。除此之外,发酵鱼制品的质构及持水力也是其重要属性,受到消费者的广泛关注。刘旭坤[5]研究表明发酵过程中,过度蛋白氧化使得鱼糜产品必需氨基酸含量下降,鱼糜的质构劣化,蛋白持水能力下降。ZHANG等[6]研究表明在发酵过程中,发酵鲤鱼质构得到了显著改善,同时鱼糜凝胶逐渐呈现三维网状结构,持水力也显著提高。赵跃[7]发现接种戊糖片球菌的罗非鱼糜香肠的质构显著高于自然发酵和热凝胶处理。大多数研究重点关注鱼肉发酵过程中的蛋白理化特性及质构、持水力等品质变化规律,但是发酵鱼制品的蛋白理化特性变化与质构及持水力的相关性及其相关调控机理仍需进一步探究。
因此本研究采用定向接种发酵技术,利用植物乳杆菌及模仿葡萄球菌作为混合发酵剂,其中植物乳杆菌是本实验室从市售酸泡菜中分离筛选出来的,具有较强的抗氧化能力[8];模仿葡萄球菌具有较强的产香能力[9]。测定鱼肉糜在接种发酵及后熟期间pH值、SDS-PAGE、肌原纤维蛋白的二硫键及总巯基含量、表面疏水性、硫代巴比妥酸反应物值(thiobarbituric acid reactive substances,TBARS)、TVB-N、质构及离心损失,着重研究鱼肉糜在发酵过程中的蛋白氧化降解、脂肪酸败及蛋白作用力等特性变化规律,探究发酵对鱼肉糜质构、持水力的影响及相关机制,从而完善对生物发酵技术的理解,为开发高质量的发酵淡水鱼制品提供坚实的理论依据,为提高我省水产品精深加工技术水平做出贡献。
1 材料与方法
1.1 材料与试剂
原料:从石家庄北国超市(益庄店)购买鲜活鲤鱼,体重1.5~2 kg/条。
菌种及试剂:植物乳杆菌(Lactobacillus plantarum)、模仿葡萄球菌(Staphylococcus simulans)来自于本学院益生菌实验室化学试剂:磷酸二氢钾、磷酸氢二钾、氯化钠、氯化镁,国药集团化学试剂股份有限公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoicacid),DTNB],翌圣生物科技(上海)股份有限公司;乙二醇二乙醚二胺四乙酸 (ethylene glycol tetraacetic acid, EGTA),上海麦克林生物科技有限公司。
1.2 仪器与设备
JM-JR51绞肉灌肠机,广东金正厨卫设备有限公司;FW2000高速分散均质机,上海弗鲁克流体机械制造有限公司;CT-3质构仪,美国博勒飞公司;3K15低温冷冻离心机,德国Sigma公司;SPX-250B生化培养箱,上海福玛实验设备有限公司;759CKT紫外可见分光光度计,上海菁华科技仪器有限公司;K9860全自动凯氏定氮仪,山东海能未来技术有限公司;PHS-3C pH计,上海雷磁仪器有限公司;165-8001小型垂直电泳仪,美国BIO-RAD公司。
1.3 实验方法
1.3.1 混合发酵剂制备
将冻干保存的植物乳杆菌及模仿葡萄球菌分别接种到液体MRS培养基中,在30 ℃培养箱中培养24 h,活化2次后,离心洗涤后收集菌体,将菌体与等体积蒸馏水混合均匀制成菌悬液,根据计数结果,两种菌活菌数均为109 CFU/g,并按照1∶1质量比制备成混合发酵剂。
1.3.2 发酵鱼肉糜制备
参照石硕等[10]方法,将新鲜鲤鱼从超市活运到实验室后,击打其头部,刮去鳞片,除去内脏,用流动水冲洗干净后取背部肉,并斩拌成鱼肉糜称重,按照每100 g鱼肉糜加入1.3 g食盐和1.3 g白砂糖比例称取食盐和白砂糖,取适量蒸馏水溶解食盐和白砂糖后与鱼肉糜混合均匀。最后将1.3.1节制备的混合发酵剂按质量比1∶100与鱼肉糜混合均匀。搅拌均匀后将灌肠机连接上偏氯乙烯材料的肠衣,灌制成长为20 cm,直径为3 cm的肠,且在肠衣上扎若干小孔用于排气。整个灌肠过程采用碎冰和冰袋给鱼肉糜降温。灌肠后的鱼肉糜作为发酵第0 h样品,此时还未形成“凝胶体”。将鱼肉糜置于37 ℃培养箱中(湿度85%)发酵一段时间(分别在发酵第12、24、36 h取样)后,在室温[(23±2) ℃]干燥后熟(分别在干燥后熟第1、3天取样)。
1.3.3 pH值测定
参照GB 5009.237—2016《食品pH值的测定》,称取绞碎的样品5 g与蒸馏水混合均质,定容至50 mL,室温下摇晃浸提0.5 h后滤纸过滤,取滤液用pH计测定。
1.3.4 肌原纤维蛋白的提取
将5 g样品剪碎并加入5 倍体积的10 mmol/L磷酸钾缓冲液(另含100 mmol/L NaCl, 2 mmol/L MgCl2, 1 mmol/L EGTA, pH 6.8),在冰浴条件下以12 000 r/min匀浆1 min。后用冷冻离心机离心(8 000×g,4 ℃,20 min),取沉淀,重复上述步骤2次,第3次用100 mmol/L NaCl溶液代替磷酸钾缓冲液。最后得到的沉淀作为肌原纤维蛋白,放4 ℃冰箱并在24 h使用。
1.3.5 SDS-PAGE
参照卢涵[11]的方法,采用双缩脲法测定肌原纤维蛋白含量,统一调节至2 μg/μL,即2 mg/mL。肌原纤维蛋白使用10%分离胶和4%浓缩胶,在电泳槽内倒入电极缓冲液,用微量注射器取10 μL样品加入浓缩胶的加样空中。调节电压至80 V电泳,至样品前沿刚好进入分离胶后,把电压提高到120 V,继续电泳直至溴酚蓝到达分离胶底部上方约1 cm,关闭电源。将凝胶放入固定液中固定1 h,然后放入考马斯亮蓝染色液中染色过夜,用蒸馏水漂洗数次,再用脱色液脱色,直到蛋白条带清晰。
1.3.6 总巯基及二硫键含量的测定
参照BENJAKUL等[12]及卢涵[11]的方法,采用分光光度计法测定肌原纤维蛋白的总巯基及二硫键含量。
1.3.7 表面疏水性的测定
参照贾娜等[13]方法并稍作改动,将鱼肉糜肌原纤维蛋白溶于20 mmol/L磷酸盐缓冲液(pH 7.0,含0.6 mol/L NaCl)中制备成4 mg/mL肌原纤维蛋白溶液,取1 mL蛋白溶液加入200 μL 1 mg/mL溴酚蓝溶液。另取1 mL 20 mmol/L磷酸盐缓冲液(pH 7.0含0.6 mol/L NaCl)加入200 μL 1 mg/mL溴酚蓝溶液作为对照。室温下振荡混匀10 min后8 000 r/min离心15 min。取上清液于595 nm波长处测定吸光度。溴酚蓝可与蛋白表面的疏水性氨基酸相结合,上清液中疏水性氨基酸越多,与溴酚蓝结合的就越多,剩余的溴酚蓝就越少,其吸光度A2就越低。蛋白表面疏水性以溴酚蓝结合量表示,计算方法如公式(1)所示:
溴酚蓝结合量![]()
(1)
式中:A1,对照组样品上清液的吸光度;A2,实验组样品上清液的吸光度。
1.3.8 TBARS值的测定
参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》。
1.3.9 TVB-N值的测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的半微量定氮法。
1.3.10 鱼肉糜质构的测定
参照卢涵[11]的方法并稍作改动,将鱼肉糜肠切成2 cm高的圆柱体,每组样品3个平行。采用CT-3质构仪进行测定,使用TA3/100探头,测定凝胶的硬度、弹性、胶着性及咀嚼性。设定条件探头调试速度为1 mm/s, 测试间隔时间为5 s,变形率为30%,每次2个循环。
1.3.11 鱼肉糜持水力的测定
参照卢涵[11]的方法并稍作改动,在50 mL离心管中加入适量玻璃珠,将定量滤纸折成漏斗状,固定在离心管中,在漏斗状滤纸中加入3 g鱼肉糜样品,离心机4 500×g离心15 min,取出称重。持水力计算如公式(2)所示:
(2)
式中:m1,离心前鱼肉糜样品质量,g;m2,离心后鱼肉糜样品剩余质量,g。
1.4 统计分析
采用SPSS(20.0)软件进行显著性分析,分别利用ANOVA中的Duncan法和LSD法比较不同发酵时间和不同处理方式样品的均值(P<0.05),用GraphPad Prism 8软件作图。
2 结果与分析
2.1 自然发酵及接种发酵鱼肉糜pH随时间的变化
如图1所示,自然发酵组及接种发酵组鱼肉糜pH值都呈下降趋势,发酵36 h后接种发酵组的pH值为4.24,显著低于自然发酵组的pH 4.80 (P<0.05),说明接种发酵能够产生大量有机酸使pH值显著下降,胡永金[3]认为发酵鱼糜的pH值降到4.5以下才能有效抑制腐败和致病菌,所以接种发酵更能保证发酵鱼糜食用安全性。pH值快速下降,不仅赋予发酵鱼肉糜独特的风味,同时也增加了发酵鱼糜的硬度、改善了质构。后熟过程中pH值变化趋于缓慢,其原因可能是某些微生物菌群大量生长繁殖,产生大量的胺类等碱性物质[14],这与下文的TVB-N值结果一致。
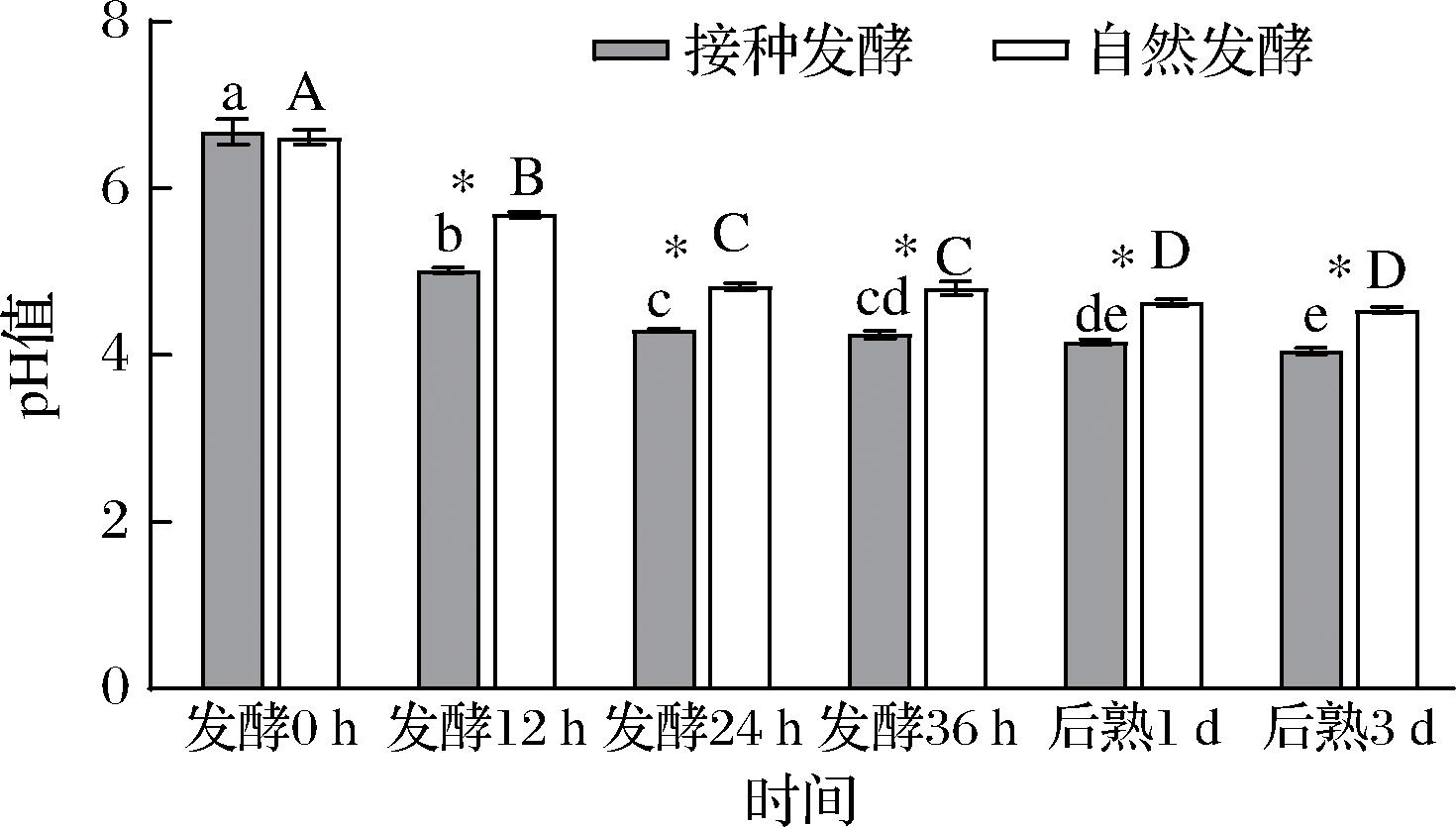
图1 发酵鱼肉糜pH值随时间的变化
Fig.1 pH value changes of fermented minced fish with time
注:不同大写字母代表自然发酵组不同时间下样品具有显著性差异(P<0.05),不同小写字母代表接种发酵组不同时间下样品不具有显著性差异(P<0.05),*代表自然发酵组和接种发酵组之间具有显著性差异(P<0.05)(下同)。
2.2 自然发酵及接种发酵鱼肉糜的TVB-N值随时间的变化
TVB-N是蛋白质被分解产生的氨及胺类等碱性含氮化合物,是肉制品新鲜度重要的评价指标之一,它的增加预示着发酵鱼肉糜腐败[15]。如图2所示,发酵36 h后,接种发酵组TVB-N值为9.92 mg/100 g,显著低于自然发酵组的13.70 mg/100 g(P<0.05),这和HONGTHONG等[16]的研究结果相似。一方面原因是接种发酵比自然发酵鱼糜pH更低,产生更多有机酸,更能中和碱性物质,使得TVB-N值未大幅提升,这与pH结果是一致的。另一方面是因为接种发酵后,植物乳杆菌和模仿葡萄球菌可能成为优势菌群,抑制了某些腐败菌对蛋白的降解从而降低碱性含氮化合物的生成。这表明接种发酵能够有效地控制鱼肉糜蛋白降解,有利于提高鱼肉糜品质。
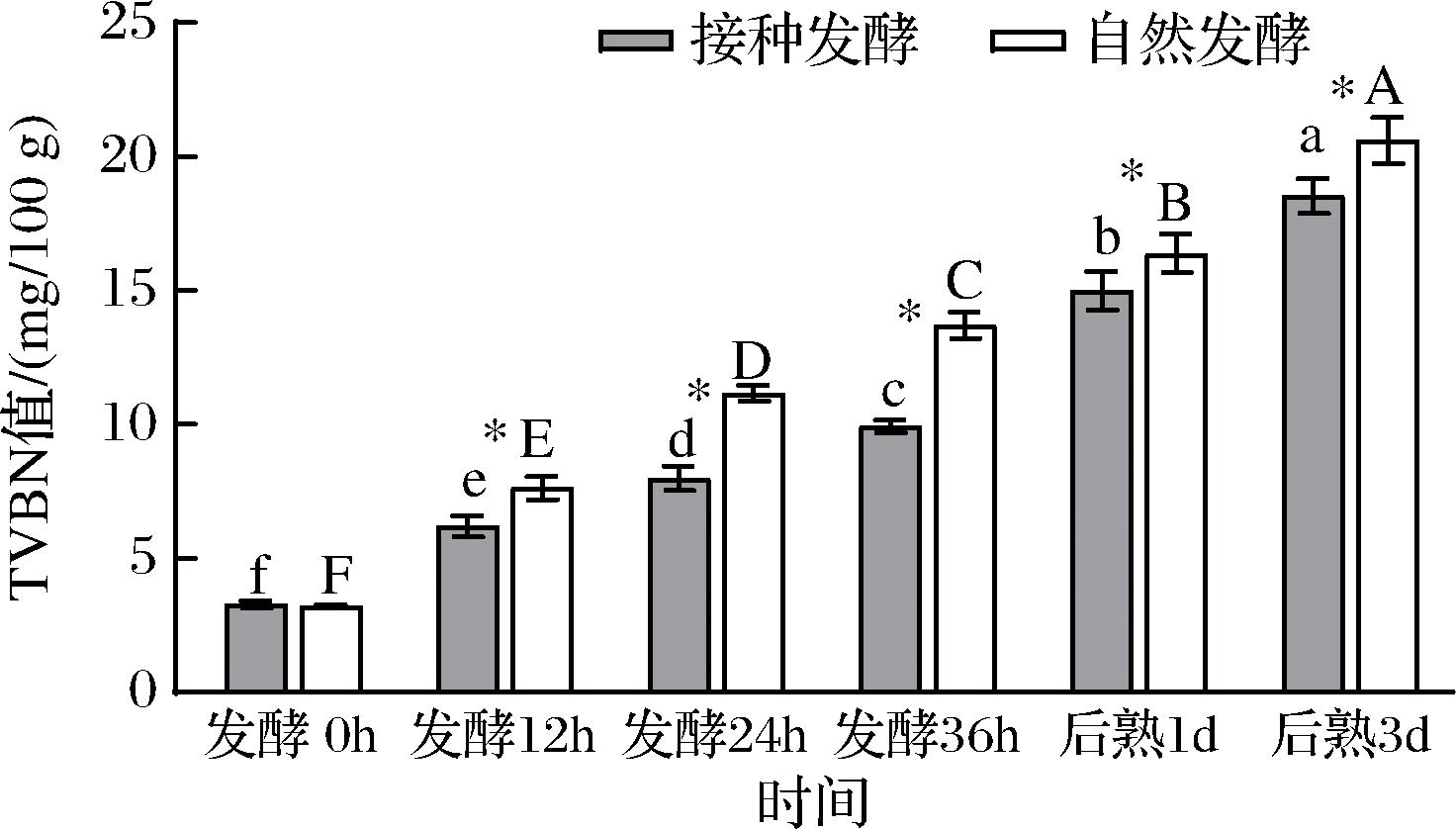
图2 发酵鱼肉糜TVB-N值随时间的变化
Fig.2 TVB-N value changes of fermented minced fish with time
2.3 自然发酵及接种发酵鱼肉糜肌原纤维蛋白SDS-PAGE随时间的变化
如图3所示,2组均观察到肌原纤维蛋白发生降解,尤其是肌球蛋白重链(myosin heavy chain, MHC)和肌动蛋白(actin)条带均随时间而变浅。其中MHC可能降解成了135 kDa左右的条带,这和ZHANG等[6]的发酵鲤鱼电泳结果相类似。在发酵12、24、36 h及后熟1、3 d时,自然发酵组的MHC条带比接种发酵组更浅,在发酵36 h后自然发酵组的MHC条带几乎消失。说明接种发酵可以抑制鱼肉糜蛋白MHC条带的降解。而发酵36 h以及后熟1、3 d接种发酵组的actin条带比自然发酵组浅,说明接种发酵组在发酵后期及后熟阶段actin降解得更多。
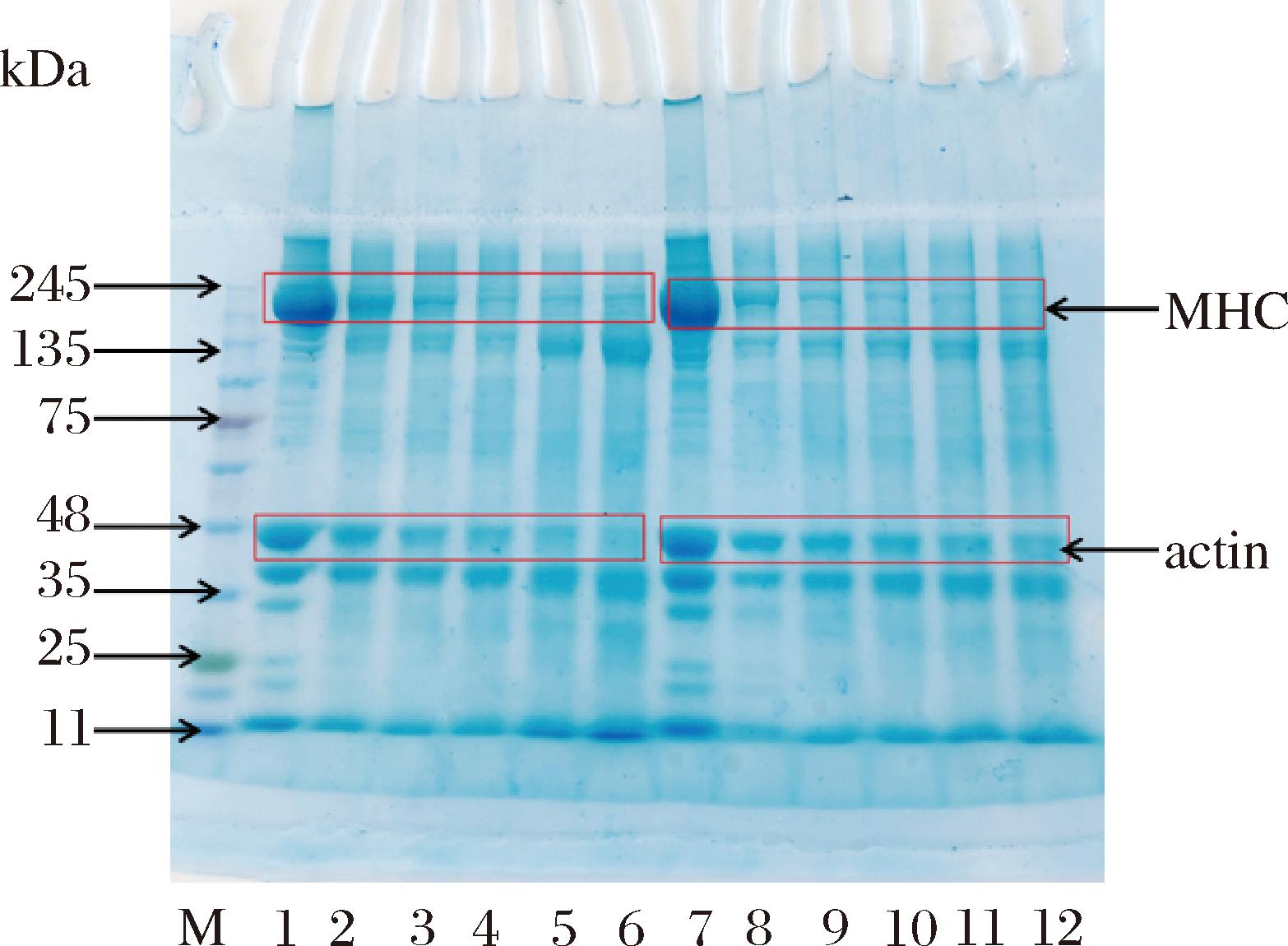
M-marker;1~6泳道代表接种发酵第0、12、24、36 h以及后熟1、3 d;7~12泳道代表自然发酵第0、12、24、36 h以及后熟1、3 d;MHC-肌球蛋白重链;actin-肌动蛋白
图3 发酵鱼肉糜肌原纤维蛋白SDS-PAGE随时间的变化
Fig.3 Myofibrillar protein SDS-PAGE of fermented minced fish with time
2.4 自然发酵及接种发酵鱼肉糜肌原纤维蛋白的总巯基含量随时间的变化
如图4所示,自然发酵及接种发酵鱼肉糜肌原纤维蛋白的总巯基含量均随着时间延长而显著下降(P<0.05),这是由于巯基在发酵过程中可被氧化生成多种氧化产物,包括二硫键,次磺酸(RSOH), 亚磺酸(RSO2H),磺酸(RSO3H), 二砜(disulfone)等[17]。巯基含量下降的越多,说明蛋白氧化越严重。并且在发酵24、36 h及后熟1、3 d时,接种发酵组鱼肉糜肌原纤维蛋白的总巯基含量显著高于自然发酵组(P<0.05)。这说明接种发酵组鱼肉糜的蛋白氧化程度低于自然发酵组。这可能是由于接菌的植物乳杆菌具有较强的清除自由基能力[8],从而可以抑制自由基导致的蛋白氧化,提高发酵鱼肉糜的氧化稳定性。
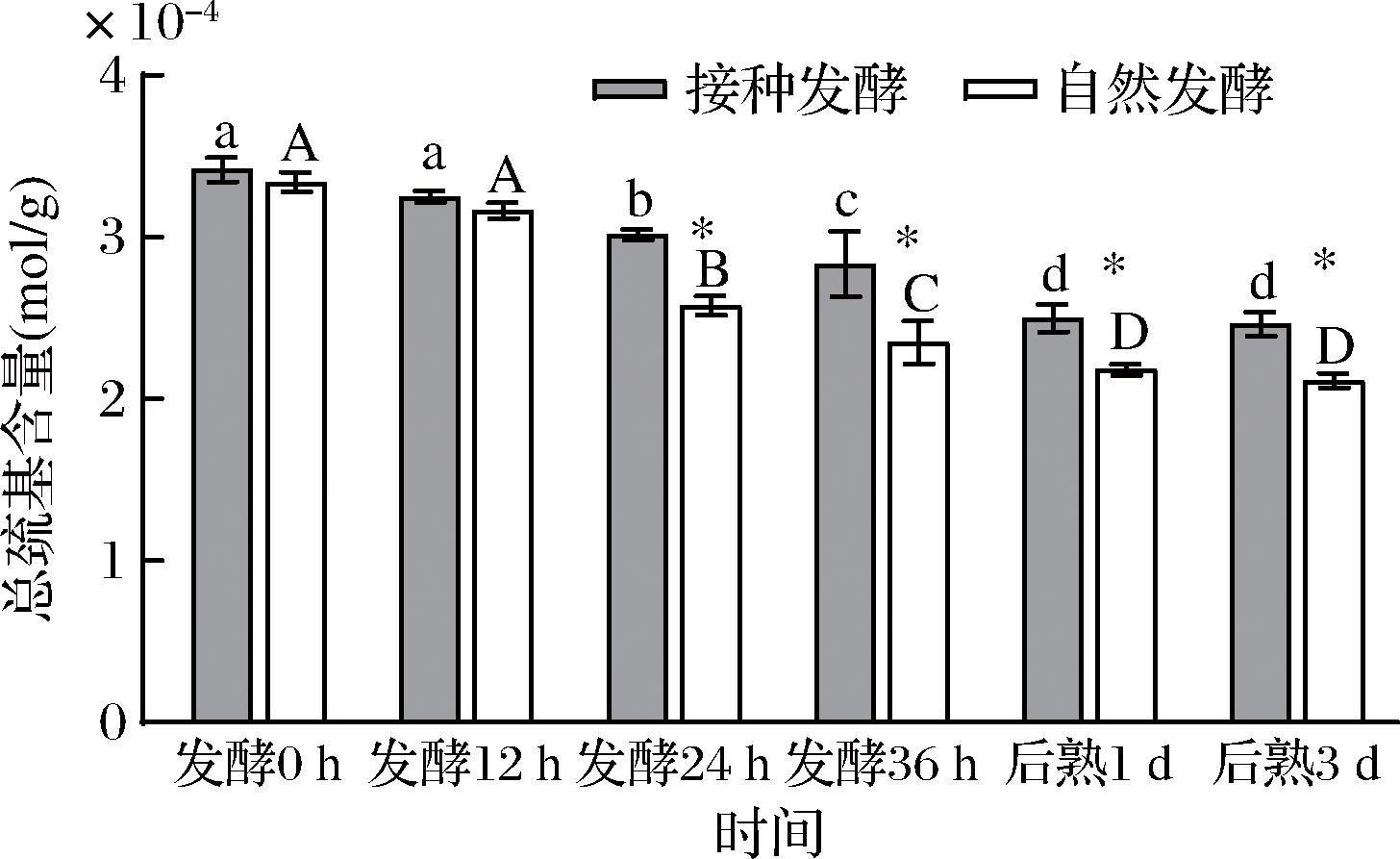
图4 发酵鱼肉糜肌原纤维蛋白总巯基含量随时间的变化
Fig.4 The changes of total sulfydryl contents in myofibrillar protein of fermented minced fish with time
2.5 自然发酵及接种发酵鱼肉糜的TBARS值随时间的变化
鱼肉中含有不饱和脂肪酸,在发酵过程中易被氧化酸败产生不良风味,TBARS值是衡量脂肪酸败程度的指标之一[3]。如图5所示,接种发酵及自然发酵组的TBARS值在发酵过程中都是呈显著上升趋势,这说明发酵过程中鱼肉糜的脂肪酸败在加剧。在整个发酵过程中,接种发酵组TBARS值显著低于自然发酵组(P<0.05),这和ZHANG等[6]的研究结果相似,这表明接种发酵能够有效地抑制发酵过程中鱼糜脂肪氧化酸败。可能是由于植物乳杆菌和模仿葡萄球菌在鱼糜发酵和成熟过程中能够产生超氧化物歧化酶及过氧化氢酶,分解发酵成熟过程中产生的过氧化物,从而抑制了脂肪氧化[18]。脂质氧化与蛋白氧化两者相互关联,某些脂质自由基和脂肪氧化产物会引发蛋白氧化[19]。TBARS值和巯基结果说明接种发酵既抑制脂肪氧化,也抑制了蛋白氧化。
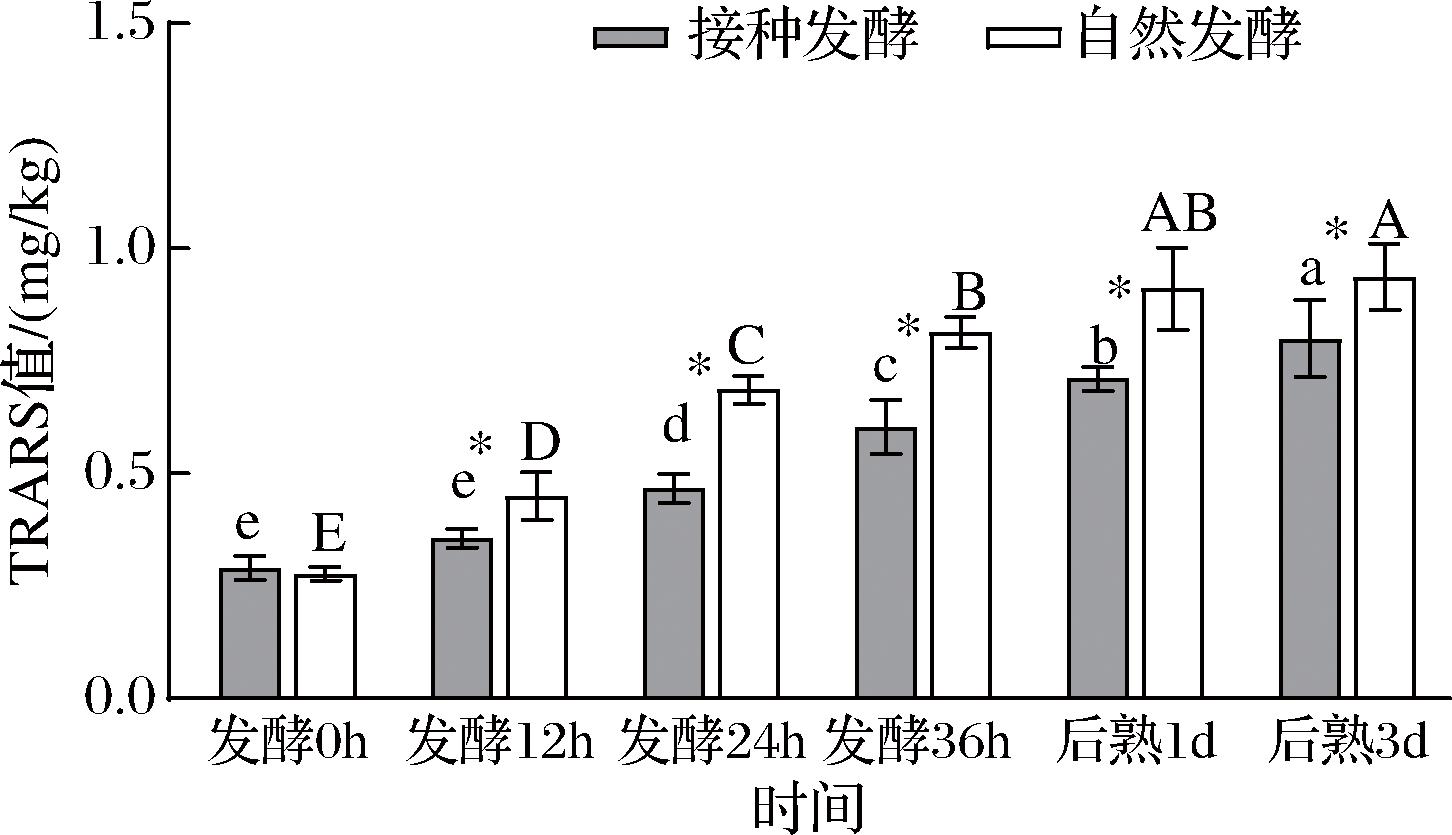
图5 发酵鱼肉糜TBARS值随时间的变化
Fig.5 TBARS values changes of fermented minced fish with time
2.6 自然发酵及接种发酵鱼肉糜肌原纤维蛋白的表面疏水性随时间的变化
表面疏水性可反映疏水性氨基酸在蛋白质表面的分布情况,与维持蛋白质构象的作用力密切相关。如图6所示,2组鱼肉糜肌原纤维蛋白的表面疏水性均呈现先下降后上升的变化趋势,其中在发酵24、36 h及后熟1、3 d时,接种发酵组鱼肉糜肌原纤维蛋白的表面疏水性均显著高于自然发酵组。这可能是由于在发酵过程中,pH值的下降导致蛋白构象发生改变,蛋白结构展开,较低pH值环境下更多的疏水性氨基酸残基暴露于蛋白表面[20]。疏水相互作用是蛋白凝胶形成过程中最主要的作用力,因此表面疏水性适当增加,可使更多的疏水基团参与到蛋白凝胶形成的过程中,从而有利于鱼肉糜质构特性。
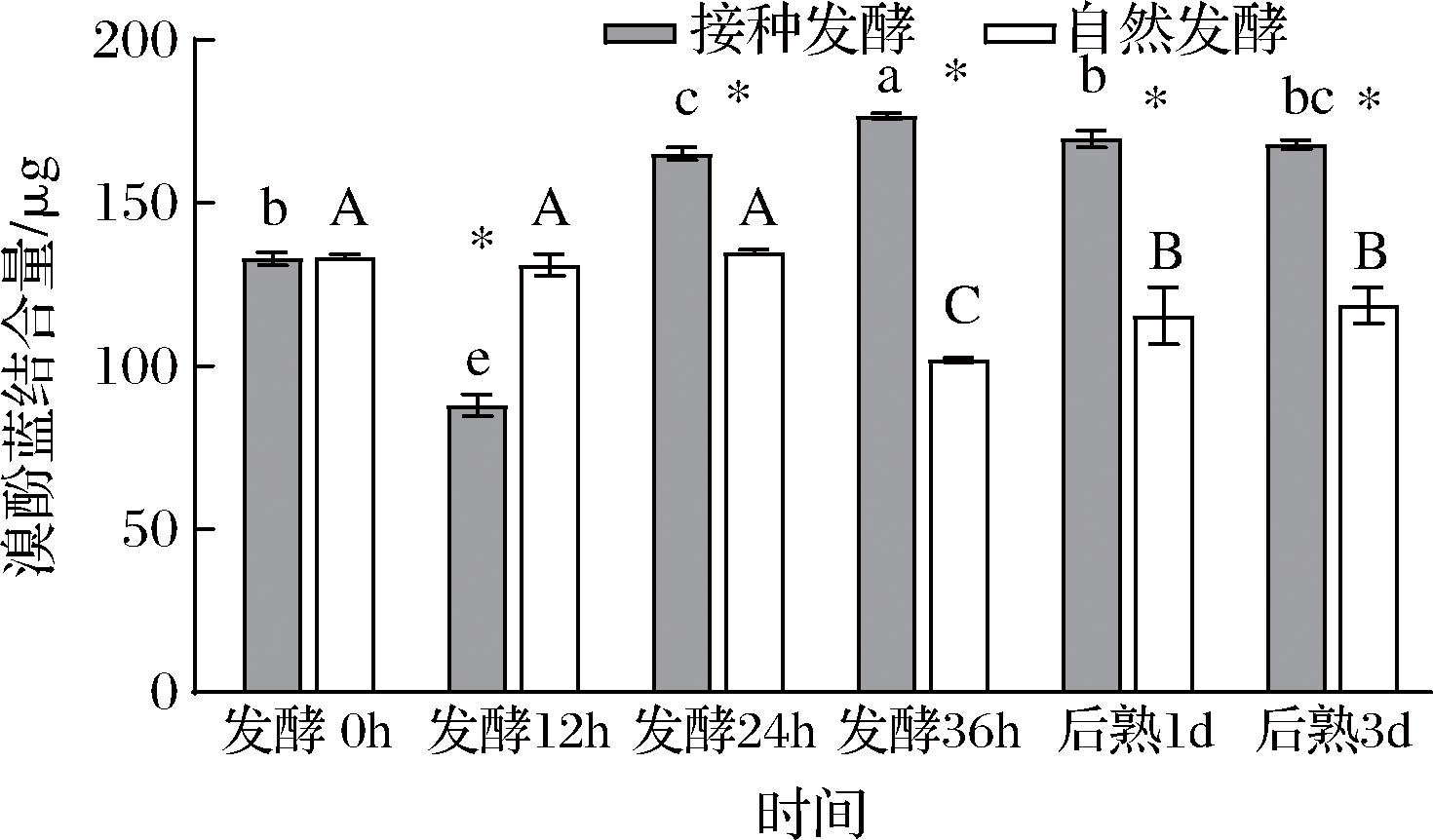
图6 发酵鱼肉糜表面疏水性随时间的变化
Fig.6 Surface hydrophobicity changes of fermented minced fish with time
2.7 自然发酵及接种发酵鱼肉糜肌原纤维蛋白的二硫键含量随时间的变化
如图7所示,自然发酵鱼肉糜肌原纤维蛋白的二硫键含量随着时间延长呈现先下降后上升趋势,发酵过程中,二硫键含量是一个动态变化的过程,这是由于二硫键随着发酵的进行既有生成又有消耗。二硫键的生成主要来源于巯基的氧化,而巯基氧化除了生成二硫键,还可能生成其他含硫衍生物,比如二硫化物、亚硫酸、亚磺酸、磺酸和硫代亚磺酸盐等[17]。二硫键的消耗主要是二硫键可进一步生成硫代亚磺酸酯(thiosulfinate)或硫代磺酸盐(thiosulfonate)[21-22]。推测自然发酵0~24 h二硫键含量先下降后上升可能是由于其消耗量大于生成量。BENJAKUL等[23]也同样报道过在-18 ℃下贮藏至第24周的金线鱼、大眼鲷鱼、狗母鱼、石首鱼肌原纤维蛋白中的二硫键含量均比初值下降。接种发酵鱼肉糜肌原纤维蛋白的二硫键含量一直呈现上升趋势。陈晓倩等[24]在棒状乳杆菌发酵秘鲁鱿鱼糜过程中也发现二硫键升高的类似结果。其中在发酵12、24、36 h及后熟1、3 d时,接种发酵组鱼肉糜肌原纤维蛋白的二硫键含量均显著高于自然发酵组。这可能是因为较低pH环境下蛋白构象发生改变,蛋白结构展开,巯基之间更容易发生交联形成二硫键[25]。
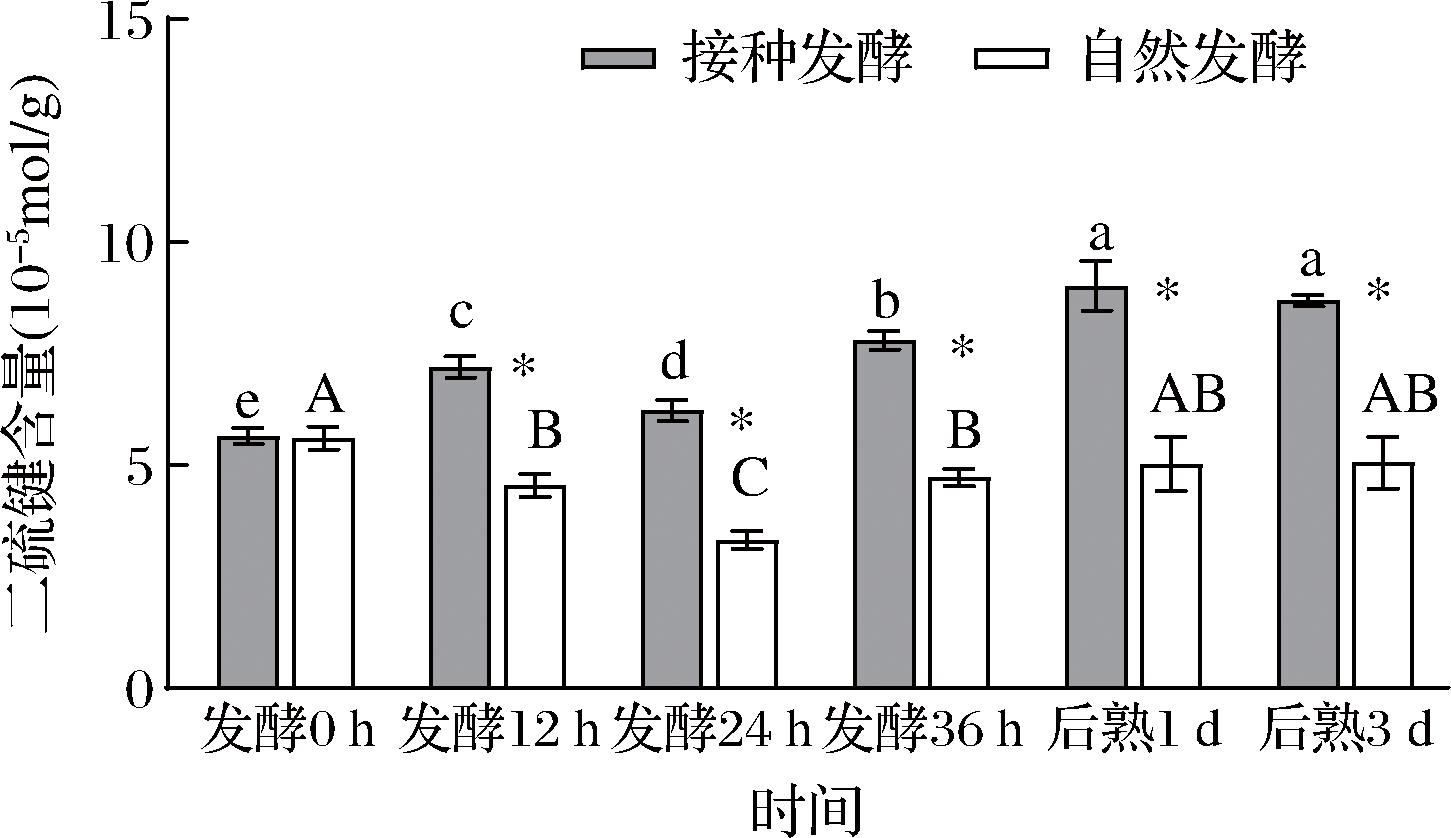
图7 发酵鱼肉糜肌原纤维蛋白二硫键含量随时间的变化
Fig.7 The changes of disulfide contents in myofibrillar protein of fermented minced fish with time
2.8 自然发酵及接种发酵鱼肉糜的质构特性随时间的变化
如表1所示,2组发酵鱼肉糜的硬度均随着时间延长而上升,这可能是由于发酵期间发酵鱼肉糜的pH值下降造成的[26]。类似地,XU等[27]认为pH值下降导致肌原纤维蛋白和肌浆蛋白变性聚集形成大分子物质,有利于硬度的提高。其中在发酵12、24、36 h及后熟1、3 d时,接种发酵组鱼肉糜硬度均显著高于自然发酵组,这可能与其较高的表面疏水性以及二硫键有关。2组鱼肉糜的弹性经发酵后均显著高于未发酵组(P<0.05),2组鱼肉糜的弹性在发酵24 h达到最高。2组鱼肉糜的弹性在0~24 h时显著上升,在发酵36 h以及后熟1~3 d时显著下降。发酵后期及后熟期间下降的原因可能是过多共价键的形成,这与二硫键上升结果一致。PÉREZ-MATEOS等[28]认为过多共价键的形成会导致凝胶硬度增加,弹性下降。2组发酵鱼肉糜的胶着性和咀嚼性的变化趋势类似,均随着时间延长而显著上升。其中在发酵12、24、36 h及后熟1、3 d时,接种发酵组鱼肉糜均显著高于自然发酵组(P<0.05)。这说明接种发酵比自然发酵能更好地改善鱼肉糜质构。
表1 自然发酵及接种发酵鱼肉糜的质构特性随时间的变化
Table 1 The changes of texture characteristics of fermented minced fish with time
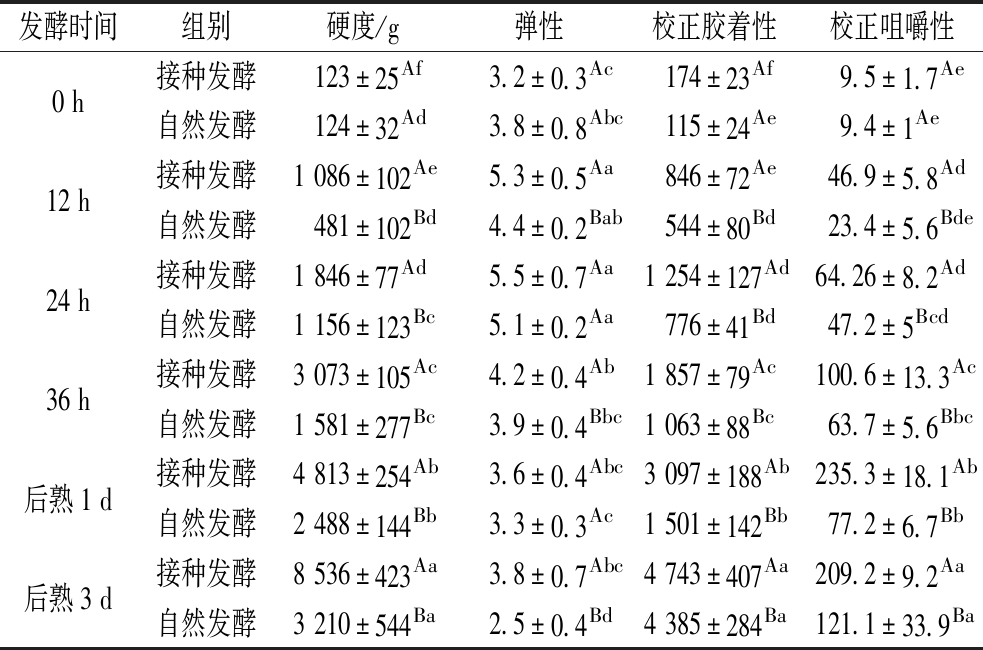
发酵时间组别硬度/g弹性校正胶着性校正咀嚼性0 h接种发酵123±25Af3.2±0.3Ac174±23Af9.5±1.7Ae自然发酵124±32Ad3.8±0.8Abc115±24Ae9.4±1Ae12 h接种发酵1 086±102Ae5.3±0.5Aa846±72Ae46.9±5.8Ad自然发酵481±102Bd4.4±0.2Bab544±80Bd23.4±5.6Bde24 h接种发酵1 846±77Ad5.5±0.7Aa1 254±127Ad64.26±8.2Ad自然发酵1 156±123Bc5.1±0.2Aa776±41Bd47.2±5Bcd36 h接种发酵3 073±105Ac4.2±0.4Ab1 857±79Ac100.6±13.3Ac自然发酵1 581±277Bc3.9±0.4Bbc1 063±88Bc63.7±5.6Bbc后熟1 d接种发酵4 813±254Ab3.6±0.4Abc3 097±188Ab235.3±18.1Ab自然发酵2 488±144Bb3.3±0.3Ac1 501±142Bb77.2±6.7Bb后熟3 d接种发酵8 536±423Aa3.8±0.7Abc4 743±407Aa209.2±9.2Aa自然发酵3 210±544Ba2.5±0.4Bd4 385±284Ba121.1±33.9Ba
注:不同小写字母代表相同的发酵组在不同时间下样品质构具有显著性差异(P<0.05),不同大写字母代表不同的发酵组在同一时间下样品质构具有显著性差异(P<0.05)。
2.9 自然发酵及接种发酵鱼肉糜的持水力随时间的变化
持水力被认为是影响肉制品质量的最重要因素之一,它代表肌原纤维蛋白与水结合的能力。如图8所示,2组发酵鱼肉糜凝胶的持水力在发酵期间显著增长,在发酵第12 h及第24 h发现接种发酵组鱼肉糜的持水力分别为76.3%及83.6%,显著高于自然发酵组的鱼肉糜此时的持水力69.7%及78%(P<0.05),这说明接种发酵比自然发酵在发酵初期(12、24 h)更有利于保持鱼肉糜水分,持水力更好。
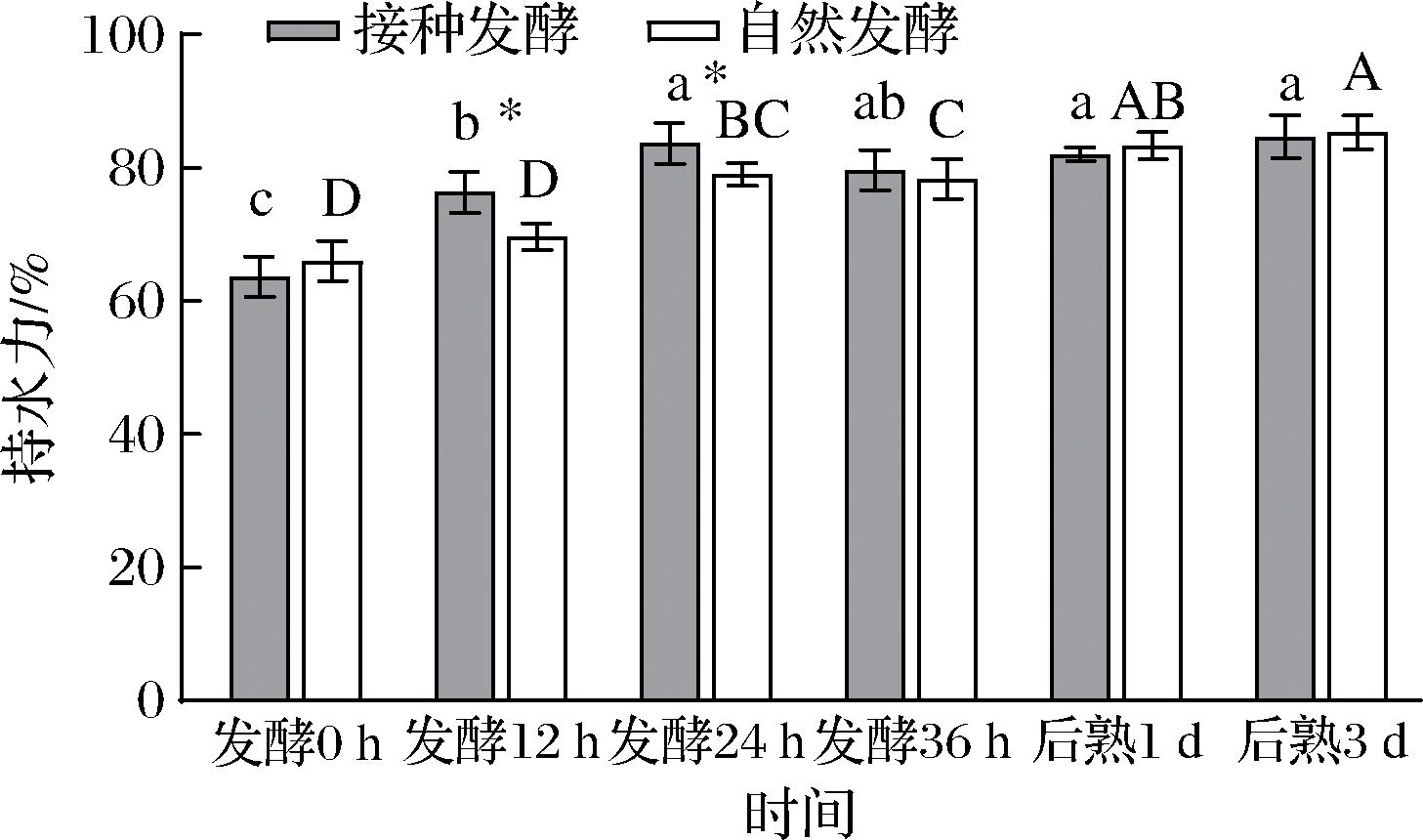
图8 发酵鱼肉糜的持水力随时间的变化
Fig.8 The changes in water holding capacity of fermented minced fish with time
3 讨论与结论
3.1 接种发酵改善了鱼肉糜的质构
本研究中,与自然发酵相比,接种发酵更有利于鱼肉糜的硬度,提高了其咀嚼性和胶着性及弹性,这与XU等[27]的研究结果类似,他们也发现采用接种发酵鲢鱼鱼糜,可形成致密的凝胶网络,增强其质构。究其原因一方面与pH值下降有关,有研究表明pH值下降导致蛋白结构改变,疏水基团外露,表面疏水性增加,巯基容易交联形成二硫键,二硫键以及疏水相互作用又是维持发酵鱼肉糜网络凝胶质构的主要作用力[29],因此接种发酵能够通过增加鱼肉糜肌原纤维蛋白的表面疏水性和二硫键来改善鱼肉糜凝胶质构,这与本实验中接种发酵组pH值显著低于自然发酵组,接种发酵组表面疏水性和二硫键含量显著高于自然发酵组相对应。另一方面与鱼肉糜蛋白和脂肪的氧化程度有关,有研究表明蛋白氧化会导致肽骨架断裂以及氨基酸侧链氧化,使得鲤鱼鱼肉质构劣化[30]。与自然发酵相比,接种发酵组的巯基含量更高,TBARS值更低,这说明接种发酵能够抑制鱼肉糜蛋白和脂肪氧化,因此其质构更好。除上述两点之外,质构还与鱼肉糜蛋白降解有关。有研究表明鱼肉糜蛋白的过度降解会破坏蛋白分子之间、蛋白质与脂肪之间的凝胶网络结构[14]。与自然发酵相比,接种发酵能够显著抑制蛋白降解,这与本文TVB-N和电泳结果相对应。综上所述,与自然发酵相比,接种发酵能够很好地改善鱼肉糜质构。
3.2 接种发酵提高了鱼肉糜的持水力
本研究中,与0 h相比,接种发酵组12 h、自然发酵组24、36 h时鱼肉糜的持水力均有所上升,而此时的pH值接近鱼肉糜的等电点。一般认为pH值在接近肌原纤维蛋白等电点时,蛋白质所带电荷最少,分子间斥力最小,肌原纤维蛋白分子间的空隙变小,水分被挤出,导致肌原纤维蛋白持水力下降。实际上,持水力高低的决定因素在于肌原纤维蛋白分子间的空隙大小。其空隙大小不仅会受pH值影响,还会受肌原纤维蛋白降解程度影响。本研究发现在发酵过程中鱼肉糜的肌原纤维蛋白,尤其是MHC有所降解,这可能导致蛋白结构有所改变,肌原纤维蛋白蛋白之间的空隙有可能变大,流动水从肌原纤维蛋白外部空间流到内部,使其持水力提高。ZENG等[31]研究表明肌原纤维蛋白发生降解引起了结构变化,导致细丝蛋白和骨架结构的膨胀,肌原纤维蛋白空间空隙变大,降低了流动水从蛋白内部到蛋白外部的压力,从而持水力上升。推测本研究中蛋白降解对肌原纤维蛋白之间空隙的影响可能比等电点对其影响更强,因此导致肌原纤维蛋白的持水力上升。
发酵初期(12、24 h)接种发酵组持水力显著高于自然发酵组,一方面可能与鱼肉糜凝胶质构结构有关,pH值下降引起蛋白质空间结构的改变会导致疏水相互作用增强[32],疏水相互作用作为维持凝胶结构主要的非共价作用力[29,33]。LI等[34]研究结果表明,适当的疏水相互作用能够改善凝胶网状结构,更多的水分子可固定于凝胶结构,促使凝胶中水分流动性减弱,从而提高鱼肉糜凝胶的持水力。与自然发酵相比,接种发酵在改善鱼肉糜凝胶质构的同时提高持水力,这与本试验的结果相一致。另外,接种发酵组持水力显著高于自然发酵组可能还与蛋白氧化有关。ESTÉVEZ等[35]认为蛋白氧化会造成蛋白的表面电荷及构象发生改变,有可能对蛋白极性基团与水分子之间的相互作用造成不良影响,导致蛋白持水力有所下降。与自然发酵组相比,接种发酵组巯基含量更高,其氧化程度较低,这可能也是造成接种发酵组样品具有较高持水力的原因。然而在发酵终点及后熟阶段终点两组的持水力并无显著差异,这可能跟两组鱼肉糜此时含水量均已大大下降有关。
综上所述,与自然发酵相比,经过植物乳杆菌及模仿葡萄球菌发酵的鱼肉糜,具有较高的表面疏水性和二硫键,较高的表面疏水性显示了蛋白质结构的展开,随后更多的巯基暴露被氧化形成了二硫键,二硫键又促进蛋白质间的相互交联,从而有利于鱼糜凝胶的形成并使鱼糜具有良好的质构。且接种发酵鱼肉糜的蛋白降解及蛋白氧化的程度较低,更有利于维持蛋白质分子之间、蛋白质与脂肪之间的凝胶网络结构,使得鱼肉糜具有更好的凝胶质构,在发酵初期也具有更好的持水力。植物乳杆菌及模仿葡萄球菌具有作为定向接种发酵剂的潜力,本研究为开发高质量的发酵淡水鱼制品提供了理论依据。
[1] 曾妮. 利用混合发酵剂制备冷冻草鱼碎肉肠的研究[D].南昌:南昌大学, 2016.
ZENG N.Study on frozen grass carp frittered meat sausages fermented by mixed starter cultures[D].Nanchang:Nanchang University, 2016.
[2] 石建喜,许艳顺,姜启兴,等.混合菌种和盐含量对发酵鲢鱼肉品质的影响研究[J].食品与生物技术学报, 2018, 37(11):1219-1224.
SHI J X,XU Y S,JIANG Q X, et al.Study on the fermented silver carp quality induced by mixed starter cultures and salt content[J].Journal of Food Science and Biotechnology, 2018,37(11):1219-1224.
[3] 胡永金. 淡水鱼糜发酵及其凝胶形成机理研究[D].无锡:江南大学, 2007.
HU Y J.Study on the fermented freshwater fishes surimi and its gel formation mechinism[D].Wuxi:Jiangnan Uniersity, 2007.
[4] ADAMS M R, COOKE R D, TWIDDY D R.Fermentation parameters involved in the production of lactic acid preserved fish-glucose substrates[J].International Journal of Food Science &Technology, 1987,22(2):105-114.
[5] 刘旭坤. 霉鱼加工过程中蛋白质变化对品质影响[D].南昌:江西科技师范大学, 2022.
LIU X K.Effect of protein changes on quality of mouldy fish during processing[D].Nanchang:Jiangxi Science &Technology Normal University,2022.
[6] ZHANG F R, ZENG Y D, WU J L, et al.Insights into the endogenous cathepsins on modori of fermented carp (Cyprinus carpio) sausage gels in acid environment[J].International Journal of Food Science &Technology, 2022, 57(9):5673-5688.
[7] 赵跃. 乳酸菌提高罗非鱼发酵鱼糜品质及风味的机制研究[D].上海:上海海洋大学, 2021.
ZHAO Y.Improvement mechanism of the quality and flavor in fermented tilapia surimi by lactic acid bacteria[D].Shanghai:Shanghai Ocean University,2021.
[8] 张香美,赵玉星,闫晓晶,等.1株具抑菌和抗氧化活性乳酸菌的筛选及鉴定[J].食品科学, 2018, 39(2):93-98.
ZHANG X M,ZHAO Y X,YAN X J, et al.Screening and identification of lactic acid bacterium with antimicrobial and antioxidant activity[J].Food Science, 2018, 39(2):93-98.
[9] 王海燕. 湖南腊肉源产香葡萄球菌的筛选、鉴定及其产香机理研究[D].北京:中国农业大学, 2005.
WANG H Y.Identification of Staphylococcu spp.isolated from hunan bacon and its mechanism of aroma·production[D].Beijing:China Agricultural University, 2005.
[10] 石硕,邓思杨,王浩,等.发酵镜鲤鱼糜肠在低温贮藏过程中的品质及氧化反应的比较[J].食品工业科技, 2018, 39(16):266-271.
SHI S,DENG S Y,WANG H, et al.Quality change and oxidation reaction of the mirror carp surimi sausage during the storage[J].Science and Technology of Food Industry, 2018, 39 (16):266-271.
[11] 卢涵. 鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学, 2017.
LU H.Protein oxidation, cathepsins activity and the quality changes of bighead carp (Aristichthys nobilis) during low-temperature storage[D].Beijing:China Agricultural University, 2017.
[12] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al.Physicochemical changes in pacific whiting muscle proteins during iced storage[J].Journal of Food science, 1997, 62(4):729-733.
[13] 贾娜,林世文,王乐田,等.没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响[J].食品科学, 2020, 41(22):1-7.
JIA N,LIN S W,WANG L T, et al.Effects of changes in sulfhydryl content and surface hydrophobicity of myofibrillar protein induced by gallic acid on its gel properties[J].Food Science,2020, 41(22):1-7.
[14] 李松林, 钱心睿, 张艺彤,等.发酵过程中乌鳢鱼糜的品质特征变化[J].食品科学,2024,45(2):203-210.
LI S L, QIAN X R, ZHANG Y T, et al.Changes in quality characteristics of snakehead surimi during fermentation[J].Food Science,2024,45(2):203-210.
[15] TAHIR H E, HASHIM S B H, KOMLA MAHUNU G, et al.Smart films fabricated from natural pigments for measurement of total volatile basic nitrogen (TVB-N) content of meat for freshness evaluation:A systematic review[J].Food Chemistry, 2022, 396:133674.
[16] HONGTHONG N, CHUMNGOEN W, TAN F J.Influence of sucrose level and inoculation of Lactobacillus plantarum on the physicochemical, textural, microbiological, and sensory characteristics of Isan sausage (Thai fermented pork sausage).[J].Animal Science Journal, 2020, 91(1):e13312.
[17] BISWAS S, CHIDA A S, RAHMAN I.Redox modifications of protein-thiols:Emerging roles in cell signaling[J].Biochemical Pharmacology, 2006, 71(5):551-564.
[18] 卢涵,张香美,彭澎,等.混合发酵剂对发酵香肠脂肪酸败和蛋白质氧化的影响[J].西北农业学报, 2019, 28(9):1552-1560.
LU H, ZHANG X M, PENG P, et al.Effects of mixed culture starters on the fat rancidity and protein oxidation of fermented sausage[J].Acta Agriculturae Boreali-occidentalis Sinica, 2019, 28(9):1552-1560.
[19] 冯美琴,张杰,孙健.模仿葡萄球菌接种对发酵香肠品质及氧化稳定性的影响[J].食品科学, 2022, 43(4):105-112.
FENG M Q,ZHANG J,SUN J.Effect of Staphylococcus simulans NJ201 inoculation on the quality and oxidative stability of fermented sausage[J].Food Science,2022, 43(4):105-112.
[20] JIANG L Z, WANG Z J, LI Y, et al.Relationship between surface hydrophobicity and structure of soy protein isolate subjected to different ionic strength[J].International Journal of Food Properties, 2015, 18(5):1059-1074.
[21] GARRISON W M.Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins[J].Chemical Reviews, 1987,87(2):381-398.
[22] WINTERBOURN C C, METODIEWA D.Reactivity of biologically important thiol compounds with superoxide and hydrogen peroxide[J].Free Radical Biology and Medicine, 1999,27(3-4):322-328.
[23] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al.Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J].Food Hydrocolloids, 2005,19(2):197-207.
[24] 陈晓倩,吴祖芳,翁佩芳.棒状乳杆菌发酵秘鲁鱿鱼糜凝胶特性的变化及其形成机理[J].食品科学, 2019, 40(4):186-191.
CHEN X Q, WU Z F, WENG P F.Changes in gel properties and formation mechanism of giant squid surimi (Dosidicus gigas) during fermentation by Lactobacillus coryneformis[J].Food Science, 2019, 40(4):186-191.
[25] JIANG Y, LI D H, TU J C, et al.Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation:The role of protein unfolding and cross-linking[J].Food Chemistry, 2021, 344:128587.
[26] YU D, FENG M Q, SUN J, et al.Protein degradation and peptide formation with antioxidant activity in pork protein extracts inoculated with Lactobacillus plantarum and Staphylococcus simulans[J].Meat Science, 2020, 160:107958.
[27] XU Y S, XIA W S, YANG F, et al.Protein molecular interactions involved in the gel network formation of fermented silver carp mince inoculated with Pediococcus pentosaceus[J].Food Chemistry, 2010, 120(3):717-723.
[28] PÉREZ-MATEOS M, LOURENÇO H, MONTERO P, et al.Rheological and biochemical characteristics of high-pressure-and heat-induced gels from blue whiting (Micromesistius poutassou) muscle proteins[J].Journal of Agricultural and Food Chemistry, 1997,45(1):44-49.
[29] 吴雪微,姜启兴,许艳顺,等.酸诱导鱼糜凝胶的酸化条件研究及凝胶特性分析[J].食品与机械, 2016, 32(12):17-21.
WU X W,JIANG Q X,XU Y S, et al.Study on acidizing conditions of acid-induced surimi gel and analysis of gel properties[J].Food &Machinery, 2016, 32(12):17-21.
[30] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D].哈尔滨:东北农业大学, 2013.
LI Y Q.Protein oxidation-induced structure and function changes of common carp (Cyprinus carpio) protein and its control technology[D].Harbin:Northeast Agricultural University,2013.
[31] ZENG Z, LI C, ERTBJERG P.Relationship between proteolysis and water-holding of myofibrils[J].Meat Science, 2017,131:48-55.
[32] CHEN J X, DENG T Y, WANG C, et al.Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J].Journal of the Science of Food and Agriculture, 2020,100(5):2 252-2 260.
[33] XIA W Y, MA L, CHEN X K, et al.Physicochemical and structural properties of composite gels prepared with myofibrillar protein and lecithin at various ionic strengths[J].Food Hydrocolloids, 2018,82:135-143.
[34] LI J H, ZHANG M Q, CHANG C H, et al.Molecular forces and gelling properties of heat-set whole chicken egg protein gel as affected by NaCl or pH[J].Food Chemistry, 2018,261:36-41.
[35] ESTÉVEZ M, VENTANAS S, HEINONEN M, et al.Protein carbonylation and water-holding capacity of pork subjected to frozen storage:Effect of muscle type, premincing, and packaging[J].Journal of Agricultural and Food Chemistry, 2011, 59(10):5435-5443.