活性干酵母是食品生产中广泛使用的发酵剂,其使用方便且易于保藏,在烘焙行业已有成熟的应用。酵母作为啤酒酿造的核心微生物,其活力活性及发酵性能对产品质量至关重要[1]。啤酒酵母根据其发酵特性分为艾尔型和拉格型两类。为方便使用,啤酒酵母被制成活性干酵母在啤酒行业广泛推广,据统计,2023年全球啤酒酵母使用量达到了236.77 万t,其中干酵母占比达75%左右[2]。尽管大多数商业化活性干酵母的品质能满足目前啤酒品类多样化发展的需求,然而拉格酵母,特别是一些非通用型拉格酵母菌株,由于缺乏对酵母遗传背景与抗逆机制的深入了解,在制备成干酵母后其发酵性能和生理特性都与商业化拉格活性干酵母产品存在显著差异,为啤酒行业的发展带来挑战。
研究表明在干燥前后,酵母细胞的形态特征、组成成分及活力活性受到显著影响。暴露于脂质过氧化、细胞收缩及渗透压胁迫等生理压力下,细胞器和细胞成分在结构和功能上均发生关键性变化。脱水过程损伤细胞壁成分并导致细胞质膜内陷,膜蛋白功能受损,进而降低细胞活力。在干燥失水压力下,酵母细胞启动应激响应机制,激活与抗逆性相关的基因,以维持内部稳态[3-5]。线粒体作为能量产生的基本细胞器,生成额外能量用以促进胞内应激响应及受损结构的修复[5-6]。海藻糖具有较高的玻璃化转变温度,能延缓自由基氧化等化学反应,并参与细胞质的玻璃化,在脱水过程中稳定膜结构[7-9]。
啤酒为世界三大饮料之一,随着啤酒行业的壮大及全球化发展,企业面临着酵母质量不一致的挑战。活性干酵母能有效应对这一问题。目前,国际上已有生产活性干酵母的企业能提供稳定的产品。然而,特定啤酒厂所使用的具有独特风味的酵母菌株往往难以更换。开发针对性的活性干酵母产品能够解决酵母管理和质量问题。本研究以常用的拉格啤酒酵母菌株为对象,跟踪干燥过程中活力活性以及海藻糖含量变化,并结合转录组数据分析,探讨干燥过程中的酵母生理变化及抗胁迫机制,旨在为活性干酵母制备提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及溶液配制
以常用的拉格啤酒酵母菌株M14、G03、W34/70、BF16、Pilsner、M84、AEB-Classic、S189、Diamond为研究对象;G03、M14、Pilsner为实验室保藏;W34/70、BF16、M84、AEB-Classic、S189、Diamond为市售活性干酵母菌株。
YPD培养基(g/L):葡萄糖20,酪蛋白胨20,酵母粉10,去离子水溶解后115 ℃,灭菌15 min。
0.5 mol/L三氯乙酸溶液(trichloroacetic acid,TCA):8.17 g三氯乙酸,去离子水溶解定容至100 mL。
蒽酮溶液:将0.2 g蒽酮溶解至80%的硫酸中,定容至100 mL,现配现用。
PBS:将0.24 g磷酸二氢钾、1.44 g磷酸氢二钠、8 g氯化钠、0.2 g氯化钾溶于800 mL超纯水中,盐酸调整pH值至7.4,最终定容到1 L,121 ℃,灭菌20 min。
1.1.2 实验试剂
葡萄糖、氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钠、浓硫酸等试剂,国药集团上海化学试剂公司;酪蛋白胨、酵母粉等试剂,生工生物工程(上海)股份有限公司;线粒体膜电位检测试剂盒、活性氧检测试剂盒,上海碧云天生物技术有限公司;ATP检测试剂盒,Promega公司。
1.2 仪器与设备
SW-CJ-1Cμ双人单面净化工作台,苏州净化有限公司;QYC2012恒温摇床,太仓市强乐实验设备有限公司;SPX-250生化培养箱,上海跃进医疗器械厂;化学发光酶标仪,上海闪谱生物科技有限公司;Bio-Tek多功能酶标仪,伯腾仪器有限公司;HVE-50高压蒸汽灭菌锅,日本HIRAYAMA公司;200 μL、1 mL等不同型号的移液枪,德国Eppendorf公司;HHS型电热恒温水浴锅,上海博讯事业有限公司;CX21显微镜,日本OLYMPUS公司;AL104电子天平,梅特勃-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 菌株及溶液配制
从保藏的甘油管中取200 μL酵母细胞接种于10 mL YPD试管中,于28 ℃下一级活化24 h,按1%接菌量加入到装有50 mL YPD的三角瓶中,于28 ℃二级活化24 h,最终按1%接菌量接入装有500 mL YPD的三角瓶中,于28 ℃下培养24 h。
1.3.2 样品干燥与复水
1.3.2.1 样品干燥与水分含量的测定
将培养24 h后的菌液于4 ℃下沉降过夜,6 000 r/min下离心10 min收集菌泥,按5 g分装至干燥皿中,并在35 ℃下烘干12 h,每2 h进行取样分别取得0、2、4、6、8、10、12 h酵母样本。采用恒重法测定酵母含水量变化,干燥样品在105 ℃烘箱中烘干6 h。称取烘干前后样品的质量,水分含量的计算如公式(1)所示:
水分含量![]()
(1)
式中:w0,烘干前坩埚中样品的质量,g;wi,烘干后坩埚中样品的质量,g。
1.3.2.2 样品复水
将培养24 h后的菌液于4 ℃下沉降过夜,6 000 r/min下离心10 min收集菌泥,按5 g分装至干燥皿中,并在35 ℃下烘干12 h,每2 h进行取样分别取得0、2、4、6、8、10、12 h酵母样本。加入10 mL去离子水至干燥不同时间的酵母样品中,于25 ℃下进行复水15 min后进行相关指标的检测。
1.3.2.3 细胞活性测定
采用美蓝染色法测定酵母活性变化[10],将干燥复水后的酵母菌液稀释至适合倍数,每毫升菌液滴加10 μL的美蓝染液染色5 min,在显微镜下用血球计数板采用五点取样法计数,蓝色为死亡菌体,用计数器分别记录死细胞数和细胞总数,如公式(2)所示:
细胞活性![]()
(2)
重复3次实验。
1.3.3 活力活性测定
1.3.3.1 胞内ATP水平分析
参照文献[10-11]所采用的检测方法。将干燥复水后的酵母样品用PBS洗涤2次后,重悬于PBS缓冲液中使菌浓达到1×107 CFU/mL,取1 mL样品于破壁管中,加入0.5 mm玻璃珠,在3 000 r/min条件下振荡1 min,冰上放置30 s,循环10次,随后在8 000 r/min条件下,离心5 min。取100 μL上清液,加入100 μL ATP检测液,混匀后用TECAN Infinite® 200多功能酶标仪进行检测,发光信号跟ATP的含量成正比。
1.3.3.2 线粒体膜电位(mitochondrial membrance potential,MMP)测定
参照碧云天生物技术有限公司增强型线粒体膜电位检测试剂盒说明书[11]。将干燥复水后的酵母样品用PBS洗涤2次后,重悬于PBS缓冲液中,调整菌浓为5×106 CFU/mL,取0.5 mL细胞样品,加入0.5 mL JC-1染色液于37 ℃避光反应20 min,随后用JC-1缓冲液洗涤细胞除去未结合的探针后,加入0.5 mL JC-1缓冲液重悬,在Bio-Tektronix多功能酶标仪检测荧光强度(测试条件:λex=485 nm,λem=590 nm)。
1.3.3.3 胞内活性氧(reactive oxygen species,ROS)含量测定
参考LEWINSKA实验方法[11],将干燥复水后的酵母样品用PBS洗涤2次后,重悬于PBS缓冲液中,用PBS洗涤2次并调整菌浓为1×107 CFU/mL取1 mL样品,加入1 μL DCFH-DA荧光探针,28 ℃避光反应30 min。反应结束后用PBS洗涤细胞除去未结合的探针。Bio-Tektronix多功能酶标仪检测荧光强度[11](测试条件:λex=488 nm,λem=525 nm)。
1.3.4 胞内海藻糖含量测定
参考GIBNEY等[8]的实验方法测定胞内海藻糖的含量,取1.5 mL干燥复水后的酵母样品,用PBS缓冲液稀释10倍后,取3 mL样品进行海藻糖实验,于8 000 r/min下离心5 min后,加入3 mL预冷的0.5 mol/L TCA,充分混匀后在25 ℃下放置40 min,于8 000 r/min下离心5 min,收集上清液,使用2 mL预冷的0.5 mol/L TCA溶液重悬菌体沉淀,重复提取1次。合并2次得到的上清液即为海藻糖提取液,将提取液在冰浴上放置10 min后,取1 mL海藻糖提取液加入4 mL蒽酮溶液,混匀后于沸水浴中反应10 min,冷却至室温后,在620 nm检测紫外吸光值。空白样品为1 mL TCA溶液。
1.3.5 转录组测序分析
将G03、M14、W34/70分别在35 ℃下干燥0、4、10 h,收集菌体样本,在华大基因的DNBSEQ平台一上进行转录组测序。首先用mRNA富集法对总RNA进行处理,用带有OligodT的磁珠富集有polyA尾巴的mRNA;随后,用打断buffer把获得的RNA片段化,随机的N6引物进行反转录,再合成cDNA二链形成双链DNA,通过特异的引物进行PCR扩增,得到单链环状DNA文库后上机测序。数据过滤后得到clean reads,将其比对到参考基因组上,之后进行新转录本预测,计算基因表达水平并根据需求检测不同样品之间的差异表达基因,并对差异表达基因做深入的聚类分析和功能富集分析。利用多种数据库进行功能注释,包括KEGG、GO、病原体-宿主相互作用数据库(Pathogen-Host Interactions,PHI)或病原体受体基因(Pathogen Receptor Genes,PRG)。
2 结果与分析
2.1 干燥过程中酵母的水分含量及干燥复水后酵母的活性变化
35 ℃恒温条件下,9株拉格酵母(BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、G03、Diamond)经过12 h干燥处理,每2 h取样分析水分含量和存活率(图1)。结果显示,干燥过程中,样品的水分含量和存活率逐渐降低。酵母样品的初始水分含量均约为80%。干燥12 h后,BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、G03、Diamond的水分含量分别为11.11%、7.68%、8.34%、9%、3.41%、8.49%、7.01%、6.88%和2.54%。酵母菌株的初始存活率均接近100%,但随干燥时间延长而差异增大。12 h后,BF16、AEB-Classic、M84、W34/70的存活率分别为75.34%、57.87%、46.04%、35.93%,Pilsner、S189、M14的存活率分别为26.7%、26.47%、21.28%,而Diamond和G03的存活率分别为18.07%和17.24%。
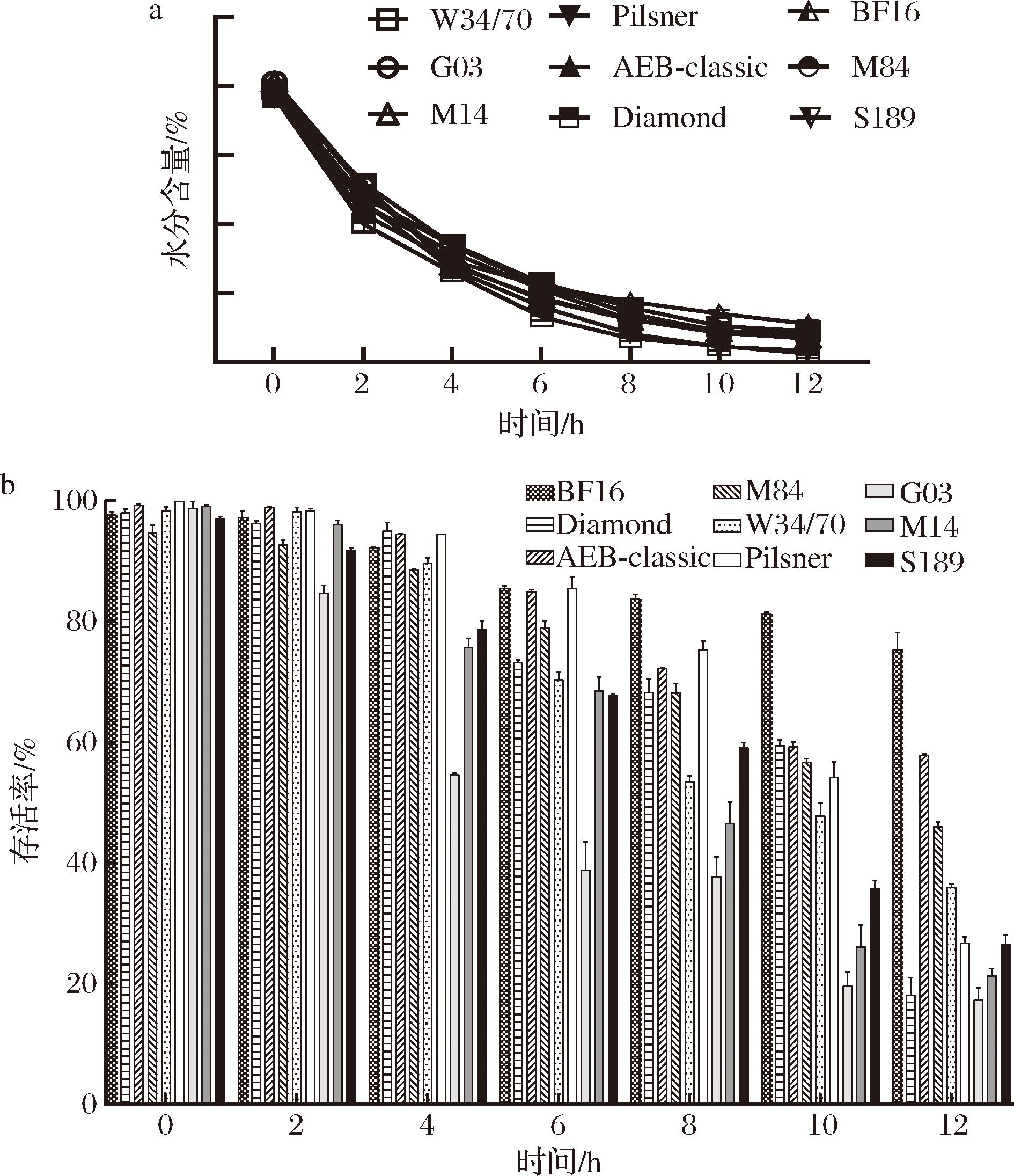
a-干燥过程中水分含量变化;b-干燥过程中酵母活性变化
图1 干燥过程中酵母水分含量及活性变化
Fig.1 Changes of moisture content and viability of yeast during drying process
35 ℃的恒温干燥条件下,9株拉格酵母的水分含量呈相似下降趋势。干燥结束时,BF16、AEB-Classic、M84、W34/70表现出较高的抗干燥能力,其次是Pilsner、S189、M14,而Diamond和G03抗干燥能力最弱。另外,在干燥过程中观察到2个显著的细胞死亡高峰期,分别位于4、10 h,因此,后期研究中重点关注了这2个干燥时间点的细胞活力及胞内海藻糖变化情况。
2.2 干燥复水后酵母的ATP含量变化
细胞的活力与胞内ATP含量密切相关[11]。为了评估酵母细胞内ATP含量与抗干燥能力之间的关系,本研究采用荧光反应法定量分析胞内ATP含量,并通过相对荧光单位(relative fluorescence units, RFU)来量化结果。分别在不同干燥时间点(0、2、4、6、8、10、12 h)测定了9株酵母菌(BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、Diamond、G03)的胞内ATP含量。干燥初始时,酵母胞内ATP含量相当,分别为108 790、100 218、95 850、109 523、108 636、98 773、102 668、102 098、103 841 RFU(图2)。
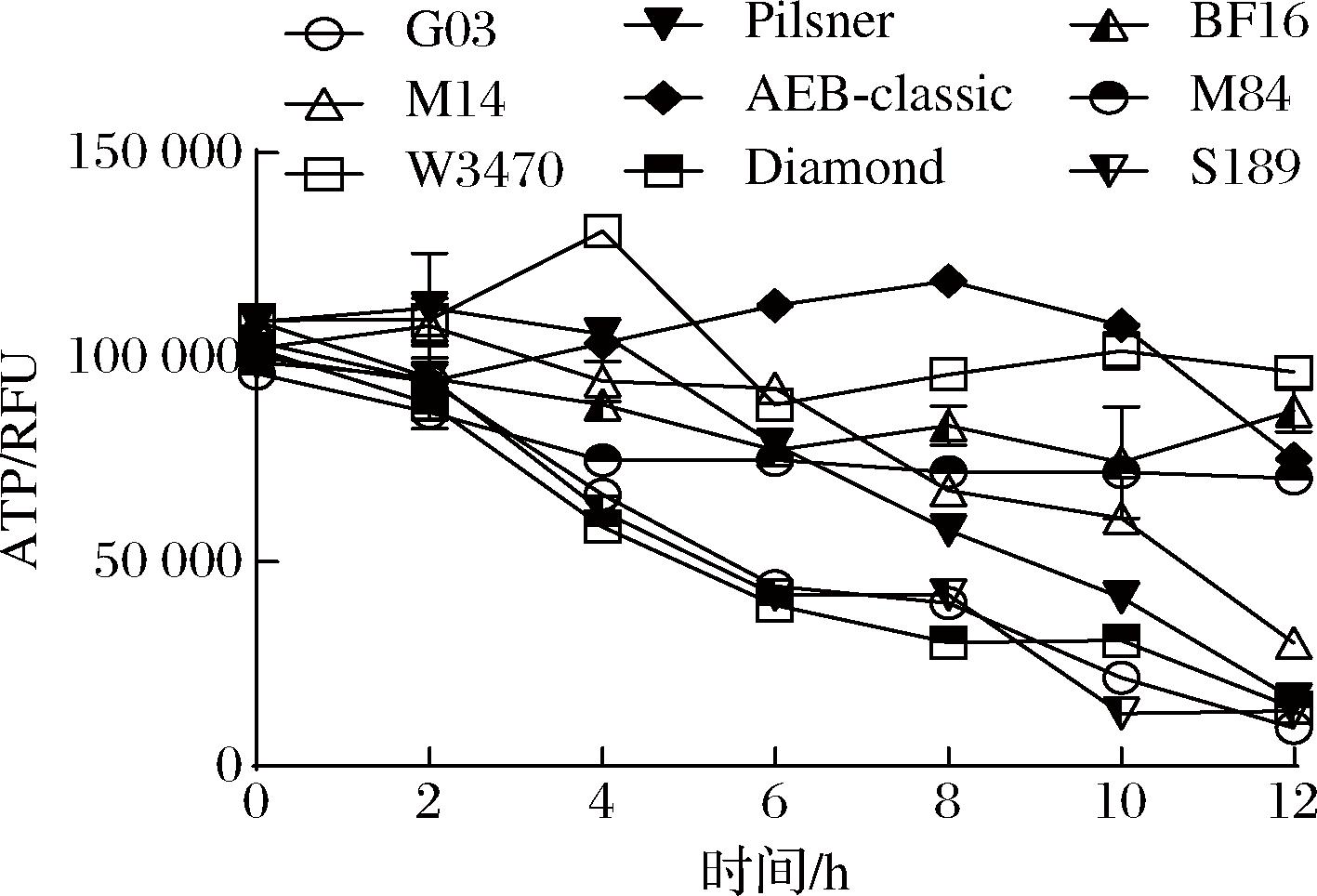
图2 干燥复水后酵母胞内ATP含量变化
Fig.2 Changes of ATP content in yeast cells after dehydration and rehydration
随着干燥时间的延长,抗干燥能力较弱的G03和Diamond菌株的胞内ATP含量显著降低。干燥12 h后,G03和Diamond菌株的胞内ATP含量降低至初始含量的9.11%和13.98%,抗干燥能力较强的Pilsner、S189、M14的胞内ATP含量为初始含量的15.18%、13.69%和29.35%,而抗干燥能力最强的BF16、AEB-Classic、M84、W34/70则分别为初始含量的79.95%、75.03%、73.5%和76.27%。在干燥胁迫下,M14、W34/70、Pilsner和AEB-Classic表现出ATP含量先上升后下降的趋势。干燥初期较高的ATP水平有利于细胞活力的保持。
2.3 干燥复水后酵母的MMP变化
MMP是线粒体能量代谢的重要指标,对维持线粒体生理功能至关重要[12-13],检测结果以RFU表示。如图3所示,9株酵母(BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、Diamond、G03)的初始MMP差异显著,G03初始MMP最低,仅有6 441.75 RFU,而BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、Diamond初始MMP值分别为G03的3.05、2.94、2.91、3.04、2.38、2.41、1.98、1.02倍。
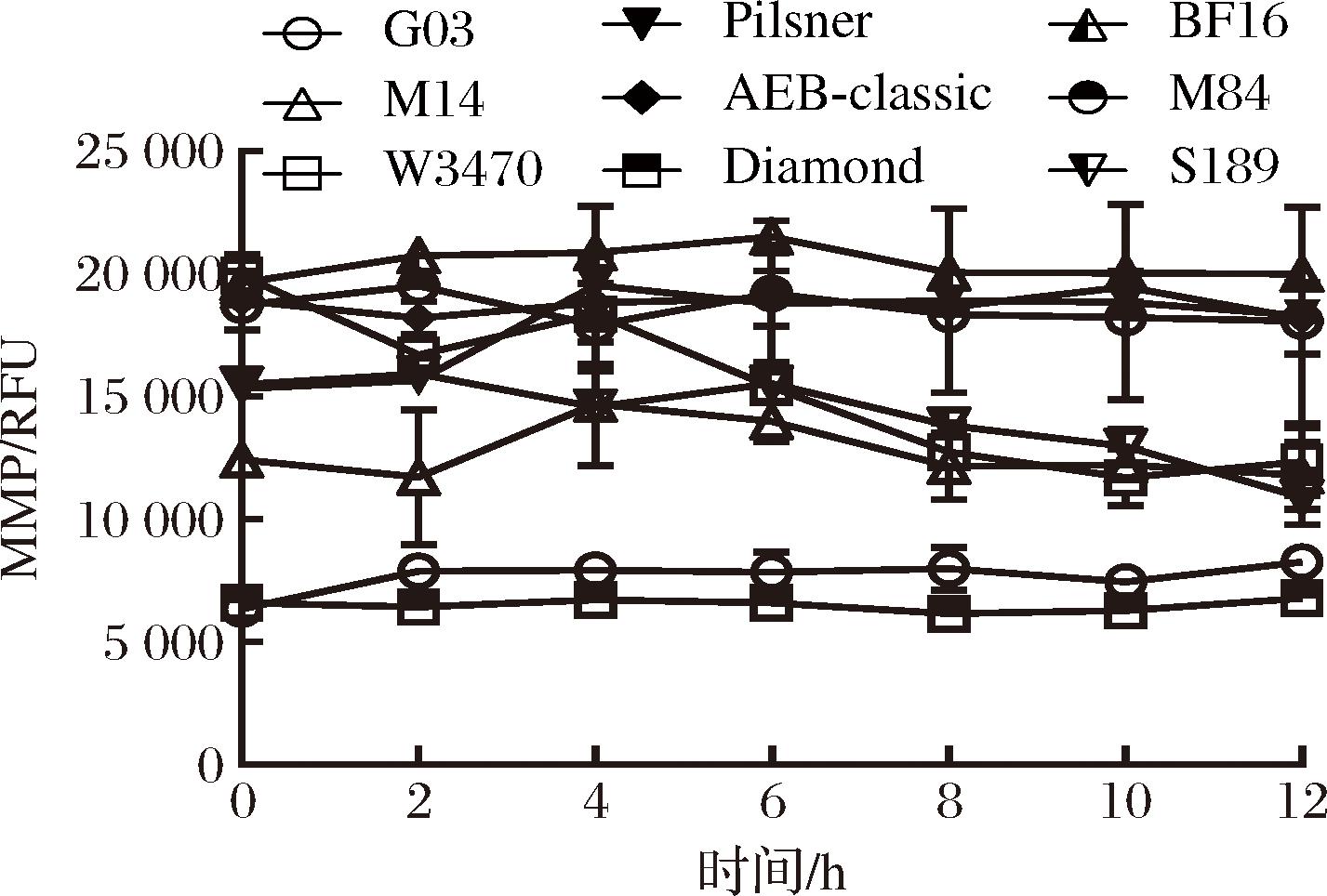
图3 干燥复水后酵母MMP变化
Fig.3 Changes of yeast MMP after dehydration and rehydration
随着干燥的进行,各菌株的MMP值基本保持稳定,但抗干燥能力最弱的Diamond和G03的MMP值始终低于其他菌株,干燥12 h后分别为6 783.05、8 305 RFU。相比之下,抗干燥能力较强的Pilsner、S189、M14其MMP值高于Diamond与G03,但低于抗干燥能力最强的BF16、AEB-classic、M84及W34/70。以上结果表明较高的初始MMP值有利于干燥胁迫下的细胞存活,MMP值越高,线粒体能量代谢越旺盛,有利于酵母菌株抵抗干燥胁迫。
2.4 干燥复水后酵母的ROS变化
ROS在生物体中维持在一定的稳态水平。但是在一些特殊情况下,如代谢紊乱、外部离子辐射等,细胞会出现氧化应激反应,进而引起ROS的大量积累,对细胞结构造成严重损害[14-15]。通过分析干燥过程对9株拉格酵母(BF16、AEB-Classic、M84、W34/70、Pilsner、S189、M14、Diamond、G03)胞内ROS含量的影响,结果发现干燥过程中,各菌株的胞内ROS含量出现不同程度的增加(图4)。
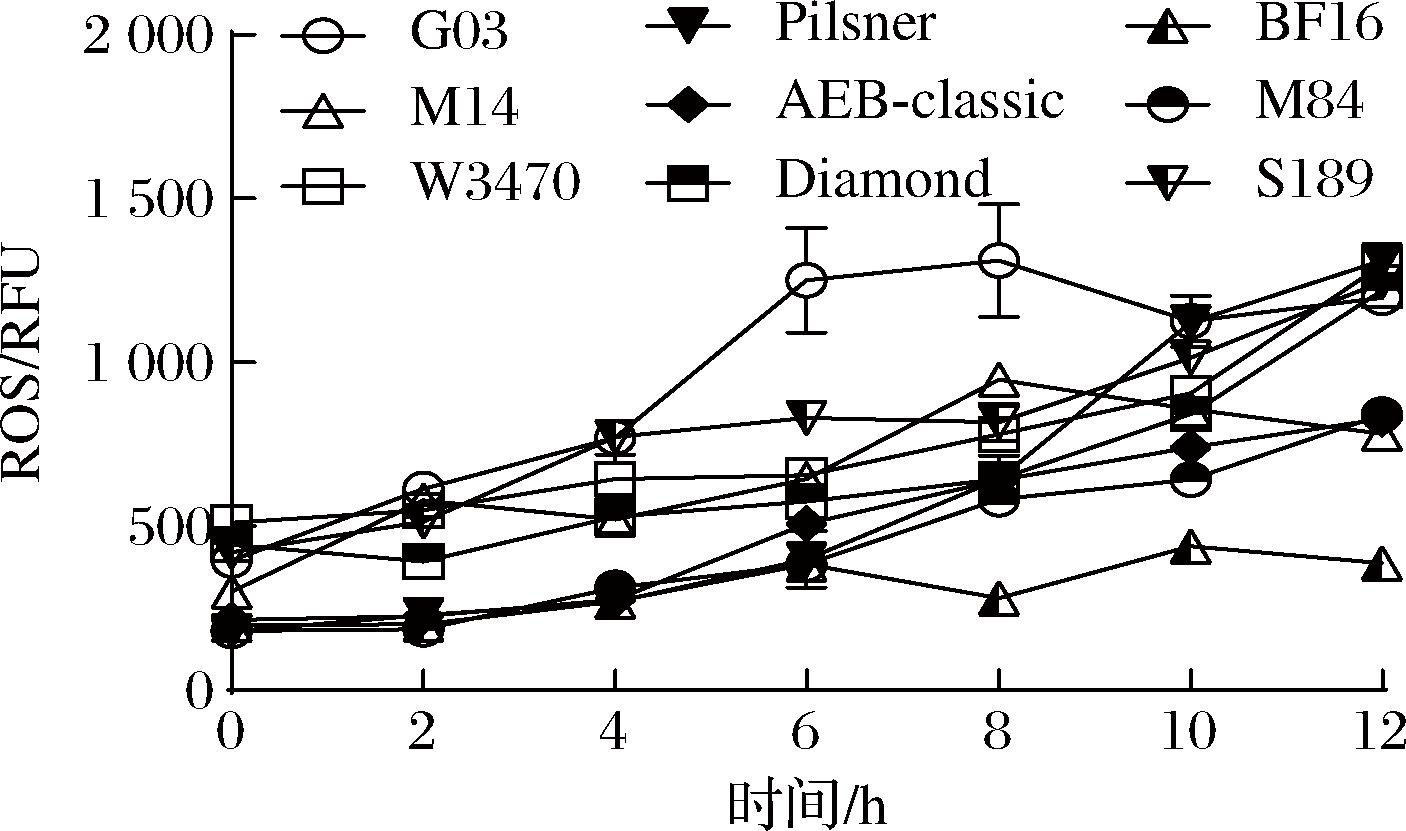
图4 干燥复水后酵母胞内ROS水平变化
Fig.4 Changes of yeast intracellular ROS level after dehydration and rehydration
干燥4 h时,G03胞内ROS含量增加最显著,其含量达到了初始水平的194.83%,各菌株胞内ROS增加的幅度如下:G03>S189>M84>M14>Pilsner>BF16>AEB-Classic>W34/70> Diamond;干燥至10 h时,G03胞内ROS含量出现较大涨幅,至初始含量的316.27%,各菌株的ROS含量变化如下:Pilsner>M84>AEB-Classic>G03>M14>S189>BF16>Diamond>W34/70。虽然在干燥结束时,W34/70和Diamond菌株的胞内ROS水平较高,但结合干燥过程来看,其ROS变化率较小,过程中产生的ROS自由基被胞内的抗氧化物质及时清除。由此可见抗干燥能力较强的酵母ROS增长较慢,反映出较强的抗氧化性能,从而在干燥条件下具有更好的存活潜力。
2.5 干燥复水后酵母的胞内海藻糖含量变化
海藻糖是一种关键的碳水储备化合物,参与细胞对热、渗透、氧化和乙醇胁迫的响应[8, 16],它通过稳定细胞结构,提高酵母对环境压力的抵抗力[17]。海藻糖具有较高的玻璃化转变温度,有助于延缓如自由基氧化等化学反应;同时,在脱水条件下保护核酸和蛋白质等大分子免受损害[9, 18-19]。
选取抗干燥能力具有显著差异的酵母菌株G03、M14、W34/70进行胞内海藻糖含量的分析,结果如图5所示,G03、M14、W34/70的初始胞内海藻糖含量分别为0.204、0.358、0.462×10-3 pg/cfu。干燥4 h时,3株菌的胞内海藻糖含量分别上升至初始含量的118.13%、127.65%、151.3%,随后3株菌的胞内海藻糖含量均逐渐下降,干燥12 h后,其含量分别降至初始含量的55.35%、30.69%、71.9%。尽管3株菌的胞内海藻糖含量变化趋势一致,但是抗干燥能力最强的W34/70的胞内海藻糖含量一直高于其他2株酵母,推测其与酵母的抗干燥能力有密切联系。
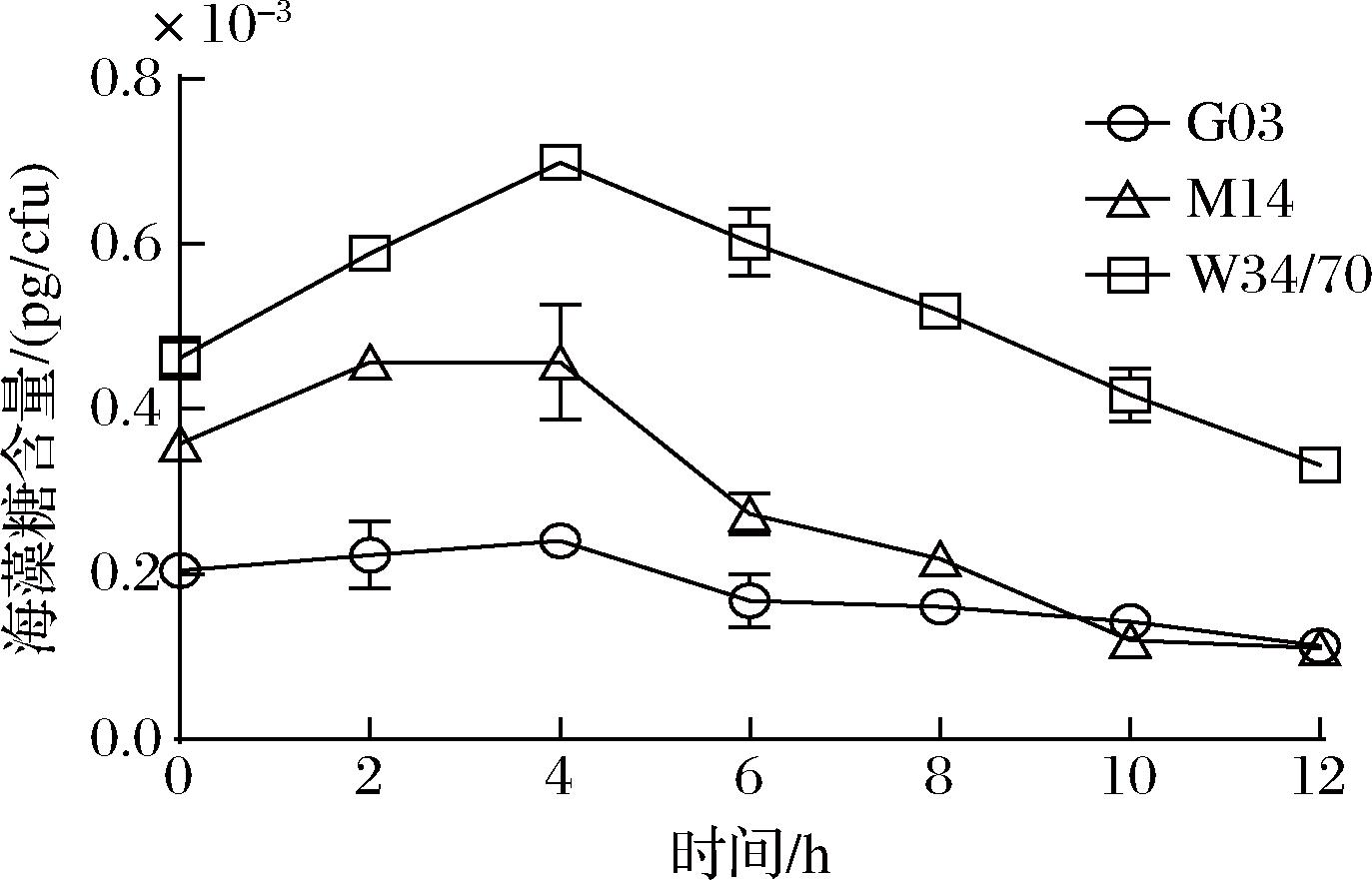
图5 干燥复水后酵母胞内海藻糖含量变化
Fig.5 Changes of trehalose content in yeast after drying and rehydration
2.6 干燥过程中的酵母转录组分析
为深入了解酵母在干燥过程中的应激响应机制,选取抗干燥能力不同的G03、M14、W34/70进行转录组分析。在35 ℃下,收集干燥0、4、10 h的细胞样本,每组3个重复,探究干燥条件下酵母细胞的转录水平变化。如图6所示,干燥胁迫条件显著影响了各基因的表达,G03在干燥4 h后上调基因2 121个,下调基因2 197个,干燥10 h后上调基因1 868个,下调基因1 659个;M14在干燥4 h后上调基因1 241个,下调基因1 266个,干燥10 h后上调基因1 715个,下调基因1 614个;W34/70在干燥4 h后上调基因1 802个,下调基因1 659个,干燥10 h后上调基因1 673个,下调基因1 827个。
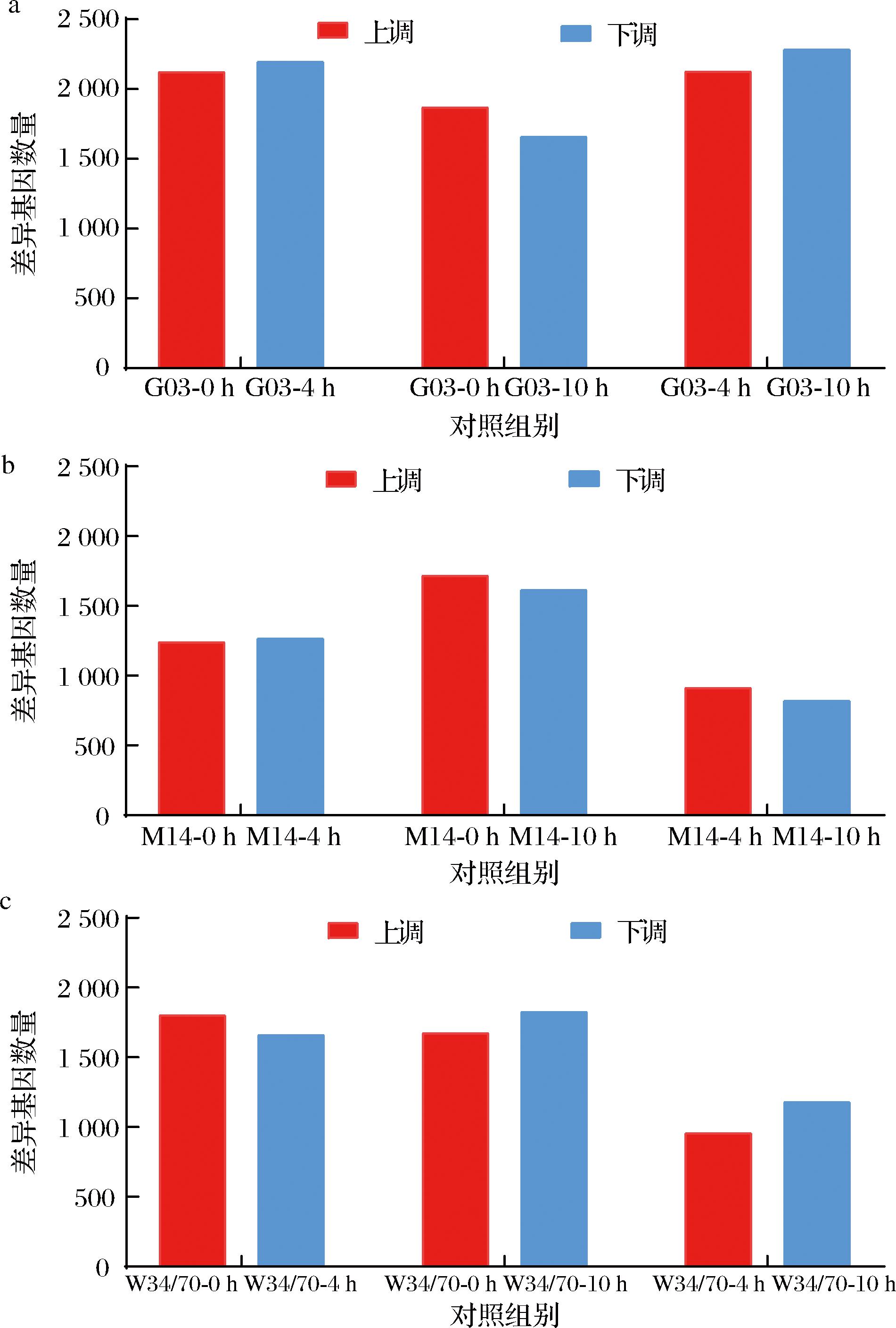
a-G03差异基因统计;b-M14差异基因统计;c-W34/70差异基因统计
图6 差异基因数量统计
Fig.6 Differential expressed genes during drying process
基于上述研究发现的各菌株胞内海藻糖变化与其抗干燥能力之间存在正相关性,且具有较高能量代谢水平的酵母其抗干燥能力较好,进一步探究了3株拉格酵母在不同干燥时间点的胞内海藻糖水平及氧化磷酸化相关的基因表达变化。通过计算干燥4、0 h、干燥10、0 h、以及干燥10、4 h的基因表达比值,并将其对数值(log2)通过热图形式展示。
酵母胞内海藻糖的代谢涉及NTH1、NTH2、TPS1、ATH1以及TPS2基因[9, 17]。海藻糖的生物合成由TPS1编码的海藻糖-6-磷酸合成酶(trehalose 6-phosphate synthetase,TPS)启动,并由TPS2编码的海藻糖-6-磷酸磷酸酶(trehalose 6-phosphate phosphatase,TPP)与完成。该过程影响糖酵解,其中中间体海藻糖-6-磷酸能抑制糖酵解的关键酶,参与调控能量代谢。如图7所示,干燥4 h时,TPS1在G03、M14、W34/70中均发生了上调,分别上调了0.71、0.84、0.88倍,当干燥10 h时,其上调倍数与4 h相比均有所下降。TPS2基因的调整在三者之间存在差异,干燥4 h时,TPS2在G03、M14、W34/70内分别上调0.58、0.70、1.46倍,其中W34/70的上调倍数最高;干燥10 h时,W34/70中TPS2基因表达继续上调,而M14中TPS2基因表达量保持不变,G03的TPS2基因表达下调。TPS2基因表达的差异可能是造成各菌株间胞内海藻糖含量差异的原因之一。NTH2和ATH1分别编码中性和酸性海藻糖水解酶,在应对逆境时,NTH2和ATH1编码的海藻糖酶能够分解贮存的海藻糖,释放出葡萄糖,有助于酵母细胞产生ATP,以维持细胞功能。干燥4 h时,NTH2在G03中下调0.23倍,在M14中保持不变,在W34/70中上调0.24倍,与干燥4 h相比,干燥10 h时,NTH2在G03和M14中发生上调,分别上调0.34、0.24倍,在W34/70中下调0.20倍。ATH1在干燥4 h时,在G03、M14中基因表达量不变,在W34/70中下调0.21倍,随后干燥10 h时,在G03、M14以及W34/70中均出现上调,分别为0.21、0.11与0.09倍。NTH2和ATH1基因表达的差异,也是造成了海藻糖含量的差异的原因之一。
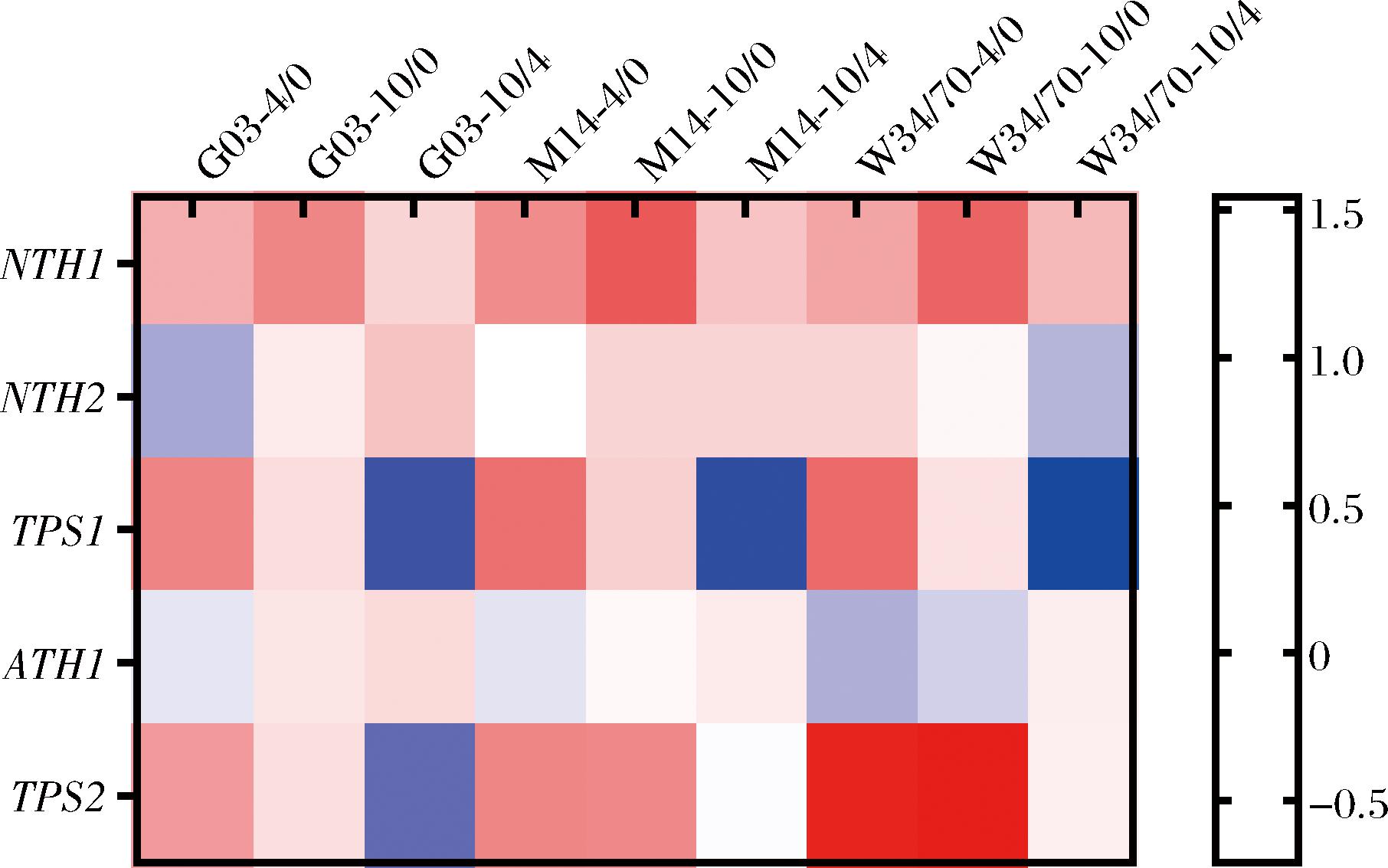
图7 海藻糖代谢差异基因分析
Fig.7 Differential expressed genes’ analysis of trehalose metabolism
酵母胞内氧化磷酸化代谢(oxidative phosphorylation,OXPHOS)相关的基因有ATP1、ACP1、COX5A等共66个。氧化磷酸化主要发生在酵母线粒体内膜,通过呼吸链在体内氧化物质释放能量,生成ATP。干燥胁迫下,细胞需要维持完整的结构并激活应激路径,对能量需求增加。如图8所示,酵母胞内OXPHOS相关的基因在3株酵母中的调控具有较大差异。
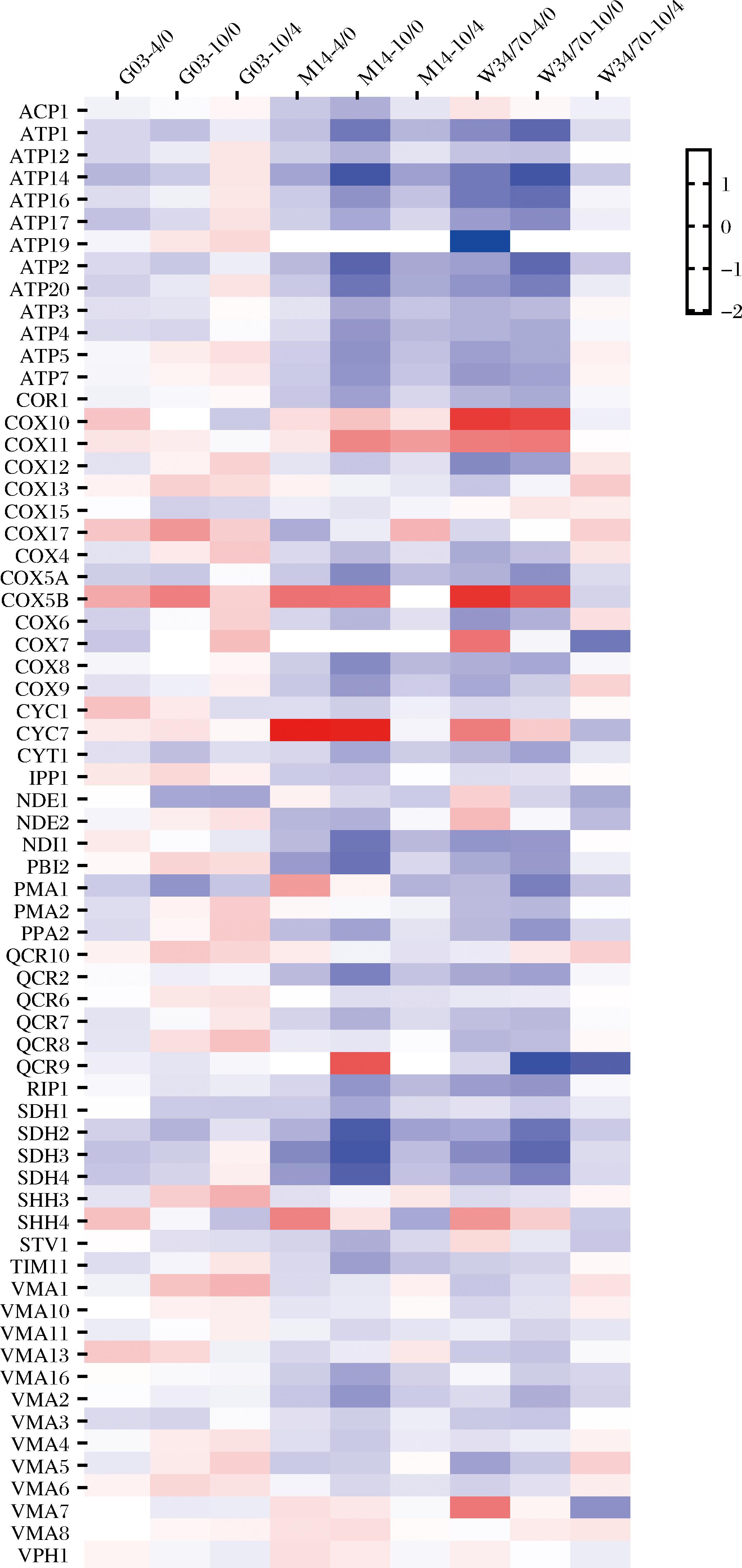
图8 氧化磷酸化差异基因分析
Fig.8 Differential expressed genes’ analysis of oxidative phosphorylation
NDI1编码复合体I(NADH脱氢酶),干燥4 h,在G03中上调0.18倍,在M14和W34/70中分别下调0.52、0.83倍,随后在干燥10 h时,在G03和M14中分别下调0.18、0.53倍,在W34/70中保持不变。SDH3编码复合体Ⅱ(琥珀酸脱氢酶),干燥4 h时,分别在G03、M14、W34/70中下调0.46、0.91、0.9倍,干燥10 h时,在G03中保持不变,M14和W34/70中分别继续下调0.27倍。CYC7与复合体Ⅲ(细胞色素bc1复合体)和复合体Ⅳ(细胞色素c氧化酶)密切相关,干燥4 h时,它在G03、M14、W34/70中分别上调0.14、1.79、0.88倍,干燥10 h后,在G03和M14中中保持不变,在W34/70中下调0.54倍。编码复合体Ⅳ(细胞色素c氧化酶)的COX5B、COX6、COX10与COX11在G03、M14、W34/70的调控存在差异,复合体Ⅳ是电子传递链中的最后一个复合体,它直接将电子传递给氧气,并参与形成水[20]。干燥4 h时,COX5B在G03、M14、W34/70内分别上调0.57、0.96、1.50倍,其中W34/70的上调倍数最高,干燥10 h时,COX5B在G03中继续上调0.30倍,在M14中保持不变,在W34/70中下调0.33倍;干燥4 h时,COX6在G03、M14、W34/70内分别下调0.35、0.32、0.81倍,其中W34/70的下调倍数最高,干燥10 h时,COX6在G03中上调0.31倍,在M14中继续下调0.24倍,在W34/70中上调0.21倍;干燥4 h时,COX10在G03、M14、W34/70内分别上调0.39、0.22、1.44倍,其中W34/70的上调倍数最高,干燥10 h时,COX10在G03中下调0.40倍,在M14中继续上调0.18倍,在W34/70中下调0.12倍;干燥4 h时,COX11在G03、M14、W34/70内分别上调0.17、0.15、0.89倍,其中W34/70的上调倍数最高,干燥10 h时,COX11在G03和W34/70中保持不变,在M14中继续上调0.66倍。负责编码复合体Ⅴ(ATP合成酶)的ATP7、ATP16、ATP20以及VMA7在G03、M14、W34/70的调控存在差异复合体Ⅳ(细胞色素c氧化酶)是电子传递链中的最后一个复合体,它直接将电子传递给氧气,并参与形成水,干燥4 h时,ATP7在G03中的表达不变,在M14和W34/70分别下调0.39和0.79倍,干燥10 h时,在G03中上调0.15倍,在M14中继续下调0.44倍,在W34/70中保持不变;干燥4 h,ATP16在三者之间分别下调0.27、0.39、1.03倍,干燥10 h时,在G03中上调,在M14中继续下调,在W34/70中保持不变,ATP20的基因表达变化与ATP16类似;干燥4 h时,VMA7在G03中的表达不变,在M14和W34/70中分别上调0.21和0.93倍,干燥10 h时,在G03中下调0.15倍,在M14中保持不变,在W34/70中下调0.86倍。
正常的氧化磷酸化代谢对于维持细胞的能量平衡至关重要。复合体的任何功能障碍都可能导致能量代谢的异常,从而影响整个细胞的生理状态,基因表达的调节使得细胞能够在变化的环境条件下维持有效的能量代谢。在干燥条件下,细胞产生过量的ROS,导致细胞膜和蛋白质的损伤,电子传递链促进ROS的清除,维持氧化还原平衡。氧化磷酸化基因在干燥胁迫下的上调是一种策略性的细胞适应。有助于维持线粒体功能,确保充足的ATP供应来支持快速恢复,提升酵母的抗干燥能力。
3 结论与讨论
活性干酵母在商业酵母领域具有重要的工业意义,但对酵母在干燥过程中生理状态的了解不足,阻碍了根据特定要求定制活性干酵母研究的发展。本研究探讨了常用的拉格啤酒酵母菌株在干燥脱水过程中的生理变化,发现抗干燥能力强的酵母菌株能在干燥过程中维持较高的胞内ATP水平和初始线粒体膜电位,并表现出较强的抗氧化性能。海藻糖代谢途径的激活对酵母的抗干燥能力至关重要,一方面海藻糖的积累稳定了细胞结构并抑制了氧化损伤,另一方面可通过促进海藻糖的水解反应来增加ATP的生成,帮助酵母维持代谢的稳定。氧化磷酸化代谢途径的调节有助于酵母细胞内氧化还原平衡的维持及能量的高效供应,从而修复由干燥引起的损伤。本研究为理解酵母的抗干燥机制提供了新的理论依据。
[1] PÉREZ-TORRADO R, BRUNO-B RCENA J M, MATALLANA E.Monitoring stress-related genes during the process of biomass propagation of Saccharomyces cerevisiae strains used for wine making[J].Applied and Environmental Microbiology, 2005, 71(11):6831-6837.
RCENA J M, MATALLANA E.Monitoring stress-related genes during the process of biomass propagation of Saccharomyces cerevisiae strains used for wine making[J].Applied and Environmental Microbiology, 2005, 71(11):6831-6837.
[2] Grand View Research. Brewer’s Yeast Market Size, Share And Growth Report, 2030[EB/OL].[2024-01-10]. https://www.grandviewresearch.com/industry-analysis/brewers-yeast-market.
[3] SOLTANI B, MCCLURE D D, OVEISSI F, et al.Experimental investigation and numerical modeling of pilot-scale fluidized-bed drying of yeast:Part B—Viability measurements and modeling[J].Food and Bioproducts Processing, 2020, 119:195-205.
[4] JENKINS D M, POWELL C D, SMART K A.Dried Yeast:Impact of dehydration and rehydration on brewing yeast DNA integrity[J].Journal of the American Society of Brewing Chemists, 2010,68(3):132-138.
[5] RAPOPORT A, GOLOVINA E A, GERVAIS P, et al.Anhydrobiosis:Inside yeast cells[J].Biotechnology Advances, 2019, 37(1):51-67.
[6] JENKINS D M, POWELL C D, FISCHBORN T, et al.Rehydration of active dry brewing yeast and its effect on cell viability[J].Journal of the Institute of Brewing, 2011, 117(3):377-382.
[7] JUN S M J, TAKAGI H.Stress-tolerance of baker’s-yeast (Saccharomyces cerevisiae) cells:Stress-protective molecules and genes involved in stress tolerance[J].Biotechnology and Applied Biochemistry, 2009, 53(3):155-164.
[8] GIBNEY P A, SCHIELER A, CHEN J C, et al.Characterizing the in vivo role of trehalose in Saccharomyces cerevisiae using the AGT1 transporter[J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(19):6116-6121.
[9] FEOFILOVA E P, USOV A I, MYSYAKINA I S, et al.Trehalose:Chemical structure, biological functions, and practical application[J].Microbiology, 2014, 83(3):271-283.
[10] KWOLEK-MIREK M, ZADRAG-TECZA R.Comparison of methods used for assessing the viability and vitality of yeast cells[J].FEMS Yeast Research, 2014, 14(7):1068-1079.
[11] ANNA L, BEATA M, KLAUDIA K, et al. Links between nucleolar activity, rDNA stability, aneuploidy and chronological aging in the yeast Saccharomyces cerevisiae[J].Biogerontology, 2014, 15(3): 289-316.
[12] WANG J J, DING H J, ZHENG F Y, et al.Physiological changes of beer brewer’s yeast during serial beer fermentation[J].Journal of the American Society of Brewing Chemists, 2019, 77(1):10-20.
[13] PICAZO C, GAMERO-SANDEMETRIO E, OROZCO H, et al.Mitochondria inheritance is a key factor for tolerance to dehydration in wine yeast production[J].Letters in Applied Microbiology, 2015, 60(3):217-222.
[14] KHROUSTALYOVA G, RAPOPORT A.Anhydrobiosis in yeasts:Changes in mitochondrial membranes improve the resistance of Saccharomyces cerevisiae cells to dehydration-rehydration[J].Fermentation, 2019, 5(3):82.
[15] FRANÇA M B, PANEK A D, ELEUTHERIO E C A.Oxidative stress and its effects during dehydration[J].Comparative Biochemistry &Physiology Part A Molecular &Integrative Physiology, 2007, 146(4):621-631.
[16] BELL W, KLAASSEN P, OHNACKER M, et al.Characterization of the 56-kDa subunit of yeast trehalose-6-phosphate synthase and cloning of its gene reveal its identity with the product of CIF1, a regulator of carbon catabolite inactivation[J].European Journal of Biochemistry, 1992, 209(3):951-959.
[17] ![]() N, BOUCHARD A, HOFLAND G W, et al.Distinct effects of sucrose and trehalose on protein stability during supercritical fluid drying and freeze-drying[J].European Journal of Pharmaceutical Sciences, 2006, 27(4):336-345.
N, BOUCHARD A, HOFLAND G W, et al.Distinct effects of sucrose and trehalose on protein stability during supercritical fluid drying and freeze-drying[J].European Journal of Pharmaceutical Sciences, 2006, 27(4):336-345.
[18] BENAROUDJ N, LEE D H, GOLDBERG A L.Trehalose accumulation during cellular stress protects cells and cellular proteins from damage by oxygen radicals[J].Journal of Biological Chemistry, 2001, 276(26):24261-24267.
[19] KANDROR O, DELEON A L, GOLDBERG A.Trehalose synthesis is induced upon exposure of Escherichia coli to cold and is essential for viability at low temperatures[J].Proceedings of the National Academy of Sciences, 2002, 99(15):9 727-9 732.
[20] HERRMANN J M, FUNES S.Biogenesis of cytochrome oxidase—Sophisticated assembly lines in the mitochondrial inner membrane[J].Gene, 2005, 354:43-52.