红托竹荪(Dictyophora rubrovalvata)隶属鬼笔目、鬼笔科、竹荪属,是一种珍贵食药用菌,因其外形优美、口感脆嫩、风味清香、营养功能价值高,又享有“雪裙仙子”“真菌皇后”等美称[1-3]。研究表明,红托竹荪采摘后水分含量在85%以上,新陈代谢旺盛,会持续消耗营养物质并伴随腐败微生物繁殖,不利于贮藏与销售[4]。加工成干品是延长其贮存期和提高品质的有效方式,但是干制方式在一定程度上会影响红托竹荪的营养品质和气味变化。郑秀艳等[5]研究发现空气源热泵干燥后的竹荪比新鲜竹荪脂肪含量更高,蛋白和形态保留效果更好。代建武等[6]研究发现控湿干燥可以有效保留红托竹荪多糖、三萜和黄酮等成分,真空红外干燥有利于多酚成分的保留。安诗语等[7]研究发现干制前后竹荪风味组成发生较大变化,部分化合物逐渐增加或减少,甚至消失。孟令帅等[8]研究发现热风干燥使得红托竹荪中含硫化合物种类和含量增加,形成特殊风味物质。然而,关于不同干制方式对红托竹荪品质的影响目前多集中在色泽、质构、营养成分和挥发性成分层面的定性定量分析,缺少香气成分和关键差异香气成分的研究。因此,对不同干制方式红托竹荪气味差异的研究至关重要。
气味是评价食用菌产品价值的重要指标之一,也是影响消费者选择的重要因素之一。红托竹荪因其独特的“清香味”受到广泛关注,有研究表明,红托竹荪中的气味物质主要包括酮类、酯类、醛类、酸类、醚类、烃类、胺类、硫化物、吡啶类、呋喃类等,其中已检出的气味特征成分有乙酸、β-瑟林烯、2,3-丁二酮、2-甲基丁酸乙酯、乙酸乙酯、3-甲基丁醛、1-辛烯-3-醇、1-辛烯-3-酮和乙酰丙烯等[9-10]。然而并不是所有的气味物质都能表现出一定的气味特性,具有高气味活度值(odor activity value, OAV)的气味物质对食物整体香气贡献更大。目前,常用的气味物质检测方法为气相色谱-质谱技术(gas chromatography-mass spectrometry, GC-MS)。全二维气相色谱-飞行时间质谱技术(two-dimensional gas chromatography-time-of-flight mass spectrometry, GC×GC-TOF-MS)采用2根分离机理不同的色谱柱串联对气味物质定性定量分析,相较于GC-MS,扫描速度更快、灵敏度更高,能鉴定出更复杂挥发性组分[11]。SHEN等[12]采用GC×GC-TOF-MS技术从羊肉串中检测出141种挥发性成分,比GC-MS多检出76种。LI等[13]采用3种技术检测羊肚菌中挥发性成分,结果显示GC×GC-TOF-MS测定的挥发性组分最丰富。然而,GC×GC-TOF-MS技术在红托竹荪气味检测中的应用目前还比较少见。
本研究采用顶空固相微萃取-全二维气相色谱-飞行时间质谱(headspace solid phase microextraction-GC×GC-TOF-MS,HS-SPME-GC×GC-TOF-MS)技术测定不同干制方式下红托竹荪气味物质和含量,结合多元统计方法分析干制方式之间的差异气味物质,通过计算OAV筛选出关键差异气味物质,为红托竹荪干制方式的选择、风味研究及食品加工等行业提供参考价值。
1 材料与方法
1.1 材料与试剂
样品来源于贵州省毕节市织金县,经上海博雅生物科技有限公司ITS(Internal Transcribed Spacer)测序鉴定为红托竹荪。
内标为2-辛醇(纯度≥99.5%),上海源叶生物科技有限公司。
1.2 仪器与设备
Agilent 7890气相色谱仪、DB-WAX(30 m×250 μm×0.25 μm)、DB-5(1 m×100 μm×0.10 μm),美国Agilent公司;冷喷射调制器、飞行时间质谱仪,美国LECO公司;MM 400混合研磨仪,德国莱驰公司;Milli-Q超纯水系统,美国Millipore公司;Scientz-100F真空冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 样品处理
新鲜红托竹荪采摘后均分3组,分别用于燃煤干燥(coal-fired drying,CD)、电热烘干(electrothermal drying,ED)和真空冷冻干燥(vacuum freeze drying,FD),干燥后的样品用研磨仪粉碎,过筛,-80 ℃保存备用。其中,燃煤干燥将样品悬挂在煤炉上方8 h。电热烘干将样品放在干燥机(奥博特)中进行干燥,干燥程序设置为3个阶段:第一阶段温度设置60 ℃,时间2 h;第二阶段温度设置45 ℃,时间4 h;第三阶段温度设置50 ℃,时间2 h。真空冷冻干燥将样品放置在真空冷冻干燥机中干燥36 h,温度设置在-50 ℃以下,真空度保持在100 mTorr以下。
1.3.2 GC×GC-TOF-MS分析
1.3.2.1 提取
称取红托竹荪干品粉末1.0 g放入20 mL顶空瓶中,加入3 mL饱和氯化钠溶液和10 μL 2-辛醇标准溶液(100 mg/L),加盖密封,在55 ℃条件下恒温20 min。随后,将预处理的纤维头(50/30 μm DVB/CAR/PDMS)插入顶空瓶中,在55 ℃萃取40 min。最后,通过无分离模式将光纤插入250 ℃的GC进样口解吸附5 min,按照设定参数进行GC×GC-TOF-MS分析。
1.3.2.2 GC×GC-TOF-MS测定
GC×GC条件:第一维色谱柱为DB-WAX(30 m×250 μm×0.25 μm),第二维色谱柱为DB-5(1 m×100 μm×0.10 μm)。载气为He(纯度99.999 9%),流速1.0 mL/min。第一维柱初始温度60 ℃保留2 min,以2 ℃/min升至170 ℃,以5 ℃/min升至240 ℃,保留4 min。调制解调器相较于第二维柱温度偏移5~15 ℃,调制时间4 s。
MS条件:离子源温度设置为220 ℃,质谱电子能量70 eV,采集质谱扫描范围33~550 amu,采集频率50 spectra/s。
1.3.2.3 定性和定量分析
定性分析:HS-SPME-GC×GC-TOF-MS检测结果采用NIST17数据库检索,筛选出匹配度>75%的气味物质,引入正构烷烃(C7~C40)线性公式计算气味物质保留指数(retention index,RI),与已发表的RIs进行比较,确定其化学组分。
定量分析:以目标挥发性物质与内标2-辛醇峰面积比值进行定量分析,挥发性物质相对含量,按公式(1)计算:
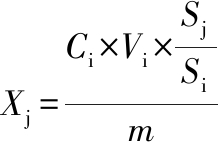
(1)
式中:Xj,目标挥发性物质的相对含量,μg/kg;Ci,内标质量浓度,100 mg/L;Vi,加入的内标物质体积,10 μL;Sj,目标物质的峰面积;Si,内标峰面积;m,样品质量,1 g。
1.4 数据处理
每组样品均作8次平行。实验数据在Excel 2021中计算处理并绘制饼图和柱状图。通过Metware平台(https://cloud.metware.cn/)进行主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),在线绘制聚类热图、维恩图、火山图。根据变量权重值(VIP≥1)和T检验的P值(P<0.05)筛选差异气味物质。OAV为气味物质相对含量与气味阈值的比值,气味阈值和气味描述参考网址(http://www.odour.org.uk/lriindex.html)和查阅相关文献获得。
2 结果与分析
2.1 红托竹荪干品气味物质分析
采用HS-SPME-GC×GC-TOF-MS技术从3组样品中共检出323种气味物质,包括酮类物质67种、杂环类物质54种、烃类物质41种、醇类物质42种、酯类物质42种、醛类物质26种、酸类物质22种和其他类物质29种。由图1可知,红托竹荪干品中气味物质数量占比高的类别有酮类、杂环类、烃类、醇类和酯类等。其中,燃煤干燥组中检出气味物质254种,电热烘干组中300种,真空冷冻干燥组中312种。由图2可知,真空冷冻干燥组红托竹荪干品气味物质种类和相对含量最为丰富,电热烘干次之,燃煤干燥较少。
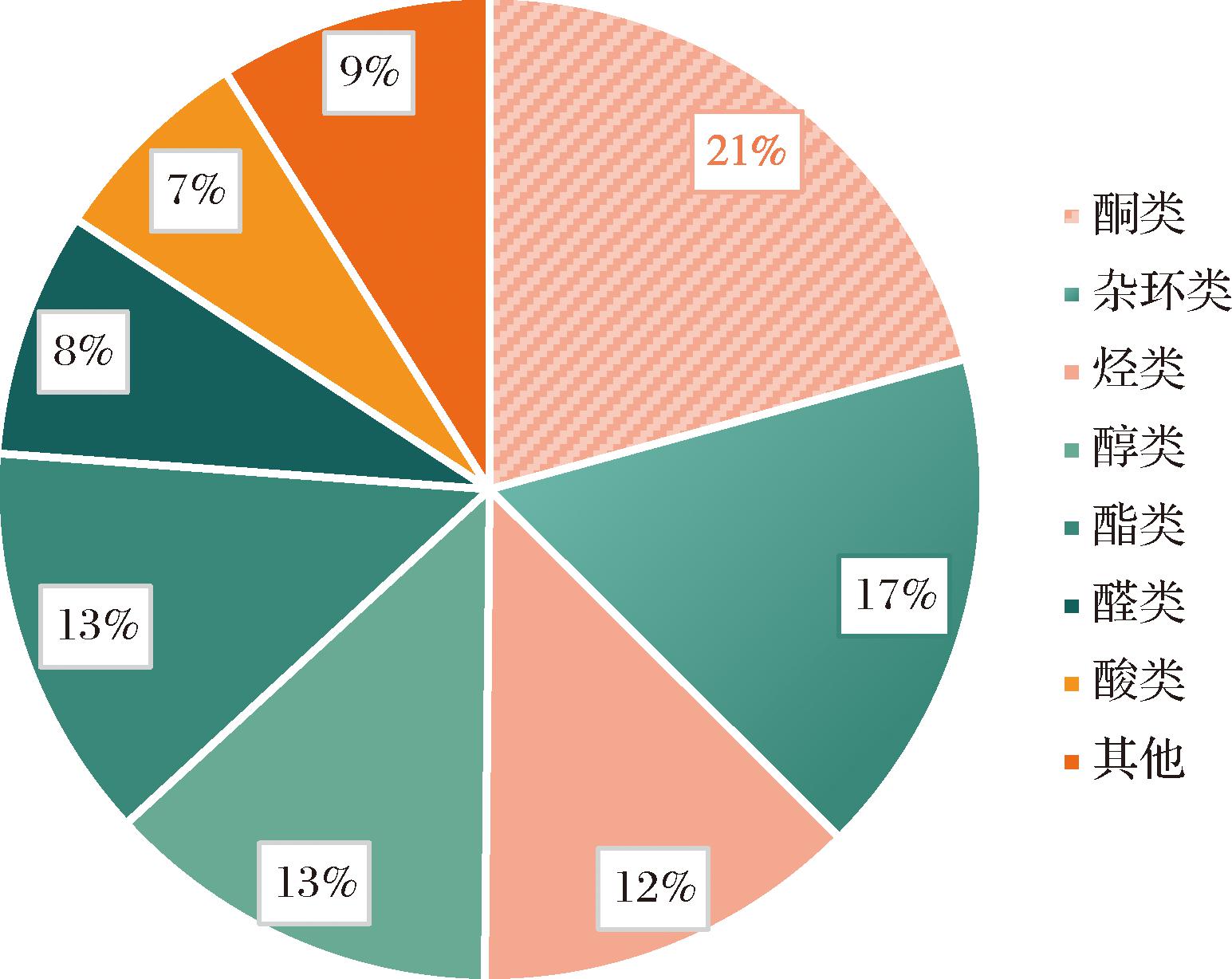
图1 GC×GC-TOF-MS检出气味物质分类
Fig.1 Classification of odorants detected by GC×GC-TOF-MS
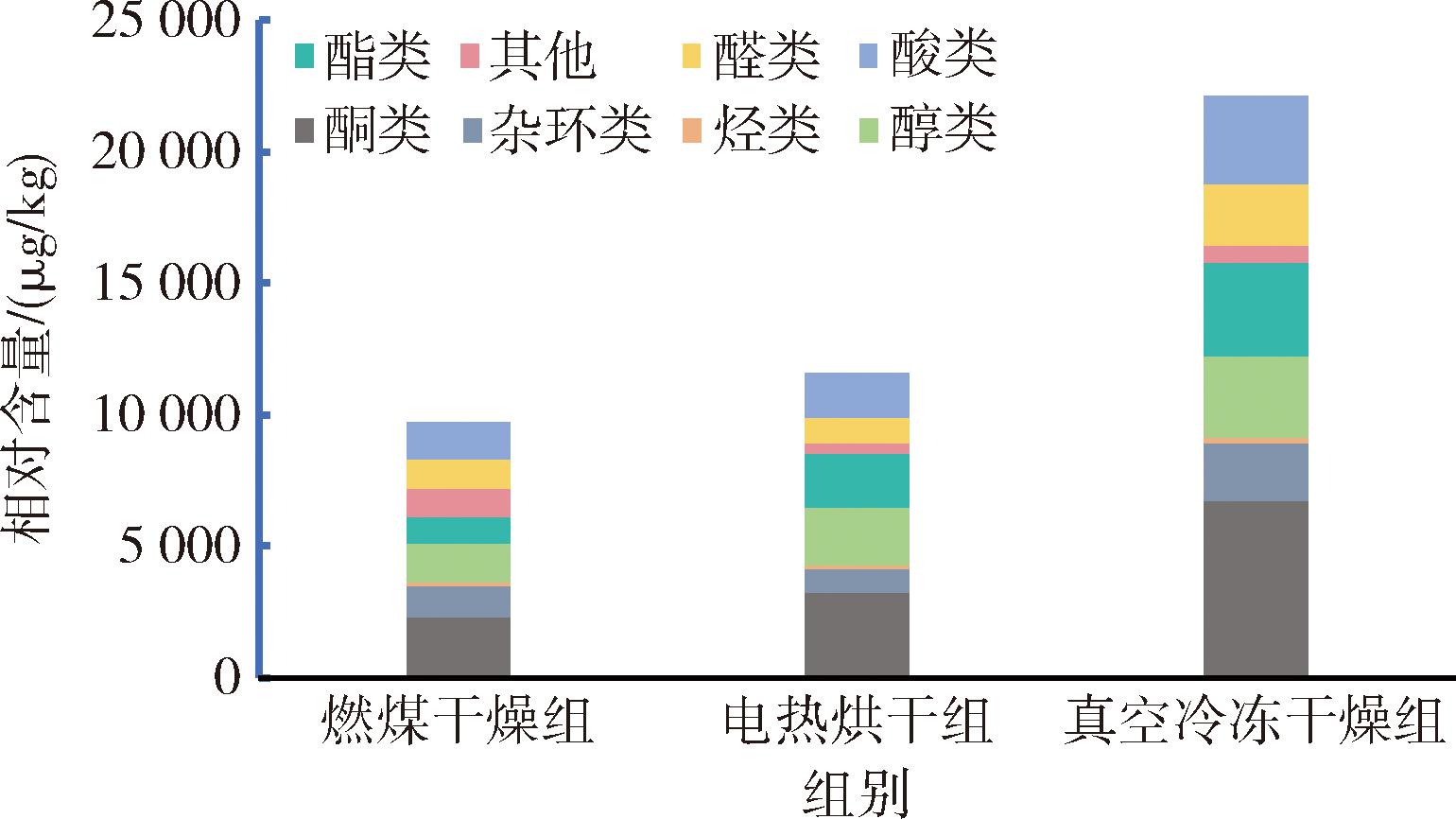
图2 三种干制方式气味物质分类及相对含量
Fig.2 Classification and relative contents of odorants by three drying methods
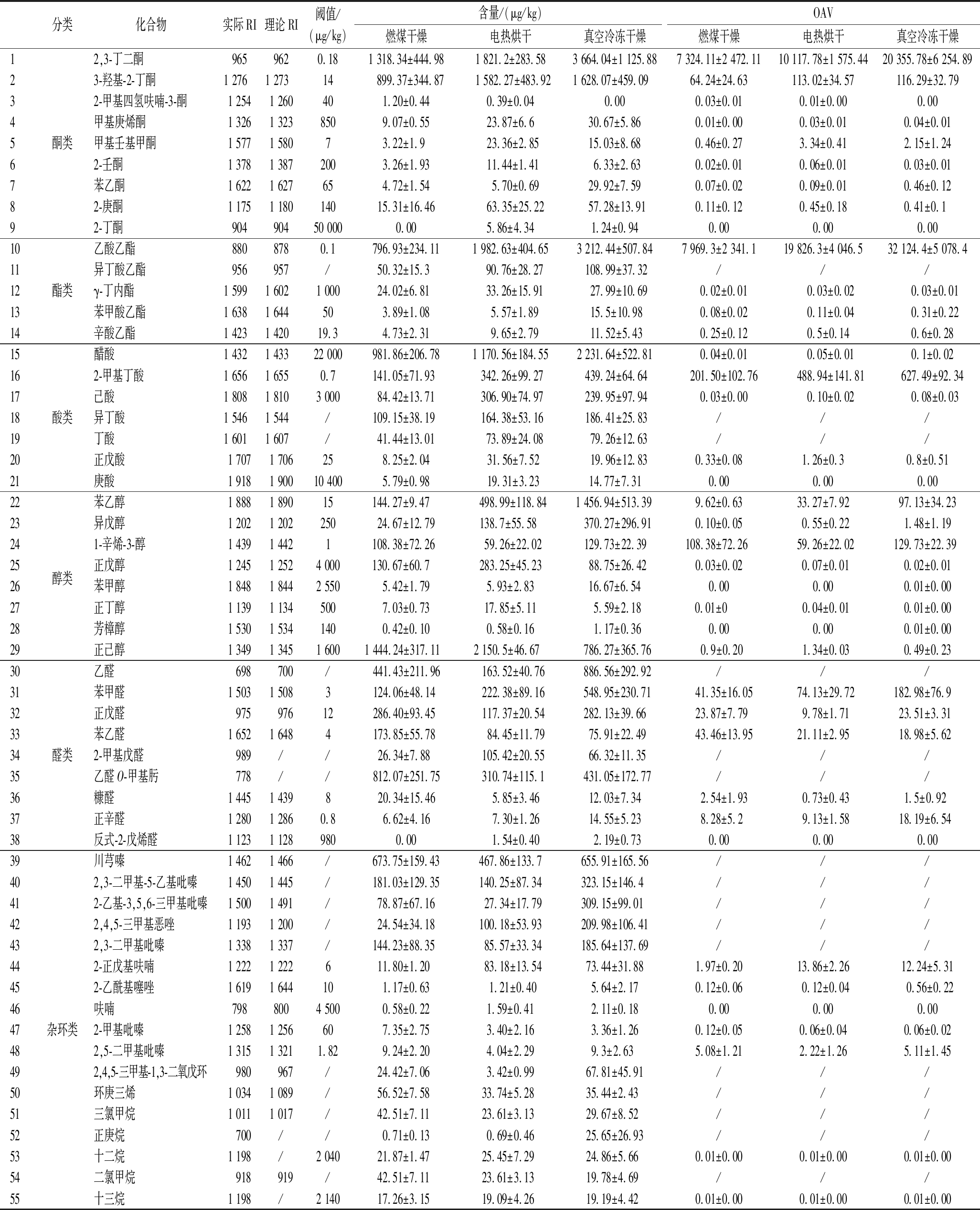
为探明干制方式对红托竹荪气味物质的影响,列出含量高以及阈值较低可能对红托竹荪气味有贡献的物质进一步分析,如表1所示。2,3-丁二酮、3-羟基-2-丁酮、乙酸乙酯、2-甲基丁酸、苯乙醇、1-辛烯-3-醇、苯甲醛、正戊醛、苯乙醛、正辛醛、2-正戊基呋喃和2,5-二甲基吡嗪等因含量高或阈值低呈现出较高的气味贡献度,是红托竹荪干品重要的气味贡献物质。醋酸、己酸、正戊醇、异戊醇、正己醇、十二烷和十三烷等高含量物质因气味阈值高而呈现出较低的气味贡献度,对红托竹荪干品起到气味辅助的作用。异丁酸乙酯、异丁酸、乙醛、乙醛O-甲基肟、川芎嗪、2,3-二甲基-5-乙基吡嗪、2-乙基-3,5,6-三甲基吡嗪、2,3-二甲基吡嗪等含量高的气味物质因未查到相关气味阈值,对红托竹荪干品气味的贡献度暂不明确。
表1 GC×GC-TOF-MS检出红托竹荪干品中关键气味物质
Table 1 Key odorants in dried D.rubrovalvata detected by GC×GC-TOF-MS
分类化合物实际RI理论RI阈值/(μg/kg)含量/(μg/kg)OAV燃煤干燥电热烘干真空冷冻干燥燃煤干燥电热烘干真空冷冻干燥12,3-丁二酮965 9620.181 318.34±444.981 821.2±283.583 664.04±1 125.887 324.11±2 472.1110 117.78±1 575.4420 355.78±6 254.8923-羟基-2-丁酮1 276 1 27314899.37±344.871 582.27±483.921 628.07±459.0964.24±24.63113.02±34.57116.29±32.7932-甲基四氢呋喃-3-酮1 254 1 260401.20±0.440.39±0.040.00 0.03±0.010.01±0.000.00 4甲基庚烯酮1 326 1 3238509.07±0.5523.87±6.630.67±5.860.01±0.000.03±0.010.04±0.015酮类甲基壬基甲酮1 577 1 58073.22±1.923.36±2.8515.03±8.680.46±0.273.34±0.412.15±1.2462-壬酮1 378 1 3872003.26±1.9311.44±1.416.33±2.630.02±0.010.06±0.010.03±0.017苯乙酮1 622 1 627654.72±1.545.70±0.6929.92±7.590.07±0.020.09±0.010.46±0.1282-庚酮1 175 1 18014015.31±16.4663.35±25.2257.28±13.910.11±0.120.45±0.180.41±0.192-丁酮904 90450 0000.00 5.86±4.341.24±0.940.00 0.00 0.00 10乙酸乙酯880 8780.1796.93±234.111 982.63±404.653 212.44±507.847 969.3±2 341.119 826.3±4 046.532 124.4±5 078.411异丁酸乙酯956 957/50.32±15.390.76±28.27108.99±37.32///12酯类γ-丁内酯1 599 1 6021 00024.02±6.8133.26±15.9127.99±10.690.02±0.010.03±0.020.03±0.0113苯甲酸乙酯1 638 1 644503.89±1.085.57±1.8915.5±10.980.08±0.020.11±0.040.31±0.2214辛酸乙酯1 423 1 42019.34.73±2.319.65±2.7911.52±5.430.25±0.120.5±0.140.6±0.2815醋酸1 432 1 43322 000981.86±206.781 170.56±184.552 231.64±522.810.04±0.010.05±0.010.1±0.02162-甲基丁酸1 656 1 6550.7141.05±71.93342.26±99.27439.24±64.64201.50±102.76488.94±141.81627.49±92.3417己酸1 808 1 8103 00084.42±13.71306.90±74.97239.95±97.940.03±0.000.10±0.020.08±0.0318酸类异丁酸1 546 1 544/109.15±38.19164.38±53.16186.41±25.83///19丁酸1 601 1 607/41.44±13.0173.89±24.0879.26±12.63///20正戊酸1 707 1 706258.25±2.04 31.56±7.52 19.96±12.830.33±0.081.26±0.30.8±0.5121庚酸1 918 1 90010 4005.79±0.98 19.31±3.2314.77±7.310.000.000.0022苯乙醇1 888 1 89015144.27±9.47 498.99±118.841 456.94±513.39 9.62±0.6333.27±7.9297.13±34.2323异戊醇1 202 1 20225024.67±12.79138.7±55.58370.27±296.910.10±0.050.55±0.221.48±1.19241-辛烯-3-醇1 439 1 4421108.38±72.2659.26±22.02129.73±22.39108.38±72.2659.26±22.02129.73±22.3925醇类正戊醇1 245 1 2524 000130.67±60.7283.25±45.2388.75±26.420.03±0.020.07±0.010.02±0.0126苯甲醇1 848 1 8442 5505.42±1.795.93±2.8316.67±6.540.00 0.00 0.01±0.0027正丁醇1 139 1 1345007.03±0.7317.85±5.11 5.59±2.180.01±0 0.04±0.010.01±0.0028芳樟醇1 530 1 5341400.42±0.100.58±0.16 1.17±0.360.00 0.00 0.01±0.0029正己醇1 349 1 3451 6001 444.24±317.11 2 150.5±46.67 786.27±365.76 0.9±0.20 1.34±0.030.49±0.2330乙醛698 700/441.43±211.96163.52±40.76886.56±292.92///31苯甲醛1 503 1 5083124.06±48.14222.38±89.16548.95±230.7141.35±16.0574.13±29.72182.98±76.932正戊醛975 97612286.40±93.45117.37±20.54282.13±39.6623.87±7.799.78±1.7123.51±3.3133苯乙醛1 652 1 6484173.85±55.7884.45±11.7975.91±22.4943.46±13.9521.11±2.9518.98±5.6234醛类2-甲基戊醛989 //26.34±7.88105.42±20.5566.32±11.35///35乙醛O-甲基肟778 //812.07±251.75310.74±115.1431.05±172.77///36糠醛1 445 1 439820.34±15.465.85±3.4612.03±7.342.54±1.930.73±0.431.5±0.9237正辛醛1 280 1 2860.86.62±4.167.30±1.2614.55±5.238.28±5.29.13±1.5818.19±6.5438反式-2-戊烯醛1 123 1 1289800.00 1.54±0.40 2.19±0.730.00 0.00 0.00 39川芎嗪1 462 1 466/673.75±159.43467.86±133.7655.91±165.56///402,3-二甲基-5-乙基吡嗪1 450 1 445/181.03±129.35140.25±87.34323.15±146.4///412-乙基-3,5,6-三甲基吡嗪1 500 1 491/78.87±67.1627.34±17.79309.15±99.01///422,4,5-三甲基恶唑1 193 1 200/24.54±34.18100.18±53.93209.98±106.41///432,3-二甲基吡嗪1 338 1 337/144.23±88.3585.57±33.34185.64±137.69///442-正戊基呋喃1 222 1 222611.80±1.2083.18±13.5473.44±31.881.97±0.2013.86±2.2612.24±5.31452-乙酰基噻唑1 619 1 644101.17±0.631.21±0.405.64±2.170.12±0.060.12±0.040.56±0.2246呋喃798 8004 5000.58±0.221.59±0.412.11±0.180.00 0.00 0.00 47杂环类2-甲基吡嗪1 258 1 256607.35±2.753.40±2.163.36±1.260.12±0.050.06±0.040.06±0.02482,5-二甲基吡嗪1 315 1 3211.829.24±2.204.04±2.299.3±2.635.08±1.212.22±1.265.11±1.45492,4,5-三甲基-1,3-二氧戊环980 967/24.42±7.063.42±0.9967.81±45.91///50环庚三烯1 034 1 089/56.52±7.5833.74±5.2835.44±2.43///51三氯甲烷1 011 1 017/42.51±7.1123.61±3.1329.67±8.52///52正庚烷700 //0.71±0.130.69±0.4625.65±26.93///53十二烷1 198 /2 04021.87±1.4725.45±7.2924.86±5.660.01±0.000.01±0.000.01±0.0054二氯甲烷918 919/42.51±7.1123.61±3.1319.78±4.69///55十三烷1 198 /2 14017.26±3.1519.09±4.2619.19±4.420.01±0.000.01±0.000.01±0.00
注:/表示无;实际RI值是由正构烷烃(C7~C40)线性公式计算得出;理论RI值由http://webbook.nist.gov/chemistry/网站查询得出。
2.2 不同干制方式红托竹荪差异气味物质分析
为探究3种干制方式对红托竹荪气味的影响,对检出气味物质进行PCA。在分析前采用尺方差(ulnar variance,UV)对检出气味物质峰值进行归一化处理,消除含量低的气味物质被覆盖的可能性。由图3-a可知,PC1和PC2累计贡献率为61.79%,能够反应样品的气味物质信息,3种干制方式分布在不同区域,无重叠,说明不同干制方式之间红托竹荪气味差异显著。
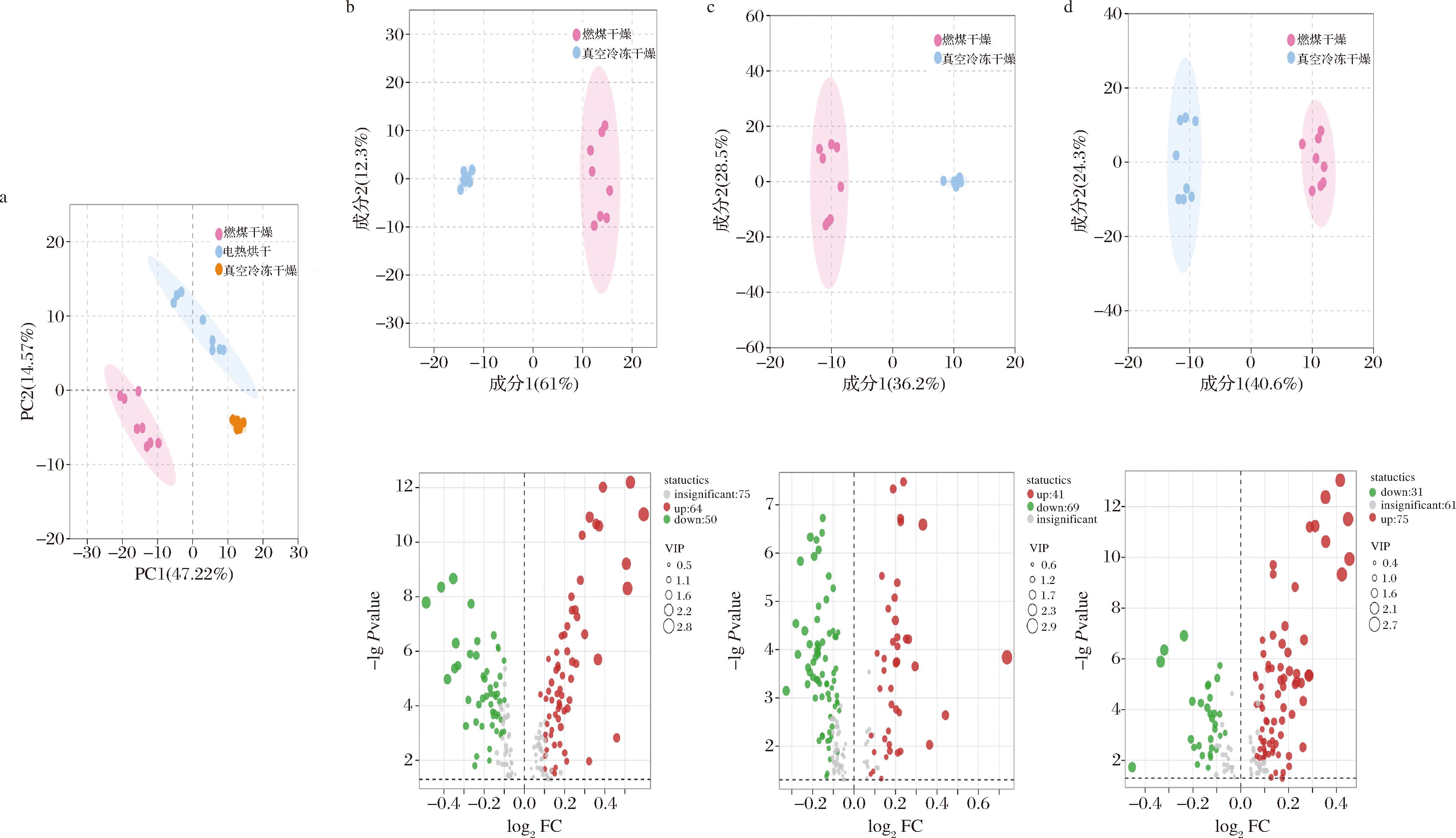
a-PCA图;b-真空冷冻干燥vs燃煤干燥;c-真空冷冻干燥vs电热烘干;d-燃煤干燥vs电热烘干
图3 不同干制方式红托竹荪挥发性物质PCA图、OPLS-DA图和火山图
Fig.3 PCA, OPLS-DA, and volcano plots of volatile substances in D.rubrovalvata under different drying methods
注:差异倍数(fold change,FC)。
通过OPLS-DA对检出气味物质进行两两判别分析,由图3-b~图3-d可知,每两组红托竹荪都分布在不同区域,说明OPLS-DA可以实现不同干制方式样品的有效区分。根据OPLS-DA,以变量权重值(VIP≥1)和T检验P值(P<0.05)为条件,从真空冷冻干燥和燃煤干燥、真空冷冻干燥和电热烘干、燃煤干燥和电热烘干之间各筛选出114、110、106种差异气味物质,共194种差异气味物质。其中,与燃煤干燥相比,真空冷冻干燥有64种气味物质上调,50种下调(图3-b),主要为杂环类、醛类、酮类等物质。与电热烘干相比,真空冷冻干燥有41种气味物质上调,69种下调(图3-c),主要为醇类、杂环类、酮类和酸类等物质。与燃煤干燥相比,电热烘干有75种气味物质上调,31种下调(图3-d),主要为杂环类、酯类、酸类和酮类等。
为进一步分析不同干制方式之间的气味差异特征,对筛选出的差异气味物质进行热图可视化(图4),颜色越红代表该化合物相对含量越高,绿色相反。从3个热图垂直方向可以看出,燃煤干燥和真空冷冻干燥、电热烘干和真空冷冻干燥、燃煤干燥和电热烘干之间的差异气味物质均被聚类成2个部分。由图4-a可知,真空冷冻干燥组含量较高的差异气味物质有苯乙醇、苯甲醛、异戊醇、3-戊烯-2-酮、3-甲基吡啶、2-甲基-2-丁烯醛等;燃煤干燥组含量较高的差异气味物质有苯乙醛、环庚三烯和羟基丙酮等。由图4-b可知,电热烘干和真空冷冻干燥之间更多的差异气味物质在电热烘干组含量较高,有苯乙醛、羟基丙酮等;而真空冷冻干燥组中含量高的差异气味物质有苯乙醇、2,3-二甲基-5-乙基吡嗪、2-乙基-3,5,6-三甲基吡嗪、3-戊烯-2-酮等。由图4-c可知,燃煤干燥和电热烘干之间更多的差异气味物质在电热烘干组含量较高,有乙酸乙酯、2-甲基丁酸、苯甲醛、异丁酸乙酯等;燃煤干燥组含量高的差异气味物质有乙醛、苯乙醛、羟基丙酮、红没药醇等。
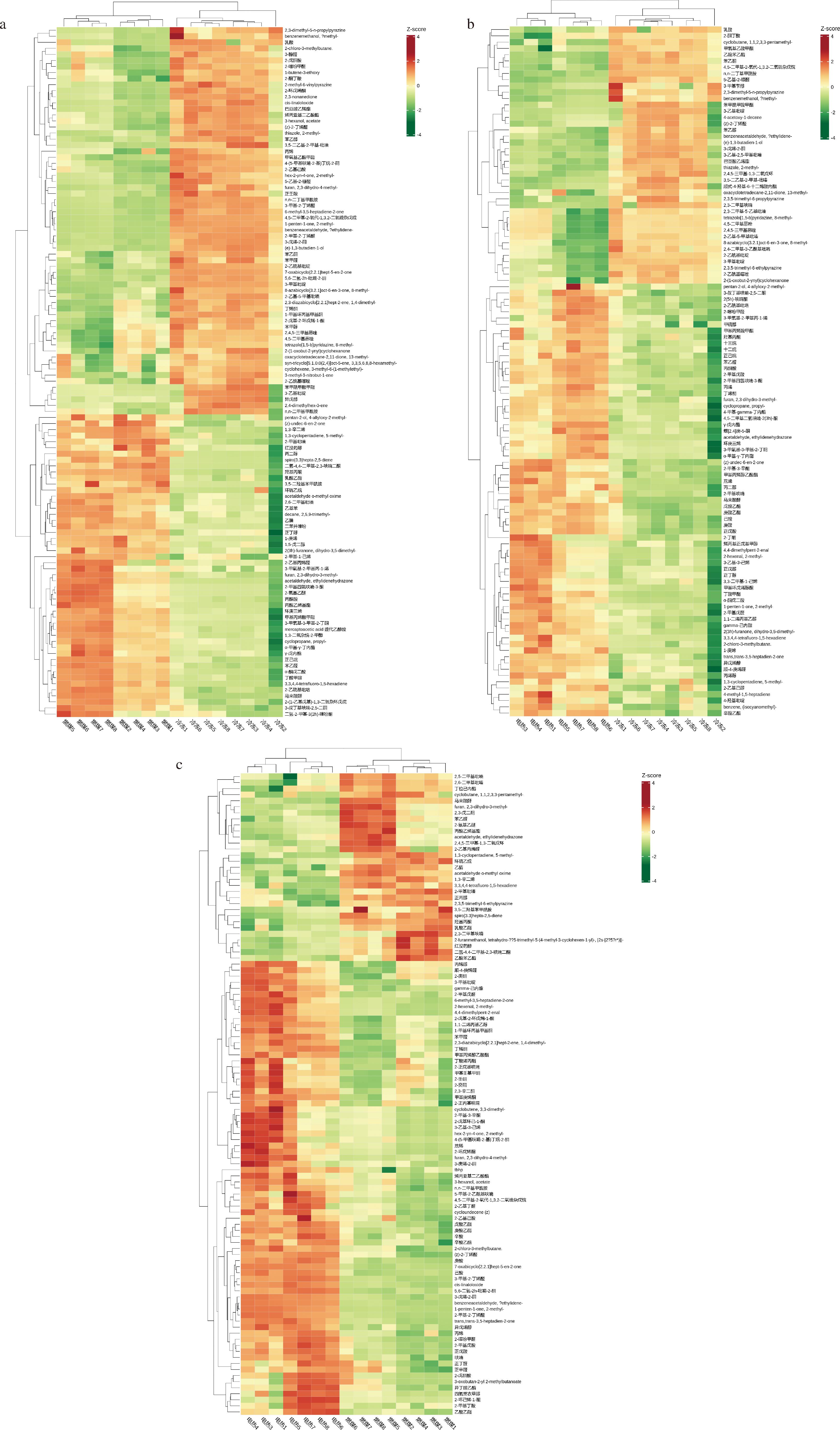
a-真空冷冻干燥vs燃煤干燥;b-真空冷冻干燥vs 电热烘干;c-燃煤干燥vs 电热烘干
图4 不同干制方式下红托竹荪差异气味物质热图
Fig.4 Heatmap of differential odorants in D.rubrovalvata under different drying methods
在分析两两干制方式之间差异气味物质的基础上,利用维恩图进一步筛选出3种干制方式之间共有差异气味物质17种,主要为醛酮类和杂环类化合物,如图5-a所示。对17种共有差异气味物质进行热图可视化,由图5-b可知,羟基丙酮、马来酸酐和苯乙醛等7种在燃煤干燥中相对含量较高,3-甲基吡啶、3-戊烯-2-酮等5种在真空冷冻干燥组相对含量较高,丙烯和丁烯酮等5种在电热烘干组相对含量较高。
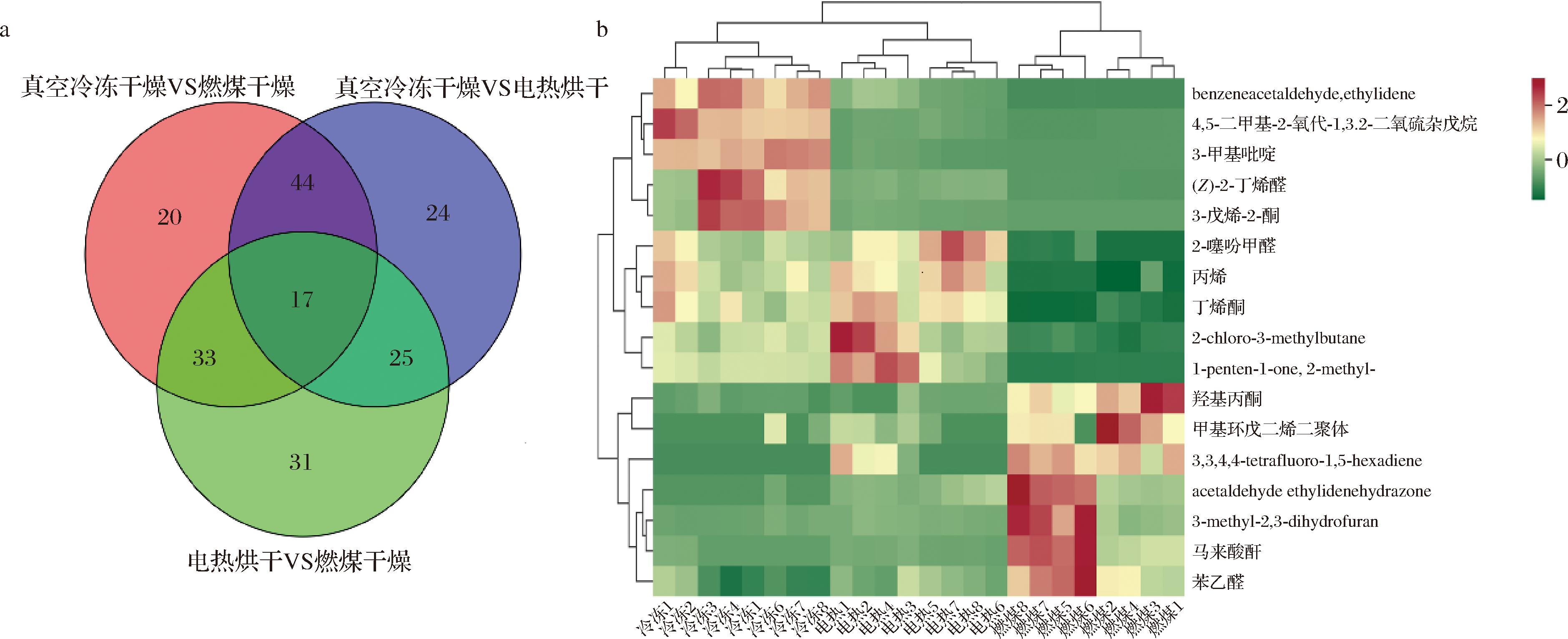
a-维恩图;b-热图
图5 不同干制方式红托竹荪共有差异气味物质
Fig.5 Common differential odorants for different drying methods in D.rubrovalvata
2.3 不同干制方式红托竹荪关键差异气味物质分析
通过OPLS-DA和聚类热图分析,发现不同干制方式红托竹荪气味物质存在显著差异,气味差异分析仅考虑气味物质种类和含量是不全面的,还与它们的气味阈值有关。OAV是一种从气味物质含量和气味阈值2个方面评价气味物质气味贡献度的方法,OAV>1可认为是对整体风味有贡献的气味物质,且值越大气味贡献度越大[14]。根据OAV>1,从差异气味物质中确定了11种气味贡献度大的物质,其中,有7种在真空冷冻干燥组中OAV最大,1种在燃煤干燥组中值最大,3种在电热烘干组中值最大,如表2所示。乙酸乙酯(OAV=7 969.3~3 2124.4)、2-甲基丁酸(OAV=201.5~627.5)、苯甲醛(OAV=41.4~183.0)、苯乙醇(OAV=9.6~97.1)、苯乙醛(OAV=19.0~43.4)、正辛醛(OAV=8.3~18.2)、2-正戊基呋喃(OAV=2.0~13.9)和2,5-二甲基吡嗪(OAV=2.2~5.1),这8种物质因气味贡献差异大可认为是3种干制方式之间的关键差异气味物质。正戊酸(OAV=0.3~1.3)、甲基壬基甲酮(OAV=0.5~3.3)和异戊醇(OAV=0.1~1.5),这3种物质因在任意1或2种干制方式中OAV>1,可认为是3种干制方式之间重要的差异气味物质。
表2 不同干制方式红托竹荪关键差异气味物质
Table 2 Key differential odorants in D.rubrovalvata different drying methods
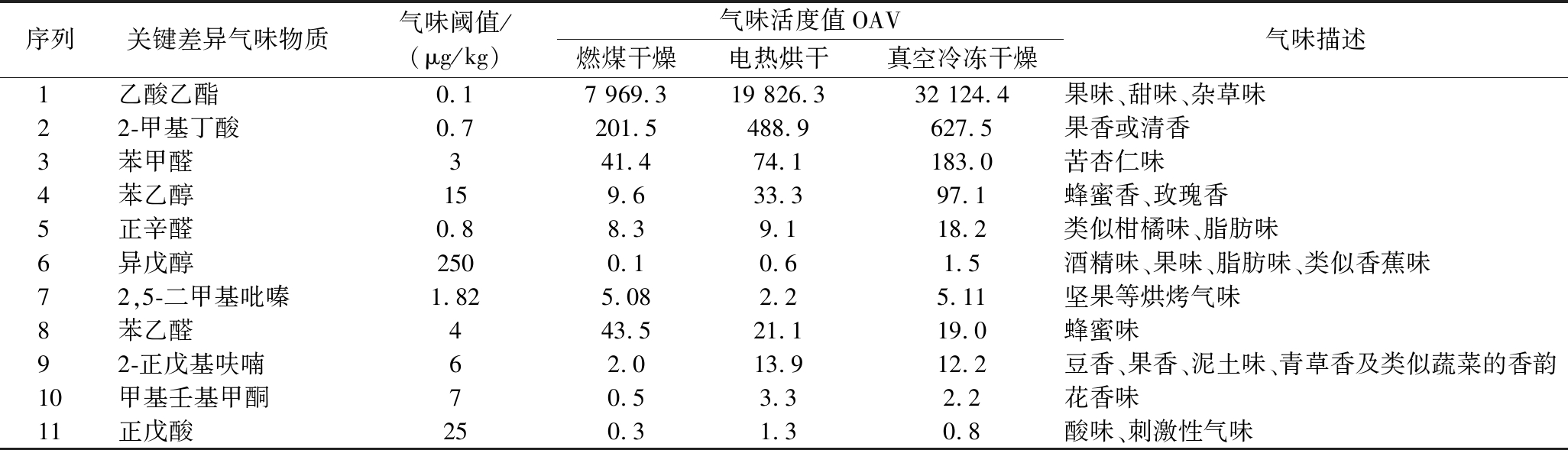
序列关键差异气味物质气味阈值/(μg/kg)气味活度值OAV燃煤干燥电热烘干真空冷冻干燥气味描述1乙酸乙酯0.17 969.319 826.332 124.4果味、甜味、杂草味22-甲基丁酸0.7201.5488.9627.5果香或清香3苯甲醛341.474.1183.0苦杏仁味4苯乙醇159.633.397.1蜂蜜香、玫瑰香5正辛醛0.88.39.118.2类似柑橘味、脂肪味6异戊醇2500.10.61.5酒精味、果味、脂肪味、类似香蕉味72,5-二甲基吡嗪1.825.082.25.11坚果等烘烤气味8苯乙醛443.521.119.0蜂蜜味92-正戊基呋喃62.013.912.2豆香、果香、泥土味、青草香及类似蔬菜的香韵10甲基壬基甲酮70.53.32.2花香味11正戊酸250.31.30.8酸味、刺激性气味
3 讨论
3.1 红托竹荪重要气味物质分析
食用菌的独特气味是由不同气味物质共同作用的结果,如含硫化合物、醇类、醛类、酮类、酯类、杂环类、烃类和酸类等化合物[15]。本研究从红托竹荪干品中筛选出12种重要气味贡献物质,分别为2,3-丁二酮(奶油味、辛辣味、焦糖味)、3-羟基-2-丁酮(黄油味、奶油味、脂肪味)、乙酸乙酯(水果味)、2-甲基丁酸(果香、酸性乳制品气味)、苯乙醇(蜂蜜香、玫瑰香)、1-辛烯-3-醇(蘑菇味、油脂香)、苯甲醛(苦杏仁味)、正戊醛(特殊香味)、苯乙醛(似蜂蜜味)、正辛醛(似柑橘味、脂肪味)、2-正戊基呋喃(豆香、泥土香)和2,5-二甲基吡嗪(坚果等烘烤气味)。有研究表明,八碳化合物是构成食用菌独特气味的重要成分,尤其是被称为“蘑菇醇”的1-辛烯-3-醇[16],本研究在3种干制方式中均检出1-辛烯-3-醇,且具有较高的气味贡献度。安诗语等[7]、孙燕等[9]和邹青青等[10]研究发现乙酸、香叶基丙酮、2,3-丁二酮、2-甲基丁酸乙酯、乙酸乙酯、3-甲基丁醛、1-辛烯-3-醇、2,3-丁二酮、己醛、苯甲醛、苯乙醛、2,3-戊二酮、2,3-丁二醇、苯乙醇、红没药醇、2,3-二甲基吡嗪、三甲基吡嗪和糠醛等气味物质是红托竹荪中含量较高,有气味贡献的物质。与本研究结果不完全一致,可能是提取方法、检测方法和干制方法不同的原因以及未考虑气味阈值的贡献作用。综上,红托竹荪特征气味物质受多种因素影响,如提取方法、检测方法和干制方法等,已有研究表明,HS-SPME是非常有效的食用菌气味物质提取方法[17],GC×GC-TOF-MS能检出更多更复杂气味物质。因此,本研究采用HS-SPME-GC×GC-TOF-MS测定不同干制方式红托竹荪差异气味物质具有一定的意义。
3.2 不同干制方式红托竹荪关键差异气味物质分析
食用菌气味形成是一个复杂的过程,易受多种因素影响,干制有利于气味物质的富集,对香气形成有显著影响,且不同的干制方法影响不同[18]。本研究从3种干制方式中检出重要差异气味物质有酮类、杂环类、醇类、酯类、酸类和醛类,且在真空冷冻干燥组含量更高。孟令帅等[8]研究发现,红托竹荪在真空冷冻干燥中醇类和酯类物质含量比加热类干燥方式浓度更高,与本研究结果一致。DENG等[19]和HOU等[20]研究表明加热不仅促进杂环类物质生成,也造成了部分损失。YANG等[21]研究发现在热风干燥过程中,金针菇中酮类物质一直降低,干燥后期醇类和醛类物质含量显著降低。小分子糖、糖醇、呈味氨基酸和呈味核苷酸等小分子物质是挥发性物质的重要前体物质[22]。郑秀艳等[5]研究表明红托竹荪中蛋白质和呈味氨基酸在真空冷冻干燥组中含量高于传统煤火干燥和空气热泵源干燥。曾镇[22]研究表明,红托竹荪在真空冷冻干燥组中多糖和蛋白质含量,游离脂肪酸、酚酸、其他脂质和可溶性糖及醇丰度均高于热风干燥组。DONG等[23]研究表明,相较于热干制方式,真空冷冻干燥组中红托竹荪甘油脂,异戊烯醇脂质和氨基酸丰度更高。综上,加热可能会造成红托竹荪中气味物质损失,真空冷冻干燥中因含氧量低、隔绝空气、低温低湿等因素可以有效抑制氧化反应,更多保留红托竹荪风味前体物质。因此,相较于燃煤干燥和电热烘干,真空冷冻干燥组红托竹荪气味物质更丰富。
根据VIP≥1、P<0.05和OAV>1,本研究从3种干制方式中共筛选出11种关键差异气味物质,其中有7种在真空冷冻干燥组中气味贡献最大,1种在燃煤干燥组中气味贡献最大,3种在电热烘干组中气味贡献最大。按气味贡献差异可以分为两类:第一类是在3种干制方式中OAV均大于1的差异气味物质,有乙酸乙酯(水果味)和2-甲基丁酸(果香、酸性乳制品香气)、苯甲醛(苦杏仁味)、苯乙醇(蜂蜜香、玫瑰香)、苯乙醛(似蜂蜜味)、正辛醛(似柑橘味、脂肪味)、2-正戊基呋喃(豆香、果香、泥土气味)、2,5-二甲基吡嗪(坚果等烘烤气味);第二类是在任意1或2种干制方式中OAV>1的差异气味物质,有甲基壬基甲酮(花香味)、异戊醇(果味、酒精味、脂肪味)和正戊酸(酸味、刺激性气味)。其中,第一类中8种物质不仅是3种干制方式之间的关键差异气味物质还是红托竹荪干品中重要气味物质。乙酸乙酯和2-甲基丁酸因含量高气味阈值低,表现出较高的OAV,是3种干制方式中气味贡献度最高的差异气味物质,且在真空冷冻干燥组气味贡献度最大。研究表明,部分醇类、醛类和酮类化合物在食用菌中起香气调节作用,在加热过程中随水分含量的减少样品内部温度升高从而导致含量降低[24]。因此,本研究检出的差异气味物质苯甲醛、苯乙醇、正辛醛和异戊醇在真空冷冻干燥组含量较高,可能是加热的原因导致其在燃煤干燥和电热烘干中含量降低。脂质氧化降解和美拉德反应在食品风味中起重要作用,具有果香味的2-正戊基呋喃的前体物质是亚油酸,由脂质氧化降解产生[24],在电热烘干组含量更高,具有花香味的甲基壬基甲酮在电热烘干组表现出较高的气味贡献度。温度高有利于吡嗪类物质的生成,具有坚果等烘烤气味的2,5-二甲基吡嗪是美拉德反应的产物,在燃煤干燥组OAV>5。研究表明,苯乙醛的前体物质是苯丙氨酸,在酶的作用下逐步转化生成苯乙醛,表现出类似蜂蜜的气味[25],燃煤干燥过程中苯乙醛的OAV是电热烘干组的2.1倍,是真空冷冻干燥组的2.3倍。部分酸类物质因阈值高在食用菌气味形成过程中起辅助作用[25],相较于燃煤干燥和真空冷冻干燥,正戊酸在电热烘干中OAV>1。综上,3种干制方式之间的气味差异主要体现在红托竹荪干品特征气味物质差异上,且在真空冷冻干燥组表现出较高的气味贡献度,说明干制方式对红托竹荪气味影响较大,且加热会降低红托竹荪气味物质含量。因此,真空冷冻干燥有利于红托竹荪气味物质保留,电热烘干因温度可控会减少气味物质的损失,燃煤干燥造成气味物质严重损失。
4 结论
本研究采用HS-SPME-GC×GC-TOF-MS技术分析3种干制方式之间红托竹荪气味特征差异,主要结论如下:a)从红托竹荪干品中共检出323种气味物质,其化学组分以酮类、醛类、杂环类、烃类、醇类、酯类、酸类等成分为主,真空冷冻干燥组气味物质种类和含量最为丰富,电热烘干次之,燃煤干燥组最少;b)乙酸乙酯、2,3-丁二酮、3-羟基-2-丁酮、1-辛烯-3-醇、苯甲醛、苯乙醛、苯乙醇、正戊醛、正辛醛、2-正戊基呋喃、2,5-二甲基吡嗪和2-甲基丁酸等是红托竹荪干品中重要的气味贡献物质;c)依据OPLS-DA筛选出194种差异气味物质,结合OAV分析确定了11种关键差异气味物质,分别为甲基壬基甲酮、乙酸乙酯、正辛醛、2-正戊基呋喃、2,5-二甲基吡嗪、2-甲基丁酸、异戊醇、苯乙醇、苯甲醛、正戊酸和苯乙醛;d)关键差异气味物质分析结果表明,加热可能会造成红托竹荪部分气味物质损失,真空冷冻干燥有利于红托竹荪保留出与果味、花香、草木香、脂肪味、奶酪味、酒精味等相关的气味物质,电热烘干因温度可控会减少此类物质的损失,燃煤干燥会造成此类物质的严重损失。综上,从气味物质和环保角度考虑,燃煤干燥不适合干制红托竹荪;从气味物质和经济价值考虑,电热烘干更值得推广;从气味物质和产品角度考虑,真空冷冻干燥更适合研发红托竹荪精品,如竹荪封堵器、竹荪牛肉香精、竹荪化妆品等。因此,研究不同干制方式红托竹荪气味差异,为红托竹荪干制方式的选择,风味研究以及产业发展提供参考价值。
[1] 张丽丽, 张磊, 章玉萍, 等.工厂化栽培红托竹荪的营养成分测定及食用安全性评价[J].中国食用菌, 2023, 42(1):111-117.
ZHANG L L, ZHANG L, ZHANG Y P, et al.Evolution on nutrient composition and edible safety of Dictyophora rubrovolvata cultivated in industrialization [J].Edible Fungi of China, 2023, 42(1):111-117.
[2] 覃发玠, 敖珍, 龙俊训.红托竹荪多糖提取、表征及生物活性研究进展[J].中国食品添加剂, 2023, 34(11):255-260.
QIN F J, AO Z, LONG J X.Research progress on extraction,characterization and biological activities of Dictyophora rubrovolvata polysaccharide[J].China Food Additives, 2023, 34(11):255-260.
[3] 梅承翰, 张丽英, 张冰梅, 等.红托竹荪多糖组分和生物活性研究进展 [J].中国食用菌, 2022, 41(11):8-11;17.
MEI C H, ZHANG L Y, ZHANG B M, et al.Research progress on the structure and bioactivities of Dictyophora rubrovalvata polysaccharide[J].Chinese Edible Fungi, 2022, 41(11):8-11;17.
[4] 郭瑜. 长白山野生松茸传统干制过程中特征香气成分的形成机制研究[D].大连:大连工业大学, 2020.
GUO Y.Study on the formation mechanism of characteristic aroma components in the traditional drying process of wild Tricholoma matsutake in Changbai Mountain[D]. Dalian: Dalian Polytechnic University, 2020.
[5] 郑秀艳, 陈曦, 何扬波, 等.干燥方式对红托竹荪品质特性和微观结构的影响 [J].现代食品科技, 2024, 40(3):209-218.
ZHENG X Y, CHEN X, HE Y B, et al.Effects of different drying methods on the quality characteristics and microstructure of Dictyophora rubrovalvata M.Zang[J].Modern Food Science &Technology, 2024, 40(3):209-218.
[6] 代建武, 周厚彬, 黄杰, 等.不同干燥方式对红托竹荪干燥特性和品质的影响 [J].农业工程学报, 2024, 40(6):90-100.
DAI J W, ZHOU H B, HUANG J, et al.Effects of different drying technologies on the drying characteristics and quality of Dictyophora rubrovolvata[J].Transactions of the Chinese Society of Agricultural Engineering, 2024, 40(6):90-100.
[7] 安诗语, 汤鹏宇, 孟繁博, 等.基于GC-IMS技术分析不同竹荪品种挥发性风味物质 [J].现代食品科技, 2024, 40(6):231-242.
AN S Y, TANG P Y, MENG F B, et al.Analysis of volatile flavor substances in different Dictyophora cultivars by gas chromatography-ion mobility spectroscopy[J].Modern Food Science and Technology, 2024, 40(6):231-242.
[8] 孟令帅, 王瑞, 郑婷婷, 等.不同干燥方式对红托竹荪感官品质的影响 [J].食品与发酵工业, 2023, 49(7):249-263.
MENG L S, WANG R, ZHENG T T, et al.Effects of different drying methods on sensory quality of Dictyophora rubrovalvata[J].Food and Fermentation Industries, 2023, 49(7):249-263.
[9] 孙燕, 向准, 罗倩, 等.不同温度竹荪品种挥发性成分及风味特性分析 [J].生物技术, 2019, 29(6):586-592.
SUN Y, XIANG Z, LUO Q, et al.Analysis of volatile components and flavor characteristics about different temperature varieties of Dictyophora duplicata[J].Biotechnology, 2019, 29(6):586-592.
[10] 邹青青, 黄明泉, 孙宝国, 等. 同时蒸馏萃取结合GC-MS分析红托竹荪挥发性成分[J]. 食品工业科技, 2011, 32(10):425-430.
ZOU Q Q, HUANG M Q, SUN B G, et al. Analysis of volatile components in Dictyophora rubrovolota Zang, ji et liou by simultaneous distillation extraction and GC-MS[J]. Science and Technology of Food Industry, 2011, 32(10):425-430.
[11] 任金玫, 陈君平, 贾玮, 等.全二维气相色谱-飞行时间质谱测定凤香型白酒中挥发性风味物质 [J].中国酿造, 2023, 42(6):231-238.
REN J M, CHEN J P, JIA W, et al.Determination of volatile components in Feng-flavor Baijiu by GC×GC-TOF-MS [J].China Brewing, 2023, 42(6):231-238.
[12] SHEN C, CAI Y, WU X N, et al.Characterization of selected commercially available grilled lamb shashliks based on flavor profiles using GC-MS, GC×GC-TOF-MS, GC-IMS, E-nose and E-tongue combined with chemometrics[J].Food Chemistry, 2023, 423:136257.
[13] LI X B, ZHANG Y M, HENGCHAO E, et al.Characteristic fingerprints and comparison of volatile flavor compounds in Morchella sextelata under different drying methods[J].Food Research International, 2023, 172:113103.
[14] ZHANG Y M, LI X B, ZHAO Z Y, et al.Comprehensive investigation on non-volatile and volatile flavor compounds in the Morchella sextelata and Morchella importuna by UPLC-MS/MS and GC×GC-TOF-MS[J].Food Chemistry:X, 2023, 20:100961.
[15] 李琴. 双孢蘑菇汤特征风味物质的鉴定及熬制过程风味物质释放规律研究[D].无锡:江南大学, 2011.
LI Q.Identification of characteristic flavor substances in Agaricus bisporus soup and study on the release law of flavor substances during boiling[D].Wuxi:Jiangnan University, 2011.
[16] 李小林, 陈诚, 黄羽佳, 等.顶空固相微萃取-气质联用分析4种野生食用菌干品的挥发性香气成分[J].食品与发酵工业, 2015, 41(9):174-180.
LI X L, CHEN C, HUANG Y J, et al.Analysis of volatile flavors in 4 dried wild edible fungi by HS-SPME-GC-MS[J].Food and Fermentation Industries, 2015, 41(9):174-180.
[17] 侯振山, 许贺然, 夏榕嵘, 等. 优化HS-SPME-GC-MS方法表征香菇不同成熟阶段的关键挥发性化合物[J]. 食品科学, 2025, 46(1):74-82.
HOU Z S, XU H R, XIA R R, et al. Optimization of HS-SPME-GC-MS for the characterization of key volatile compounds in Lentinus edodes at different maturity stages[J]. Food Science, 2025, 46(1):74-82.
[18] 李润. 香菇加工干制过程特征性香气成分形成机制研究[D].兰州:兰州理工大学, 2021.
LI R.Study on the formation mechanism of characteristic aroma components during the processing and drying of Lentinus edodes[D].Lanzhou:Lanzhou University of Technology, 2021.
[19] DENG Y, LUO Y L, WANG Y G, et al.Effect of different drying methods on the myosin structure, amino acid composition, protein digestibility and volatile profile of squid fillets[J].Food Chemistry,2015,171:168-176.
[20] HOU H, LIU C, LU X S, et al.Characterization of flavor frame in shiitake mushrooms (Lentinula edodes) detected by HS-GC-IMS coupled with electronic tongue and sensory analysis:Influence of drying techniques[J].LWT,2021,146:111402.
[21] YANG W J, YU J, PEI F, et al.Effect of hot air drying on volatile compounds of Flammulina velutipes detected by HS-SPME-GC-MS and electronic nose[J].Food Chemistry,2016,196:860-866.
[22] 曾镇.不同干制方式下竹荪营养品质的对比及褐变行为研究[D].成都:成都大学,2023.
ZENG Z.Comparison of nutritional quality and browning behavior of Dictyophora indusiata under different drying methods[D].Chengdu:Chengdu University, 2023.
[23] DONG H, ZHOU C Y, LI X B, et al.Ultraperformance liquid chromatography-quadrupole time-of-flight mass spectrometry based untargeted metabolomics to reveal the characteristics of Dictyophora rubrovolvata from different drying methods [J].Frontiers in Nutrition,2022,9:1056598.
[24] 王文倩, 高雅, 王子强, 等.干制双孢蘑菇香气化合物分析及其对咸味感知的增强作用 [J].中国食品学报, 2024, 24(4):315-326.
WANG W Q, GAO Y, WANG Z Q, et al.Characterization of the key aroma compounds in dry Agaricus bisporus and their effects on saltiness perception enhancement[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(4):315-326.
[25] XIE L M, GUO S L, RAO H T, et al.Characterization of volatile flavor compounds and aroma active components in button mushroom (Agaricus bisporus) across various cooking methods[J].Foods, 2024, 13(5):685.