生物胺是一类在多种动植物组织中广泛分布的含氮化合物,于人体内发挥多重关键作用,尤其在核酸调节、维持生物膜稳定性以及生物碱和蛋白质合成等方面具有显著影响[1-2]。通常情况下,新鲜非发酵制品中生物胺含量较低,然而在发酵制品中,由于不当的环境卫生条件、食品加工工艺及贮存方法等因素,导致其生物胺含量显著升高。目前,生物胺已经成为许多国家评估食品安全的参考依据之一。例如,美国食品药物管理局、澳大利亚和欧盟规定水产品中组胺含量分别不得高于50、200、100 mg/kg,我国GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》规定高组胺鱼类组胺含量不得超过400 mg/kg,其他鱼类不得超过200 mg/kg,澳大利亚、瑞士、法国、荷兰和德国对葡萄酒中组胺限量规定分别为10、10、8、3.5、2 mg/L[3-6],然而,我国目前尚未设立酒类中生物胺含量的限量标准。
目前,检测生物胺的方法主要有液相色谱法、气相色谱法、薄层色谱法、毛细管电泳法等仪器方法,其中最常用的是反相高效液相色谱法,样品经衍生化或固相萃取处理后连接紫外、荧光或二极管阵列检测器进行分析[7-11]。研究表明,高效液相色谱-荧光法和高效液相色谱-紫外法在45~60 min内可实现酒中生物胺的定量分析。但是,这种方法均存在样品需要前处理、操作过程较为烦琐、分析时间较长的缺点。由于乙醇会增加生物胺的毒性,因此,开发一种能够快速便捷、准确测定并筛查白酒中生物胺的方法,对于保障消费者健康以及提升白酒行业的质量控制水平具有至关重要的意义。
实时直接分析(direct analysis in real time, DART)是近年来出现的一种新型原位电离技术。实时直接分析离子源是一种非表面接触的热解析大气压电离技术,结合等离子体技术的简单性和灵敏性,可直接分析固体、液体和气体[12-13]。该技术无需依赖耗时的色谱分离以及繁琐的样品制备,仅需进行简单的样品预处理,就能满足实验室对样品高通量分析的需求,同时也能满足现场、无损、快速、低碳、原位、直接分析等多方面的要求。目前,利用原位电离质谱建立快速测定的方法包括:测定饼干中的聚丙烯酰胺的形成[14]、测定玉米中的黄曲霉毒素B1[15]、牛奶及奶制品批判性评估[16]、分析脂肪类食物中的有机磷杀虫剂[17],饲料和食物中抗寄生虫兽药的高通量分析[18],用于检测茶类饮料和软饮料中的咖啡因[19],监控茶叶发酵及生产[20]等。然而,目前通过原位电离质谱分析白酒中生物胺的研究仍相对较少。
本文对实时直接分析参数、进样速度、采样模式和溶剂进行优化,通过实时直接分析离子源与三重四极杆质谱联用技术(direct analysis in real time coupled with triple quadrupole mass spectrometry, DART-QQQ)建立快速检测白酒中生物胺的外标定量方法,非衍生-实时分析-快速测定化是该方法的最大优势。建立一套快速筛查白酒中生物胺DART-QQQ分析方法,以期满足白酒行业对质量安全控制和风险评估的需求。
1 材料与方法
1.1 材料与试剂
生物胺标准品:腐胺(putrescine, PUT, 98%)、组胺(histamine, HIS, 99%)、尸胺(cadaverine, CAD, 98%)、酪胺(tyramine, TYR, 99%)、色胺(tryptamine, TRP, 99%),北京曼海格生物技术公司;甲醇,JTBaker-上海起发实验试剂有限公司;无水乙醇,德国Merck公司;甲酸、乙酸铵,西陇科学股份有限公司;超纯水,杭州哇哈哈集团有限公司。
1.2 仪器与设备
MTB2000D天平,深圳美孚电子有限公司;AB 4500三重四极杆质谱仪,美国AB SCIEX公司;真空泵,美国威斯康辛州WELCH公司;DART SVP离子源,vapur接口,12 Dip-it和Quick Strip网板自动进样模块,美国马萨诸塞州Ion Sense公司。
1.3 实验方法
1.3.1 标准溶液的配制
在甲醇水中分别制备1 000 mg/L的HIS、CAD、TYR、TRP、和PUT标准溶液。五种生物胺标准溶液用白酒样品进行稀释,分别配制50~900 μg/L标准溶液待测。所有制备好的标准溶液贮存于4 ℃的冰箱中冷藏直至分析前。
1.3.2 仪器参数
DART离子源的参数如下:正电离模式和设定在400 ℃的电离气体温度。氦气以流速为1.0 L/min在该研究中用作工作气体。随后进行其他参数的优化,以获得最佳的实验方法。Quick Strip自动进样器采用1 mm/s的恒定速度,进样体积为5 μL样品。五种生物胺的化合物信息以及质谱参数如表1所示。
表1 五种生物胺的化合物信息以及质谱参数
Table 1 Compound information and mass spectrum parameters of five biogenic amines
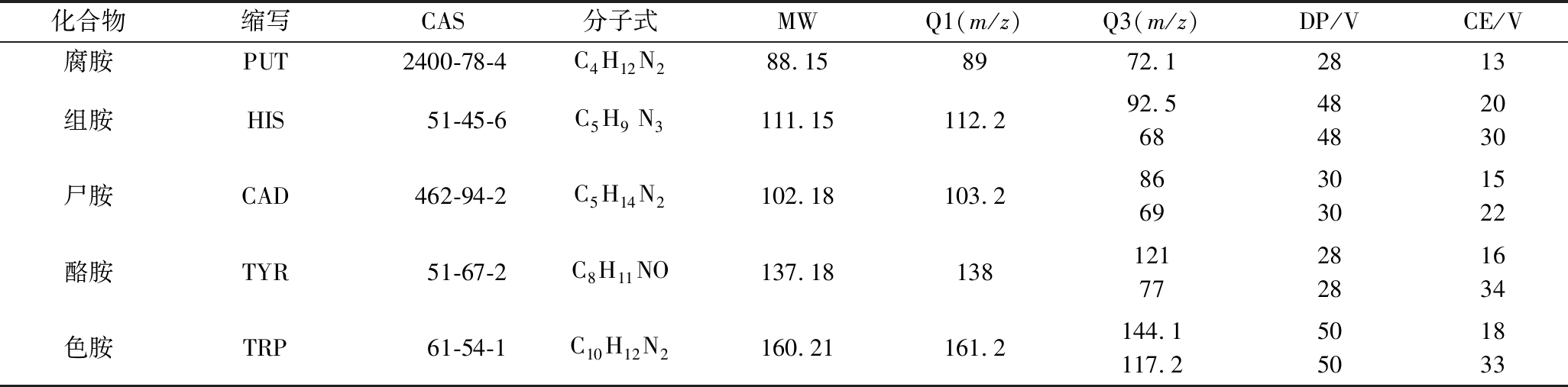
化合物缩写CAS分子式MWQ1(m/z)Q3(m/z)DP/VCE/V腐胺PUT2400-78-4C4H12N288.158972.12813组胺HIS51-45-6C5H9 N3111.15112.292.56848482030尸胺CAD462-94-2C5H14N2102.18103.2866930301522酪胺TYR51-67-2C8H11NO137.181381217728281634色胺TRP61-54-1C10H12N2160.21161.2144.1117.250501833
注:去簇电压(declustering potential,DP);碰撞电压(cell exit potential,CE)。
1.3.3 生物胺的标准曲线
采用外标法进行定量,对不同浓度的标准生物胺溶液通过DART离子源与DART-QQQ进行检测。生物胺浓度为x轴,峰面积为y轴,绘制校准曲线(y=ax+b),并以标准曲线计算生物胺含量。
1.3.4 方法评价
该方法采用不含生物胺的白酒基质进行验证,为了评价该方法的检出限和定量限,在空白白酒基质中添加了生物胺,以3倍的信噪比计算检测限(limit of detection, LOD),10倍的信噪比计算定量限(limit of quantitation, LOQ)。通过在50~900 μg/L的6个不同水平下向白酒样品中加入5种生物胺获得校准曲线。
1.4 数据处理
使用美国马萨诸塞州SCIEX分析软件Analyst software 1.6.2用于数据分析。
2 结果与分析
2.1 DART-QQQ参数的优化
为了对白酒中的生物胺进行精确且高效的定量分析,首先对分析方法的关键参数进行了优化,包括气体温度、样品进样方法、进样速率、溶剂选择以及可能需要的添加剂。实验结果表明,在正离子模式下的电喷雾电离(electrosprayIonization, ESI)过程中,生物胺的检测信号增强。在采用DART-QQQ技术的研究中,生物胺在正离子模式下展现出更高的信号强度,这与ROMERO-GONZ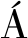 LEZ等[21]的研究结果一致,因此本文采用正模式进行接下来的研究。
LEZ等[21]的研究结果一致,因此本文采用正模式进行接下来的研究。
由于DART的温度会对化合物的信号产生严重影响,是DART-QQQ条件优化关键参数之一,因此本实验首先对温度进行了优化,优化温度为200~500 ℃。生物胺在不同DART温度下的信号响应趋势如图1所示。在200 ℃以下时,5种生物胺的检测响应普遍较低,且随着DART源温度的增加,这些生物胺的信号响应显著增强。这可能是由于于生物胺具有较弱的挥发性,而较高的温度可能促进了这些化合物的挥发,从而提高了检测信号。然而,当DART源的温度升至超过400 ℃时,5种生物胺的信号响应出现了下降,过高的温度可能导致样品的过度挥发或热降解,进而造成目标分析物的损失,降低了分析的灵敏度。基于上述发现,为了确保5种生物胺标准品都能获得良好的信号响应,本文选定400 ℃为DART源的最优工作温度,以此温度作为后续实验中的电离气体温度。

图1 温度对生物胺响应的影响
Fig.1 Effect of temperature on the response of biogenic amines
2.2 DART进样速度
进样模块的速度会对目标物的响应值、峰形和色谱峰间距具有一定的影响,为了研究模块速度对5种生物胺响应的影响,如图2所示,本文使用0.6、1.0、1.4、1.8 mm/s的模块速度对生物胺进行了对比,结果显示,当模块速度为0.6 mm/s时,峰高较低、色谱峰较宽,这可能是由于较慢的进样速度导致分析物在进入质谱检测系统前部分损失所致。对于1.4、1.6 mm/s的速度设置,大多数目标物表现出色谱峰间距过窄,导致峰形重叠。有色谱峰不能完全分开,会对后期的定性定量造成一定的影响。然而当进样速度优化为1 mm/s时,5种生物胺色谱峰峰形尖锐且峰间距适宜,表明在此速度下,色谱分离效果最佳,为实验提供了良好的分析条件。
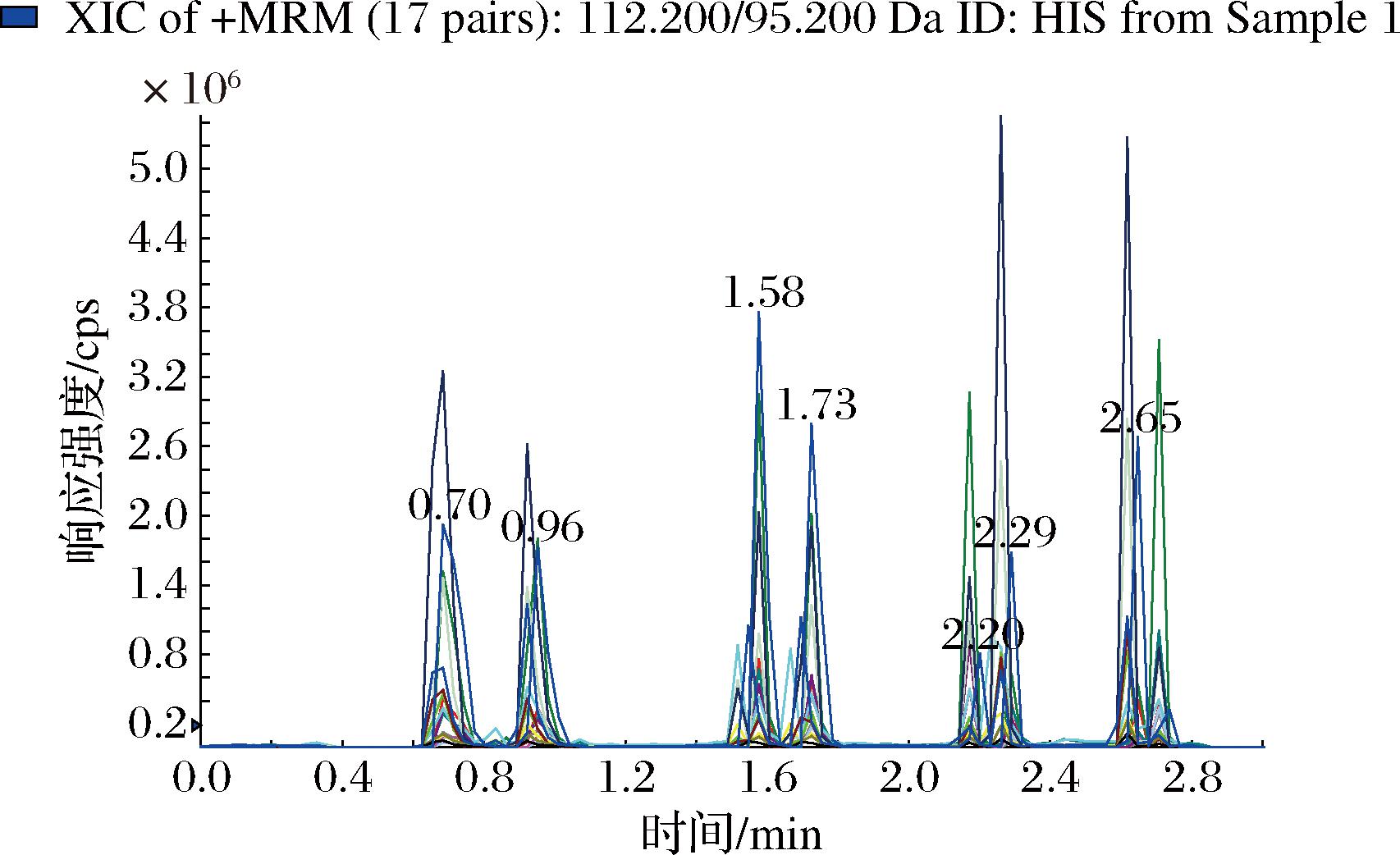
图2 不同进样速度对生物胺响应的影响
Fig.2 Effect of injection rates on the response of biogenic amines
2.3 DART采样模式优化
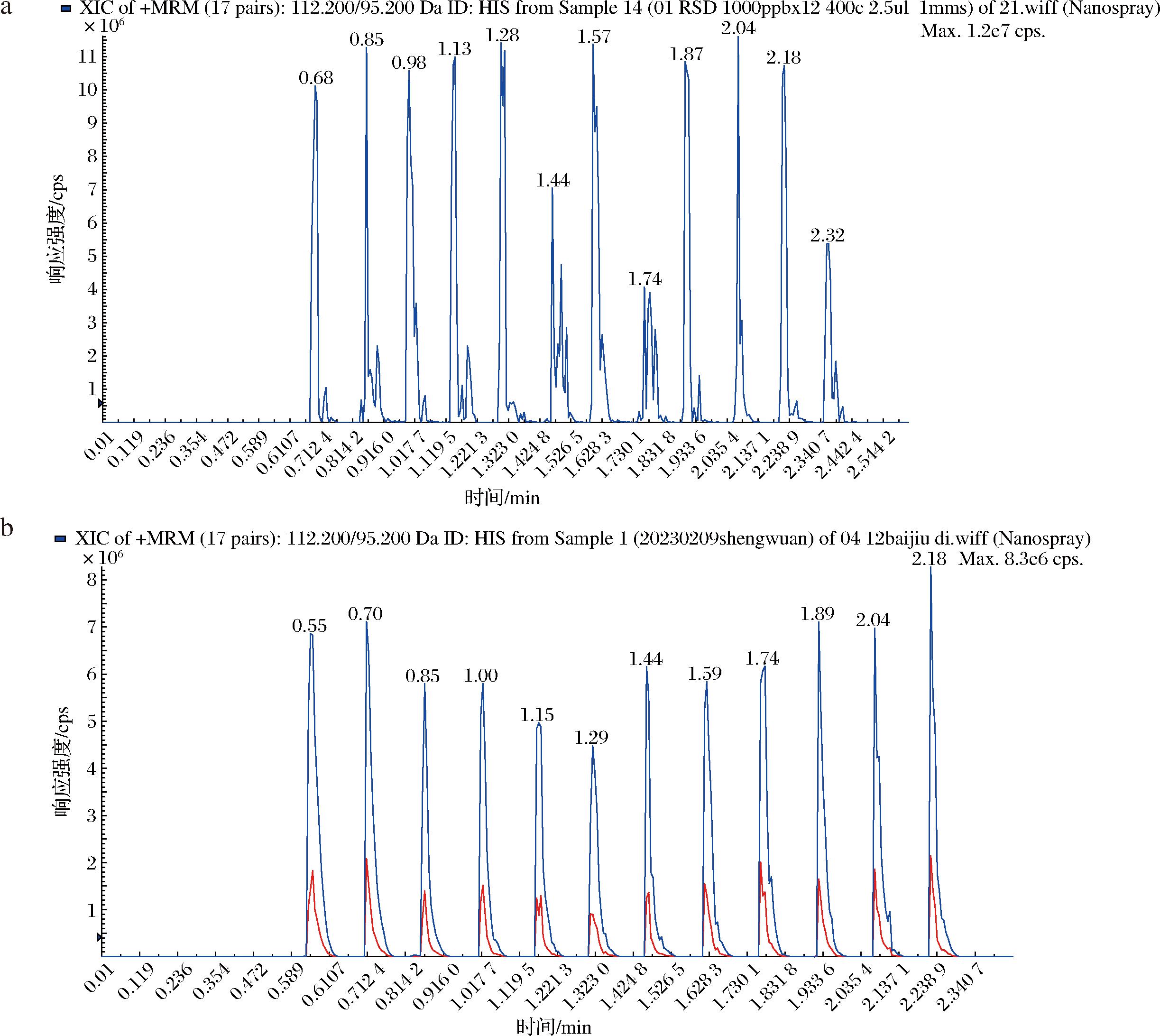
为进一步探究进样方式对分析物灵敏度及实验重复性的影响,特别是在DART技术中的应用,如图3所示,本研究中对比了2种进样模式。一种是图3-a的12-dip-it模式,另一种是图3-b的Quick Strip玻璃探针模式。在12-Dip-it操作模式下,先使用甲醇清洁玻璃棒探针,随后将进样模块安装在滑轨上,以6.0 mm/s的速度用氮气进行干燥。通过手动将探针直接浸入标准溶液中,使液体样品附着于玻璃探针表面至自然干燥后置于滑轨上以1.0 mm/s的速度进样,同时也可以采用移液枪吸取5 μL目标物进行进样。在不同进样体积的对比研究中发现,采用探针直接标准溶液中进样,由于进样体积太小,不足1 μL,目标物的信号响应过低,因此本研究采用5 μL作为进样体积。在12-dip-it的模式下5种生物胺的相对标准偏差(relative standard deviation, RSD)为26.87%~73.91%,由此可知在12-dip-it模式下5种生物胺标准品不具有良好的重复性。然而,在Quick Strip的模式下,样品直接取5 μL标准品在网板中心的位置上,并在空气中自然干燥之后直接进样,5种生物胺的RSD为14.71%~16.93%,显示出比12-dip-it方法更高的重复性。其中Quick Strip模式下HIS的典型质谱如图3-b所示。由于Quick Strip方法分析物的相对标准偏差低于20%,所以选择该方法作为最终的进样模式。
a-12-dip-it;b-Quick Strip模式
图3 HIS在白酒中的标准图
Fig.3 Standard diagram of HIS in Baijiu
2.4 溶剂和添加剂对DART质谱响应的影响
溶剂和添加剂的选择对分析物的电离效率及检测灵敏度具有显著影响[22]。由于乙醇和甲醇广泛用于溶液配制,同时也是白酒的主要成分,因此在研究中选择了乙醇溶液和甲醇溶液作为溶剂进行比较分析。通过对比50%乙醇溶液与50%甲醇溶液(均为体积分数)配制的5种生物胺标准溶液的响应强度,图3-b显示了5种生物胺的响应。显然,标准品在乙醇溶剂中的响应值高于在甲醇溶剂中的响应值。因此,本文中选择乙醇/水作为基本溶剂。此外,实验还研究了添加剂甲酸和乙酸铵对生物胺电离的影响。如图4所示,通过向溶液中加入不同浓度的这2种添加剂,5种生物胺表现出不同的响应值。添加甲酸后,CAD的强度增加。此外,加入乙酸铵后,HIS的信号增强。但是甲酸和乙酸胺的加入并未显示出对分析物的离子化的显著促进,为了简化实验流程,最终选择乙醇为标准溶液,不添加任何添加剂作为本次研究的溶剂。
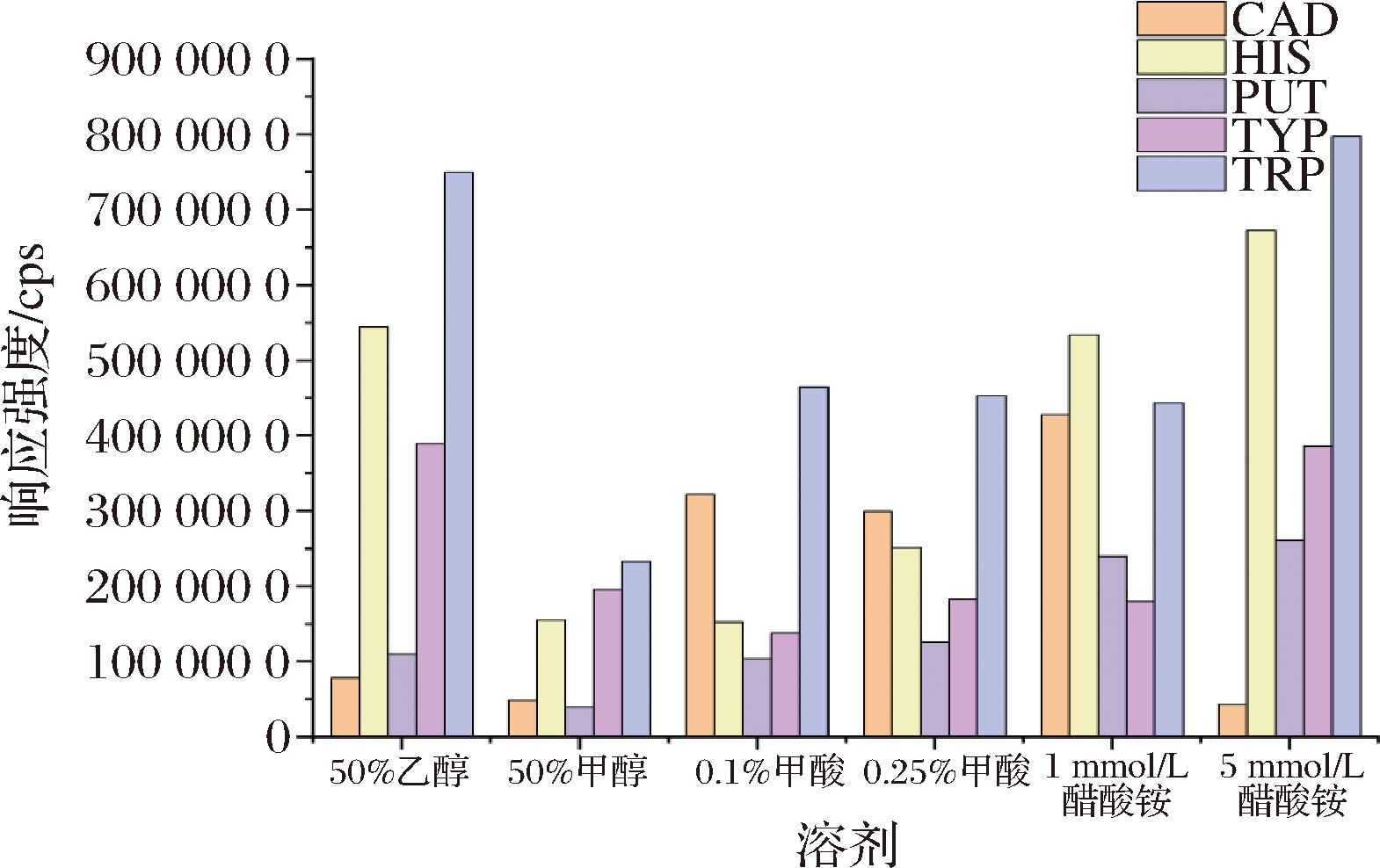
图4 溶剂对5种生物胺的响应影响
Fig.4 Effect of solvent on the response of the five biogenic amines
注:图中%均为体积分数。
2.5 基质效应
分析物信号的抑制或增强是在分析过程中常见的现象,如果存在严重的基质效应且未得到妥善处理,会影响方法的灵敏度和准确性。为了减少基质效应的影响,可以采取多种策略,包括但不限于改进样品的前处理技术、优化色谱分离条件以及采用基质匹配的标准曲线或基质加标法进行校准。尽管已有多种方法用于校正基质效应,但在DART-QQQ技术应用于饮料酒中5种生物胺的分析时,关于这些生物胺的基质效应(matrix effect, ME)的报道尚不多见。在本研究中,由于白酒样品采用直接进样,没有任何分离步骤。因此,酒中丰富的风味化合物可能对目标物产生影响。为了消除这种潜在的基质效应,本文研究了一种不含生物胺的白酒基质建立标准曲线。这一不含生物胺的白酒样本是通过液相色谱串联三重四极杆质谱技术进行验证和确定的。
2.6 方法可行性
为了验证方法的可行性,实验对该方法的线性范围、定量限制和检测限制进行了验证。因此,使用不含生物胺的白酒基质作为标准曲线,在50~900 μg/L的5个不同水平下加入5种生物胺,相应的结果总结如表2所示。结果表明,5种生物胺的线性在50~900 μg/L的范围内。以3∶1的信噪比计算LOD,以10∶1的信噪比计算LOQ,5种生物胺的方法检出限为8.60~38.00 μg/L,定量限为28.75~126.50 μg/L。根据目前国外对葡萄酒中生物胺的限量为2 mg/L,该新方法的LOD和LOQ可以满足检测要求。因此,该方法在真实基质中具有良好的灵敏度,适用于生物胺的检测。
表2 五种生物胺线性、检出限和定量限
Table 2 Linearity, limit of detection, and limit of quantification for 5 biogenic amines
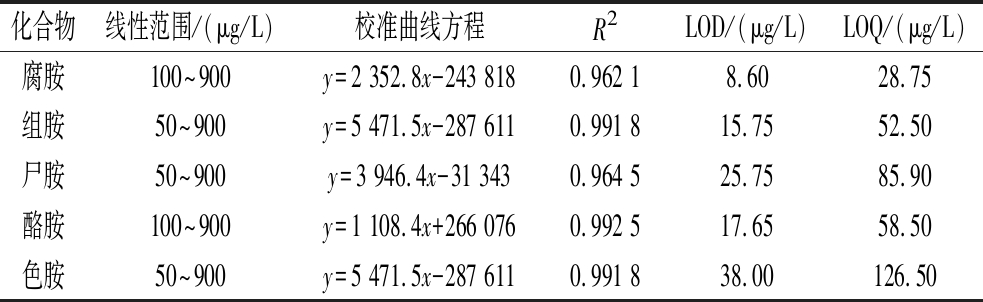
化合物线性范围/(μg/L)校准曲线方程R2LOD/(μg/L)LOQ/(μg/L)腐胺100~900y=2 352.8x-243 8180.962 18.6028.75组胺50~900y=5 471.5x-287 6110.991 815.7552.50尸胺50~900y=3 946.4x-31 3430.964 525.7585.90酪胺100~900y=1 108.4x+266 0760.992 517.6558.50色胺50~900y=5 471.5x-287 6110.991 838.00126.50
此外,如表3所示,通过液相色谱、气相色谱和离子色谱测定白酒中生物胺的分析时间为30~70 min,本研究建立的原位电离质谱测定生物胺方法前处理简单快捷、抗干扰能力强,可对白酒样品直接上机分析,且分析时间仅需5 min,可满足快速筛查白酒中生物胺的需求。
表3 生物胺分析方法的对比
Table 3 Comparison of analytical methods for biogenic amines

方法预处理方法分析时间/min参考文献气相色谱-串联质谱法液液萃取37[23]离子色谱法萃取74[24]高效液相色谱-质谱法衍生35.5[25]实时直接分析直接进样5本方法
2.7 方法重复性与回收率实验
取白酒样品,分别加入100、150、200 μL的生物胺标准品中间液,使用DART-QQQ进行检测,白酒加标回收率结果如表4所示。
表4 白酒加标回收率结果
Table 4 Results of recovery rate of Baijiu standard addition
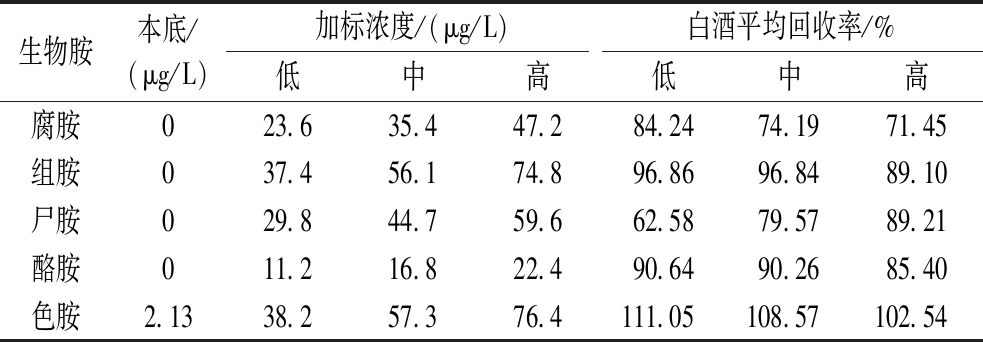
生物胺本底/(μg/L)加标浓度/(μg/L)白酒平均回收率/%低中高低中高 腐胺023.635.447.284.2474.19 71.45组胺037.456.174.896.8696.8489.10尸胺029.844.759.662.5879.57 89.21酪胺011.216.822.490.6490.26 85.40色胺2.1338.257.376.4111.05108.57102.54
本实验标准曲线相关系数为0.995~0.999,精密度为0.97%~9.30%,加标回收率为62.58%~111.05%,本实验从标准曲线、精密度、回收率3个方面对白酒中5种生物胺方法进行了验证,稳定性较好,灵敏度较高,均符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》。
2.8 样品检测
对市销某香型白酒样品进行直接测定,并与质量浓度为1 mg/L的5种生物胺的标准品进行对比,结果如图5所示,结果表明,酒样中生物胺的含量低于标准品中的生物胺浓度,未超过限量浓度,表明选取的白酒是在安全限量值以内的。本研究围绕白酒的食品安全风险管理需求,协助企业建立起食品质量安全潜在风险因子的排查与评估方法,建立的生物胺快速筛查的方法,填补了当前酒中生物胺筛查检测领域的空白,有望发展成为通用方法,为企业开展质量安全控制提供技术支撑。

a-尸胺;b-组胺;c-腐胺;d-酪胺;e-色胺
图5 白酒基质中1 mg/L 5种生物胺标准品以及对
市场芝麻香白酒样品的测定
Fig.5 1 mg/L of five biogenic amine standards and sesame-flavor Baijiu samples
3 结论
本文建立了一种非衍生化的DART-QQQ方法,用于高效快速筛查白酒中安全风险因子生物胺。本方法具有分析速度快(仅需5 min)、检测灵敏度高的特点。所采用的DART-QQQ技术避免了复杂的操作程序、严格的衍生条件、不稳定的衍生产物、较差的方法重现性以及需要复杂的色谱分离等诸多问题,极大降低了样品前处理的实验成本和实验误差,为白酒中生物胺的检测提供了新方法。因此,本研究提出的分析方法不仅适用于高通量筛选,还适用于实时监测白酒中的生物胺含量,为白酒种生物胺的检测提供了一种有价值的参考方法。
[1] FAN J Y, QU G Y, WANG D T, et al.Synergistic fermentation with functional microorganisms improves safety and quality of traditional Chinese fermented foods[J].Foods, 2023, 12(15):2892.
[2] SEITTER M, GENG B, HERTEL C.Binding to extracellular matrix proteins and formation of biogenic amines by food-associated coagulase-negative staphylococci[J].International Journal of Food Microbiology, 2011, 145(2-3):483-487.
[3] 张立飞, 孙明浩, 华成黎, 等.发酵食品中生物胺的形成、检测及其防控策略的研究进展[J].食品与发酵工业, 2023, 49(3):329-339.
ZHANG L F, SUN M H, HUA C L, et al.Research progress on the production, detection and prevention of biogenic amine in fermented food[J].Food and Fermentation Industries, 2023, 49(3):329-339.
[4] 肖洪, 丁晓雯, 梁菡峪, 等.发酵食品中的生物胺及其控制研究进展[J].食品工业科技, 2012, 33(20):346-350.
XIAO H, DING X W, LIANG H Y, et al.Research progress in the biogenic amines and its control measures in fermented food[J].Science and Technology of Food Industry, 2012, 33(20):346-350.
[5] 王可利, 叶泰, 徐斐, 等.UPLC-MS/MS法测定黄酒中8种生物胺[J].食品科学, 2021, 42(16):281-285.
WANG K L, YE T, XU F, et al.Determination of eight biogenic amines in Huangjiu (rice wine) by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2021, 42(16):281-285.
[6] 张雅卿, 叶书建, 周睿, 等.发酵食品风味物质及其相关微生物[J].酿酒科技, 2021(2):85-96.
ZHANG Y Q, YE S J, ZHOU R, et al.Flavoring substances and related microorganisms of fermented food[J].Liquor-Making Science &Technology, 2021(2):85-96.
[7] SELF R L, WU W H, MARKS H S.Simultaneous quantification of eight biogenic amine compounds in tuna by matrix solid-phase dispersion followed by HPLC-orbitrap mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2011, 59(11):5906-5913.
[8] LI Y, YANG H X, LIAO H M, et al.Simultaneous determination of ten biogenic amines in a thymopolypeptides injection using ultra-performance liquid chromatography coupled with electrospray ionization tandem quadrupole mass spectrometry[J].Journal of Chromatography B, 2013, 929:33-39.
[9] 张颖, 张蕴, 赵永纲.分散固相萃取-高效液相色谱-串联质谱法测定红酒中14种生物胺及其代谢产物[J].中国卫生检验杂志, 2022, 32(9):1025-1029.
ZHANG Y, ZHANG Y, ZHAO Y G.Detection of 14 biogenic amines and their metabolites in red wine by dispersive solid-phase extraction coupled with high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Health Laboratory Technology, 2022, 32(9):1025-1029.
[10] GOSETTI F, MAZZUCCO E, GENNARO M C, et al.Simultaneous determination of sixteen underivatized biogenic amines in human urine by HPLC-MS/MS[J].Analytical and Bioanalytical Chemistry, 2013, 405(2-3):907-916.
[11] PAWAR R S, GRUNDEL E, FARDIN-KIA A R, et al.Determination of selected biogenic amines in Acacia rigidula plant materials and dietary supplements using LC-MS/MS methods[J].Journal of Pharmaceutical and Biomedical Analysis, 2014, 88:457-466.
[12] HAN J, DATLA R, CHAN S, et al.Mass spectrometry-based technologies for high-throughput metabolomics[J].Bioanalysis, 2009, 1(9):1665-1684.
[13] ZHOU Z G, ZHANG J L, ZHANG W, et al.Rapid screening for synthetic antidiabetic drug adulteration in herbal dietary supplements using direct analysis in real time mass spectrometry[J].Analyst, 2011, 136(12):2613-2618.
[14] VACLAVIK L, CAPUANO E, G?KMEN V, et al.Prediction of acrylamide formation in biscuits based on fingerprint data generated by ambient ionization mass spectrometry employing direct analysis in real time (DART) ion source[J].Food Chemistry, 2015, 173:290-297.
[15] BUSMAN M, LIU J H, ZHONG H J, et al.Determination of the aflatoxin AFB1 from corn by direct analysis in real time-mass spectrometry (DART-MS)[J].Food Additives &Contaminants:Part A, 2014, 31(5):932-939.
[16] HRBEK V, VACLAVIK L, ELICH O, et al.Authentication of milk and milk-based foods by direct analysis in real time ionization-high resolution mass spectrometry (DART-HRMS) technique:A critical assessment[J].Food Control, 2014, 36(1):138-145.
[17] KIGUCHI O, OKA K, TAMADA M, et al.Thin-layer chromatography/direct analysis in real time time-of-flight mass spectrometry and isotope dilution to analyze organophosphorus insecticides in fatty foods[J].Journal of Chromatography A, 2014, 1370:246-254.
[18] ALBERT A, SHELLEY J T, ENGELHARD C.Plasma-based ambient desorption/ionization mass spectrometry:State-of-the-art in qualitative and quantitative analysis[J].Analytical and Bioanalytical Chemistry, 2014, 406(25):6111-6127.
[19] WANG L, ZHAO P Y, ZHANG F Z, et al.Detection of caffeine in tea, instant coffee, green tea beverage, and soft drink by direct analysis in real time (DART) source coupled to single-quadrupole mass spectrometry[J].Journal of AOAC International, 2013, 96(2):353-356.
[20] FRASER K, LANE G A, OTTER D E, et al.Monitoring tea fermentation/manufacturing by direct analysis in real time (DART) mass spectrometry[J].Food Chemistry, 2013, 141(3):2060-2065.
[21] ROMERO-GONZ LEZ R, ALARC
LEZ R, ALARC N-FLORES M I, MART
N-FLORES M I, MART NEZ VIDAL J L, et al.Simultaneous determination of four biogenic and three volatile amines in anchovy by ultra-high-performance liquid chromatography coupled to tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2012, 60(21):5324-5329.
NEZ VIDAL J L, et al.Simultaneous determination of four biogenic and three volatile amines in anchovy by ultra-high-performance liquid chromatography coupled to tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2012, 60(21):5324-5329.
[22] JIA S D, KANG Y P, PARK J H, et al.Determination of biogenic amines in Bokbunja (Rubus coreanus Miq.) wines using a novel ultra-performance liquid chromatography coupled with quadrupole-time of flight mass spectrometry[J].Food Chemistry, 2012, 132(3):1185-1190.
[23] 温永柱, 范文来, 徐岩.GC-MS法定性白酒中的多种生物胺[J].酿酒, 2013,40(1):38-41.
WEN Y Z, FAN W L, XU Y.Identification of a variety of biogenic amines by GC-MS method in China’s liquor[J].Liquor Making, 2013,40(1):38-41.
[24] 宋卫得, 许美玲, 高尧华, 等.离子色谱法同时测定果汁中20种有机胺、生物胺和阳离子[J].分析试验室, 2020, 39(5):590-595.
SONG W D, XU M L, GAO Y H, et al.Simultaneous determination of twenty organic amine,biogenic amines and cations in fruit juice by ion chromatography[J].Chinese Journal of Analysis Laboratory, 2020, 39(5):590-595.
[25] 罗娇依, 郑越男, 刘彤彤, 等.柱前衍生超高效液相色谱-串联质谱法测定三文鱼中9种生物胺[J].食品安全质量检测学报, 2021,12(17):6909-6917.
LUO J Y, ZHENG Y N, LIU T T, et al.Determination of 9 kinds of biogenic amines in salmon by precolumn derivatization-ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2021,12(17):6 909-6917.