蛋白质是乳中最重要的成分之一,为人体的生长和发育提供氨基酸,生物活性蛋白在抵御病原体和人体免疫系统成熟方面发挥着重要作用[1-2]。母乳(human milk,HM)被认为是婴儿最好的食物。世界卫生组织建议,婴儿应在出生后的前6个月内进行纯母乳喂养,在母乳喂养有限的情况下,婴儿配方奶粉经常被用作满足婴儿营养需求的替代品。目前人们可利用的乳类已有10多种,世界各地都使用牛、水牛、绵羊、山羊和骆驼生产供人类食用的乳和乳制品[3]。乳及乳制品主要以液态乳和乳粉形式进行销售,在这2种乳的生产过程中巴氏杀菌法和喷雾干燥是目前热处理中应用最为广泛的技术。研究表明,热处理可提高乳蛋白的消化率和生物利用率[4-5]。有研究对浓缩乳进行高热处理后,酪蛋白(casein,CN)在胃消化过程中的抗性增强,认为热处理降低了蛋白质在胃中的消化率与水解程度[6]。这表明乳在胃中的消化行为的差异与加热强度有关,这些争议也使热处理对乳制品消化行为的影响成为了热门的研究方向。此外,消化模型也可能导致消化行为的差异,近年来静态和(半)动态体外消化模型以及动物模型(大鼠和猪)被广泛用于消化研究。虽然动物模型中消化道的结构特征和生理功能与人体相似,能够以更直接的方式评估食物消化吸收和生物可及性的潜力,但动物模型的体内消化实验具有耗时长、成本高、个体差异大、生殖性差和受制于伦理约束等缺点[7]。体外静态消化模型可以模拟人体消化过程中的消化成分、消化环境、消化底物和消化酶比例,并保持消化参数恒定,但体外静态消化流体动力学和传质条件与体内不一致,无法达到消化道的有效模拟。体外动态仿生胃消化模型,能够有效模拟人体胃的蠕动和排空,连续分泌胃液和消化酶,pH值动态变化,更接近真实的人体内环境,有利于模拟人体的消化过程[5]。
虽然已有研究探讨热处理对乳蛋白质消化的影响,但大部分的研究只集中在一个物种上,并且大多数研究使用了体外静态消化模型,热处理对HM与动物乳蛋白消化行为影响的综合研究较少。本研究的目的是利用体外动态模拟胃消化模型(pH 3.2,37 ℃,120 min),探究加工对母乳、牛乳、山羊和绵羊乳的消化和生理功能的影响,旨在进一步了解加工对各物种乳的消化性及生理功能的关系。本研究在开发符合消费者需求的创新乳制品方面及婴幼儿配方奶粉的优化及原料选择具有实际意义。
1 材料与方法
1.1 材料与试剂
荷斯坦牛原乳(bovine raw milk,BRM),中国内蒙古某养殖场;萨能山羊原乳(caprine raw milk,CRM)和东弗里生绵羊原乳(ovine raw milk,ORM),草原红宝羊乳业有限公司(中国内蒙古)。所有原奶收集混合,即刻分份,在-40 ℃下贮存,干冰运输,用于进行进一步加工消化实验。本研究经江南大学医学伦理委员会审核批准(伦理号:JNU20220901IRB14),收集了8位健康母亲在哺乳期30~80 d的母乳样本。按照知情同意原则,所有志愿者均自愿参加。
P7125猪胃黏膜胃蛋白酶、pepstatin A、荧光素异硫氰酸异构体(fluorescein isothiocyanate,FITC),Sigma-Aldrich公司。所有其他化学品均为分析级,由中国上海国药化学试剂有限公司提供。
1.2 仪器与设备
DHSI-Ⅳ体外动态胃仿生系统,晓东宜健(苏州)仪器设备有限公司;超高温瞬时杀菌(ultra-high temperature instantaneous sterilization,UHT)系统,瑞安市善源机械有限公司;MOBILE MINOR型喷雾干燥设备,基伊埃工程技术(中国)有限公司;GEA-NIRO-SOAVI型高压均质机,意大利凯派克斯科技有限公司;EL204型和PL2002型电子天平、Seven Compact pH计,上海梅特勒-托利多仪器有限公司;X08A型电热消解仪,上海晟声自动化分析仪器有限公司;SKD-200半自动凯氏定氮仪,上海沛欧分析仪器有限公司;UV-2700紫外可见分光光度计,日本岛津公司;Mini-PROTEIN Tetra电泳仪、ChemiDoc XRS+化学发光成像分析系统,美国Bio-Rad公司;Olympus BX53型正置荧光显微镜,日本Olympus公司;Agilent 1100高效液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 原乳热处理
1.3.1.1 巴氏杀菌处理
牛乳巴氏杀菌乳(bovine pasteurized milk,BPM),山羊巴氏杀菌乳(caprine pasteurized milk,CPM)和绵羊巴氏杀菌乳(ovine pasteurized milk,OPM)是通过将3种反刍动物原乳在25 MPa的条件下加热到75 ℃保持15 s来制备的。
1.3.1.2 喷雾干燥处理
将3种原乳进行均质(25 MPa,55~60 ℃,2次),超高温瞬时灭菌(UHT,92 ℃,15 s)预热处理,然后通过喷雾干燥机(输入温度:160~165 ℃,输出温度:80~85 ℃)获得喷雾干粉,得到牛乳喷雾干乳粉(bovine spray dried milk,BSDM)、山羊喷雾干燥乳粉(caprine spray dried milk,CSDM)和绵羊喷雾干燥乳粉(ovine spray dried milk,OSDM)。
1.3.2 蛋白含量测定
所有样品中的蛋白质含量用凯氏定氮法测定,蛋白质含量计算时系数为6.38,转化因子从氮含量中获得[8]。
1.3.3 体外动态消化模拟
采用婴幼儿体外动态模型进行消化,消化模型及仪器参数参照ZHANG等[9]的方法,具体仪器参数如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.039034)所示。由于液体在口腔中的停留时间相对较短,本研究中牛奶样品省略了口腔消化阶段。所有模拟消化液,包括0.5 mol/L HCl和胃电解质液,使用DHSI-Ⅳ内置水浴池预热并保持在37 ℃。电解质液按照INFOGEST标准化方法制备[10]。将胃蛋白酶和脂肪酶溶解在由7.80 mmol/L K+、0.90 mmol/L ![]() mmol/L Cl-、0.10 mmol/L Mg2+、1.00 mmol/L
mmol/L Cl-、0.10 mmol/L Mg2+、1.00 mmol/L ![]() Na+、0.15 mmol/L Ca2+组成的模拟胃液(pH 3.2)中,定容至150 mL组成模拟胃液,使得胃蛋白酶浓度为400 U/mL,胃脂肪酶浓度为120 U/mL。量取一定质量的乳蛋白配料样品并制备120 mL蛋白质量浓度为10 mg/mL的乳样,样品初始蛋白浓度如附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.039034)所示,样品与模拟胃液的比例维持在1∶1(体积比),分别在0、30、60、120 min收集胃模型中残留的乳食糜进行指标检测。凝胶电泳及微观结构样品以1∶100(体积比)加入PepstatinA(0.73 mmol/L)终止反应,其余样品将pH值调节至7.0~8.0终止反应。每组样品进行3次平行实验。用于蛋白水解和氨基酸分析的食糜样品保存于-80 ℃冰箱。微观结构样品不能进行冷冻,需在终止反应后于1 h内与FITC染料混合进行观察。
Na+、0.15 mmol/L Ca2+组成的模拟胃液(pH 3.2)中,定容至150 mL组成模拟胃液,使得胃蛋白酶浓度为400 U/mL,胃脂肪酶浓度为120 U/mL。量取一定质量的乳蛋白配料样品并制备120 mL蛋白质量浓度为10 mg/mL的乳样,样品初始蛋白浓度如附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.039034)所示,样品与模拟胃液的比例维持在1∶1(体积比),分别在0、30、60、120 min收集胃模型中残留的乳食糜进行指标检测。凝胶电泳及微观结构样品以1∶100(体积比)加入PepstatinA(0.73 mmol/L)终止反应,其余样品将pH值调节至7.0~8.0终止反应。每组样品进行3次平行实验。用于蛋白水解和氨基酸分析的食糜样品保存于-80 ℃冰箱。微观结构样品不能进行冷冻,需在终止反应后于1 h内与FITC染料混合进行观察。
表1 体外动态胃消化过程中不同乳蛋白消化液的pH值的变化
Table 1 Changes in pH of different milk protein digestive juice during dynamic gastric digestion in-vitro
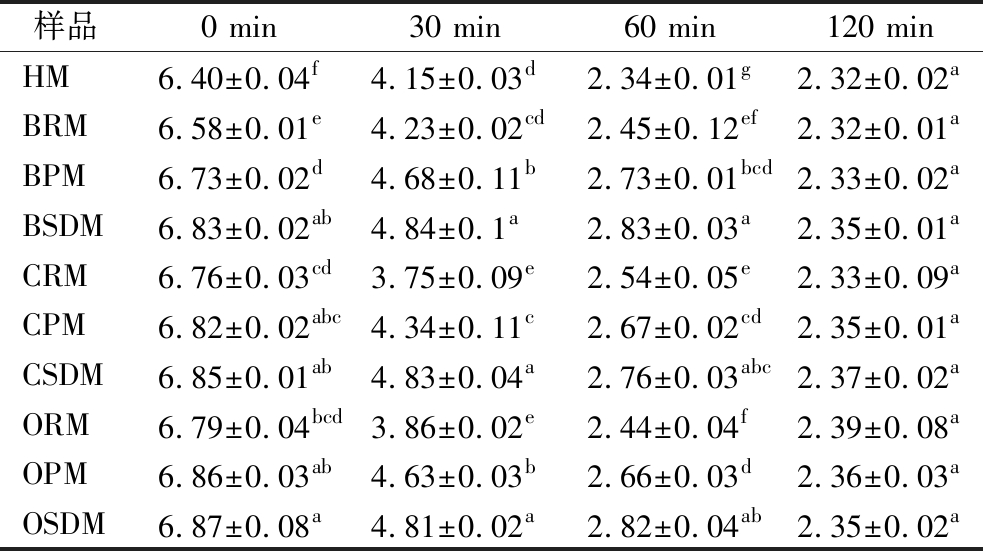
样品0 min30 min60 min120 minHM6.40±0.04f4.15±0.03d2.34±0.01g2.32±0.02aBRM6.58±0.01e4.23±0.02cd2.45±0.12ef2.32±0.01aBPM6.73±0.02d4.68±0.11b2.73±0.01bcd2.33±0.02aBSDM6.83±0.02ab4.84±0.1a2.83±0.03a2.35±0.01aCRM6.76±0.03cd3.75±0.09e2.54±0.05e2.33±0.09aCPM6.82±0.02abc4.34±0.11c2.67±0.02cd2.35±0.01aCSDM6.85±0.01ab4.83±0.04a2.76±0.03abc2.37±0.02aORM6.79±0.04bcd3.86±0.02e2.44±0.04f2.39±0.08aOPM6.86±0.03ab4.63±0.03b2.66±0.03d2.36±0.03aOSDM6.87±0.08a4.81±0.02a2.82±0.04ab2.35±0.02a
注:小写字母表示差异显著性(P<0.05)。
表2 不同哺乳动物种乳蛋白组成[17]
Table 2 Protein composition of milk with different mammalian species[17] 单位:g/L
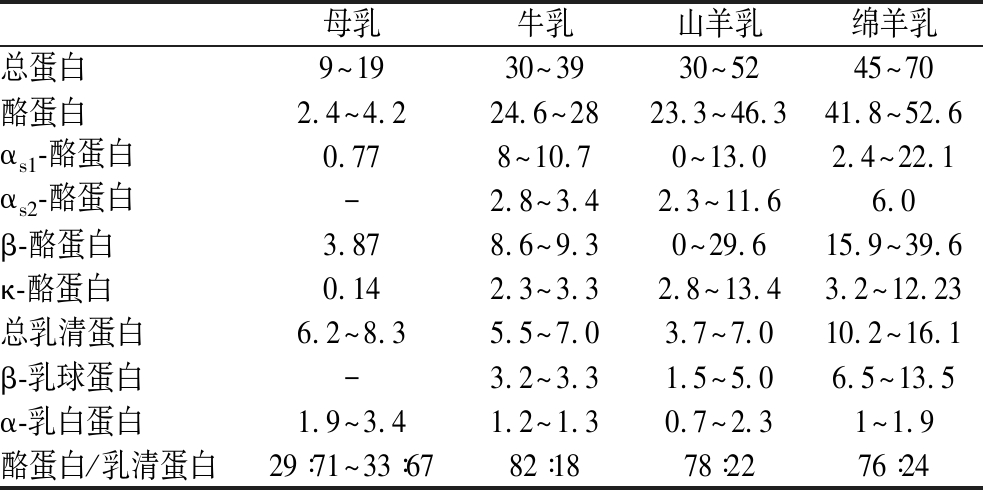
母乳牛乳山羊乳绵羊乳总蛋白9~1930~3930~5245~70酪蛋白2.4~4.224.6~2823.3~46.341.8~52.6αs1-酪蛋白0.778~10.70~13.02.4~22.1αs2-酪蛋白-2.8~3.42.3~11.66.0β-酪蛋白3.878.6~9.30~29.615.9~39.6κ-酪蛋白0.142.3~3.32.8~13.43.2~12.23总乳清蛋白6.2~8.35.5~7.03.7~7.010.2~16.1β-乳球蛋白-3.2~3.31.5~5.06.5~13.5α-乳白蛋白1.9~3.41.2~1.30.7~2.31~1.9酪蛋白/乳清蛋白29∶71~33∶6782∶1878∶2276∶24
1.3.4 微观结构
将未消化和消化后的样品与FITC无水乙醇溶液(2∶1 000,g∶mL)混合,对蛋白质进行染色,反应20 min。将10 μL的混合物转移到载玻片上,用盖玻片覆盖后在荧光显微镜下用10倍放大镜观察蛋白质微观结构。
1.3.5 SDS-PAGE
0 min和30 min的样品用超纯水将蛋白质质量浓度稀释至2 mg/mL,其余样品不作处理;将每个样品与等量的缓冲液混合,煮沸5 min。SDS-PAGE用12%分离凝胶和4%浓缩胶进行,凝胶由考马斯亮蓝R250染色,使用Image LabTM软件(3.0版)观察并进行图像分析。
1.3.6 蛋白水解度
用邻苯二甲醛法测定消化物的水解程度。测试前,样品在4 ℃下以10 000×g离心30 min。上清液经0.45 μm离心尼龙膜过滤器过滤,然后用分光光度计测量340 nm处的吸光度。水解度的计算是根据前人[11]的研究进行的。
1.3.7 游离氨基酸分析
采用高效液相色谱法测定样品中游离氨基酸的组成和含量。将各样品与10%(体积分数)的三氯乙酸溶液按1∶1(体积比)混合,混匀后超声30 min,静置过夜,然后将样品在4 ℃,10 000×g条件下离心30 min,将上清液过0.45 μm离心尼龙膜过滤器过滤。
1.3.8 高效尺寸排除色谱法
使用Waters e2695高效液相色谱系统跟踪胃消化过程中肽的释放。样品在10 000×g,4 ℃条件下离心 30 min。上清液经膜过滤后转移到TSK-GEL G2000SWxl色谱柱(300 mm×7.8 mm,5 μm)上。流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=400∶600∶1,流速为 0.5 mL/min。标准物质包括细胞色素C、肽酶、杆菌肽、乙硫氨酸-蛋氨酸-酪氨酸-精氨酸和乙硫氨酸-蛋氨酸-蛋氨酸。
1.4 统计与数据分析
使用 GraphPad Prism 9(GraphPad 软件公司)进行数据分析。采用单因素方差分析来分析未加热组和不同加热组之间以及不同物种组之间的差异。蛋白质水解度和游离氨基酸数据以每组“平均值±标准差”表示(每组n=2或3)。所有统计分析均使用SPSS 27.0版进行,统计学显著水平设定为P<0.05(IBM SPSS,芝加哥,伊利诺斯州,美国)。在评估显著性时,使用邓肯事后检验法进行事后检验。如果发现缺乏正态性,则使用Tamhane的T2检验。
2 结果与分析
2.1 胃消化过程中pH的变化
表1列出了体外动态模拟胃消化过程中各样品的pH值变化。消化前,样品的pH值为6.4±0.04~6.87±0.08,胃液的初始pH值为3.2。在胃消化过程中,随着胃液和胃酸的分泌以及胃排空的进行,消化液pH值逐渐降低。本研究发现,消化中期(30~60 min),热处理强度越大,消化液pH值下降幅度越小,喷雾干燥乳和巴氏杀菌乳的pH值下降幅度小于原乳;这是由于热处理后乳清蛋白(whey protein,WP)发生变性,与酪蛋白胶束表面结合,由于WP的空间位阻效应,形成了疏松多孔的半固态凝块,对胃酸有一定的缓冲能力[12]。消化中期巴氏杀菌乳的pH值变化低于喷雾干燥乳,这可能是因为与喷雾干燥乳相比,巴氏杀菌乳在胃中形成的蛋白质凝块更为紧密,因此对胃液酸碱的缓冲能力较弱。在消化后期(120 min),在消化液和胃排空的多重作用下,样品蛋白质水解加速,凝块的形态由多孔网状固体变为溶胶-凝胶,凝块的缓冲能力明显降低[13],导致胃液pH值迅速下降,不同样品间的pH值无显著差异。
2.2 体外消化过程中蛋白质微结构的变化
胃消化过程中HM和经不同热处理的动物乳蛋白凝块微观结构如图1所示。0 min时,在不添加消化酶的情况下将乳蛋白溶液的pH值调至4.0,观察到蛋白聚集。当pH值降至等电点(isoelectric point,pI)时,酪蛋白的净电荷降至0,酪蛋白最大程度地折叠,相互结合形成聚集体。随着胃酸连续分泌和排空,蛋白质在胃蛋白酶的作用下被水解,蛋白质团块逐渐减少,胃消化30 min时仍能观察到不同样品蛋白质凝块大小和聚集程度的差异,胃消化 60 min时胃中蛋白质凝块的大小无明显差异。动态消化过程中观察到的蛋白质聚集受到 pH 值和热处理强度的影响。胃消化液的连续分泌导致胃消化阶段的pH值降至约2(< pI),同时,加热也导致乳大量酸化,在酸化的情况下,κ-酪蛋白中谷氨酸和天冬氨酸残基的羧基发生质子化,κ-酪蛋白以塌陷的形式逐渐失去溶解性,酪蛋白胶束的聚集导致絮凝[14]。可以清楚地看到,HM形成的蛋白质凝块最细小松散。原乳中CRM的蛋白质凝块更加柔软细腻。此外,热处理后的牛乳、山羊乳和绵羊乳的蛋白质凝块明显小于同物种原乳,破碎程度更高,蛋白质网络更开放,这有利于蛋白质水解,胃排空率也会更高。YE等[15]发现,与原乳相比加热后的乳都显示出更柔软的凝块和更快的胃排空率,这与本研究的结果一致。热处理可能会减少酪蛋白-酪蛋白之间的相互作用以及酪蛋白-脂肪球之间的相互作用,从而改变酪蛋白链的方向并发生融合重排,使凝块结构发生变化,形成更开放松散的网络[16],这些结构改变会影响消化过程中酶与裂解位点的结合,从而进一步影响蛋白质水解动力学。

图1 胃消化过程中乳蛋白质微观结构
Fig.1 Microstructure of milk proteins during gastric digestion
2.3 体外消化过程中的蛋白质水解动力学
图2显示了各样品在胃消化过程中的SDS-PAGE蛋白质图谱。除乳中的蛋白质成分产生的SDS-PAGE条带外,凝胶图像中还产生了其他条带,这可能是由于加热和消化过程中引发的一系列化学反应导致蛋白质降解和肽链断裂所致。本研究发现在体外动态胃消化过程中,酪蛋白的消化速度快于乳清蛋白,这是因为乳清蛋白具有相对紧密的二级和三级结构,在天然状态下不易凝结,天然β-乳球蛋白以二聚体形式存在,具有球状结构,可将疏水分子保留在蛋白质结构中。在原乳样品中,HM和BRM的酪蛋白条带在胃消化120 min时已观察不到,而CRM和ORM中仍存在少量酪蛋白条带,这表明在胃消化过程中,HM和BRM中酪蛋白的水解速度快于CRM和ORM。这可能与不同物种牛奶中酪蛋白的含量和百分比有关,众所周知,较低的酪蛋白/乳清蛋白值能够导致更快的蛋白质消化,与牛乳、山羊乳和绵羊乳相比,HM的酪蛋白/乳清蛋白值较低,有利于消化的进行,各物种乳的酪蛋白/乳清蛋白值如表2所示。
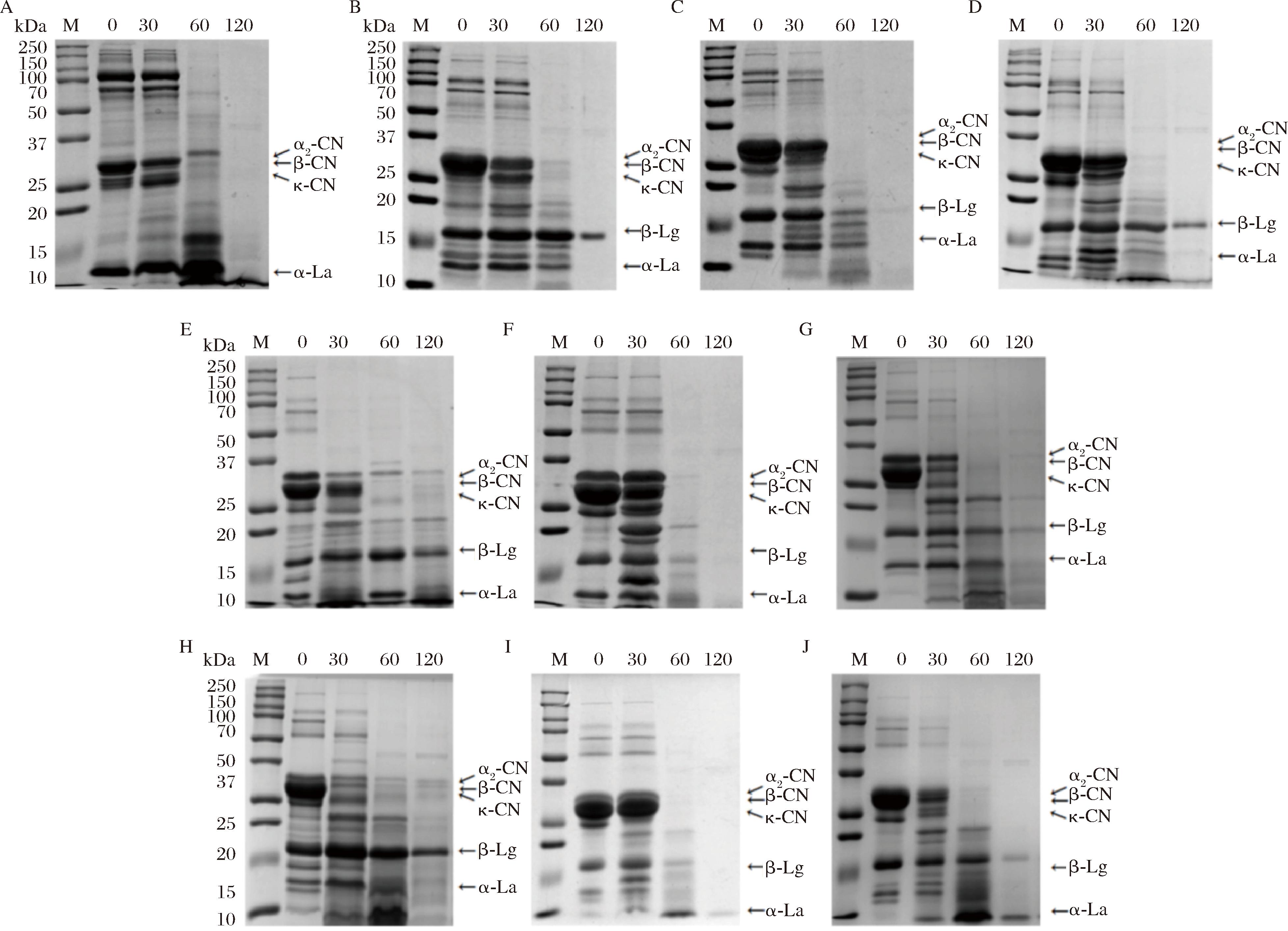
A-母乳;B-牛原乳;C-牛巴氏杀菌乳;D-牛喷雾干燥乳;E-山羊原乳;F-山羊巴氏杀菌乳;G-山羊喷雾干燥乳;H-绵羊原乳;I-绵羊巴氏杀菌乳;J-绵羊喷雾干燥乳
图2 利用体外消化模型对乳蛋白质进行SDS-PAGE分析
Fig.2 SDS-PAGE analysis of milk proteins using an in-vitro digestion model
注:M:Maker;αs-CN:αs-酪蛋白;β-CN:β-酪蛋白;κ-CN:κ-酪蛋白;β-Lg:β-乳球蛋白;α-La:α-乳白蛋白。
SDS-PAGE结果表明,巴氏杀菌和喷雾干燥处理后样品中酪蛋白和乳清蛋白的消化速度快于原乳。在胃消化前期(0~30 min),各样品之间没有明显差异,但在消化中期(60 min),巴氏杀菌乳和喷雾干燥乳中不再有明显酪蛋白条带,而原乳中仍有条带残留,说明热处理在一定程度上加速了蛋白质的消化,热处理会导致一小部分酪蛋白去磷酸化并降低其在乳清中的溶解度,从而使其更易水解。在婴幼儿胃中,高磷酸化水平的酪蛋白在生理条件下会形成致密的团块,限制了消化酶对酪蛋白中肽键的利用,从而降低蛋白质水解的效率[18]。在胃消化的中后期,同一物种间乳清蛋白消化率为:巴氏杀菌乳>喷雾干燥乳>原乳,表明热处理在一定程度上促进了蛋白质的消化。WP是一种对热敏感的蛋白质,热处理可使变性乳清蛋白和κ-酪蛋白在酪蛋白胶束表面聚合,形成可溶性复合物,复合物的形成可使酪蛋白从胶束中解离,从而导致乳蛋白质组分在酪蛋白胶束相/乳清相中的分布发生变化,进而影响牛奶的胃消化动力学[19]。
2.4 蛋白质水解动力学
SDS-PAGE条带只能观察蛋白质在胃中的消化,而水解度和肽段分布可以定量地反映样品在胃内的水解程度,能够更直观地观察蛋白质在胃中的水解动力学。蛋白水解度和肽段分布的结果如图3和图4所示。二者结果一致表明,随着消化时间的延长,蛋白质水解程度升高并逐渐水解为氨基酸和小肽。

A-牛乳组;B-山羊乳组;C-绵羊乳组
图3 体外动态消化过程中各样品乳蛋白胃消化液水解度变化
Fig.3 Changes in hydrolysis degree of milk protein gastric digestive juice of each sample during dynamic digestion in-vitro
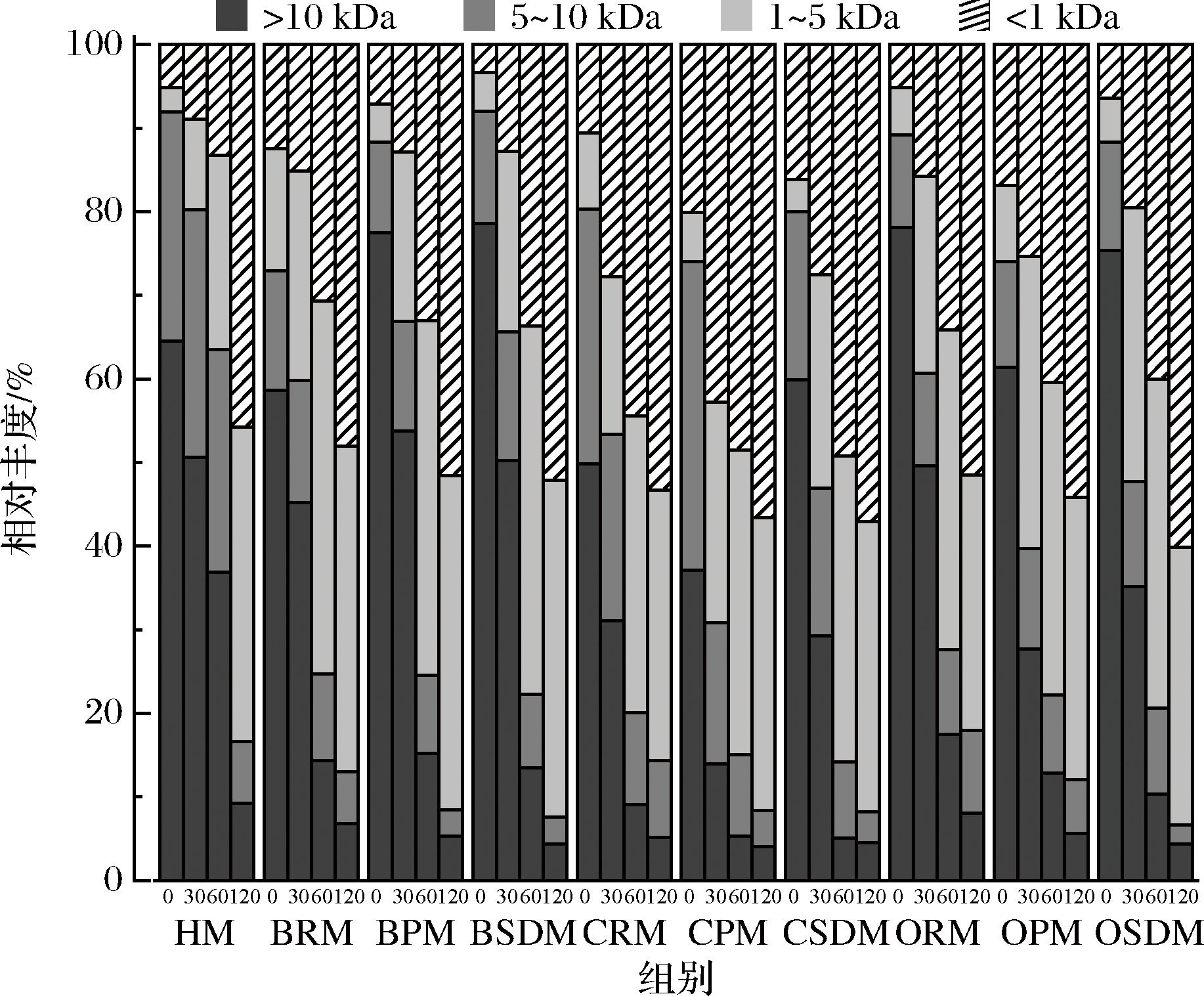
图4 婴幼儿体外模拟动态胃消化过程中乳蛋白消化液肽段分子质量
Fig.4 Molecular weight of peptides in samples during simulated dynamic gastric digestion in infants and young children in-vitro
图3结果表明,在胃消化过程中,不同样品的蛋白质水解程度具有显著差异,大多数蛋白质只被部分消化,水解程度较低。在胃消化结束时(120 min),观察到的HM水解程度最低,山羊乳组所有样品蛋白质的水解程度均高于牛乳组和绵羊乳组。
由图4可以看出,0 min时,肽段分布主要在10 kDa以上,随着蛋白质的水解,高分子质量的比例下降,小分子质量肽占比逐渐增加。胃消化120 min后,HM中小分子质量肽(<1 kDa)的比例明显低于BRM、CRM和ORM(P<0.05)。同时,相同物种间,喷雾干燥乳中小分子质量肽(<1 kDa)的比例最高,其次是巴氏杀菌乳,而原乳中小分子质量肽(<1 kDa)的比例最低,这表明较高强度的热处理更有利于蛋白质水解成小分子质量肽段。
HM在胃消化过程中被水解的程度明显低于其他乳,这可能是由于HM在动态胃消化过程中形成的蛋白凝块比其他物种乳的蛋白凝块更松散细腻,从而加速了胃蠕动和排空,使胃中可被消化的底物更少[5]。同一物种的蛋白质水解率从高到低依次为:喷雾干燥乳>巴氏杀菌乳>原乳。本研究中,影响蛋白质胃消化动力学的主要因素可能是热处理强度的差异,高热处理(均质+超高温灭菌预热协同处理)和低热处理(巴氏杀菌)。有研究表明,热处理会增加酪蛋白在胃中的抗性,降低其水解速度及水解程度[20]。例如,对浓缩乳进行高热处理后,酪蛋白在胃消化过程中的抗性增强[6],热处理(90 ℃/10 min)导致酪蛋白在胃中完全消化的时间延长[21-22]。热处理引起的酪蛋白结构变化有限,但热处理加速了酪蛋白凝块的裂解,并最终导致酪蛋白水解度和水解速率的增加[23-25]。热处理强度引起的蛋白修饰对蛋白质质量显著影响,特别是乳蛋白糖基化,热处理造成酪蛋白中赖氨酸残基发生糖基化修饰,导致消化酶无法作用该位点,降低了酪蛋白的水解速率、水解肽中大分子肽比例增加;β-酪蛋白和αs2-酪蛋白发生糖基化修饰后不易于水解,赖氨酸生物利用率显著降低[26-29]。但也有相反研究结果显示超高温灭菌奶的餐后血氮水平和尿素氮水平高于巴氏杀菌乳,表明高热处理更有利于乳蛋白在胃肠道中的消化和水解[30]。这些结果表明,热处理对于乳蛋白消化的影响取决于确切的加工条件,蛋白质去折叠化和空间位阻之间的平衡将决定糖基化后乳蛋白的可消化性是增加还是降低。多数研究表明这种平衡更倾向于难以接近的裂解位点,导致整体消化率较低[31-32]。
2.5 体外消化过程中游离氨基酸的释放
胃消化过程中氨基酸变化规律的解析有助于更好地了解乳蛋白在体内的可用性和吸收情况。各样品消化前的游离氨基酸含量均较低,总游离氨基酸含量为(2.79±0.09)~(12.07±0.69) mg/g蛋白质(图5)。样品中总游离氨基酸(total amino acids,TAA)、必需氨基酸(essential amino acids,EAA)和非必需氨基酸(nonessential amino acids,NEAA)的含量随着消化的进行而增加,EAA在TAA中的占比明显增加,NEAA在TAA中的占比明显下降(表3)。
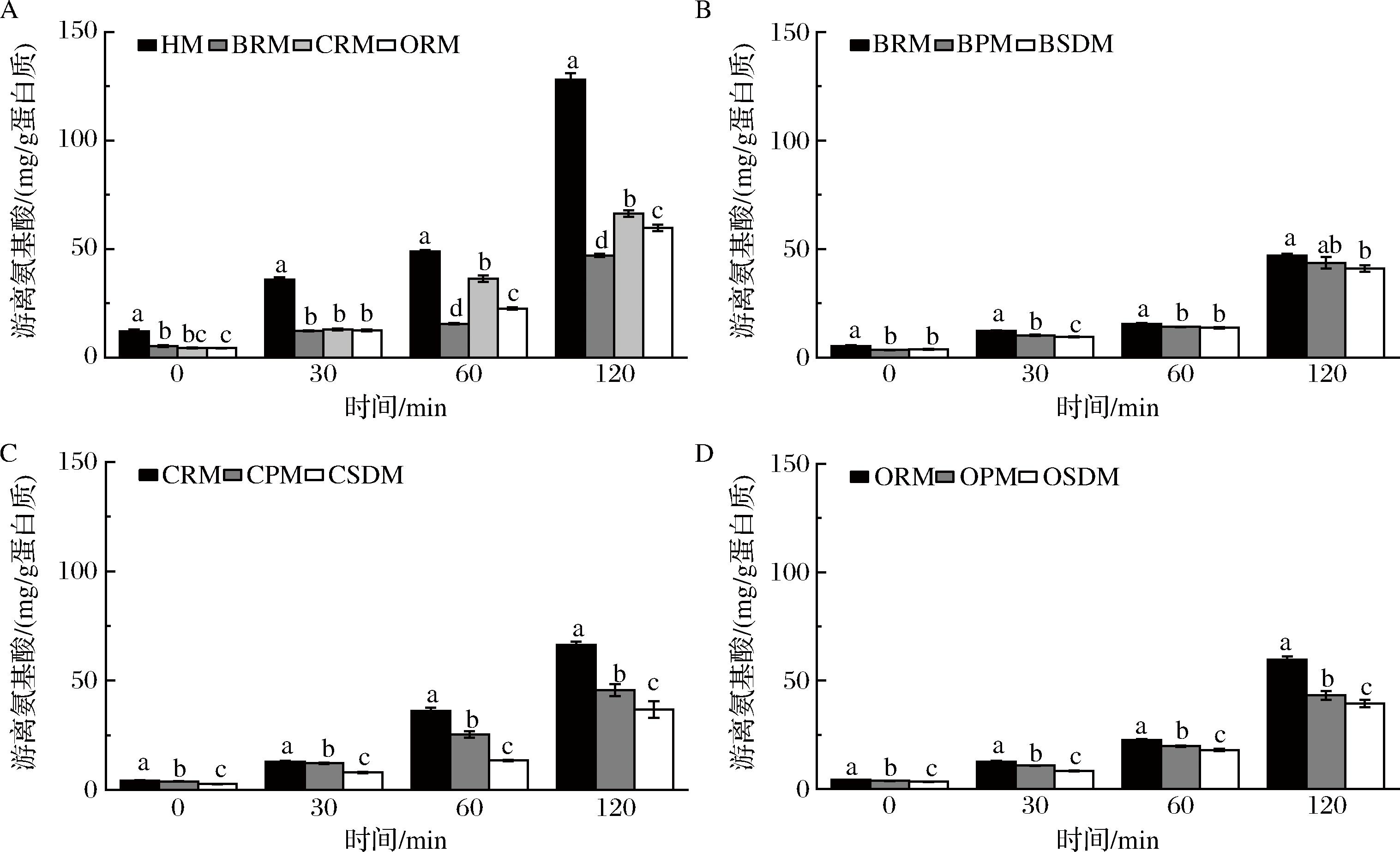
A-原乳组;B-牛乳组;C-山羊乳组;D-绵羊乳组
图5 体外动态胃消化过程中游离氨基酸释放量
Fig.5 Free amino acids release during dynamic gastric digestion in-vitro
注:小写字母表示代表差异显著性(P<0.05)。
表3 不同乳蛋白消化液中EAA和NEAA在TAA中的占比
Table 3 Percentage of EAA and NEAA to TAA in each sample 单位:%
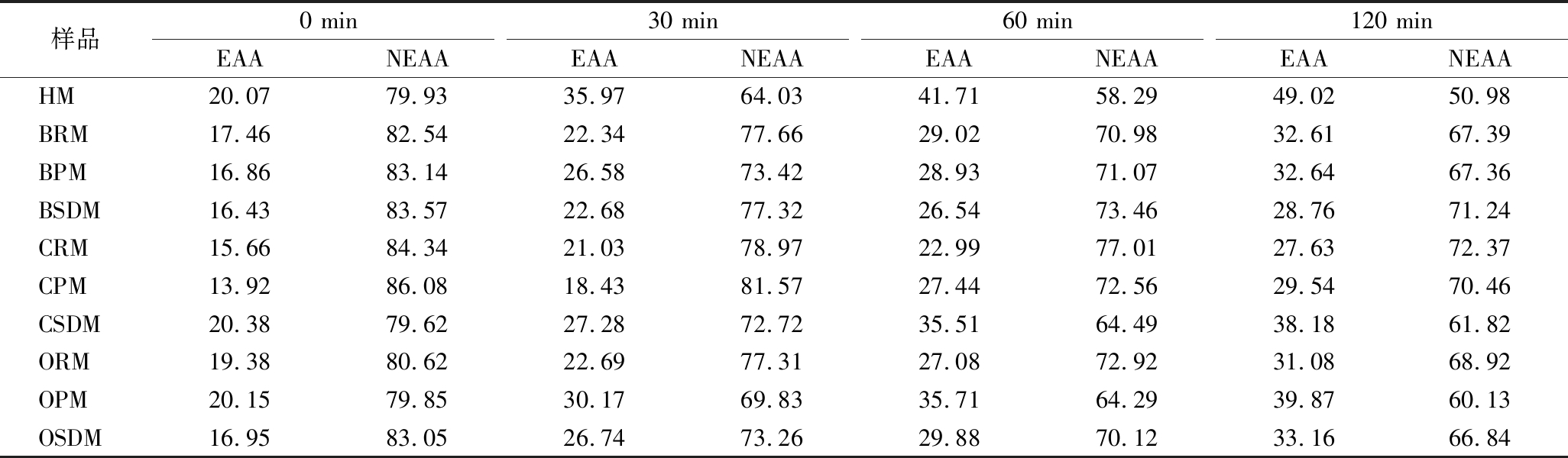
样品0 min30 min60 min120 minEAANEAAEAANEAAEAANEAAEAANEAAHM20.0779.9335.9764.0341.7158.2949.0250.98BRM17.4682.5422.3477.6629.0270.9832.6167.39BPM16.8683.1426.5873.4228.9371.0732.6467.36BSDM16.4383.5722.6877.3226.5473.4628.7671.24CRM15.6684.3421.0378.9722.9977.0127.6372.37CPM13.9286.0818.4381.5727.4472.5629.5470.46CSDM20.3879.6227.2872.7235.5164.4938.1861.82ORM19.3880.6222.6977.3127.0872.9231.0868.92OPM20.1579.8530.1769.8335.7164.2939.8760.13OSDM16.9583.0526.7473.2629.8870.1233.1666.84
与其他物种乳相比,HM中的游离氨基酸含量最高,HM的蛋白质凝块网络更为开放,有利于更多的酶切位点更多暴露出来,从而加快游离氨基酸的释放。在不同的热处理条件下,BRM、CRM和ORM释放的游离氨基酸高于热处理组:原乳>巴氏杀菌乳>喷雾干燥乳,这表明热处理可能会在一定程度上抑制消化过程游离氨基酸的释放。这可能是热处理过程中蛋白质发生糖基化、氧化及消旋化等变性和化学修饰造成的。统计发现,24项研究中,有20项研究发现蛋白质变性和改性降低了蛋白质的消化率和生物利用率[16],糖基化的β-CN的消化率低于单独加热的β-CN的消化率[33],摄入糖基化乳蛋白会导致血浆中赖氨酸浓度下降[34]。RUTHERFURD等[35]也发现,牛乳中的酪氨酸和α-乳白蛋白氧化会显著降低大鼠回肠中氨基酸的真消化率和酪蛋白的总消化率。热处理引起的蛋白质改性导致生物利用率下降,主要有3个原因:a)糖基化修饰了赖氨酸位点,直接阻碍了胃蛋白酶的识别和裂解;b)酶解位点附近的糖基化修饰间接阻碍了胃蛋白酶的识别和酶解;c)糖基化修饰引起的交联阻碍了蛋白酶酶解位点的可及性。除糖基化外,氧化和消旋化也会降低总消化率和蛋白质质量,但对氧化和消旋化的研究程度低于糖化。
3 结论
该研究利用体外动态胃消化模型,研究了不同物种(人、牛、山羊和绵羊)和热处理强度(巴氏杀菌和喷雾干燥)对乳蛋白水解程度、消化率和游离氨基酸释放的影响。热处理会导致婴幼儿体外消化过程中蛋白质消化模式和水解动力学发生变化。巴氏杀菌处理有利于胃内凝块的消化,而喷雾干燥处理则增加了凝块的水解程度,这些发现可能对乳制品加工以及乳蛋白在体内的吸收利用具有一定的指导意义。
[1] NGUYEN H T H, GATHERCOLE J L, DAY L, et al.Differences in peptide generation following in vitro gastrointestinal digestion of yogurt and milk from cow, sheep and goat[J].Food Chemistry, 2020, 317:126419.
[2] ![]() M.Consumer behaviour on Slovak yoghurt and fermented milk products market[J].Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis, 2017, 65(6):1967-1978.
M.Consumer behaviour on Slovak yoghurt and fermented milk products market[J].Acta Universitatis Agriculturae et Silviculturae Mendelianae Brunensis, 2017, 65(6):1967-1978.
[3] BITTANTE G, AMALFITANO N, BERGAMASCHI M, et al.Composition and aptitude for cheese-making of milk from cows, buffaloes, goats, sheep, dromedary camels, and donkeys[J].Journal of Dairy Science, 2022, 105(3):2132-2152.
[4] BACH A, ARIS A, VIDAL M, et al.Influence of milk processing temperature on growth performance, nitrogen retention, and hindgut’s inflammatory status and bacterial populations in a calf model[J].The Journal of Dairy Research, 2017, 84(3):355-359.
[5] LIU Z D, SUOLANG Q P, WANG J J, et al.Formation of structured clots, gastric emptying and hydrolysis kinetics of yak milk during in vitro dynamic gastrointestinal digestion:Impact of different heat treatments[J].Food Research International, 2022, 162(Pt A):111958.
[6] DUPONT D, BOUTROU R, MENARD O, et al.Heat treatment of milk during powder manufacture increases casein resistance to simulated infant digestion[J].Food Digestion, 2010, 1(1):28-39.
[7] ALEXEEV E E, HE X, SLUPSKY C M, et al.Effects of iron supplementation on growth, gut microbiota, metabolomics and cognitive development of rat pups[J].PLoS One, 2017, 12(6):e0179713.
[8] LYNCH J M, BARBANO D M.Kjeldahl nitrogen analysis as a reference method for protein determination in dairy products[J].Journal of AOAC International, 1999, 82(6):1389-1398.
[9] ZHANG H Y, DUAN S F, YU Y, et al.Impact of casein-to-whey protein ratio on gastric emptying, proteolysis, and peptidome profile of fermented milk during in vitro dynamic gastrointestinal digestion in preschool children[J].Food Chemistry, 2023, 405:134840.
[10] MUDIE D M, MURRAY K, HOAD C L, et al.Quantification of gastrointestinal liquid volumes and distribution following a 240 mL dose of water in the fasted state[J].Molecular Pharmaceutics, 2014, 11(9):3039-3047.
[11] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science, 2001, 66(5):642-646.
[12] YE A Q, CUI J, DALGLEISH D, et al.Formation of a structured clot during the gastric digestion of milk:Impact on the rate of protein hydrolysis[J].Food Hydrocolloids, 2016, 52:478-486.
[13] LI S Q, PAN Z, YE A Q, et al. Structural and rheological properties of the clots formed by ruminant milks during dynamic in vitro gastric digestion: Effects of processing and species[J]. Food Hydrocolloids, 2022, 126:107465.
[14] CORREDIG M, NAIR P K, LI Y, et al.Invited review:Understanding the behavior of caseins in milk concentrates[J].Journal of Dairy Science, 2019, 102(6):4772-4782.
[15] YE A Q, LIU W L, CUI J, et al.Coagulation behaviour of milk under gastric digestion:Effect of pasteurization and ultra-high temperature treatment[J].Food Chemistry, 2019, 286:216-225.
[16] VAN LIESHOUT G A A V, LAMBERS T T, BRAGT M C E, et al.How processing may affect milk protein digestion and overall physiological outcomes:A systematic review[J].Critical Reviews in Food Science and Nutrition, 2020, 60(14):2422-2445.
[17] HUANG J L, ZHANG L N, LAN H L, et al.How to adjust α-lactalbumin and β-casein ratio in milk protein formula to give a similar digestion pattern to human milk?[J].Journal of Food Composition and Analysis, 2022, 110:104536.
[18] MA Y, HOU Y M, XIE K, et al.Digestive differences in immunoglobulin G and lactoferrin among human, bovine, and caprine milk following in vitro digestion[J].International Dairy Journal, 2021, 120:105081.
[19] BRODKORB A, CROGUENNEC T, BOUHALLAB S, et al. Advanced Dairy Chemistry[M]. New York: Springer New York, 2016:155-178.
[20] STENDER E G P, KOUTINA G, ALMDAL K, et al.Isoenergic modification of whey protein structure by denaturation and crosslinking using transglutaminase[J].Food &Function, 2018, 9(2):797-805.
[21] DUPONT D, MANDALARI G, MOLLÉ D, et al.Food processing increases casein resistance to simulated infant digestion[J].Molecular Nutrition &Food Research, 2010, 54(11):1677-1689.
[22] S NCHEZ-RIVERA L, MÉNARD O, RECIO I, et al.Peptide mapping during dynamic gastric digestion of heated and unheated skimmed milk powder[J].Food Research International, 2015, 77:132-139.
NCHEZ-RIVERA L, MÉNARD O, RECIO I, et al.Peptide mapping during dynamic gastric digestion of heated and unheated skimmed milk powder[J].Food Research International, 2015, 77:132-139.
[23] EGGER L, MÉNARD O, BAUMANN C, et al.Digestion of milk proteins:Comparing static and dynamic in vitro digestion systems with in vivo data[J].Food Research International, 2019, 118:32-39.
[24] EGGER L, MÉNARD O, DELGADO-ANDRADE C, et al.The harmonized INFOGEST in vitro digestion method:From knowledge to action[J].Food Research International, 2016, 88:217-225.
[25] ![]() , ZAJ
, ZAJ C P,
C P, ![]() J, et al. The Effect of Heat Treatment on Cow’s Milk Protein Profiles[J]. Foods, 2022, 11(7):1023.
J, et al. The Effect of Heat Treatment on Cow’s Milk Protein Profiles[J]. Foods, 2022, 11(7):1023.
[26] MIWA N, YOKOYAMA K, WAKABAYASHI H, et al.Effect of deamidation by protein-glutaminase on physicochemical and functional properties of skim milk[J].International Dairy Journal, 2010, 20(6):393-399.
[27] WADA Y, LÖENNERDAL B.Effects of different industrial heating processes of milk on site-specific protein modifications and their relationship to in vitro and in vivo digestibility[J].Journal of Agricultural and Food Chemistry, 2014, 62(18):4175-4185.
[28] MELTRETTER J, BECKER C-M, PISCHETSRIEDER M.Identification and site-specific relative quantification of β-lactoglobulin modifications in heated milk and dairy products[J].Journal of Agricultural and Food Chemistry, 2008, 56(13):5165-5171.
[29] WADA Y, LÖENNERDAL B.Effects of industrial heating processes of milk-based enteral formulas on site-specific protein modifications and their relationship to in vitro and in vivo protein digestibility[J].Journal of Agricultural and Food Chemistry, 2015, 63(30):6787-6798.
[30] LACROIX M, BON C, BOS C, et al.Ultra high temperature treatment, but not pasteurization, affects the postprandial kinetics of milk proteins in humans[J].The Journal of Nutrition, 2008, 138(12):2342-2347.
[31] JOUBRAN Y, MOSCOVICI A, LESMES U.Antioxidant activity of bovine alpha lactalbumin Maillard products and evaluation of their in vitro gastro-duodenal digestive proteolysis[J].Food &Function, 2015, 6(4):1229-1240.
[32] ZHAO D, LI L, LE T T, et al.Digestibility of glyoxal-glycated β-casein and β-lactoglobulin and distribution of peptide-bound advanced glycation end products in gastrointestinal digests[J].Journal of Agricultural and Food Chemistry, 2017, 65(28):5778-5788.
[33] ZHAO D, LE T T, LARSEN L B, et al.Effect of glycation derived from α-dicarbonyl compounds on the in vitro digestibility of β-casein and β-lactoglobulin:A model study with glyoxal, methylglyoxal and butanedione[J].Food Research International, 2017, 102:313.
[34] NYAKAYIRU J, VAN LIESHOUT G A A V, TROMMELEN J, et al.The glycation level of milk protein strongly modulates post-prandial lysine availability in humans[J].The British Journal of Nutrition, 2020, 123(5):545-552.
[35] RUTHERFURD S M, MONTOYA C A, MOUGHAN P J.Effect of oxidation of dietary proteins with performic acid on true ileal amino acid digestibility as determined in the growing rat[J].Journal of Agricultural and Food Chemistry, 2014, 62(3):699-707.