双乙酰作为一种挥发性风味化合物,天然存在于许多植物香气和发酵产品中,如百合、黑莓、啤酒、葡萄酒、酸奶、酸奶油、奶酪、醋等[1-2]。双乙酰可作为食品合成香料添加到乳制品中来改善产品的风味品质,还能赋予酒类和调味品、肉及肉制品独特的香气和风味。此外,双乙酰具有良好的抗菌作用,不仅可降低人类食源性病原体对食物的污染程度,还能抑制采后果蔬真菌病原体的生长,减少果蔬自身品质的损耗并延长其贮藏期[3]。
目前对双乙酰的研究主要围绕其制备和分析方法,对于应用方面研究较少。双乙酰的制备方法主要包括直接提取法、化学合成法和生物合成法,其中应用最广泛的为生物合成法。生物合成法具有高产低能、绿色环保和安全可靠等优点,是目前国内外双乙酰研究的热点之一[4-5]。双乙酰的分析方法主要分为两类,分别是直接分析法和α-二羰基化合物分析法,其中α-二羰基化合物分析法是双乙酰仪器检测主要采用的一类方法。此外,双乙酰因其特有的黄油气味和良好的抑菌功效,在乳制品、酒类和调味品、肉及肉制品、果蔬保鲜等领域已有相关应用。本文对双乙酰的理化性质、安全性、制备方法、分析方法及其在食品行业中的应用现状等方面进行综述,以期为双乙酰的进一步研究和应用发展提供参考。
1 双乙酰的理化性质及安全性
1.1 双乙酰的理化性质
双乙酰,又名丁二酮、2,3-丁二酮等,经稀释后呈强烈的奶油香气,外观呈黄色至黄绿色液体,分子质量为86.09,熔点为-2~-4 ℃,沸点为88 ℃,分子式为C4H6O2,分子结构如图1所示。双乙酰在室温下可迅速挥发,溶于甘油和水,混溶于乙醇、乙醚、大多数非挥发性油和丙二醇,不溶于矿物油。
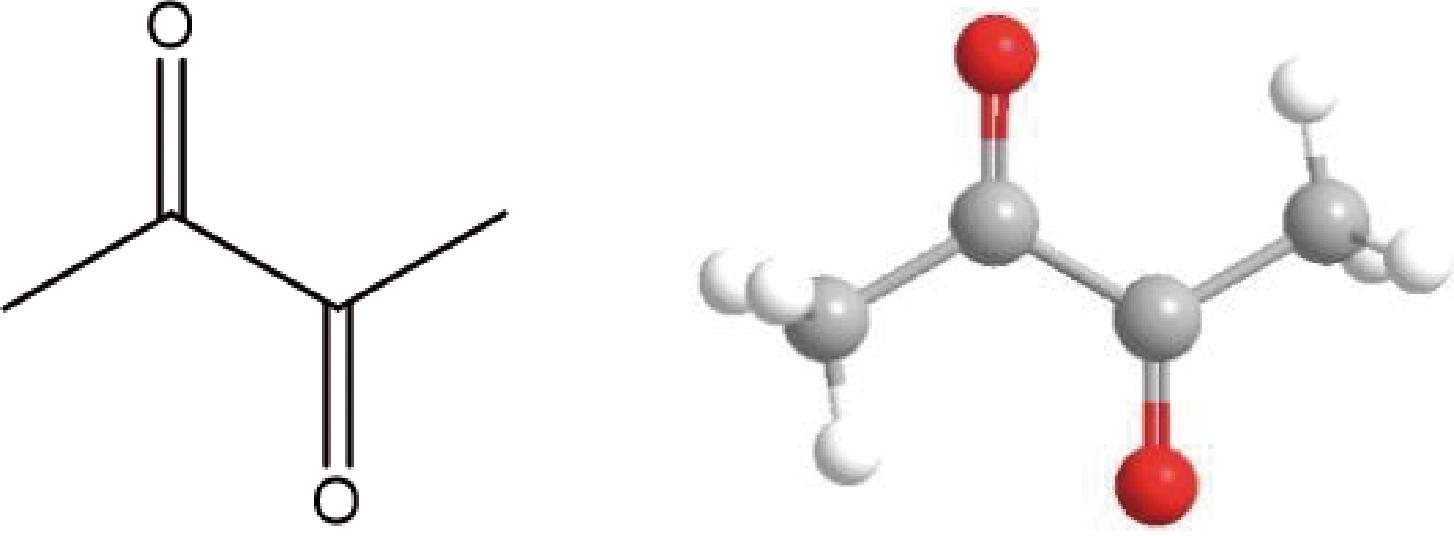
图1 双乙酰的平面与立体分子结构
Fig.1 Planar and stereoscopic molecular structures of diacetyl
1.2 双乙酰的安全性
美国食品和药物管理局允许在食品中添加双乙酰,并认为摄入食物中的双乙酰通常是安全的(generally recognized as safe,GRAS)[6]。双乙酰同时也是我国广泛使用的食品添加剂(GB 2760—2024《食品安全国家标准 食品添加剂使用标准》)之一,常用于黄油、干酪、酸奶油等乳制品生产,赋予产品类似黄油的风味[7]。因此,在食品中合理使用双乙酰是安全、无毒害的。
2 双乙酰的制备方法
2.1 直接提取法
直接提取法是指从含有双乙酰的天然植物中提取植物精油,再通过游离法将其分离从而获得双乙酰[7]。这种以天然植物为原材料生产双乙酰的方法,得到的双乙酰产物稳定性好,提取过程简便且绿色安全,但是弊端也很明显。直接提取法生产经济效益低,不能满足工业化生产的需求,因而实际中已经很少使用该工艺生产双乙酰[8]。
2.2 化学合成法
目前,工业化生产双乙酰的主流方法是化学合成法,根据生产过程中氧化剂成分和反应条件的不同,具体细分为异丁醛气相氧化法、丁酮氧化法、乙偶姻氧化法等[7,9]。
2.2.1 异丁醛气相氧化法
异丁醛气相氧化法是以异丁醛为底物,在加入空气和催化剂的条件下经汽化反应氧化生成双乙酰的过程,并在这一过程中有副产物丙酮的生成。国内学者基于传统的异丁醛气相氧化法进行相关研究,测试了反应中理想的气相氧化环境,结果表明,当反应温度达到290 ℃、异丁醛体积比率为10%时,双乙酰的得率可上升至28%,纯度则可达到95%。此法虽然具备低污染、高回收的特点,但因反应过程中副产物丙酮的出现,致使双乙酰的分离成本较高,难以实现低成本的大规模生产。
2.2.2 丁酮氧化法
丁酮氧化法是丁酮与多种氧化剂经氧化作用生成双乙酰的一种反应。按照不同氧化剂的使用差异又可细分为:亚硝酸盐氧化法、空气-金属催化氧化法、二氧化硒臭氧氧化法等[10]。
亚硝酸盐氧化法是工业生产双乙酰的传统方法之一,该方法利用亚硝酸钠作为氧化剂来对丁酮进行氧化,初步获得粗制双乙酰,再结合纯化步骤对其进行精炼,最后可以获得较纯净的双乙酰产品。但该方法依赖的氧化剂带有一定的致癌倾向,并会生成硫酸氢钠这类副产物,这不仅增加了分离的成本,难以实现有效的回收,还对生态环境造成了伤害。
空气-金属催化氧化法通常以铜、镍、锌、钒或铁等金属盐或金属的氧化物为催化剂,使丁酮在空气液相或者气相中进行氧化反应合成双乙酰。ANUNZIATA等[11]采用以Fe、V和Ti为活性中心的各种沸石,合成了VS-1、Ti-NCL、Ti-MCM-41和Fe-BEA型催化剂,并通过比表面积测定、红外光谱、X射线衍射、吡啶吸附和模板脱附等手段对其进行表征,结果表明通过溶胶-凝胶法制备的VS-1和V-ZSM-5催化剂可有效地在丁酮气相氧化中合成双乙酰。BELTRAMONE等[12]在VS-1的基础上,加入O2和30%(体积分数)H2O2,通过对丁酮进行选择性氧化来合成双乙酰,结果发现当以O2作为氧化剂时,丁酮的转化率随温度升高而增加,但双乙酰的选择性却有所降低。虽然改进后的金属催化剂促进了双乙酰的生产,但是其改进工艺比较复杂,需要进一步简化。
二氧化硒臭氧氧化法是将二氧化硒和水进行充分的混合,再经过臭氧处理,最终通过丁酮氧化反应生成双乙酰。研究人员在二氧化硒臭氧氧化法的基础上,借鉴过氧化氢催化丁酮合成双乙酰的工艺路线,将2种方法相结合,最终获得了产率在40%以上、纯度高于95%的双乙酰[10]。该方法生产的双乙酰纯度极高,但因生产过程中使用的二氧化硒含有剧毒,不宜生产食品级双乙酰。
2.2.3 丁酮肟化法
丁酮肟化法合成双乙酰包括3个步骤,首先是以亚硝酸钠和硫酸为催化剂催化甲醇和亚硝酸生成亚硝酸甲酯,其次是亚硝酸甲酯与丁酮在路易斯酸盐、磷酸和盐酸3种介质中发生肟基化反应合成双乙酰一肟,最后加入次氯酸和盐酸经水解得到粗制的双乙酰。粗制双乙酰经分离纯化可得到高纯度的双乙酰,其得率提升至42%,纯度达到92%[13]。该生产工艺中所涉及的亚硝酸甲酯毒性较大,因而生产的双乙酰安全性低,还会造成严重的环境污染。
2.2.4 乙偶姻氧化法
乙偶姻氧化法是将乙偶姻置于特定条件下,通过氧化剂的参与实现其分子中双键的断裂,进而转化为双乙酰。刘耀华[14]在微波辐射下以三氯化铁为氧化剂,当在最佳的反应条件[乙偶姻∶三氯化铁=1∶1.3(物质的量之比),微波功率400 W,辐射10 min]时,双乙酰产率可高达81.41%。王江梅等[15]采用电化学的方法来合成双乙酰,发现在低温中性的条件下,保持0.05 A电流强度生产双乙酰的效果最优。该方法相较于传统丁酮的合成方法,具有操作简便、绿色环保等优点,是一种新型的合成思路。
2.3 生物合成法
直接提取法得到的双乙酰成本较高,而化学合成法生产的双乙酰食品安全性低且存在一定的环境污染,为满足人们对于食品合成香料的需求,一种低能、高效、绿色环保的生物合成法成为了国内外研究的热点之一。生物合成法是通过微生物代谢途径发酵生产双乙酰的方法,该方法具有生产成本低、效率高、绿色环保等优点,属于环境友好型生产。随着生物工业的发展,利用微生物进行目标产品的生产已成为各大企业的共识,研究人员对其代谢通路的研究也日益深入。在自然界中,有大量可以进行自然代谢产生双乙酰的微生物,如乳酸菌(Lactobacillus)、芽孢杆菌(Bacillus)、肠杆菌(Enterobacter)以及假丝酵母菌(Candida)等[16-17],双乙酰的代表性生产菌株如表1所示。例如,具有低α-乙酰乳酸脱羧酶和乳酸脱氢酶活性的乳酸乳球菌突变株能够大量生产双乙酰,最终产量为0.52 g /L[18]。干酪乳杆菌中乳酸脱氢酶和丙酮酸脱氢酶复合物基因的突变,可以提高乳清渗透液中的乳糖合成双乙酰的能力,其产量为1.4 g/L[19]。最近,GAO等[20]对光滑假丝酵母CCTCC M202019进行了代谢工程,以生产食品级双乙酰,最终获得了产量为2.1 g/L的高产菌株。ZHANG等[21]重建了肠杆菌cloacae溶解亚种菌株SDM中的 2,3-丁二醇生物合成途径,通过敲除α-乙酰乳酸脱羧酶编码基因和灭活双乙酰还原酶DR-Ⅰ和DR-Ⅱ活性,最后获得了产量为1.45 g/L的双乙酰。目前报道的双乙酰产量最高的菌株是一种未确定种名的芽孢杆菌,在分批补料发酵中,双乙酰产量可高达11.18 g/L[22]。
表1 双乙酰的代表性生产菌株
Table 1 The representative production strain of diacetyl

菌株底物培养基双乙酰产量/(g/L)文献Lactococcus lactis subsp柠檬酸MRS培养基0.52[18]Lactobacillus casei柠檬酸MRS培养基1.4[19]Candida glabrata葡萄糖合成培养基2.1[20]Enterobacter cloacae葡萄糖M9培养基;酵母抽提物1.45[21]Bacillus sp.葡萄糖LB培养基11.18[22]
双乙酰生物合成途径如图2所示,该途径包含2种底物:当以柠檬酸为底物时,柠檬酸在柠檬酸裂解酶的作用下裂解为草酰乙酸和乙酸,其中乙酸分泌到胞外,草酰乙酸在草酰乙酸脱羧酶的作用下脱羧形成丙酮酸。丙酮酸再经过脱羧反应生成2-羟乙基-硫胺素焦磷酸(2-hydroxyethyl-thiamine pyrophosphate,HETPP),然后HETPP与丙酮酸反应形成α-乙酰乳酸。α-乙酰乳酸经过非酶催化脱羧(nonenzymatic decarboxylation,NOD)生成双乙酰,同时此途径中会有乙偶姻和2,3-丁二醇等副产物的产生。以葡萄糖为底物时,葡萄糖经过糖酵解途径生成重要的代谢中间产物丙酮酸,丙酮酸在α-乙酰乳酸合成酶的催化下生成α-乙酰乳酸,然后α-乙酰乳酸在酸性条件下经过NOD生成双乙酰。在此代谢途径中也会伴有甲酸、乳酸、乙酸、乙醇、乙偶姻和 2,3-丁二醇等副产物的生成。其中,由丙酮酸在α-乙酰乳酸合成酶的作用下生成双乙酰的途径存在一定的争论,以下综述双乙酰合成途径。
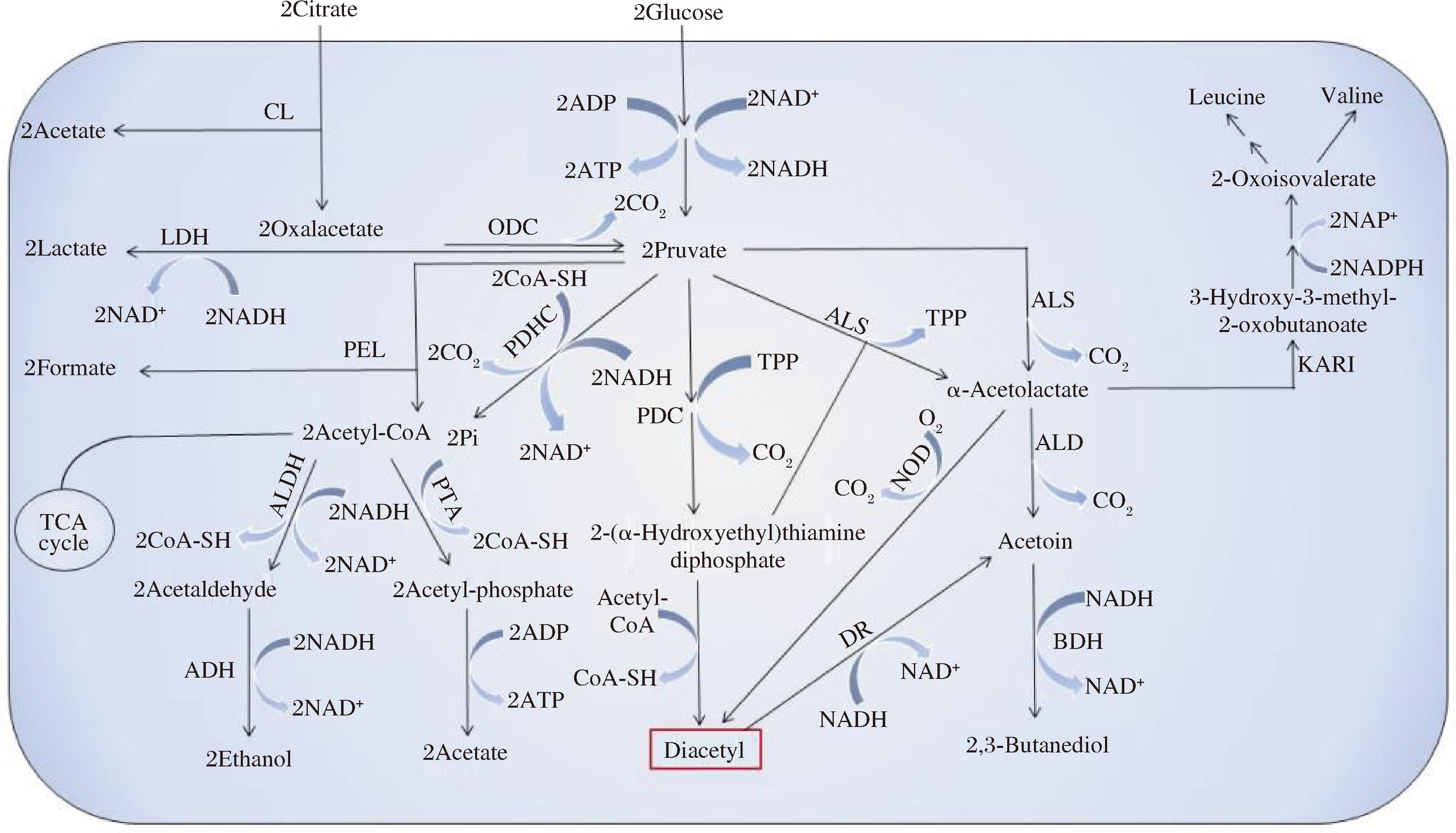
图2 双乙酰生物合成路径[25]
Fig.2 Diacetyl biosynthetic pathway [25]
注:TCA cycle-三羧酸循环;CL-柠檬酸裂解酶;ODC-草酰乙酸脱羧酶;PDHC-丙酮酸脱氢酶复合物;PDC-丙酮酸脱酶;ALS-α-乙酰乳酸合成酶;NOD-非酶催化脱羧;DR-双乙酰还原酶;ALD-乙酰乳酸脱羧酶;BDH-丁二醇脱氢酶;LDH-乳酸脱氢酶;PFL-丙酮酸甲酸裂解酶;ALDH-醛脱氢酶;ADH-醇脱氢酶;PTA-磷酸转乙酰酶;ACK-乙酸激酶;KARI-乙酮醇酸还原异构酶;Acetyl-CoA-乙酰辅酶a;CoA-SH-辅酶a;Citrate-柠檬酸盐;Acetate-醋酸盐; Oxalacetate-草酰乙酸酯; Formate-甲酸盐; Acetaldehyde-乙醛; Ethanol-乙醇;Glucose-葡萄糖; Pruvate-丙酮酸; 2Acetyl-phosphate-2乙酰磷酸酯;2-(α-Hydroxyethyl)thiamine diphosphate-2-(α-羟乙基)二磷酸硫胺素; Leucine-亮氨酸; Valine-缬氨酸; 2-Oxoisovalerate-2-氧代异戊酸酯; 3-Hydroxy-3-methyl-2-oxobutanoate-3-羟基-3-甲基-2-氧代丁酸酯; α-Acetolactate-α-乙酰乳酸盐; Acetoin-乙偶姻; 2,3-Butanediol-2,3-丁二醇。
现在研究报道的双乙酰生物合成路径有2条:第一条路径是丙酮酸先生成α-乙酰乳酸,然后再经过非酶催化脱羧NOD生成双乙酰[23]。第二条路径是丙酮酸形成的HETPP复合体可与乙酰-CoA 在双乙酰合成酶的作用下生成双乙酰,但至今尚未发现这种酶的存在[24]。近年来,越来越多的研究表明,NOD反应是双乙酰生成的主要路径[20]。
已有大量文献[26-27]表明,研究者们采用了代谢工程的方法来提高某些产品中天然存在的双乙酰含量,旨在发酵过程中培养出高产量的双乙酰菌株。但双乙酰产量又往往会受到多种因素的影响,例如底物、pH和温度等。AUNSBJERG等[28]发现与不含副干酪乳杆菌DGCC 2132的酸奶相比,副干酪乳杆菌DGCC 2132菌株与酸奶发酵剂在43 ℃下共同发酵时,双乙酰含量显著增加。SALMER N等[29]以燕麦、大麦和麦芽为基质,通过接种嗜酸乳杆菌(NCIMB 8821)、植物乳杆菌(NCIMB 8826)和罗伊氏乳杆菌(NCIMB 11951)的单一培养物生产了6种基于谷物的益生菌饮料,并在发酵过程中监测挥发性和非挥发性风味化合物的含量,结果表明,以植物乳杆菌(NCIMB 8826)为接种物的麦芽饮料中,乙醛和双乙酰的含量最高,分别为21.038、4 mg/L。JANG等[30]观察到双乙酰在pH=12的最高碱性条件下形成最多。DUDKIEWICZ等[31]发现在(4±1) ℃时双乙酰的生成量为0.8 mg/kg,但在(-18±2) ℃时增加到1.60 mg/kg,这表明在低温条件下双乙酰水平可以迅速增加。
N等[29]以燕麦、大麦和麦芽为基质,通过接种嗜酸乳杆菌(NCIMB 8821)、植物乳杆菌(NCIMB 8826)和罗伊氏乳杆菌(NCIMB 11951)的单一培养物生产了6种基于谷物的益生菌饮料,并在发酵过程中监测挥发性和非挥发性风味化合物的含量,结果表明,以植物乳杆菌(NCIMB 8826)为接种物的麦芽饮料中,乙醛和双乙酰的含量最高,分别为21.038、4 mg/L。JANG等[30]观察到双乙酰在pH=12的最高碱性条件下形成最多。DUDKIEWICZ等[31]发现在(4±1) ℃时双乙酰的生成量为0.8 mg/kg,但在(-18±2) ℃时增加到1.60 mg/kg,这表明在低温条件下双乙酰水平可以迅速增加。
3 常见食品中双乙酰含量及其分析方法
双乙酰天然存在于许多植物和发酵产品中,当作为食品和饮料样品的挥发性成分之一进行分析时,双乙酰可以通过气相色谱/气相色谱-质谱联用法(GC/GC-MS)直接观察,无需使用衍生物。因此,双乙酰的含量通常以GC峰面积百分比的形式进行报告,而不是以绝对量的形式。当分析双乙酰用以评估样品风味特征时,则有必要分析样品中的绝对量。然而,对双乙酰这种高反应性和挥发性化学物质的痕量水平进行定量分析相当困难。有关于食品和饮料中存在双乙酰的报道有很多,但只有少数研究报告了双乙酰的含量。常见食品中双乙酰含量及其分析方法如表2所示。
表2 常见食品的双乙酰含量及其分析方法
Table 2 Diacetyl content in common food and its analysis method

食品种类文献双乙酰含量分析方法优缺点酱油酸奶[35][36]0.47~5.48 μg/mL1.2 mg/L气相色谱法优点:分离和检测性能高,分析时间短缺点:不能直接给出定性分析结果,对热不稳定化合物分析困难乳制品[37]1.2~22 000 μg/g气相色谱-质谱联用法优点:分离和检测性能好,可确定分子质量和结构果酒啤酒软饮料烘焙咖啡蜂蜜醋[38][39][40][41][42][43]0.66~2.95 mg/LNR<298.6 μg/L0.34~0.46 μg/mL0~4.3 mg/kg5.14~36.14 μg/mL液相色谱法优点:灵敏度高、选择性好,不受样品挥发性和热稳定性的限制缺点:分析成本高、时间长洋蓟汁[44]0~179 mmol/L极谱法优点:准确度高,选择性好,适用范围广。缺点:使用挥发性毒物-汞
注:NR,参考文献中未报道。
研究人员发现产品中双乙酰的含量并不一直处于稳定状态,其在发酵过程中可能会增加或减少。例如,山羊奶杰克奶酪中的双乙酰含量在第18周之前增加(乳酸菌代谢产生双乙酰),然后在第30周之前下降(双乙酰转化为其他发酵终产物)[32]。食品中的双乙酰含量也受到贮存条件的影响。冷藏和冷冻贮存的软羊奶奶酪中双乙酰含量有明显的下降[33]。将双乙酰添加到低脂冰淇淋中并冷冻贮存后,双乙酰的含量从第1天的1 mg/kg 降至固相微萃取检测限以下(<0.08 mg/kg)[34]。这种下降的原因是双乙酰即使在低温下也具有高度挥发性。双乙酰也可以从含水量较低的产品中蒸发。例如,在脱脂奶粉的贮存过程中,双乙酰的损失紧随乳糖的结晶而发生,这受到相对湿度、温度以及蛋白质和有机物质的存在的影响。
双乙酰的分析有2种类型。第1种,可通过双乙酰的属性(挥发性化学物质)直接进行分析。第2种分析方法是针对α-二羰基化合物进行分析。由于双乙酰具有较高的反应活性和水溶性,因此很难对其进行定量分析。故国际上公认的分析方法是对α-二羰基化合物进行分析,即使用适当的衍生物对这类化学物质进行定量测定。喹喔啉类物质是检测双乙酰基广泛使用的衍生物之一,它是双乙酰和2,3-苯二胺的产物[45]。图3显示了双乙酰与2,3-苯二胺的衍生化反应,该反应易发生在室温条件下的弱碱性溶液中[46]。早在20世纪80年代初,就有系统性的报道称喹喔啉类物质是热处理食品中的风味化学物质之一[47]。因此,已有大量实验采用喹喔啉类物质对各种食品和饮料中的双乙酰进行定量测定。例如,通过对该衍生物的测定,在烘焙咖啡中双乙酰的含量为2.72 μg/g[48]。RODRIGUES等[49]开发了一种流动注入方波阴极剥离伏安法技术,且该技术已应用于用2,3-苯二胺离线衍生成喹喔啉类物质后,测定葡萄酒和波特酒中的双乙酰含量。
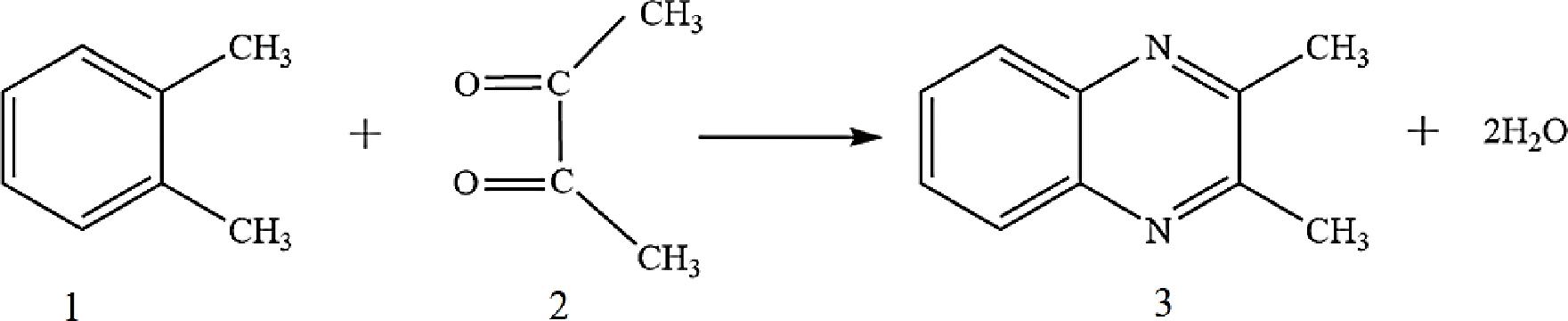
图3 双乙酰与2,3-苯二胺的衍生化反应
Fig.3 Derivative reaction of diacetyl with 2,3-phenylenediamine
注:1:2,3-苯二胺;2:双乙酰;3:喹喔啉类物质。
4 双乙酰在食品领域中的应用
4.1 乳制品风味改良
双乙酰通常与乳制品相关,是黄油、酸奶油、酸奶和许多奶酪中的重要芳香化合物[50]。双乙酰是奶酪中赋予奶香味的重要风味物质,其含量高低对于奶酪的风味有着重要影响。裴志雯等[51]的实验结果表明,不同附属发酵剂菌株显著影响切达奶酪的风味,但是对切达奶酪成熟期间的基本成分变化、蛋白水解情况和质构变化无显著影响。添加具有双乙酰高产能力菌株CCFM 601的切达奶酪组在成熟过程中可产生较高含量的双乙酰以及较浓厚的奶香味,且随着奶酪成熟时间的延长,双乙酰下降速度较慢。因此在切达奶酪加工中添加高产双乙酰能力的附属发酵剂菌株,可在切达奶酪成熟过程中可赋予其更多奶香味。同样,酸奶油的大部分感官特性和风味也是由双乙酰所赋予的。双乙酰是乳基成分经受乳酸菌(lactic acid bacteria,LAB)发酵时产生的主要化合物之一,其对发酵产品的质量和消费者的接受度产生决定性影响。发酵过程中产生的芳香化合物通常由挥发性有机酸和羰基化合物组成,其中就包括双乙酰,它是一种挥发性羰基化合物。在实验室中,双乙酰是通过柠檬酸发酵途径产生的。柠檬酸盐是该途径中的前体,有助于发酵后积累的双乙酰的稳定性。因此,在酸奶油的生产过程中,添加以柠檬酸盐为基础的乳酸菌变得尤为重要。这些乳酸菌包括了乳酸杆菌、乳酸乳球菌乳酸亚种和乳明串珠菌等。KIM等[52]使用LRCC 5306来发酵奶油,可生产出感官吸引力大大提高的酸奶油,从而提高消费者的接受度。
研究人员可根据双乙酰含量评估乳制品质量[53]。MAKHAL等[54]发现了含有22%脂肪和3%混合菌株发酵剂的成熟凝乳酱可赋予干酪愉快的酸性味道、微妙的双乙酰基色调,并改善其口感、质地和视觉外观,从而提高产品的整体质量。TIAN等[55]从西藏开菲尔谷物中筛选出产香气的乳酸菌,并将其用作辅助培养物,以改善酸奶的芳香特征。结果表明,植物乳杆菌(1-33和1-34)在提高“经典酸奶风味”、“奶油风味”和“整体可接受性”方面发挥了重要作用,使用这2种菌种发酵的酸奶中乙醛、双乙酰和乙偶姻的含量均高于对照组。酸奶的独特风味是由乳酸和复杂的挥发性化合物组成的,如双乙酰、乙醛、乙偶姻等,已被广泛认为可以为酸奶添加理想的风味。在这些化合物中,双乙酰通常用于增强黄油风味,可通过实验室发酵生产或直接添加作为食品风味增强剂来改善酸奶的风味[56]。研究表明,使用产双乙酰菌株作为发酵乳的发酵剂可以有效增强最终产品的黄油风味[57]。NGUYEN等[58]研究了5种乳酸菌菌株在发酵乳生产中的应用,发现其中的嗜热链球菌在发酵乳发酵过程中具有较强的酸化作用,且最终产品中的双乙酰含量最高。因此, 嗜热链球菌适合作为辅助培养物,以影响产品不同的酸度和风味。
4.2 酒类和调味品风味调控
双乙酰在多种发酵食品中发挥着重要作用,比如啤酒、葡萄酒、白酒、食醋和蚝油等,它能赋予这些酒类和调味品独特的香气和风味。特别是在啤酒中,双乙酰的含量对于其整体风味有着决定性的影响。研究表明,当啤酒中双乙酰的含量控制在0.1~0.15 mg/L时,可以确保啤酒的香味和口感达到最佳状态[59]。这个范围内的双乙酰含量既不会因过度添加导致馊饭味,也不会因不足而失去应有的清爽感。当双乙酰以超过5~7 mg/L的浓度存在于葡萄酒中,同样也会造成葡萄酒风味发生显著转变,使其具有腐败特性[60]。酱香型白酒是中国传统白酒的典型类型,它是在开放环境下通过自然发酵过程生产的,但当堆积发酵不良时,通常会出现黄油异味。由于双乙酰具有挥发性,可以通过蒸馏富集,当浓度超过白酒中的阈值时,就会出现黄油异味[61]。因此,如何有效地控制双乙酰的含量,已成为目前酒类酿造的热门课题之一。此外,镇江香醋(Zhenjiang aromatic vinegar,ZAV)是中国最著名的传统谷物醋之一,其陈化香气与双乙酰关系密切。ZHOU等[62]通过气相色谱-嗅觉-质谱、气味活性值(odour active value,OAVs)、香气重组实验和遗漏实验对陈年ZAV中的关键香气化合物进行了表征。感官分析表明,与新鲜ZAV 相比,陈化ZAV 具有更高的焦糖味、黄油味和整体复杂性,其中双乙酰对陈年ZAV香气做出了重要贡献。CALLEJ N等[63]也强调了双乙酰对雪利酒醋整体香气的重要贡献,并认为其是雪利酒醋的关键气味剂之一。蚝油是南方沿海城市的传统调味品之一,它的气味属性影响着消费者对其品质的直观印象。王洪江等[64]借助气-质联用分析了15款市售蚝油的特征风味化合物,并对其OAVs进行比较,结果表明双乙酰是该样品的特征风味物质之一。
N等[63]也强调了双乙酰对雪利酒醋整体香气的重要贡献,并认为其是雪利酒醋的关键气味剂之一。蚝油是南方沿海城市的传统调味品之一,它的气味属性影响着消费者对其品质的直观印象。王洪江等[64]借助气-质联用分析了15款市售蚝油的特征风味化合物,并对其OAVs进行比较,结果表明双乙酰是该样品的特征风味物质之一。
4.3 肉及肉制品贮藏
天然抗菌化合物可抑制细菌和真菌的生长,从而改善食品品质,延长其货架期。双乙酰是乳酸菌在发酵过程中产生的代谢物之一,可作为抗菌剂有效对抗人类食源性病原体。WILLIAMS-CAMPBELL等[65]研究了CO2和双乙酰单独或联合处理对绞碎牛肉腐烂微生物的影响。结果表明,CO2和双乙酰单独处理均可达到防腐的效果,但对牛肉的表观颜色有一定的负面影响。混合处理的肉可保持红色的外观且没有异味。因此,双乙酰和CO2可以联合使用,在不影响产品风味的情况下保持牛肉的红色外观并抑制腐败微生物的生长。发酵香肠是备受人们喜爱的传统食品之一,但发酵香肠中潜在的微生物安全也不可忽视。在大多数情况下,相关致病病原体不会在发酵香肠中生长,但会存活足够长的时间,当数量足够多时,便足以致病。有关研究表明,酮类化合物有助于发酵香肠奶香味的产生,乙偶姻和双乙酰是与发酵香肠风味相关的酮类化合物,具有黄油味、蘑菇和香草等气味[66]。HOLCK等[67]发现在发酵香肠面糊中添加300 mg/kg的双乙酰可显著减少大肠杆菌O157∶H7的数量,一定程度上增强了发酵香肠的安全性并赋予其良好风味。
4.4 果蔬采后保鲜
随着人们对健康饮食的日益重视,果蔬作为重要的营养来源备受关注。但果蔬保质期通常较短,因此需要适当的保鲜技术来延长其保质期。双乙酰作为天然抗菌剂可防止不良微生物的生长,提高果蔬的抗氧化能力,从而起到良好的保鲜作用。LI等[68]采用采用20 mL/L双乙酰熏蒸处理12 h可显著抑制西兰花小花泛黄并保持其贮存期间的营养品质。LING等[69]的研究表明,双乙酰可以激活兰州百合球茎中的抗氧化酶和抗病酶,防止病原真菌入侵并诱导抗药性。LI等[70]采用10 μL/L双乙酰熏蒸处理可显著抑制鲜切莴苣的褐变,并延长其在4 ℃贮存期间的保质期。且最近研究表明,双乙酰能够抑制采后葡萄、柑橘、苹果和草莓中真菌病原体的生长,具有应用于采后果蔬商业化的潜力。CALVO等[71]的研究结果表明,只需0.02 mL/L的双乙酰即可控制鲜食葡萄中灰霉菌引起的灰霉病,并在相同剂量下可减少柑橘中高达60%的蓝腐病的发病率。
5 结论与展望
双乙酰在制备、分析等方面已被广泛研究,特别是其作为挥发性风味化合物的相关功能特性备受国内外研究人员的关注。双乙酰的制备途径众多,但低能、高效、环保的生物合成法依旧是人们需要探讨的话题。随着双乙酰在食品领域的应用不断拓展,亟需探明其生物合成机制及调控规律,利用基因编辑等分子生物学手段培养双乙酰高产菌株,从而大幅降低生产成本。此外,在开展严格的安全性毒理性学评价前提下,进一步加强双乙酰在食品各领域,特别是风味调控和采后保鲜方面的基础理论研究和关键技术突破,为双乙酰在食品产业的高质量发展提供有力支撑。
[1] D’AGOSTINO M F, SANZ J, SANZ M L, et al.Optimization of a solid-phase microextraction method for the gas chromatography-mass spectrometry analysis of blackberry (Rubus ulmifolius Schott) fruit volatiles[J].Food Chemistry, 2015, 178:10-17.
[2] INGA M, GARC A J M, AGUILAR-GALVEZ A, et al.Chemical characterization of odour-active volatile compounds during Lucuma (Pouteria lucuma) fruit ripening[J].CyTA-Journal of Food, 2019, 17(1):494-500.
A J M, AGUILAR-GALVEZ A, et al.Chemical characterization of odour-active volatile compounds during Lucuma (Pouteria lucuma) fruit ripening[J].CyTA-Journal of Food, 2019, 17(1):494-500.
[3] 张玉萍, 莫丽媛, 丁惠敏, 等.双乙酰处理对鲜切西兰花贮藏品质及抗氧化能力的影响[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.038197.
ZHANG Y P, MO L Y, DING H M, et al.Effects of diacetyl treatment on storage quality and antioxidant capacity of fresh-cut broccoli[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.038197.
[4] LIU J M, CHAN S H J, BROCK-NANNESTAD T, et al.Combining metabolic engineering and biocompatible chemistry for high-yield production of homo-diacetyl and homo-(S,S)-2, 3-butanediol[J].Metabolic Engineering, 2016, 36:57-67.
[5] WANG Y, LI L X, MA C Q, et al.Engineering of cofactor regeneration enhances (2S, 3S)-2, 3-butanediol production from diacetyl[J].Scientific Reports, 2013, 3(1):2643.
[6] HALLAGAN J B.The use of diacetyl (2, 3-butanedione) and related flavoring substances as flavorings added to foods:Workplace safety issues[J].Toxicology, 2017, 388:1-6.
[7] 周全.一种2,3-丁二酮合成方法的研究[D].长沙:湖南师范大学, 2011.
ZHOU Q.Study on a synthetic method of 2,3-butanedione[D].Changsha:Hunan Normal University, 2011.
[8] 王悦鹏. 产丁二酮芽孢杆菌的改造及发酵优化[D].大连:大连理工大学, 2019.
WANG Y P. Transformation and fermentation optimization of butanone-producing Bacillus[D]. Dalian: Dalian University of Technology, 2019.
[9] 练敏, 纪晓俊, 黄和, 等.香料2,3-丁二酮的合成现状及展望[J].现代化工, 2008, 28(8):29-32;34.
LIAN M, JI X J, HUANG H, et al.Present production and prospect of flavor 2,3-butanedione[J].Modern Chemical Industry, 2008, 28(8):29-32;34.
[10] 陈聪. 谷氨酸棒状杆菌合成双乙酰的代谢工程研究[D].天津:天津大学, 2020.
CHEN C. Study on metabolic engineering of diacetyl synthesis by Corynebacterium glutamicum[D]. Tianjin: Tianjin University, 2020.
[11] ANUNZIATA O A, PIERELLA L B, COSTA M G, et al.Studies on the synthesis of diacetyl over oxidation zeolite catalysts[J].Catalysis Letters, 2001, 71(1):127-131.
[12] BELTRAMONE A, GOMEZ M, PIERELLA L, et al.Synthesis of 2, 3-butanedione over TS-1, Ti-NCl, TiMCM-41, Ti-beta, Fe-Si, Fe-beta and VS-1 zeolites[J].Molecules, 2000, 5(3):610-611.
[13] 谢海燕. 丁酮气相催化氧化制丁二酮[D].长沙:湖南师范大学, 2001.
XIE H Y. Preparation of butanone by gas phase catalytic oxidation of butanone[D]. Changsha: Hunan Normal University, 2001.
[14] 刘耀华. 微波辐射三氯化铁氧化乙偶姻合成丁二酮[J].化学世界, 2017, 58(9):531-533.
LIU Y H.Butanedione preparation by oxidizing acetoin with ferric chloride under microwave radiation[J].Chemical World, 2017, 58(9):531-533.
[15] 王江梅, 张银新, 丁世玲, 等.电化学合成丁二酮的研究[J].辽宁化工, 2011, 40(5):451-452.
WANG J M, ZHANG Y X, DING S L, et al.Synthesis of diacetyl with electrochemical method[J].Liaoning Chemical Industry, 2011, 40(5):451-452.
[16] TESHOME E, FORSIDO S F, VASANTHA RUPASINGHE H P, et al.Potentials of natural preservatives to enhance food safety and shelf life:A review[J].The Scientific World Journal, 2022, 2022(1):9901018.
[17] LO R, HO V T T, BANSAL N, et al.The genetic basis underlying variation in production of the flavour compound diacetyl by Lactobacillus rhamnosus strains in milk[J].International Journal of Food Microbiology, 2018, 265:30-39.
[18] MONNET C, AYMES F, CORRIEU G.Diacetyl and α-acetolactate overproduction by Lactococcus lactis subsp.lactis biovar diacetylactis mutants that are deficient in α-acetolactate decarboxylase and have a low lactate dehydrogenase activity[J].Applied and Environmental Microbiology, 2000, 66(12):5518-5520.
[19] NADAL I, RICO J, PÉREZ-MART NEZ G, et al.Diacetyl and acetoin production from whey permeate using engineered Lactobacillus casei[J].Journal of Industrial Microbiology and Biotechnology, 2009, 36(9):1233-1237.
NEZ G, et al.Diacetyl and acetoin production from whey permeate using engineered Lactobacillus casei[J].Journal of Industrial Microbiology and Biotechnology, 2009, 36(9):1233-1237.
[20] GAO X, XU N, LI S B, et al.Metabolic engineering of Candida glabrata for diacetyl production[J].PLoS One, 2014, 9(3):e89854.
[21] ZHANG L J, ZHANG Y X, LIU Q Y, et al.Production of diacetyl by metabolically engineered Enterobacter cloacae[J].Scientific Reports, 2015, 5:9033.
[22] WANG Y P, SUN W H, ZHENG S H, et al.Genetic engineering of Bacillus sp.and fermentation process optimizing for diacetyl production[J].Journal of Biotechnology, 2019, 301:2-10.
[23] DORAU R, CHEN L, LIU J M, et al.Efficient production of α-acetolactate by whole cell catalytic transformation of fermentation-derived pyruvate[J].Microbial Cell Factories, 2019, 18(1):217.
[24] 杨丽杰, 王俊沪.乳酸乳球菌中双乙酰代谢支路的调控[J].中国乳品工业, 2004, 32(5):24-29.
YANG L J, WANG J H.Genetic manipulation of the pathway for diacetyl metabolism in Lactococcus lactis[J].China Dairy Industry, 2004, 32(5):24-29.
[25] 崔真真, 毛雨丰, 陈聪, 等.生物法合成双乙酰的研究进展[J].生物加工过程, 2017, 15(5):57-64.
CUI Z Z, MAO Y F, CHEN C, et al.Recent advances for microbial production of diacetyl[J].Chinese Journal of Bioprocess Engineering, 2017, 15(5):57-64.
[26] ZHAO L, BAO Y M, WANG J Y, et al.Optimization and mechanism of diacetyl accumulation by Enterobacter aerogenes mutant UV-3[J].World Journal of Microbiology and Biotechnology, 2009, 25(1):57-64.
[27] GAO J, XU Y Y, LI F W, et al.Production of S-acetoin from diacetyl by Escherichia coli transformant cells that express the diacetyl reductase gene of Paenibacillus polymyxa ZJ-9[J].Letters in Applied Microbiology, 2013, 57(4):274-281.
[28] AUNSBJERG S D, HONORÉ A H, MARCUSSEN J, et al.Contribution of volatiles to the antifungal effect of Lactobacillus paracasei in defined medium and yogurt[J].International Journal of Food Microbiology, 2015, 194:46-53.
[29] SALMER N I, THOMAS K, PANDIELLA S S.Effect of substrate composition and inoculum on the fermentation kinetics and flavour compound profiles of potentially non-dairy probiotic formulations[J].LWT-Food Science and Technology, 2014, 55(1):240-247.
N I, THOMAS K, PANDIELLA S S.Effect of substrate composition and inoculum on the fermentation kinetics and flavour compound profiles of potentially non-dairy probiotic formulations[J].LWT-Food Science and Technology, 2014, 55(1):240-247.
[30] JANG H W, JIANG Y P, HENGEL M, et al.Formation of 4 (5)-methylimidazole and its precursors, α-dicarbonyl compounds, in Maillard model systems[J].Journal of Agricultural and Food Chemistry, 2013, 61(28):6865-6872.
[31] DUDKIEWICZ A, HAYES W, ONARINDE B.Sensory quality and shelf-life of locally produced British butters compared to large-scale, industrially produced butters[J].British Food Journal, 2022, 124(10):3220-3235.
[32] ATTAIE R.Quantification of volatile compounds in goat milk Jack cheese using static headspace gas chromatography[J].Journal of Dairy Science, 2009, 92(6):2435-2443.
[33] PARK Y W, DRAKE M A.Effect of 3 months frozen-storage on organic acid contents and sensory properties, and their correlations in soft goat milk cheese[J].Small Ruminant Research, 2005, 58(3):291-298.
[34] CHAUHAN J M, LIM S Y, POWERS J R, et al.Short communication:Low-fat ice cream flavor not modified by high hydrostatic pressure treatment of whey protein concentrate[J].Journal of Dairy Science, 2010, 93(4):1452-1458.
[35] KIM Y, AHN H, LEE K G.Analysis of glyoxal, methylglyoxal and diacetyl in soy sauce[J].Food Science and Biotechnology, 2021, 30(11):1403-1408.
[36] LIM C M, JHOO J W, KIM G Y.Determination of volatile flavor compounds during storage of cereal added yogurt using HS-SPME[J].Korean Journal for Food Science of Animal Resources, 2013, 33(5):646-654.
[37] RINCON-DELGADILLO M I, LOPEZ-HERNANDEZ A, WIJAYA I, et al.Diacetyl levels and volatile profiles of commercial starter distillates and selected dairy foods[J].Journal of Dairy Science, 2012, 95(3):1128-1139.
[38] BAEK C W, CHANG H J, LEE J H.Method validation and assessment of hazardous substances and quality control characteristics in traditional fruit wines[J].Foods, 2022, 11(19):3047.
[39] WANG J Y, WANG X J, HUI X, et al.Determination of diacetyl in beer by a precolumn derivatization-HPLC-UV method using 4-(2, 3-dimethyl-6-quinoxalinyl)-1, 2-benzenediamine as a derivatizing reagent[J].Journal of Agricultural and Food Chemistry, 2017, 65(12):2635-2641.
[40] FENG T T, XU X B, DU M, et al.Simultaneous determination of glyoxal, methylglyoxal and diacetyl in beverages using Vortex-assisted liquid-liquid microextraction coupled with HPLC-DAD[J].Analytical Methods, 2017, 9(16):2445-2451.
[41] PAPETTI A, MASCHERPA D, GAZZANI G.Free α-dicarbonyl compounds in coffee, barley coffee and soy sauce and effects of in vitro digestion[J].Food Chemistry, 2014, 164:259-265.
[42] MARCEAU E, YAYLAYAN V A.Profiling of α-dicarbonyl content of commercial honeys from different botanical origins:Identification of 3, 4-dideoxyglucoson-3-ene (3, 4-DGE) and related compounds[J].Journal of Agricultural and Food Chemistry, 2009, 57(22):10837-10844.
[43] PAPETTI A, MASCHERPA D, MARRUBINI G, et al.Effect of in vitro digestion on free α-dicarbonyl compounds in balsamic vinegars[J].Journal of Food Science, 2013, 78(4):C514-C519.
[44] ZAL N Z,
N Z, ![]() J, T
J, T TH-MARKUS M, et al.Sensorically and antimicrobially active metabolite production of Lactobacillus strains on Jerusalem artichoke juice[J].Journal of the Science of Food and Agriculture, 2011, 91(4):672-679.
TH-MARKUS M, et al.Sensorically and antimicrobially active metabolite production of Lactobacillus strains on Jerusalem artichoke juice[J].Journal of the Science of Food and Agriculture, 2011, 91(4):672-679.
[45] GUÉRAUD F, ATALAY M, BRESGEN N, et al.Chemistry and biochemistry of lipid peroxidation products[J].Free Radical Research, 2010, 44(10):1098-1124.
[46] HIDALGO F J, ZAMORA R.Carbonyl chemistry and the formation of heterocyclic aromatic amines with the structure of aminoimidazoazaarene[J].Journal of Agricultural and Food Chemistry, 2022, 70(1):79-86.
[47] SHIBAMOTO T.Diacetyl:Occurrence, analysis, and toxicity[J].Journal of Agricultural and Food Chemistry, 2014, 62(18):4048-4053.
[48] ![]() A, GÖKMEN V.5-Hydroxymethylfurfural accumulation plays a critical role on acrylamide formation in coffee during roasting as confirmed by multiresponse kinetic modelling[J].Food Chemistry, 2020, 318:126467.
A, GÖKMEN V.5-Hydroxymethylfurfural accumulation plays a critical role on acrylamide formation in coffee during roasting as confirmed by multiresponse kinetic modelling[J].Food Chemistry, 2020, 318:126467.
[49] RODRIGUES J A, BARROS A A, ALMEIDA P J, et al.Flow injection square wave cathodic stripping voltammetric determination at a hanging mercury drop electrode of rapidly reduced compounds:Determination of diacetyl in wine as 2, 3-dimethylquinoxaline[J].Analytica Chimica Acta, 2001, 449(1-2):119-127.
[50] CRUZ A G, CASTRO W F, FARIA J A F, et al.Probiotic yogurts manufactured with increased glucose oxidase levels:Postacidification, proteolytic patterns, survival of probiotic microorganisms, production of organic acid and aroma compounds[J].Journal of Dairy Science, 2012, 95(5):2261-2269.
[51] 裴志雯, 殷俊玲, 夏傲喃, 等.高产双乙酰的附属发酵剂筛选及其对切达奶酪品质的影响[J].食品与发酵工业, 2024,50(20):1-8.
PEI Z W, YIN J L, XIA A N, et al.Screening and application of adjunct culture for high productinn of diacetyl in cheddar cheese[J].Food and Fermentation Industries, 2024,50(20):1-8.
[52] KIM Y, YOON S, SHIN H, et al.Isolation of Lactococcus lactis ssp.cremoris LRCC5306 and optimization of diacetyl production conditions for manufacturing sour cream[J].Food Science of Animal Resources, 2021, 41(3):373-385.
[53] MILESI M M, WOLF I V, BERGAMINI C V, et al.Two strains of nonstarter lactobacilli increased the production of flavor compounds in soft cheeses[J].Journal of Dairy Science, 2010, 93(11):5020-5031.
[54] MAKHAL S, KANAWJIA S K, GIRI A.Process for improving the quality of direct acidified C ottage cheese[J].International Journal of Dairy Technology, 2014, 67(4):530-538.
[55] TIAN H X, SHI Y H, ZHANG Y, et al.Screening of aroma-producing lactic acid bacteria and their application in improving the aromatic profile of yogurt[J].Journal of Food Biochemistry, 2019, 43(10):e12837.
[56] LI P, GAO Y Y, WANG C L, et al.Effect of ILV6 deletion and expression of aldB from Lactobacillus plantarum in Saccharomyces uvarum on diacetyl production and wine flavor[J].Journal of Agricultural and Food Chemistry, 2018, 66(32):8556-8565.
[57] LORUSSO A, CODA R, MONTEMURRO M, et al.Use of selected lactic acid bacteria and quinoa flour for manufacturing novel yogurt-like beverages[J].Foods, 2018, 7(4):51.
[58] NGUYEN H T H, GOMES REIS M, WA Y C, et al.Differences in aroma metabolite profile, microstructure, and rheological properties of fermented milk using different cultures[J].Foods, 2023, 12(9):1875.
[59] CHOI E J, AHN H W, KIM W J.Effect of α-acetolactate decarboxylase on diacetyl content of beer[J].Food Science and Biotechnology, 2015, 24(4):1373-1380.
[60] BARTOWSKY E J, HENSCHKE P A.The ‘buttery’attribute of wine:Diacetyl:Desirability, spoilage and beyond[J].International Journal of Food Microbiology, 2004, 96(3):235-252.
[61] WANG L, LIU Y F, YANG F, et al.Microbiome analysis and random forest algorithm-aided identification of the diacetyl-producing microorganisms in the stacking fermentation stage of Maotai-flavor liquor production[J].Food Biotechnology, 2019, 33(4):338-352.
[62] ZHOU Z L, JIAN D Z, GONG M, et al.Characterization of the key aroma compounds in aged Zhenjiang aromatic vinegar by gas chromatography-olfactometry-mass spectrometry, quantitative measurements, aroma recombination and omission experiments[J].Food Research International, 2020, 136:109434.
[63] CALLEJ N R M, MORALES M L, TRONCOSO A M, et al.Targeting key aromatic substances on the typical aroma of sherry vinegar[J].Journal of Agricultural and Food Chemistry, 2008, 56(15):6631-6639.
N R M, MORALES M L, TRONCOSO A M, et al.Targeting key aromatic substances on the typical aroma of sherry vinegar[J].Journal of Agricultural and Food Chemistry, 2008, 56(15):6631-6639.
[64] 王洪江,赵品贞,姬庆,等.影响蚝油气味品质的关键风味化合物的研究[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.039288.
WANG H J, ZHAO P Z, JI Q, et al.Study on key flavor compounds influencing odor quality of oyster sauce products[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.039288.
[65] WILLIAMS-CAMPBELL A M, JAY J M.Effects of diacetyl and carbon dioxide on spoilage microflora in ground beef[J].Journal of Food Protection, 2002, 65(3):523-527.
[66] 刘英丽, 杨梓妍, 万真, 等.发酵剂对发酵香肠挥发性风味物质形成的作用及影响机制研究进展[J].食品科学, 2021, 42(11):284-296.
LIU Y L, YANG Z Y, WAN Z, et al.Progress in understanding the effect and mechanism of starter cultures on the formation of volatile flavor compounds in fermented sausage[J].Food Science, 2021, 42(11):284-296.
[67] HOLCK A, AXELSSON L, MCLEOD A, et al.Health and safety considerations of fermented sausages[J].Journal of Food Quality, 2017, 2017(1):9753894.
[68] LI X T, MENG Z, MALIK A U, et al.Maintaining the quality of postharvest broccoli by inhibiting ethylene accumulation using diacetyl[J].Frontiers in Nutrition, 2022, 9:1055651.
[69] LING L J, PANG M M, LUO H, et al.Antifungal activity of diacetyl, a volatile organic compound, on Trichoderma lixii F2 isolated from postharvest Lanzhou lily bulbs[J].Food Bioscience, 2023, 52:102365.
[70] LI X T, ZHANG S, WANG Q G, et al.Diacetyl inhibits the browning of fresh-cut stem lettuce by regulating the metabolism of phenylpropane and antioxidant ability[J].Foods, 2023, 12(4):740.
[71] CALVO H, MENDIARA I, ARIAS E, et al.Antifungal activity of the volatile organic compounds produced by Bacillus velezensis strains against postharvest fungal pathogens[J].Postharvest Biology and Technology, 2020, 166:111208.