乳液是由2种不相溶的液体形成的分散体系,因具有包埋和传递生物活性物质、改变食品流变学和感官特性等功能被广泛应用于食品工业中,如利用乳液输送生物活性物质[1]、3D打印乳液凝胶[2]和乳液基食品包装材料的制备[3]等。随着人们对绿色健康意识的增强,消费者对乳液安全性日益重视,天然大分子乳液(蛋白和多糖等)逐渐成为研究人员关注的焦点。作为非平衡体系,乳液在食品加工和贮存过程中,由于pH值和温度等环境条件的影响易出现絮凝、相分离、聚集和奥氏熟化等不稳定现象,影响其在食品领域的应用。
研究者多采用高能物理方法提高乳液稳定性,例如均质化、微流化器处理、超声处理等,其中,超声作为一种高能乳化方式,具有环境友好的特点,在不使用化学添加剂的条件下可以改变组分的物理化学性质,近年来逐渐成为研究的热点[1-3]。超声依据频率可分为高强度(10~1 000 W/cm2)和低强度(<1 W/cm2)超声,其在介质的传播过程中存在1个交变周期,在负压相位时,介质的密度减小,液体内形成微小的气泡,在正压相位时,介质的密度增大,液体中形成的气泡被压缩,气泡在交替正负压强下受到压缩和拉伸,达到阈值能量时气泡急剧崩溃[4]。气泡崩溃瞬间产生巨大的瞬时压力,形成的冲击波和高速射流对乳液起到均质作用,而压力的变化则改变两相系统的流动特性,从而稳定乳液[5]。研究表明,超声的引入显著降低了乳液液滴尺寸,诱导体系中乳化剂的理化特性和结构特征发生变化,进而提高乳液的热稳定性[6]和贮存稳定性,本文主要介绍了超声构建乳液的机制,详细阐述了超声对蛋白、多糖及其复合基乳液特性的影响,以期为超声在食品乳液体系构建中的应用提供理论参考。
1 超声构建乳液机制
超声作为一种非热物理技术,空化泡的瞬时破裂使气泡周围的压力和体积发生剧烈变化,产生约4 000 K的温度和约100 MPa的高压,引起的物理效应可以促进分散相液滴的破碎,形成稳定的乳液[5](图1)。超声波通过乳液时,液滴振动速度的差异影响其相对运动,引起的压力变化可改变乳液的流动特性,此外当超声波在介质中传播时,部分声波能量能被介质吸收并转化为热能,导致介质温度升高,影响蛋白质的展开和多糖的乳化特性,对乳液的稳定性能影响较大[7]。
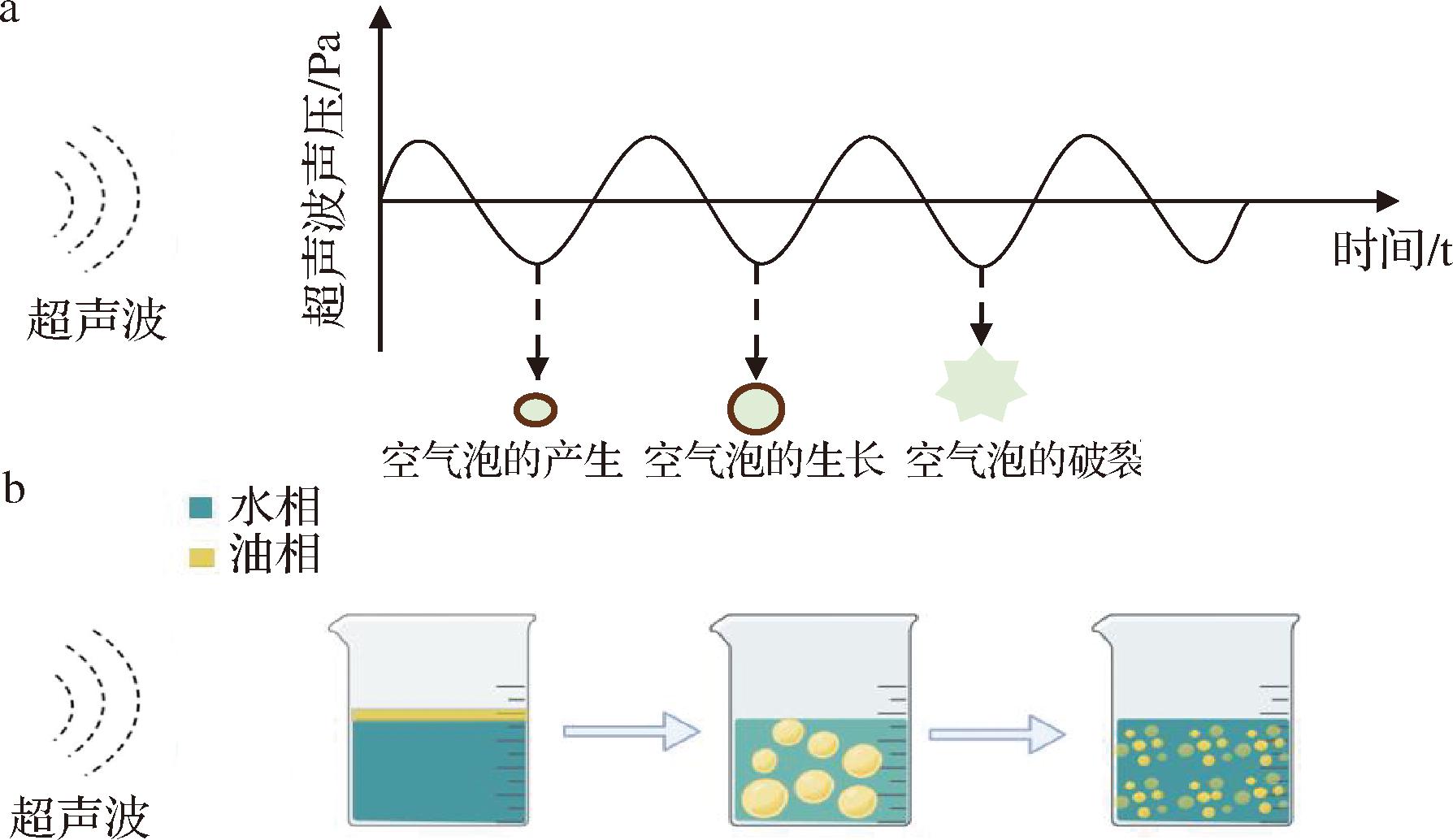
a-超声空化效应示意图;b-乳液形成步骤示意图
图1 超声构建乳液原理示意图[12]
Fig.1 Schematic diagram of ultrasound construction of emulsions[12]
超声可以改变乳液基质的结构从而影响乳液稳定性。超声作用于蛋白基乳液时,能够显著降低蛋白分子粒径,破坏其二级和三级结构,促使蛋白疏水基团暴露,加速蛋白在油水界面的扩散速率,并促进蛋白在乳液体系中形成稳定的界面膜[8](图2-a);此外,超声处理多糖基乳液时能够破坏多糖的糖苷键,降低多糖分子质量,使其形成结构较松散的碎片状,较小尺寸的多糖具有较高的水迁移率,从而具有较高的界面容量,形成更紧密的界面层,有助于油滴的稳定[9](图2-b);同时,超声通过改变蛋白-多糖之间的共价或非共价相互作用,增加蛋白-多糖复合物基乳液界面膜的厚度,提高乳液的稳定性[10-11](图2-c)。
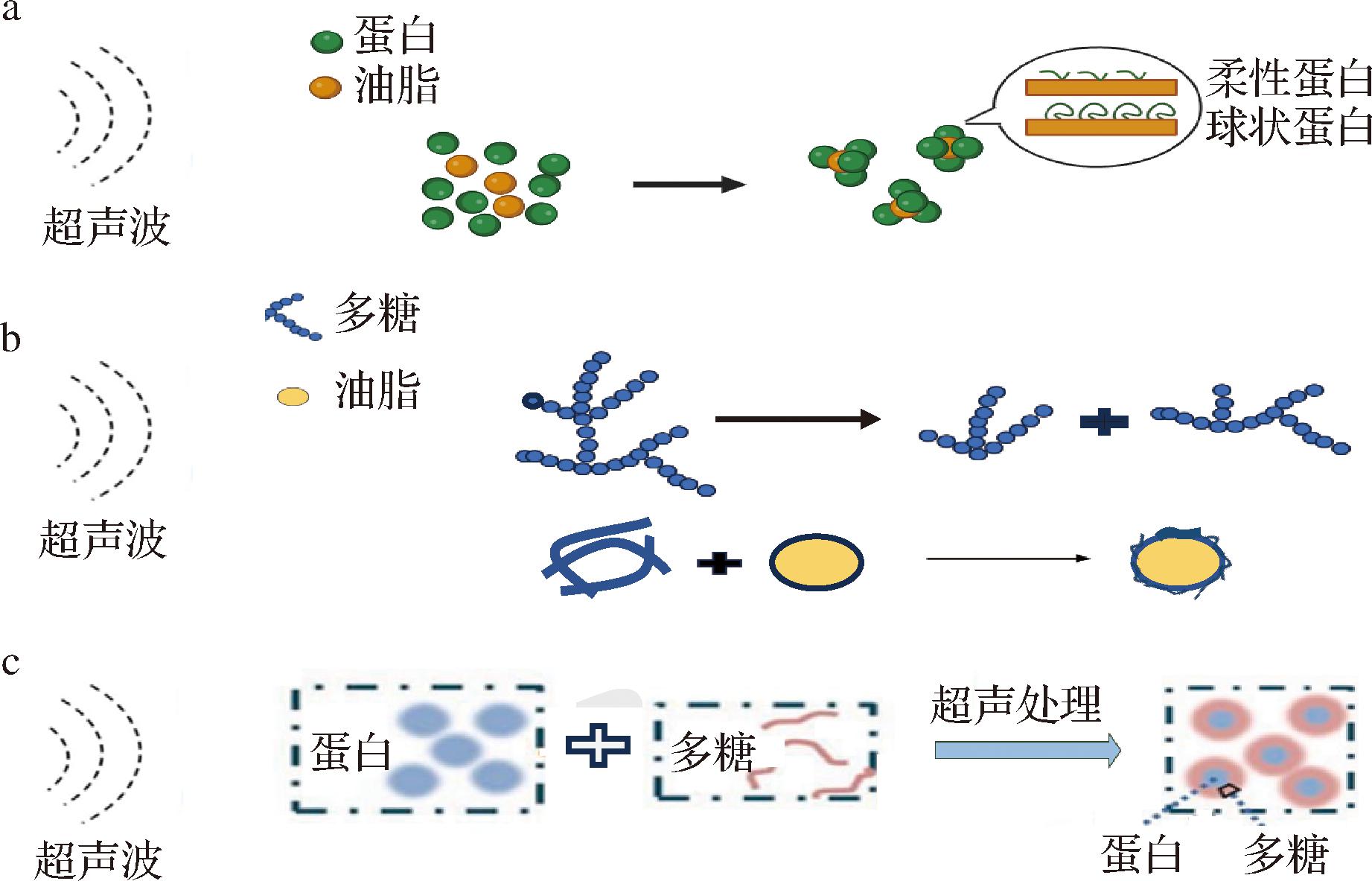
a-超声构建蛋白基乳液示意图;b-超声构建多糖基乳液示意图;c-超声构建蛋白-多糖基乳液示意图
图2 超声构建蛋白、多糖和蛋白-多糖复合基乳液示意图[13]
Fig.2 Schematic diagram of ultrasound construction of protein, polysaccharide and protein-polysaccharide emulsions[13]
2 超声构建乳液研究
2.1 蛋白基乳液
蛋白质可以定向吸附在油滴表面,在油水界面形成蛋白质膜以降低界面张力,保持乳液的稳定[14]。蛋白的理化和结构特性与其乳化性能密切相关,超声处理能够改变蛋白的粒径、分子质量、电荷、分子柔韧性及表面疏水性等,促进蛋白质-水的相互作用,加快蛋白界面迁移速率,快速形成两相界面膜[8],从而提高蛋白的溶解性和乳化性。因此,超声已被广泛应用于蛋白基乳液的制备(表1)。
表1 超声构建蛋白基乳液
Table 1 Protein emulsions prepared with ultrasound
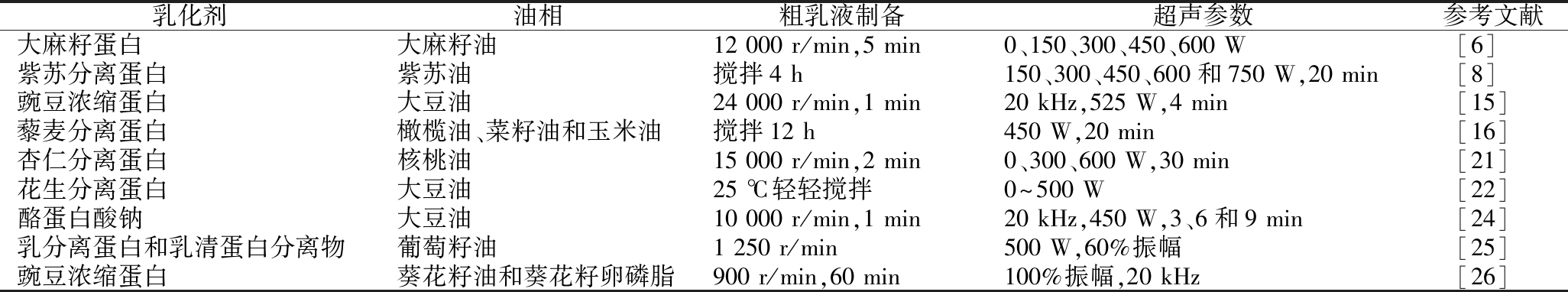
乳化剂油相粗乳液制备超声参数参考文献大麻籽蛋白大麻籽油12 000 r/min,5 min0、150、300、450、600 W[6]紫苏分离蛋白紫苏油搅拌4 h150、300、450、600和750 W,20 min[8]豌豆浓缩蛋白大豆油24 000 r/min,1 min20 kHz,525 W,4 min[15]藜麦分离蛋白橄榄油、菜籽油和玉米油搅拌12 h450 W,20 min[16]杏仁分离蛋白核桃油15 000 r/min,2 min0、300、600 W,30 min[21]花生分离蛋白大豆油25 ℃轻轻搅拌0~500 W[22]酪蛋白酸钠大豆油10 000 r/min,1 min20 kHz,450 W,3、6和9 min[24]乳分离蛋白和乳清蛋白分离物葡萄籽油1 250 r/min500 W,60%振幅[25]豌豆浓缩蛋白葵花籽油和葵花籽卵磷脂900 r/min,60 min100%振幅,20 kHz[26]
蛋白在自然状态下多以聚集的形式存在,超声空化效应产生的湍流和高剪切力,可以破坏蛋白分子间或分子内非共价相互作用(氢键、静电相互作用和疏水相互作用等),导致蛋白聚集体分解成小片段,促进可溶性蛋白聚合体或单体的形成,减少蛋白的粒径,影响其分子质量[8,15-16]。MEKALA等[17]研究超声处理乳清浓缩蛋白时发现,600 W超声处理乳清蛋白后,蛋白的粒径和分子质量显著减小,并且分布变窄,比表面显著增加,蛋白溶解度提高,在两相界面处更容易发生分子重排,乳液的稳定性提高。同时,有研究发现超声处理蛋白时间大于24 min则会导致蛋白分子形成不可溶性聚集体,粒径变大,乳液稳定性下降[18]。超声对蛋白基乳液zeta电位的影响各异,研究发现超声处理α-乳清蛋白基乳液后[19],乳液的zeta电位绝对值呈现增加趋势,稳定性提高;超声乳化榛子蛋白基乳液时,乳液zeta电位绝对值降低,对其稳定性产生不利影响[20]。
超声处理可促进蛋白内部结构去折叠,结构部分展开,疏水和—SH基团暴露,在疏水相互作用下,蛋白更容易与脂肪结合形成乳液,乳化能力提高[8,21]。研究表明,超声处理可以减弱蛋白分子间作用力,将部分α-螺旋结构转化为β-折叠和无规则卷曲,低含量的α-螺旋和高含量的无规则卷曲有利于蛋白的去折叠,提高其结构的柔韧性,增加溶解性和乳化性能[22]。极端的超声强度使蛋白暴露出过量的疏水基团,蛋白分子容易通过疏水作用发生交联、聚集,吸附在油-水界面的能力降低,对蛋白的乳化性能产生负面影响[23]。超声参量对蛋白结构和乳化性能的影响各异,因此,研究操作参量引起蛋白基乳液特性变化的内在原因,可对超声构建蛋白基乳液产生积极影响。
2.2 多糖基乳液
多糖大量的羟基和糖醛酸使其具有高效的持水能力,通过范德华力在油滴表面形成亲水胶体膜,防止液滴聚集并增加体系的乳化稳定性[27]。纤维素、淀粉、壳聚糖等多糖已被广泛用作乳化剂制备乳液(表2)。
表2 超声构建多糖基乳液
Table 2 Polysaccharide emulsions prepared with ultrasound

乳化剂油相粗乳液制备超声参数参考文献黄原胶和海藻酸丙二醇椰子油18 000 r/min,2 min270 W,2、7、15、30、60 min[30]鱼明胶甘油、大豆油、吐温8013 000 r/min,2 min20 kHz,400 W,0、3、6、9、12和15 min[33]壳聚糖石蜡油500 r/min,5 min25 kHz,950 W[34]单宁酸混合的小麦淀粉大豆油1 000 r/min20 kHz,665 W,1 min[35]明胶/儿茶素山核桃油 -300 W[36]纤维素纳米纤维葵花籽油15 000 r/min,1 min1 800 W,20 min[37]纤维素微纳米晶体亚麻籽油10 000 r/min,3 min525 W,20 kHz[38]莲藕淀粉/黄原胶大豆油12 000 r/min,2 min20、40 kHz,600 W,6 min[39]辛稀酸酐改性淀粉肉桂精油800 r/min,30 min450 W,2.5、5和10 min[40]
天然多糖因分子质量较大,无法有效地包裹和稳定油滴,具有较低的乳化稳定性。超声处理可以破坏多糖分子中的糖苷键,降低多糖分子质量和黏度,提高其两相界面容量,加速多糖分子在油水界面的吸附,形成稳定的乳液[28]。超声处理时,多糖链断裂的程度取决于多糖的初始结构和分子质量,分子质量较大的多糖在超声作用下更容易快速降解,研究发现分子质量较大的波斯胶比分子质量较小的黄花胶降解速度更快[29]。
超声同时可以改变多糖分子构象。超声能够促进多糖分子形成分子内和分子间氢键以及多糖链间相互缠绕,在油水界面处形成厚而致密的界面层,降低界面张力,为油滴提供了足够的空间位阻,稳定乳液中的油滴[28,30]。研究发现,由于大分子质量多糖巨大的取代基,因此没有螺旋结构,但经超声降解后,分子质量较小的多糖会形成随机螺旋构象,产生更大的空间位阻和排斥力,使黏度增加,改善乳化性[28]。此外,超声处理可以增强多糖与其他成分间的相互作用,进一步提高多糖基乳液的稳定性[31]。过度超声处理不利于多糖疏水性和亲水性聚合物之间的平衡,从而导致多糖乳化性能的降低[32]。
住:-代表参考文献未提取(下同)。
2.3 蛋白-多糖基乳液
蛋白基乳液对pH值和温度等环境因素比较敏感[14],而多糖可在不同的环境因素下产生稳定的乳状液[27]。研究表明,以蛋白-多糖复合物为乳化剂,可以形成液滴尺寸较小且耐环境压力的乳液[18],如MA等[10]运用630 W的超声功率处理大豆分离蛋白-果胶乳液,结果表明,与未经超声处理的样品相比,超声处理的大豆分离蛋白-果胶乳液液滴尺寸从608 nm降至402 nm;并且经超声处理的大豆分离蛋白-果胶乳液的液滴具有更厚的界面层,耐受环境压力增强,乳化活性指数和稳定性指数分别提高44.1%和24.68%。目前,蛋白-多糖复合乳化剂已被广泛用作乳化剂(表3)。
表3 超声构建蛋白-多糖基乳液
Table 3 Protein-polysaccharide emulsions prepared with ultrasound

乳化剂油相粗乳液制备超声参数参考文献大豆分离蛋白和柑橘果胶大豆油 -900 W,22 kHz[9] 花生分离蛋白和高甲氧基果胶大豆油13 000 r/min,1 min6.0 W/cm3,3、4、8和10 min[31]大豆分离蛋白和果胶大豆油20 000 r/min,5 min20 kHz[46]豌豆分离蛋白和果胶大豆油13 000 r/min,2 min5.43 W/cm3,25 ℃[47]肌原纤维蛋白、壳聚糖和瓜尔豆胶大豆油15 000 r/min,40 s20 kHz,振幅为60%[48]鹰嘴豆蛋白粉和人参皂苷南极磷虾油 -600 W,5、10、15、20和25 min[49]玉米淀粉和椰子奶油单甘酯和椰子奶油13 500 r/min,6 min20 kHz,40%振幅,13 min,50~55 W/cm3[50]高甲氧基果胶和大豆蛋白豆油15 000 r/min,4 min20 kHz,120 W[51]乳清分离蛋白和可溶性大豆多糖葵花籽油 -70%振幅,2 min[52]
超声的空化效应能提高蛋白和多糖的接触效率和相互作用的程度。在蛋白和多糖的非共价作用中,超声破坏多糖分子间和分子内的氢键[28]。LIU等[41]研究发现经超声处理后,酪蛋白酸钠的酪氨酸残基暴露于蛋白质表面,增强了酪蛋白酸钠和果胶之间的相互作用。超声能促进位于油相内的蛋白疏水基团的暴露,增加对水相内亲水性侧链的吸附,并将额外的蛋白质和多糖链插入到油相的酰基链中,进一步增强脂质和蛋白质-多糖复合物之间的相互作用,从而提高乳液的稳定性。同时超声还可增强蛋白与多糖之间的疏水相互作用,促进可溶性小聚集体的形成,研究发现超声处理可使酪蛋白酸钠/可溶性大豆多糖复合物暴露更多的疏水残基,增强复合物表面疏水性,使它们更容易吸附在油水界面,增加乳液稳定性[42]。超声的空化效应同时能够影响蛋白-多糖复合物的电荷分布,QAYUM等[43]发现超声促进乳清蛋白-支链淀粉复合物分子表面暴露出更多带负电的氨基酸残基,从而增加液滴之间的静电相互作用,促进蛋白质-多糖重组为较小粒径的聚合物,提高蛋白和多糖分子之间的结合强度,增强乳液的稳定性。超声促使蛋白暴露出更多的疏水性基团和带负电的氨基酸残基,增加多糖与蛋白的疏水相互作用,提升蛋白-多糖基乳化剂的乳化潜力,有利于形成稳定的食品乳液。
糖基化反应是一种基于美拉德反应的蛋白化学改性方法,以蛋白自身特性为基础引入羟基,同时接枝多糖的空间位阻作用抑制了乳液液滴间的聚集和絮凝,提高蛋白-多糖复合物的乳化性[44]。研究表明,超声的空化效应能促进蛋白的展开,暴露出蛋白表面的活性氨基基团,加强蛋白ε-氨基基团与多糖羰基还原端之间的碰撞作用,加速糖基化反应,随着多糖的还原端羰基与蛋白质α-螺旋区域的ε-氨基之间形成共价键,α-型结构向β型结构转变,提高蛋白结构的柔韧性,增加乳化性[11]。LI等[45]研究发现山羊乳清蛋白与多糖结合后,其乳液稳定性显著增强,多糖部分可通过增加被包裹油滴之间的静电排斥作用来抑制油滴的聚集,提高乳液稳定性。但过长的超声处理时间导致蛋白重新折叠,嵌入到内部区域,减少表面自由氨基酸,降低糖基化程度[10],影响蛋白-多糖复合物乳化性,限制了超声在制备蛋白-多糖复合乳液上的应用。
2.4 其他
表面活性剂是指能显著降低两相间表面张力的化合物,具有两亲性结构,在乳化过程中可以在油水界面快速分散并重新排列,形成稳定的乳液[7]。蛋白和多糖中添加表面活性剂,能显著降低界面张力,并迅速形成小液滴,改善乳液的乳化性能,提高乳液稳定性。目前已有在淀粉[53]、乳清分离蛋白[54]等中添加表面活性剂以改善乳液特性的报道。
超声波能增加蛋白疏水残基和巯基等结合位点的暴露,从而增强表面活性剂与蛋白间亲和力,提高乳液稳定性[49]。LI等[55]研究发现在相同条件下,磷脂酰胆碱(phosphatidylcholine,PC)-酪蛋白(casein,CAS)基乳液的粒径显著小于CAS基乳液,并且经超声处理后的PC-CAS乳液在蛋白质表面具有更多的活性基团,有利于PC与CAS分子之间的相互作用,进一步增强乳液的稳定性,提高乳化性能。超声作用下表面活性剂的添加量对多糖乳液的平均粒径有显著影响,ZHANG等[34]研究发现当Span 80的加入量从1%增加到8%时,壳聚糖乳液的平均粒径从400 nm减小到200 nm,但当添加量大于8%时,壳聚糖乳液的平均粒径从200 nm增加到450 nm。目前关于超声处理后表面活性剂的化学结构和界面性质的变化研究鲜见报道,同时表面活性剂分子的毒性问题有待进一步研究。
3 超声对乳液特性的影响
3.1 超声对乳液液滴大小及分布的影响
3.1.1 液滴的大小和分布
乳液特性包含了乳液液滴的大小和分布、电位和乳液流变特性等。超声在乳液制备中产生的空化效应能显著减小液滴尺寸并使其分布更加均匀。乳液是2种不混溶液体的亚稳态分散体系,液滴大小和液滴分布的变化会影响乳剂的稳定性和流变性,小的液滴尺寸和窄的液滴分布表明乳液具有较好的乳化性能[17]。
超声空化产生的物理力随着超声时间或功率的增加而增大,有利于油滴破碎,使乳液的液滴尺寸显著减小,乳液界面处吸附蛋白占比增高,同时增加乳液液滴之间的静电排斥和空间排斥,防止聚集物形成,促进小液滴形成,液滴会呈现球形状态(图3),少有聚集情况[56]。CALLIGARIS等[57]发现随着时间从20 s增加到240 s,Tween 80稳定的葵花籽油乳液平均液滴尺寸从475 nm减少到258 nm。此外,LI等[6]在对大麻籽蛋白乳液超声处理时,发现超声处理破坏了一些较大的不溶性蛋白质聚集体,使乳液多分散性指数呈下降趋势,有利于乳液的贮藏稳定性,但随着超声时间的增加会对乳剂产生负面影响,高强度超声会破坏蛋白质的球形结构,重新形成蛋白质聚集体,较小的液滴合并,粒径变大,油滴析出,分散性变差,降低乳液稳定性。研究发现乳液平均液滴尺寸随着超声时间的延长,乳液的粒径呈现先减低后增加的趋势[7,54,58],NYUYDZE等[59]也发现界面蛋白会在高强度超声下发生聚集,乳液粒径逐渐增大,液滴聚集降低乳液稳定性。良好的热稳定性对于乳液质量至关重要,超声处理能提高乳液的热稳定性,WANG等[46]研究发现与未经超声处理的大豆分离蛋白-果胶乳液相比,经超声处理的乳液在100 ℃加热后,粒径显著减小,乳液分离现象得到改善,乳液稳定性提高。因此对大多数乳状液进行适当的超声处理,可以减小乳状液液滴尺寸,提高乳液稳定性。
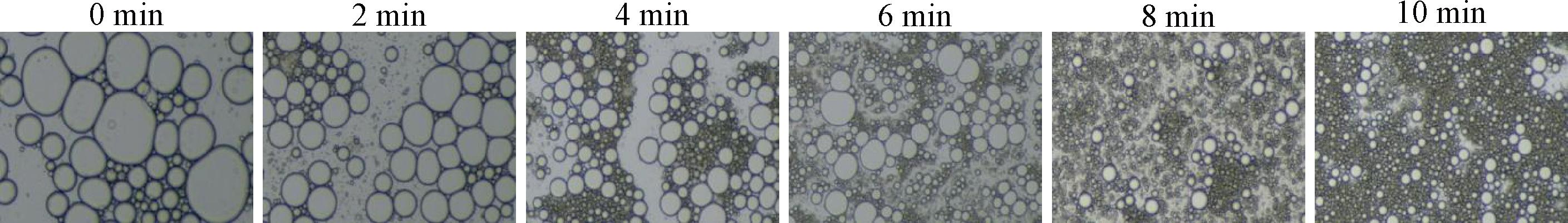
图3 超声时间对乳液光学显微图像的影响[56]
Fig.3 The optical microscopic images before and after the emulsion prepared by ultrasonic time[56]
3.1.2 液滴的降解动力学研究
乳液体系中液滴受到不同工艺参数影响,如乳化能量、分散相浓度、乳化剂浓度、两相密度和黏度等影响[60],因此构建合适的模型获得乳液体系中液滴的尺寸不仅能对实际应用提供一定指导,也能为乳液介观特性的研究提供新的方法和思路。
KOLMOGOROV和HINZE提出了紊流中气泡或液滴破裂的理论。他们认为气泡破裂是与气泡大小大致相同的湍流涡流相互作用的结果[61],以该理论为基础,建立了最大液滴尺寸(dmax)或平均液滴尺寸与应用功率密度(εp)、连续相密度(ρ)以及分散相与连续相之间的界面张力(τ)相关联的比例方程如公式(1)所示:
(1)
此后,由于这些开创性的研究,方程在不断的进行拓展变形,已经适用于多种体系,比如湍流黏性状态、不同黏度的分散相的乳液等[54],其中,SIVA等[60]也参考该理论,获得了预测超声场下水包油乳液液滴平均尺寸的模型,他们认为通过超声空化制备的预油水乳液,其装载油量(coil loading,OL)、乳化剂装载量(emulsifier loading,EL)、超声振幅(ultrasound amplitude,US)和初始平均液滴直径(d0),在乳化液中液滴大小分布没有空间变化的情况下,这些自变量的取值将导致平均液滴大小(d)随超声时间(t)的变化而变化。研究者对新函数使用白金汉量纲分析理论(Buckingham’s π theorem)进行变量分析及代换运算后,得到关于超声均质液滴平均尺寸的表征方程如公式(2)所示:
(2)
式中:d,超声后液滴粒径,nm;d0,未经超声的粗乳液液滴,nm;ε,超声功率密度,W/cm3;t,超声时间,s;η,总液滴破损参数;a,无量纲的参数,一般通过计算得出。李等通过研究超声场下花生分离蛋白(peanut protein isolate,PPI)-高甲氧基果胶(high methoxyl pectin,HMP)复合乳液液滴破碎动力学模型,发现线性回归优度R2均大于0.72(图4),液滴尺寸预测模型在一定超声范围内拟合度较好,对实际生产具有一定参考意义[56]。

图4 PPI-HMP 液滴实际尺寸与拟合模型[56]
Fig.4 Actual size and fitting model of PPI-HMP droplets[56]
3.2 超声对乳液zeta电位的影响
乳液液滴电荷的大小对食品乳液的稳定性有重要影响,zeta电位通常用来表征液滴的电学性质,反映乳液液滴间相互作用的强度,zeta电位绝对值越高(≥30 mV),液滴越不容易发生聚结,乳液具有更高的稳定性[7]。
超声处理诱导蛋白结构展开,暴露出更多带负电的氨基酸,从而提高液滴的表面电荷以及乳液稳定性。研究表明,相较于未超声的核桃分离蛋白乳液,经超声处理的核桃分离蛋白乳液的zeta电位绝对值呈现增加趋势,乳液稳定性得到改善[62]。超声功率过大时,蛋白分子通过疏水作用发生交联、聚集[23],对zeta电位绝对值产生相反的效果,并且对乳液的稳定性产生负面影响。WANG等[63]研究发现随着超声功率的增加,米糠蛋白-单宁酸乳液的zeta电位绝对值呈先上升后下降的趋势,超声功率大于400 W时,乳液zeta电位绝对值显著下降,乳液稳定性降低。超声时间对蛋白、多糖及其复合基乳液的zeta电位绝对值的影响同样具有多样性,LIANG等[39]研究发现短时间超声处理能显著改善莲藕淀粉/黄原胶乳液的zeta电位,如在超声4 min时,莲藕淀粉/黄原胶乳液的zeta电位绝对值达到最大值(35.38±0.62) mV,但随着超声时间的增加,莲藕淀粉/黄原胶复合物通过分子间作用力发生聚集,乳液zeta电位绝对值显著降低,稳定性降低。超声处理可以抑制等电点对乳液zeta电位绝对值的影响,TANG等[64]研究发现未经超声处理的辣木籽蛋白乳液在等电点(pH=4.8)时,zeta电位绝对值接近0 mV,液滴集聚,经超声处理后辣木籽蛋白乳液在pH=4.8时,zeta电位绝对值达到20 mV,分子间静电排斥较强,乳液稳定性得到改善。超声通过改变蛋白、多糖的结构,改善乳液的zeta电位,在构建稳定乳液方面具有积极效应。
3.3 超声对乳液流变特性的影响
流变特性是指物体在外力作用下的应变与应力之间的定量关系。表观黏度、储能模量(G′)和损耗模量(G″)是表征乳液流变特性的重要方式,黏度和黏弹性的改善有助于乳液的稳定。目前超声已被用于改善蛋白、多糖乳液的流变特性。
超声对乳液液滴大小具有显著影响,乳液液滴半径(r)与乳液界面张力(τ)、连续相黏度(ηc)和剪切速率(γ)之间关系密切,可通过泰勒方程表示[7]。研究表明,超声的空化效应显著减小乳液液滴尺寸,促进乳液体系的界面面积增大,液滴间的相互作用增强,分散相的相对体积分数增大,乳液黏度增大,乳液的液滴上浮速率和胶体粒子的布朗运动速率均减慢,能有效抑制液滴碰撞引起的聚集和絮凝,从而提高乳液稳定性[56,65]。李滢溪[56]研究发现,与未超声的粗乳液相比,在剪切速率为0.1~100 s-1时,超声均质后的花生分离蛋白-果胶复合乳液的表观黏度均提高,乳液稳定性得到改善。但过度的超声会降低乳液的黏度。WANG等[63]研究超声处理米糠蛋白-单宁酸乳液时发现,超声功率400 W时乳液存在最大表观黏度,但随着超声功率的增大,乳液的表观黏度呈现先增大后减小的趋势。
乳液的网络结构特征也影响其流变特性,超声处理可使乳液的网络结构更加致密,从而提高乳液黏弹性,增加界面膜的机械强度,减缓液滴的运动速率,提高乳液稳定性[66]。FU等[67]研究发现,随着超声功率从0 W增加至450 W,无盐鸡肌原纤维蛋白乳液的G′和G″值呈增加趋势,乳液的黏弹性得到提高,凝胶网络结构逐渐形成,稳定性得到改善。但过度超声处理对乳液的流变特性有着不利影响,WANG等[68]研究发现高功率(600和800 W)超声处理会破坏鸡木胸肌原纤维蛋白结构,抑制了鸡木胸肌原纤维蛋白α-螺旋向β-折叠的转变,无规则卷曲含量增加至54%,大量的无序结构,蛋白难以形成连续的界面膜来包裹油滴,抑制了网络结构的形成,降低乳液黏弹性,乳液稳定性下降。超声通过提高乳液黏度和形成致密的网络结构来改善乳液的流变特性,在提高乳液稳定性方面具有一定潜力。
4 结论与展望
超声是一种绿色非热加工技术,已被广泛应用于食品工业。超声空化效应可改善蛋白、多糖及其复合物的理化和结构特性,增强蛋白和多糖等生物大分子在乳液界面上的吸附能力,改善乳液的稳定性。同时,超声作用能够降低乳液液滴尺寸,提高乳液的zeta电位绝对值,改善乳液的流变特性,抑制液滴之间的聚集和乳析现象,增加乳液的稳定性。然而,超声对乳液和乳化剂的影响具有多样性,过度处理下蛋白会形成聚集体,减少蛋白和多糖间相互作用,影响其乳化能力,并且可以破坏多糖基乳液疏水性和亲水性聚合物之间的平衡,使乳液失稳,食品乳液的稳定性很大程度上取决于超声参量的选取。目前,利用超声技术构建蛋白、多糖及其复合基乳液的研究还处于起步阶段,已有研究主要集中于超声对乳液的液滴大小、zeta电位和流变特性的影响,超声对食品乳液基质的影响及稳定机制仍然需要进行大量的研究工作,尤其在超声构建稳定乳液体系的工业化过程上依旧面临重大挑战。
[1] TAN C, ZHU Y Q, AHARI H, et al.Sonochemistry:An emerging approach to fabricate biopolymer cross-linked emulsions for the delivery of bioactive compounds[J].Advances in Colloid and Interface Science, 2023, 311:102825.
[2] CUI L J, GUO J X, MENG Z.A review on food-grade-polymer-based O/W emulsion gels:Stabilization mechanism and 3D printing application[J].Food Hydrocolloids, 2023, 139:108588.
[3] TAVASSOLI M, KHEZERLOU A, PUNIA BANGAR S, et al.Functionality developments of Pickering emulsion in food packaging:Principles, applications, and future perspectives[J].Trends in Food Science &Technology, 2023, 132:171-187.
[4] ZHENG J X, GUO Y L, ZHU L X, et al.Cavitation effect in two-dimensional ultrasonic rolling process[J].Ultrasonics, 2021, 115:106456.
[5] CUCHEVAL A, CHOW R C Y.A study on the emulsification of oil by power ultrasound[J].Ultrasonics Sonochemistry, 2008, 15(5):916-920.
[6] LI N, WANG T, YANG X R, et al.Effect of high-intensity ultrasonic treatment on the emulsion of hemp seed oil stabilized with hemp seed protein[J].Ultrasonics Sonochemistry, 2022, 86:106021.
[7] ZHOU L, ZHANG J, XING L J, et al.Applications and effects of ultrasound assisted emulsification in the production of food emulsions:A review[J].Trends in Food Science &Technology, 2021, 110:493-512.
[8] ZHAO Q L, XIE T T, HONG X, et al.Modification of functional properties of Perilla protein isolate by high-intensity ultrasonic treatment and the stability of o/w emulsion[J].Food Chemistry, 2022, 368:130848.
[9] CUI R B, ZHU F.Ultrasound modified polysaccharides:A review of structure, physicochemical properties, biological activities and food applications[J].Trends in Food Science &Technology, 2021, 107:491-508.
[10] MA X B, YAN T Y, HOU F R, et al.Formation of soy protein isolate (SPI)-Citrus pectin (CP) electrostatic complexes under a high-intensity ultrasonic field:Linking the enhanced emulsifying properties to physicochemical and structural properties[J].Ultrasonics Sonochemistry, 2019, 59:104748.
[11] ZHAO C B, YIN H H, YAN J N, et al.Structure and acid-induced gelation properties of soy protein isolate-maltodextrin glycation conjugates with ultrasonic pretreatment[J].Food Hydrocolloids, 2021, 112:106278.
[12] BARRETTO T L, SANCHES M A R, PATEIRO M, et al.Recent advances in the application of ultrasound to meat and meat products:Physicochemical and sensory aspects[J].Food Reviews International, 2023, 39(7):4529-4544.
[13] TAHA A, AHMED E, ISMAIEL A, et al.Ultrasonic emulsification:An overview on the preparation of different emulsifiers-stabilized emulsions[J].Trends in Food Science &Technology, 2020, 105:363-377.
[14] NISHINARI K, FANG Y, GUO S, et al.Soy proteins:A review on composition, aggregation and emulsification[J].Food hydrocolloids, 2014, 39:301-318.
[15] DE OLIVEIRA A P H, OMURA M H, DE ALMEIDA ALVES BARBOSA É, et al.Combined adjustment of pH and ultrasound treatments modify techno-functionalities of pea protein concentrates[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 603:125156.
[16] CEN K Y, YU X, GAO C C, et al.Effects of different vegetable oils and ultrasonicated quinoa protein nanoparticles on the rheological properties of Pickering emulsion and freeze-thaw stability of emulsion gels[J].Journal of Cereal Science, 2021, 102:103350.
[17] MEKALA S, SILVA E K, SALDA?A M D A.Mechanism, kinetics, and physicochemical properties of ultrasound-produced emulsions stabilized by lentil protein:A non-dairy alternative in food systems[J].European Food Research and Technology, 2022, 248(1):185-196.
[18] JADHAV H B, CHOUDHARY P, GOGATE P, et al.Sonication as a potential tool in the formation of protein-based stable emulsion-Concise review[J].Ultrasonics Sonochemistry, 2024, 107:106900.
[19] QAYUM A, CHEN W, MA L, et al.Characterization and comparison of α-lactalbumin pre-and post-emulsion[J].Journal of Food Engineering, 2020, 269:109743.
[20] QIN X L, YANG R, ZHONG J F, et al.Ultrasound-assisted preparation of a human milk fat analog emulsion:Understanding factors affecting formation and stability[J].Journal of Food Engineering, 2018, 238:103-111.
[21] ZHANG S L, TIAN L, YI J H, et al.Impact of high-intensity ultrasound on the chemical and physical stability of oil-in-water emulsions stabilized by almond protein isolate[J].LWT, 2021,149:111972.
[22] MOZAFARPOUR R, KOOCHEKI A, NICOLAI T.Modification of grass pea protein isolate (Lathyrus sativus L.) using high intensity ultrasound treatment:Structure and functional properties[J].Food Research International, 2022, 158:111520.
[23] CHEN L, ZHANG S B.Structural and functional properties of self-assembled peanut protein nanoparticles prepared by ultrasonic treatment:Effects of ultrasound intensity and protein concentration[J].Food Chemistry, 2023, 413:135626.
[24] LI K, LI Y, LIU C L, et al.Improving interfacial properties, structure and oxidative stability by ultrasound application to sodium caseinate prepared pre-emulsified soybean oil[J].LWT, 2020, 131:109755.
[25] SILVA M, ZISU B, CHANDRAPALA J.Stability of oil-water primary emulsions stabilised with varying levels of casein and whey proteins affected by high-intensity ultrasound[J].International Journal of Food Science &Technology, 2021, 56(2):897-908.
[26] QAMAR S, BHANDARI B, PRAKASH S.Effect of different homogenisation methods and UHT processing on the stability of pea protein emulsion[J].Food Research International, 2019, 116:1374-1385.
[27] YANG M, ZHANG Z L, HE Y, et al.Study on the structure characterization and moisturizing effect of Tremella polysaccharide fermented from GCMCC5.39[J].Food Science and Human Wellness, 2021, 10(4):471-479.
[28] TANG Q L, HUANG G L.Improving method, properties and application of polysaccharide as emulsifier[J].Food Chemistry, 2022, 376:131937.
[29] RAOUFI N, KADKHODAEE R, FANG Y P, et al.Ultrasonic degradation of Persian gum and gum tragacanth:Effect on chain conformation and molecular properties[J].Ultrasonics Sonochemistry, 2019, 52:311-317.
[30] LI Y J, XIANG D, WANG B, et al.Oil-in-water emulsions stabilized by ultrasonic degraded polysaccharide complex[J].Molecules, 2019, 24(6):1097.
[31] ZHANG L F, LI Y X, SUN X Y, et al.The droplet breakup model and characteristics of pH-shifted peanut protein isolate-high methoxyl pectin stabilised emulsions under ultrasound[J].Ultrasonics Sonochemistry, 2023, 94:106340.
[32] WANG C, QIU W Y, CHEN T T, et al.Effects of structural and conformational characteristics of Citrus pectin on its functional properties[J].Food Chemistry, 2021, 339:128064.
[33] LI X, SHA X M, YANG H S, et al.Ultrasonic treatment regulates the properties of gelatin emulsion to obtain high-quality gelatin film[J].Food Chemistry:X, 2023, 18:100673.
[34] ZHANG K M, MAO Z J, HUANG Y C, et al.Ultrasonic assisted water-in-oil emulsions encapsulating macro-molecular polysaccharide chitosan:Influence of molecular properties, emulsion viscosity and their stability[J].Ultrasonics Sonochemistry, 2020, 64:105018.
[35] WEI X L, LI J, EID M, et al.Fabrication and characterization of emulsions stabilized by tannic acid-wheat starch complexes[J].Food Hydrocolloids, 2020, 107:105728.
[36] HUANG M G, WANG J, TAN C, et al.Modulating the functional properties of protein-stabilized Pickering emulsion by inulin, xanthan gum and chitosan[J].Food Bioscience, 2023, 55:103063.
[37] FENG X, DAI H J, YU Y, et al.Adjusting the interfacial property and emulsifying property of cellulose nanofibrils by ultrasonic treatment combined with gelatin addition[J].Food Hydrocolloids, 2022, 133:107905.
[38] MEIRELLES A A D, COSTA A L R, CUNHA R L.The stabilizing effect of cellulose crystals in O/W emulsions obtained by ultrasound process[J].Food Research International, 2020, 128:108746.
[39] LIANG Q F, ZHOU C W, REHMAN A, et al.Improvement of physicochemical properties, microstructure and stability of Lotus root starch/xanthan gum stabilized emulsion by multi-frequency power ultrasound[J].Ultrasonics Sonochemistry, 2023, 101:106687.
[40] FENG X, WANG W Y, CHU Y F, et al.Effect of cinnamon essential oil nanoemulsion emulsified by OSA modified starch on the structure and properties of pullulan based films[J].LWT, 2020, 134:110123.
[41] LIU Y X, LIANG Q F, LIU Y, et al.Sodium caseinate/pectin complex-stabilized emulsion:Multi-frequency ultrasound regulation, characterization and its application in quercetin delivery[J].Food Hydrocolloids, 2024,156:110316.
[42] TAVASOLI S, MAGHSOUDLOU Y, SHAHIRI TABARESTANI H, et al.Changes in emulsifying properties of caseinate-soy soluble polysaccharides conjugates by ultrasonication[J].Ultrasonics Sonochemistry, 2023, 101:106703.
[43] QAYUM A, RASHID A, LIANG Q F, et al.Multi-scale ultrasound induced composite coacervates of whey protein and pullulan polysaccharide on emulsion forming and stabilizing mechanisms[J].Colloids and Surfaces B:Biointerfaces, 2024, 234:113709.
[44] AKSOY Z, ERSUS S.The comparative studies on the physicochemical properties of mung bean protein isolate-polysaccharide conjugates prepared by ultrasonic or controlled heating treatment[J].Biocatalysis and Agricultural Biotechnology, 2023, 50:102690.
[45] LI K, WANG J Y, ZHAO P F, et al.Effect of ultrasound-assisted Maillard reaction on glycosylation of goat whey protein:Structure and functional properties[J].Food Chemistry, 2024, 441:138292.
[46] WANG T, WANG N, LI N, et al.Effect of high-intensity ultrasound on the physicochemical properties, microstructure, and stability of soy protein isolate-pectin emulsion[J].Ultrasonics Sonochemistry, 2022, 82:105871.
[47] MA K Y, ZHANG L F, SUN X Y, et al.Correlationship between self-assembly behavior and emulsion stabilization of pea protein-high methoxyl pectin complexes treated with ultrasound at pH 2.0[J].Ultrasonics Sonochemistry, 2023, 100:106596.
[48] GAO T X, ZHAO X, LI R, et al.Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of low-salt myofibrillar protein[J].Food Hydrocolloids, 2022, 123:107143.
[49] XU L P, YAN W Q, ZHANG M, et al.Application of ultrasound in stabilizing of Antarctic krill oil by modified chickpea protein isolate and ginseng saponin[J].LWT, 2021, 149:111803.
[50] LU X, CHEN J H, ZHENG M J, et al.Effect of high-intensity ultrasound irradiation on the stability and structural features of coconut-grain milk composite systems utilizing maize kernels and starch with different amylose contents[J].Ultrasonics Sonochemistry, 2019, 55:135-148.
[51] ALBANO K M, CAVALLIERI  L F, NICOLETTI V R.Electrostatic interaction between soy proteins and pectin in O/W emulsions stabilization by ultrasound application[J].Food Biophysics, 2020, 15(3):297-312.
L F, NICOLETTI V R.Electrostatic interaction between soy proteins and pectin in O/W emulsions stabilization by ultrasound application[J].Food Biophysics, 2020, 15(3):297-312.
[52] CABEZAS D M, PASCUAL G N, WAGNER J R, et al.Nanoparticles assembled from mixtures of whey protein isolate and soluble soybean polysaccharides.Structure, interfacial behavior and application on emulsions subjected to freeze-thawing[J].Food Hydrocolloids, 2019, 95:445-453.
[53] SONG X Y, ZHENG F, MA F L, et al.The physical and oxidative stabilities of Pickering emulsion stabilized by starch particle and small molecular surfactant[J].Food Chemistry, 2020, 303:125391.
[54] SILVA M, ANH BUI T H, DHARMADANA D, et al.Ultrasound-assisted formation of double emulsions stabilized by casein-whey protein mixtures[J].Food Hydrocolloids, 2020, 109:106143.
[55] LI X, QI B K, ZHANG S, et al.Effects of homogeneous and ultrasonic treatment on casein/phosphatidylcholine complex-emulsions:Stability and bioactivity insights[J].Ultrasonics Sonochemistry, 2023, 97:106457.
[56] 李滢溪. 超声构建花生分离蛋白-果胶乳液体系及其稳定机制研究[D].郑州:河南工业大学,2023.
LI Y X.Study on ultrasound construction of peanut protein isolate-pectin emulsion system and itsstabilization mechanism[D].Zhengzhou:Henan University of Technology,2023.
[57] CALLIGARIS S, PLAZZOTTA S, VALOPPI F, et al.Combined high-power ultrasound and high-pressure homogenization nanoemulsification:The effect of energy density, oil content and emulsifier type and content[J].Food Research International, 2018, 107:700-707.
[58] PASQUEL RE TEGUI J L, BARRALES F M, REZENDE C A, et al.Production of copaiba oleoresin particles from emulsions stabilized with modified starches[J].Industrial Crops and Products, 2017, 108:128-139.
TEGUI J L, BARRALES F M, REZENDE C A, et al.Production of copaiba oleoresin particles from emulsions stabilized with modified starches[J].Industrial Crops and Products, 2017, 108:128-139.
[59] NYUYDZE C, MART NEZ-MONTEAGUDO S I.Role of soy lecithin on emulsion stability of dairy beverages treated by ultrasound[J].International Journal of Dairy Technology, 2021, 74(1):84-94.
NEZ-MONTEAGUDO S I.Role of soy lecithin on emulsion stability of dairy beverages treated by ultrasound[J].International Journal of Dairy Technology, 2021, 74(1):84-94.
[60] SIVA S P, KOW K W, CHAN C H, et al.Prediction of droplet sizes for oil-in-water emulsion systems assisted by ultrasound cavitation:Transient scaling law based on dynamic breakup potential[J].Ultrasonics Sonochemistry, 2019, 55:348-358.
[61] JULIAN MCCLEMENTS D, RAO J J.Food-grade nanoemulsions:Formulation, fabrication, properties, performance, biological fate, and potential toxicity[J].Critical Reviews in Food Science and Nutrition, 2011, 51(4):285-330.
[62] SHI L S, YANG X Y, GONG T, et al.Ultrasonic treatment improves physical and oxidative stabilities of walnut protein isolate-based emulsion by changing protein structure[J].LWT, 2023, 173:114269.
[63] WANG N, WANG D H, XING K W, et al.Ultrasonic treatment of rice bran protein-tannic acid stabilized oil-in-water emulsions:Focus on microstructure, rheological properties and emulsion stability[J].Ultrasonics Sonochemistry, 2023, 99:106577.
[64] TANG S Q, DU Q H, LI Y, et al.Effect of pH on the structure and emulsification properties of ultrasonicated water-soluble protein from Moringa oleifera seed[J].International Journal of Food Science &Technology, 2024, 59(1):627-638.
[65] 王中江, 常宗明, 张翠, 等.超声波及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液的特性比较[J].中国食品学报, 2019, 19(8):157-165.
WANG Z J, CHANG Z M, ZHANG C, et al.Comparison of the characteristic of soybean protein-phosphatidylcholine nanoemulsion by ultrasound and high pressure homogenization[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):157-165.
[66] TAO Y, CAI J M, WANG P, et al.Exploring the relationship between the interfacial properties and emulsion properties of ultrasound-assisted cross-linked myofibrillar protein[J].Food Hydrocolloids, 2024, 146:109287.
[67] FU Q Q, SHI H B, ZHOU L, et al.Effects of ultrasound power on the properties of non‐salt chicken myofibrillar protein emulsions[J].International Journal of Food Science &Technology, 2022, 57(4):2523-2534.
[68] WANG K, LIU H, SUN J X.Improved gelling and emulsifying properties of chicken wooden breast myofibrillar protein by high-intensity ultrasound combination with pH-shifting[J].Poultry Science, 2023, 102(11):103063.