食品乳化剂作为食品工业中用量最多的添加剂,其乳化性能一直备受重视。常见的天然多糖类乳化剂和蛋白质类乳化剂均存在稳定性差、乳化能力弱等缺点,严重制约了其在食品行业中的应用[1]。研究表明,多糖和蛋白质的共价复合物具有更优异的乳化特性,已被广泛应用于食品、药品、包封材料等领域[2],但是多糖的结构对乳化特性的影响仍不清楚。基于此,深入探究影响乳化特性的分子结构特征,如支链度和相对分子质量等,对乳化剂的开发与利用具有重要意义。
玉米纤维胶(corn fiber gum,CFG)是通过碱提醇沉的工艺从玉米麸皮中提取出来的一种性能优异的阿拉伯木聚糖[3]。如图1所示,CFG主要由阿拉伯糖和木糖组成,其主链由β-(1-4)-吡喃木糖构成,侧链是连接在O-2或O-3处的α-L-Araf残基[4-5]。CFG的功能特性与其相对分子质量、支链度和活性基团等结构特征密切相关。YADAV等[6-7]已经证实CFG的乳化性能等同于甚至超越了被誉为“黄金标准”的乳化剂——阿拉伯胶(gum Arabic,GA)。然而,CFG链中蛋白质含量不足,不能稳定的吸附在乳液液滴的表面,严重限制了其作为乳化剂的广泛应用[8]。同时,大豆分离蛋白(soy protein isolate,SPI)是目前使用最为广泛的蛋白制品之一,但其贮存稳定性易受pH、温度以及离子强度等因素的影响[9]。因此,将CFG与SPI以共价复合物的形式来改善其功能特性在食品工业中具有十分广阔的应用前景。
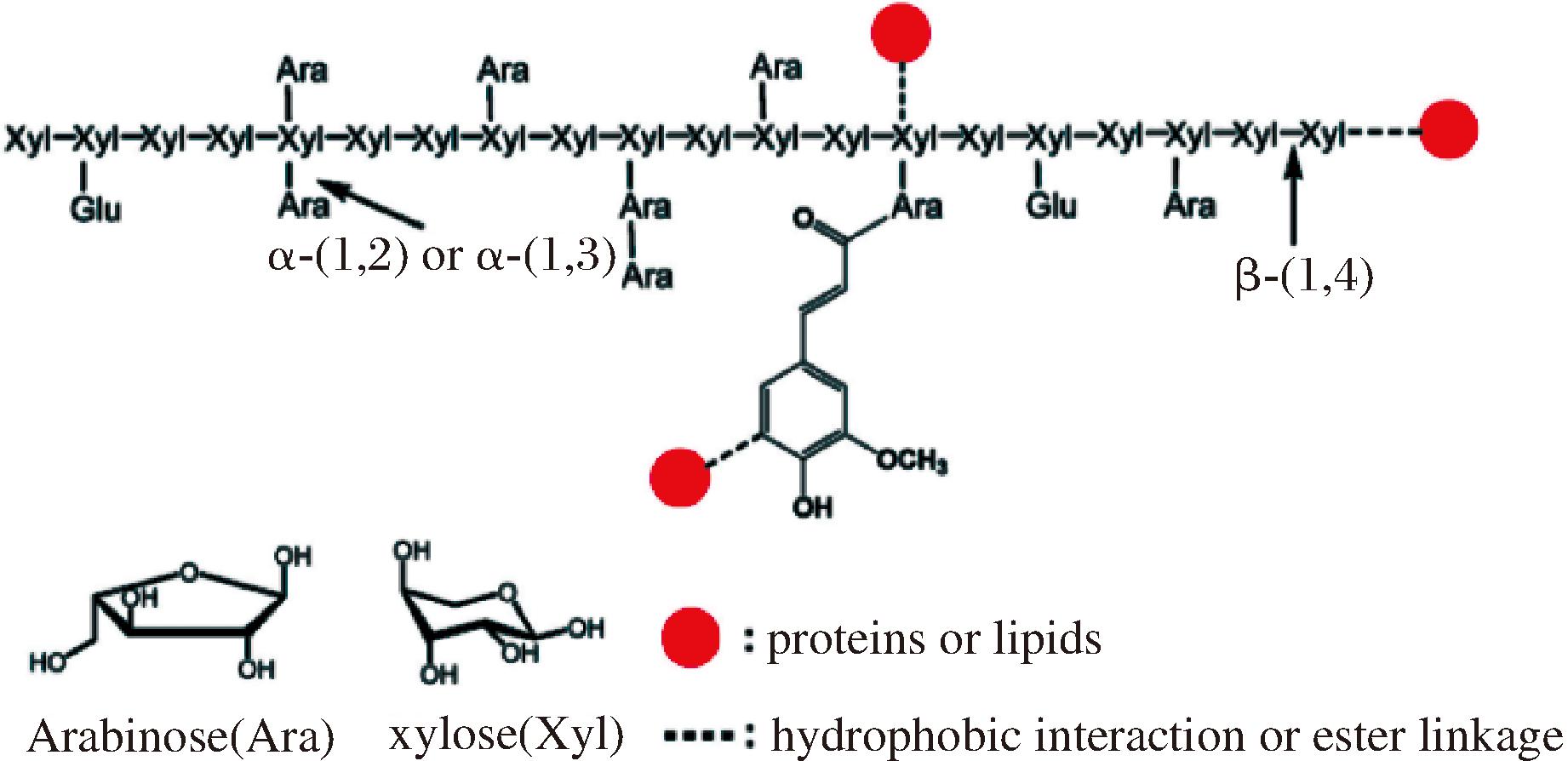
图1 玉米纤维胶的一般结构[8]
Fig.1 The general structure of CFG
注: Arabinose:阿拉伯糖;xylose:木糖;proteins or lipids:蛋白质或脂肪;hydrophoboc interaction or ester linkage:疏水性相互作用或酯键 。
美拉德反应是多糖与蛋白共价结合最常见的方法之一,其反应产物糖-蛋白共价复合物具有更为紧密的结构和更高的相对分子质量,可以有效地阻止乳液液滴的絮凝。因此,糖-蛋白共价复合物作为新型的乳化剂可有效改善天然多糖和蛋白质的乳化性、溶解性和稳定性等[2, 10]。LI等[11]发现,与单独的SPI或多糖蛋白质的混合物相比,阿拉伯木聚糖水解物与SPI通过美拉德反应制备的复合物明显提高了乳液的乳化能力及稳定性。LIU等[12]研究发现,相对分子质量较低的葡聚糖具有较小的空间位阻,更容易与蛋白质分子发生碰撞,更有利于美拉德反应的发生。虽然上述研究为糖-蛋白类乳化剂的应用提供了理论基础,但鲜有乳化剂分子结构(支链度、相对分子质量)对乳化性能影响的相关研究。
本研究利用酸水解和酶水解得到不同支链度和不同相对分子质量的CFG,通过美拉德反应制备不同结构的CFG-SPI共价复合物,并对其理化特性和乳化性能进行研究,以探究不同结构的CFG对复合物乳化特性的影响。研究结果可为CFG-SPI乳化剂的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
玉米麸皮,黑龙江中粮生化能源有限公司;大豆分离蛋白(纯度:蛋白质≥90%),北京索莱宝科技有限公司。
1.2 仪器与设备
Prominence LC-20A高效凝胶排阻色谱仪(RID-20A检测器),岛津公司;ICS-5000+离子色谱仪,美国Thermo Scientific公司;JJ-1磁力搅拌器,金坛市城东新瑞仪器厂;ZG-TP201松竫精密天平,哈尔滨众汇衡器有限公司;New MOS-450圆二色谱,法国Biologic公司;Zetasizer advance纳米粒度及Zeta电位分析仪,马尔文仪器有限公司。
1.3 实验方法
1.3.1 CFG的提取与制备
在LIU等[13]方法的基础上稍作调整,通过碱提醇沉的方式从玉米麸皮中提取阿拉伯木聚糖,即CFG。
1.3.2 改性CFG的制备
CFG水解物的制备参考LIU等[13]的方法,利用三氟乙酸分别水解20、30、50 min,得到不同支链度的CFG,分别命名为CA1、CA2、CA3;利用木聚糖酶分别水解0.5、1、2 h,得到不同相对分子质量的CFG,分别命名为CE1、CE2、CE3。
1.3.3 CFG理化指标的测定
采用苯酚-硫酸法[14]测定改性前后CFG中的总糖含量;以牛血清白蛋白为标准品,采用BCA蛋白定量试剂盒测定改性前后CFG中的蛋白质含量[15];以半乳糖醛酸为标准,采用间羟基联苯比色法[16]测定改性前后CFG中的糖醛酸含量;采用JAFARI等[17]的方法测定改性前后CFG中的水分含量。
1.3.4 相对分子质量的测定
采用高效凝胶排阻色谱仪测定样品的相对分子质量[18]。色谱柱为Ultrahydrogel linear Column(10 μm,7.8 mm×300 mm),流动相0.1 mol/L NaNO3,流速0.6 mL/min,柱温40 ℃。样品充分溶解于流动相中,过0.22 μm滤膜后进行测定,并以葡聚糖为标准计算相对分子质量。
1.3.5 CFG的单糖组成分析
参照KANG等[18]的方法进行测定。
1.3.6 CFG-SPI共价复合物的制备
参考ZHU等[19]的方法进行样品的制备。将1.3.2节中制备的多糖样品和SPI分别按质量比2∶1于蒸馏水中混匀,混合溶液冷冻干燥后研磨成粉,得到多糖-蛋白物理混合物(分别命名为CFG-SPI-M、CA1-SPI-M、CA2-SPI-M、CA3-SPI-M、CE1-SPI-M、CE2-SPI-M、CE3-SPI-M);将上述冻干粉分别放置在干燥器中(相对湿度为79%),80 ℃反应5 h,得到多糖-蛋白共价复合物,分别命名为CFG-SPI、CA1-SPI、CA2-SPI、CA3-SPI、CE1-SPI、CE2-SPI、CE3-SPI。各样品的命名见表1。
表1 改性玉米纤维胶-大豆分离蛋白样品
Table 1 Modified corn fiber gum-soy protein isolate samples

样品物理混合物共价复合物CFG与SPICFG-SPI-MCFG-SPI不同支链度的高支链度 CA1-SPI-MCA1-SPICFG与SPI中支链度 CA2-SPI-MCA2-SPI低支链度 CA3-SPI-MCA3-SPI不同相对分子质量高相对分子质量CE1-SPI-MCE1-SPI的CFG与SPI中相对分子质量CE2-SPI-MCE2-SPI低相对分子质量CE3-SPI-MCE3-SPI
1.3.7 CFG-SPI共价复合物的结构表征
1.3.7.1 SDS-PAGE测定
SDS-PAGE分析按照AKHTAR等[20]方法并略有修改。使用12%丙烯酰胺分离凝胶和6%堆积凝胶,样液与上样缓冲液按体积比1∶1混匀,沸水浴加热5 min,冷却至室温备用。上样量6.0 μL,浓缩胶电压80 V,待溴酚蓝条带进入分离胶后,电压升至120 V,之后对凝胶片进行蛋白质(0.2%考马斯亮蓝G-250)染色1 h和脱色2 h,直至条带清晰。
1.3.7.2 傅里叶变换红外光谱(Fourier transform infrared,FT-IR)测定
参考张志颖等[21]的方法进行傅里叶变换红外光谱扫描。准确称取1.0 mg样品和150.0 mg干燥后的KBr,研磨均匀后压片,去除空白背景峰后,通过16次扫描,获得分辨率为4 cm-1、波数为4 000~500 cm-1的傅里叶变换红外光谱图。
1.3.8 CFG-SPI共价复合物的功能特性
1.3.8.1 褐变程度测定
配制2 mg/mL的样品溶液,以蒸馏水作为空白对照,在420 nm处测定吸光度值[22]。
1.3.8.2 蛋白质溶解度测定
配制2 mg/mL的样品溶液,用1 mol/L的NaOH溶液和HCl溶液调节样品溶液pH值为4.5和7.0,在室温下搅拌30 min后离心(8 000 r/min,20 min)[2]。使用公式(1)计算蛋白质溶解度:
蛋白质溶解度![]()
(1)
1.3.9 CFG-SPI共价复合物乳液的乳化特性
1.3.9.1 水包油乳液的制备
称取0.2 g共价复合物样品充分溶解于100 mL蒸馏水中,加热至70 ℃后,加入1.0 g葵花籽油,利用高速分散机在20 000 r/min下剪切2 min,450 bar下均质3 min,得到水包油乳液,并以相同的方法制备CFG、SPI和GA乳液作为对照。水包油乳液制备流程如图2所示。
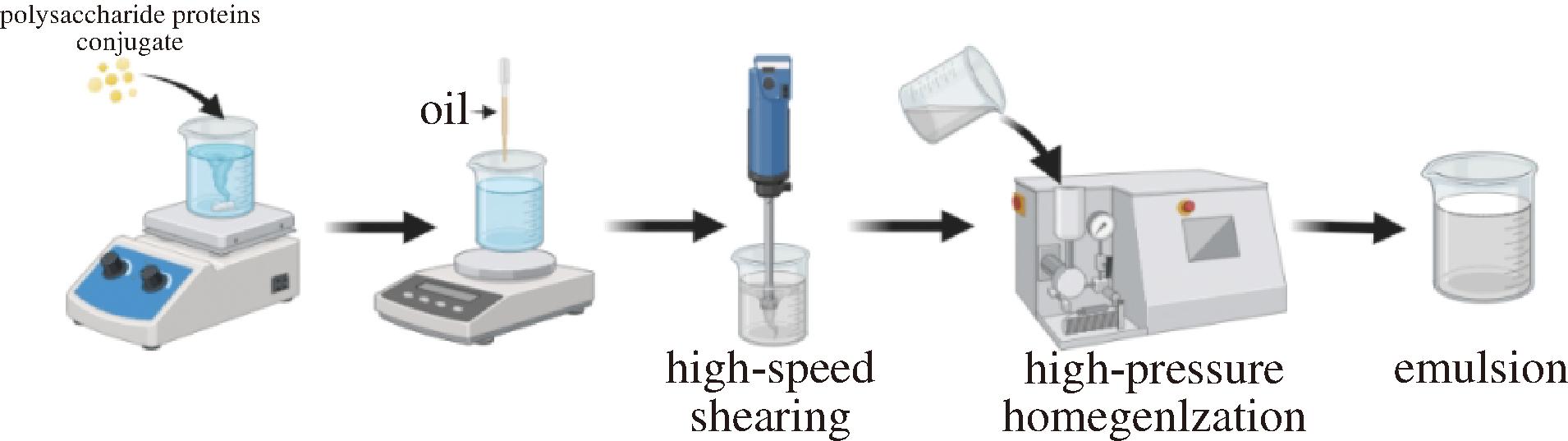
图2 水包油乳液制备流程
Fig.2 Preparation process of oil-in-water emulsion
注:polysaccharide proteins conjugate:多糖蛋白质共价复合物;oil:油;high-speed shearing:高速剪切;high-pressure homogenization:高压均质;emulsion:乳液。
1.3.9.2 乳液粒径测定
使用激光粒度分析仪对乳液的粒径分布进行测量[23]。将水和葵花籽油的折射率分别设为1.333和1.474,加样直至遮蔽率为15%~20%。体积加权平均直径(D4,3)用来监测乳液贮存过程中液滴大小分布的变化。
1.3.9.3 乳液稳定性测定
使用分散体系稳定性分析仪测定乳液稳定性指数[24](turbiscan stability index,TSI)。将1.3.9.1节中所制备的乳液取出20 mL放置于圆柱形玻璃小瓶中,在贮存0、1、3、5、7、14 d时分别进行1次扫描。
1.3.9.4 Zeta电位测定
根据WANG等[25]的方法进行了适当修改,使用Zeta电位分析仪测定0 d和14 d乳液的Zeta电位,将乳液稀释100倍后吸取1 mL注入石英比色皿中进行测定。
1.4 统计学分析
所有实验数据均进行3次重复,表示为“平均值±标准偏差”(SD),并且使用SPSS 21用于显著性分析,P<0.05为统计学显著性。使用Origin 2021软件绘制数据。
2 结果与分析
2.1 CFG的基本结构表征
2.1.1 化学组成和相对分子质量分析
由表2可知,改性前后CFG的主要化学组成没有发生明显变化。CFG在提取过程中已经去除了游离的蛋白质,但CFG中仍含有5.57%左右的蛋白质,可能是因为与CFG共价连接的蛋白质主要集中在分子内部,这与本课题组之前已有的研究结果相一致[18]。改性前后CFG的相对分子质量分布如图3所示,CFG分别经过三氟乙酸和木聚糖酶处理后,其相对分子质量均随水解时间的延长而降低,分别由原始的624.4 kDa降到96.7 kDa和84.4 kDa,证明酸解和酶解均能破坏CFG原始结构降低相对分子质量。
表2 改性前后CFG的化学组成和相对分子质量
Table 2 Chemical composition and relative molecular weight of CFG before and after modification
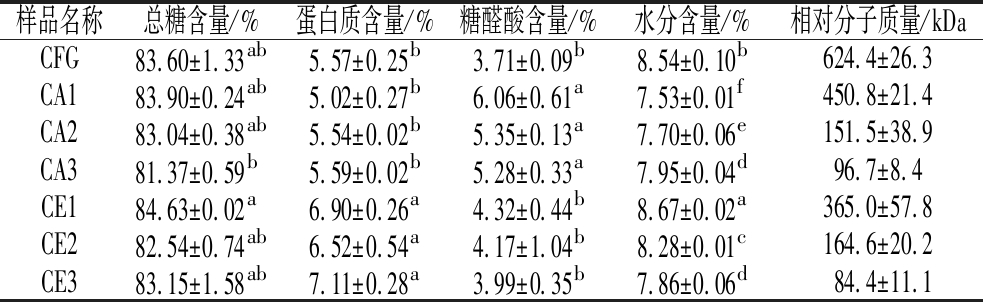
样品名称总糖含量/%蛋白质含量/%糖醛酸含量/%水分含量/%相对分子质量/kDaCFG83.60±1.33ab5.57±0.25b3.71±0.09b8.54±0.10b624.4±26.3CA183.90±0.24ab5.02±0.27b6.06±0.61a7.53±0.01f450.8±21.4CA283.04±0.38ab5.54±0.02b5.35±0.13a7.70±0.06e151.5±38.9CA381.37±0.59b5.59±0.02b5.28±0.33a7.95±0.04d96.7±8.4CE184.63±0.02a6.90±0.26a4.32±0.44b8.67±0.02a365.0±57.8CE282.54±0.74ab6.52±0.54a4.17±1.04b8.28±0.01c164.6±20.2CE383.15±1.58ab7.11±0.28a3.99±0.35b7.86±0.06d84.4±11.1
注:同一列中不同字母表示差异显著P<0.05(下同)。
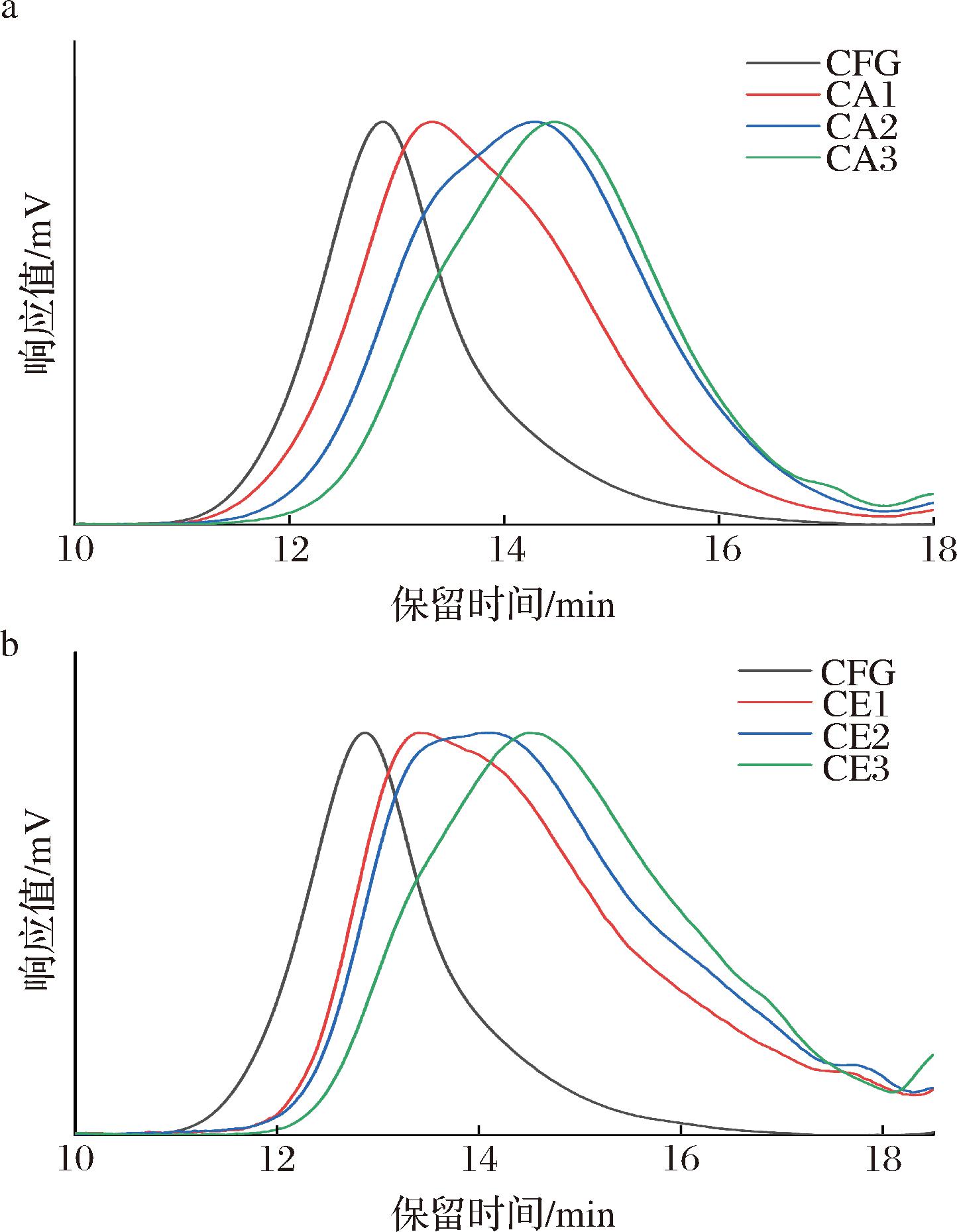
a-三氟乙酸水解;b-木聚糖酶水解
图3 三氟乙酸水解和木聚糖酶水解CFG后的高效尺寸筛析色谱图谱
Fig.3 High-performance size exclusion chromatography spectra of CFG after trifluoroacetic acid hydrolysis and xylanase hydrolysis
2.1.2 单糖组成分析
改性前后CFG的单糖组成如表3所示,CFG降解后其单糖种类没有改变,但是所占比例发生明显变化。先前的研究[18]也表明,阿拉伯糖和木糖的比值(A/X)与CFG的支链度成正比,所以此研究中以A/X的比值作为支链度的评价标准。随着酸水解程度的增加,阿拉伯糖含量逐渐降低,导致木糖含量相对升高,所以A/X降低,这是由于TFA主要作用于CFG的侧链[26];随着酶水解程度的增加,阿拉伯糖和木糖含量没有明显变化,A/X没有差异,说明木聚糖酶主要作用于CFG的主链[13]。
表3 改性前后CFG的单糖组成
Table 3 Monosaccharide composition of CFG before and after modification
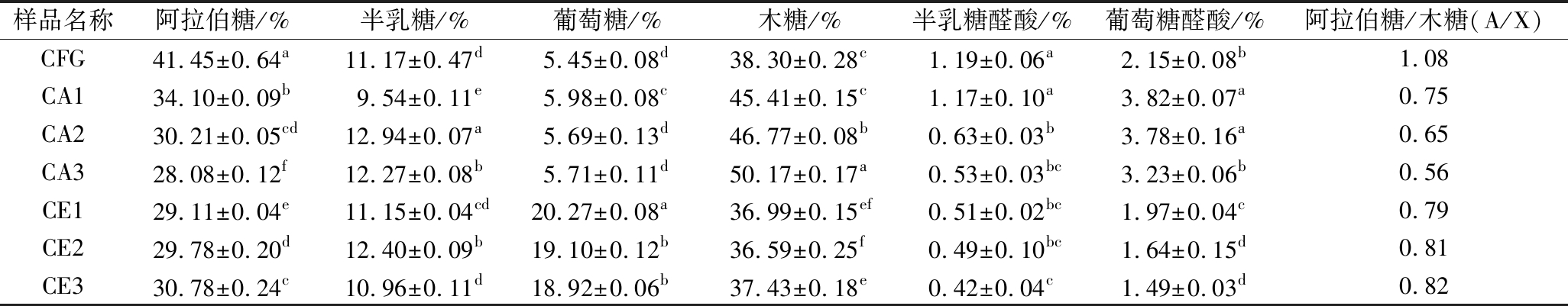
样品名称阿拉伯糖/%半乳糖/%葡萄糖/%木糖/%半乳糖醛酸/%葡萄糖醛酸/%阿拉伯糖/木糖(A/X)CFG41.45±0.64a11.17±0.47d5.45±0.08d38.30±0.28c1.19±0.06a2.15±0.08b1.08CA134.10±0.09b9.54±0.11e5.98±0.08c45.41±0.15c1.17±0.10a3.82±0.07a0.75CA230.21±0.05cd12.94±0.07a5.69±0.13d46.77±0.08b0.63±0.03b3.78±0.16a0.65CA328.08±0.12f12.27±0.08b5.71±0.11d50.17±0.17a0.53±0.03bc3.23±0.06b0.56CE129.11±0.04e11.15±0.04cd20.27±0.08a36.99±0.15ef0.51±0.02bc1.97±0.04c0.79CE229.78±0.20d12.40±0.09b19.10±0.12b36.59±0.25f0.49±0.10bc1.64±0.15d0.81CE330.78±0.24c10.96±0.11d18.92±0.06b37.43±0.18e0.42±0.04c1.49±0.03d0.82
2.2 CFG-SPI共价复合物的结构表征
2.2.1 SDS-PAGE分析
SDS-PAGE被用于判断蛋白质与多糖之间是否通过美拉德反应发生了共价结合[20]。图4中结果表明,所有的混合物样品(泳道1、3、5、7、9、11、13)均出现了SPI的特征条带:11~75 kDa,而它们的复合物条带(泳道2、4、6、8、10、12、14)中,蛋白质的特征条带强度明显降低,是由于CFG分子中的羰基与SPI的肽键之间通过美拉德反应发生共价结合形成了共价键,生成了更大的高分子物质无法透过凝胶[2]。此外,共价复合物样品中蛋白质的特征条带并未完全消失,说明并不是所有的SPI都发生了共价结合[19]。对于原始的CFG(泳道15)没有观察到条带,可能是因为原始CFG的相对分子质量非常大,不能透过凝胶。
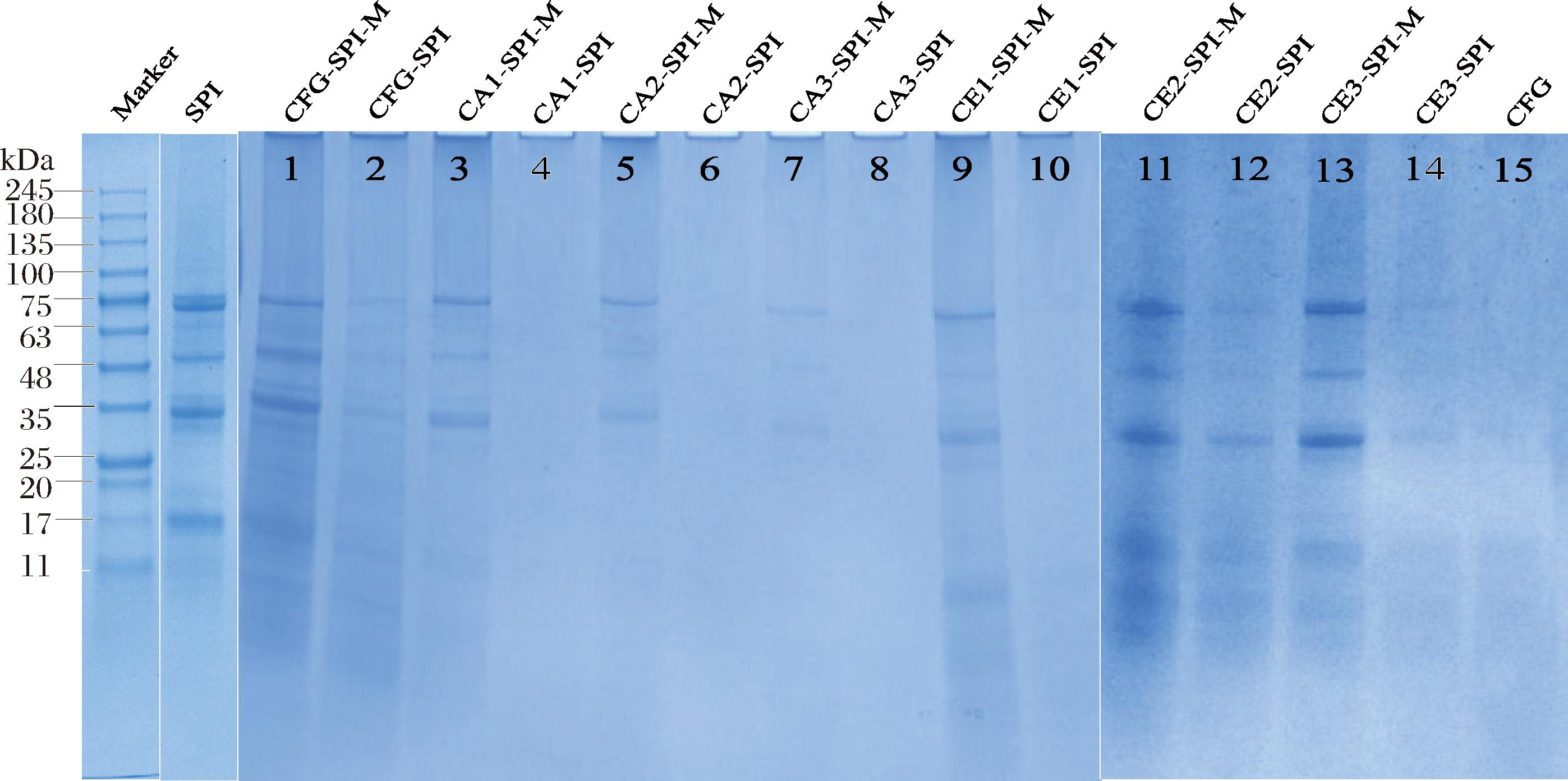
图4 CFG、SPI、CFG-SPI物理混合物和CFG-SPI复合物的SDS-PAGE图
Fig.4 SDS-PAGE patterns of CFG, SPI, CFG-SPI physical mixtures, and CFG-SPI conjugates
2.2.2 FT-IR分析
如图5所示,SPI具有蛋白质的典型吸收峰:3 200~3 600 cm-1强而宽的区域是分子间N—H和O—H的伸缩振动(酰胺A区);1 654 cm-1处是C![]() O键的伸缩振动(酰胺Ⅰ区);1 541 cm-1处是N—H键的伸缩变形(酰胺Ⅱ区);1 240 cm-1是C—N伸缩振动和N—H的弯曲变形(酰胺Ⅲ区)。
O键的伸缩振动(酰胺Ⅰ区);1 541 cm-1处是N—H键的伸缩变形(酰胺Ⅱ区);1 240 cm-1是C—N伸缩振动和N—H的弯曲变形(酰胺Ⅲ区)。
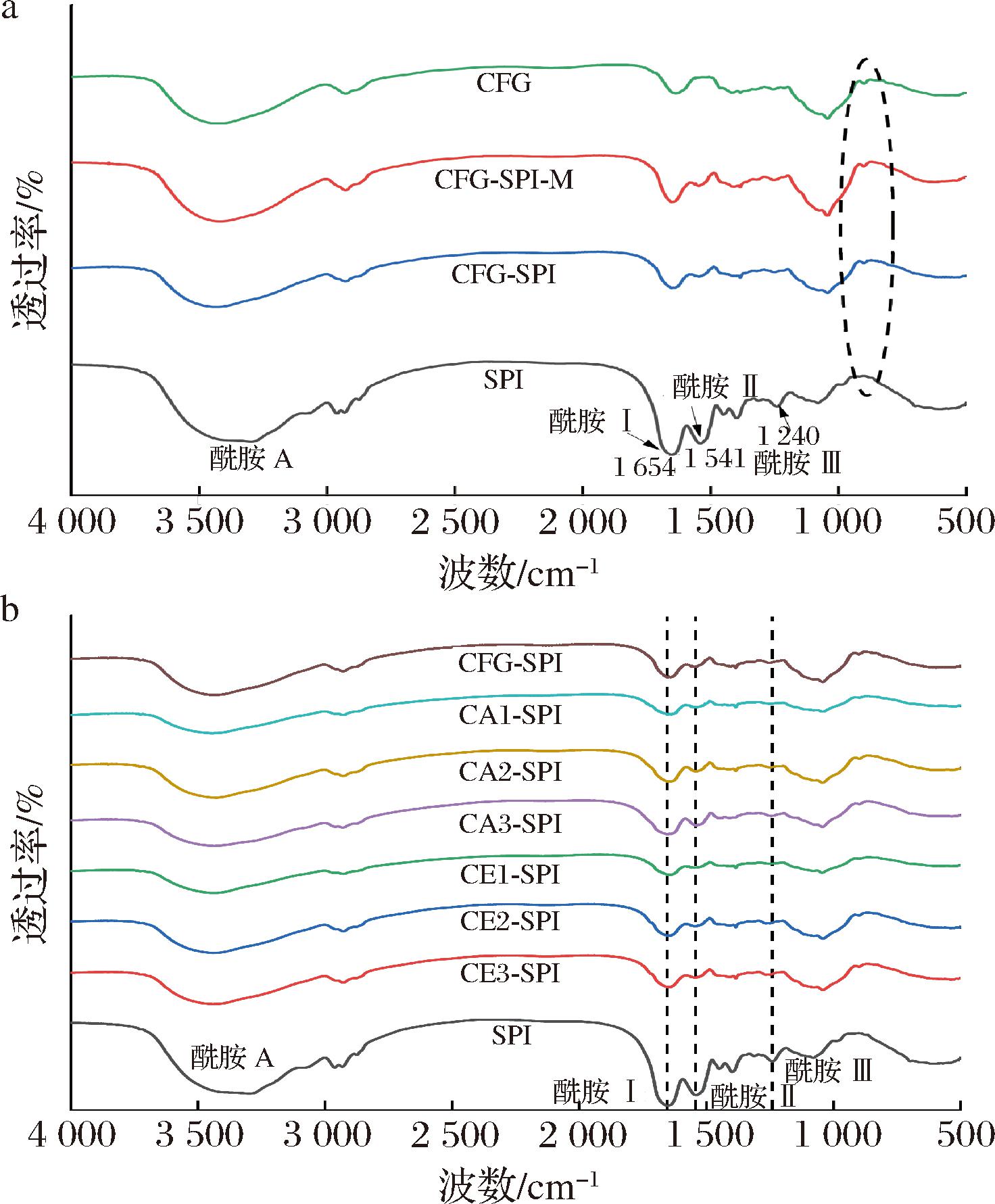
a-CFG、SPI、CFG-SPI-M和CFG-SPI;b-SPI和改性前后的CFG与SPI的共价复合物
图5 CFG、SPI、CFG-SPI-M和CFG与SPI共价复合物的FT-IR图
Fig.5 FT-IR spectra of CFG, SPI, CFG-SPI-M, and conjugates of CFG and SPI
所有共价复合物的吸收峰与CFG-SPI-M相比,在酰胺A区均发生了偏移和振动变形,这是由于CFG分子中的羰基与SPI的肽键形成了共价键[19];在酰胺Ⅰ、酰胺Ⅱ和酰胺Ⅲ区域的吸收峰强度均明显降低,可能是美拉德反应过程中蛋白质中的赖氨酸被消耗,导致—NH2基团损失[27]。另外,在953~1 180 cm-1区域(碳水化合物的“指纹”区域),复合物比SPI具有更强的峰信号,这表明CFG与SPI之间通过美拉德反应发生了共价结合[19]。
2.3 CFG-SPI共价复合物的功能特性
2.3.1 褐变程度分析
多糖和蛋白质共价复合物的褐变程度通常用来表征美拉德反应的程度,即褐变水平越深,说明美拉德反应进行的程度越大[24]。如图6所示,水解的CFG-SPI复合物的褐变程度整体高于未水解的CFG-SPI,说明具有较低支链度/低相对分子质量的CFG含有较高比例的还原末端,更有利于与蛋白质上的氨基通过美拉德反应形成共价键。CA1-SPI、CA2-SPI和CA3-SPI的褐变程度随CFG支链度的降低逐渐增大,可能是低支链度的CFG具有较弱的空间位阻,更容易被SPI分子中的活性基团所利用。而CE1-SPI、CE2-SPI和CE3-SPI的褐变程度随CFG相对分子质量的降低变化不显著,但褐变程度整体偏高。推测是因为CFG断开主链后,其碳链变短,使存在的开链形式增多,所以有更多的位点与SPI发生共价连接[28]。上述结果表明,支链度是影响美拉德反应发生较为重要的因素,支链度越高越有利于美拉德反应的发生。
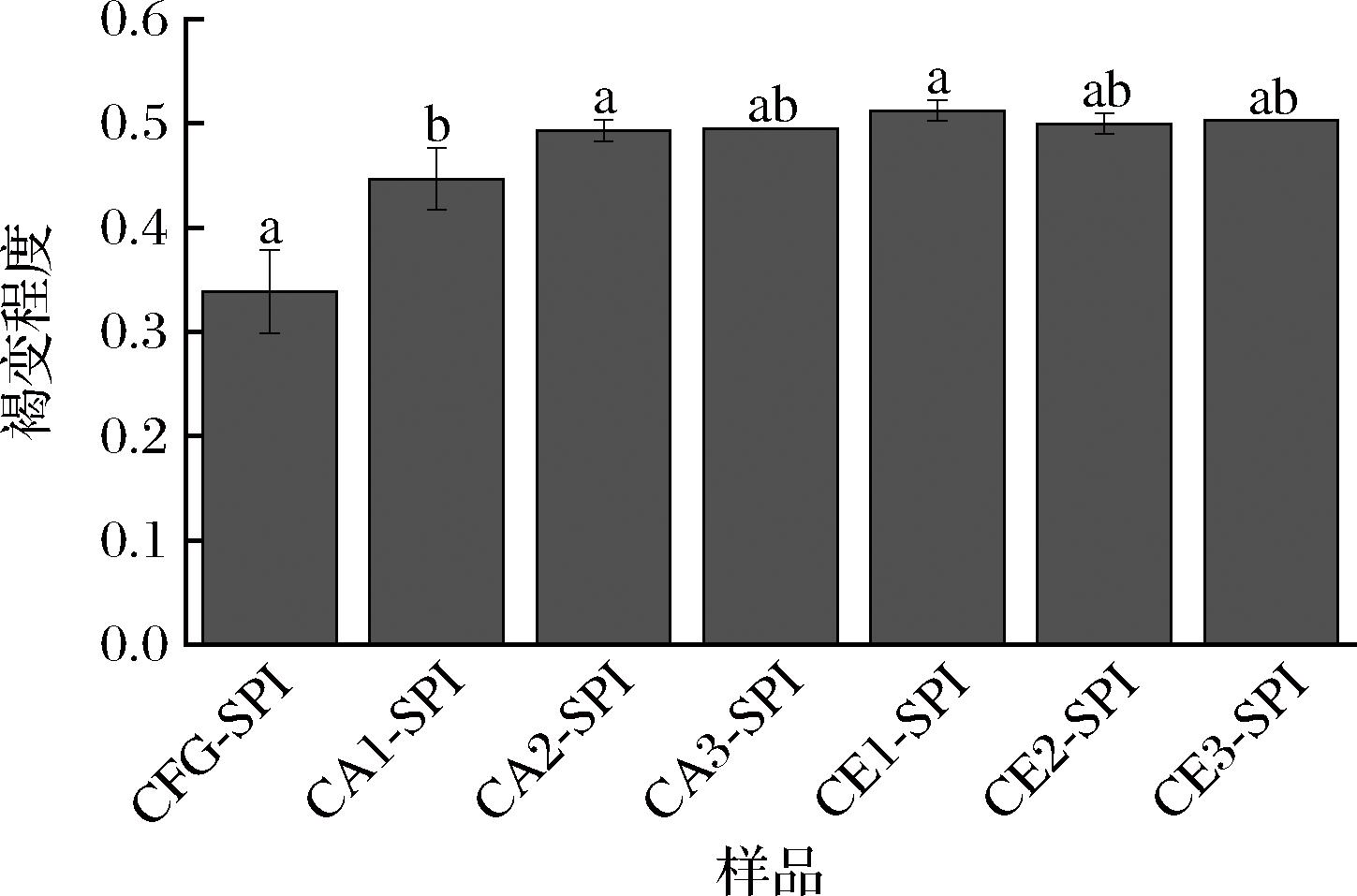
图6 多糖-蛋白质共价复合物的褐变程度
Fig.6 Browning degree of polysaccharide-protein conjugates
注:不同字母表示差异显著P<0.05(下同)。
2.3.2 蛋白质溶解度分析
蛋白质的溶解性是实现乳化性、抗氧化性和胶凝性等功能特性的基础,并影响其在食品加工中的应用。如图7所示,pH值为4.5和7.0时,与SPI和CFG-SPI-M相比,共价复合物的蛋白质溶解度明显提高,说明美拉德反应显著改善了SPI的溶解度,这是因为CFG提供了大量的羟基,提高了SPI的亲水性,进而增加了蛋白质的溶解度[19]。CE1-SPI、CE2-SPI和CE3-SPI的蛋白质溶解度高于CA1-SPI、CA2-SPI和CA3-SPI,可能是因为酶水解后的CFG,其支链度更高,与SPI形成的共价复合物空间稳定性更强,有效地阻止了蛋白质聚集。同时,所有样品的蛋白质溶解度在蛋白质的等电点(pI=4.5)时均有所降低,说明蛋白质在等电点附近分子内和分子间的静电斥力降低,使蛋白质的净电荷减少,导致其聚集或沉淀。
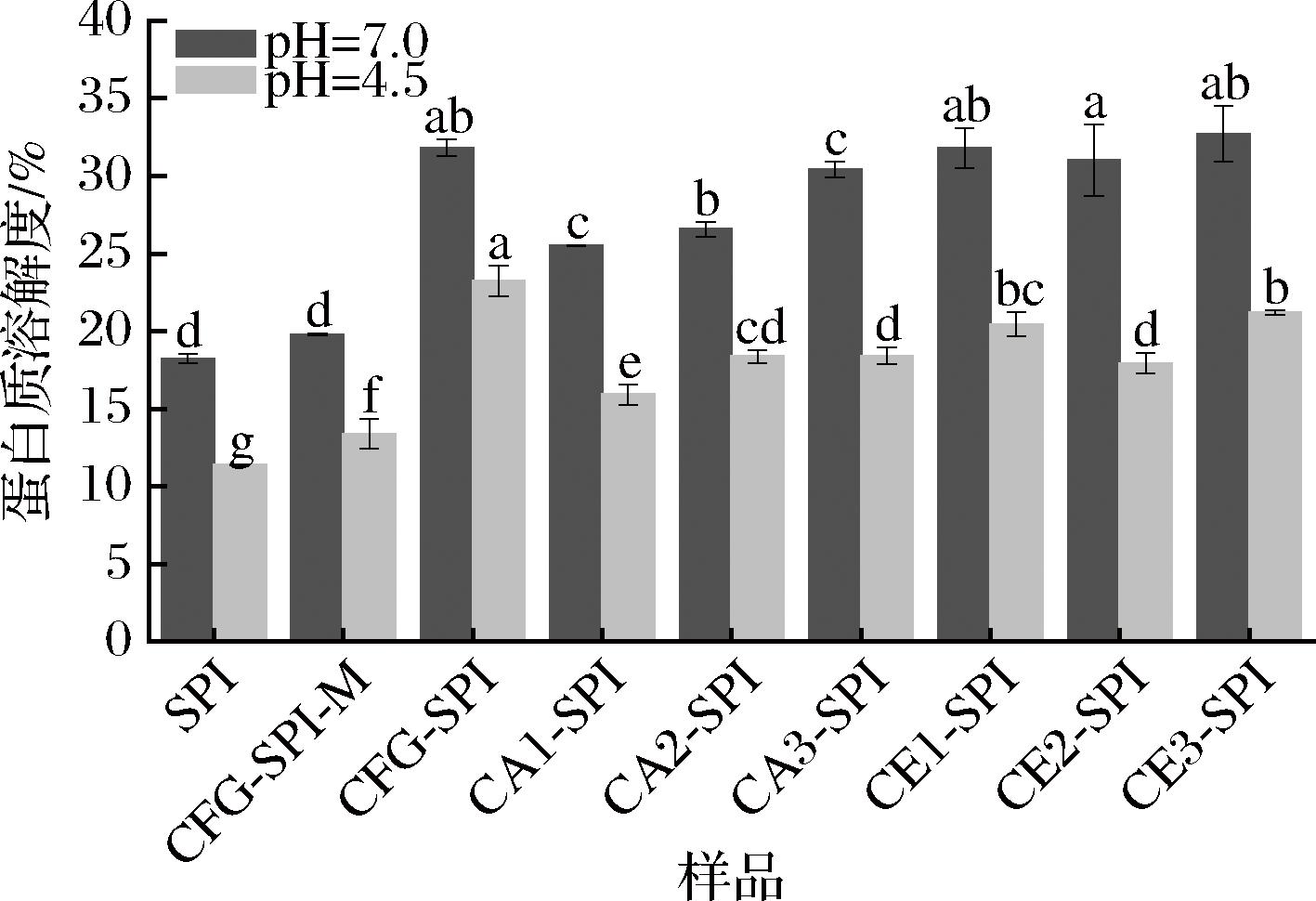
图7 SPI,CFG-SPI混合物/共价复合物的蛋白质溶解度
Fig.7 Protein solubility of SPI, CFG-SPI mixture/conjugates
2.4 CFG-SPI共价复合物的乳化特性
2.4.1 粒径分析
体积加权平均粒径(D4,3)用于表示与目标颗粒具有相同体积/表面积比的液滴的直径[29],D4,3的值越小,说明液滴尺寸越小,乳化剂的乳化性能越好。如图8所示,共价复合物的乳液粒径明显低于单独的SPI、CFG和CFG-SPI-M,也低于GA,这是蛋白分子的高乳化性和多糖大分子的空间位阻相结合的结果,在YADAV等[7]的研究中也有类似的报道。在乳液贮存14 d时,CE1-SPI、CE2-SPI和CE3-SPI的乳液粒径与CFG-SPI结果相近,但要明显低于CA1-SPI、CA2-SPI和CA3-SPI,可能是因为木聚糖酶主要作用于CFG的主链,从而维持了和原始CFG相似的结构;而CFG经过酸水解后,支链度较低,其共价复合物的空间位阻较弱,导致乳液稳定性较差。而且,CE1、CE2和CE3的支链度相近,相对分子质量逐渐降低,但其共价复合物的乳液粒径无明显差异,说明CFG相对分子质量的变化对乳液稳定性影响不大。
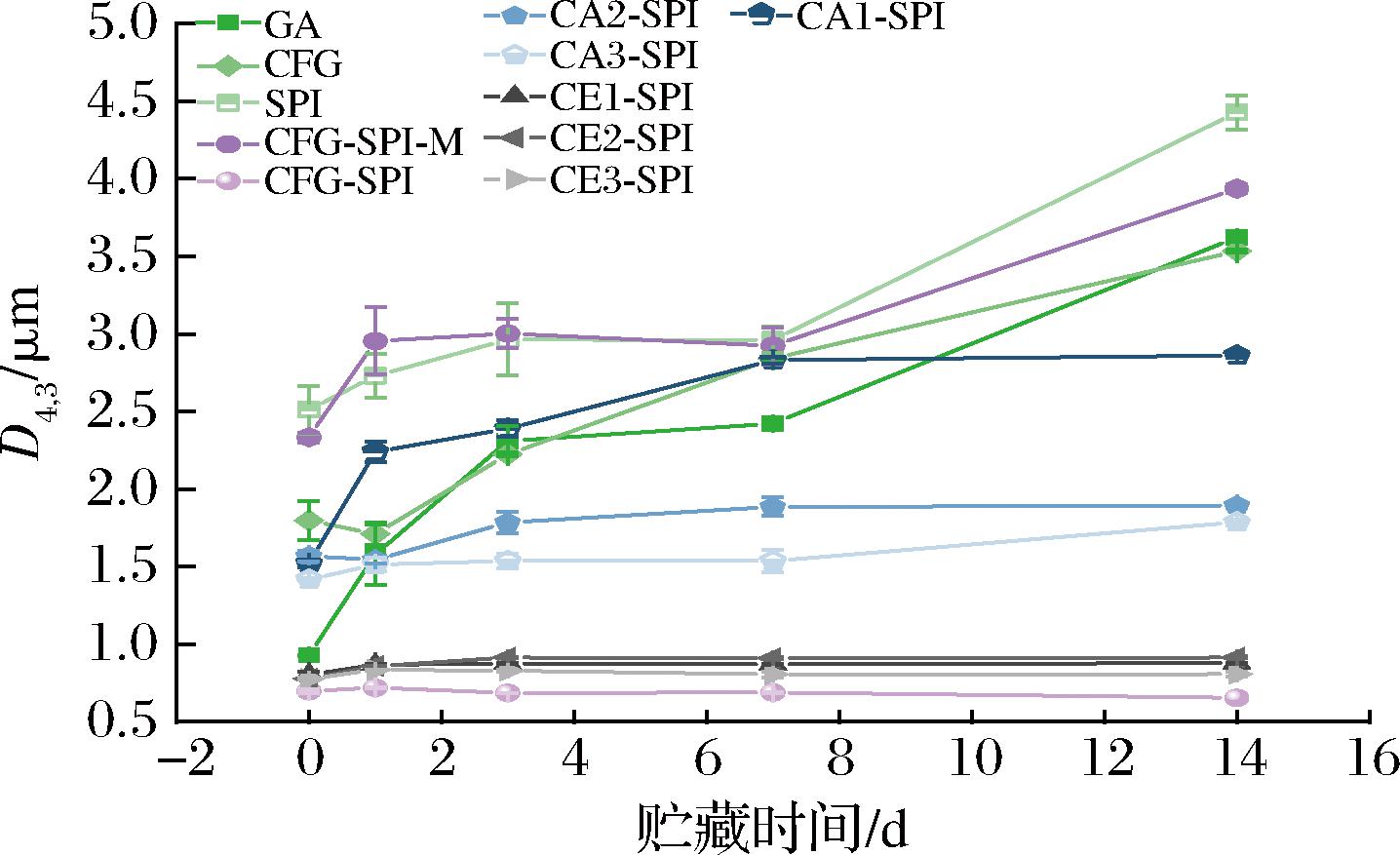
图8 乳液的体积加权平均粒径(D4,3)在14 d内的变化
Fig.8 Volume-weighted average particle size (D4,3) of the emulsions changed within 14 days
2.4.2 乳液稳定性分析
通过分散体系的稳定程度分析乳液在贮存过程中内部液滴的变化,通常用TSI来表示,其数值越大或变化越大,表明乳液液滴越不稳定。如图9所示,乳液在贮存14 d时,共价复合物的TSI均明显优于天然的CFG、SPI和GA,该现象与粒径结果一致。说明共价复合物可以在乳液油滴表面形成一个更厚和更高效的空间位阻,在一定程度上能够阻止液滴上浮和聚集[24]。CA3与CE3的相对分子质量接近,但CE3-SPI的乳化稳定性更好,这是由于CE3的支链度更高,其共价复合物具有更紧密的结构[2],说明CFG的支链度是影响乳化特性的重要因素。
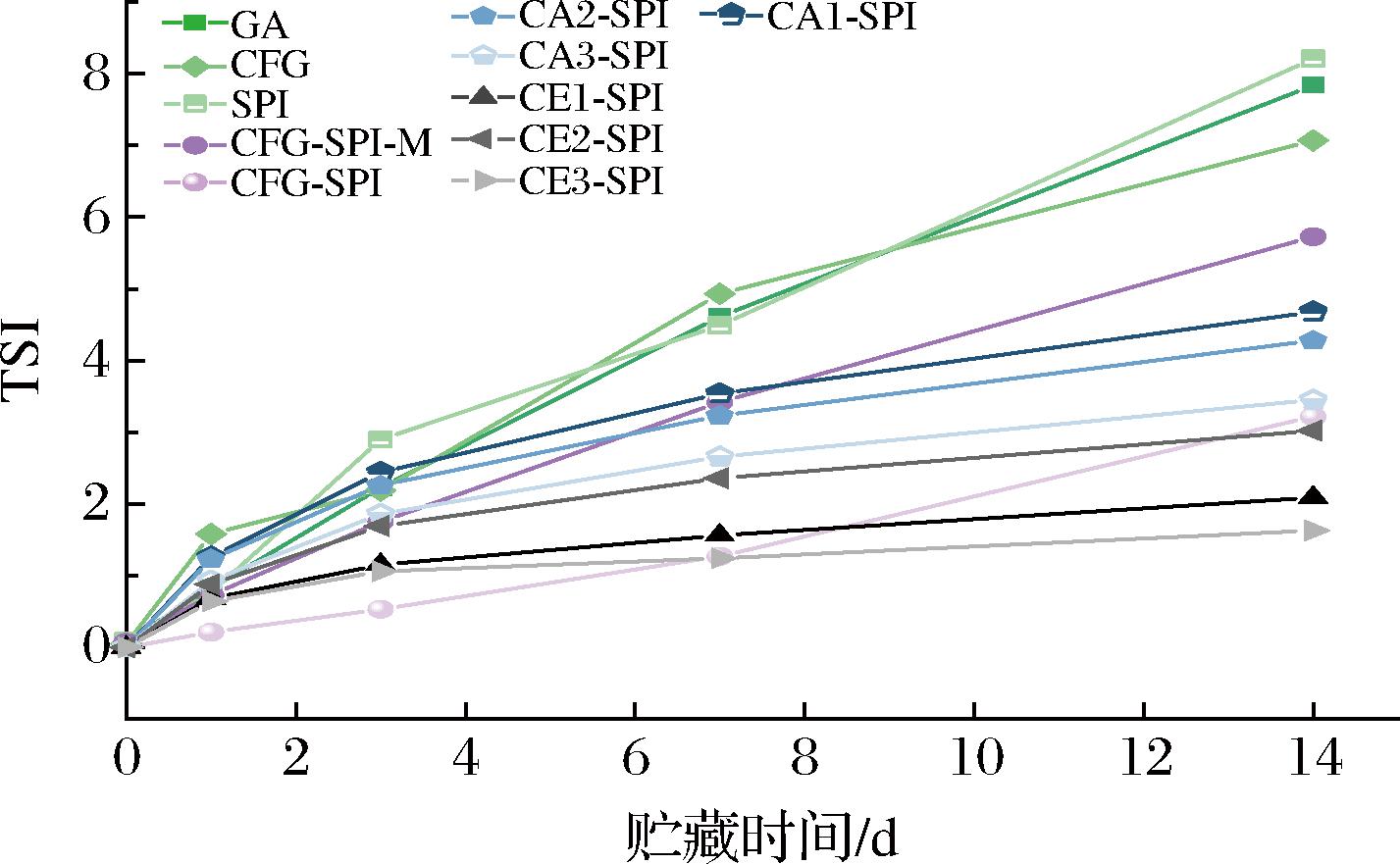
图9 乳液的稳定性指数在14 d内的变化
Fig.9 Emulsion stability index of the emulsions changed within 14 days
2.4.3 Zeta分析
有报道称,Zeta电位的绝对值≥20 mV则表示该分散体系具有较好的稳定性,且Zeta电位的绝对值越高,乳液越稳定[25]。如图10所示,无论是新鲜乳液还是贮存14 d后的乳液,原始的CFG、SPI和CFG-SPI-M的Zeta电位绝对值均低于共价复合物,说明CFG与SPI共价结合后,有效增强了分子之间的空间位阻,使得被掩蔽的带电阴离子被释放,增加了电位绝对值。CFG-SPI的乳液Zeta电位绝对值高于CA1-SPI、CA2-SPI、CA3-SPI、CE1-SPI、CE2-SPI和CE3-SPI,说明CFG-SPI稳定性较好,这是因为CFG-SPI具有较高的负电荷,乳液颗粒之间的静电斥力较大,可以有效阻止液滴聚集[30]。此外,与CA1、CA2和CA3相比,CE1、CE2和CE3的支链度较高,空间位阻较强,所以其共价复合物乳液的Zeta电位绝对值较高。
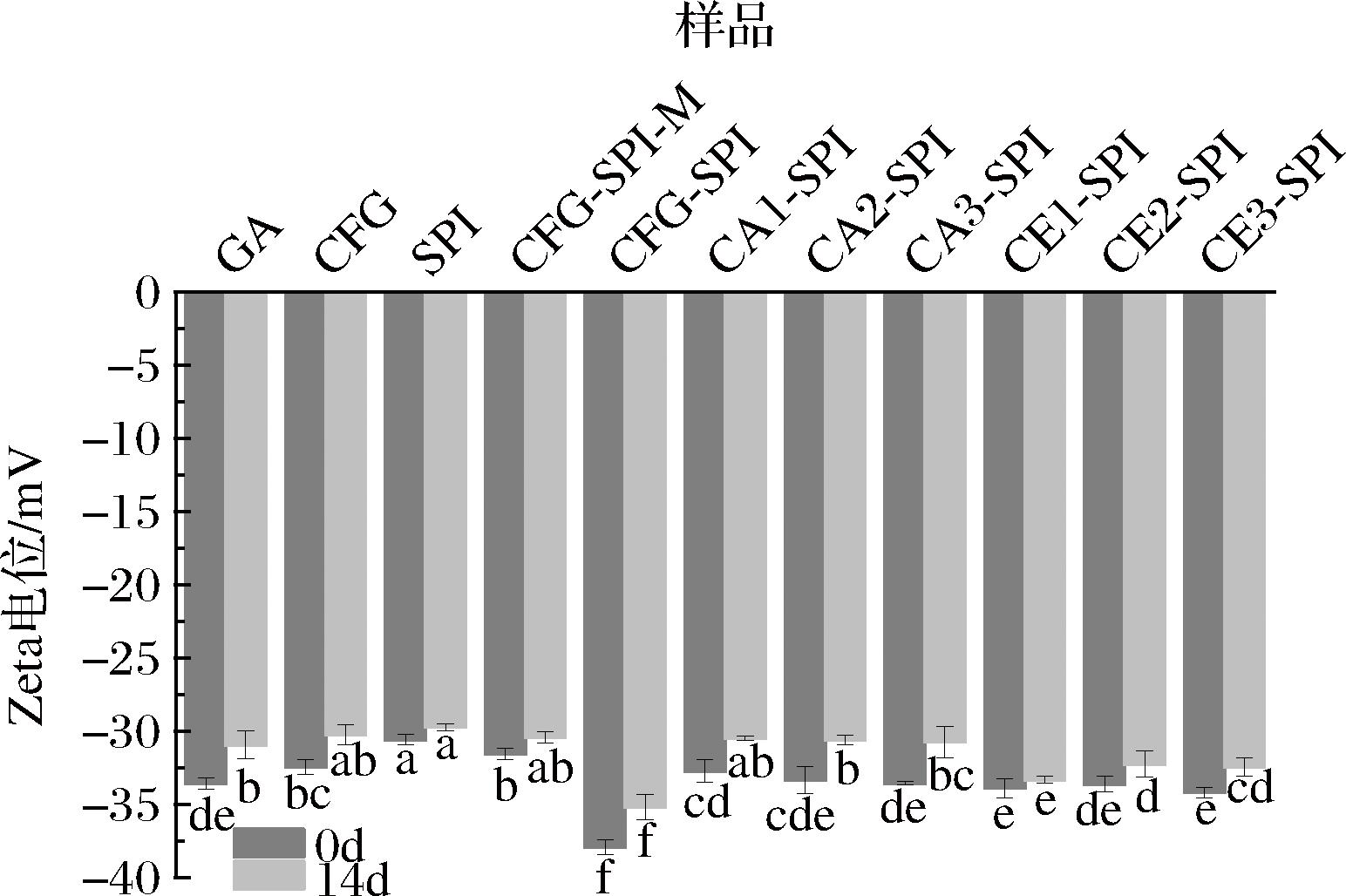
图10 贮存时间对乳液Zeta电位的影响
Fig.10 Effect of storage time on Zeta potential of emulsion
3 结论
本研究表明,随着酸水解时间的延长,CFG的支链度和相对分子质量均呈现下降的趋势,而木聚糖酶处理时间的延长对支链度无明显影响,只是改变了其相对分子质量大小。SDS-PAGE和FT-IR的结果表明,CFG与SPI通过美拉德反应发生了共价结合,形成的CFG-SPI复合物显著提高了SPI的溶解度,且低支链度/低相对分子质量的CFG,更有利于美拉德反应的发生。共价复合物的乳化性能均高于天然的CFG、SPI、GA和CFG-SPI-M,且相对分子质量相近、支链度较高的CFG,其复合物的结构更紧凑,乳化稳定性更好,说明CFG的支链度是影响乳化特性的重要因素。此外,CFG的支链度相近,相对分子质量逐渐降低,但其复合物的乳化性能无明显差异,说明CFG的相对分子质量对乳化特性的影响不大。本研究的结果将为后续糖-蛋白类乳化剂的开发利用提供一定理论依据。
[1] TANG Q L, HUANG G L.Improving method, properties and application of polysaccharide as emulsifier[J].Food Chemistry, 2022, 376:131937.
[2] LIU Y, ZHAO G L, ZHAO M M, et al.Improvement of functional properties of peanut protein isolate by conjugation with dextran through Maillard reaction[J].Food Chemistry, 2012, 131(3):901-906.
[3] DE MATTOS N R, COLODETTE J L, DE OLIVEIRA C R.Alkaline extraction and carboxymethylation of xylans from corn fiber[J].Cellulose, 2019, 26(3):2177-2189.
[4] WHISTLER R L, CORBETT W M.Oligosaccharides from partial acid hydrolysis of corn fiber hemicellulose[J].Journal of the American Chemical Society, 1955, 77(23):6328-6330.
[5] SAULNIER L, MAROT C, CHANLIAUD E, et al.Cell wall polysaccharide interactions in maize bran[J].Carbohydrate Polymers, 1995, 26(4):279-287.
[6] YADAV M P, JOHNSTON D B, HOTCHKISS A T Jr, et al.Corn fiber gum:A potential gum arabic replacer for beverage flavor emulsification[J].Food Hydrocolloids, 2007, 21(7):1022-1030.
[7] YADAV M P, STRAHAN G D, MUKHOPADHYAY S, et al.Formation of corn fiber gum-milk protein conjugates and their molecular characterization[J].Food Hydrocolloids, 2012, 26(2):326-333.
[8] CAI Z X, WEI Y, ZHANG H B, et al.Holistic review of corn fiber gum:Structure,properties,and potential applications[J].Trends in Food Science &Technology, 2021, 111:756-770.
[9] HUA Y F, CUI S W, WANG Q, et al.Heat induced gelling properties of soy protein isolates prepared from different defatted soybean flours[J].Food Research International, 2005, 38(4):377-385.
[10] KATO A.Surface Activity of Proteins[M].Boca Raton:CRC Press, 1996:115-129.
[11] LI S S, LIU Y, QIN W, et al.Physicochemical stability and in vitro bioaccessibility of β-carotene emulsions stabilized with Arabinoxylan hydrolysates-soy protein isolate conjugates[J].LWT, 2022, 157:113120.
[12] LIU F, ZHANG S Y, CHEN K X, et al.Fabrication, in-vitro digestion and pH-responsive release behavior of soy protein isolate glycation conjugates-based hydrogels[J].Food Research International, 2023, 169:112884.
[13] LIU Y, WANG S W, KANG J, et al.Arabinoxylan from wheat bran:Molecular degradation and functional investigation[J].Food Hydrocolloids, 2020, 107:105914.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[15] CORTÉS-R OS J, Z
OS J, Z RATE A M, FIGUEROA J D, et al.Protein quantification by bicinchoninic acid (BCA) assay follows complex kinetics and can be performed at short incubation times[J].Analytical Biochemistry, 2020, 608:113904.
RATE A M, FIGUEROA J D, et al.Protein quantification by bicinchoninic acid (BCA) assay follows complex kinetics and can be performed at short incubation times[J].Analytical Biochemistry, 2020, 608:113904.
[16] BLUMENKRANTZ N, ASBOE-HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry, 1973, 54(2):484-489.
[17] JAFARI A, TUMBLESON M, RAUSCH K D.Evaluation of grain moisture measurement methods suited for developing countries[J].Journal of Stored Products Research, 2022, 98:102001.
[18] KANG J, HUANGFU Z Y, TIAN X N, et al.Arabinoxylan of varied structural features distinctively affects the functional and in vitro digestibility of wheat starch[J].Food Hydrocolloids, 2023, 140:108615.
[19] ZHU X R, MENG L Y, SONG S, et al.Insight into the mechanisms of the excellent emulsification properties of whey protein isolate-arabinoxylan conjugates[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 27:100312.
[20] AKHTAR M, DICKINSON E.Whey protein-maltodextrin conjugates as emulsifying agents:An alternative to gum Arabic[J].Food Hydrocolloids, 2007, 21(4):607-616.
[21] 张志颖, 张琳璐, 白英, 等.亚麻籽胶-乳清蛋白改性物的制备及抗氧化性[J].食品与发酵工业, 2023, 49(1):146-153.
ZHANG Z Y, ZHANG L L, BAI Y, et al.Preparation and antioxidant activity of flaxseed gum-whey protein modified[J].Food and Fermentation Industries, 2023, 49(1):146-153.
[22] LIU L, LI X D, DU L L, et al.Effect of ultrasound assisted heating on structure and antioxidant activity of whey protein peptide grafted with galactose[J].LWT, 2019, 109:130-136.
[23] AKHTAR M, DICKINSON E.Emulsifying properties of whey protein-dextran conjugates at low pH and different salt concentrations[J].Colloids and Surfaces B:Biointerfaces, 2003, 31(1-4):125-132.
[24] DONG X Y, DU S S, DENG Q C, et al.Study on the antioxidant activity and emulsifying properties of flaxseed gum-whey protein isolate conjugates prepared by Maillard reaction[J].International Journal of Biological Macromolecules, 2020, 153:1 157-1 164.
[25] WANG J, FAN M C, LI Y, et al.Structural and emulsion-stabilizing properties of the alkali-extracted arabinoxylans from corn and wheat brans[J].International Journal of Biological Macromolecules, 2023, 251:126190.
[26] KANG J, GUO Q B, SHI Y C.NMR and methylation analysis of hemicellulose purified from corn bran[J].Food Hydrocolloids, 2019, 94:613-621.
[27] SAATCHI A, KIANI H, LABBAFI M.A new functional protein-polysaccharide conjugate based on protein concentrate from sesame processing by-products:Functional and physico-chemical properties[J].International Journal of Biological Macromolecules, 2019, 122:659-666.
[28] CHEVALIER F, CHOBERT J M, POPINEAU Y, et al.Improvement of functional properties of β-lactoglobulin glycated through the Maillard reaction is related to the nature of the sugar[J].International Dairy Journal, 2001, 11(3):145-152.
[29] MU L X, ZHAO M M, YANG B, et al.Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J].Journal of Agricultural and Food Chemistry, 2010, 58(7):4494-4499.
[30] 张宏媛, 钱佳俊, 李哲远, 等.部分酸水解对桃胶多糖结构和乳化功能的影响[J].食品科学, 2023, 44(4):99-106.
ZHANG H Y, QIAN J J, LI Z Y, et al.Effect of partial acid hydrolysis on the structure and emulsifying function of peach gum polysaccharide[J].Food Science, 2023, 44(4):99-106.