苹果(Malus pumila Mill)是蔷薇科亚科下的苹果属植物类别的大宗水果,营养丰富,酸甜可口,对人体健康如血压、血脂、体重等有重要作用,素有“温带水果之冠”的美誉[1]。中国是世界苹果原生中心之一,2020—2021年产季中国苹果产量4 406.6万t,位居第1,占世界苹果总产量的54.7%[2]。然而苹果在采后由于贮运不当极易被霉菌侵染而发生腐烂,从而导致巨大的经济损失。棒曲霉和扩展青霉能够在苹果伤口处定殖并利用其营养物质生长进而导致苹果腐败,而且这2种霉菌还会在苹果上产生棒曲霉素(patulin, PAT)。PAT是一种具有致畸和致癌特性的真菌毒素[3]。PAT生成后会向未腐烂组织扩散,即使去除腐败部分,苹果组织中仍会有残留。此外,PAT耐热耐酸,在加工过程中难以去除,导致苹果加工产品如苹果汁、苹果醋等被污染,进而威胁食用者的健康[4]。
苹果采后病害防治的主要方法有物理防治、化学防治和生物防治。近年来,生物防治因其安全、高效、绿色等优点成为研究的热点。目前,对于苹果腐败菌和PAT产生菌的生物防治主要集中在扩展青霉上。已筛选出的具有生防效果的拮抗菌包括细菌、霉菌和酵母菌等。酵母菌具有遗传稳定性好、营养要求简单、生存力强、安全性高和对各种病原菌控制效果显著等优点[5]。因此,酵母已成为利用生物防治方法控制果实采后病害的主要拮抗菌。LI等[6]发现酵母菌(Saccharomyces cerevisiae) YE-7不仅能防控苹果上的扩展青霉,还可以直接影响PAT的生物合成从而控制PAT在苹果上的积累,清酒假丝酵母(Candida sake) 41E[7]、马克斯克鲁维酵母(Kluyveromyces marxianus) XZ1[8]和拟粉红锁掷孢酵母(Sporidiobolus pararoseus) Y16[9-10]也同样兼具抑菌和去毒作用。CSERNUS等[11]对腐败苹果表面菌株进行分离发现除了常见的扩展青霉外,棒曲霉也能够导致苹果腐败并且可以产生PAT。但国内外对于棒曲霉的生物防治及产毒关注较少。张亚健[12]筛选出能够抑制苹果表面的棒曲霉的枯草芽孢杆菌B22,此菌株明显控制了苹果的腐败。贺玉梅等[13]的研究表明在体外静置培养条件下,棒曲霉的产毒能力大于扩展青霉。
因此,本研究从供试菌株中筛选出兼具抑菌和控制PAT产生的生防菌,并评估拮抗菌在苹果上防控棒曲霉和扩展青霉的潜力和特性,最后考查了拮抗菌对苹果贮藏品质的影响,以期为采后苹果保鲜及苹果加工产品安全提供一定理论参考。
1 材料与方法
1.1 材料与试剂
供试果实:红富士苹果,产地陕西延安。选择自然成熟、外观均匀一致和表面完好无机械损伤的果实,用0.1%(质量分数)的NaClO溶液浸泡消毒5 min,放入塑料筐中在室温下晾干后备用。
棒曲霉(Aspergillus clavatus):冻干粉,购于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),菌株编号CGMCC 3.3516。
扩展青霉(Penicillium expansum):冻干粉,购于CGMCC,菌株编号CGMCC 3.3703。
拮抗菌:经预实验,拟采用本课题组分离鉴定并保存的12株菌种,分别是酿酒酵母(Saccharomyces cerevisiae SC1)、异常威克汉姆酵母(Wickerhamomyces anomalus WA8)、德尔布有孢酵母(Torulaspora delbruecki TD2)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum HU1)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii PK1)、膜醭毕赤酵母(Pichia membranifaciens PM1)、白地霉(Geotrichum candidum XG1)、乳酸片球菌(Pediococcus acidilactici F35)、植物乳杆菌(Lactobacillus plantarum F31)、清酒乳杆菌(Latilactobacillus sakei F15)、赫伦魏斯氏菌(Weissella hellenica F1)、副干酪乳杆菌(Lactobacillus paracasei F50)。
PAT:纯度≥98%,CAS:149-29-1,购买于麦克林(中国上海)。
1.2 仪器与设备
LHS-150CAY恒温恒湿培养箱,上海齐欣科学仪器有限公司;THZ-98C恒温振荡器,上海一恒科学仪器有限公司;VORTEX-5漩涡混合器,海门市其林贝尔仪器制造有限公司;XDN100氮吹仪,上海析谱仪器有限公司;Agilent 1260 series高效液相色谱仪,安捷伦科技有限公司;PAL-1糖度计,广州市爱宕科学仪器有限公司;GY-4型果实硬度计,青岛拓科仪器有限公司。
1.3 实验方法
1.3.1 菌株活化及孢子悬液制备
病原菌的活化:用75%酒精擦拭安瓿瓶后,用火焰加热其顶端,滴入少量无菌水至加热的安瓿瓶顶端使之破裂,用镊子敲打破裂顶端使之破裂。吸取300 μL无菌水滴入瓶内,轻轻振荡,吸取全部菌悬液在PDA培养基上28 ℃培养。
病原菌孢子悬浮液制备:参照JIANG等[14]的方法将病原菌划线至PDA琼脂平板上,于28 ℃培养直至产生大量孢子,用10 mL无菌0.01%吐温80溶液将孢子冲洗下来,用8层纱布过滤去除菌丝,用无菌离心管收集滤液,利用血球板计数和生理盐水稀释调节孢子悬浮液浓度至所需浓度,待用。
1.3.2 拮抗菌的体内外筛选
1.3.2.1 拮抗菌的体外筛选
拮抗菌的筛选采用平板对峙法:参照PEREYRA等[15]的方法稍作修改,接种5 μL病原菌孢子液(棒曲霉浓度1×106 spores/mL、扩展青霉浓度1×105 spores/mL)到PDA平板中央,在距平板中心四周的1 cm处点接酵母菌(浓度1×108cells/mL),对照组点接无菌水,置于28 ℃培养箱培养5 d后观察其生长状况,测量霉菌生长直径,计算抑菌率,如公式(1)所示。每个处理3个平行,实验重复2次。
抑菌率/%=(对照病原菌菌落直径-实验病原菌菌落直径)×100
(1)
双层平板划线法:参照CHEN等[16]将供试乳酸菌在MRS固体培养基培养基表面划2条3 cm平行短横线,37 ℃培养48 h,直到长出规则菌落。然后将病原菌孢子悬浮液(棒曲霉浓度1× 106 spores/mL、扩展青霉浓度1× 105 spores/mL)与融化后保温的未凝固 PDA(2%琼脂)培养基混匀后(孢子终浓度为1×104 spores /mL),立即倾倒至上述划线平板上层,每个平板倾倒10 mL,于28 ℃培养箱中培养,已未接种乳酸菌的平板作为对照,48 h后记录抑菌圈面积,计算抑菌率。每个处理3个平行,实验重复2次。
1.3.2.2 拮抗菌的活体筛选
参照ALVAREZ等[7]的方法稍作修改,在果实表面的赤道部位打4个分布均匀并且直径、深度一致的伤口(4 mm×5 mm)。用移液枪向伤口处注入30 μL拮抗菌悬液(浓度1×108cells/mL),2 h后接种30 μL病原菌(棒曲霉为1×106 spores/mL、扩展青霉为1×105 spores/mL),以只接种无菌蒸馏水为对照,用密封袋逐个密封,置于25 ℃的培养箱中。8 d后测定果实的腐烂直径。每个处理3个平行,实验重复2次。
1.3.3 G.candidum XG1对病原菌产毒能力的影响
参考ZONG等[17]的方法稍作修改,将G.candidum XG1分别接种到含病原菌孢子悬液(棒曲霉浓度1×106 spores/mL、扩展青霉浓度1× 105 spores/mL)的培养基(PDB培养基、苹果汁、苹果),以只接种无菌蒸馏水为对照,置于25 ℃培养箱中静置培养。在2、4、6、8、10 d取样测定PAT含量。PAT的提取及测定参照SETTIER-RAM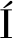 REZ等[18]的方法。
REZ等[18]的方法。
1.3.4 G.candidum XG1在苹果伤口及表面的定殖情况
1.3.4.1 G.candidum XG1在苹果表面的生长动态
参考LI等[6]的方法稍作修改,G.candidum XG1在苹果表面的存活及繁殖能力测定如下:用无菌记号笔在苹果的赤道处画4个等距离相同大小的圆(直径40 mm),在每个圆中心滴加30 μL 浓度为1×108cells/mL的G.candidum XG1菌悬液,用无菌涂布棒将酵母菌悬液均匀的涂布在圆圈内,对照组加入等量的无菌生理盐水。在室温下晾干后,苹果装在塑料筐中,用保鲜膜密封塑料筐,分别在25、4 ℃下贮藏。测定25 ℃下苹果伤口的G.candidum XG1数量,连续8 d每天测定;4 ℃下则间隔3 d测定1次,共测定21 d。
菌落计数方法:用无菌手术刀切下4个圆圈,将组织置于40 mL无菌生理盐水中,用无菌研钵将组织捣碎。将样品稀释后,取100 μL涂抹在PDA培养基上,在28 ℃下培养48 h后进行菌落计数,G.candidum XG1的数量表示为lg cells/circle。
1.3.4.2 G.candidum XG1在苹果伤口处的生长动态
G.candidum XG1在苹果伤口的存活及繁殖能力测定如下:30 μL的G.candidum XG1菌悬液(1×108 cells/mL)加入到处理好的苹果伤口中对照组加入等量的无菌生理盐水。其余方法同1.3.4.1节。G.candidum XG1的数量表示为lg cells/wound。
1.3.5 不同浓度的G.candidum XG1在苹果上对病原菌的抑制效果
果实打孔后,向伤口处注入30 μL拮抗菌菌悬液,2 h后注入30 μL病原菌孢子悬液(拮抗菌悬液浓度分别为106、107、108、109cells/mL),以无菌水作对照,用密封袋逐个密封,置于25 ℃的培养箱中。8 d后测定由果实的腐烂直径。每个处理3个平行,实验重复2次。
1.3.6 G.candidum XG1不同接种时间和接种次序在苹果上对病原菌的抑制效果
果实打孔后,分别在接种30 μL病原菌孢子悬浮液之前24、12、2、0 h之后2、12、24 h接种同等体积的1×108 cells/mL拮抗菌菌悬液,用密封袋逐个密封,置于25 ℃的培养箱中。8 d后测定由果实的腐烂直径。每个处理3个平行,实验重复2次。
1.3.7 G.candidum XG1各种处理液在体内外对病原菌的抑制效果
拮抗菌各种处理液的制备:参考王智荣等[19]的方法。a)无菌水:蒸馏水在121 ℃下高压灭菌20 min;b)原液:移取拮抗菌培养液,并用滤液调节浓度1×108 cells/mL;c)菌悬液:将培养液移入无菌离心管中,6 000 r/min,离心5 min,倒去上清液,收集菌体,用无菌水洗涤菌体;d)热杀死液:原液在121 ℃下高压灭菌20 min;2次,最后加入无菌水,调节至所需浓度,待用;e)滤液:将培养液移入无菌离心管中,6 000 r/min,离心5 min,移取上清液,用无菌注射器经0.22 μm水系滤膜过滤即得。
G.candidum XG1各种处理液在体外对病原菌的防治:采用中心混合培养法,处理方法同1.3.2.1节。
G.candidum XG1各种处理液在苹果上对病原菌的防治:处理方法同1.3.2.2节。
1.3.8 G.candidum XG1对苹果自然腐败及贮藏品质的影响
将未经清洗和消毒的苹果每12个装入6个塑料筐,随机分成2组。一组均匀喷洒浓度为1×108 cells/mL的G.candidum XG1悬浮液,另一组苹果喷洒生理盐水作为对照。将上述样品在25 ℃下贮存40 d。参照ZHENG等[8]的方法稍作修改,统计苹果的自然病害发生率,分析贮藏后的失重率、硬度、可溶性固形物、可滴定酸度、维生素C含量和褐变度。
1.4 数据处理
采用Origin 2023软件进行绘图,IBM SPSS Statistics 23软件对数据进行方差分析,利用 Duncan’s 多重比较进行差异显著性分析,P<0.05 表示差异显著。
2 结果与分析
2.1 拮抗菌的体内外筛选结果
如表1所示,在体外抑菌比较试验中,供试菌株G.candidum XG1对棒曲霉和扩展青霉的抑菌率最高,分别为78.07%和83.71%,抑菌率显著(P<0.05)高于其他酵母菌和乳酸菌。在活体(苹果)试验上,G.candidum XG1同样表现出最好的抑菌效果,对棒曲霉和扩展青霉的抑菌率分别为54.66%和63.56%。虽然通过霉菌生长直径和苹果腐败面积计算抑菌率,会导致抑菌率值不高,但是由图1可知,G.candidum XG1在PDA培养基和苹果上对棒曲霉和扩展青霉控制效果较佳。体外具有抑菌效果的菌株如P.membranifaciens、P.acidilactici等在活体上反而出现促进苹果腐败的效果,可能是由于这些菌株本身能够导致苹果腐败或能够诱导病原菌生长进而促进苹果腐败。白地霉(G.candidum)是一种产香酵母,目前多应用于白酒及果酒发酵增香[20],在生物防治中应用较少。ALIMADADI等[21]发现白地霉通过产生挥发性物质途径防治鲜食葡萄青霉病。综合体内、外试验结果,因G.candidum XG1的生防效果最佳,故选择其作为后续的拮抗菌进行研究。
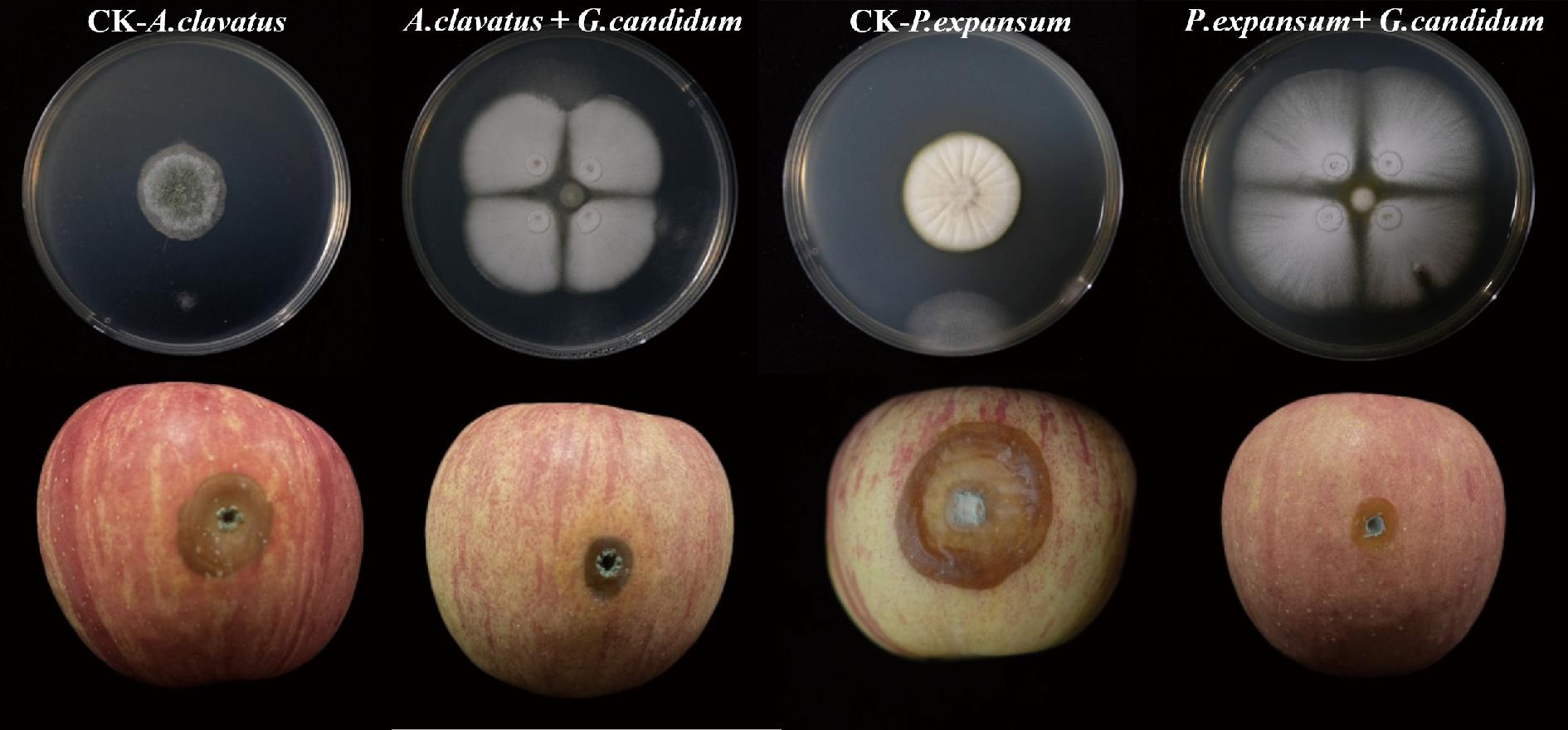
图1 G.candidum XG1在PDA培养基和苹果上拮抗霉菌的效果图
Fig.1 Effect of G.candidum XG1 antagonizing mold on PDA medium and apple
表1 拮抗菌的体内外筛选结果 单位:%
Table 1 Results of in vitro and in vivo screening of antagonists

供试菌株体外抑菌率活体抑菌率A.clavatusP.expansumA.clavatusP.expansumS.cerevisiae18.46±3.97e41.59±4.07c16.38±1.41ef6.99±0.78eW.anomalus7.44±2.21g32.09±2.43de11.35±0.94g9.52±0.85eT.delbruecki18.46±1.43e22.33±4.36gh19.42±0.99de18.32±2.69cH.uvarum17.27±1.11e22.85±3.29gh26.22±0.77c23.05±4.04bP.kudriavzevii17.58±2.30e24.00±1.30fgh9.45±1.89g13.92±2.16dP.membranifaciens23.57±5.81d26.87±2.67fg31.74±4.68b-3.28±0.1fG.candidum78.07±1.18a83.71±3.61a54.66±1.33a63.56±0.72aP.acidilactici77.77±2.43a63.74±1.76b-10.18±1.62i17.35±1.32cL.plantarum49.54±0.43b34.18±1.92d22.04±3.22d-13.55±0.89hL.sakei11.62±0.60f22.82±2.78gh16.11±1.58f17.06±1.77cW.hellenica15.41±0.72ef20.24±0.91h18.69±1.81ef-10.53±1.86gL.paracasei28.40±1.63c28.48±1.04ef-4.76±0.72h-8.58±1.23g
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 G.candidum XG1对病原菌产生PAT的影响
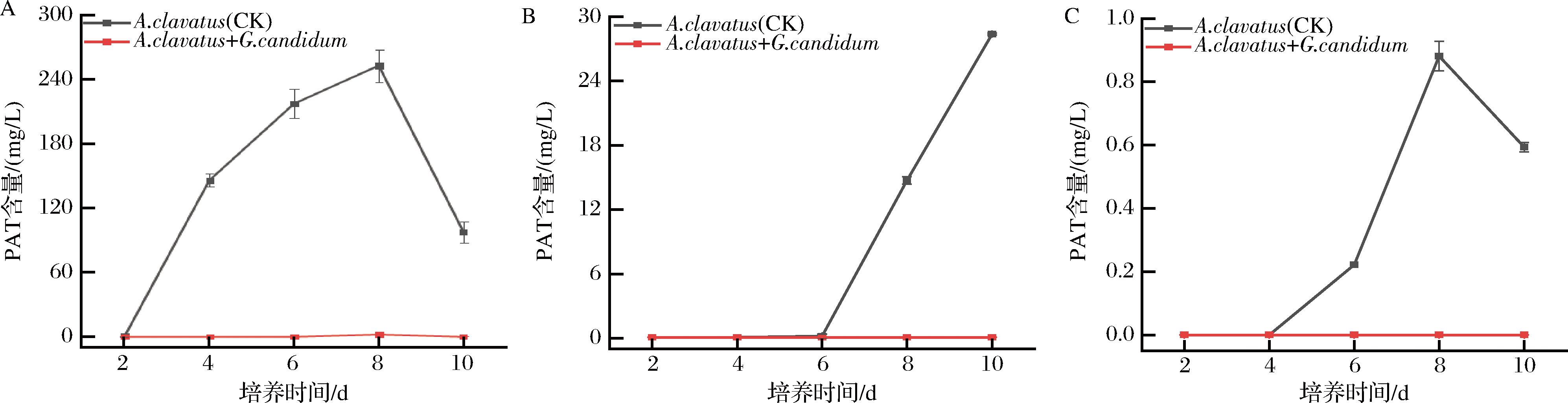
ZHU等[22]研究发现,Rhodosporidium paludigenum能够显著降低苹果青霉病的发病率,但反而使苹果上PAT含量增加。这说明在R.paludigenum的刺激下P.expansum产生PAT的途径可能被激活。因此,不能仅用苹果病害症状的大小来评估拮抗菌对病原菌产毒的影响。故将拮抗菌G.candidum XG1与病原菌在不同基质中共培养检测其产毒能力,结果如图2和图3所示。在仅接种病原菌的对照组中,病原菌均能产生毒素,实验组中因为有了G.candidum XG1介入,3种基质(PDB、苹果汁、苹果)中检测出的PAT含量远远低于对照组或无法检测出PAT,产毒抑制率最高达到99%以上。说明G.candidum XG1在不同基质中能够强烈抑制病原菌产生PAT。原因可以归咎于G.candidum XG1能够抑制棒曲霉生长且不会刺激病原菌产毒,这与ZHENG等[8]的研究发现相似。
A-G.candidum在PDB中对A.clavatus产毒的影响;B-G.candidum在苹果汁中对A.clavatus产毒的影响;C-G.candidum在苹果上对A.clavatus产毒的影响
图2 G.candidum XG1在3种不同基质上对A.clavatus产生PAT的影响
Fig.2 Effect of G.candidum XG1 on the production of PAT by A.clavatus on three different substrates
注:CK表示仅接种棒曲霉的对照组,A.clavatus+G.candidum表示棒曲霉与白地霉共培养。
A-G.candidum在PDB中对P.expansum产毒的影响;B-G.candidum在苹果汁中对P.expansum产毒的影响;C-G.candidum在苹果上对P.expansum产毒的影响
图3 G.candidum XG1在3种不同基质上对P.expansum产生PAT的影响
Fig.3 Effect of G.candidum XG1 on the production of PAT by P.expansum on three different substrates
注:CK表示仅接种扩展青霉的对照组,P.expansums+G.candidum表示棒曲霉与白地霉共培养。
2.3 G.candidum XG1在苹果伤口及表面的定殖情况
由于环境中各种因素会干扰拮抗菌的生防效果,因此理想的拮抗菌首先需要具有较强的生存性和抗逆性。如图4-A和图4-B所示,在不同贮藏温度(4、25 ℃)下,G.candidum XG1在苹果表面的数目都呈先下降再上升再下降趋势。前期苹果表面的G.candidum XG1数量下降,可能是因为G.candidum XG1没有适应苹果表皮的环境,随后在中期微生物开始进行生长繁殖,后期由于营养物质消耗和有害代谢产物积累,从而导致G.candidum XG1数量下降。G.candidum XG1在苹果上的生长规律,与大多数微生物在培养基中生长情况相似,即微生物要经历稳定期、生长期和衰亡期。因此,研究揭示了G.candidum XG1可以快速适应苹果表面环境并在苹果表面定殖,为G.candidum XG1作为苹果上的理想生防菌奠定了基础。

A-4 ℃时G.candidum在苹果表面的定殖情况;B-25 ℃时G.candidum在苹果表面的定殖情况;C-4 ℃时G.candidum在苹果伤口处的定殖情况;D-25 ℃时G.candidum在苹果伤口处的定殖情况
图4 G.candidum XG1在苹果伤口及表面的定殖情况
Fig.4 Colonization of the wound and surface of the apple by G.Candidum XG1
2.4 不同浓度的G.candidum XG1对病原菌孢子在PDB中萌发情况的影响
如图5-A所示,高浓度的G.candidum XG1可以显著降低病原菌的孢子萌发率。在PDB中培养10 h后,随着G.candidum XG1浓度的提高,棒曲霉和扩展青霉的孢子萌发率逐渐降低。当G.candidum XG1的浓度为1×109 cells/mL时孢子萌发率都为0,此时仅接种病原菌的CK组萌发率分别为98.00%(棒曲霉)和60.46%(扩展青霉)。同时,G.candidum XG1可以显著降低病原菌的芽管长度(图5-B),在PDB中培养10 h后,霉菌的芽管长度与G.candidum XG1的浓度成反比。当G.candidum XG1浓度为1×109 cellss/mL时,病原菌的芽管长度为0,此时CK组的芽管长度为30.83 μm(棒曲霉)和33.75 μm(扩展青霉)。由此可知,G.candidum XG1能够显著抑制病原菌的孢子萌发,并且随着G.candidum XG1浓度的增加,抑制效果也提高。ZHAO等[5]的研究结果也表明病原菌的萌发率与芽管长度和拮抗菌浓度呈反比。
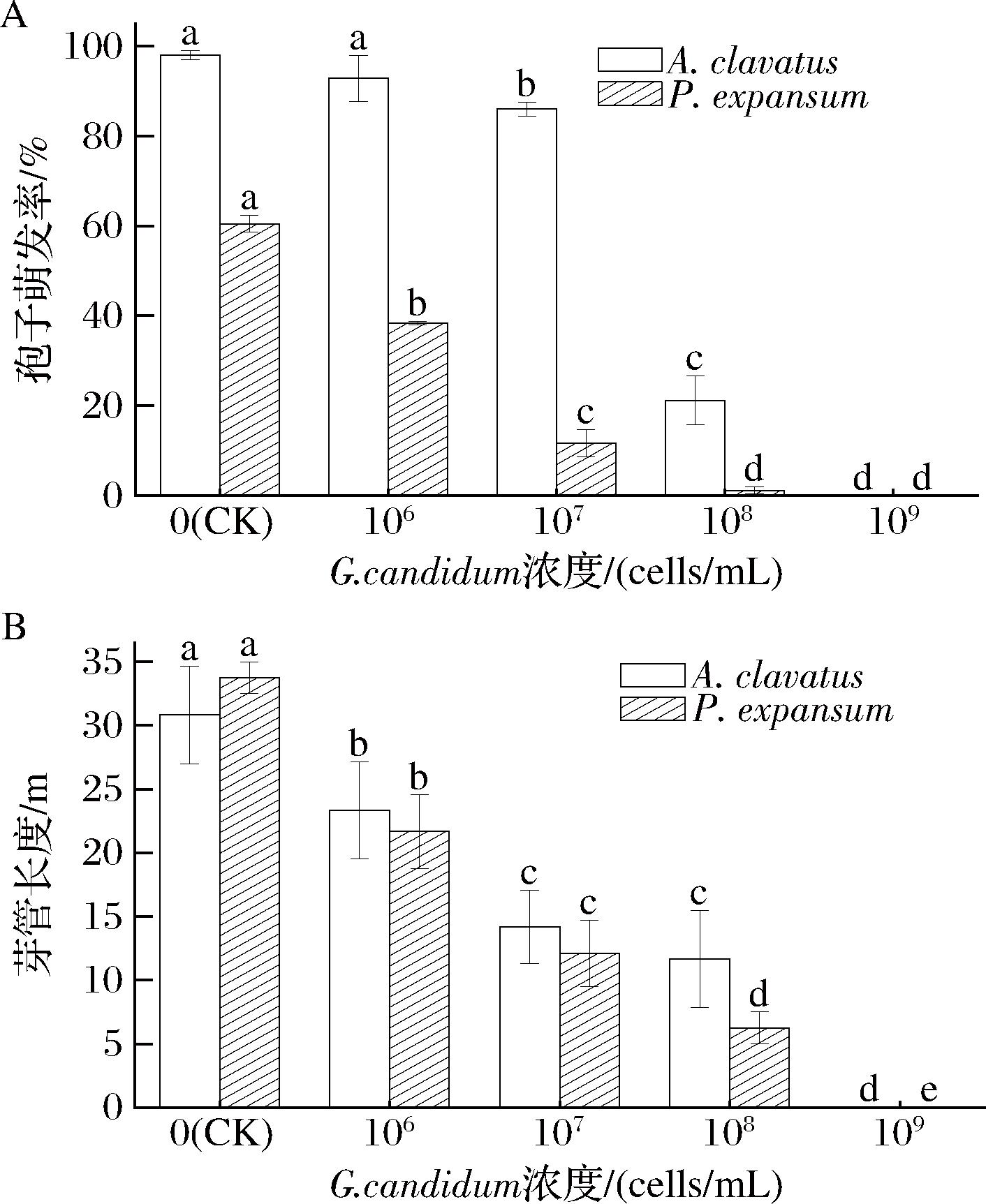
A-病原菌孢子萌发率;B-病原菌芽管长度
图5 不同浓度的G.candidum XG1对病原菌孢子在PDB中萌发情况的影响
Fig.5 Effects of different concentrations of G.candidum XG1 on the germination of pathogenic spores in PDB
注:不同字母表示差异显著(P<0.05)(下同)。
2.5 不同浓度的G.candidum XG1在苹果上对病原菌的抑制效果
如图6所示,G.candidum XG1菌悬液能够显著抑制苹果上的A.clavatus和P.expansum,有效防止苹果的腐败。苹果腐败直径随着G.candidum XG1浓度的提高,逐渐降低。当G.candidum XG1的浓度为1×109 cells/mL时苹果腐败直径分别为5.57 mm(棒曲霉)和10.77 mm(扩展青霉),此时仅接种病原菌的CK组分别为18.60 mm(棒曲霉)和31.23 mm(扩展青霉)。结果表明,G.candidum XG1悬液浓度越高,苹果腐败直径越小。
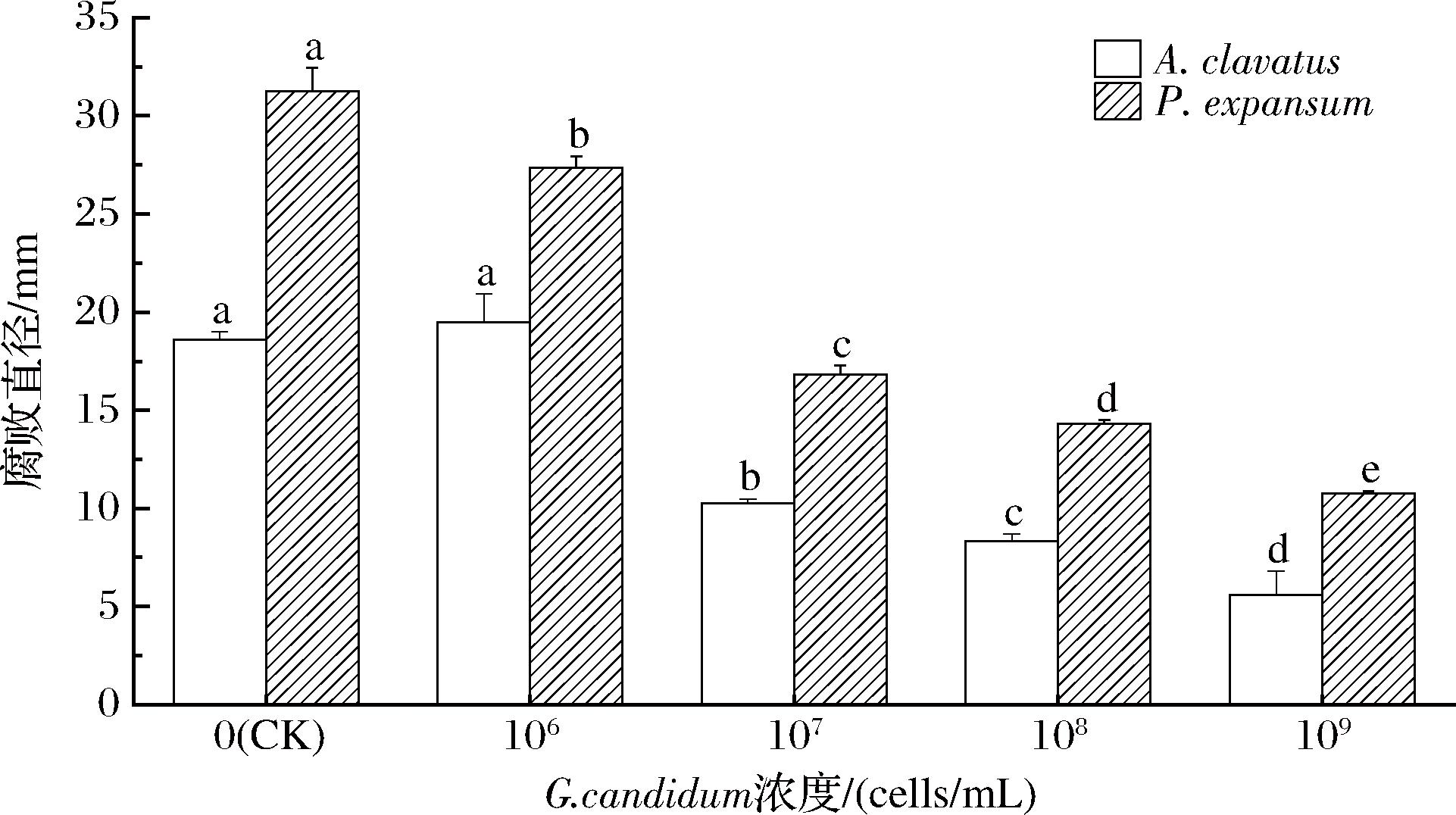
图6 不同浓度的G.candidum XG1在苹果上对病
原菌的抑制效果
Fig.6 Inhibitory effect of different concentrations of G.candidum XG1 on pathogenic bacteria in apple
2.6 G.candidum XG1不同接种时间和接种次序在苹果上对病原菌的抑制效果
如图7所示,G.candidumXG1菌悬液和病原菌孢子悬浮液的接种次序和接种时间对拮抗菌的防治效果具有显著影响。拮抗菌的接种时间越早或接种次序优先于病原菌,将有利于提高抑制效果。原因是拮抗菌可以提前在果实伤口或者表面形成保护,病原菌无法接触入侵果实从而降低病害发生,DE CAPDEVILLE等[23]的研究发型在接种扩展青霉前48 h接种酵母能够诱导苹果系统抗性机制,进而降低苹果青霉病发病。
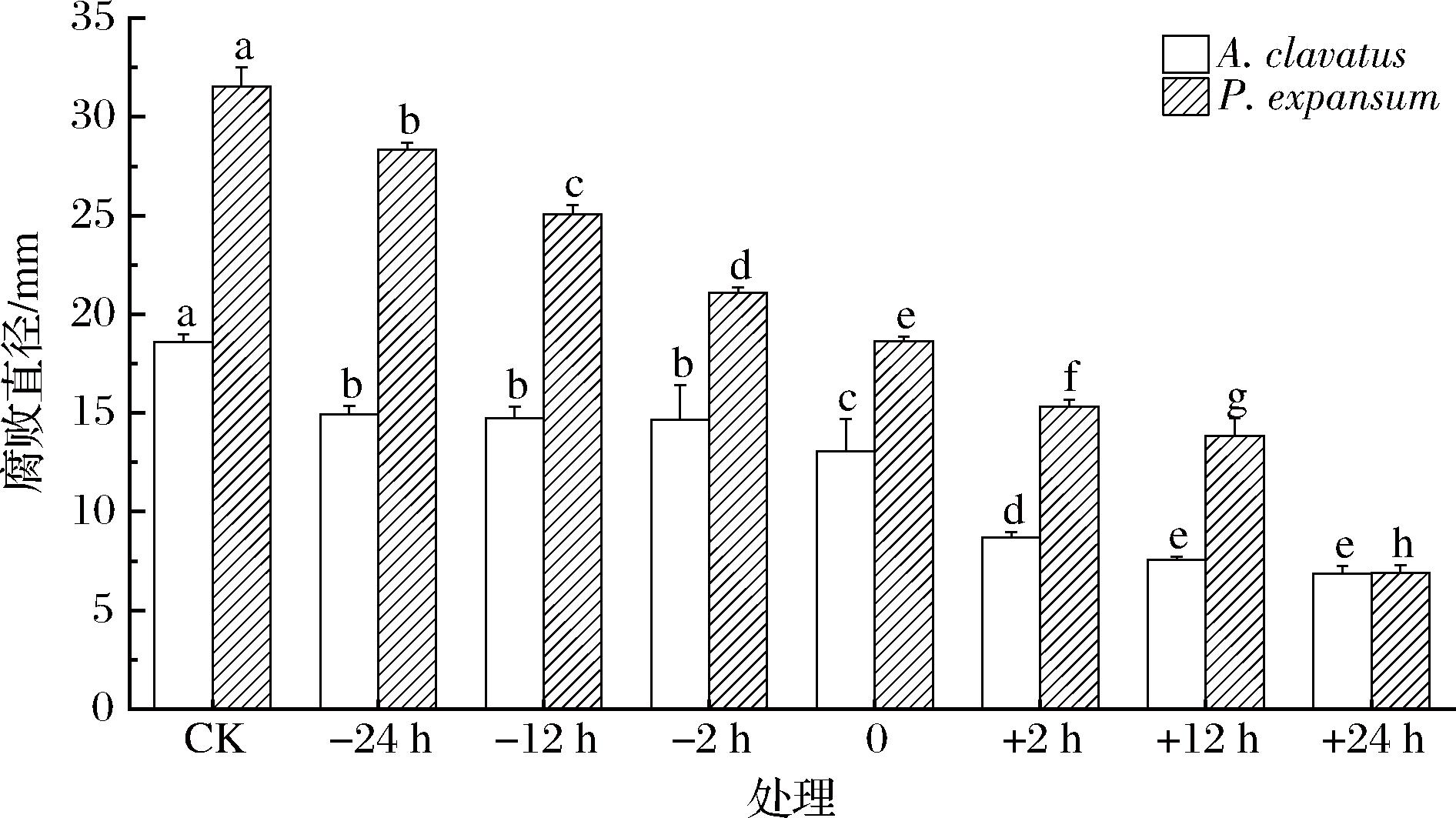
图7 G.candidum XG1不同接种时间和接种次序
在苹果上对病原菌的抑制效果
Fig.7 Inhibitory effect of G.Candidum XG1 on pathogenic bacteria in apple with different inoculation time and inoculation order
注:-表示病原菌孢子悬浮液先于拮抗菌菌悬液接种;+表示拮抗菌菌悬液先于病原菌孢子悬浮液接种;CK表示仅接种病原菌的对照组。
2.7 G.candidum XG1不同处理的菌液对病原菌的抑制效果
为初步了解G.candidum XG1对病原菌的抑菌方式,采用不同处理的菌液对病原菌进行抑菌试验,结果如图8所示。由图8-A可知,PDA培养基上G.candidum XG1原液和菌悬液都对棒曲霉和扩展青霉有显著的抑制作用,病原菌生长直径均小于10 mm,热杀死液和滤液的抑菌效果相近,抑菌率均低于10%,抑菌作用远远低于原液和菌悬液。从图8-B可以看出,G.candidum XG1原液和菌悬液(1×108 cells/mL)对苹果上病原菌的防治效果最佳,腐败直径均小于10 mm。而G.candidum XG1热杀死液和滤液处理的苹果腐烂直径与对照组无显著差异。结果说明G.candidum XG1对病原菌的主要抑菌方式不是通过产生抑菌物质,而是营养与空间竞争。这一结果与其他文献报道的拮抗酵母的抑菌方式一致。
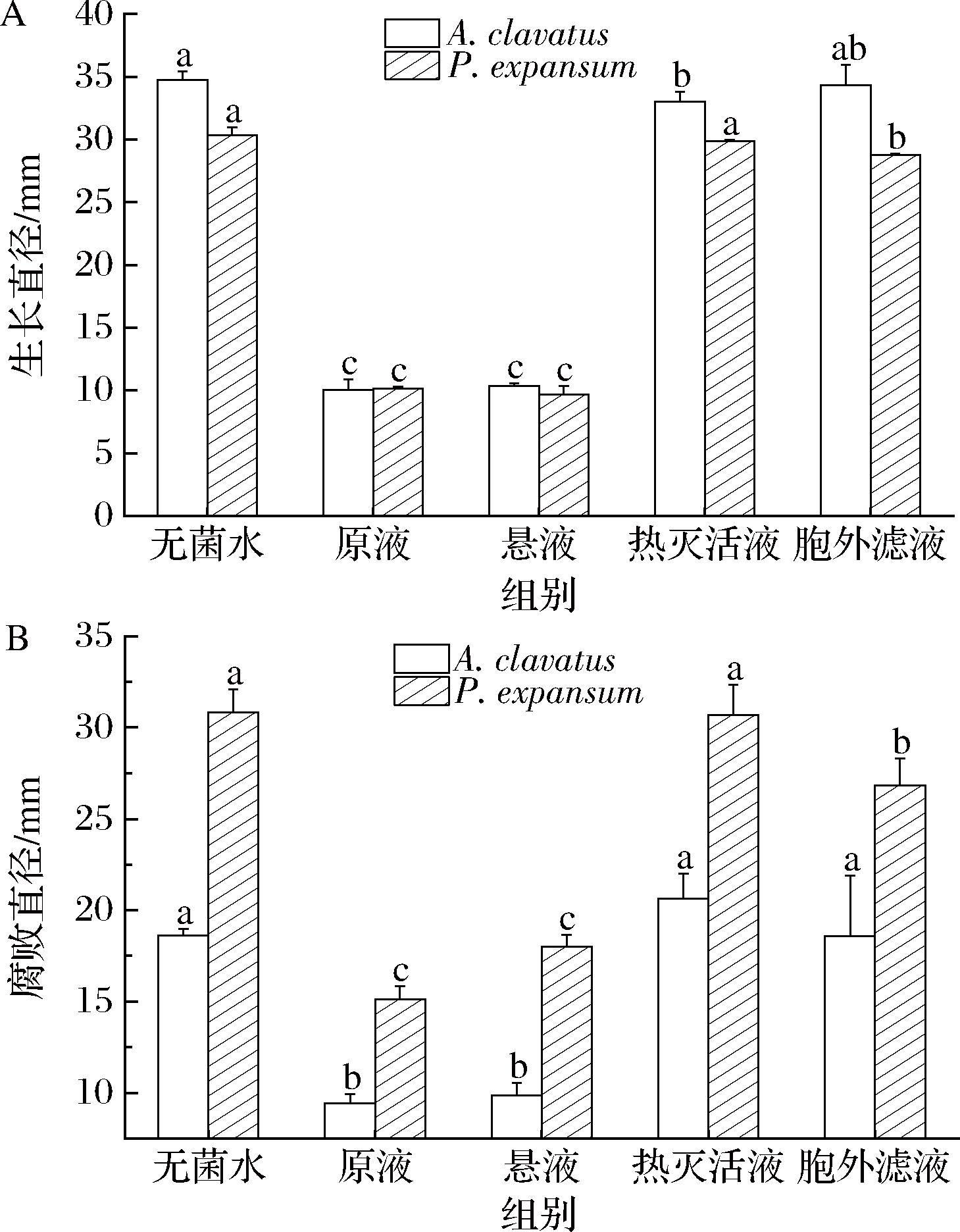
A-病原菌在PDA平板上的生长情况;B-病原菌在苹果上的生长情况
图8 G.candidum XG1不同处理的菌液对病原菌的抑制效果
Fig.8 Inhibitory effect of different bacterial liquids of G.Candidum XG1 on pathogenic bacteria
2.8 G.candidum XG1对苹果采后自然腐败及贮藏品质的影响
前面的研究证实了G.candidum XG1对苹果上PAT产生菌防治的可行性,但该拮抗菌在自然条件下对苹果病变及品质的影响未知。G.candidum XG1对苹果采后自然腐烂及贮藏品质的影响如表2所示,在25 ℃培养40 d后,G.candidum XG1处理组苹果的腐败率仅为13.889%,远低于未处理拮抗菌组的36.111%。喷洒了G.candidum XG1的实验组苹果失重率、苹果硬度、可滴定酸和维生素C含量与CK组存在显著性差异且均高于CK组,可溶性固形物含量和褐变度与CK组无显著性差异。由图9可知,用G.candidum XG1处理的苹果品质优于未喷洒的对照组。表明G.candidum XG1可以显著控制苹果采后的自然腐败,并且对苹果采后自然贮藏品质无不良影响。

A-对照组(仅喷洒无菌水);B-实验组(喷洒G.candidum菌悬液)
图9 G.candidum XG1对苹果采后自然腐败及贮藏品质的影响效果
Fig.9 Effect of G.candidum XG1 on postharvest natural spoilage and storage quality of apple
注:图内标签文字CK1~CK12表示对照组内苹果编号,T1~T12表示实验组内苹果编号。
表2 G.candidum XG1对苹果采后自然腐烂及贮藏品质的影响
Table 2 Effect of G.candidum XG1 on natural decay and storage quality of apples after harvest
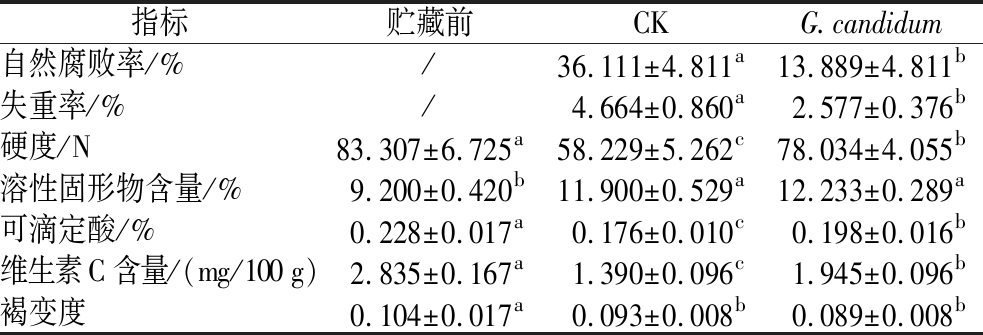
指标贮藏前CKG.candidum自然腐败率/%/36.111±4.811a13.889±4.811b失重率/%/4.664±0.860a2.577±0.376b硬度/N83.307±6.725a58.229±5.262c78.034±4.055b溶性固形物含量/%9.200±0.420b11.900±0.529a12.233±0.289a可滴定酸/%0.228±0.017a0.176±0.010c0.198±0.016b维生素C含量/(mg/100 g)2.835±0.167a1.390±0.096c1.945±0.096b褐变度0.104±0.017a0.093±0.008b0.089±0.008b
3 结论与讨论
近年来酵母菌作为生物防治剂防治采后果实病害成为研究热点,这一举措不仅可以减少化学杀菌剂的使用,还是无害环境的病害管理策略。本文筛选出的酵母菌G.candidum XG1,首次作为拮抗菌防控苹果上的棒曲霉和扩展青霉,可以在苹果的表面及伤口迅速生长,抑制率达54.66%和63.56%,能够强烈抑制病原菌生物合成PAT,对苹果采后自然贮藏品质无不良影响。G.candidum XG1的浓度越高,接种时间越早,抑菌效果越好。为了更好地将G.candidum XG1运用在实际的生产中,后续还应当阐明G.candidum XG1的抑菌机制、控制毒素合成机制,为采后苹果的保鲜以及加工产品的安全性提供理论支持。
[1] 张强强. 中国苹果生产布局演变与优势评价研究[D].杨凌:西北农林科技大学, 2021.
ZHANG Q Q.The evolution and advantage evaluation of apple production layout in China[D].Yangling:Northwest A&F University, 2021.
[2] 2021年度中国苹果产业发展报告(总篇)精简版[J].中国果菜, 2023, 43(1):1-8.
China apple industry development report in 2021(general), condensed version[J].China Fruit and Vegetable, 2023, 43(1):1-8.
[3] MOAKE M M, PADILLA-ZAKOUR O I, WOROBO R W.Comprehensive review of patulin control methods in foods[J].Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1):8-21.
[4] VIDAL A, OUHIBI S, GHALI R, et al.The mycotoxin patulin:An updated short review on occurrence, toxicity and analytical challenges[J].Food and Chemical Toxicology, 2019, 129:249-256.
[5] ZHAO L N, WANG Y J, DHANASEKARAN S, et al.Efficacy of Wickerhamomyces anomalus yeast in the biocontrol of blue mold decay in apples and investigation of the mechanisms involved[J].BioControl, 2021, 66(4):547-558.
[6] LI W L, ZHOU T, WU T, et al.Saccharomyces cerevisiae YE-7 reduces the risk of apple blue mold disease by inhibiting the fungal incidence and patulin biosynthesis[J].Journal of Food Processing and Preservation, 2018, 42(1):e13360.
[7] ALVAREZ A, GELEZOGLO R, GARMENDIA G, et al.Role of Antarctic yeast in biocontrol of Penicillium expansum and patulin reduction of apples[J].Environmental Sustainability, 2019, 2(3):277-283.
[8] ZHENG X F, ZHENG L L, XIA F P, et al.Biological control of blue mold rot in apple by Kluyveromyces marxianus XZ1 and the possible mechanisms of action[J].Postharvest Biology and Technology, 2023, 196:112179.
[9] ZHAO L N, SUN Y W, YANG D B, et al.Effects of Sporidiobolus pararoseus Y16 on postharvest blue mold decay and the defense response of apples[J].Journal of Food Quality, 2018(1), 2018:6731762.
[10] 孙艺文, 赵利娜, 郑香峰, 等.拟粉红锁掷孢酵母降解展青霉素的机制[J].食品与生物技术学报, 2020, 39(2):16-23.
SUN Y W, ZHAO L N, ZHENG X F, et al.The possible mechanisms involved in degradation of patulin by Sporidiobolus pararoseus[J].Chinese Journal of Food and Biotechnology, 2020, 39(2):16-23.
[11] CSERNUS O, BECZNER J, SEBÖK F, et al.Characterisation of moulds from apple fruit in hungary[J].Acta Alimentaria, 2015, 44(1):150-156.
[12] 张亚健. 贮藏期苹果表面微生物的变化趋势及棒曲霉拮抗菌的筛选[D].保定:河北农业大学, 2009.
ZHANG Y J.The variation trend of microorganism of apple during the storage period and screening of the antagonistic bacteria of Aspergillus Clavalus[D].Baoding:Hebei Agricultural University, 2009.
[13] 贺玉梅, 贾珍珍, 董葵, 等.展青霉素产生菌产毒性能研究[J].中国卫生检验杂志, 2001(3):302-303.
HE Y M, JIA Z Z, DONG K, et al.Chinese Journal of Health Laboratory Technology, 2001(3):302-303.
[14] JIANG M Y, WANG Z R, CHEN K W, et al.Inhibition of postharvest gray mould decay and induction of disease resistance by pseudomonas fluorescens in grapes[J].Acta Alimentaria, 2019, 48(3):288-296.
[15] PEREYRA M M, D AZ M A, SOLIZ-SANTANDER F F, et al.Screening methods for isolation of biocontrol epiphytic yeasts against Penicillium digitatum in lemons[J].Journal of Fungi, 2021, 7(3):166.
AZ M A, SOLIZ-SANTANDER F F, et al.Screening methods for isolation of biocontrol epiphytic yeasts against Penicillium digitatum in lemons[J].Journal of Fungi, 2021, 7(3):166.
[16] CHEN H, JU H M, WANG Y W, et al.Antifungal activity and mode of action of lactic acid bacteria isolated from kefir against Penicillium expansum[J].Food Control, 2021, 130:108274.
[17] ZONG Y Y, LI B Q, TIAN S P.Effects of carbon, nitrogen and ambient pH on patulin production and related gene expression in Penicillium expansum[J].International Journal of Food Microbiology, 2015, 206:102-108.
[18] SETTIER-RAM REZ L, L
REZ L, L PEZ-CARBALLO G, HERN
PEZ-CARBALLO G, HERN NDEZ-MU
NDEZ-MU OZ P, et al.New isolated Metschnikowia pulcherrima strains from apples for postharvest biocontrol of Penicillium expansum and patulin accumulation[J].Toxins, 2021, 13(6):397.
OZ P, et al.New isolated Metschnikowia pulcherrima strains from apples for postharvest biocontrol of Penicillium expansum and patulin accumulation[J].Toxins, 2021, 13(6):397.
[19] 王智荣, 梅小飞, 杜木英, 等.荧光假单胞菌ZX对采后锦橙绿霉病的防治及其抑菌机制[J].微生物学报, 2019, 59(5):950-964.
WANG Z R, MEI X F, DU M Y, et al.Biocontrol of green mold decay in Jincheng citrus fruits by Pseudomonas fluorescens ZX[J].Acta Microbiologica Sinica, 2019, 59(5):950-964.
[20] 张阳阳, 赵筱岑, 王荣荣, 等.白地霉S13固态发酵白酒条件优化[J].中国酿造, 2023, 42(5):196-200.
ZHANG Y Y, ZHAO X C, WANG R R, et al.Optimization of solid-state fermentation conditions of Baijiu by Geotrichum candidum S13[J].China Brewing, 2023, 42(5):196-200.
[21] ALIMADADI N, POURVALI Z, NASR S, et al.Screening of antagonistic yeast strains for postharvest control of Penicillium expansum causing blue mold decay in table grape[J].Fungal Biology, 2023, 127(3):901-908.
[22] ZHU R Y, FEUSSNER K, WU T, et al.Detoxification of mycotoxin patulin by the yeast Rhodosporidium paludigenum[J].Food Chemistry, 2015, 179:1-5.
[23] DE CAPDEVILLE G, WILSON C L, BEER S V, et al.Alternative disease control agents induce resistance to blue mold in harvested ‘red delicious’ apple fruit[J].Phytopathology, 2002, 92(8):900-908.