量子点(quantum dots, QDs),也称为半导体纳米粒子或半导体纳米晶体,是一种零维纳米材料,尺寸介于2~20 nm。量子点因其优异的光学特性,广泛应用于生物成像[1]、环境材料[2]、药物传递[3]、能源[4]、光学[5]等领域。然而,现有研究表明,量子点可能对生物体产生毒性作用,如细胞毒性、免疫毒性、肝毒性和遗传毒性等[6],这些影响会导致细胞死亡、DNA损伤、免疫系统异常等不良后果[7]。大量研究发现,量子点分布在生物体的心、肝、脾、肺、肾等多个器官中,并可在这些器官中长期积累[8-10]。随着量子点的广泛应用,人们开始担心量子点对环境和人类的潜在危害。此外,研究者们发现使用SiO2包封可以显著改善量子点在细胞内的光学性质和生物相容性,大大降低量子点的生物毒性[11],因此引起了广泛的关注。
镉(Cd)是一种有毒有害的重金属,对人类健康构成重大威胁。近年来随着工业的发展,镉污染事件相继报道,中国文瑞塘河的镉含量为高达16 μg/L[12],广州南沙水体测出镉含量为25 μg/L[13],最新报告指出地表水、井水的镉含量超过标准的2~5倍[14]。因此,对监测食品及环境水质的镉含量尤为重要。目前大多数传统的镉检测方法如原子吸收光谱法、原子荧光光谱法等都存在成本高、耗时长、需要复杂的设备及高要求的操作步骤等问题,在实际应用中受到限制[15]。在前期的工作中,本团队开发了一种新型的CdTe/CdS/SiO2量子点,并与APDC(吡咯烷二硫代氨基甲酸铵)构建了“OFF-ON” CdTe/CdS/SiO2量子点模型,利用此模型进行了镉的快速检测,目前已实现在海水、淡水和牛奶中的镉检测,其操作方法简便、快捷且不依赖复杂仪器,对镉具有很高的选择性和灵敏度[16]。在此研究基础上,希望在未来能实现CdTe/CdS/SiO2量子点的生物体内成像及检测。
然而,目前关于CdTe/CdS/SiO2量子点的毒性尚未明确,为了拓展量子点在更多领域上的应用,对其进行安全性评价是至关重要的。本文通过探究CdTe/CdS/SiO2量子点在小鼠体内的亚急性毒性和分布特征,将低剂量(0.4 mg/kg)和高剂量(4 mg/kg)的量子点通过腹腔注射到小鼠体内,分别在暴露后的1、7、14、28、42 d处死小鼠。通过比较实验组与对照组(9 g/L生理盐水)的小鼠体重、脏器系数、血液学、氧化指标、组织病理学、生物分布等方面在42 d内的变化,以此判断量子点在小鼠体内的毒性作用,为CdTe/CdS/SiO2量子点在生物上的应用提供有利的数据支撑。
1 材料与方法
1.1 材料与试剂
BALB/c雄性小鼠(约23 g/只),广州市言诚生物科技有限公司,生产许可证号:SCXK(京)2019-0010。氯化镉(CdCl2),上海易恩化学技术有限公司;65%硝酸,德国默克(Merck)公司;超氧化物歧化酶(superoxide dismutase,SOD)活力检测试剂盒、过氧化氢酶(catalase,CAT)活力检测试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
Varioskan全自动酶标仪、iCAP TQ ICP-MS电感耦合等离子体质谱仪、RC6 Plus高速冷冻离心机,塞默飞世尔科技(中国)有限公司;PE-6800全自动血细胞分析仪,深圳市普康电子有限公司;TANK PLUS微波消解仪,上海新仪微波化学科技有限公司;SN-HWS电热恒温水浴锅,上海力辰仪器科技有限公司;JXFSTPRP全自动样品快速研磨仪,上海净信实业发展有限公司;BSA224S型电子天平,北京赛多利斯公司;DMI4000B倒置荧光显微镜,德国徕卡(Leica)生物系统有限公司。
1.3 实验方法
1.3.1 动物分组及处理
动物实验在前人研究的基础上加以修改[17-19],分组设计见图1:将9 g/L 90只6周龄的BALB/c雄性小鼠随机分为3组:对照组(9 g/L生理盐水)、低剂量组(0.4 mg/kg)和高剂量组(4 mg/kg),给药方式为腹腔注射,注射量为每只100 μL,进行42 d的亚急性毒性实验。小鼠饲喂由中国江苏协和生物科技有限公司提供的标准实验饲料(中国国家标准化标准,GB 14924.1),自由提供饮用水,并记录体重、行为、精神状态、食物摄取量和粪便情况。在注射后的第1、7、14、28和42天处死小鼠,每组6只,收集心、肝、脾、肺、肾,记录脏器质量。本实验设计已获广东海洋大学伦理委员会批准(批准号:GDOU-LAE-2021-020)。
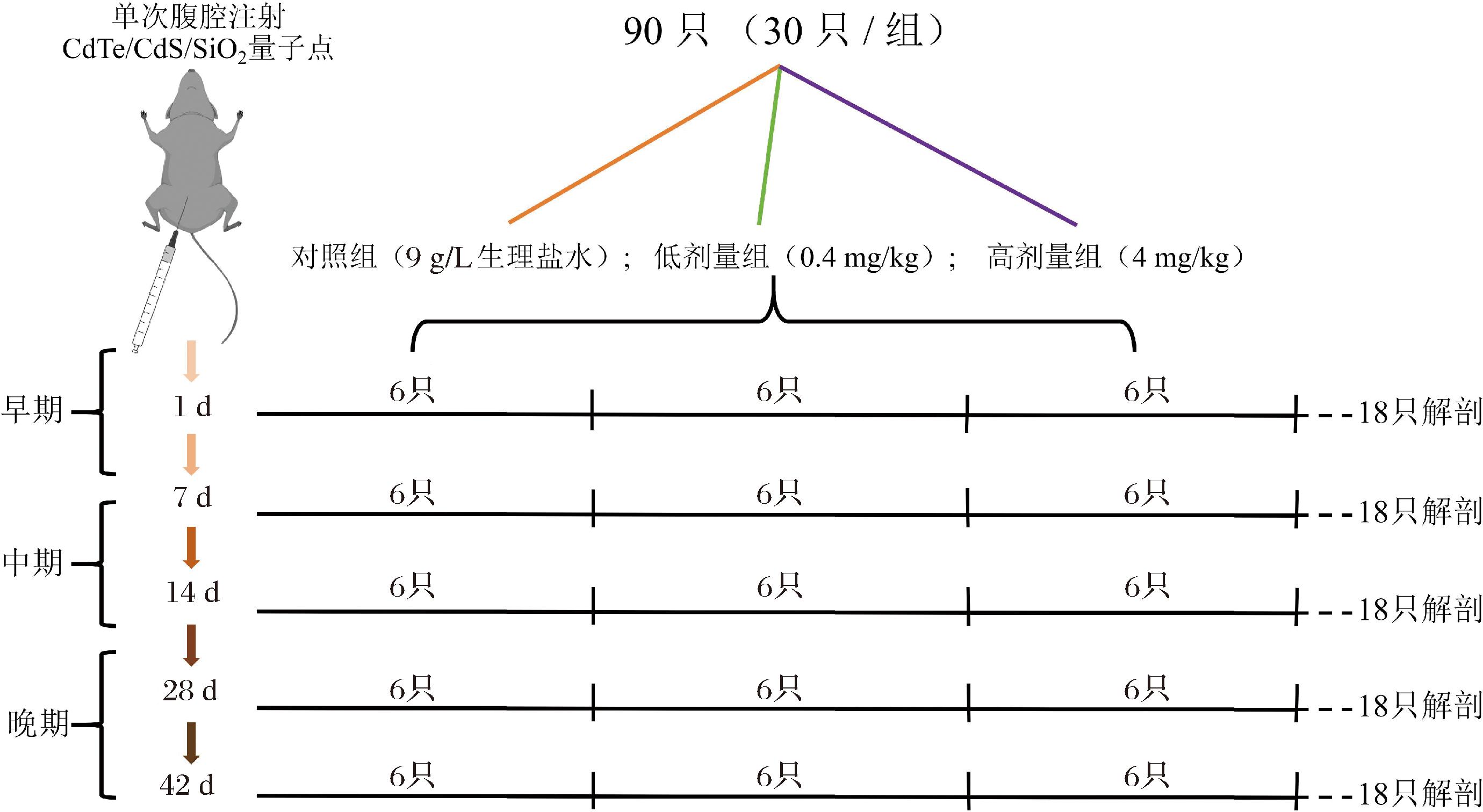
图1 动物分组设计
Fig.1 Animal grouping design
1.3.2 血细胞计数
在注射CdTe/CdS/SiO2量子点后的第1、7、14、28和42天,眼球取血,收集于EDTA抗凝管中,采用全自动血细胞分析仪进行血细胞计数。测量的指标包括:白细胞、淋巴细胞比率、中间细胞比率、粒细胞比率、淋巴细胞、中间细胞、粒细胞、红细胞、红细胞压积、红细胞平均体积、红细胞分布宽度的变异系数、红细胞分布宽度的标准偏差、血红蛋白、平均血红蛋白含量、平均血红蛋白浓度、血小板、血小板积压、平均血小板体积、血小板分布宽度、血小板大细胞比率。
1.3.3 CdTe/CdS/SiO2量子点在小鼠体内的荧光成像
在CdTe/CdS/SiO2量子点处理24 h后,对小鼠进行解剖,取其心、肝、脾、肺、肾,用9 g/L生理盐水冲洗血迹,吸干水分后整齐摆放在干净的黑板上,在黑暗环境中打开紫外灯(λex=365 nm),并用相机记录此状态下的荧光发光。使用自动研磨仪研磨各脏器,在荧光显微镜下观察其发光情况,并使用Photoshop 2021软件计算心、肝、脾、肺和肾的细胞荧光比率,以此判断CdTe/CdS/SiO2量子点在小鼠主要脏器中的成像及分布。
1.3.4 电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)分析
采集小鼠的组织样本(心、肝、脾、肺、肾),并保存在-80 ℃。在ICP-MS分析之前,样品在微波消解仪中用8 mL 65%(体积分数)的硝酸进行消化。消化条件为:第一阶段:150 ℃,5 min;第二阶段:180 ℃,25 min。消化完毕后,用去离子水稀释至50 mL,以降低硝酸浓度。随后,使用ICP-MS系统检测各器官中的Cd2+浓度,根据Cd2+浓度判断CdTe/CdS/SiO2量子点在小鼠主要器官中的积累情况。
1.3.5 氧化指标测定
根据SOD活力检测试剂盒、CAT活力检测试剂盒、MDA含量检测试剂盒的说明书,分别测定CdTe/CdS/SiO2量子点对小鼠心、肝、脾、肺和肾的氧化损伤程度。
1.3.6 组织病理学分析
将小鼠的组织样本(心、肝、脾、肺、肾)置于4%多聚甲醛溶液中固定,用无水乙醇脱水后进行石蜡包埋。使用全自动切片机将组织切片至5 μm的厚度,然后用苏木精和伊红(hematoxylin-eosin,H&E)染色,H&E染色切片在临床病理学的生物显微镜下观察。
1.4 统计学方法
数据使用SPSS 27.0.1软件进行统计学分析,通过单因素方差分析(ANOVA)和Tukey的事后检验来计算显著性差异,P<0.05的水平上认为具有显著性差异。所有数据均以“平均值±标准差”(SD)表示。
2 结果与分析
2.1 CdTe/CdS/SiO2量子点对小鼠体重及脏器系数的影响
体重波动是评估量子点在生物体内化学毒性的初始指标之一[20],为判断CdTe/CdS/SiO2量子点对小鼠生长和健康状况的影响,本研究对小鼠进行了42 d的体重变化监测。如图2所示,高剂量量子点暴露可显著抑制小鼠早期和中期(7、14、21 d)的体重增加(P<0.05),但在暴露后期(28、42 d)的抑制效果逐渐减弱;低剂量组体重与对照组相比没有统计学上的差异。此外,观察量子点注射后小鼠的外观和行为,量子点暴露小鼠在饮食、毛发颜色和光泽度方面没有明显的变化,且未现象出颤抖、嗜睡、攻击等异常行为。结果表明,早期在高剂量CdTe/CdS/SiO2量子点的暴露下对小鼠的生长产生了抑制作用,但在28 d以后小鼠的体重生长已恢复到正常水平。因此,可判断CdTe/CdS/SiO2量子点对小鼠体重没有造成不可逆的损伤,CdTe/CdS/SiO2量子点在小鼠体内的总体毒性相对较弱。
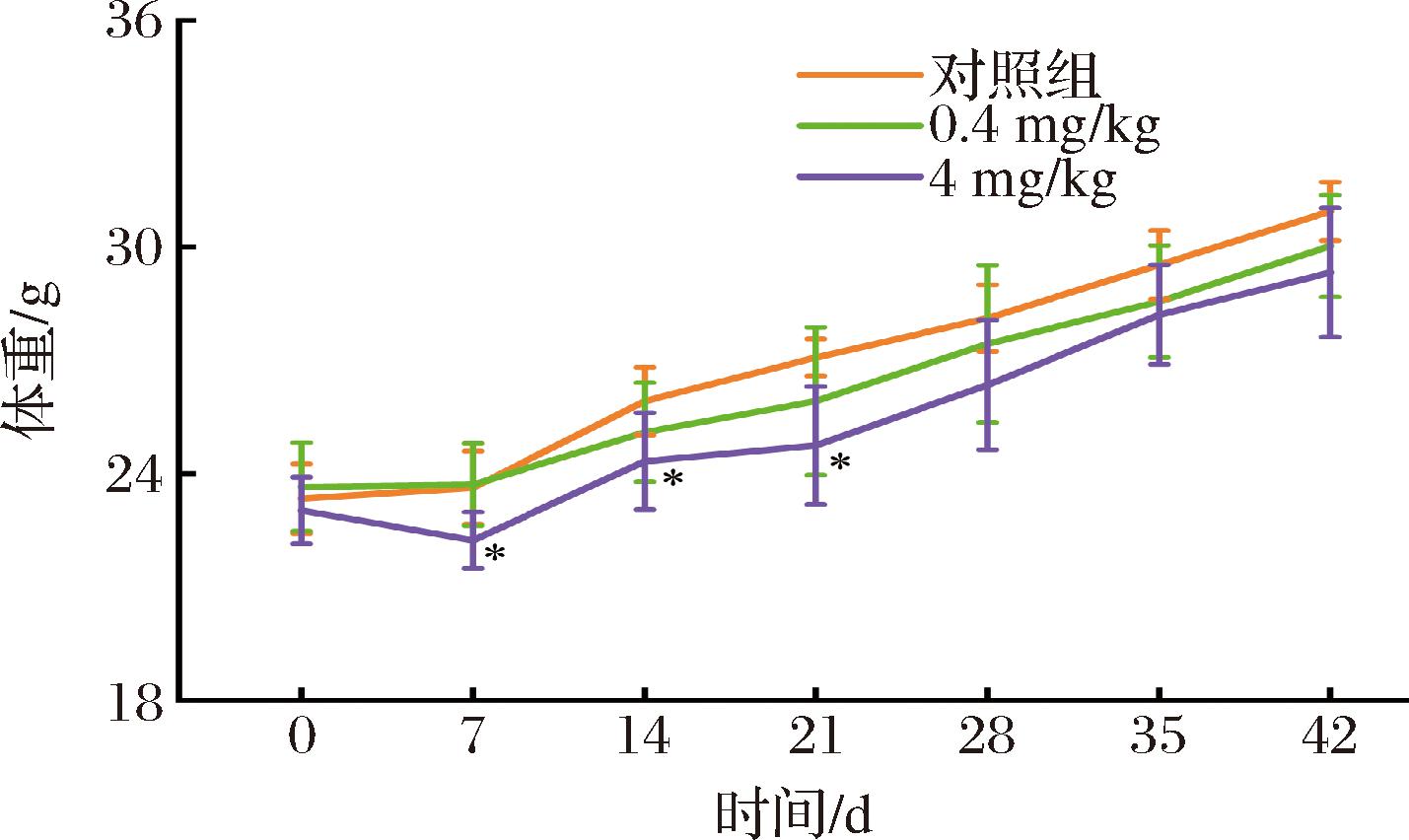
图2 CdTe/CdS/SiO2量子点对小鼠体重的影响
Fig.2 Effect of CdTe/CdS/SiO2 quantum dots on body weight of mice
注:*表示同一采样时间与对照组比较有显著性差异
(P<0.05)(下同)。
脏器系数是动物体内脏器质量与动物体重之间的比值,可用于评价量子点对小鼠脏器损伤的影响。如图3所示,通过统计小鼠心、肝、脾、肺、肾的脏器系数发现,在最终时间点(第42天)实验组的脏器系数与对照组相比无统计学意义,表明量子点暴露小鼠体内后各脏器没有发生充血、水肿或者肥大增生,也没有出现萎缩现象。结果表明,CdTe/CdS/SiO2量子点对小鼠的脏器系数无显著影响,在小鼠体内具有良好的生物相容性。
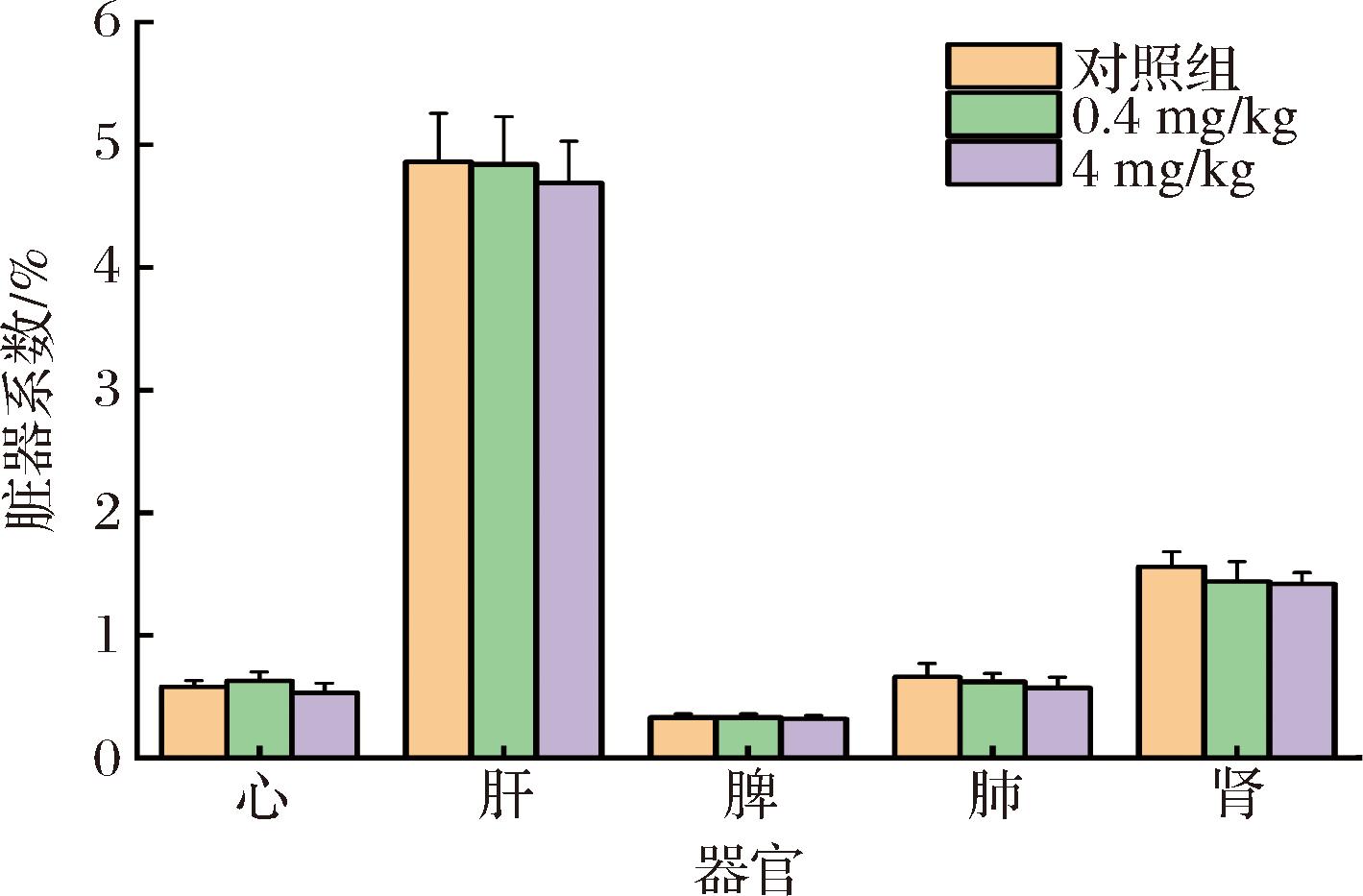
图3 CdTe/CdS/SiO2量子点对小鼠脏器系数的影响
Fig.3 Effect of CdTe/CdS/SiO2 quantum dots on organ coefficient of mice
2.2 CdTe/CdS/SiO2量子点对小鼠血细胞的影响
血细胞计数是反映小鼠健康状况的常见临床检查。当量子点通过腹腔注射进入小鼠体内,首先会接触到小鼠血液中的各种血细胞并对其造成影响[21-22]。许多细胞系可以吸收量子点,可能导致细胞活力降低、诱导凋亡、氧化应激和细胞形态改变等损伤[23-25]。本文通过测定20种血常规数据,分析量子点对小鼠血细胞计数的影响,结果如图4所示,量子点暴露小鼠的部分血液指标(白细胞、淋巴细胞比率、粒细胞比率、淋巴细胞、红细胞压积、红细胞分布宽度的变异系数、血小板、血小板压积)在早中期某些时间点上与对照组存在显著性差异(P<0.05),说明量子点引起了血液学变化,这可能是它们在体内逐渐代谢和降解的结果[26]。然而,除平均血红蛋白浓度外,其余血细胞计数在后期(第42天)趋于稳定并恢复到正常水平,与对照组相比无明显差异。结果表明,CdTe/CdS/SiO2量子点对小鼠血细胞呈现短期影响,后期随着时间的延长可以恢复到正常水平,表明量子点对小鼠血细胞的毒性较弱。
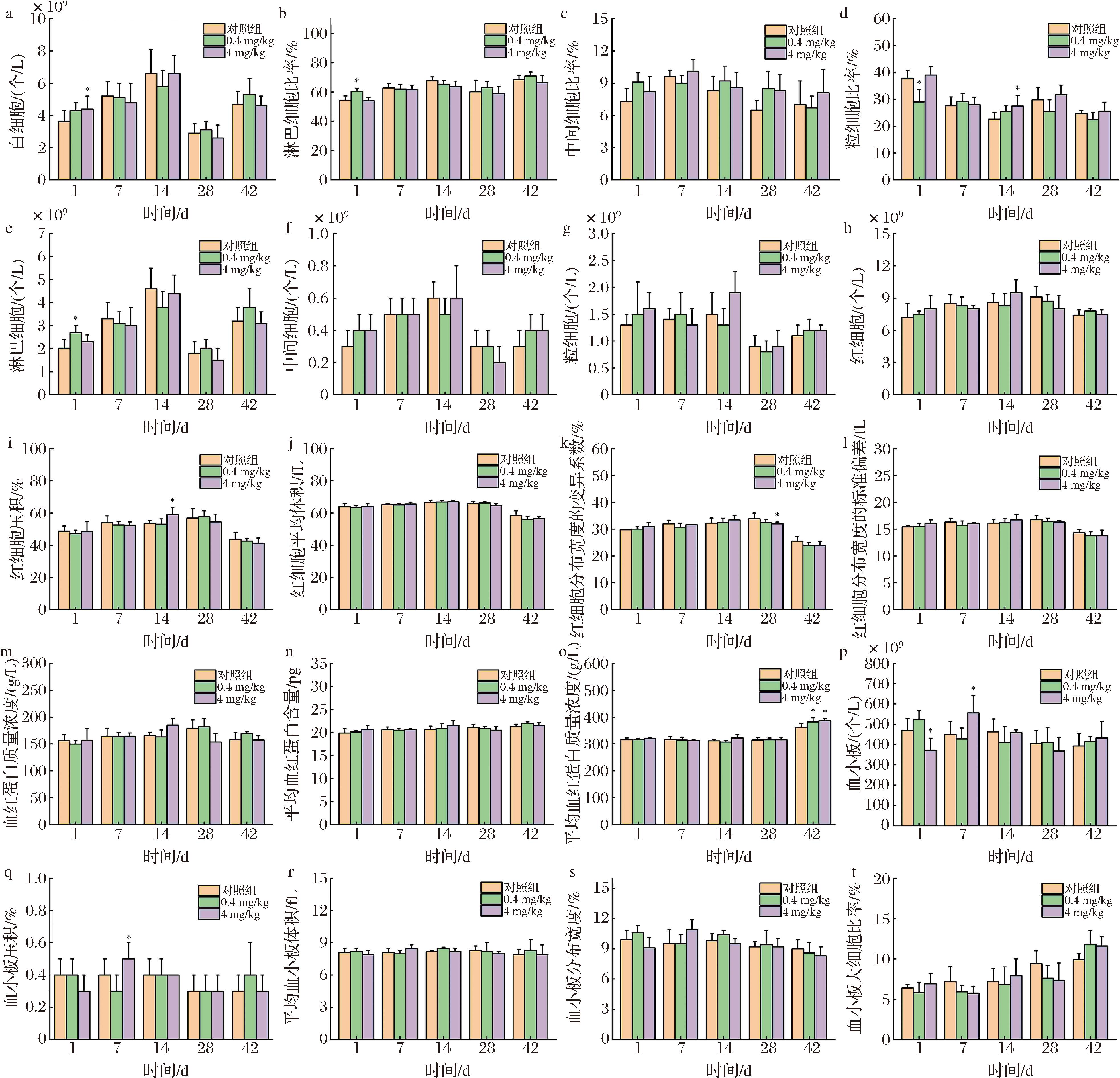
a-白细胞;b-淋巴细胞比率;c-中间细胞比率;d-粒细胞比率;e-淋巴细胞;f-中间细胞;g-粒细胞;h-红细胞;i-红细胞压积;j-红细胞平均体积;k-红细胞分布宽度的变异系数;l-红细胞分布宽度的标准偏差;m-血红蛋白质量浓度;n-平均血红蛋白含量;o-平均血红蛋白质量浓度;p-血小板;q-血小板压积;r-平均血小板体积;s-血小板分布宽度;t-血小板大细胞比率
图4 CdTe/CdS/SiO2量子点对小鼠血细胞的影响
Fig.4 Effect of CdTe/CdS/SiO2 quantum dots on blood cells in mice
2.3 CdTe/CdS/SiO2量子点在小鼠体内的分布和蓄积
为了探明量子点在各器官中的成像及分布,本文利用荧光成像技术检测CdTe/CdS/SiO2量子点在小鼠体内的分布(图5)。如图5-a所示,在肝、脾、肺部均可检测到来自CdTe/CdS/SiO2量子点的荧光信号,在肺部的发光程度异常突出。为了证实这一现象,记录了来自心、肝、脾、肺和肾的细胞荧光比率。如图5-c所示,肺部荧光率较高,占7.32%,其次是脾脏(1.48%)和肝脏(1.08%),该结果与LI等[27]报道的CuInS2/ZnS量子点在小鼠肺、脾和肝中表现出的荧光现象一致。
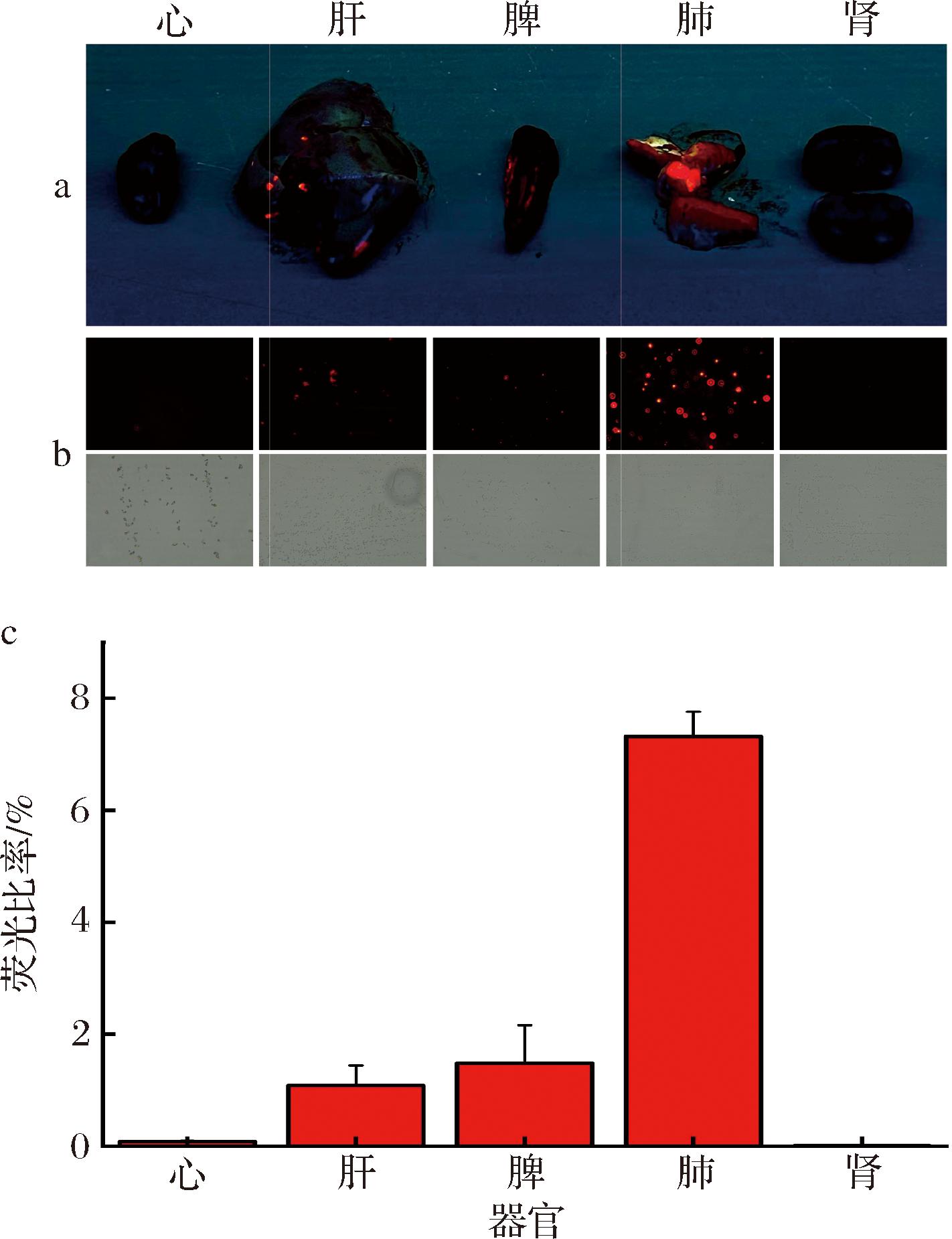
a-小鼠脏器的紫外灯照射图像(λex=365 nm);b-荧光显微镜下的荧光视野图(上)和正常视野(下);c-小鼠脏器的荧光比率
图5 CdTe/CdS/SiO2量子点在小鼠器官的分布
Fig.5 Distribution of CdTe/CdS/SiO2 quantum dots in mice organs
为了进一步探究CdTe/CdS/SiO2量子点在小鼠体内的积累情况,本文利用ICP-MS测定不同阶段高剂量组器官中量子点主要成分Cd2+的分布。如图6所示,注射CdTe/CdS/SiO2量子点后Cd2+主要在脾和肺中聚集[9],与主要脏器的荧光分布基本一致。脾作为机体最大的免疫器官[28],肺是注射量子点后的血液首过器官之一[27],它们的量子点分布和蓄积最大。然而,在后期28、42 d时,脾和肺的Cd2+水平含量显著下降,而肝和肾的Cd2+水平上升,表明量子点从脾、肺转移到有血液循环的肝、肾中[29]。此外,量子点可能会通过粪便和尿液排出体外,这也是导致小鼠体内分布变化的原因之一[30-31]。本研究表明,由CdTe/CdS/SiO2量子点释放的Cd2+可在主要器官停留长达42 d以上。
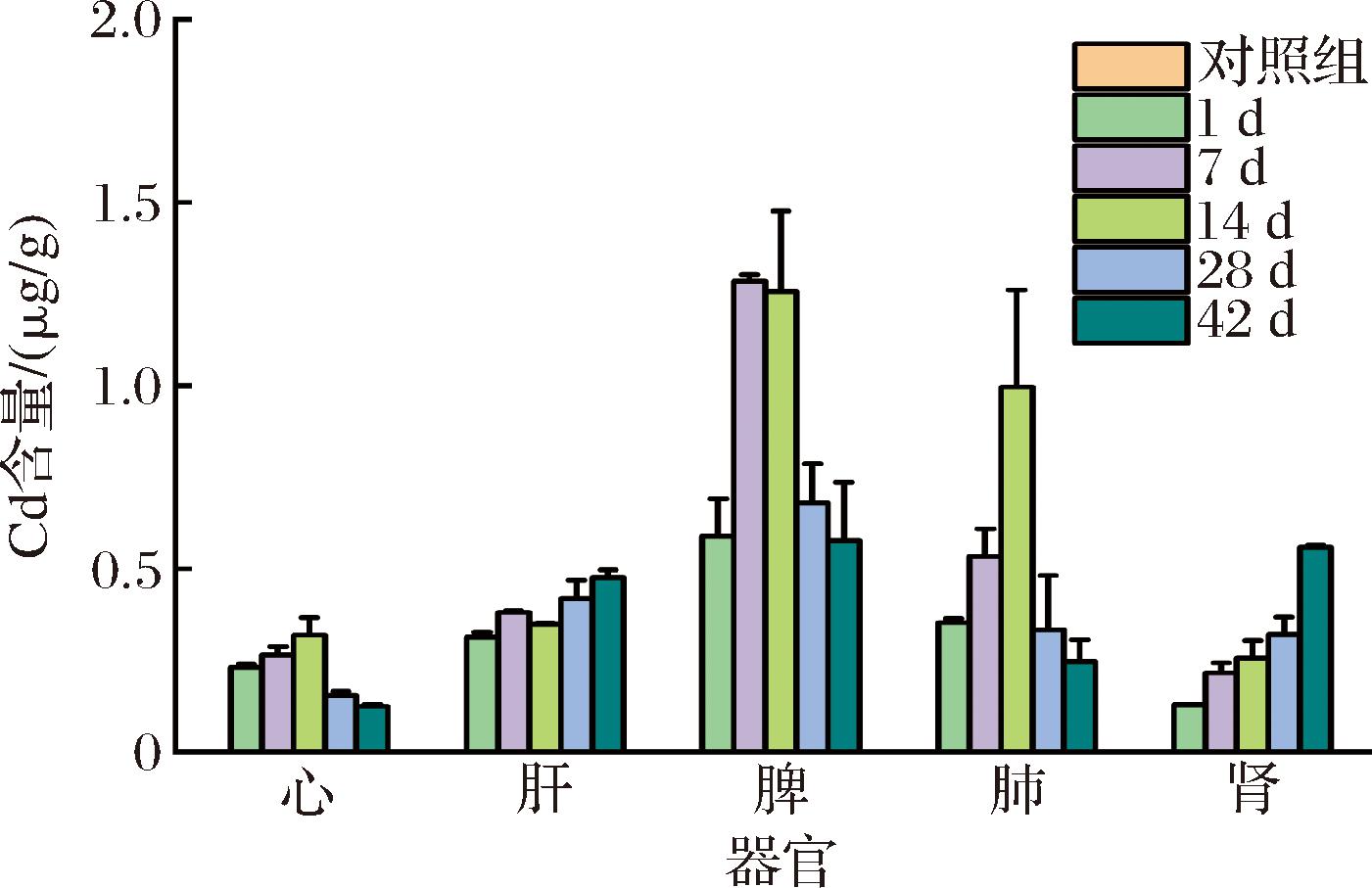
图6 小鼠主要器官在不同时间点的Cd2+浓度
Fig.6 Cd2+ concentration in major organs of mice at different time points
2.4 CdTe/CdS/SiO2 量子点对小鼠器官氧化指标的影响
许多纳米材料可以诱发生物体内的氧化应激,为进一步揭示CdTe/CdS/SiO2量子点积累对小鼠器官的毒性作用,本文通过测定SOD、CAT活力以及MDA含量来评估CdTe/CdS/SiO2量子点对心、肝、脾、肺、肾的氧化损伤作用。如图7所示,早中期在CdTe/CdS/SiO2量子点暴露下,小鼠各器官的SOD、CAT活力及MDA含量与对照组相比呈现动态的显著性差异(P<0.05)。研究报道,CdTe量子点能够触发氧化应激途径[32],而产生的部分氧化损伤可能来自于核心量子点中的镉泄露[33-34],或是由量子点本身的聚集氧化导致[35]。在42 d时,暴露组小鼠的脾脏CAT活力及肾脏MDA含量仍存在显著性差异(P<0.05)。研究表明,Cd2+会诱导抗氧化酶活力降低和脂质过氧化[36-37],结合图6发现,Cd2+在脾中的含量很高,这可能导致脾的CAT活力在后期不能恢复到正常水平;Cd2+在肾中积累则导致肾的MDA含量在后期出现显著性差异。除此之外,在最终时间点(第42天),实验组的SOD、CAT活力和MDA含量与对照组之间无统计学意义,表明小鼠以自身的免疫系统调节能力,通过抗氧化酶来缓解过氧化物应激。结果表明,尽管CdTe/CdS/SiO2量子点在早中期能诱发小鼠器官产生氧化应激,但随着时间的延长,氧化应激水平逐渐降低,表明CdTe/CdS/SiO2量子点对小鼠器官的氧化指标影响较小。

a-心的SOD活力;b-心的CAT活力;c-心的MDA含量;d-肝的SOD活力;e-肝的CAT活力;f-肝的MDA含量;g-脾的SOD活力;h-脾的CAT活力;i-脾的MDA含量;j-肺的SOD活力;k-肺的CAT活力;l-肺的MDA含量;m-肾的SOD活力;n-肾的CAT活力;o-肾的MDA含量
图7 CdTe/CdS/SiO2量子点对小鼠器官氧化酶活的影响
Fig.7 Effect of CdTe/CdS/SiO2 quantum dots on oxidase activity in mouse organs
2.5 CdTe/CdS/SiO2量子点对小鼠主要器官组织形态的影响
组织病理学检查是安全性评估的重要手段,为生理系统疾病提供了可靠依据。上文ICP-MS结果表明,CdTe/CdS/SiO2量子点可在脏器中滞留42 d以上。为进一步探究小鼠器官在量子点暴露下对组织形态的影响,将高剂量组的心、肝、脾、肺、肾做成石蜡切片,并以9 g/L生理盐水处理42 d为对照,用H&E染色观察。如图8所示,量子点暴露小鼠的脏器组织形态正常且结构清晰,具体表现在:心脏横切面清晰,心肌组织未见积水变性;肝脏结构可见均匀的粉红色胞浆,肝小叶、中央静脉未见明显水肿;脾脏结构清晰,未见炎症浸润;肺脏中可见清晰肺泡,未见组织纤维化;肾脏中肾小球与周围肾小管分布清晰,未见上皮细胞增生[38]。显然,在CdTe/CdS/SiO2量子点暴露下的小鼠器官未观察到明显的组织病变,LI等[26]的研究也表明在CdSe/ZnS量子点暴露下的器官组织未出现异常变化。结果表明,尽管CdTe/CdS/SiO2量子点可以在部分器官残留42 d以上,但在小鼠主要器官组织中没有观察到明显的病理学表现。

图8 小鼠器官在不同时间点的病理切片(比例尺:100 μm)
Fig.8 Pathological slices of mouse organs at different time points (scale bar:100 μm)
3 结论
CdTe/CdS/SiO2量子点作为一种新开发的荧光纳米材料,在生物、医疗等领域具有很好的应用前景,因此有必要对其进行安全性评价。本文通过监测小鼠的体重、脏器系数、血细胞计数、氧化指数、组织病理学变化和在小鼠脏器上的分布蓄积情况,评价了CdTe/CdS/SiO2量子点在小鼠体内42 d的亚急性毒性及分布特征,研究表明CdTe/CdS/SiO2量子点在小鼠体内表现出的毒性较弱,表明CdTe/CdS/SiO2量子点在体内具有很高的生物相容性。本研究的结果有助于CdTe/CdS/SiO2量子点作为安全性材料应用在生物领域,为后续Cd2+传感平台以及药物递送系统的开发提供有利的价值。然而,今后还需要进一步的全面研究来充分阐明CdTe/CdS/SiO2量子点的生化性质与生物体内效应之间的相互关系,以建立安全数据库指导后续的生物应用。
[1] LU H T, LI W S, DONG H F, et al.Graphene quantum dots for optical bioimaging [J].Small, 2019, 15(36):1902136.
[2] HE Y F, AN C Z, HOU X L, et al.CdTe@CdS quantum dots for labeling and imaging macrophages in liver frozen sections below the freezing point [J].Journal of Materials Chemistry B, 2022, 10(15):2952-2962.
[3] ZAYED D G, ABDELHAMID A S, FREAG M S, et al. Hybrid quantum dot-based theranostic nanomedicines for tumor-targeted drug delivery and cancer imaging[J]. Nanomedicine, 2019, 14(3):225-228.
[4] NOZIK A J, BEARD M C, LUTHER J M, et al.Semiconductor quantum dots and quantum dot arrays and applications of multiple exciton generation to third-generation photovoltaic solar cells[J].Chemical Reviews, 2010, 110(11):6873-6890.
[5] LI X L, JIA Y, CAO A Y.Tailored single-walled carbon nanotube?CdS nanoparticle hybrids for tunable optoelectronic devices [J].ACS Nano, 2010, 4(1):506-512.
[6] WU T S, ZHANG T, CHEN Y L, et al.Research advances on potential neurotoxicity of quantum dots [J].Journal of Applied Toxicology, 2016, 36(3):345-351.
[7] LU J, TANG M, ZHANG T.Review of toxicological effect of quantum dots on the liver [J].Journal of Applied Toxicology, 2019, 39(1):72-86.
[8] CHINNATHAMBI S, SHIRAHATA N.Recent advances on fluorescent biomarkers of near-infrared quantum dots for in vitro and in vivo imaging [J].Science and Technology of Advanced Materials, 2019, 20(1):337-355.
[9] YANG L, KUANG H J, ZHANG W Y, et al.Quantum dots cause acute systemic toxicity in lactating rats and growth restriction of offspring [J].Nanoscale, 2018, 10(24):11564-11577.
[10] 林苏霞, 许改霞, 杨坚泰, 等.CdSe/CdS/ZnS量子点在雌性小鼠体内的分布和蓄积[J].中国医学物理学杂志, 2012, 29(3):3423-3426.
LIN S X, XU G X, YANG J T, et al.Biodistribution and bioaccumulation of CdSe/CdS/ZnS quantum dots in female mice[J].Chinese Journal of Medical Physics, 2012, 29(3):3423-3426.
[11] WANG J, LI N, SHAO F, et al.Microwave-assisted synthesis of high-quality CdTe/CdS@ ZnS-SiO2 near-infrared-emitting quantum dots and their applications in Hg2+ sensing and imaging [J].Sensors and Actuators B:Chemical, 2015, 207(74-82).
[12] QU L Y, HUANG H, XIA F, et al.Risk analysis of heavy metal concentration in surface waters across the rural-urban interface of the Wen-Rui Tang River, China [J].Environmental Pollution, 2018, 237:639-649.
[13] CHEN Y J, HUANG H F, DING Y, et al.Trace metals in aquatic environments of a mangrove ecosystem in Nansha, Guangzhou, South China:Pollution status, sources, and ecological risk assessment [J].Environmental Monitoring and Assessment, 2019, 191(10):629.
[14] NGOC N T M, CHUYEN N V, THAO N T T, et al.Chromium, cadmium, lead, and arsenic concentrations in water, vegetables, and seafood consumed in a coastal area in Northern Vietnam [J].Environmental health insights, 2020, 14:1178630220921410.
[15] QIAN J, WANG K, WANG C Q, et al.Ratiometric fluorescence nanosensor for selective and visual detection of cadmium ions using quencher displacement-induced fluorescence recovery of CdTe quantum dots-based hybrid probe [J].Sensors and Actuators B:Chemical, 2017, 241:1153-1160.
[16] CHEN J Q, MENG H M, FANG Z J, et al. An “off-on” fluorescent nanosensor for the detection of cadmium ions based on APDC-etched CdTe/CdS/SiO2 quantum dots[J]. Heliyon, 2024, 10(5): e26980.
[17] NGUYEN K C, ZHANG Y, TODD J, et al.Biodistribution and systemic effects in mice following intravenous administration of cadmium telluride quantum dot nanoparticles [J].Chemical Research in Toxicology, 2019, 32(8):1491-1503.
[18] CHEN L-N, WANG J, LI W-T, et al.Aqueous one-pot synthesis of bright and ultrasmall CdTe/CdS near-infrared-emitting quantum dots and their application for tumor targeting in vivo[J].Chemical Communications, 2012, 48(41):4971-4973.
[19] SADAF A, ZESHAN B, WANG Z Y, et al.Toxicity evaluation of hydrophilic CdTe quantum dots and CdTe@SiO2 nanoparticles in mice [J].Journal of Nanoscience and Nanotechnology, 2012, 12(11):8287-8292.
[20] SINGH V, KASHYAP S, YADAV U, et al.Nitrogen doped carbon quantum dots demonstrate no toxicity under in vitro conditions in a cervical cell line and in vivo in Swiss albino mice [J].Toxicology Research, 2019, 8(3):395-406.
[21] LIN G M, CHEN T, PAN Y N, et al.Biodistribution and acute toxicity of cadmium-free quantum dots with different surface functional groups in mice following intratracheal inhalation [J].Nanotheranostics, 2020, 4(3):173.
[22] ZOU W Y, LI L, CHEN Y J, et al.In vivo toxicity evaluation of PEGylated CuInS2/ZnS quantum dots in BALB/c mice [J].Frontiers in Pharmacology, 2019, 10(437).
[23] LUO Y H, WU S B, WEI Y H, et al.Cadmium-based quantum dot induced autophagy formation for cell survival via oxidative stress [J].Chemical Research in Toxicology, 2013, 26(5):662-673.
[24] NGUYEN K C, WILLMORE W G, TAYABALI A F.Cadmium telluride quantum dots cause oxidative stress leading to extrinsic and intrinsic apoptosis in hepatocellular carcinoma HepG2 cells [J].Toxicology, 2013, 306:114-123.
[25] 韩晓乐, 李擎宇, 郝浩, 等. 量子点细胞毒性[J]. 湖北科技学院学报(医学版), 2019, 33(4):359-364.
HAN X L, LI Q Y, HAO H, et al. Cytotoxicity of quantum dots[J]. Journal of Hubei University of Science and Technology (Medical Sciences), 2019, 33(4):359-364.
[26] LI L, TIAN J L, WANG X M, et al. Cardiotoxicity of intravenously administered CdSe/ZnS quantum dots in BALB/c mice[J]. Frontiers in Pharmacology, 2019, 10:1179.
[27] LI L, DAOU T J, TEXIER I, et al.Highly luminescent CuInS2/ZnS core/shell nanocrystals:cadmium-free quantum dots for in vivo imaging[J].Chemistry of Materials, 2009, 21(12):2422-2429.
[28] LIANG Y, ZHANG T, TANG M.Toxicity of quantum dots on target organs and immune system [J].Journal of Applied Toxicology, 2022, 42(1):17-40.
[29] SU Y Y, PENG F, JIANG Z Y, et al.In vivo distribution, pharmacokinetics, and toxicity of aqueous synthesized cadmium-containing quantum dots [J].Biomaterials, 2011, 32(25):5855-5862.
[30] GE X L, HUANG B, ZHANG Z L, et al.Glucose-functionalized near-infrared Ag2Se quantum dots with renal excretion ability for long-term in vivo tumor imaging [J].Journal of Materials Chemistry B, 2019, 7(38):5782-5788.
[31] 杨鹏飞, 杨林, 况慧娟, 等.量子点体内生物转运和转化特征及毒性研究进展[J].中国药理学与毒理学杂志, 2015, 29(6):1007-1013.
YANG P F, YANG L, KUANG H J, et al.Research advances in characteristics of biotransport and biotransformation and toxicities of quantum dots in vivo[J].Chinese Journal of Pharmacology and Toxicology, 2015, 29(6):1007-1013.
[32] BAI C C, YAO Y S, WANG Z H, et al.CdTe quantum dots trigger oxidative stress and endoplasmic reticulum stress-induced apoptosis and autophagy in rat Schwann cell line RSC96 [J].Journal of Applied Toxicology, 2022, 42(12):1962-1977.
[33] DU Y, ZHONG Y Y, DONG J J, et al.The effect of PEG functionalization on the in vivo behavior and toxicity of CdTe quantum dots [J].RSC advances, 2019, 9(22):12218-12225.
[34] 唐永安, 胡军, 杨祥良, 等.镉系量子点的生物毒性及相应机制[J].化学进展, 2014, 26(10):1731-1740.
TANG Y A, HU J, YANG X L, et al.Biotoxicity of cadmium-based quantum dots and the mechanisms[J].Progress in Chemistry, 2014, 26(10):1731-1740.
[35] HU L, ZHONG H, HE Z G. Toxicity evaluation of cadmium-containing quantum dots: A review of optimizing physicochemical properties to diminish toxicity[J]. Colloids and Surfaces B: Biointerfaces, 2021, 200:111609.
[36] YANG Z J, HE Y Q, WANG H F, et al. Protective effect of melatonin against chronic cadmium-induced hepatotoxicity by suppressing oxidative stress, inflammation, and apoptosis in mice[J]. Ecotoxicology and Environmental Safety, 2021, 228:112947.
[37] 王靖雯, 房志家, 高原, 等.半胱氨酸通过抑制氧化应激和炎症减轻镉诱导的小鼠肝脏脂质代谢紊乱[J].食品与发酵工业, 2023, 49(14):132-137.
WANG J W, FANG Z J, GAO Y, et al.Cysteine alleviates cadmium-induced disorders of hepatic lipid metabolism in mice by inhibiting oxidative stress and inflammation [J].Food and Fermentation Industries, 2023, 49(14):132-137.
[38] CHENG K, YANG X Q, ZHANG X S, et al.High-security nanocluster for switching photodynamic combining photothermal and acid-Induced drug compliance therapy guided by multimodal active-targeting imaging[J].Advanced Functional Materials, 2018, 28(36):1803118.