L-高丝氨酸又称2-氨基-4-羟基丁酸,是一种宝贵的非蛋白质氨基酸,在L-蛋氨酸和L-苏氨酸等多种氨基酸的生物合成中起着关键作用[1-3]。此外,它还是合成L-高丝氨酸内酯、γ-丁内酯、四氢呋喃、异丁醇、1,4-丁二醇等多种前景广阔的平台化合物的重要中间体[4]。近年来,L-高丝氨酸被广泛应用于除草剂L-草铵膦的合成,这种化合物在现代农业被广泛使用[5],由于其具有广谱除草活性、低毒性、高效和良好的环境相容性而备受青睐。
目前,L-高丝氨酸主要通过化学法合成,这种方法由于产量低、底物昂贵和具有环境毒性而受到限制。因此,本研究选择使用生物合成法来解决上述生产方法的缺点,提高L-高丝氨酸产率。近年来,系统代谢工程和合成生物学取得了重要进步,人们对利用微生物发酵法高效生产L-高丝氨酸的兴趣与日俱增[6-7]。各种微生物宿主已被证明可以成功地作为细胞工厂,利用可再生资源生产L-高丝氨酸。VO等[8]通过对大肠杆菌W3110进行迭代进化和合理的工程设计,开发出了一种高效的微生物底盘细菌,使L-高丝氨酸的产量达到了110.8 g/L。LI等[9]基于代谢流的再分配策略证明了谷氨酸棒杆菌ATCC 13032具有发酵生产L-高丝氨酸的潜力,并通过摇瓶发酵生产L-高丝氨酸,使其产量达到8.8 g/L。
玉米浆是玉米淀粉的主要副产物,含有丰富的氨基酸、矿物质、维生素和其他重要营养成分,其作为一种经济有效且易于获取的发酵营养源,可为发酵过程提供充足的基本营养成分[10-11]。在氨基酸工业发酵过程中,玉米浆可以作为复合营养源的重要替代物,然而,其对发酵过程的影响和潜在机制仍不清楚。本文探讨了不同浓度的玉米浆对谷氨酸棒杆菌发酵生产L-高丝氨酸的影响。基于比较转录组学挖掘影响这一过程的潜在基因并分析其内在机制,为谷氨酸棒杆菌的工程菌株构建和发酵优化提供新的视角。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本研究中大肠杆菌(Escherichia coli) DH5α由中国科学院天津工业生物技术研究所保藏。谷氨酸棒杆菌H100由本实验室保藏。大肠杆菌-谷氨酸棒杆菌穿梭载体pXMJ19用于基因表达研究。所用菌株与质粒如表1所示。
表1 本研究所用菌株与质粒
Table 1 Bacteria and plasmids used in this study

菌株和质粒相关描述来源DH5αE.coli derivative;competent cells for general cloning实验室保藏H100representative parent C.glutamicum strain, ΔthrB;Psod-lysCC932T;Psod-homG1133A实验室保藏H100-pXMJ19C.glutamicum H100 derivative;contains the pXMJ19 control plasmid本研究构建H100-cg3096C.glutamicum H100 derivative;contains the pXMJ19-cg3096 recombinant plasmid本研究构建pXMJ19C.glutamicum-E.coli shuttle expression vector, Cmr实验室保藏pXMJ19-cgtRNA_3582pXMJ19 derivative, containing thecgtRNA_3582 gene from C.glutamicum本研究构建pXMJ19-cg1761-cg1764pXMJ19 derivative, containing the cg1761-cg1764 gene from C.glutamicum本研究构建pXMJ19-cg2836-cg2837pXMJ19 derivative, containing the cg2836-cg2837 gene from C.glutamicum本研究构建pXMJ19-cg3195pXMJ19 derivative, containing the cg3195 gene from C.glutamicum本研究构建pXMJ19-cg3001pXMJ19 derivative, containing thecg3001 gene from C.glutamicum本研究构建pXMJ19-cg1091pXMJ19 derivative, containing the cg1091 gene from C.glutamicum本研究构建pXMJ19-cg2937-cg2940pXMJ19 derivative, containing the cg2937-cg2940 gene from C.glutamicum本研究构建pXMJ19-cg0763pXMJ19 derivative, containing the cg0763 gene from C.glutamicum本研究构建pXMJ19-cg1612pXMJ19 derivative, containing thecg1612 gene from C.glutamicum本研究构建pXMJ19-cg3096pXMJ19 derivative, containing the cg3096 gene from C.glutamicum本研究构建pXMJ19-cg0347pXMJ19 derivative, containing the cg0347 gene from C.glutamicum本研究构建pXMJ19-cg0798pXMJ19 derivative, containing the cg0798 gene from C.glutamicum本研究构建pXMJ19-cg1483pXMJ19 derivative, containing the cg1483 gene from C.glutamicum本研究构建pXMJ19-cg2002pXMJ19 derivative, containing the cg2002 gene from C.glutamicum本研究构建pXMJ19-cg1792pXMJ19 derivative, containing thecg1792 gene from C.glutamicum本研究构建pXMJ19-cg0018pXMJ19 derivative, containing the cg0018 gene from C.glutamicum本研究构建pXMJ19-cg2931-cg2933pXMJ19 derivative, containing the cg2931-cg2933 gene from C.glutamicum本研究构建pXMJ19-cg2181pXMJ19 derivative, containing the cg2181 gene from C.glutamicum本研究构建pXMJ19-cg0039pXMJ19 derivative, containing the cg0039 gene from C.glutamicum本研究构建pXMJ19-cg3107pXMJ19 derivative, containing the cg3107 gene from C.glutamicum本研究构建
1.1.2 工具酶及试剂
2×Phanta Max Master Mix、2×Rapid Taq Master Mix、HiScript Ⅲ 1 st Strand cDNA Synthesis Kit、ChamQ Universal SYBR qPCR Master Mix,南京诺唯赞生物科技有限公司;无缝克隆酶,武汉力博瑞生物科技有限公司;氯霉素,索莱宝生物科技有限公司;L-高丝氨酸,天津希恩思奥普德科技有限公司;质粒提取试剂盒、胶回收试剂盒、总RNA提取试剂盒、细菌基因组DNA提取试剂盒,天根生化科技有限公司;NADP+/NADPH检测试剂盒,上海碧云天生物技术有限公司;酵母提取物、脑心浸液、胰蛋白胨,葡萄糖、尿素、玉米浆、山梨醇,天津百赛斯生物科技有限公司;其他试剂(如NaCl、MgCl2等)均为国产分析纯。
1.1.3 培养基与培养条件
LB培养基(g/L):酵母提取物5、胰蛋白胨10、NaCl 10;固体培养基加入2%(质量分数)琼脂粉。
LBHIS培养基(g/L):酵母提取物2.5、胰蛋白胨5、氯化钠5、脑心浸液18.5、山梨醇91;固体培养基加入2%(质量分数)琼脂粉。
发酵种子培养基(pH 7.2~7.3)(g/L):玉米浆30、尿素5、硫酸铵5、磷酸二氢钾1、葡萄糖25、硫酸镁0.5、L-苏氨酸0.4。
L-高丝氨酸发酵培养基(pH 7.2~7.3)(g/L):玉米浆7.5、硫酸铵40、硫酸镁0.5、磷酸二氢钾 0.25、葡萄糖80、乙酸钾0.5、L-苏氨酸0.4、柠檬酸0.01、七水合硫酸亚0.011、生物素0.0021、硫胺素0.0035、泛酸钙盐0.014、烟酰0.0042、碳酸钙20,磷酸0.225 mL。
大肠杆菌DH5α用作一般克隆的宿主细胞。谷氨酸棒杆菌H100作为亲本菌株进行功能分析。除非另有说明,大肠杆菌细胞通常在37 ℃的LB培养基中培养,谷氨酸棒杆菌细胞在32 ℃的LBHIS培养基中培养。需要时,在培养基中添加抗生素,谷氨酸棒杆菌的抗生素最终浓度为15 μg/L氯霉素,诱导目的基因表达时使用400 μmol/L异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)。
1.2 实验方法
1.2.1 质粒和菌株的构建
大肠杆菌-谷氨酸棒杆菌穿梭载体pXMJ19用作构建表达载体的骨架。利用对特定基因设计的引物,从谷氨酸棒杆菌基因组DNA中扩增目标基因的编码区。随后,使用ClonExpress® Ⅱ一步克隆试剂盒,通过无缝克隆法将纯化的PCR片段克隆到穿梭载体骨架中,获得可诱导表达的重组质粒。然后将表达载体转化到相应的谷氨酸棒杆菌细胞中进行后续功能分析。
1.2.2 L-高丝氨酸发酵
制备种子时,将谷氨酸棒杆菌工程菌株H100及其衍生物在种子培养基中32 ℃下培养过夜。过夜培养后,将细胞接种到装有20 mL发酵培养基的250 mL摇瓶中,起始OD600为1.0,在32 ℃、200 r/min的振荡条件下培养72 h。在整个发酵过程中使用20 g/L CaCO3作为中和剂和缓冲剂,以调节pH值。离心后,使用Zorbax Eclipse AAA柱对L-高丝氨酸进行定性定量的HPLC分析,色谱条件为:检测波长338 nm,柱温40 ℃,流速2 mL/min,进样量35 μL。流动相A:0.04 mol/L NaH2PO4溶液(用NaOH溶液将pH调至7.8),流动相B:甲醇450 mL、乙腈450 mL、水100 mL混合,流动相经0.22 μm有机滤膜过滤后超声除气20 min。
1.2.3 RNA-Seq 转录组分析
将过夜培养的谷氨酸棒杆菌菌株接种到含有不同质量浓度玉米浆(5、7.5、10、15 g/L)的发酵培养基中,在32 ℃、200 r/min的振荡条件下培养72 h,从收获的细胞中提取RNA,然后在北京诺维信科技有限公司进行cDNA文库构建和Illumina测序。该项目的原始RNA-seq数据已存入NCBI SRA数据库,登录号为PRJNA945339。两组间的RNA-seq差异表达分析使用DESeq2 R软件包进行。使用本杰明-霍奇伯格法(Benjamini-Hochberg)对P值进行多重检验调整,错误发现率为5%,以生成pad。基因显著差异表达的阈值设定为P<0.05和|log2 FoldChange|>1.0。
1.2.4 定量RT-PCR
使用RNAprep Pure Cell/Bacteria试剂盒从细胞中分离总RNA。根据生产商提供的方法,使用HiScript Ⅲ 1 st Strand cDNA Synthesis Kit(+ gDNA wiper)进行反转录。在进行实时PCR分析时,使用2×ChamQTM Universal SYBR qPCR Master Mix、0.4 μmol/L引物和适当的模板DNA制备反应混合物,一式三份,并使用Applied Biosystems 7500快速实时PCR系统进行评估。该过程中使用特定引物进行扩增。根据著名的2-ΔΔCt法计算基因表达量的相对变化倍数,该方法取决于16S rRNA参考基因的归一化[12]。
1.2.5 NADPH测定
将隔夜培养的谷氨酸棒杆菌菌株接种到发酵培养基中,在32 ℃温度下振荡培养。每个培养物的稀释密度约为1.0×108 cells/mL,用于检测。在发酵的指数期离心收获细胞,用PBS缓冲液洗涤2次,并在含有20 mmol/L Tris-HCl(pH 8.0)、2 mmol/L EDTA-2Na、1.2% Triton X-100和20 mg/mL溶菌酶的缓冲液中裂解。细胞内NADPH含量的测定采用商用NADP+/NADPH检测试剂盒,按照生产商的说明书进行[5]。
2 结果与分析
2.1 玉米浆对谷氨酸棒杆菌生长和生产的影响
玉米浆是玉米湿法研磨的副产品,在发酵过程中一直被用作提高微生物生长的廉价营养物[10]。在这项研究中,我们发现在发酵培养基中添加较低浓度的玉米浆虽然仅轻微提高谷氨酸棒杆菌生物量,但却显著提高了L-高丝氨酸的产量,而玉米浆添加质量浓度>15 g/L时,L-高丝氨酸产量并未随着玉米浆浓度的升高而明显增加。如图1-a和图1-b所示,随着玉米浆添加质量浓度的增加(添加质量浓度<15 g/L),L-高丝氨酸的产量随之增加。与玉米浆添加质量浓度为5 g/L的对照组相比,7.5、10、15 g/L的L-高丝氨酸产量分别增加了9.0%、26.9%和35.8%。在玉米浆添加质量浓度为20~40 g/L时,L-高丝氨酸产量未有明显变化。当玉米浆量增加至更高质量浓度时,L-高丝氨酸产量仅有轻微下降。以上结果表明,在发酵培养基中添加适量浓度玉米浆可以促进谷氨酸棒杆菌发酵生产L-高丝氨酸。
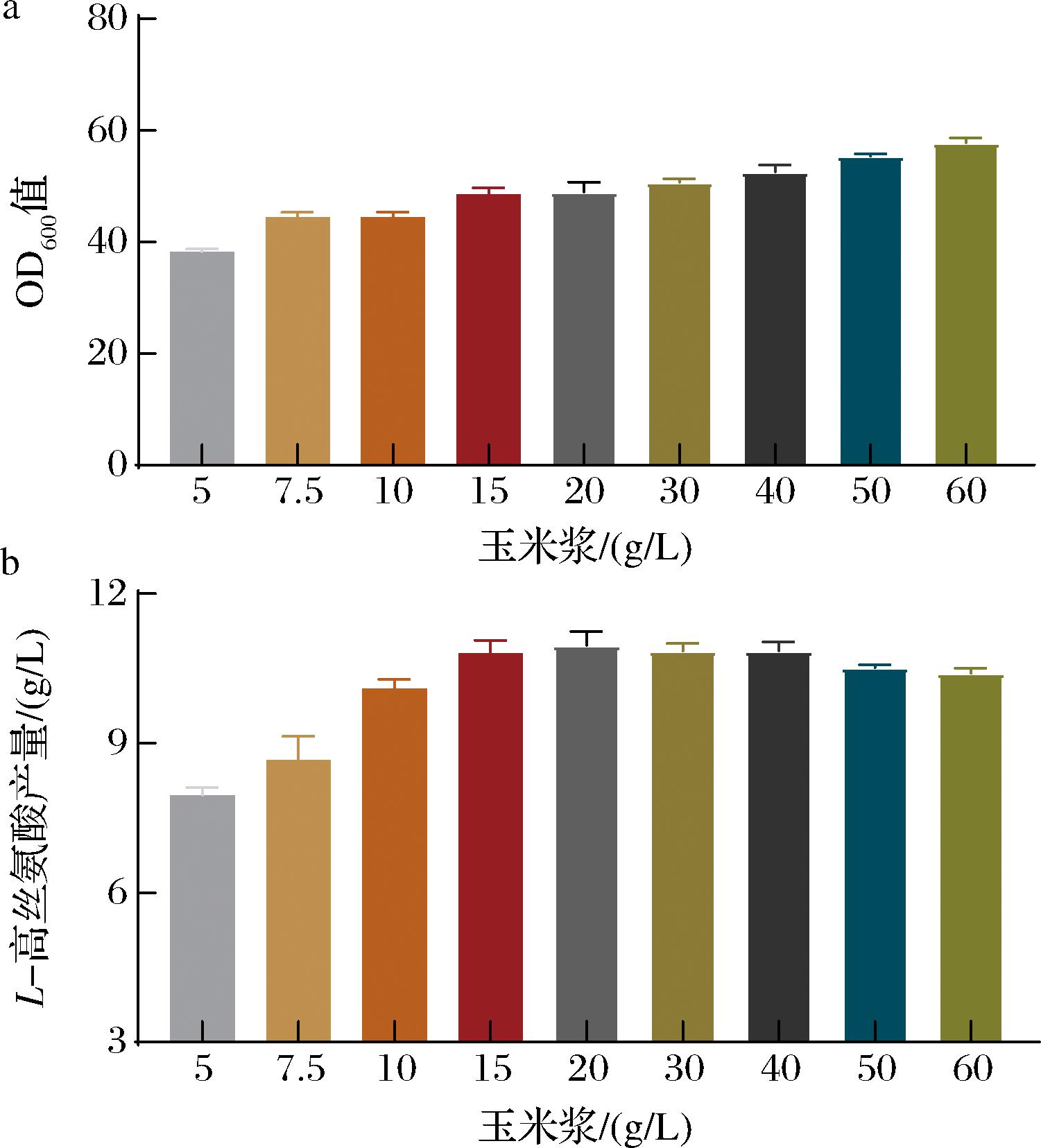
a-不同浓度玉米浆发酵72 h对微生物生长的影响;b-不同浓度玉米浆发酵72 h后的L-高丝氨酸产量
图1 不同浓度玉米浆条件下谷氨酸棒杆菌的生长及产量
Fig.1 Growth and yield of C.glutamicum under different corn steep liquor concentrations
2.2 转录组分析揭示玉米浆对谷氨酸棒杆菌的影响
为了研究玉米浆对细胞生长的影响以及促进L-高丝氨酸生产的潜在机制,本研究对4种不同质量浓度(5.0、7.5、10和15 g/L)的发酵样品进行转录组分析。如图2-a和图2-b所示,通过韦恩图和火山图分析3个处理组中的差异表达基因。结果表明,与添加5 g/L玉米浆的样本相比,添加7.5 g/L玉米浆的样本有535个基因的表达水平发生了变化(274个基因上调,261个基因下调);添加10 g/L玉米浆样品有1 341个基因的表达水平发生了变化(619个基因上调,722个基因下调);添加15 g/L玉米浆样品有1 089个基因的表达水平发生了变化(498个基因上调,291个基因下调)。此外,韦恩图表明在不同质量浓度玉米浆处理的样本中,3个处理组有394个重叠的差异表达基因。
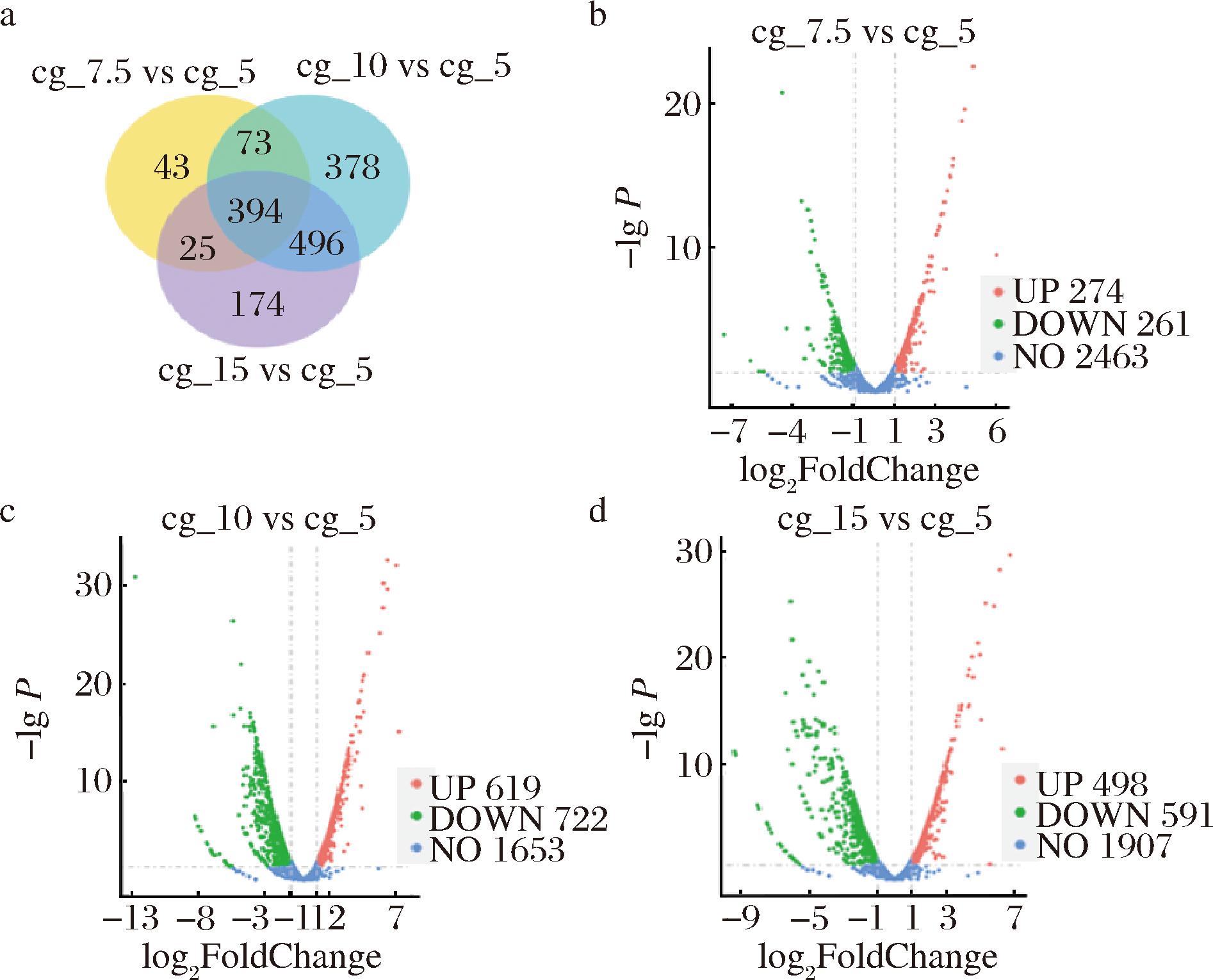
a-转录组比较分析韦恩图;b-转录组比较分析火山图
图2 不同浓度玉米浆条件下谷氨酸棒杆菌的转录组分析
Fig.2 Transcriptome analysis of C.glutamicum under different corn steep liquor concentrations
注:|log2 FoldChange|≥1且P≤0.05的差异表达基因用红色和绿色圆点显示。
为了更全面地了解与细胞代谢过程相关的基因表达谱,我们对相关通路基因表达的全局变化进行系统地研究。如图3所示,结果表明高浓度玉米浆处理使得发酵过程的中心碳代谢途径呈现出上调的趋势,包括糖酵解途径、磷酸戊糖途径和三羧酸循环途径。一些在维持细胞代谢和促进生长方面相关的基因的转录水平也出现了不同程度的上调,如编码磷酸戊糖途径中2种主要的酶zwf和devB,以及编码高效利用葡萄糖的酶ppgK、pfkA、fda、pyk、sucDC、sdhBA,它们主要被用于生产相关的生物分子构成原料、能量和还原当量。随着玉米浆添加质量浓度的提高,与乙酸代谢相关的一些基因,包括ackA、pta和cg3096,其表达水平也随之上调。此外,与L-高丝氨酸合成的竞争途径相关基因(如lysA和metX)的表达水平发生了下调。值得注意的是,结果还表明参与L-高丝氨酸转运的brnFE转运系统的基因表达水平发生了上调[10]。正如预期的那样,这些变化在将增加的碳通量引导到L-高丝氨酸积累方面发挥了关键作用。
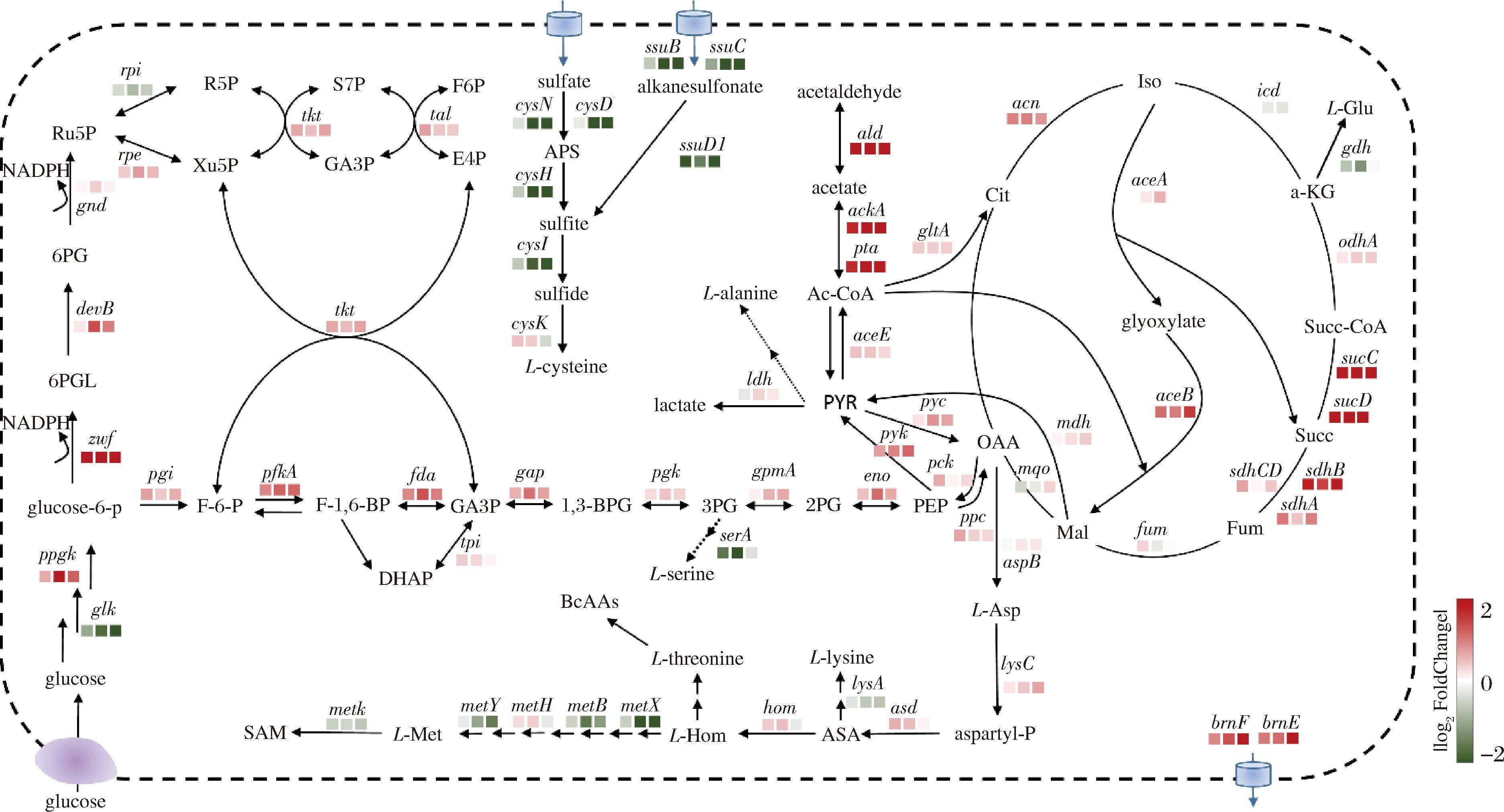
图3 转录组分析L-高丝氨酸生物合成途径基因表达水平变化
Fig.3 The expression levels of L-homoserine biosynthesis pathway genes in C.glutamicum based on transcriptome analysis
注:上调和下调的基因分别显示为红色和绿色;方框的颜色代表所示基因的|log2 FoldChange|;方形框从左到右依次代表7.5、10和15 g/L玉米浆的样品。
2.3 研究促进L-高丝氨酸生产的潜在靶点
为了挖掘玉米浆促进细胞生长和L-高丝氨酸合成的关键基因和模块,基于质粒过表达系统,本文筛选并评估了20个具有代表性的差异表达基因(图4-a和图4-b)。这些基因包括在3个处理组中重叠上调的前8个差异表达基因(cgtRNA_3582、cg1761-cg1764、cg2836-cg2837、cg3195、cg3001、cg1091、cg2937-cg2940、cg0763)、以及至少在2个处理组中重叠上调的前 12个差异表达基因(cg1612、cg3096、cg0347、cg0798、cg1483、cg2002、cg1792、cg0018、cg2931-cg2933、cg2181、cg0039、cg3107)。同时,使用7.5 g/L玉米浆处理后,通过RNA-seq分析上述基因的表达水平(图4-c),并分析它们对L-高丝氨酸生产的影响(图4-d)。结果表明,除了sucDC(cg2836-cg2837)和prpC1(cg0798)对细胞生长有轻微改善外,其余基因均对细胞生长没有显著影响。此外,编码醛脱氢酶Ald的cg3096[13]表达量的增加可以显著提高谷氨酸棒杆菌中L-高丝氨酸的生产,与对照菌株相比,其产量提高了27.4%。

a-至少在2个不同处理中重叠的20个上调基因靶点;b-20个靶点的相对表达水平;c-含有对照pXMJ19或其衍生物的谷氨酸棒杆菌重组菌株的细胞生长;d-7.5 g/L玉米浆质量浓度下20个靶点的L-高丝氨酸产量
图4 谷氨酸棒杆菌候选靶点的验证
Fig.4 Validation of candidate targets for C.glutamicum
2.4 Cg3096通过改善NADPH含量高效生产L-高丝氨酸
上述转录组结果表明cg3096可以促进L-高丝氨酸的合成,因此我们通过RT-PCR进一步验证其在不同浓度玉米浆处理下的表达水平。实验结果证明,随着玉米浆添加浓度的增加,cg3096的表达水平显著增加(图5-a)。同时,通过摇瓶发酵验证cg3096对L-高丝氨酸生产具有促进作用(图5-b),结果表明,过表达cg3096可以明显提高L-高丝氨酸的产量,发酵60 h后L-高丝氨酸产量达(12.74±0.52) g/L。
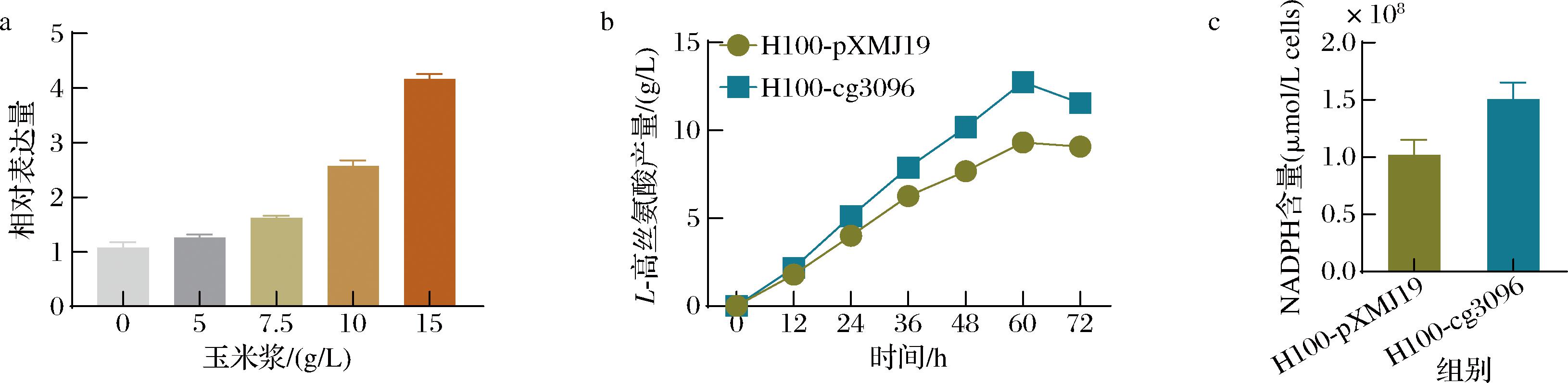
a-通过RT-PCR检测不同浓度玉米浆处理的样品中cg3096的表达水平;b-在7.5 g/L玉米浆的培养基中发酵生产L-高丝氨酸的时间过程;c-发酵期间cg3096过表达及其亲本菌株的NADPH水平。
图5 cg3096在L-高丝氨酸生产中的作用和潜在机制
Fig.5 Roles and potential mechanisms of cg3096 in L-homoserine production
推测cg3096在谷氨酸棒杆菌中编码醛脱氢酶Ald,其在乙醇利用和通过NADP+依赖的氧化途径进行醛解毒的过程中发挥着关键作用[13-14]。上述反应与NADPH的再生途径一起,可能作为细胞内NADPH的重要来源。为了验证这一假设,本文评估了过表达cg3096对发酵过程中NADPH含量的影响。正如预期的那样,cg3096的过表达显著地增加了NADPH含量,与H100-pXMJ19菌株相比,NADPH含量增加了约47.8%(图5-c)。由于NADPH的含量是限制L-高丝氨酸生物合成的主要因素[15],因此可以通过过表达cg3096提高NADPH的含量,促进L-高丝氨酸的生产。
为了进一步了解cg3096对代谢通路相关基因表达的变化,本文对亲本(H100-pXMJ19菌株)与cg3096过表达菌株进行了转录组比较分析(图6-a)。结果表明,87个基因发生了上调,126个基因发生了下调(图6-b为其中10个具有代表性的上调的差异表达基因)。正如预期的那样,与亲本菌株相比,过表达菌株中cg3096基因表达水平显著升高。此外,添加玉米浆时,一些假定的转运体编码基因,如cg1785(amt,编码铵转运体)、cg0922(编码铁苷酸转运体)、cg1061-cg1064(urtABC,编码尿素转运体)和糖利用基因簇cg0535-cg0536[16],在cg3096过表达菌株中都出现明显的上调。鉴于玉米浆中含有蛋白质、氨基酸、维生素、矿物质、还原糖、有机酸、酚类化合物等,上述基因表达水平的提高有助于提高玉米浆的利用率,从而实现L-高丝氨酸的高效合成。
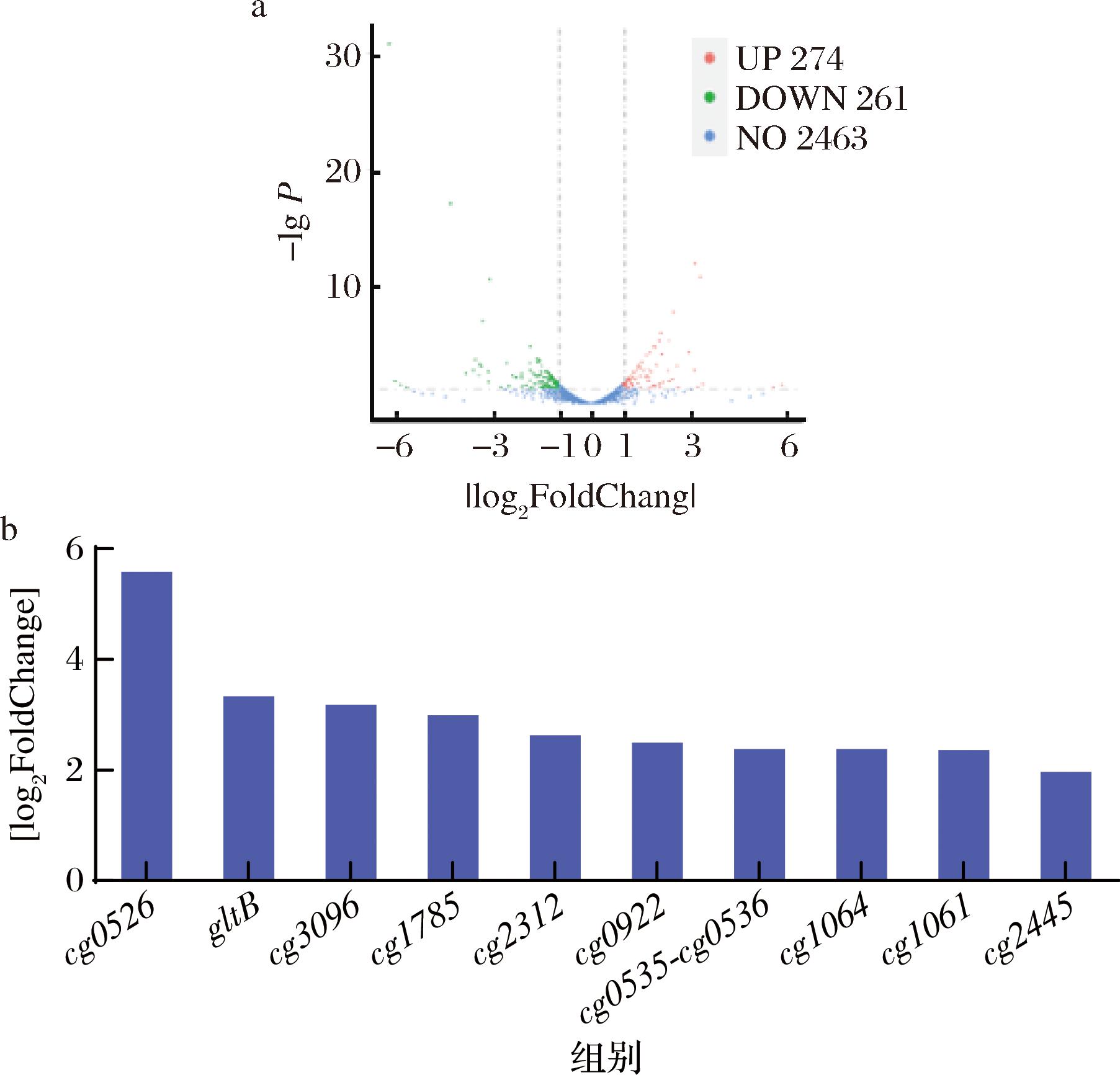
a-cg3096过表达及其亲本菌株的转录组比较分析火山图;b-来自RNA-seq数据的10个代表性上调差异表达基因的表达水平
图6 亲本与cg3096转录组分析
Fig.6 Transcriptome analysis of parents and cg3096
注:|log2Foldchange|≥1且P≤0.05的deg以红色和绿色圆点显示。
3 结论
与传统的酵母提取物相比,玉米浆可以作为一种更具成本效益的营养替代品,提高发酵过程的整体经济效益[10]。在这项研究中,添加玉米浆能够显著促进谷氨酸棒杆菌发酵生产L-高丝氨酸,与5 g/L玉米浆添加浓度相比,将玉米浆质量浓度提升至7.5、10、15 g/L时,L-高丝氨酸产量分别增加了9.0%、26.9%和35.8%。通过比较转录组分析,我们发现cg3096能有效提高L-高丝氨酸的产量。cg3096是一种醛脱氢酶Ald,已被证实能将多种醛催化成相应的羧酸[17-18]。之前的研究表明,Ald在乙醇利用和醛解毒过程中发挥着重要作用[13]。此外,由于玉米浆中的天然底物如香草酸盐的代谢过程中会释放甲醛,因此Ald的甲醛解毒系统对于谷氨酸棒杆菌对玉米浆的高效利用也是必不可少的[13,19]。过表达cg3096可以使得发酵过程中的NADPH水平增加47.8%,这表明cg3096可能是细胞内NADPH的重要来源。L-高丝氨酸的生物合成需要大量的NADPH,因此,加强NADPH的供应是高水平生产L-高丝氨酸的有效策略。在本研究中,首次提供了醛脱氢酶Cg3096通过改善NADPH供应促进L-高丝氨酸高效生产的证据,为谷氨酸棒杆菌代谢物的高水平生产提供了新的视角。
[1] MU Q X, ZHANG S S, MAO X J, et al.Highly efficient production of L-homoserine in Escherichia coli by engineering a redox balance route[J].Metabolic Engineering, 2021, 67:321-329.
[2] ZHANG Y, WEI M H, ZHAO G H, et al.High-level production of L-homoserine using a non-induced, non-auxotrophic Escherichia coli chassis through metabolic engineering[J].Bioresource Technology, 2021, 327:124814.
[3] LIU M, LOU J L, GU J L, et al.Increasing L-homoserine production in Escherichia coli by engineering the central metabolic pathways[J].Journal of Biotechnology, 2020, 314:1-7.
[4] DING C, ZHANG J W, QIAO J F, et al.Identification and engineering efflux transporters for improved L-homoserine production in Escherichia coli[J].Journal of Applied Microbiology, 2023, 134(4):lxad075.
[5] LI N, LI L H, YU S Q, et al.Dual-channel glycolysis balances cofactor supply for L-homoserine biosynthesis in Corynebacterium glutamicum[J].Bioresource Technology, 2023, 369:128473.
[6] KO Y S, KIM J W, LEE J A, et al.Tools and strategies of systems metabolic engineering for the development of microbial cell factories for chemical production[J].Chemical Society Reviews, 2020, 49(14):4615-4636.
[7] CAI M M, ZHAO Z Q, LI X F, et al.Development of a nonauxotrophic L-homoserine hyperproducer in Escherichia coli by systems metabolic engineering[J].Metabolic Engineering, 2022, 73:270-279.
[8] VO T M, PARK S.Metabolic engineering of Escherichia coli W3110 for efficient production of homoserine from glucose[J].Metabolic Engineering, 2022, 73:104-113.
[9] LI N, XU S, DU G C, et al.Efficient production of L-homoserine in Corynebacterium glutamicum ATCC 13032 by redistribution of metabolic flux[J].Biochemical Engineering Journal, 2020, 161:107665.
[10] ZHOU K M, YU J, MA Y H, et al.Corn steep liquor:Green biological resources for bioindustry[J].Applied Biochemistry and Biotechnology, 2022, 194(7):3280-3295.
[11] WAHJUDI S M W, PETRZIK T, OUDENNE F, et al.Unraveling the potential and constraints associated with corn steep liquor as a nutrient source for industrial fermentations[J].Biotechnology Progress, 2023, 39(6):e3386.
[12] HARSHITHA R, ARUNRAJ D R.Real-time quantitative PCR:A tool for absolute and relative quantification[J].Biochemistry and Molecular Biology Education, 2021, 49(5):800-812.
[13] LESSMEIER L, HOEFENER M, WENDISCH V F.Formaldehyde degradation in Corynebacterium glutamicum involves acetaldehyde dehydrogenase and mycothioL-dependent formaldehyde dehydrogenase[J].Microbiology, 2013, 159(Pt 12):2651-2662.
[14] AUCHTER M, ARNDT A, EIKMANNS B J.Dual transcriptional control of the acetaldehyde dehydrogenase gene ald of Corynebacterium glutamicum by RamA and RamB[J].Journal of Biotechnology, 2009, 140(1-2):84-91.
[15] SUN B Y, WANG F Q, ZHAO J, et al.Engineering Escherichia coli for L-homoserine production[J].Journal of Basic Microbiology, 2023, 63(2):168-178.
[16] BRÜSSELER C, SP TH A, SOKOLOWSKY S, et al.Alone at last!-Heterologous expression of a single gene is sufficient for establishing the five-step Weimberg pathway in Corynebacterium glutamicum[J].Metabolic Engineering Communications, 2019, 9:e00090.
TH A, SOKOLOWSKY S, et al.Alone at last!-Heterologous expression of a single gene is sufficient for establishing the five-step Weimberg pathway in Corynebacterium glutamicum[J].Metabolic Engineering Communications, 2019, 9:e00090.
[17] SCHRÖDER J, JOCHMANN N, RODIONOV D A, et al.The zur regulon of Corynebacterium glutamicum ATCC 13032[J].BMC Genomics, 2010, 11:12.
[18] SHORTALL K, DJEGHADER A, MAGNER E, et al.Insights into aldehyde dehydrogenase enzymes:A structural perspective[J].Frontiers in Molecular Biosciences, 2021, 8:659550.
[19] WANG F, HU J H, GUO C, et al.Enhanced laccase production by Trametes versicolor using corn steep liquor as both nitrogen source and inducer[J].Bioresource Technology, 2014, 166:602-605.