糖原是人体及动物细胞的主要能量供给和储存物质[1],目前糖原的提取方法可分体内提取法和体外合成法,其中由于生物体内复杂的合成环境及提取方法的损伤,使得体内提取法提取的糖原具有较宽的分散性以及不均匀的分支结构,而体外酶法合成可以通过对结构和功能进行精确设计,获得结构可控且理化特性稳定的糖原状聚合物(glycogen-like-polymer,GLP)[2]。在对GLP进行化学或生化修饰以获得功能衍生物的过程中,取代基可能位于颗粒的内部或表面[3]。GLP作为用于复杂生物环境的纳米颗粒,需要较多参数才能得到较好控制。包括糖原的分子尺寸和精细结构即链长分布、分支度、分支模式、粒径等,这些要素会影响酶的可及性、糖原的性质和功能[4]。
体外三酶协同法(蔗糖磷酸化酶-α葡聚糖磷酸化酶-分支酶,sucrose phosphorylase-α-glucan phosphorylase-branching enzyme,SP-GP-BE)可以为蔗糖底物合成GLP。然而在复杂的生物环境中,需要对GLP的分子尺寸和结构进行更精细的控制。本团队[5]前期对该法进行了研究,所制备得到的GLP的分子质量整体保持在107 Da数量级[6]。
在目前的国内外研究进展中,以日本格力高健康研究所为代表的研究机构所研制出的分子质量在7×106 Da的GLP可以维持血糖水平,降低血液中胆固醇的水平[7];由于在人体和动物体中,骨细胞的代谢与糖代谢密切相关[8],因此分子质量在5×106 Da的GLP被发现可以有效促进新骨和牙髓的愈合[9];因此基于GLP可开发新型骨愈合天然材料,推动骨愈合领域的跨越式发展;分子质量在5×106~6.5×106 Da的GLP具有一定的抗肿瘤活性[10];分子质量在8.7×106 Da的GLP可以促进促炎细胞因子的表达,进而在一定程度上预防结肠炎[11];分子质量在1.2×106~6×106 Da的GLP可以作为药物递送系统载体和临床诊断标记化学传感器;分子质量在8.7×106 Da的GLP可以抑制户外紫外线导致的人体角质细胞的氧化应激[12];分子质量在3.1×106~6.5×106 Da的GLP可以抑制人表皮角质细胞中活性氧的积累[13]。此外,英国利兹贝克特大学所研制出的分子质量在2×106 Da的GLP可以维持血糖稳态并可以作为细胞水合的关键调节剂[14];中国江南大学生命健康学院所购买的商业化的分子质量在2.5×104~1.0×105 Da的GLP可以作为药物载体和免疫佐剂进行科学研究,其可以增强实体瘤渗透和基因递送效率等[15]。因此亟待进一步通过改进酶法,将GLP的分子质量从107 Da降至106 Da。
针对该问题,本研究引入了本团队前期筛选的一株来源于Thermoproteus uzoniensis的4-α-糖基转移酶(Tu-α-glucanotransferase,TuαGT)通过四酶协同法合成GLP[16]。TuαGT与微生物内的糖代谢,糖原的合成降解密切相关,且具有4种特异性功能,水解、歧化、环化和偶合[16]。其中,水解反应是指将一段较长糖链水解为不同长度的较短糖链;歧化反应是指通过分子间转糖基反应,将从原产物上切下来的一段α-1,4糖链接至其他的链上,这通常会使糖链的长度增加;环化反应是指通过分子内转糖基作用,将一定长度的糖链首尾相连形成环状链的过程;偶合反应为其逆反应[17]。本研究旨在利用TuαGT的歧化作用,通过SP-GP-BE-TuαGT四酶协同反应,通过改变体系中的酶活比例合成了一系列GLP,并对其分子尺寸和精细结构进行表征。
1 材料与方法
1.1 主要材料和仪器
来源于Streptococcus mutans的蔗糖磷酸化酶SP,来源于Aquifex aeolicus VF5的α-葡聚糖磷酸化酶GP,来源于Thermoproteus uzoniensis的4-α-糖基转移酶TuαGT,本实验室保藏菌种。
商业分支酶BE,丹麦诺维信公司;异淀粉酶,爱尔兰Megazyme公司;蛋白胨和酵母浸粉,美国Oxoid公司;卡那霉素(kanamycin,Kana)、氨苄青霉素(ampicillin,Amp)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG),中国上海生工生物工程技术服务有限公司;直链淀粉,英国卡博森斯有限公司;苯酚磷酸二氢钾、钼酸铵、乙酸锌、抗坏血酸、抗坏血酸钠、可溶性淀粉、醋酸钠、二甲基亚砜,国药集团化学试剂有限公司。
DIONEX ICS-5000+SP-5高压离子色谱系统,美国Thermo Fisher科技公司;5424R高速冷冻离心机,德国Eppendorf有限公司;JP 650Y超声波细胞破碎仪,无锡久平仪器有限公司;G180T高压灭菌锅,厦门致微仪器有限公司;SW-CJ-1FD 型单人单面净化工作台,苏州净化工作台设备有限公司;JP-650Y 超声波清洗器,无锡久平仪器有限公司;TS-1000蛋白电泳系统,中国天能有限公司;ZHSY-50V水浴摇床,上海知楚仪器有限公司;MTH-100酶反应器,杭州米欧仪器有限公司;Starter 5000 pH计,美国 Ohaus公司;SPECTRA MAX190光吸收读板机、SPECTRA MAX190酶标仪,美国Molecular Devices公司;DAWN HELEOS Ⅱ 高效尺寸排阻色谱仪-多角度激光光散射-折光检测器,美国Wyatt Technology公司;Avance Ⅲ 400 MHz全数字化核磁共振波谱仪,德国Bruker公司。
1.2 不同分子尺寸和精细结构的GLP的制备
首先制备酶工具。Luria-Bertani(LB)液体培养基的配制,取5 g酵母粉、10 g蛋白胨和10 g NaCl溶解于去离子水中并充分搅拌混匀,调整pH为7.0,定容至1 L;分别灌装至250 mL锥形瓶和2 L锥形瓶中,经121 ℃高温高压灭菌20 min后于室温静置冷却,获得灭菌后的培养基。
种子液培养:取保藏于甘油管中的SP、GP和TuαGT菌液接种于包含相应标准的一定质量浓度的抗生素的LB液体培养基中,于37 ℃及200 r/min条件下恒温摇床恒温培养8~10 h至OD600达到0.1,成功获得不同酶的种子液。其中,SP需添加在质量浓度为100 μg/mL Amp的LB液体培养基中,GP和TuαGT需添加在质量浓度为50 μg/mL Kana的LB液体培养基中。
扩大及发酵培养:将上述种子液按照等体积比的浓度接种至含相应抗生素的LB液体培养基中,置于37 ℃的恒温摇床中以200 r/min的速度恒温培养至OD600达到0.4~0.6;再置于冰水混合浴中冷却15 min停止反应,加入终浓度为0.4 mmol/L的IPTG后迅速置于18 ℃的恒温摇床后以160 r/min的转速下诱导发酵24 h。
酶的分离:将上述诱导发酵液分别置于4 ℃下以8 500 r/min离心20 min后收集菌体,经过20 mmol/L Tris-HCl缓冲液(pH 7.0,含250 mmol/L NaCl溶液)重悬后,在相同条件下离心并重复洗涤菌体。将菌体重新悬浮于该缓冲液中,置于冰水混合浴中超声波破碎15 min(其中脉冲时间为2 s,脉冲间隔为3 s,超声波功率为40%,总功率为650 W)。将破碎后的菌体细胞液置于4 ℃下以8 500 r/min离心20 min弃去破碎的菌体碎片,收集上清液分别获得SP、GP和TuαGT的粗酶提取液。
酶的纯化:采用镍离子金属螯合亲和层析法对带有组氨酸亲和标签的上述粗酶液进行纯化。将镍亲和层析柱分别使用10倍柱体积的乙醇和去离子水进行清洗,使用5倍柱体积的20 mmol/L Tris-HCl缓冲液(pH 7.0,含 250 mmol/L NaCl溶液)平衡,再取10倍柱体积的粗酶液经重力流穿,随后进行2次流穿使酶蛋白尽可能与镍亲和凝胶结合,接着使用5倍柱体积分别包含5、20、200和500 mmol/L咪唑的20 mmol/L Tris-HCl缓冲液(pH 7.0,含250 mmol/L NaCl溶液)进行梯度洗脱并分别收集洗脱液;之后再使用5倍柱体积的20 mmol/L Tris-HCl缓冲液(pH 7.0,含250 mmol/L NaCl溶液)对凝胶柱进行平衡,最后使用10倍柱体积的去离子水和乙醇进行清洗后,使用2倍柱体积的乙醇进行镍凝胶柱的保存,以便下次使用。其中耐热酶GP和TuαGT可先分别置于75和85 ℃的水浴条件下保温30 min,在4 ℃以8 500 r/min离心20 min去除热不稳定的杂蛋白后再取上清液继续按照上述镍亲和层析法的步骤进行纯化。经SDS-PAGE验证得到SP、GP和TuαGT的纯酶液。
酶活力测定:SP的酶活力通过钼蓝比色法测定,蔗糖每分钟产生1 μmol葡萄糖-1-磷酸(glucose-1-phosphate,G-1-P)所需的酶量定义为1个酶活力单位(U);GP的酶活力通过钼酸盐比色法测定,G-1-P每分钟产生1 μmol Pi所需的酶量定义为1个酶活力单位(U),BE的酶活力测定使用碘显色法,直链淀粉-碘复合物的吸光度每分钟下降1%所需的酶量定义为1个酶活力单位(U)经测定并换算为实际合成体系(mL)中分别得到SP为255.60 U/mL,GP为114.15 U/mL,BE为286 398.01 U/mL,TuαGT为11.15 U/mL。
实验方法:将反应底物蔗糖和引物麦芽三糖(G3)以体积比600∶1(即各为2 400 μmol和4 μmol)的比例充分溶解于pH 7.0的磷酸盐复配缓冲液反应缓冲液中(160 mmol/L KH2PO4溶液和240 mmol/L Na2HPO4溶液)(体系为9.558 mL),SP∶GP∶BE的酶比例为1∶1∶400,实际添加量分别为2、2、800 U,而TuαGT分别添加了2~22 U并在55 ℃以500 r/min的条件下充分反应16 h。
反应结束后灭酶,离心,透析2 d,经过薄层色谱法和HPLC检测,冻干得到GLP。样品编号分别记为GLP-0~GLP-11,见表1。
表1 四酶协同法中TuαGT加酶量
Table 1 Volume of TuαGT in the four enzyme synergy method
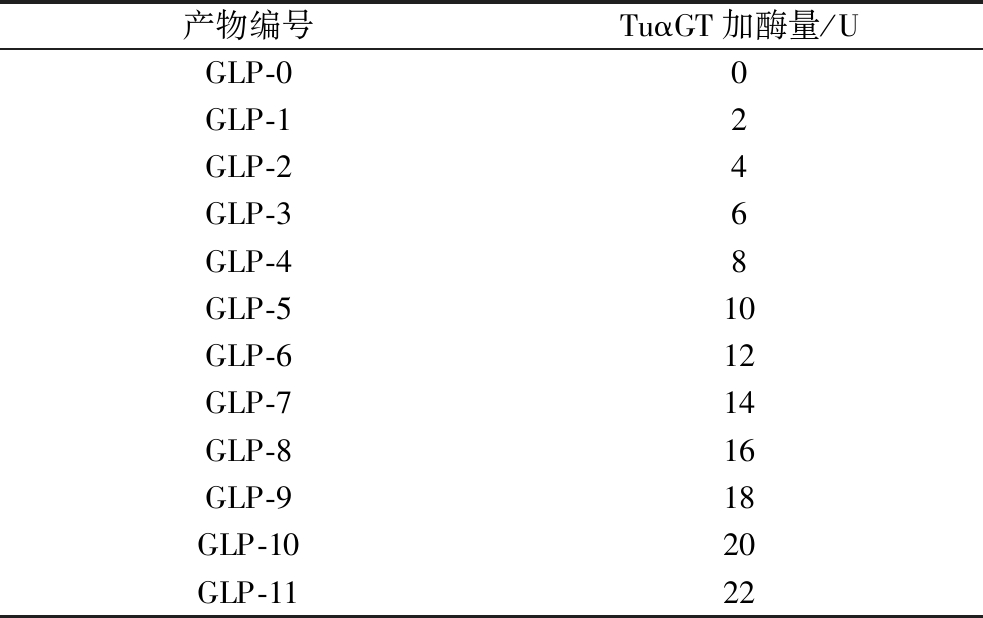
产物编号TuαGT加酶量/UGLP-00GLP-12GLP-24GLP-36GLP-48GLP-510GLP-612GLP-714GLP-816GLP-918GLP-1020GLP-1122
1.3 糖原状聚合物的分子质量检测
使用配有多角度激光检测器和示差检测器的尺寸排阻色谱仪(high pressure size exclusion chromatography-multiangle light scattering-refractive index-system,HPSEC-MALLS-RI)对产物的分子质量及分布进行测定。取样品3 mg,溶解在超纯水中配制3 mg/mL水溶液,涡旋后在沸水浴中加热10 min,置于40 ℃下振荡过夜使其均匀分散。溶解后的样品使用0.22 μm滤膜过滤后使用进样器注入HPSEC系统。色谱柱为Shodex OHpak SB-805 HQ,柱温40 ℃,折光指数增量(dn/dc)0.138。使用Astra软件对分子质量谱图进行分析得到重均分子质量(weight-average molecular weight,Mw)和数均分子质量(number-average molecular weight,Mn)。
1.4 GLP的分支度检测
使用核磁共振氢谱(1H nuclear magnetic resonance,1H NMR)对产物的分支度进行测定。取10 mg样品溶解于1 mL重水中在沸水浴中连续搅拌加热1 h,冻干,复溶并再次冻干。样品重新分散于0.5 mL添加质量分数为0.03% TMSP的重水中,沸水浴中连续搅拌加热1 h后,将溶液转移至内径5 mm的专用核磁管,在60 ℃下保温并对样品进行检测,并将TMSP的参考峰位置的化学位移定义为0 ppm。使用MestRenova软件进行分析,其中分支通过信号峰的积分面积按照公式(1)计算:
分支度![]()
(1)
式中:H1(1,4→6)表示(α1→4,6)连接的葡萄糖残基的1H质子,其相对化学位移为4.98 ppm;H1(m)和H1(n)分别表示链中间和非还原性末端的葡萄糖残基的1H质子,其相对化学位移均为5.38 ppm。
1.5 GLP的链长分布检测
使用高效阴离子交换色谱-脉冲安培检测器(high-performance anion-exchange chromatography with pulsed amperometric detection,HPAEC-PAD)对产物的链长分布进行测定。取4 mg样品溶解于2 mL 50 mmol/L醋酸钠缓冲液(pH 4.5)中,溶液温度平衡至42 ℃后同时加入1 U异淀粉酶和1.8 U普鲁兰酶在42 ℃脱支48 h。反应结束后灭酶离心,使用0.22 μm滤膜过滤。将过滤液注入HPAEC系统中,其中测试温度25 ℃;所用色谱柱为CarboPac PA-200(250 mm×3 mm),流速为0.5 mL/min。所用洗脱液由三部分溶液构成:(A)0.1 mmol/L NaOH与1 mol/L醋酸钠的混合溶液;(B)0.1 mmol/L NaOH溶液;(C)超纯水。梯度洗脱程序:0~50 min,A洗脱液的相对比例为38%;0~40 min B洗脱液的相对比例在4%~40%范围内梯度增加;41~50 min时为4%;剩余体积由C洗脱液补充。所得数据使用Chromeleon 7软件进行分析,并得到聚合度及分布,其中平均链长按照公式(2)计算:
平均链长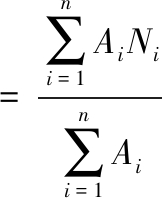
(2)
式中:n,峰数;A,相对峰面积;N,峰i的聚合度。
1.6 GLP的粒径检测
使用动态光散射技术(dynamic light scattering,DLS)对产物的粒径进行测定。样品以10 mg/mL溶解于超纯水中,过0.22 μm微孔滤膜,弃置前5滴样品溶液,置于甲苯检测池中,使用ALV CGS3系统在15°~155°之间进行测量。
1.7 GLP体外酶解测定
使用α-淀粉酶串联淀粉葡萄糖苷酶测定产物的体外酶解性质。首先,样品以10 mg/mL溶解于pH 5.2、浓度为0.2 mol/L乙酸钠缓冲液(包含1 mmol/L CaCl2溶液),在37 ℃下加入终浓度为150 U/mL的α-淀粉酶和80 U/mg的淀粉葡萄糖苷酶反应24 h后终止反应,并使用HPSEC-MALLS-RI分析其分子质量。其次,分别于30、60、90、120、150 min取样,加入9倍体积的无水乙醇,离心收集上清液并使用GOPOD试剂盒测定水解率。
1.8 数据处理
使用Origin 2024软件进行数据拟合、计算及作图处理,所有实验结果均取3次实验数据的平均值。
2 结果与分析
2.1 GLP的分子尺寸
GLP的分子尺寸与其在生物医学等领域的应用密切相关,Mw≤106 Da的GLP具有较好的应用效果[8],因此首先使用HPSEC-MALLS-RI测定关键性指标Mw,图1显示,GLP均呈现双峰分布,其中GLP-0的出峰时间在13~16 min,而GLP-1~GLP-11的出峰时间均在13~18 min,且峰均整体呈现右移趋势,根据高效尺寸排阻色谱的原理,分子尺寸越大的物质越易被洗脱,出峰时间越早,而分子尺寸越小的物质在凝胶色谱柱中的保留时间越短,出峰时间越晚,因此可以较直观的看出当引入TuαGT酶后,GLP产物的Mw均呈现不同幅度的下降趋势。具体的分子质量如表2所示,空白对照组的分子质量为2.20×107 Da,随着TuαGT酶的引入和反应,终产物的分子质量明显降低;GLP-1和GLP-2分别降低至1.22×107和1.09×107 Da,从GLP-3起,分子质量从107 Da骤降至106 Da,并随着TuαGT酶的不断增加,稳定在8.59×106~4.94×106 Da;因此初步获得了在目标区间内的产物。
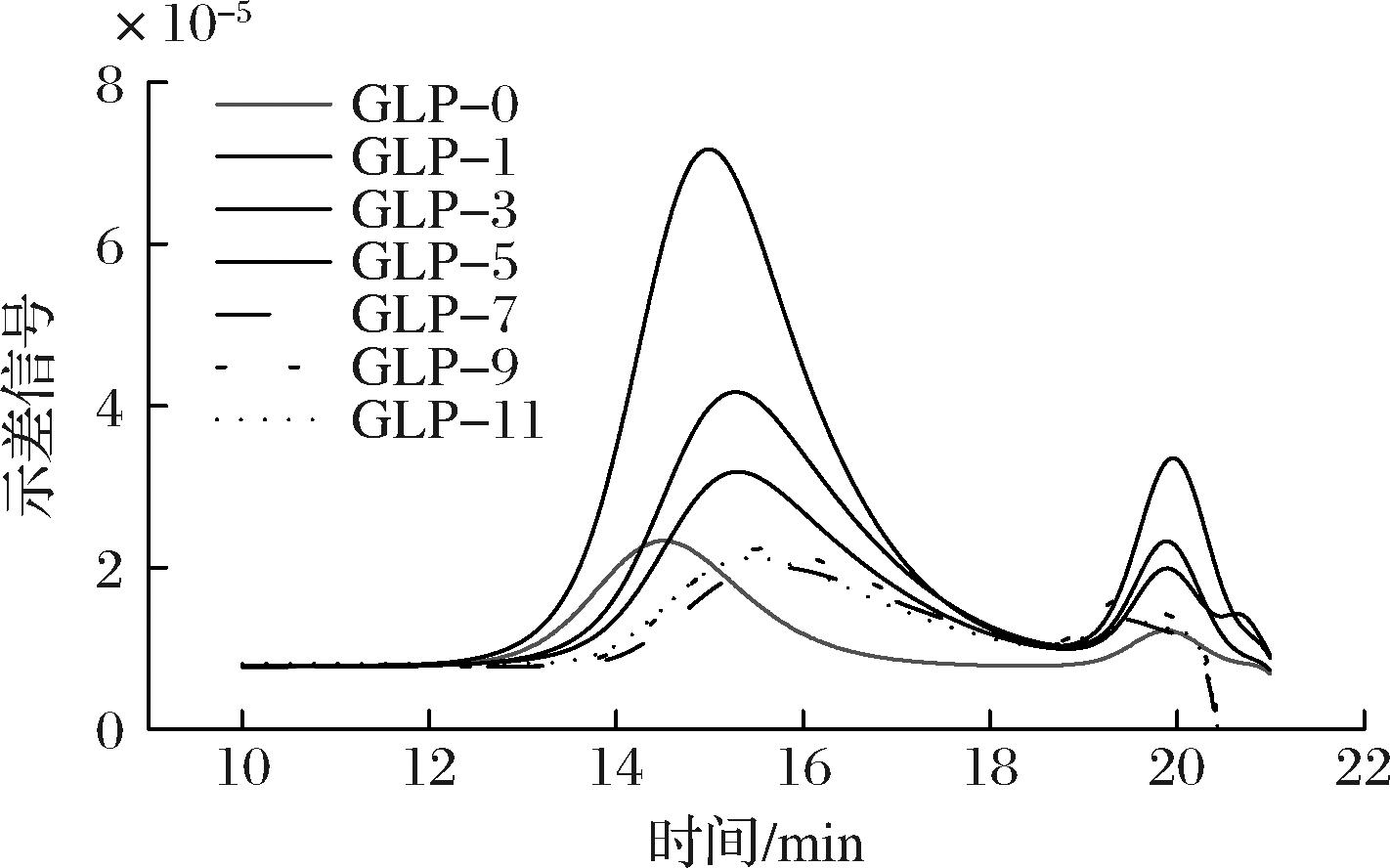
图1 不同酶比例下GLP的分子质量分布图
Fig.1 Molecular weight distributions of GLP under different enzyme ratio
注:实线为 RI 示差检测器信号。
表2 不同酶比例下GLP的分子尺寸
Table 2 Molecular size of GLP under different enzyme ratio
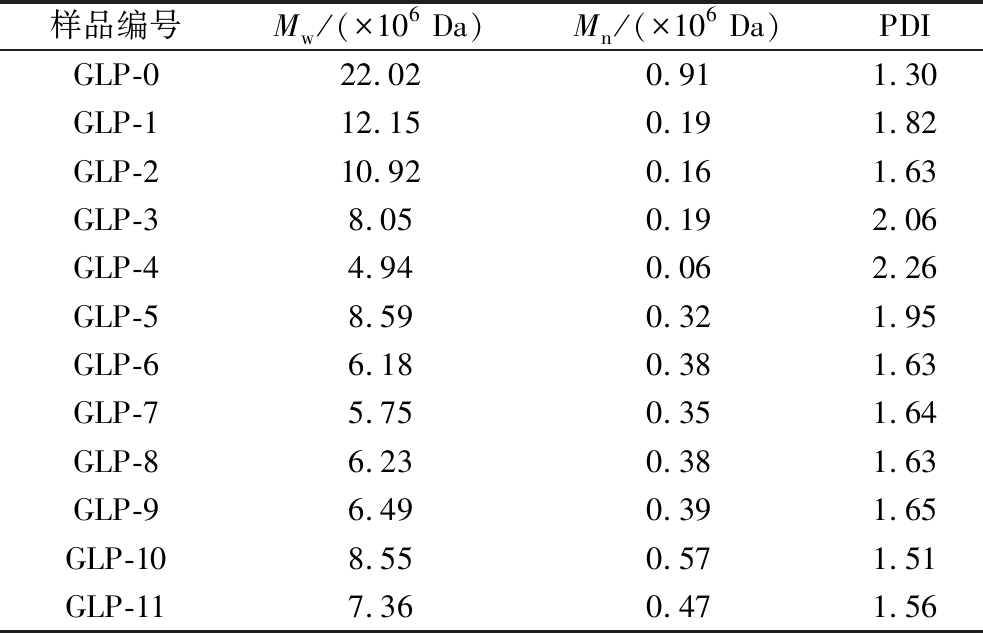
样品编号Mw/(×106 Da)Mn/(×106 Da)PDIGLP-022.020.911.30GLP-112.150.191.82GLP-210.920.161.63GLP-38.050.192.06GLP-44.940.062.26GLP-58.590.321.95GLP-66.180.381.63GLP-75.750.351.64GLP-86.230.381.63GLP-96.490.391.65GLP-108.550.571.51GLP-117.360.471.56
2.2 GLP的分支度
GLP的分支度是表征其结构高度支化的重要指标,SWANSON[18]报道其中α-1,6糖苷键的比例约为7%~10%,因此使用1H NMR测定GLP的分支度,结果如表3所示。
表3 不同酶比例下GLP的分支度
Table 3 The branching degree of GLP under different enzyme ratio
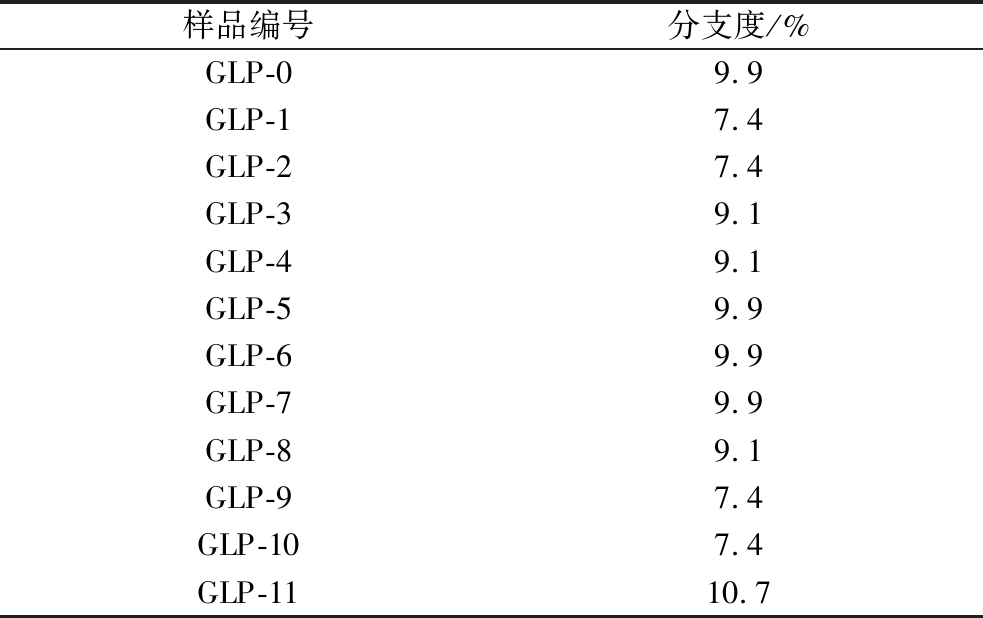
样品编号分支度/%GLP-09.9GLP-17.4GLP-27.4GLP-39.1GLP-49.1GLP-59.9GLP-69.9GLP-79.9GLP-89.1GLP-97.4GLP-107.4GLP-1110.7
本组内之前SP-GP-BE三酶协同法的实验结果显示,GLP的分支度随着反应时间的延长逐渐增加,并最终稳定在9.0%~9.9%[6],且随着Mw的增加不会再继续增加;这可能是由于其延长速率远低于分支速率。据ZHANG等[19]报道,不同酶的比例将通过影响链的延长和分支速率来影响GLP中的分支形成速度进而对最终分支度造成影响。
GLP-0~GLP-11的核磁共振图谱中显示,其分支度保持在7.4%~10.7%,整体较高并在预期范围内,说明SP-GP-BE-TuαGT四酶协同法所制备的低分子质量GLP并不会丧失其高度分支化的性质,保持了较完整的分支结构。
2.3 GLP的链长分布
SP-GP-BE-TuαGT四酶协同法制备出的GLP产物,已通过2.1节中测定其分子尺寸降低至106 Da,通过2.2节测定其分支度在7.4%~10.7%,因此基于上述结果进一步测定GLP的精细结构,首先测定了GLP的链长分布。
使用异淀粉酶和普鲁兰酶将GLP完全脱支后,使用HPAEC-PAD测定GLP的链长分布,结果如表4和图2所示。其中,聚合度是和动力学中表征聚合物的重要参数,依据聚合度DP的大小不同可将链长划分为DP3~12,DP13~24,DP>25。
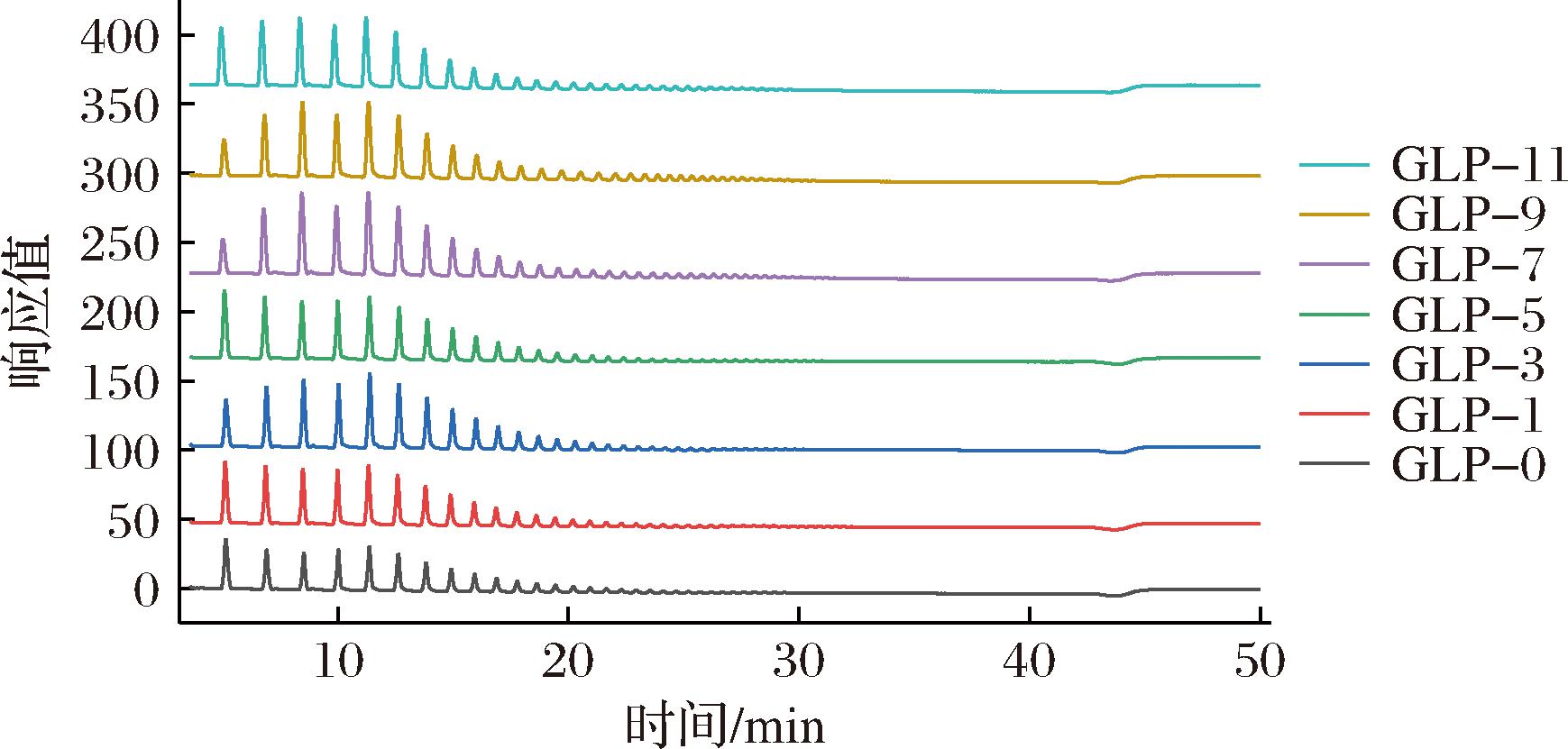
图2 不同酶比例下GLP的链长分布
Fig.2 The chain length distribution of GLP under different enzyme ratio
表4 不同酶比例下GLP的聚合度
Table 4 The degree of polymerization of GLP under different enzyme ratio
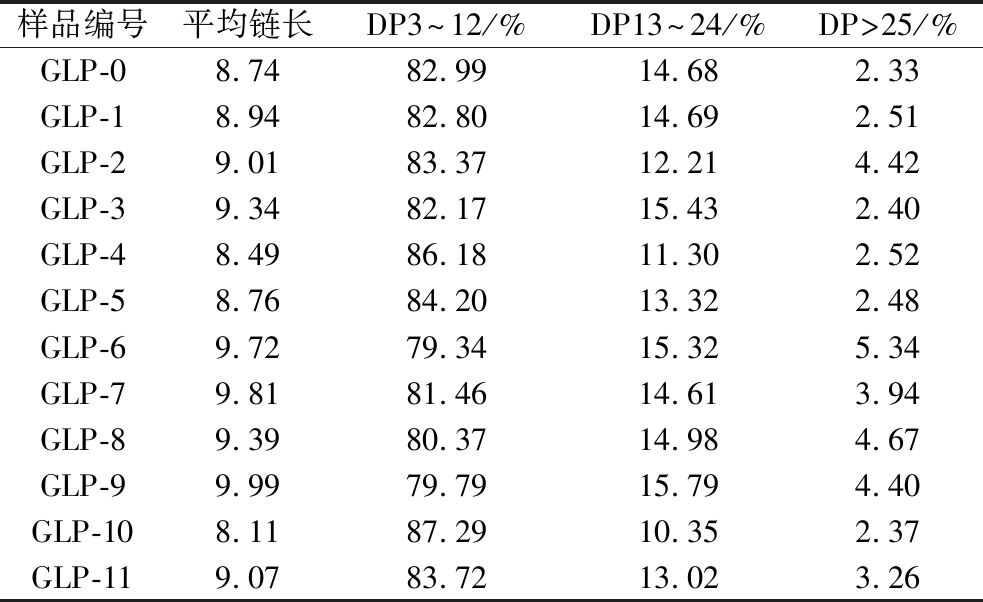
样品编号平均链长DP3~12/%DP13~24/%DP>25/%GLP-08.7482.9914.682.33GLP-18.9482.8014.692.51GLP-29.0183.3712.214.42GLP-39.3482.1715.432.40GLP-48.4986.1811.302.52GLP-58.7684.2013.322.48GLP-69.7279.3415.325.34GLP-79.8181.4614.613.94GLP-89.3980.3714.984.67GLP-99.9979.7915.794.40GLP-108.1187.2910.352.37GLP-119.0783.7213.023.26
GLP的平均链长整体保持在8.11~9.99,在较小的范围内波动;空白对照组GLP-0的平均链长为8.74,而GLP-1~GLP-11整体均高于空白对照组,保持在8.76~9.99的范围内(除GLP-4、GLP-10之外),这可能是由于TuαGT在体系中发挥了歧化作用使得GLP的糖链被延长的结果,而链长增加会进一步使得产物的链长分布变的疏松。
随着体系中TuαGT加酶量的增加,DP3~12的短链占比在79.34%~87.29%、DP13~24的中链占比在10.35%~15.79%、DP>25的长链占比在2.33%~5.34%,表示在GLP合成体系中,短链的比例依然明显较高,这可能是分支酶BE对于底物糖链长度的偏好特异性以及糖原独特的结构和性质所决定的[20]。不同DP的占比比例均有不同程度的变化,且在一个相对较小的范围内波动,说明TuαGT酶的引入会改变GLP的链长分布趋势,产生的波动性可能是由于TuαGT在混合体系中随机发挥水解作用和歧化作用切下一段α-1,4葡聚糖,并将切下来的糖链接至其他的糖链片段上所造成的。DP>25的长链比例无明显提高的现象说明TuαGT可能对于越长的外侧链作用效果越不明显。这可能是由于在反应初期,GP主要发挥延长作用[21],BE则一直持续不断的发挥分支作用,TuαGT主要发挥歧化作用;当反应后期较为充分时,GP可能反向发挥磷酸解作用,BE继续发挥分支作用并达到了分支极限[22],TuαGT发挥歧化作用可能将副产物上的糖链接支到主产物上,使分子质量在降低到106 Da时逐渐保持平衡。
2.4 GLP的粒径
GLP的粒径也是表征其精细结构的指标,且据TAN等[1]报道其一般在10~30 nm之间,因此采用DLS测定GLP的粒径,结果如表5所示,空白对照组GLP-0的z-均回转半径(z-average radius of gyration,Rz)为30.0 nm,而GLP-1~GLP-11的Rz均降低,整体保持在28.0~19.3 nm的范围内,既在预期目标范围内,也说明TuαGT酶的引入会以不同幅度降低GLP的z均回转半径,这也与之前的分子质量变化趋势相一致[23]。
表5 不同酶比例下GLP的粒径
Table 5 The Rz of GLP under different enzyme ratio
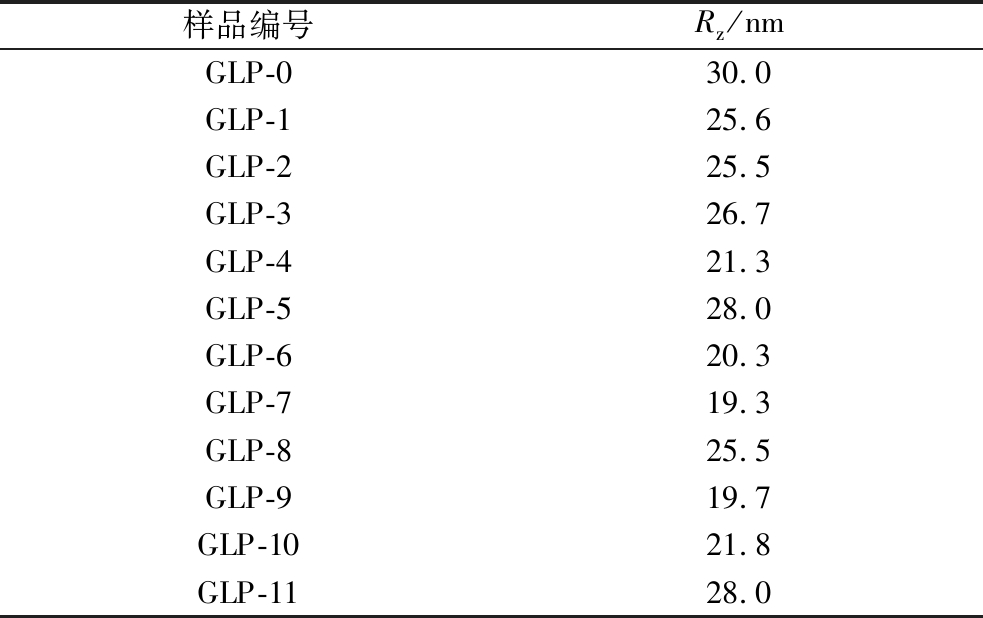
样品编号Rz/nmGLP-030.0GLP-125.6GLP-225.5GLP-326.7 GLP-421.3 GLP-528.0GLP-620.3GLP-719.3GLP-825.5GLP-919.7GLP-1021.8 GLP-1128.0
2.5 GLP的抗酶解性
基于GLP在生物医学等领域的应用,测定了其抗酶解性。首先,经过24 h双酶体外酶解后,使用HPSEC-MALLS-RI测定产物分子质量,高效尺寸排阻色谱仪的多角度激光检测器和示差检测器未明显出峰,说明水解产物主要由葡萄糖和大分子糊精组成,其分子质量较低,未达到检测器下限。而双酶水解率如图3所示,GLP的双酶水解率均随着反应时间的增加而增加,在酶解达到150 min时水解率在56.81%~60.22%,抗酶解率在39.78%~43.19%。随着TuαGT加酶量的不断增加,GLP的水解率整体呈现增加趋势,这可能是由于TuαGT的水解作用和歧化作用更强[24],导致GLP上的糖链分布更加疏松,因此抗酶解性下降;而当GLP的Mw处于较低水平时,其酶解率较高。
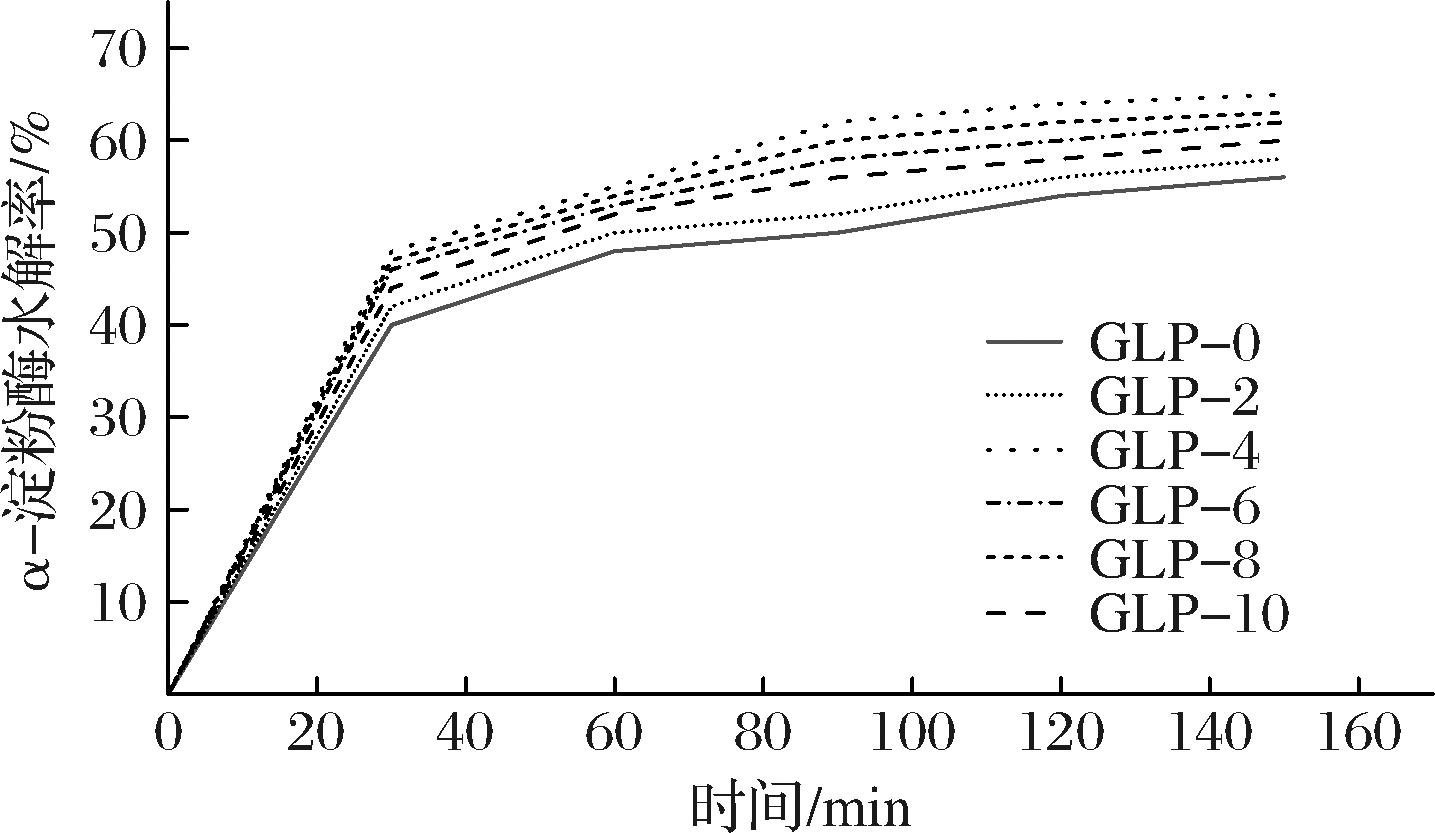
图3 不同酶比例下GLP的α-淀粉酶和淀粉葡糖苷酶水解率
Fig.3 Degree of α-amylase and amyloglucosidase hydrolysis of GLP under different enzyme ratio
2.6 四酶协同的反应机制
综上,基于对SP-GP-BE-TuαGT四酶协同反应体系中反应要素TuαGT加酶量的探究,绘制了如图4所示的机制图。首先,原SP-GP-BE三酶协同反应机制可能为底物蔗糖和引物麦芽三糖保持恒定比例,在蔗糖磷酸化酶SP和α-葡糖基磷酸化酶GP的共同作用下逐渐伸长形成长的糖链;当链的长度达到分支酶BE作用的最优底物长度时,BE就催化该长链断裂为短链,并以α-1,6分支键的形式,将所得短链转移并连接至核心分支葡聚糖上,从而使得分支葡聚糖的平均相对分子质量、短链比例及含量以及分支度持续增加。在合成过程中,随着BE的分支作用,GLP的分子尺寸均匀性增加、分支逐渐变短直至BE无法结合从而趋于平衡。随着分支数量的增加和底物的不断消耗,链延长速率逐渐降低,分支速率逐渐受到限制,分支度趋于稳定,且GP可以在反应过程中同时发挥可逆的磷酸解作用,最终达到平均相对分子质量不再继续增长且保持相对稳定和均匀的状态,且该GLP核心相较于外围具有更高的分支密度。
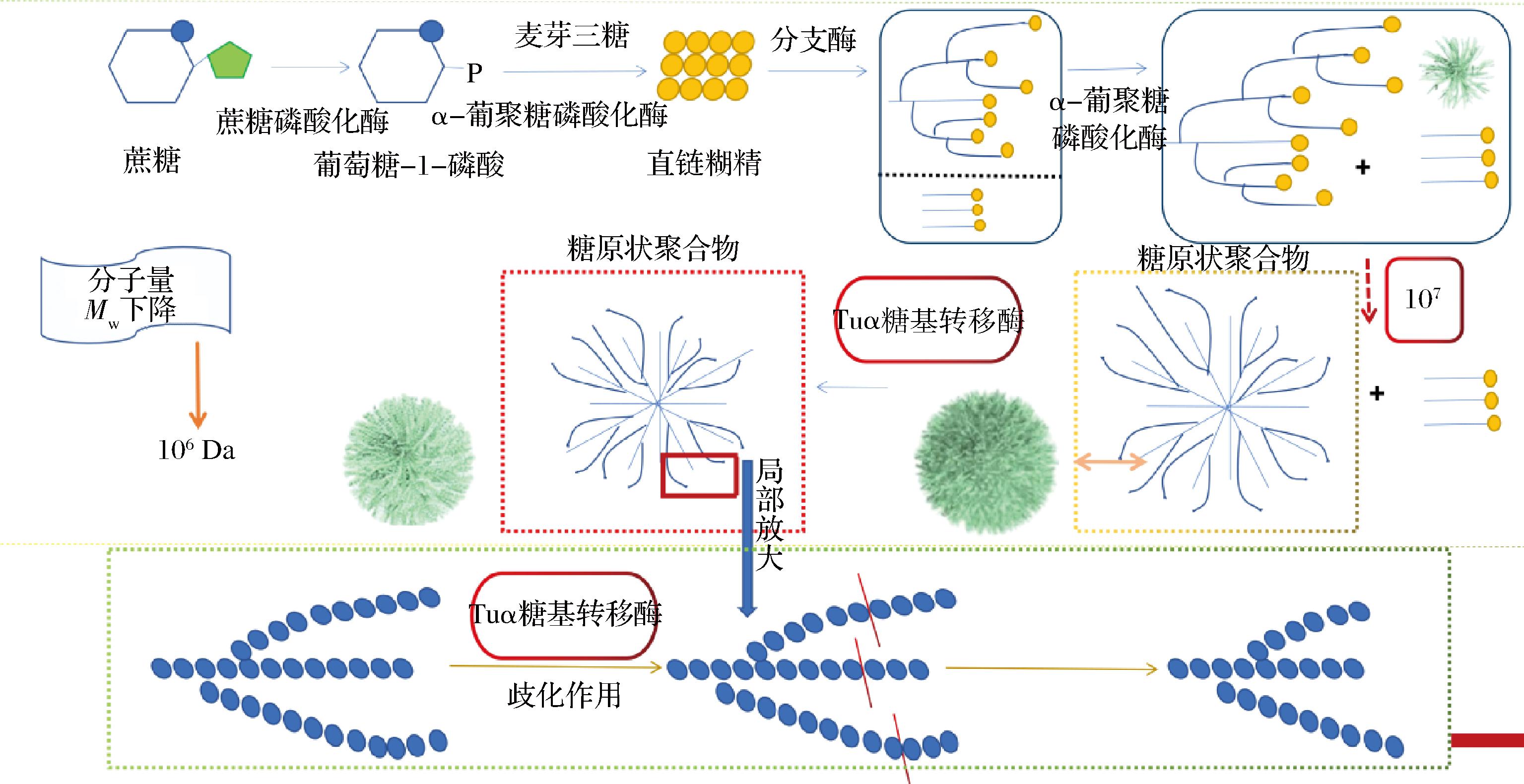
图4 SP-GP-BE-TuαGT四酶协同机制图
Fig.4 The mechanism diagram of the SP-GP-BE-TuαGT enzyme synergy reaction
当引入TuαGT酶后,四酶协同制备GLP的模式可能发生了变化。在GLP的形成过程中,当三酶协同反应将引物麦芽三糖的非还原性末端延长至GLP的核心分支密度接近于极限值时,TuαGT酶可通过发挥其水解作用和歧化作用催化分子内和分子间的转糖基作用将GLP的外侧分支链有选择性的绕过分支点并从中间区域的α-1,4糖苷键切开,且随着TuαGT加酶量的增加,酶的可及性增强,作用效果更显著,因此GLP的糖链减少、整体分子质量减小、平均链长增加、粒径减小,其中Mw和z-均回转半径Rz最终趋于平缓,所得GLP的Mw最终稳定在106 Da。
3 结论
本研究通过SP-GP-BE-TuαGT四酶协同法制备出新的糖原状-聚合物GLP,通过控制SP-GP-BE和TuαGT的酶活比例合成了一系列具有不同分子尺寸和精细结构的GLP-0~GLP-11,结果为Mw从2.20×107 Da降低到8.59×106~4.94×106 Da,平均链长在8.11~9.99,分支度在7.4%~10.7%,粒径Rz在19.3~28.0 nm,抗酶解率在39.78%~43.19%,为糖原状-聚合物GLP的体外酶法合成提供了新思路,也增加了在生物医疗等领域的应用潜力。
[1] TAN X L, SULLIVAN M A, NADA S S, et al.Proteomic investigation of the binding agent between liver glycogen β particles[J].ACS Omega, 2018, 3(4):3640-3645.
[2] KAJIURA H, TAKATA H, AKIYAMA T, et al.In vitro synthesis of glycogen:The structure, properties, and physiological function of enzymatically-synthesized glycogen[J].Biologia, 2011, 66(3):387-394.
[3] TAKATA H, KAJIURA H, FURUYASHIKI T, et al.Fine structural properties of natural and synthetic glycogens[J].Carbohydrate Research, 2009, 344(5):654-659.
[4] KAJIURA H, KAKUTANI R, AKIYAMA T, et al.A novel enzymatic process for glycogen production[J].Biocatalysis and Biotransformation, 2008, 26(1-2):133-140.
[5] JIN Z Y, BAI Y X, LIU J L.Methods of synthesizing sugar polymers with different compactness in vitro: China,CN113481261A[P]. 2021-10-08.
[6] LIU J L, WANG Y L, LI X X, et al.Effect of starch primers on the fine structure of enzymatically synthesized glycogen-like glucan[J].Journal of Agricultural and Food Chemistry, 2022, 70(20):6202-6212.
[7] FURUYASHIKI T, OGAWA R, NAKAYAMA Y, et al.Effects of enzymatically synthesized glycogen on lipid metabolism in diet induced obese mice[J].Food Science and Technology Research, 2018, 24(1):119-127.
[8] IDA-YONEMOCHI H, NAKAGAWA E, TAKATA H, et al.Extracellular enzymatically synthesized glycogen promotes osteogenesis by activating osteoblast differentiation via Akt/GSK-3β signaling pathway[J].Journal of Cellular Physiology, 2019, 234(8):13602-13616.
[9] QUISPE-SALCEDO A, IDA-YONEMOCHI H, OHSHIMA H.The effects of enzymatically synthesized glycogen on the pulpal healing process of extracted teeth following intentionally delayed replantation in mice[J].Journal of Oral Biosciences, 2015, 57(2):124-130.
[10] RYOYAMA K, KIDACHI Y, YAMAGUCHI H, et al.Anti-tumor activity of an enzymatically synthesized α-1,6 branched α-1,4-glucan, glycogen[J].Bioscience, Biotechnology, and Biochemistry, 2004, 68(11):2332-2340.
[11] BESFORD Q A, WOJNILOWICZ M, SUMA T, et al.Lactosylated glycogen nanoparticles for targeting prostate cancer cells[J].ACS Applied Materials &Interfaces, 2017, 9(20):16869-16879.
[12] KITAKAZE T, YOSHIOKA Y, FURUYASHIKI T, et al.Enzymatically synthesized glycogen protects inflammation induced by urban particulate matter in normal human epidermal keratinocytes[J].Journal of Clinical Biochemistry and Nutrition, 2020, 67(1):29-35.
[13] FURUYASHIKI T, YATUSHASHI H, KAMASAKA H.Bioglycogen has moisturizing and anti-UV effects on human skin[J].SOFW Journal:Internationales Journal Fur Angewandte Wissenschaft, 2017, 143(3).
[14] KING R F G J, JONES B, O’HARA J P.The availability of water associated with glycogen during dehydration:A reservoir or raindrop?[J].European Journal of Applied Physiology, 2018, 118(2):283-290.
[15] 韩玉宁. 基于糖原的靶向性纳米抗肿瘤药物载体的研究[D].无锡:江南大学, 2020.
HAN Y N.Study on targeted nano-scale anti-tumor drug carrier based on glycogen[D].Wuxi:Jiangnan University, 2020.
[16] 范旭瑶. 4αGT和AS双酶制备增强型热可逆淀粉凝胶的机制研究[D].无锡:江南大学, 2022.
FAN X Y.Study on the mechanism of preparation of enhanced thermoreversible starch gel by 4αGT and AS[D].Wuxi:Jiangnan University, 2022.
[17] 李雯秀. 大环糊精的酶法制备及其对淀粉糊化—回生行为的影响研究[D].无锡:江南大学, 2023.
LI W X.Enzymatic preparation of macrocyclodextrin and its effect on starch gelatinization-retrogradation behavior[D].Wuxi:Jiangnan University, 2023.
[18] SWANSON R A.A thermodynamic function of glycogen in brain and muscle[J].Progress in Neurobiology, 2020, 189:101787.
[19] ZHANG P, NADA S S, TAN X L, et al.Exploring glycogen biosynthesis through Monte Carlo simulation[J].International Journal of Biological Macromolecules, 2018, 116:264-271.
[20] BESFORD Q A, CAVALIERI F, CARUSO F.Glycogen as a building block for advanced biological materials[J].Advanced Materials, 2020, 32(18):e1904625.
[21] GRIMAUD F, LANCELON-PIN C, ROLLAND-SABATÉ A, et al.In vitro synthesis of hyperbranched α-glucans using a biomimetic enzymatic toolbox[J].Biomacromolecules, 2013, 14(2):438-447.
[22] KAGEYAMA A, YANASE M, YUGUCHI Y.Structural characterization of enzymatically synthesized glucan dendrimers[J].Carbohydrate Polymers, 2019, 204:104-110.
[23] KAJIURA H, TAKATA H, KURIKI T, et al.Structure and solution properties of enzymatically synthesized glycogen[J].Carbohydrate Research, 2010, 345(6):817-824.
[24] WANG Y, LI X X, JI H Y, et al.Thermophilic 4-α-glucanotransferase from Thermoproteus uzoniensis retards the long-term retrogradation but maintains the short-term gelation strength of tapioca starch[J].Journal of Agricultural and Food Chemistry, 2020, 68(20):5658-5667.