高温大曲是酱香型白酒主体香气的来源之一[1],在酿造过程中起着提供菌系、酶系和物系的作用,赋予酒体丰满的香气和郁人的口感,甚至起着决定风格的重要作用[2]。因此,高温大曲质量的好坏,对酱香型白酒的出酒率、风格、质量影响举足轻重。酱香型白酒或高温大曲生产企业的制曲工艺及参数存在一定的差异,均遵循润麦、粉碎、母曲添加、加水拌料、曲坯成型、入仓发酵、翻曲、拆曲、储存等工序。因传统高温大曲的制作工艺复杂、劳动强度大及制曲工人的个体主观判断差异,导致大曲质量不稳定,酱香型白酒生产企业及高温大曲生产企业为提质增效,对高温大曲的机械化和自动化做了一定的探索,目前仅实现了原料进仓、润粮、粉碎、母曲添加、加水拌料、曲坯成型的机械化控制[3]。因传统高温大曲堆积发酵过程中需要大量的稻草隔离曲药以防止黏连并起到保温、保湿的作用,在机械化制曲过程中稻草的替代物及替代方式还未找到,高温大曲在堆积发酵过程难以实现机械化安曲、翻曲、拆曲及过程管控。目前,贵州国台酒业初步探索了高温大曲堆积发酵自动化[4],研究表明稻草在高温大曲发酵过程具有接种的作用,但其对高温大曲微生物的组成并非起决定性的影响,决定性的影响主要来源于母曲、原料和制曲条件及环境。其次,传统高温大曲与控温控湿曲房的大曲共同拥有多种优势微生物,但比例差异较大。通过改变高温大曲堆积发酵方式提高机械化大曲质量的研究仍相对较少。
本研究以传统高温大曲生产工艺参数为基础,对比传统高温大曲和以中高温大曲曲架为发酵容器的高温大曲的质量差异来判断架式高温大曲发酵的可行性。基于高温大曲理化指标、风味物质含量、功能微生物结构等多维度,探究中高温大曲曲架用于高温大曲发酵的可行性,为实现机械化高温制曲做技术储备,推动高温大曲自动化生产。
1 材料与方法
1.1 材料与试剂
小麦,本地市售;曲架,泸州市某公司制。
NaOH、HCl、无水葡萄糖、酒石酸钾钠、碘、KI、次甲基蓝、CuSO4、CuSO4·5H2O、可溶性淀粉、重铬酸钾、氯化钴、铬黑T、冰乙酸、无水乙酸、无水乙醇、福林试剂、H2SO4、Na2CO3、三氯乙酸、乳酸、乳酸钠、酪蛋白、L-酪氨酸、NaH2PO4、Na2HPO4等(均为分析纯),聚合化工有限公司;己酸、己酸乙酯、2-辛醇(均为色谱纯),Sigma-Aldrich公司。
1.2 仪器与设备
DHG-9245A烘箱,上海一恒科学仪器有限公司;MLS-375L高压蒸汽灭菌器,日本Panasonic公司;5804R高速冷冻离心机,德国艾本德公司;SP-756P紫外可见分光光度计,上海屹谱仪器有限公司;SCQ-5201A数控定时超声波清洗机,上海声彦超声波仪器有限公司;DL-1电炉,北京中兴伟业仪器有限公司;GC/MS-QP2020气相色谱质谱联用仪、2010PLUS气相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 制曲
采用传统高温大曲制曲工艺制备机械化高温大曲。机械压制曲坯后,将曲坯分别放入3间相邻发酵房进行堆积发酵。发酵房一采用传统高温大曲横三竖三的堆积发酵工艺,为传统组,样品以CT表示;发酵房二为中高温大曲曲架堆积发酵工艺A,样品以DC表示;发酵房三为中高温大曲曲架堆积发酵工艺B,样品以CL表示。工艺A和工艺B的主要区于所采用的保温保湿措施和相应的材料不同。
1.3.2 取样
高温大曲发酵结束后,分别将3种不同堆积发酵方式的曲药转移至库房贮藏6个月,在库房采用五点取样法从曲堆不同位置分别采集白曲及黄曲成品高温大曲,将样品分别进行粉碎后混合均匀,各取2份密封储存在无菌自封袋中,每份500 g,一份存于-80 ℃用于微生物检测,一份存于-20 ℃用于理化指标和风味检测。曲药样品编号如表1所示。
表1 不同堆积发酵方式高温大曲样品编号
Table 1 Number of high-temperature Daqu produced by different fermentation methods
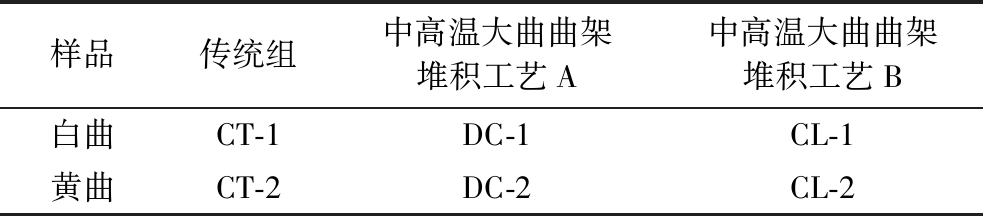
样品传统组中高温大曲曲架堆积工艺A中高温大曲曲架堆积工艺B白曲CT-1DC-1CL-1黄曲CT-2DC-2CL-2
1.3.3 理化指标的检测
大曲样品的水分、酸度、淀粉、糖化力、液化力、发酵力、酯化力均参考QB/T 4257—2011《酿酒大曲通用分析方法》中的步骤;还原糖和酸性蛋白酶活力的测定:使用斐林试剂法和蛋白酶活力测定方法[5]。
1.3.4 大曲微生物多样性检测
称取20 g曲粉,用无菌取样袋密封后,将样品送往上海派森诺生物科技股份有限公司进行微生物多样性检测,测序数据于派森诺基因云平台(https://www.genescloud.cn)进行处理。
1.3.5 大曲风味物质分析
采用顶空固相微萃取法[6]结合GC-MS测定高温大曲中的挥发性物质含量。
1.3.6 数据分析方法
大曲的理化指标用SPSS 23进行显著性分析。用Origin Pro 2021作柱形图。结果用“平均值±标准偏差”的形式表示。用Origin Pro 2021绘制样本组间微生物群落差异热图。
2 结果与分析
2.1 不同堆积发酵方式高温大曲的理化特性及风味分析
2.1.1 不同堆积发酵方式高温大曲的理化指标分析
不同堆积发酵方式下大曲的水分、还原糖、酸度和淀粉含量如图1所示。结果表明,大曲的含水量在9%左右,其中DC组含水量最低,与其余2组差异明显(P<0.05)。CT、DC和CL组内白曲和黄曲的含水量差异不明显。不同堆积发酵方式下黄曲还原糖含量均高于白曲,其中CL组内白曲与黄曲还原糖含量差异显著(P<0.05)。在发酵过程中,一般曲堆表层及四周的曲块水分散失较快,分解代谢反应缓慢,易产生白曲,而位于曲堆内部的曲块水分散失较慢,微生物分解代谢、褐变反应及美拉德反应较为旺盛,易产生黄曲,这可能也是导致黄曲中的还原糖含量高于白曲的原因。由于黄曲发酵过程中微生物分解代谢旺盛,细菌微生物代谢产酸较多[7],因此,不同堆积发酵方式下黄曲的酸度均高于白曲(P<0.05)。大曲淀粉含量在60%左右,DC组淀粉含量最高,显著高于CT组和CL组(P<0.05),淀粉含量的差异可能与产淀粉酶微生物的丰度及微生物代谢活力差异有关。
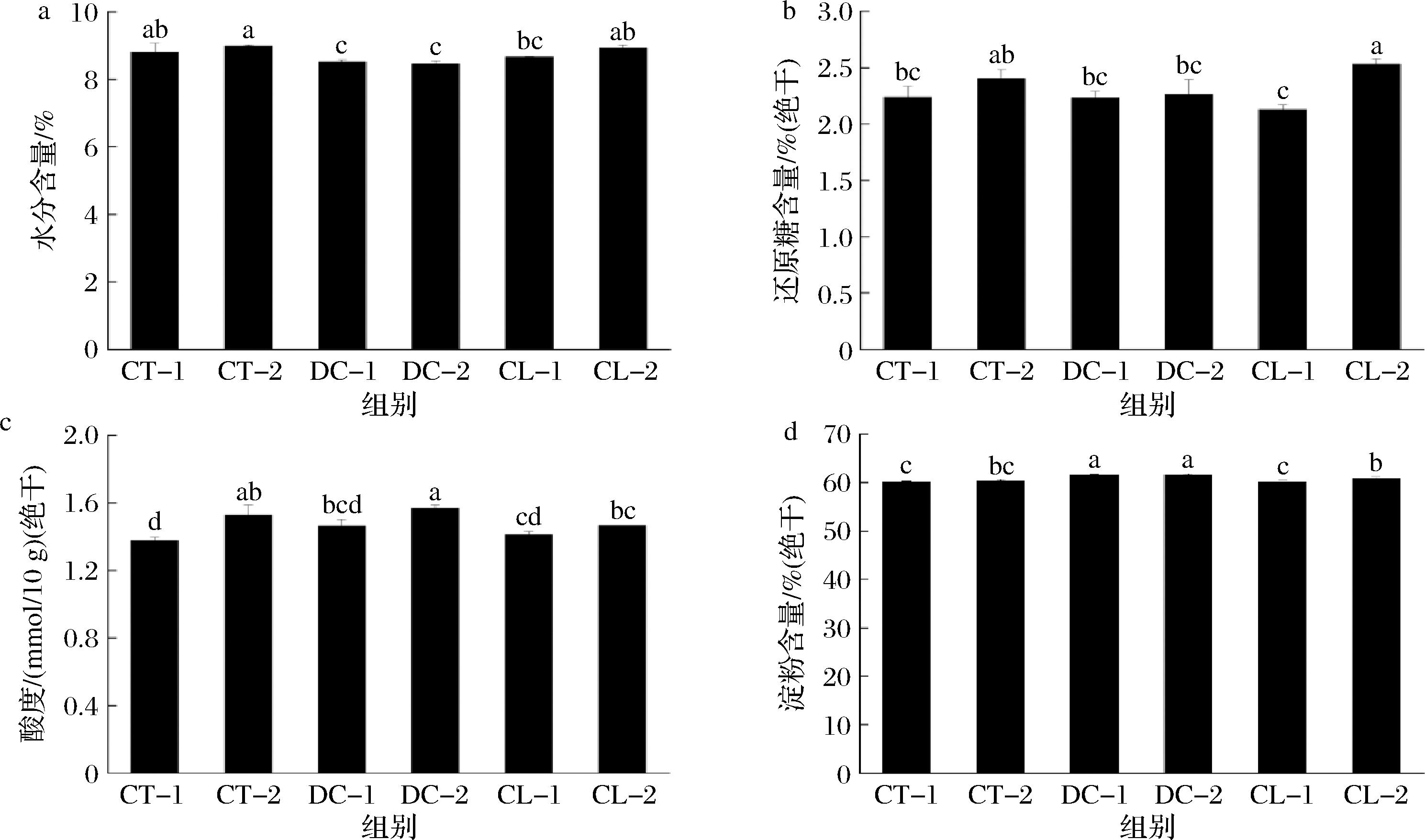
a-水分含量;b-还原糖含量;c-酸度;d-淀粉含量
图1 不同堆积发酵方式大曲的理化指标
Fig.1 Physiochemical indices of Daqu samples under different fermentation methods
注:不同小写字母代表差异显著(P<0.05)(下同)。
2.1.2 不同堆积发酵方式高温大曲的酶活力分析
糖化力、发酵力、液化力、酯化力和酸性蛋白酶活力可初步用于评价曲药的质量,其在不同堆积发酵方式大曲中的指标如图2所示。结果表明,CT-1的糖化力为(170.402±2.449) U,显著高于其他大曲样品(P<0.05),DC组大曲的糖化能力最弱,尤其是DC-2的糖化力最低(100.423±0.748) U,这可能是因为DC组所采用的保温保湿措施对其微生物群落结构产生了影响,微生物合成的糖化酶较少。CT-2和CL-2的液化力较高分别为(0.078±0.004) U和(0.076±0.004) U,而DC-1、DC-2和CL-1的液化力较低。CT-1的发酵力最高,为(0.112±0.002) U,CL-1和CL-2的最低,堆积发酵工艺B条件下曲坯发酵温度相对更高,不利于酵母菌等产酯化酶微生物的生长,导致CL组整体的酯化力偏低。此外,CT-1还表现出高酯化力和酸性蛋白酶活力,分别为(198.732±1.909)和(25.535±0.577) U。CT-2的酯化能力最低,DC-1的酸性蛋白酶活力最低。总体而言,白曲的糖化力和酯化力高于黄曲,其余酶活力无明显规律。传统堆积方式曲药的酶活力高于曲架堆积发酵方式曲药。高温大曲通常以糖化力为限定酶活力指标[8],曲架堆积发酵方式B曲药的糖化力和液化力指标更接近传统堆积方式曲药,表明其发酵效果更接近传统堆积发酵方式。

a-糖化力;b-液化力;c-发酵力;d-酯化力;e-酸性蛋白酶活力
图2 不同堆积发酵方式大曲的酶活力
Fig.2 Enzymatic activities of Daqu samples under different fermentation methods
由图1和图2可知,各组大曲理化指标相差不大,表明各大曲微生物总体代谢水平相当。不同堆积发酵方式大曲的酶活性相差较大,可能不同堆积发酵方式影响大曲功能微生物的种类及丰度,不同功能微生物合成的功能酶存在差异,导致各组大曲的酶活力存在差异。
2.1.3 不同堆积发酵方式高温大曲的风味物质分析
高温大曲在酱香型白酒发酵中具有投粮、提供菌源、糖化发酵和生香的作用。经过6个月的贮藏,大曲中的各种微生物和风味物质不断演替而趋于平衡稳定,大曲中的风味物质经酒醅发酵代谢、蒸馏后,对白酒的风格质量起到显著影响[9]。因此,分析大曲风味物质不仅利于判断曲药的质量,也利于对白酒中的风味物质进行溯源。
不同堆积发酵方式高温大曲中风味物质种类(VIP>1)和含量如图3所示。结果表明,CT-1~CL-2的6种大曲中分别检出27、29、28、29、29、27种风味物质,其中CT-2、DC-2、CL-1的种类最多,DC-1次之,CT-1和CT-2的最少,可能与大曲中功能微生物的多样性差异和整体发酵代谢有关。风味物质含量方面,CL-1和CL-2的风味物质含量较高,CT-1、CT-2、DC-1和DC-2的风味物质含量相近,可能曲架堆积发酵方式B更有利于微生物代谢产香。从白曲和黄曲角度分析,大曲风味物质的含量均为CL>DC>CT。
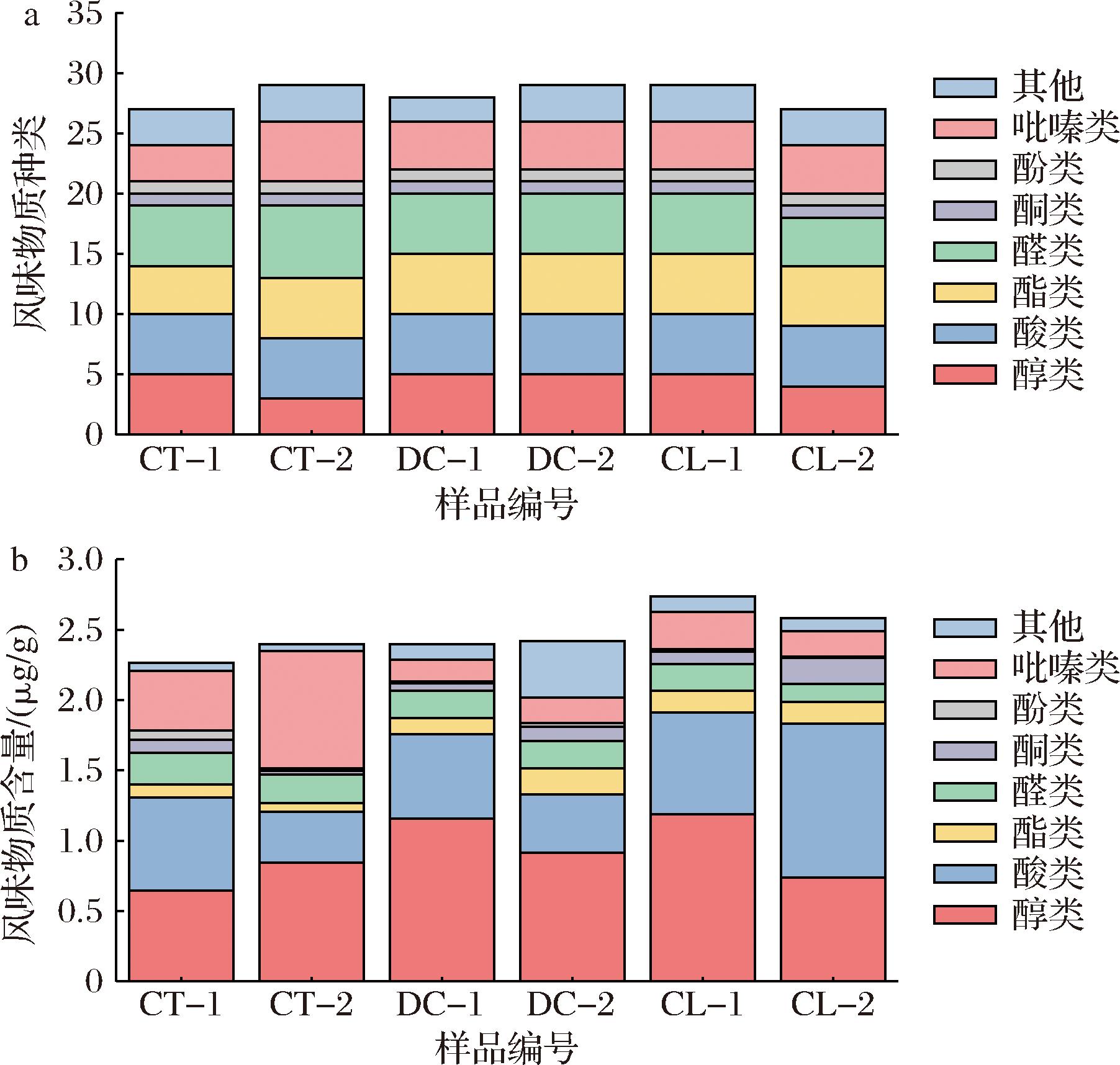
a-风味物质种类;b-风味物质含量
图3 不同堆积发酵方式高温大曲的风味物质种类及含量
Fig.3 Types and contents of flavor compounds in Daqu samples under different fermentation methods
大曲的风味物质主要通过微生物代谢合成,微生物群落结构相似的大曲中风味物质含量可能相近。如图3所示,醇类、酸类、吡嗪类和醛类为高温大曲中优势风味物质。如增强出版附表1(http://doi.org/10.13995/j.cnki.11-1802/ts.039154)所示,大曲中醇类物质含量最高,主要为苯乙醇、异戊醇、正己醇和蘑菇醇,醇类物质主要源于酵母菌在有氧条件下转化糖类、厌氧条件下转化氨基酸,或酵母菌主导的相应醛类物质的还原反应生成[10]。
同时,醇类能够作为酯化反应的前体物质,对白酒具有一定的增香作用。大曲中的主要酸类为异戊酸、异丁酸、己酸和4-甲基戊酸,可作为酯类化合物合成的前体物质,如醋酸菌将葡萄糖和乙醇氧化为乙酸,乙酸与其他醇类物质反应生成酯类物质[11]。大曲中的主要吡嗪类为四甲基吡嗪、三甲基吡嗪和2,5-二甲基吡嗪,吡嗪类物质具有烤香、坚果香等香味特征,是酱香型白酒中重要的香味物质,也是白酒的健康因子,主要由微生物代谢和氨基与羰基化合物间的美拉德反应合成。大曲中的主要醛类为壬醛、苯乙醛、2-吡咯甲醛和苯甲醛,醛类物质的沸点低且易挥发,具有提香和增加酒体喷香的作用,醛类含量高的酒也可作为调味酒使用[12]。2-辛酮为主要的酮类物质,使大曲具有蘑菇、土壤的气息[13],且曲架组中的含量高于传统组。
2.2 不同堆积发酵方式高温大曲的微生物群落分析
2.2.1 不同堆积发酵方式高温大曲细菌群落结构
不同堆积发酵方式大曲细菌群落组成如图4所示(<1%合并为others),共检出19种优势细菌,且样品间细菌群落组成差异明显。经过发酵和6个月的贮藏,高温大曲中的优势细菌主要为枝芽孢杆菌属(Virgibacillus)、克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)和高温放线菌属(Termoactinomyces)。不同堆积发酵方式所得白曲的微生物群落相似,曲架组中高温放线菌属、克罗彭斯特菌属和火山渣芽孢杆菌属(Scopulibacillus)的相对丰度高于传统组,而传统组中枝芽孢菌属、芽孢杆菌属和海洋芽孢杆菌属(Oceanobacillus)的相对丰度高于曲架组。不同堆积发酵方式所得黄曲的微生物群落结构相似,相对丰度存在差异,传统组中芽孢杆菌、高温放线菌、火山渣芽孢杆菌属和糖多孢菌属的相对丰度较高,曲架组中枝芽孢菌属、克罗彭斯特菌属和海洋芽孢杆菌属相对丰度高于传统组。曲架组相比较,DC组的高温放线菌属和海洋芽孢杆菌属相对丰度高于CL组,而火山渣芽孢杆菌属相对丰都低于CL组。虽然不同堆积发酵方式细菌群落结构存在差异,但优势菌群相似,均为高温大曲特征性的微生物群落结构[14]。
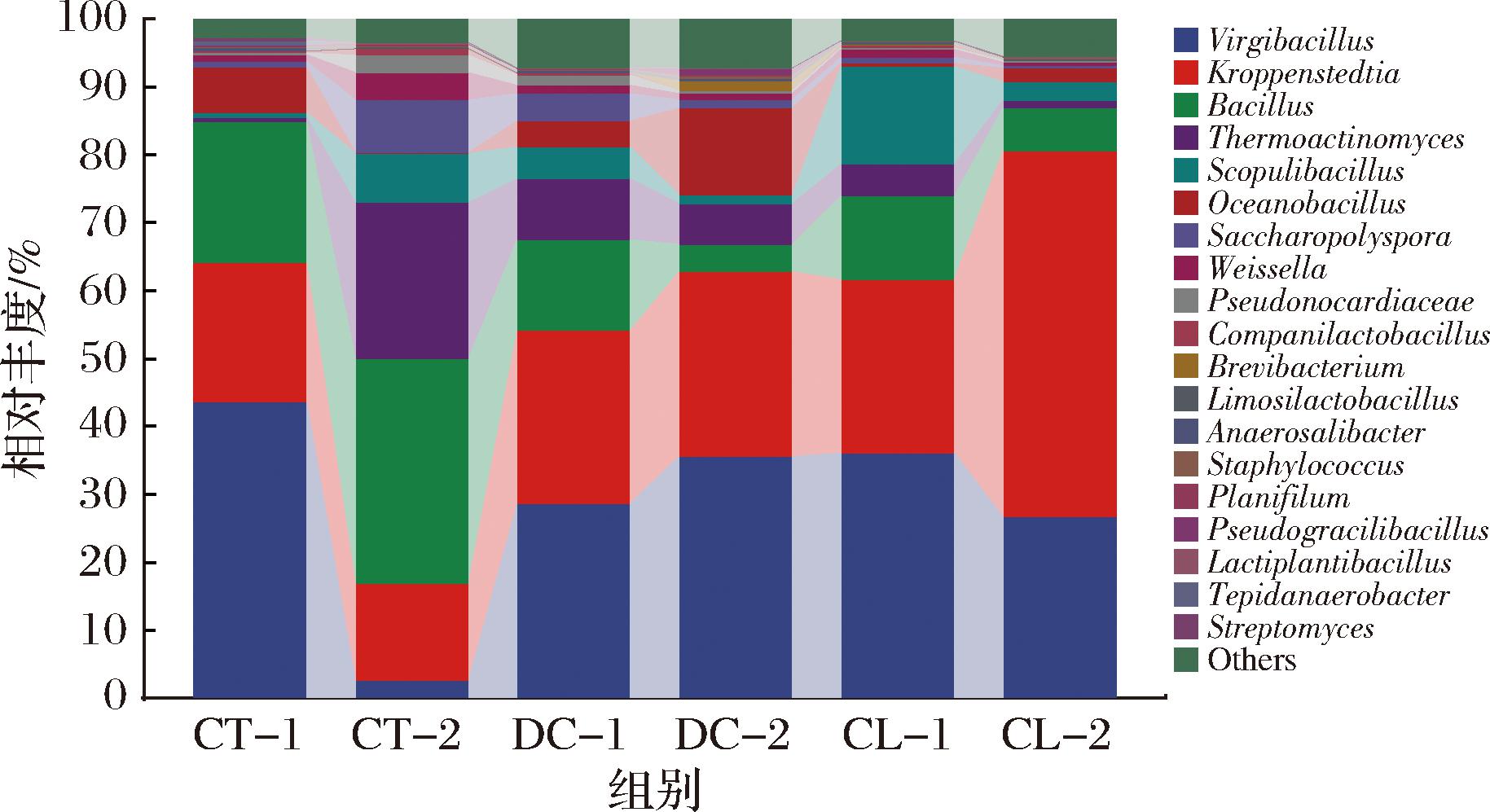
图4 不同堆积发酵方式高温大曲细菌群落结构
Fig.4 Bacterial communities of Daqu samples under different fermentation methods
传统堆积发酵方式曲坯间相互挤压,导致曲坯间气体流动性较弱。而曲架堆积发酵方式,由于曲架的支撑作用,增加了曲坯间的间隙,曲坯间的气体流动交互优于传统堆积发酵方式。不同堆积发酵方式可能导致曲坯堆积的疏松度和发酵过程中的微氧环境存在一定的差异,不同组在发酵过程中温度变化规律基本相似,温度数值虽存在一定差异[增强出版附表2(http://doi.org/10.13995/j.cnki.11-1802/ts.039154)],但细菌对温度的耐受性较高,不同堆积发酵方式曲药的细菌群落结构相似,而不同堆积发酵方式营造的微氧环境不同,可能对细菌的生长繁殖代谢有一定的影响,因此,不同堆积发酵方式曲药中细菌的相对丰度存在差异。
芽孢杆菌(Virgibacillus、Kroppenstedtia、Bacillus、Thermoactinomyces、Scopulibacillus、Oceanobacillus、Anaerosalibacter、Staphylococcus、Pseudogracilibacillus)为高温大曲的优势细菌,相对丰度在81.23%~94.43%,它们代谢生成的氨基酸、脂类和有机酸等风味底物,为白酒提供了大量的风味物质。高温大曲中,细菌群落普遍形成以枝芽孢菌属、克罗彭斯特菌属和芽孢杆菌属为核心的产香功能菌群,促进了各种氨基酸和风味物质的代谢。其中枝芽孢菌属、克罗彭斯特菌属和高温放线菌属对高温(>60 ℃)和低含水量(10%~15%)的发酵环境具有更强的适应性。克罗彭斯特菌属还可以合成各种风味的前体物质(如氨基酸、乳酸),并通过二次代谢生成白酒的异戊二烯和萜烯风味物质[15]。而枝芽孢菌属具有促进吡嗪产生的作用[16],高温放线菌属则可以产生独具酱香风味的愈创木酚[17]。芽孢杆菌属能够合成蛋白酶、淀粉酶和糖化酶等多种水解酶,这些酶类物质有利于发酵原料的糖化和液化[18],也可以利用一些大分子物质合成双乙酰,并且与大曲中己酸乙酯的形成有关[19]。
2.2.2 不同堆积发酵方式高温大曲真菌群落结构
不同堆积发酵方式高温大曲真菌群落组成如图5所示(<1%合并为others),共检出17种优势真菌,真菌群落结构相似但相对丰度存在一定差异。其中,嗜热真菌属(Thermomyces)和热子囊菌属(Thermoascus)为优势真菌,相对丰度占37.53%~60.66%和22.80%~51.76%。也是高温大曲中核心的产香功能真菌[14]。与传统组相比,曲架组的曲霉属(Aspergillus)相对丰度较高,而热子囊菌属、毕赤酵母属(Pichia)、丝衣霉属(Byssochlamys)相对较低,可能与传统组的发酵温度更高[增强出版附表2(http://doi.org/10.13995/j.cnki.11-1802/ts.039154)],更有利于富集嗜热真菌有关。在白曲中,曲架组的嗜热真菌属、曲霉属、踝节菌属(Rasamsonia)高于传统组,而热子囊菌属、毕赤酵母属、丝衣霉属则低于传统组;在黄曲中,传统组的嗜热真菌属相对丰度高于曲架组。曲架DC组与曲架CL组真菌差异主要为曲霉属、踝节菌属和小囊菌属(Microascus)。霉菌为好氧菌,酵母菌为兼性厌氧菌,对发酵环境温度的耐受力较弱[15]。不同堆积发酵方式可能导致曲坯堆积的疏松度和发酵过程中的微氧环境存在一定的差异,因此,相较于传统堆积发酵方式,曲架堆积发酵温度低,曲架支撑作用,增加了曲坯间的间隙,营造的溶氧环境和增加气体流动性可能有利于酵母菌和霉菌的生长。曲架高温大曲和传统高温大曲的堆积发酵方式和翻曲方式虽存在一定差异,但主要制曲工序和流程基本一致,发酵温度变化的规律相似,对真菌富集无明显的影响。
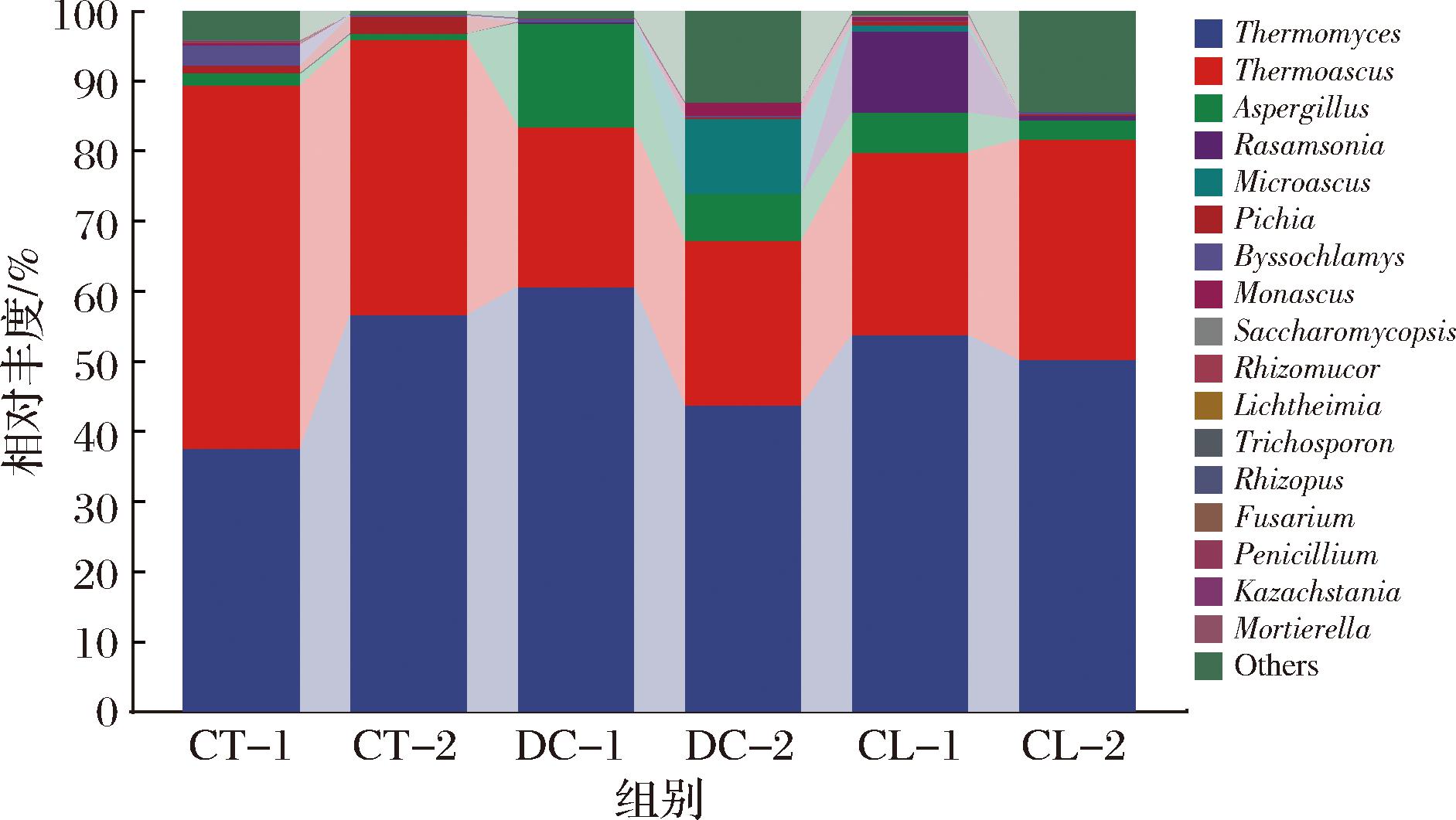
图5 不同堆积发酵方式高温大曲真菌群落结构
Fig.5 Fungal communities of Daqu samples under different fermentation methods
热子囊菌属和嗜热真菌属是大曲中常见的高效降解碳水化合物的嗜热真菌,大多能产淀粉酶、蛋白酶、纤维素酶、脂肪酶和β-葡聚糖酶,有利于原料的分解和利用,对高温大曲和白酒的发酵都有重要作用[20]。同时,嗜热真菌属也是酱香型白酒发酵过程和低温大曲曲心的优势真菌,是白酒生产过程中重要的酶类来源[21]。曲霉属为大曲提供糖化力[9],作为发酵过程中主要供酶菌源,能够合成淀粉酶、纤维素酶、果胶酶、蛋白酶、酯化酶和有机酸,也是白酒酿造过程的重要功能微生物[22]。毕赤酵母属属于耐高温酵母菌,是酒醅发酵过程中常见的能产乙醇和产酯的酵母菌属之一[23]。踝节菌属是一类具有编码糖苷水解酶能力的耐高温真菌属,且能够降解纤维素[22]。红曲霉属(Monascus)能够产生红曲霉素和酯化酶。液态发酵过程能够产生醇、醛、酸、酯类物质,散发出酒香、果香和蜜甜香味,而固态发酵过程产生一些酯类物质,对白酒风味有积极影响[24]。
2.2.3 不同堆积发酵方式高温大曲微生物群落差异性分析
微生物群落交互热图如图6所示。细菌群落方面,CT-2单独为一簇,与其他组的细菌群落差异较大。其他样品聚为一簇,表明它们的细菌群落相近,但丰度存在一定差异。其中DC-1、CL-2细菌群落最相近且与CL-1为一小簇。同细菌群落结构分析一致,不同堆积发酵方式对高温大曲的细菌组成影响显著。真菌群落方面与细菌相似,CT-1单独为一簇,与其他组的细菌群落差异较大。其他样品聚为一簇,它们的真菌群落相近,但丰度存在差异。其中CL-2、CT-2真菌群落最相近且与DC-1为一小簇,结构较为相近。同真菌群落结构分析一致,不同堆积发酵方式对高温大曲的真菌的生长无明显的影响。
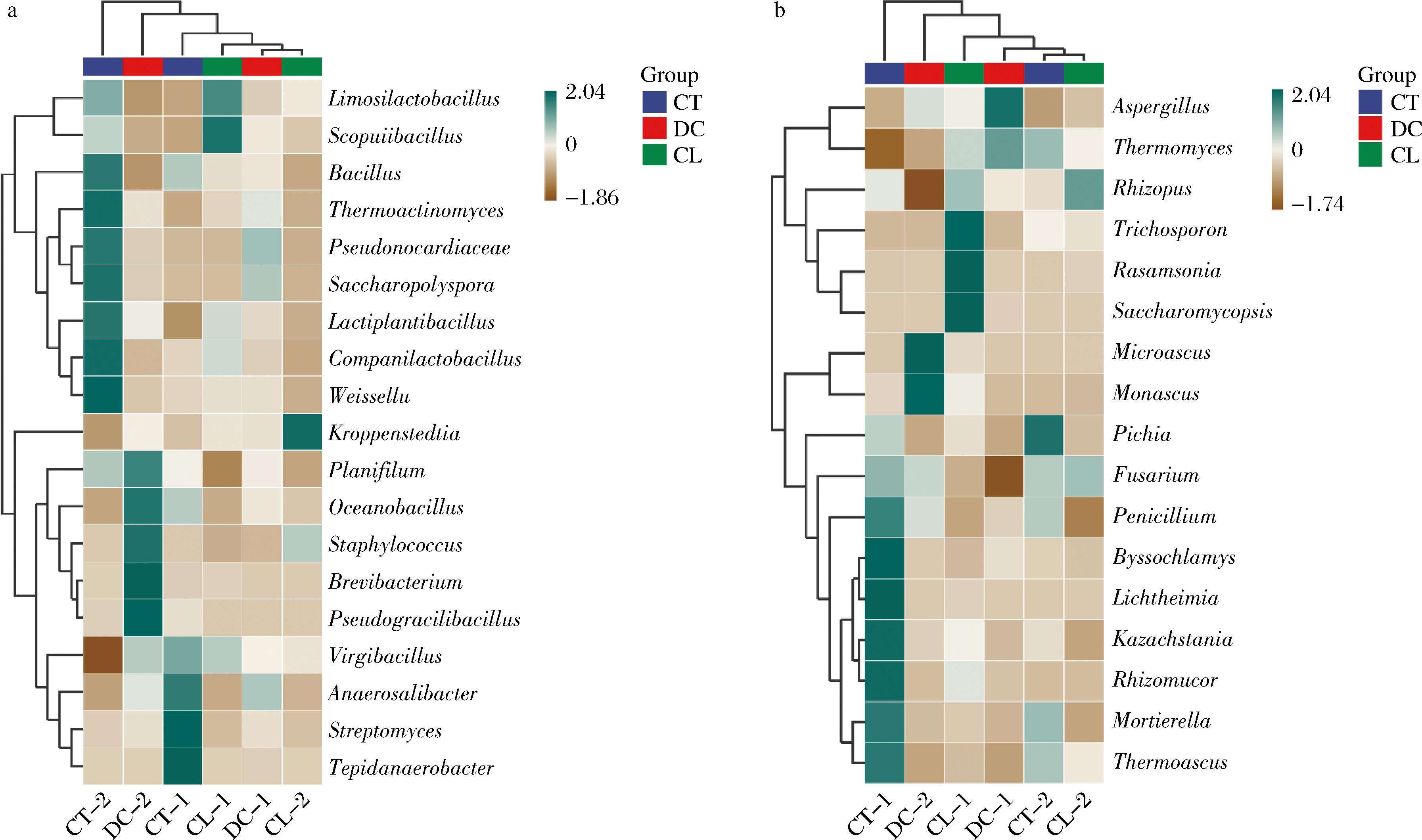
a-细菌;b-真菌
图6 不同堆积发酵方式高温大曲细菌和真菌属水平交互热图
Fig.6 Bacterial and fungal heatmap of Daqu samples under different fermentation methods on genus level
2.3 不同堆积发酵方式高温大曲微生物群落与风味物质关联性分析
计算风味物质与微生物属水平丰度前19的细菌及前17的真菌的Pearson相关系数,绘制关联性热图,如图7和图8所示。

图7 不同堆积发酵方式高温大曲细菌群落与风味物质的关联性分析
Fig.7 Analysis of the correlation between the bacterial community and flavor compounds in high-temperature Daqu produced by different stacking fermentation methods
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)(下同)。

图8 不同堆积发酵方式高温大曲真菌群落与风味物质的关联性分析
Fig.8 Analysis of the correlation between the fungal community and flavor compounds in high-temperature Daqu produced by different stacking fermentation methods
枝芽孢菌属与苯乙醛、苯酚、蘑菇醇、壬醛呈极显著正相关,与γ-亚麻酸呈显著正相关,与异戊醇、苯甲酸甲酯、2,6-二乙基吡嗪、3,5-二乙基-2-甲基-吡嗪呈极显著负相关,与正己醇、己醛呈显著负相关。克罗彭斯特菌属与1,2,4-三甲氧基苯、2-乙基-3,5-二甲基吡嗪、异戊醇、己酸、仲辛酮、棕榈酸甲酯、亚油酸甲酯、2-乙酰基吡咯呈极显著正相关,与4-甲基戊酸、2-吡咯甲醛呈显著正相关,与2,5-二甲基吡嗪、壬醛、四甲基吡嗪、三甲基吡嗪、2,6-二乙基吡嗪、3,5-二乙基-2-甲基-吡嗪呈极显著负相关,与己醛呈显著负相关。芽孢杆菌属与2,5-二甲基吡嗪、壬醛、四甲基吡嗪、三甲基吡嗪、2,6-二乙基吡嗪、3,5-二乙基-2-甲基-吡嗪呈极显著正相关,与正己醇、己醛呈显著正相关,与1,2,4-三甲氧基苯、2-乙基-3,5-二甲基吡嗪、己酸、仲辛酮、棕榈酸甲酯、亚油酸甲酯、2-乙酰基吡咯呈极显著负相关,与异戊醇呈显著负相关。高温放线菌属与苯甲酸甲酯、苯甲醛、2,6-二乙基吡嗪、3,5-二乙基-2-甲基-吡嗪呈极显著正相关,与苯乙醇、己醛呈显著正相关,与异戊酸、4-甲基戊酸、仲辛酮呈极显著负相关,与苯乙醛、蘑菇醇呈显著负相关。
嗜热真菌属与苯甲酸甲酯呈极显著正相关,与苯乙醇、氨茴酸甲酯呈显著正相关,与苯酚、蘑菇醇、仲辛酮呈极显著负相关,与棕榈酸甲酯、亚油酸甲酯呈显著负相关。热子囊菌属与正己醇、2-正戊基呋喃、四甲基吡嗪、三甲基吡嗪呈极显著正相关,与蘑菇醇、2,5-二甲基吡嗪呈显著正相关,与1,2,4-三甲氧基苯、γ-亚麻酸、苯甲醇、苯乙醇、氨茴酸甲酯、苯甲酸甲酯、2-乙酰基吡咯、2-乙基-3,5-二甲基吡嗪呈极显著负相关。曲霉属与1,2,4-三甲氧基苯、γ-亚麻酸、苯甲醇、苯乙醇、氨茴酸甲酯、2-乙酰基吡咯、2-乙基-3,5-二甲基吡嗪呈极显著正相关,与2,6-二乙基吡嗪、3,5-二乙基-2-甲基-吡嗪、正己醇、2-正戊基呋喃、四甲基吡嗪、三甲基吡嗪呈极显著负相关,与己醛、2,5-二甲基吡嗪呈显著负相关。
2.4 不同堆积发酵方式高温大曲微生物群落与与基本理化、酶活力关联性分析
计算理化指标、酶活力与微生物属水平丰度前19的细菌及前17的真菌的Pearson相关系数,R值0.6筛选后,绘制关联性热图,结果如图9、图10所示。
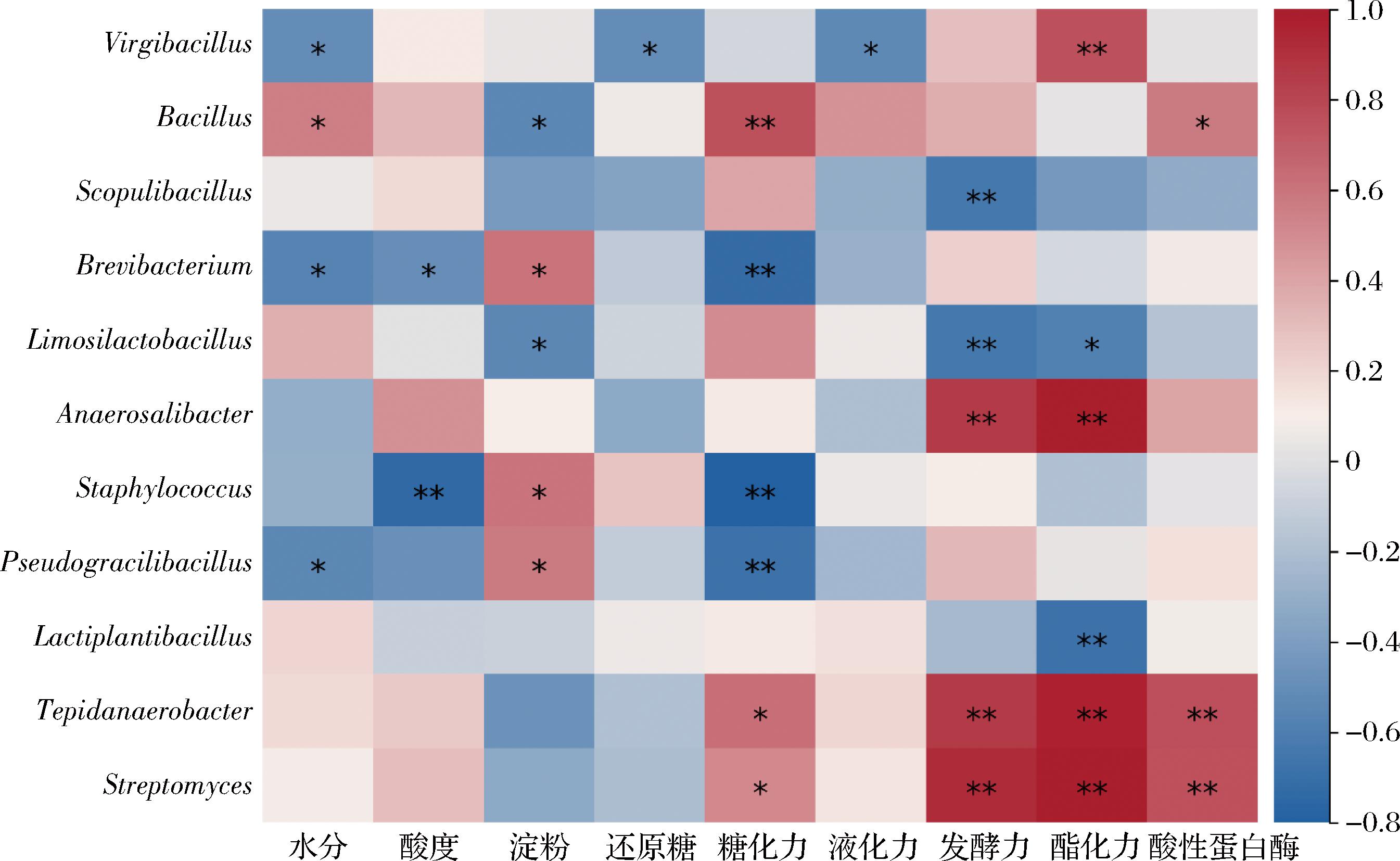
图9 不同堆积发酵方式高温大曲细菌群落与理化、酶活力指标的关联性分析
Fig.9 Analysis of the correlation between the bacterial communities of high-temperature Daqu produced by different stacking fermentation methods and physical and chemical, enzyme activity indicators
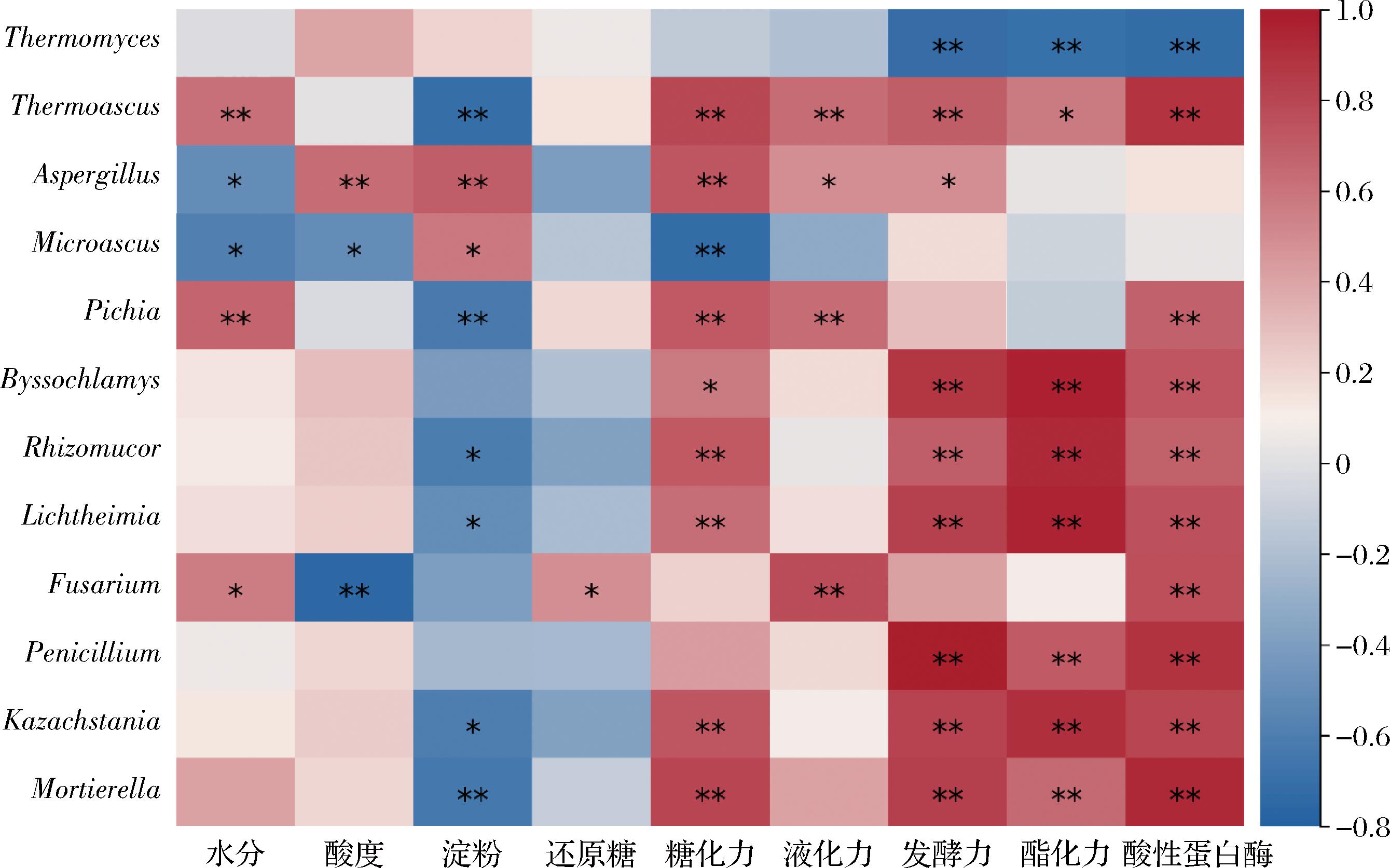
图10 不同堆积发酵方式高温大曲真菌群落与理化、酶活力指标的关联性分析
Fig.10 Analysis of the correlation between the fungal communities of high-temperature Daqu produced by different stacking fermentation methods and physical and chemical, enzyme activity indicators
在细菌群落方面,Virgibacillus与酯化力呈极显著正相关,与发酵力呈一定相关性,与水分、还原糖和液化力呈显著负相关。这与相关报道[14]描述的低水分环境有利酯化功能微生物Virgibacillus相对丰度的增加相吻合。Bacillus与糖化力呈极显著正相关,与水分和酸性蛋白酶呈显著正相关,并与液化力和酯化力有一定相关性,与其自身合成多种水解酶如糖化酶和蛋白酶有关[18],并且Bacillus在低水分的发酵环境具有更强的适应性[14]。Scopulibacillus与发酵力呈极显著负相关。Scopulibacillus属于耐热微生物,可分泌蛋白酶、淀粉酶和纤维素酶等,但相关性分析并无明显关联性,可能与其丰度较小有关。Tepidanaerobacter与Streptomyces对各指标关联性相似,与发酵力、酯化力和酸性蛋白酶活力极显著正相关,其丰度较低且在高温大曲中的功能报道较少,需进一步研究。
在真菌群落方面,Thermomyces与酯化力、发酵力、酸性蛋白酶呈显著负相关,这与其他文献报道的与酯化、发酵力呈正相关相悖,这可能与高温条件下不利于产酶有关。Thermoascus与水分、糖化力、液化力、发酵力、酸性蛋白酶呈极显著正相关,与酯化力显著正相关,与淀粉含量呈极显著负相关。这可能与Thermoascus可以产生各种水解酶从而利于原料的分解,并合成有机酸和酯类化合物有关[14]。Aspergillus与酸度、淀粉和糖化力呈极显著正相关,与液化力和发酵力呈显著正相关,与水分呈显著负相关。这可能与Aspergillus具有能合成淀粉酶的能力有关。虽然Aspergillus的整体丰度较低,但在曲架组中的丰度相较于传统组更高,这有助于提升曲架组的糖化力和液化力。Byssochlamys、Rhizomucor、Lichtheimia、Penicillium、Kazachstania和Mortierella对各指标关联性相似,均与发酵力、酯化力和酸性蛋白酶活力极显著正相关,其丰度较低且在高温大曲中的功能报道较少,需进一步研究。
3 结论
本文对不同堆积发酵方式高温大曲的理化特性、酶活力、微生物群落结构和风味组分进行了分析研究,结果表明,不同组大曲的理化指标差异较小,但酶活力指标差异显著。不同堆积发酵方式黄曲还原糖含量及酸度高于白曲,曲架堆积发酵方式B曲药的糖化力指标接近传统堆积方式曲药。风味方面,醇类、酸类、吡嗪类和醛类为不同堆积发酵方式高温大曲优势风味物质。微生物群落结构方面,不同堆积发酵方式大曲的微生物群落结构相似,相对丰度存在一定差异。枝芽孢杆菌属、芽孢杆菌属、克罗彭斯特菌属和高温放线菌属为优势细菌,嗜热真菌属和热子囊菌属为优势真菌。不同堆积发酵方式对大曲中细菌群落的影响显著,对真菌群落结构有影响但不显著,可能是因为传统发酵方式曲坯间存在挤压,导致曲坯间气体流动性较弱,而曲架对曲坯的支撑作用,增加了曲坯间的间隙,从而增加曲坯堆积的疏松度和提高发酵过程中的微氧环境有关。相关性分析显示,芽孢杆菌属、热子囊菌属和曲霉属均与糖化力、液化力及发酵力呈正相关,这与它们均能合成水解酶有关。不同堆积发酵方式的大曲中各功能微生物丰度的差异以及微生物间的相互协同作用,可能导致酶活力及风味差异显著。整体上,曲架堆积发酵方式B适合于探索机械化高温大曲酿造。
[1] 王婧, 王晓丹, 邱树毅, 等.酱香型白酒酿造体系风格特征形成探究[J].酿酒, 2015, 42(4):99-104.
WANG J, WANG X D, QIU S Y, et al.Advances in research on the formation of Maotai-flavor liquor brewing system features[J].Liquor Making, 2015, 42(4):99-104.
[2] 胡宝东, 王晓丹, 王婧, 等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业, 2016, 37(2):260-264.
HU B D, WANG X D, WANG J, et al.Relationship between production technology of Maotai-flavor Daqu and its quality[J].The Food Industry, 2016, 37(2):260-264.
[3] 简晓平, 施永祥, 王涛, 等.机制大曲和人工大曲生物、理化指标比较分析[J].酿酒科技, 2014(1):55-58.
JIAN X P, SHI Y X, WANG T, et al.Comparative analysis of biological and physiochemical indexes of artificial Daqu and machine-made Daqu[J].Liquor-Making Science &Technology, 2014(1):55-58.
[4] 山其木格, 唐平, 王丽, 等.“无稻草,不翻仓,控温控湿”曲房创新对高温大曲微生物组成的影响研究[J].酿酒科技, 2021(9):94-101;113.
SHAN Q M G, TANG P, WANG L, et al.Effect of innovative Daqu storage room on the microbial composition of high-temperature Daqu[J].Liquor-Making Science &Technology, 2021(9):94-101;113.
[5] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社, 1998:50-80.
SHEN Y F.Book of Liquor Production Technology[M].Beijing:China Light Industry Press, 1998:50-80.
[6] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Research International, 2017, 102:68-76.
[7] 陈心雨, 刘念, 王超凯, 等.高温大曲中美拉德反应的研究进展[J].食品与发酵科技, 2023, 59(6):109-112.
CHEN X Y, LIU N, WANG C K, et al.Research progress of Maillard reaction in high temperature Daqu[J].Food and Fermentation Science and Technology, 2023, 59(6):109-112.
[8] 魏阳,张芮,张立强,等. 小麦粉碎度与成品高温大曲理化和风味组分的相关性研究[J].食品与发酵工业,2024,50(20):181-189.
Wei Yang, Zhang Rui, Zhang Liqiang, et al. Correlation Study between Wheat Particle Size and Physicochemical and Flavor Components of High-temperature Daqu in Finished Products[J]. Food and Fermentation Industries, 2024, 50(20): 181-189.
[9] LIU M L, LIU X Q, LI Y.Soybean peptides’ cryoprotective effects on Saccharomyces cerevisiae fermenting power in frozen dough and maintenance of the Chinese steamed bread qualities[J].Journal of Food Processing and Preservation, 2020, 44(8):e14572.
[10] FAN W L, QIAN M C.Identification of aroma compounds in Chinese ‘Yanghe Daqu’ liquor by normal phase chromatography fractionation followed by gas chromatography[sol]olfactometry[J].Flavour and Fragrance Journal, 2006, 21(2):333-342.
[11] 刘冉, 周英昊, 邵玲智.酱香型白酒大曲中微生物菌群分析[J].中国食品工业, 2022(6):97-99;101.
LIU R, ZHOU Y H, SHAO L Z.Analysis of microflora in tai-flavor liquor Daqu[J].China Food Industry, 2022(6):97-99;101.
[12] 秦炳伟, 吕志远, 张梦梦, 等.顶空固相微萃取-全二维气相色谱-飞行时间质谱解析泉香型白酒的风味物质[J].食品与发酵工业, 2023, 49(18):289-296.
QIN B W, LYU Z Y, ZHANG M M, et al.Analysis of flavor substances in spring-flavor Baijiu by HS-SPME-GC × GC-TOF-MS[J].Food and Fermentation Industries, 2023, 49(18):289-296.
[13] 古翀羽, 冉茂芳, 魏阳, 等.不同配料青稞大曲理化特性与微生物群落相关性研究[J].食品与发酵工业, 2021, 47(22):126-135.
GU C Y, RAN M F, WEI Y, et al.Correlation of physicochemical properties and microbial community in highland barley Daqu fermented with various materials[J].Food and Fermentation Industries, 2021, 47(22):126-135.
[14] ZHU C T, CHENG Y X, SHI Q L, et al.Metagenomic analyses reveal microbial communities and functional differences between Daqu from seven provinces[J].Food Research International, 2023, 172:113076.
[15] ZHANG L Q, WU C D, DING X F, et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCR-DGGE[J].World Journal of Microbiology &Biotechnology, 2014, 30(12):3055-3063.
[16] DU Y K, XIN W, XIA Y, et al.Analysis of fermentation control factors on volatile compounds of primary microorganisms in Jiang-flavor Daqu[J].Journal of Food Biochemistry, 2022, 46(10):e14277.
[17] 李豆南, 黄魏, 王晓丹, 等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学, 2018, 39(6):171-176.
LI D N, HUANG W, WANG X D, et al.Identification and flavor profile of a thermoactinomycetaceae strain separated from Moutai-flavor Daqu[J].Food Science, 2018, 39(6):171-176.
[18] HUANG Y H, YI Z L, JIN Y L, et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-flavor liquor starter[J].Frontiers in Microbiology, 2017, 8:1747.
[19] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[20] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2020, 9(2):1003-1016.
[21] 吴成, 王春晓, 王晓丹, 等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学, 2019, 40(3):348-355.
WU C, WANG C X, WANG X D, et al.A review of the application of high-throughput sequencing technology in analysis of the diversity of microbial communities involved in the fermentation of alcoholic beverages[J].Food Science, 2019, 40(3):348-355.
[22] 周天慈, 何宏魁, 周庆伍, 等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业, 2021, 47(16):66-71.
ZHOU T C, HE H K, ZHOU Q W, et al.Exploring the source of microbiota in medium-high temperature Daqu based on high-throughput amplicon sequencing[J].Food and Fermentation Industries, 2021, 47(16):66-71.
[23] 沈世明, 何猛超, 刘桂珍, 等.酱香型大曲贮存初期微生物及风味物质变化的分析研究[J].酿酒科技, 2023(2):128-135.
SHEN S M, HE M C, LIU G Z, et al.Changes of microorganisms and flavor substances of Jiangxiang Daqu in the early stage of storage[J].Liquor-Making Science &Technology, 2023(2):128-135.
[24] 孙利林, 李立郎, 胡萍, 等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技, 2020, 36(8):299-306;193.
SUN L L, LI L L, HU P, et al.Analysis of microbial community structure and flavor composition of Maotai-flavor Daqu[J].Modern Food Science and Technology, 2020, 36(8):299-306;193.