大曲是以小麦为主要原料,有的则以大麦或豌豆等作为主要原料,经过润料、粉碎、加水拌料、制坯等操作后入库储存。大曲的发酵过程通常在开放的环境中进行,会产生独特的微生物系统和各种各样的酶和挥发性化合物,这对白酒的品质和产量具有深远的影响[1-2]。大曲一般要贮存3~6个月才投入生产,在整个贮存过程中,大曲通过“去除不和谐”的物质,从而达到“净化”作用以至“香味增加”。因此,只有经过一定时间贮藏的大曲方可酿造出高品质的白酒。
目前,判断大曲的质量是否足以用于白酒生产,主要取决于积累的生产经验进行感官评价,部分取决于其物理化学性质,这些导致白酒的质量水平不稳定。近年来,随着高通量测序和顶空固相微萃取-气相色谱-质谱等分析技术的发展,研究人员发现,大曲老化过程不仅受贮存时间的影响,而且是一个非常复杂的过程,其中微生物菌群随着外界环境(如温度和湿度)的变化而不断变化,发酵后大曲中的微生物也保持活性,使其酶和代谢物含量发生变化。例如,梁晨等[3]发现芽孢杆菌属、乳杆菌属、明串珠菌属、高温放线菌属、乳球菌属等是大曲贮存过程中的优势菌群,随大曲贮存时间推移,酸、醇类物质在贮存前期不断积累,酯类及含氮类等重要风味物质在后期不断形成。FAN等[4]通过高通量测序技术研究发现,在通风良好、干燥的储存环境中,大曲微生物会出现进一步的相互作用,从而达到优化微生物群落的效果。此外,他们还发现,清香型大曲在贮存过程中,酯化力和发酵力会增加,而液化力和糖化力的变化不大,推测主要是由于各种微生物之间相互作用的平衡引起的。徐千惠等[5]研究发现,浓香型大曲在贮存过程中,大曲微生物群落重新平衡,并导致酶活力及挥发性化合物进一步丰富和转化;在这个过程中,微生物群落的构建由随机性过程主导,同时也受确定性过程影响,其中变量选择起到了较大作用,生态位差异也产生一定影响;大曲糖化力、液化力及风味物质的变化与微生物群落演替密切相关,这些研究为探索影响大曲贮存期质量的因素提供了帮助。然而,目前对大曲贮存期的关键影响因素尚未得到科学的解释,这是推动大曲从手工生产向大规模机械化生产成功转型亟待解决的关键科学问题。
为此,本研究以西北某酒厂不同贮存期浓香型大曲为研究对象,通过理化检测和高通量测序技术分析其物理化学性质以及微生物的多样性差异,同时对大曲理化特性与微生物类群的关联性进行分析,以期为大曲选择合理的贮存期提供理论基础,从而为提高白酒品质以及出酒率提供科学的解决方案。
1 材料与方法
1.1 实验样品
不同贮存期中高温大曲样品:产于西北某酒厂。
取样方法:分别在大曲贮存过程中的第0、30、60、90天选择固定曲房作为抽样点,为保证取样科学性及均一性,随机抽取12块曲构成平行样,每块曲一分为四,取1/4曲块粉碎后将其混匀,用五点取样法进行缩分取样,取500 g作为实验样品,分别进行理化指标、生化指标及微生物指标的测定。大曲样品编号记作D0、D30、D60、D90。
1.2 实验仪器
TL-48R粉碎研磨仪,上海万柏生物科技有限公司;5424R高温台式冷冻离心机,德国Eppendorf公司;GeneAmp®9700型PCR仪,美国ABI公司;BIOWEST西班牙琼脂糖,上海联硕宝为生物科技有限公司;DYY-6C电泳仪,北京市六一仪器厂;5NanoDrop2000超微量分光光度计,美国Thermo Fisher Scientific公司;AxyPrep DNA Gel Extraction Kit试剂盒,美国Axygen Biosciences公司;NEXTFLEX Rapid DNA-Seq Kit建库试剂盒,美国Bioo Scientific公司;MiSeq Reagent Kit测序试剂盒v3,美国llumina公司。
1.3 实验方法
1.3.1 指标的测定
根据标准QB/T4257—2011《酿酒大曲通用分析方法》对大曲样品水分、酸度、干基淀粉、糖化力、液化力、发酵力和酯化力等进行检测,所有指标测定均进行3次重复实验。
1.3.2 DNA提取、扩增和测序
根据DNeasy®PowerSoil Pro Kit试剂盒说明书进行大曲微生物群落总DNA提取,完成微生物群的DNA提取之后,用琼脂糖凝胶电泳测定DNA纯度(使用Agarose M和TAE缓冲液配制成1%的凝脂糖凝胶,加入EB染料,取6 μl DNA样品和1 μl Loading Buffer充分混匀并均匀点样,然后在110 V的恒定持续电压下进行电泳实验,电泳结束后,进行凝胶成像分析),用超微量分光光度计测DNA浓度。
使用通用引物338F/806R(5′-ACTCCTACGG-GAGGCAGCAGAG-3′/5′-GGACTACHVGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3~V4可变区,ITS1f/2043R(5′-CTTGGTCATTAGGAAGA-3′/5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌rRNA基因的ITS1区,利用Illumina公司的Miseq PE300测序平台,最后交由武汉爱基百客生物科技有限公司进行测序。
1.3.3 统计学分析
将不同贮存期4个大曲样品的测序数据进行质量控制和去除低质量序列,过滤掉低频序列,对序列进行聚类和分类,得到ASV表格和分类学注释信息。根据ASV表格进行Alpha和Beta多样性分析,同时计算样本内部的多样性参数,包括Chao1指数、ACE指数、Shannon指数、Simpson指数等,评估并比较不同样本之间微生物群落的多样性差异。利用UPARSE 7.1软件和RDP 2.2软件对各类型样本的操作分类单位(operational taxonomic unit,OTUs)进行分析。使用SAS9.0软件进行贮存期大曲样品中优势菌属和理化特性的关联性数据分析,选取相关性系数绝对值<0.4,采用Cytoscape软件(v3.10.1)绘制相关性网络图。
2 结果与分析
2.1 贮存过程中大曲部分理化指标动态变化规律
大曲水分含量对微生物的繁殖有显著影响,其对大曲的安全贮藏至关重要。据报道,12.5%的水分含量是大曲进入贮存的门槛。根据传统的生产经验,一般酿造要求大曲的含水率在10%~14%以内。本研究测定了不同贮存期大曲样品的水分含量,结果表明不同贮存期大曲样品的含水率在11%~12%的合理范围内波动(图1),说明大曲含水量的变化受贮藏时间的影响较小。大曲中干基淀粉的含量在贮存过程中整体是降低的趋势,可能是微生物群落的富集和某些微生物的变化在一定程度上起了作用[6]。如图1所示,大曲的酸度在贮存90 d后达到0.75 mmol/10 g,比刚出库时成曲样品提高了66.7%,这一结果与GUAN等[7]的研究结果相一致,其研究发现大曲在贮存过程中酸度有所波动,造成这一现象的原因可能是由于每块大曲砖块间都留有一定的缝隙,使曲房形成了一个相对干燥、通风良好温湿度恒定的空间[8],大曲微环境适合,微生物活性显著增强,代谢相对活跃,产酸量也有所增加,特别是产酸微生物如醋酸杆菌和乳酸菌的活动,故贮存会造成大曲酸度发生显著变化[9]。酸度是目前判断大曲是否成熟的重要标准,也是目前大曲制备过程中唯一使用的客观标准。
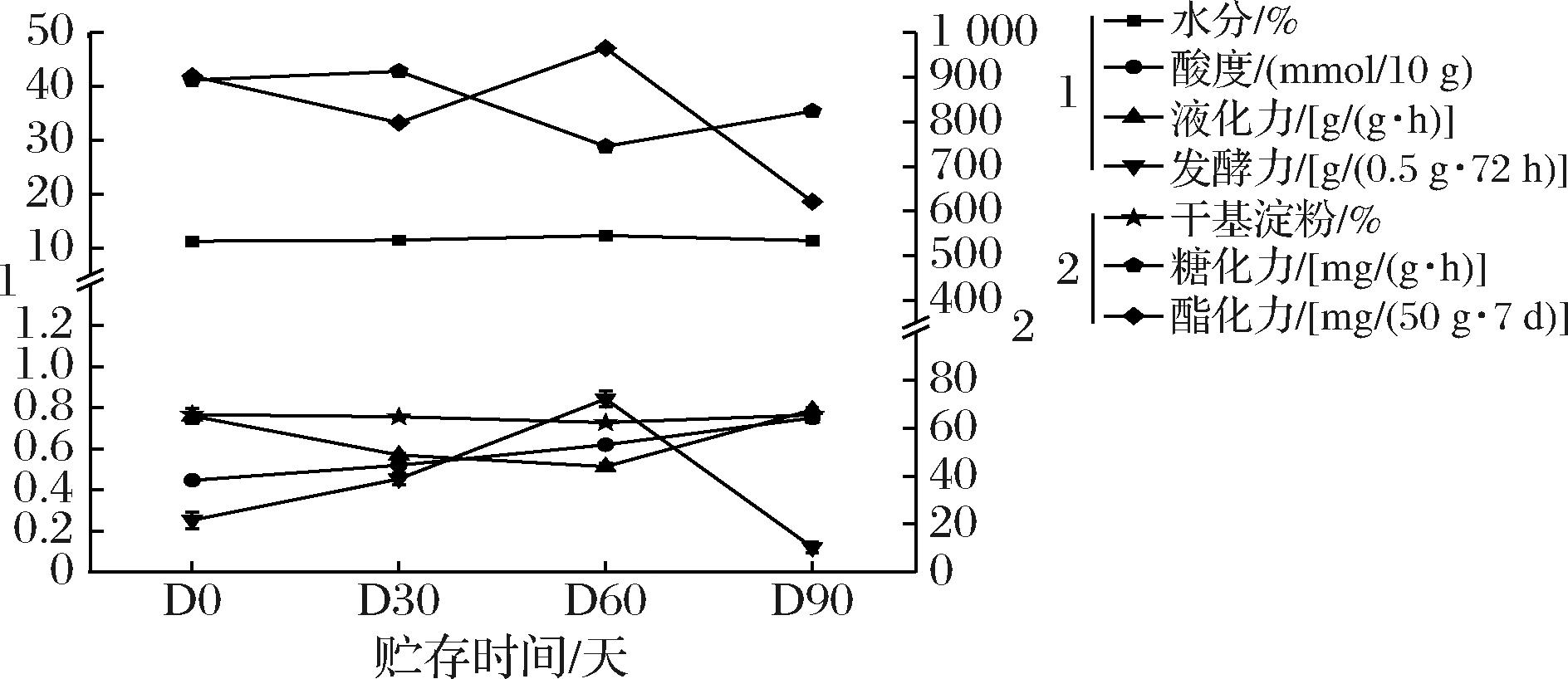
图1 中高温大曲贮存期间水分含量、酸度、液化力、发酵力、干基淀粉、糖化力和酯化力的动态变化
Fig.1 Dynamic changes in water content, acidity, liquefaction power, fermentation power, dry starch, saccharification power, and esterification power of medium and high temperature Daqu during storage
注:D0、D30、D60、D90分别为不同贮藏时间(0、30、60、90 d)的大曲样品。
大曲生化指标是影响白酒产量、质量和风格的直接因素,其中糖化力和液化力关系到原料的糖化结果,与白酒的出酒率有着直接的关系。本研究发现在贮存期间(0~3个月),糖化力和液化力整体变化的趋势是先降低后增加,这可能是由于在贮存期间温度升高,导致贮存房间水分的升高,而大曲水分较高则有利于霉菌的生长,从而能够充分的代谢糖化酶和液化酶[10]。对于大曲发酵力,总体随贮存时间的推移先增加后降低,发酵力反映的是大曲将糖转变为乙醇的能力,其与酵母菌的含量有密不可分的关系。除此之外,酯化力反映了大曲催化合成酯的能力,其与白酒中的乙酸乙酯、丁酸乙酯、己酸乙酯、和乳酸乙酯等风味成分的生成有密切关系,研究表明在贮存前3个月酯化力总体呈降低趋势。综上,中高温大曲在贮存前3个月其理化指标变化幅度较大,建议中高温大曲最短要贮存3个月才可投入使用。
2.2 贮存过程中大曲微生物群落的丰富度和多样性
对于微生物群落组成而言,有多种指标可以反映其多样性,如丰富度指数(Chao1指数和ACE指数)和多样性指数(Shannon指数和Simpson指数),本文对浓香型大曲在不同贮存期的微生物多样性进行分析,结果见表1。
表1 不同贮存阶段中高温大曲细菌和真菌Alpha多样性指数
Table 1 Alpha diversity index of bacteria and fungi at different storage stages of medium and high temperature Daqu
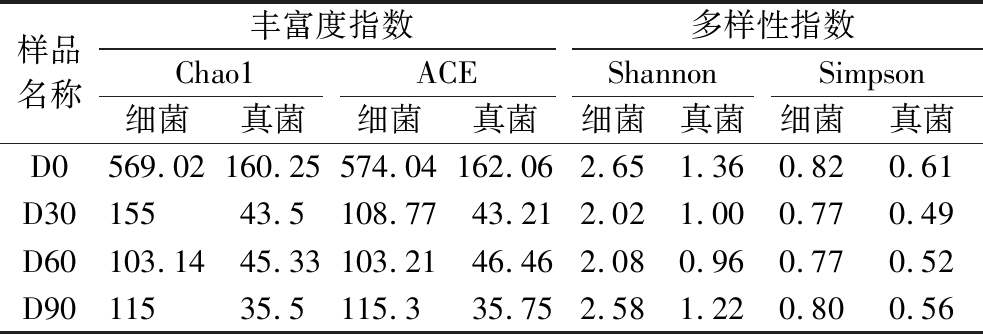
样品名称丰富度指数多样性指数Chao1ACEShannonSimpson细菌真菌细菌真菌细菌真菌细菌真菌D0569.02160.25574.04162.062.651.360.820.61D3015543.5108.7743.212.021.000.770.49D60103.1445.33103.2146.462.080.960.770.52D9011535.5115.335.752.581.220.800.56
浓香型大曲在不同贮存期间细菌群落具有较高的丰富度和多样性,但随着贮存时间的增加而降低。在贮存0 d的大曲中,细菌的丰富度和多样性最高,表征大曲微生物丰富度的Chao1指数和ACE指数分别达到569.02和574.04;在大曲贮存60 d,Chao1指数和ACE指数急剧降低至103.14和103.21;随着贮存期延长至90 d,大曲中的微生物丰富度得到一定程度的恢复;同样细菌的多样性指数在贮存90 d时也得到一定的恢复。表明在贮存期大曲细菌多样性越来越高,细菌群落均匀度渐佳,逐渐形成一个稳定的群体。同时有研究表明,大曲样品细菌群落α-多样性的变化与大曲贮存环境有关,通常pH和酸度会显著影响微生物群落的α-多样性,表现为一些不耐酸的微生物不能适应该环境而消亡。由于曲房具有良好的通风性,环境中耐酸的微生物可附着在大曲表面,利用小麦中的糖类物质进行生长繁殖,从而提高贮存后期大曲样品的α-多样性[11]。对真菌而言,其丰富度指数和多样性指数整体类似于细菌,在贮存0 d时,丰富度指数(Chao1:160.25,ACE:162.06)和多样性指数(Shannon:1.36,Simpson:0.61)均达到最高值,在整个贮存过程中均先降低再上升,该结果与吴正坤等[12]的研究结果一致,表明大曲在贮存过程中真菌群落结构不断调整、平衡以至稳定。
2.3 贮存过程中大曲微生物群落的变化
2.3.1 基于门和属水平大曲细菌类群解析
本研究基于门和属水平对浓香型大曲贮存过程中细菌多样性进行解析,并将相对含量>1.0%的门和属定义为优势门和优势属,如图2所示。厚壁菌门(Firmicutes)和放线菌门(Actinobacteriota)是大曲样品贮存期间相对丰度最高的两个门。厚壁菌门在大曲贮存期间占绝对优势地位,其相对丰度范围在59.11%~87.83%,表明贮存期间的大曲样品具有相对稳定的门水平细菌群落结构,这一结果与唐贤华等[13]的研究结果相似。厚壁菌门普遍具有耐酸、分解小麦和高粱中淀粉和蛋白质等的特性。
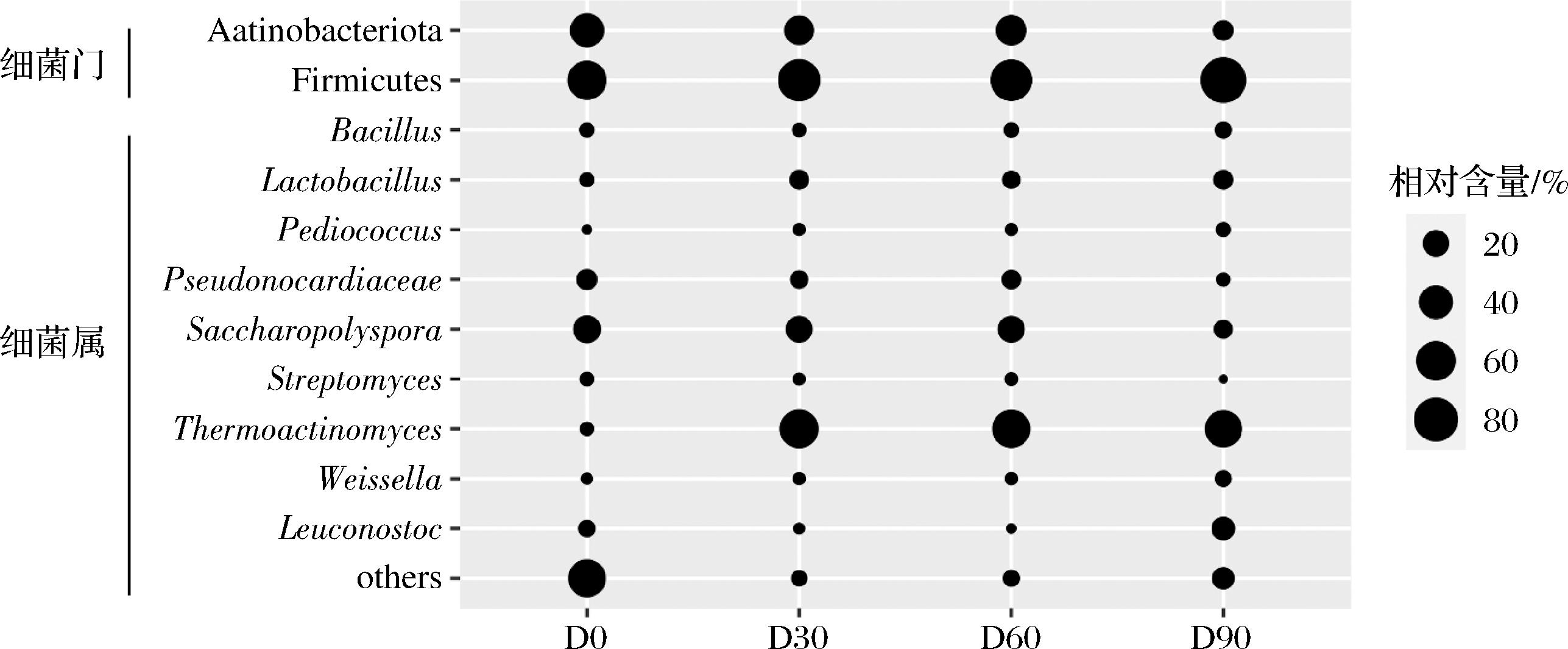
图2 中高温大曲贮存过程中优势细菌门和属相对含量分析
Fig.2 Analysis of relative contents of dominant bacteria phylum and genus during storage of medium and high temperature Daqu
为进一步更为准确地描述大曲样品在不同贮存时间的细菌群落结构,我们从属水平揭示其组成差异,不同贮存时间大曲样品中细菌群落属水平的演替规律见图2。4个大曲样品共检测到40个属,其中芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、假诺卡氏菌属(Pseudonocardiaceae)、糖多孢菌属(Saccharopolyspora)、链霉菌属(Streptomyces)、高温放线菌属(Thermoactinomyces)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)是大曲贮存期间的优势细菌属(相对丰度都>1%)。该结果相较于与本实验室探究的浓香型大曲生产过程中属水平微生物多样性变化,我们发现相较与发酵期,大曲微生物的多样性在整个贮存期较低且较为稳定,这可能与贮存期间的环境条件有关,尤其是温度。随贮存时间延长,大曲水分流失,芽孢杆菌属、片球菌属和魏斯氏菌属的相对含量一直增加,明串珠菌属在贮存90 d的相对丰度达到13.56%,而链霉菌属含量大致不变。在贮存30~90 d,高温放线菌属相对丰度均大于52%,糖多孢菌属在贮存前两个月的相对丰度约为22%,在贮存第3个月相对丰度减少到6.3%。总体而言,高温放线菌属和糖多孢菌属在贮存过程中占主导地位。
据报道,高温放线菌属具有发达的菌丝体、含有淀粉酶、蛋白酶和纤维素酶活力等特点,有助于小麦等制曲原料的液化和糖化,提高原料的利用率[14],除此之外还可提升酯类香气成分含量和白酒的出酒率[15]。芽孢杆菌是浓香型大曲中不可或缺的功能细菌,具有产生蛋白水解酶、淀粉酶、吡嗪类和有机酸的功能,其通过自身的代谢活动对大曲内营养成分的含量产生影响,分泌的胞外蛋白酶使大曲内游离氨基酸总含量增加,尤其是带有苯环的芳香族氨基酸的含量[16]。乳杆菌属和魏斯氏菌属均属于乳酸菌,适合在高酸以及湿度较大的环境中存在,代谢产生乳酸。这可能是大曲在贮藏过程中酸度增加的原因之一。研究发现乳杆菌属还可以反映白酒发酵阶段转移的微生物演替率[17],另一方面,还可筛选出许多不耐低酸的微生物,这可能导致浓香型大曲微生物群落结构的变化。魏斯氏菌属也是大曲中最丰富的细菌类群之一,其能够降解纤维二糖并在pH<3的酸性发酵环境中生长代谢[18]。糖多孢菌属可参与大分子的分解和代谢,主要是通过酶的产生,导致风味物质的形成,例如CHAKRABORTY等[19]分离出一株Saccharopolyspora sp.A9,产生耐热α-淀粉酶,将淀粉水解成葡萄糖和麦芽糖,为白酒风味的形成提供前体物质。
2.3.2 基于门和属水平大曲真菌类群解析
本研究进一步从门和属水平解析了大曲贮存期真菌的多样性,同样将相对含量>1.0%的门和属定义为优势门和优势属,如图3所示。子囊菌门(Ascomycota)是中高温大曲贮存期间唯一的优势真菌门,其相对丰度在99.27%~99.91%的范围内。同时我们也从不同属水平,检测了不同贮存时间真菌群落结构变化。不同贮存时间大曲样品中真菌群落属水平的演替规律见图3。3个大曲样品共检测到26个属,其中曲霉属(Aspergillus)、链格孢属(Alternaria)、地丝菌属(Geotrichum)、复膜孢酵母属(Saccharomycopsis)、热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、威克汉姆酵母属(Wickerhamomyces)等是大曲贮存期的优势真菌属。曲霉属、地丝菌属和威克汉姆酵母属在30~90 d的时间段内,其相对丰度依次增加,其中曲霉属和地丝菌属是浓香型白酒固态发酵中产生中性蛋白酶和糖化酶的主要霉菌,而热子囊菌属在贮存60 d相对丰度达到37%,而在贮存第90天时,热子囊菌属消失。复膜孢酵母属在贮存0~60 d含量降低,在60~90 d相对丰度又上升。粱晨等[3]发现大曲中的复膜孢酵母属细菌主要来源于空气,可能在贮存后期,由于空气流通性较好,空气中的复膜孢酵母属细菌进入大曲占据优势。在整个贮存期间,嗜热真菌属占绝对优势,其相对丰度约为59%。

图3 中高温大曲贮存过程中优势真菌门和属相对含量分析
Fig.3 Analysis of relative contents of dominant fungi phylum and genus during storage of medium and high temperature Daqu
热子囊菌属和嗜热真菌属在中高温大曲中普遍存在,且相对丰度比例比其他真菌微生物高,该结果与杨少勇等[20]研究的结果一致。热子囊菌属可以产生具有高热稳定性和活力的纤维素酶和蛋白酶等,特别是它产生的过氧化氢酶是迄今为止报道的热碱稳定性最好的,还具有产酒生香作用[21]。除此之外研究发现该菌属还具有一个编码β-葡萄糖苷酶的基因[22]。热子囊菌属在贮存90 d消失的原因可能是由于曲库中曲虫滋生,随贮存时间延长曲虫数量上升,影响了该菌属的生长。嗜热真菌属能提供蛋白酶、纤维素酶等重要酶类,具有促进蛋白质高分子多糖降解的作用,在白酒酿造过程中具有产酒生香的作用,也是合成乙酸乙酯的核心微生物。复膜孢酵母属在贮存后期相对丰度增加,研究发现,该菌属可在生物酶的作用下合成酯类、高级醇类等香气化合物,增加风味复杂性,从而改善白酒的最终风味[23]。
2.4 贮存过程中大曲理化特性与微生物类群的关联性分析
浓香型中高温大曲理化特性与微生物类群的关联性分析,结果如图4所示。浓香型大曲贮存过程中,乳杆菌属(Lactobacillus)、假诺卡氏菌属(Pseudonocardiaceae)、糖多孢菌属(Saccharopolyspora)、链霉菌属(Streptomyces)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、曲霉属(Aspergillus)、威克汉姆酵母属(Wickerhamomyces)与糖化力呈正相关,有研究表明,曲霉属中的米曲霉(Aspergillus oryzae)、黑曲霉(Aspergillus niger)和威克汉姆酵母属都是常见的产糖化酶功能菌[24]。嗜热真菌属(Thermomyces)与液化力、发酵力、酯化力、干基淀粉、水分呈正相关,在整个贮存过程中,嗜热真菌属的相对含量占到49%~69%,说明该菌属在整个贮存过程中实际贡献可能较大。乳杆菌属、假诺卡氏菌属、糖多孢菌属、链霉菌属与液化力呈负相关;片球菌属(Pediococcus)和高温放线菌属(Thermoactinomyces)分别与发酵力和酯化力呈负相关,芽孢杆菌属(Bacillus)与酸度呈负相关,这与刘敏芳等的研究结果一致[24]。由此可知,优势菌属对贮存期浓香型大曲的生化性能影响主要体现在糖化力与液化力上。
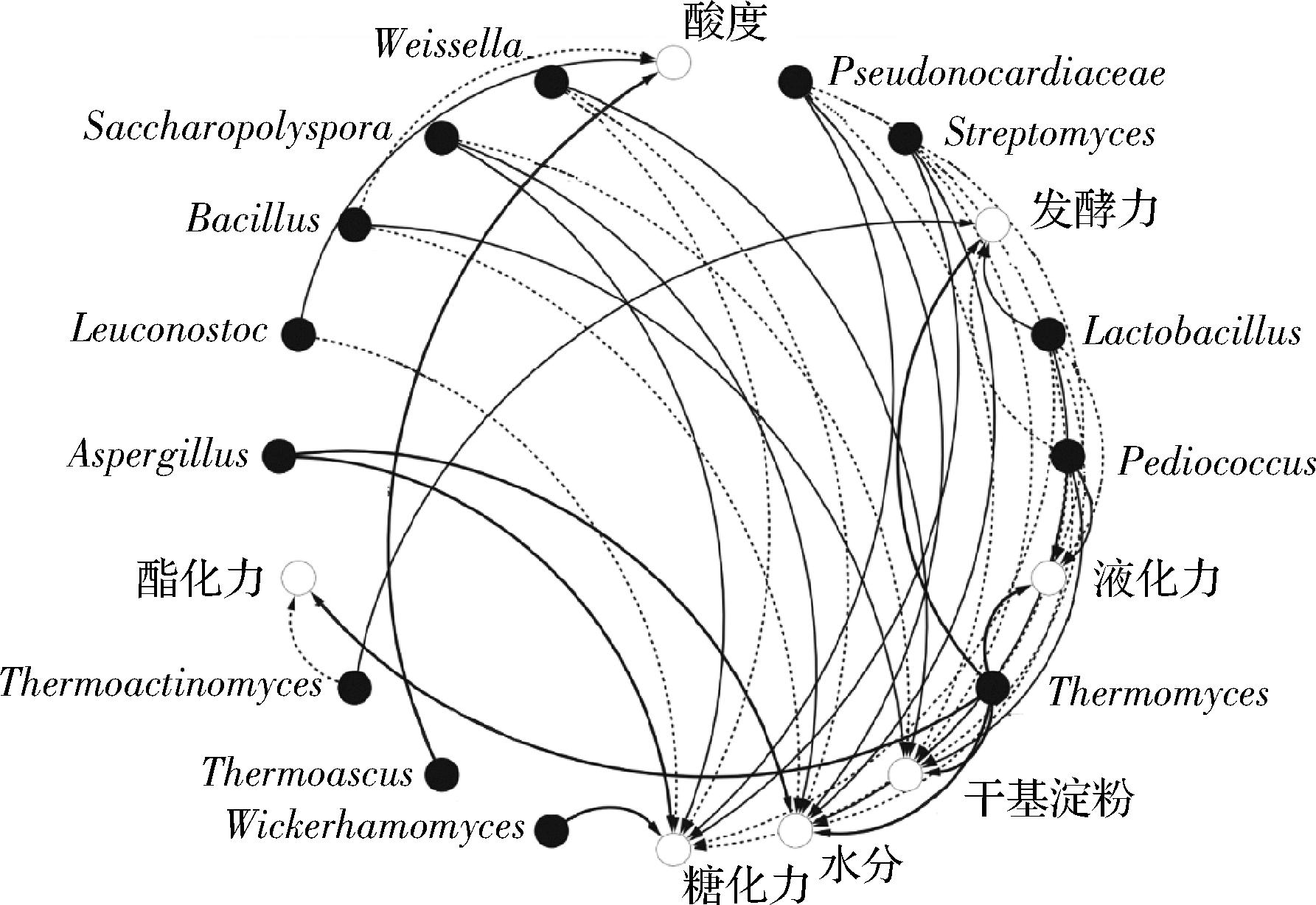
图4 优势菌属与贮存期中高温大曲理化指标之间的相关性分析
Fig.4 Correlation analysis between dominant strains and physicochemical indexes of high temperature Daqu during storage
注:图中实线表示正相关,虚线表示负相关。
3 结论
本研究对产自西北某酒厂浓香型大曲的理化指标和发酵特性进行综合评价,并利用高通量测序技术对微生物群落的变化进行了系统的解析。研究发现,大曲中微生物的丰富度和多样性随贮存时间的变化均先降低再上升,微生群落均匀度渐佳,逐渐形成一个稳定的群体。在整个贮存过程中(0~3个月)高温放线菌属、糖多孢菌属和嗜热真菌属占绝对优势;乳酸菌(乳杆菌属、魏斯氏菌属)的相对含量一直增加,是大曲贮藏过程中酸度增加的原因之一,同时,该菌属为后续正常的发酵提供了合适的条件以及动力。大曲在不同贮存期间的理化特性和微生物类群间存在复杂的联系,优势菌属对贮存期浓香型大曲的生化性能影响主要体现在糖化力与液化力上。综上所述,大曲贮藏过程中理化以及微生物群落结构呈现复杂的动态变化,贮存期过长或过短则会影响大曲的质量,因此需要根据微生物群落的动态演化过程选择最佳的存储期。由此可见,深入揭示中高温大曲在贮藏过程中理化指标以及微生物群落的动态演替规律,有利于促进酿酒技术的提升与创新,也有利于白酒行业的可持续和高质量发展。
[1] WANG P, WU Q, JIANG X J, et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].International Journal of Food Microbiology, 2017, 250:59-67.
[2] 刘文虎, 柴丽娟, 张立强, 等.基于宏基因组学解析不同质量等级中温大曲微生物组的异质性[J].微生物学报, 2023, 63(11):4383-4398.
LIU W H, CHAI L J, ZHANG L Q, et al.Metagenomics unveils the microbiome heterogeneity of medium-temperature Daqu with different quality grades[J].Acta Microbiologica Sinica, 2023, 63(11):4383-4398.
[3] 梁晨, 杜海, 徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报, 2017, 44(2):384-393.
LIANG C, DU H, XU Y.The succession of procaryotic microbial community and the flavor components in the storage process of Daqu[J].Microbiology China, 2017, 44(2):384-393.
[4] FAN G S, FU Z L, TENG C, et al.Effects of aging on the quality of roasted sesame-like flavor Daqu[J].BMC Microbiology, 2020, 20(1):67.
[5] 徐千惠, 饶家权, 邹永芳, 等.浓香型大曲贮存期微生物群落演替及代谢产物的变化机制[J].食品科学, 2023, 44(22):225-234.
XU Q H, RAO J Q, ZOU Y F, et al.Mechanism of microbial community succession and metabolite change in Nongxiangxing Baijiu Daqu during storage[J].Food Science, 2023, 44(22):225-234.
[6] FAN G S, FU Z L, SUN B G, et al.Roles of aging in the production of light-flavored Daqu[J].Journal of Bioscience and Bioengineering, 2019, 127(3):309-317.
[7] GUAN T W, YANG H, OU M Y, et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT, 2021, 139:110544.
[8] ZHANG C L, AO Z H, CHUI W Q, et al.Characterization of volatile compounds from Daqu-a traditional Chinese liquor fermentation starter[J].International Journal of Food Science &Technology, 2011, 46(8):1591-1599.
[9] LUO H B, WANG D D, WANG Y, et al.The change rules of physiochemical indexes of Luzhou-flavor daqu based on continuous flow chemical analyzer[J].Advanced Materials Research, 2014(881-883):761-765.
[10] 范文来, 徐岩.大曲酶系研究的回顾与展望[J].酿酒, 2000, 27(3):35-40.
FAN W L, XU Y.Review of Daqu enzyme’s research[J].Liquor Making, 2000, 27(3):35-40.
[11] 陈乐乐, 王乙伊, 汪怡宁, 等.浙江地区中温大曲贮存过程细菌群落多样性及功能预测分析[J].中国酿造, 2023, 42(1):109-114.
CHEN L L, WANG Y Y, WANG Y N, et al.Diversity and functional prediction of bacterial community during the storage of medium-temperature Daqu in Zhejiang region[J].China Brewing, 2023, 42(1):109-114.
[12] 吴正坤, 刘蒲临, 杨团元, 等.不同贮存期高温大曲微生物群落演替与理化指标相关性分析[J].中国酿造, 2023, 42(7):160-166.
WU Z K, LIU P L, YANG T Y, et al.Correlation analysis of microbial community succession and physicochemical properties of Daqu in different storage periods[J].China Brewing, 2023, 42(7):160-166.
[13] 唐贤华, 田伟, 张崇军, 等.中温大曲在发酵和贮存过程中微生物群落结构分析[J].中国酿造, 2019, 38(6):113-118.
TANG X H, TIAN W, ZHANG C J, et al.Analysis of microbial community structure of medium temperature Daqu during fermentation and storage[J].China Brewing, 2019, 38(6):113-118.
[14] XI X, YANG F, CHEN L, et al.Dynamic changes of bacteria communities in Moutai-flavour Daqu during storage analysed by next generation sequencing[J].Letters in Applied Microbiology, 2022, 75(6):1486-1496.
[15] 张培芝. 大曲高温放线菌(Thermoactinomyces daqus)CICC 10681安全性评价研究[D].北京:北京林业大学, 2020.
ZHANG P Z.Study on safety evaluation of thermoactinomycetes Dacus CICC 10681 in Daqu[D].Beijing:Beijing Forestry University, 2020.
[16] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[17] TAN Y W, ZHONG H P, ZHAO D, et al.Succession rate of microbial community causes flavor difference in strong-aroma Baijiu making process[J].International Journal of Food Microbiology, 2019, 311:108350.
[18] YANG Y, WANG S T, LU Z M, et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature daqu starter[J].Food Research International, 2021, 140:110037.
[19] CHAKRABORTY S, KHOPADE A, BIAO R, et al.Characterization and stability studies on surfactant, detergent and oxidant stable α-amylase from marine haloalkaliphilic Saccharopolyspora sp.A9[J].Journal of Molecular Catalysis B:Enzymatic, 2011, 68(1):52-58.
[20] 杨少勇, 黎婷玉, 蔡文超, 等.襄阳地区高温大曲和中高温大曲真菌多样性解析[J].中国酿造, 2021, 40(5):76-80.
YANG S Y, LI T Y, CAI W C, et al.Analysis of fungal diversity in high-temperature Daqu and medium-high-temperature Daqu from Xiangyang[J].China Brewing, 2021, 40(5):76-80.
[21] 方芳, 李寅, 堵国成, 等.一株嗜热子囊菌产生的碱性耐热过氧化氢酶及其应用潜力[J].生物工程学报, 2004, 20(3):423-428.
FANG F, LI Y, DU G C, et al.Thermo-alkali-stable catalase from Thermoascus aurantiacus and its potential use in textile bleaching process[J].Chinese Journal of Biotechnology, 2004, 20(3):423-428.
[22] SMEKENOV I, BAKHTAMBAYEVA M, BISSENBAYEV K, et al.Heterologous secretory expression of β-glucosidase from Thermoascus aurantiacus in industrial Saccharomyces cerevisiae strains[J].Brazilian Journal of Microbiology, 2020, 51(1):107-123.
[23] JIANG X H, LU Y Y, LIU S Q.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae, Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms, 2020, 8(3):315.
[24] 刘敏芳, 王昊乾, 唐艺婧, 等.后火曲制作过程中理化、生化指标和微生物菌群变化及其相关性分析[J].中国酿造, 2023, 42(5):70-77.
LIU M F, WANG H Q, TANG Y J, et al.Changes of physicochemical and biochemical indexes and microbial community and analysis during the preparation of Houhuoqu[J].China Brewing, 2023, 42(5):70-77.