食源性致病菌引起的一系列食品安全问题严重危害人类健康。蜡样芽胞杆菌(Bacillus cereus)是一种革兰氏阳性杆菌,广泛在自然界和动物肠道中生存,好氧、能产生耐热芽孢。大多数菌株在6~42 ℃环境下均可生长,28~35 ℃是其最适生长温度,不易被杀死,其营养要求不高,是食源性疾病的常见致病菌[1],其引起的食物中毒位列我国细菌性食物中毒第三位[2]。致病型蜡样芽孢杆菌可以通过大量繁殖并分泌毒素引发食物中毒,主要临床表现为恶心、呕吐、腹痛、腹泻等胃肠道疾病,还可能会引发全眼球炎、心内膜炎、脑膜炎、肺炎和败血症等疾病,甚至导致死亡[3]。据世界卫生组织统计,全球每年大约有十分之一的消费者会因食用腐败食品患病,其中蜡样芽孢杆菌的感染事件排名第三,占细菌性中毒事件的11.4%[4]。食源性致病菌引起的食物中毒日益严重和普遍,开发相应的防腐抑菌剂显得尤为重要。目前,使用最多的防腐方法是添加化学防腐剂[5],但其副作用较为明显,如促使微生物发生变异、产生耐药性、化学抑菌剂在食品的残留及对人体的危害等。因此,开发绿色、安全、高效的天然抑菌防腐剂成为人们关注的热点。相关学者对天然物质的抗菌保鲜活性进行了大量的基础理论和应用研究[5-7]。
石榴(Punica pranatum L.),作为我国传统的药食同源植物,含有多种活性成分,包括氨基酸、蛋白质、酚类和鞣质、黄酮类、生物碱、糖及其苷类、有机酸、挥发油等化学成分[8-9]。作为天然物质的石榴对人体没有毒副作用并且具有调节血脂、抑菌、抗肿瘤、抗癌、预防心血管疾病、抗氧化及清除自由基、保护消化系统等药理功能[10-11]。本研究基于石榴皮显著抗氧化性及医药领域相关抑菌活性,结合当前食源性食物中毒的问题,以石榴皮为研究材料,选取最具有代表性蜡样芽孢杆菌为研究对象,以枯草芽孢杆菌和萎缩芽孢杆菌为参照,评价石榴皮提取物对蜡样芽孢杆菌的抑菌能力,并通过考察石榴皮提取物对菌体的生长曲线、菌体细胞形态、细胞膜渗透性、细胞膜完整性等进行抑菌机理的研究,研究结果将对植物源食品防腐抑菌剂及石榴皮的深度开发和利用奠定理论依据。
1 材料与方法
1.1 菌株
菌株:蜡样芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、萎缩芽孢杆菌(Bacillus atrophaeus)由甘肃农业大学提供。
1.2 材料及试剂
石榴皮粉末,兰州同仁堂药店;牛肉膏、胰蛋白胨,北京奥博星生物技术有限责任公司;NaCl、KH2PO4、Na2HPO4,西陇科学股份有限公司;25%戊二醛水溶液、无水甲醇、无水乙醇、福林试剂、无水碳酸钠、无水丙酮、蒽酮、乙酸乙酯、浓硫酸、磷酸,国药集团化学试剂有限公司;没食子酸、考马斯亮蓝R-250,上海麦克林生化科技股份有限公司。
1.3 仪器与设备
722N紫外分光光度计,上海仪电分析仪器有限公司;Regulus 8100型扫描电子显微镜,日立公司;YXQ-50A立式高压蒸汽灭菌锅,上海博讯实业有限公司;QYC-N2102C恒温摇床振荡培养箱,上海福玛公司;HHWS-Ⅱ-200恒温恒湿培养箱,上海跃进医疗器械有限公司;TGL-20M台式冷冻型离心机,上海土森视觉科技有限公司;IKARV10旋转蒸发仪,苏州赛恩斯仪器有限公司。
1.4 实验方法
1.4.1 石榴皮提取物的制备
称取石榴皮粉末10 g,按料液比1∶30(g∶mL)添加体积分数为70%的甲醇、丙酮、乙醇3种溶剂随后超声波提取(50 ℃、100 W、4 h),再经旋转蒸发仪浓缩得到浸膏后自然挥发为固体结晶,研磨为粉末备用。
1.4.2 供试菌培养及菌悬液制备
芽孢杆菌活化与培养:将保存于4 ℃冰箱中的蜡样芽孢杆菌、枯草芽孢杆菌、萎缩芽孢杆菌接种于牛肉膏蛋白胨-琼脂培养基上,于27 ℃恒温箱培养24 h。
菌悬液的制备:在恒温箱中培养24 h后的培养皿中,倒入10 mL无菌水制得的悬浮液,吸取5 mL滴入50 mL无菌NB液体培养基中,并于27 ℃、180 r/min培养8 h达到对数期(107~108 CFU/mL),备用。用平板菌落计数法确定菌液浓度。
1.4.3 抑菌作用测定
1.4.3.1 测定抑菌直径
采用打孔法及二倍稀释法测定抑菌直径。按质量浓度用无菌水溶解石榴皮提取物粉末,配制质量浓度分别为70、35、17.5、8.75、4.375、2.187 mg/mL的石榴皮提取物。取200 μL溶液,以蜡样芽孢杆菌为指示菌,枯草芽孢杆菌和萎缩芽孢杆菌为对照菌进行抑菌试验,24 h后用游标卡尺测量抑菌圈直径,无菌水作为空白对照组。
1.4.3.2 测定最低抑菌浓度(minimal inhibitory concentration,MIC)
MIC采用二倍稀释法进行测定。吸取NB液体培养基100 μL于96孔细胞培养板中,再将100 μL 200 mg/mL石榴皮提取物加到孔内,对200 mg/mL石榴皮提取物进行二倍稀释,依次取100 μL加入96孔细胞培养板中,稀释至最低质量浓度为0.1 mg/mL;随后向上述各孔板中加入100 μL培养至对数生长期的菌液。以仅加液体培养基不加菌液为阴性对照,加菌液不加石榴皮提取物为阳性对照,将96孔细胞培养板放置于27 ℃恒温培养箱24 h后,孔板中肉眼不可见浑浊的浓度即为MIC。
1.4.4 生长曲线的测定
将0.5 mL不同浓度(以MIC为最低浓度,以2倍浓度向上配比3个梯度,即质量浓度分别为2、4、8 mg/mL)的石榴皮提取物加入到3种芽孢杆菌菌悬液中,在27 ℃,180 r/min下培养,每隔2 h测定波长600 nm处的吸光值,加无菌水为对照组。前12 h每2 h测定OD600nm,24 h后再次测定OD600nm。以时间为横坐标,OD600nm值为纵坐标,绘制吸光度随时间变化的曲线即为该菌的生长曲线,试验平行3次。
1.4.5 菌体形态测定
将0.5 mL质量浓度为20 mg/mL石榴皮提取物加入到3种芽孢杆菌菌悬液中,27 ℃,180 r/min摇床振荡培养12 h后取10 mL菌液,5 000 r/min离心5 min,弃除上清液。加入25 g/L的戊二醛溶液,4 ℃固定4 h;用pH 7.4的磷酸缓冲液洗涤3次后,用乙醇梯度脱水(30%、50%、70%、90%、100%,体积分数),每次10 min;5 000 r/min离心5 min,弃上清液,依次加入50%、75%、100%叔丁醇体积分数溶液逐级冲洗,常温放置10 min。5 000 r/min离心5 min,弃上清液,依次加入叔丁醇∶乙腈(2∶1,体积比),叔丁醇∶乙腈(1∶1,体积比),乙腈溶液逐级冲洗,常温放置10 min。干燥后将菌体挑出在黑色导电胶上铺平,使用离子溅射仪镀膜,后可置于扫描电镜下观察拍摄。
1.4.6 可溶性总糖的测定
采用蒽酮法[12]测定指示菌液中可溶性总糖含量。培养方案参照1.4.4节,分别处理0、2、4、6、8、10和12 h后取出3 mL,4 000 r/min离心10 min,取上清液1 mL,加入1 mL蒸馏水,0.5 mL蒽酮试剂,再缓慢加入5 mL浓硫酸,混匀冷却后置于沸水浴中加热10 min,取出放置暗处冷却至室温,测定OD620nm,从标准曲线中查得相应的总糖含量。加等量无菌水作为对照,试验平行3次。
1.4.7 可溶性蛋白的测定
采用考马斯亮蓝法[13]测定可溶性蛋白含量。培养方案参照1.4.4节,处理方案参照1.4.6节,小心取出上清液,取考马斯亮蓝R-250溶液5 mL,向其中加入上清液1 mL,静置15 min后,于紫外分光光度计595 nm波长下测定其吸光度。通过查阅标准曲线,确定可溶性蛋白质含量。加等量无菌水为对照,试验平行3次。
1.4.8 核酸泄露的测定
培养方案参照1.4.4节,处理方案参照1.4.6节;取上清液,稀释一定倍数后测定OD260nm处吸光度值,分析细菌胞外核酸变化规律。以未经石榴皮提取物处理的菌悬液的上清液为对照。
1.4.9 电导率的测定
培养方案参照1.4.4节,处理方案参照1.4.6节,上清液用于电导率的测定,加等量无菌水作为对照,试验平行3次[14]。
1.5 数据统计分析
采用SPSS 27.0软件进行数据处理,所有实验均重复3次取其平均值,Duncan法进行差异显著性分析,图由Origin 8.5软件完成。
2 结果与分析
2.1 石榴皮提取物的抑菌作用测定结果
由表1可知,3种溶剂提取物在各浓度处理蜡样芽孢杆菌时均有抑菌圈,且抑菌圈直径随浓度增高而增大,乙醇提取物的抑菌圈最大,在质量浓度为70 mg/mL时,蜡样芽孢杆菌抑菌直径达到(13.04±0.49) mm,而枯草芽孢杆菌和萎缩芽孢杆菌在质量浓度低于4.375 mg/mL,能观察到孔洞周围有抑菌作用,但不易测量,高于8.75 mg/mL时才出现明显、清晰抑菌圈。在同一浓度下,蜡样芽孢杆菌的抑菌圈直径约为枯草芽孢杆菌和萎缩芽孢杆菌的1.5倍,且从最低抑菌浓度表2也可知,石榴皮提取物对枯草芽孢杆菌和萎缩芽孢杆菌的MIC皆为2 mg/mL,对蜡样芽孢杆菌的MIC则为1 mg/mL,说明蜡样芽孢杆菌对石榴皮提取物各浓度处理的响应更敏感,石榴皮提取物对蜡样芽孢杆菌具有较强的抑菌效果。
表1 石榴皮提取物对芽孢杆菌的抑菌作用测定
Table 1 The bacteriostatic action of pomegranate peel extract on the Bacillus
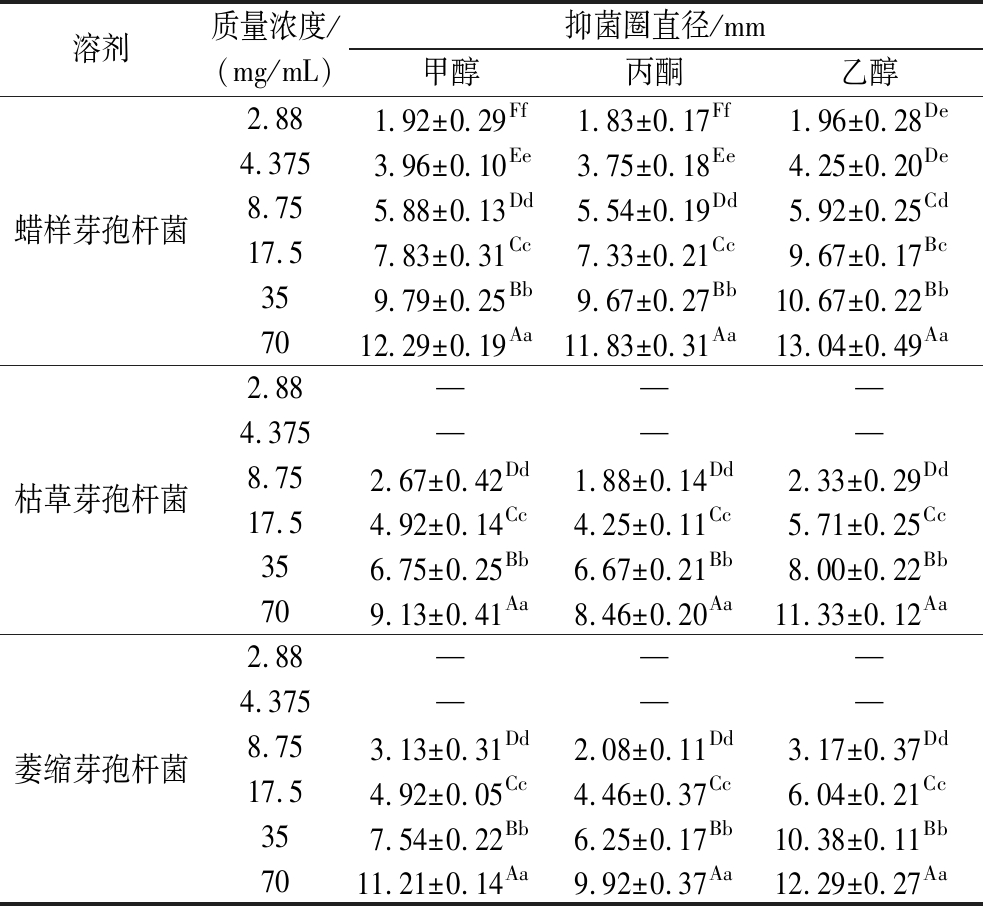
溶剂质量浓度/(mg/mL)抑菌圈直径/mm甲醇丙酮乙醇蜡样芽孢杆菌2.881.92±0.29Ff1.83±0.17Ff1.96±0.28De4.3753.96±0.10Ee3.75±0.18Ee4.25±0.20De8.755.88±0.13Dd5.54±0.19Dd5.92±0.25Cd17.57.83±0.31Cc7.33±0.21Cc9.67±0.17Bc359.79±0.25Bb9.67±0.27Bb10.67±0.22Bb7012.29±0.19Aa11.83±0.31Aa13.04±0.49Aa枯草芽孢杆菌2.88———4.375———8.752.67±0.42Dd1.88±0.14Dd2.33±0.29Dd17.54.92±0.14Cc4.25±0.11Cc5.71±0.25Cc356.75±0.25Bb6.67±0.21Bb8.00±0.22Bb709.13±0.41Aa8.46±0.20Aa11.33±0.12Aa萎缩芽孢杆菌2.88———4.375———8.753.13±0.31Dd2.08±0.11Dd3.17±0.37Dd17.54.92±0.05Cc4.46±0.37Cc6.04±0.21Cc357.54±0.22Bb6.25±0.17Bb10.38±0.11Bb7011.21±0.14Aa9.92±0.37Aa12.29±0.27Aa
注:同列标注不同小写字母表示差异显著(P<0.05),大写字母表示差异极显著(P<0.01)。—表示无抑菌圈出现。
表2 石榴皮提取物最低抑菌浓度测定
Table 2 Results of MIC determination of pomegranate peel extract by Bacillus

菌种提取物质量浓度/(mg/mL)4210.50.25蜡状芽孢杆菌---+++枯草芽孢杆菌--+++++++萎缩芽孢杆菌--+++++++
综合考虑,石榴皮乙醇提取物抑菌效果强且安全性高,后续实验选择乙醇作为提取溶剂。
2.2 石榴皮提取物对芽孢杆菌生长曲线的影响
由图1可知,不同浓度石榴皮提取物处理3种芽孢杆菌,对照组和处理组很快进入对数生长期,处理组因受到不同浓度石榴皮提取物的抑制,整体生物量均较对照小,且浓度越高生物量越小,芽孢杆菌的生长受到抑制,迟缓期有所延长,但总体上仍保持典型的细菌生长曲线。3种芽孢杆菌处理组均在24 h后进入稳定期,且中高浓度处理组蜡样芽孢杆菌和萎缩芽孢杆菌与对照差异极显著(P<0.01),表明石榴皮提取物能有效抑制芽孢杆菌的生长速度,延缓菌体的繁殖,使其生长缓慢;并且随着石榴皮提取物浓度的增加抑菌效果增强。
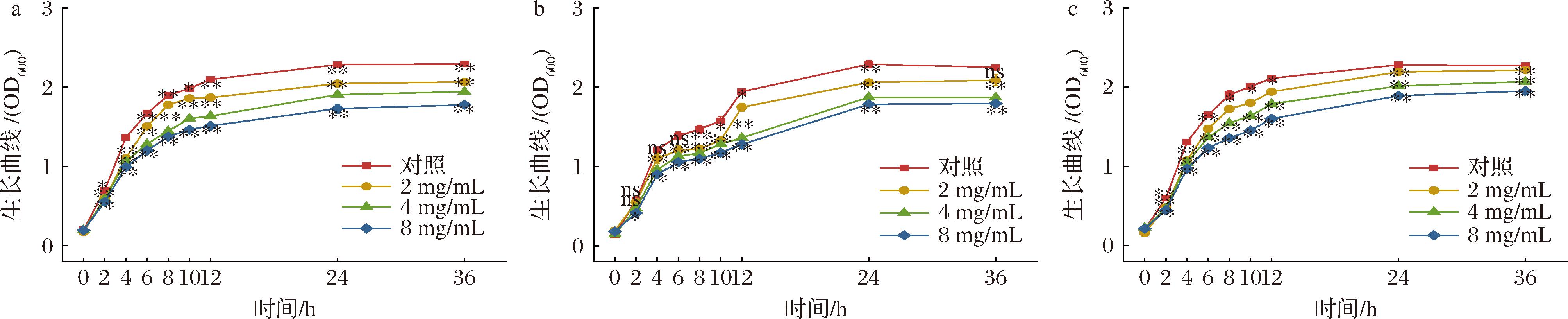
a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图1 石榴皮提取物对芽孢杆菌生长曲线的影响
Fig.1 Inhibitory growth curve of pomegranate peel extract against Bacillus
注:ns表示差异不显著(P>0.05);*表示差异显著(P<0.05);**表示差异极显著(P<0.01)(下同)。

a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图2 芽孢杆菌的扫描电子显微镜图像
Fig.2 SEM images of Bacillus
2.3 石榴皮提取物对芽孢杆菌细胞形态的影响
如图2所示,对照组蜡样芽孢杆菌呈杆状,表面粗糙,两端平整,菌体周生鞭毛;而经20 mg/mL的石榴皮提取物处理后菌体表面出现变形和破裂,鞭毛消失,部分细胞出现塌陷皱缩,且细胞内容物溢出,细胞边界模糊。对照组枯草芽孢杆菌呈规则的杆状,表面有鞭毛,边界清晰,经石榴皮提取物处理后菌体细胞形态被破坏,大量细菌堆积在一起,且有大量内容物析出。萎缩芽孢杆菌处理前是饱满立体的,多成对排列,周生鞭毛,石榴皮提取物处理后,菌体细胞变短变细,细胞形态被破坏,菌体四周出现内容物,部分细胞出现干瘪或空洞。这种形态异常主要是石榴皮提取物通过破坏芽孢杆菌细胞结构的完整性,使胞内物质流出所致。
2.4 石榴皮提取物对芽孢杆菌可溶性总糖含量的影响
当细菌膜结构发生破坏时,糖类物质外泄,引起可溶性总糖含量的升高,因此可通过芽孢杆菌菌液中可溶性总糖含量的变化来反映细胞膜结构的完整性[14]。由图3可知,对照组在培养时间内可溶性总糖含量变幅极微,持续恒定;经石榴皮提取物处理后,OD620nm值显著上升,说明处理组中细胞膜通透性发生了改变,糖类物质大量外渗,导致可溶性总糖含量大幅上升,且石榴皮提取物浓度越高,对细菌细胞膜的影响越大,可溶性总糖含量越高;尤其不同浓度处理对蜡样芽孢杆菌可溶性总糖的影响均达极显著水平(P<0.01),处理4 h三种芽孢杆菌可溶性总糖含量均达到峰值;最高浓度下,蜡样芽孢杆菌处理组可溶性总糖含量是对照组的1.75倍;枯草芽孢杆菌处理组是对照组的1.66倍;萎缩芽孢杆菌处理组是对照组的1.87倍,随后处理组可溶性总糖含量均有不同程度的下降,但总体仍远高于对照组。
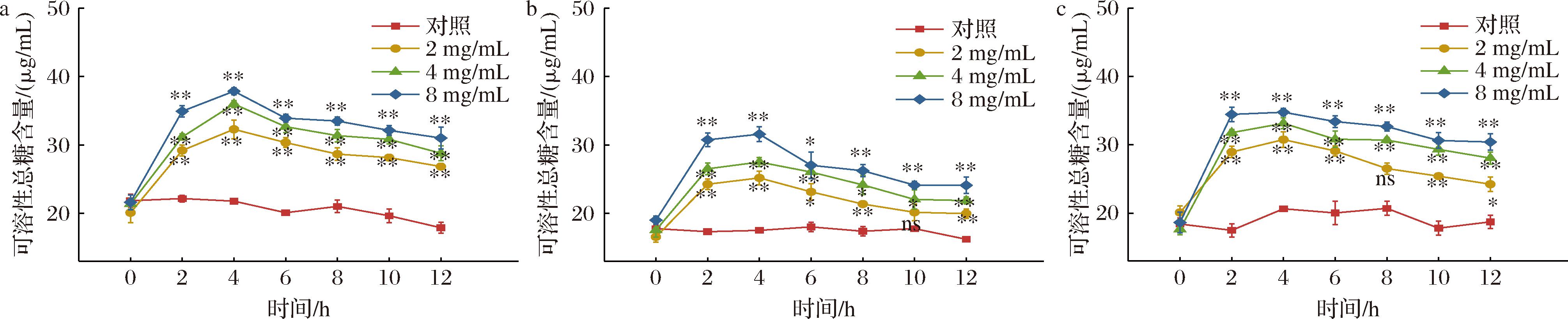
a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图3 石榴皮提取物对芽孢杆菌可溶性总糖的影响
Fig.3 Effects of pomegranate peel extract on soluble total sugar content of the Bacillus
2.5 石榴皮提取物对芽孢杆菌可溶性蛋白的影响
由图4可知,在培养期内,对照组可溶性蛋白含量持续平稳,变幅不大,处理组随着培养时间的延长,可溶性蛋白质含量持续增加,且远高于对照组。处理组3种芽孢杆菌可溶性蛋白含量变化趋势整体相似,0~10 h可溶性蛋白含量增加;10 h后可溶性蛋白含量变化较小,高浓度稍有增高,低浓度有所降低,但可溶性蛋白含量随处理浓度增加而升高;12 h时,3种芽孢杆菌最高浓度处理组的可溶性蛋白含量分别是对照组的2.43、2.09、2.53倍,蜡样芽孢杆菌及萎缩芽孢杆菌各浓度处理间与对照差异均极显著(P<0.01),说明石榴皮提取物浓度越高,对细胞膜完整性影响越大,使细胞破裂,细胞质外泄,细胞质中大量的蛋白质进入培养液中,从而引起培养液中蛋白质含量的提高。
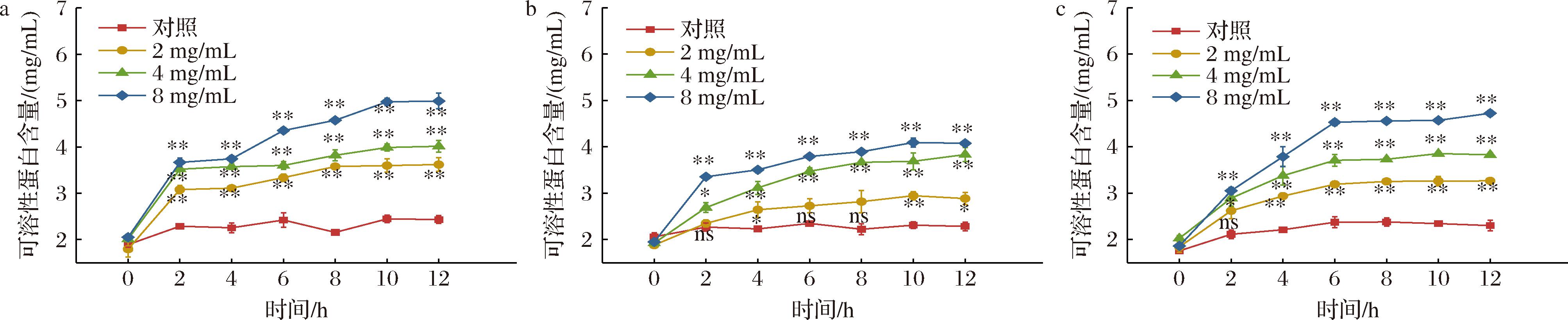
a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图4 石榴皮提取物对芽孢杆菌可溶性蛋白的影响
Fig.4 Effect of pomegranate peel extract on soluble proteins of Bacillus
2.6 石榴皮提取物对芽孢杆菌核酸泄露的影响
细胞膜是外界环境刺激对细胞不可渗透的屏障,而细胞通透性是菌体正常生长代谢的重要指标[15],核酸作为细胞内的大分子物质,正常状态下不能透过细胞膜释放在胞外,当细胞膜遭到破坏时,菌体内容物向外释放[16],内容物释放量越大,细胞膜通透性破坏程度越大。核酸在260 nm有最大吸收峰,因此可通过OD260nm来表征细胞外的核酸的泄露情况,以此评价细胞膜通透性[17]。如图5所示,3种芽孢杆菌对照组OD260nm在0~12 h处理时间内变幅不大,相对持续平稳,经石榴皮提取物处理后,OD260nm值显著上升,与对照差异均达显著水平(P<0.05),高浓度处理均达极显著水平(P<0.01),蜡样芽孢杆菌在处理6 h时,OD260nm增加至峰值,最高浓度处理组是对照组的3.04倍,10 h后趋于平稳;枯草芽孢杆菌、萎缩芽孢杆菌在处理4 h时,OD260nm增加到最高值,最高浓度处理组均是对照组的2.45倍,6~8 h后趋于平稳,中低浓度处理与对照差异未达极显著。由此可见,石榴皮提取物可以通过破坏芽孢杆菌细胞膜的完整性,使胞内核酸大量泄露,并且随着石榴皮提取物浓度增加,细胞膜破坏效果增强,影响细胞的正常生长,从而抑制了细菌的繁殖。
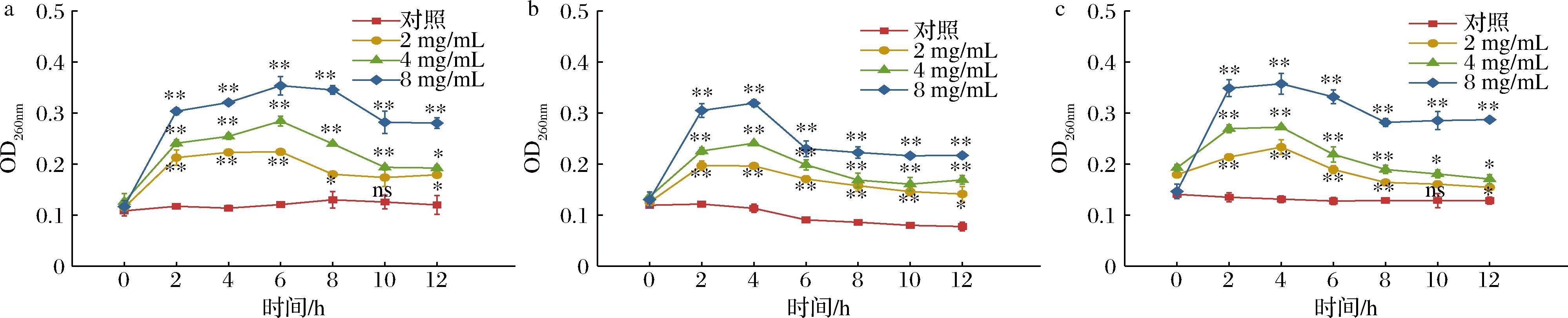
a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图5 石榴皮提取物对芽孢杆菌核酸泄露的影响
Fig.5 Effect of pomegranate peel extract on nucleic acid leakage of Bacillus
2.7 石榴皮提取物对芽孢杆菌电导率的影响
细胞膜是细菌的一层保护屏障,当强抑制剂破坏细胞膜时,细菌的保护屏障被打破,使其内部的电解质,如钾、钙离子等渗透到了细胞外的培养液中,使其培养液的电导率上升,电解质外渗导致细胞内多种代谢途径受阻,影响菌体的生长[18]。由图6可知,不同浓度石榴皮提取物对芽孢杆菌的细胞膜的通透性均有一定的影响,加入石榴皮提取物后,3种芽孢杆菌的电导率显著增大,且处理浓度越高及处理时间越长电导率越大,而对照组电导率值变化不大,造成以上原因可能是石榴皮提取物破坏了细菌细胞膜,细胞内电解质外渗到培养液中,使菌液电导率增加。高浓度处理蜡样芽孢杆菌与对照的电导率差异极显著(P<0.01),处理组是对照组的1.16倍,对枯草芽孢杆菌电导率的影响不及其他2种供试菌,处理前期各浓度与对照差异不达极显著。
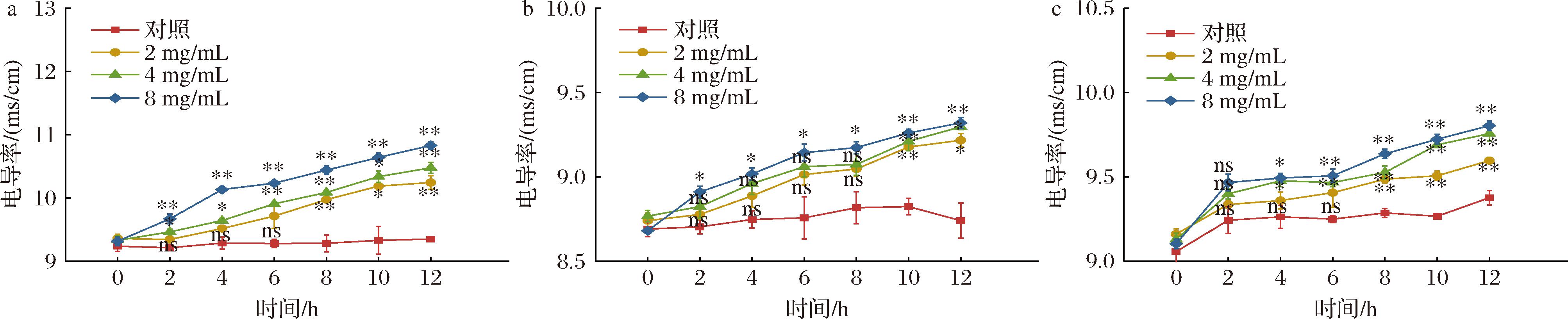
a-蜡样芽孢杆菌;b-枯草芽孢杆菌;c-萎缩芽孢杆菌
图6 石榴皮提取物对芽孢杆菌电导率的影响
Fig.6 Effect of pomegranate peel extract on electrical conductivity of Bacillus
3 结论与讨论
研究不同溶剂对石榴皮抑菌效果的影响,结果表明乙醇提取物抑菌效果最好,70 mg/mL质量浓度的石榴皮提取物对蜡样芽孢杆菌的抑菌圈直径为(13.04±0.49) mm,在同浓度同菌种条件下,甲醇提取物次之,为(12.29±0.19) mm,丙酮提取物最差,为(11.83±0.31) mm,这与董周永[19]的试验结果稍有不同,其溶剂提取物抑菌效果为甲醇>乙醇>丙酮,其原因可能是提取方式不同,导致获得抑菌成分的比例不同,或因抑菌对象及石榴品种、产地、成熟期不同等[10];相关研究表明,多酚存在广泛抑菌作用[20-22],本研究提取过程参考石榴皮多酚提取方案[23],提取率高达36.4%,利用Folin-Ciocalteu比色法,获得多酚含量最高为23.4%,且研究得知,不同溶剂提取物的抑菌圈直径与多酚含量正相关,故推测本研究石榴皮提取物的主要抑菌成分与多酚有关,后续研究中将通过生物追踪法联合高效液相质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS)等测定其主要抑菌成分。
石榴皮提取物对3种芽孢杆菌均有明显的抑制作用,洪军等[24]、董周永[19]、徐云凤等[10]研究发现石榴皮提取物对肠炎沙门氏菌、副溶血性弧菌、李斯特氏菌、大肠杆菌、鼠伤寒沙门氏菌、金黄色葡萄球菌、巨大芽孢杆菌、枯草芽孢杆菌、大肠杆菌、铜绿假单胞菌等都能够有效抑制其生长,本研究发现其对蜡样芽孢杆菌及萎缩芽孢杆菌亦有抑菌效果,说明石榴皮对细菌具有广谱抑菌作用,具有开发为植物源防腐保鲜剂的潜力。
石榴皮提取物能使芽孢杆菌的生物量下降,有效抑制指示菌的生长速率,使菌体缓慢生长,这与饶苇等[25]、阚玉红等[26]、孙伟等[27]研究效果相似;在抑菌机理研究中,通过对供试菌的电镜扫描观测,石榴皮提取物处理可导致3种芽孢杆菌的菌体细胞形态发生变化,由此对细胞膜通透性及完整性相关物质进行测定。研究发现,石榴皮提取物能使供试菌可溶性总糖、可溶性蛋白、核酸泄漏量及电导率均较对照显著上升,且上升幅度随处理浓度增加而升高,刘芮等[28]、PAUL等[29]、KOHANSKI等[30]也获得相似结果,由此进一步证明石榴皮提取物能破坏细胞膜完整性,使细胞膜透性增强,细胞活力丧失。
赵妗颐等[31]在研究巨大芽孢杆菌L2发酵产物对魔芋软腐病菌的抑菌机制中发现空白组中可溶性总糖质量浓度与培养时间呈负相关,说明在菌体细胞膜保持完整情况下,魔芋软腐病菌能吸收菌体外糖类物质供自身利用;本研究在可溶性总糖测定中处理前期总体上升,后期有下降,分析其原因推测为:处理后期可溶性总糖含量有所下降可能与泄露出可溶性总糖又被新生细菌吸收利用有关;而有关核酸泄露呈现的先上升后下降趋势,陈琦等[32]在研究月见草籽粗提物对致病性枯草芽孢杆菌的抑菌能力中也得到相似结论,这可能与外泄核酸物质帮助受损细菌细胞进行生长和修复而导致含量下降有关,但具体其下降原因还有待进一步研究。
研究通过石榴皮提取物对蜡样芽孢杆菌的抑菌效果及抑菌机理进行探究,表明石榴皮提取物可通过改变的芽孢杆菌的细胞形态以及破坏细胞膜,使细胞内容物泄漏从而达到抑菌效果。因此,结合研究报道,认为石榴皮既可控制常见肠道有害菌又能抑制由蜡样芽孢杆菌引发的食品致腐细菌的生长,有望用于绿色、天然生物防腐抑菌剂的开发来源。
[1] PORCELLATO D, ASPHOLM M, SKEIE S B, et al.Application of a novel amplicon-based sequencing approach reveals the diversity of the Bacillus cereus group in stored raw and pasteurized milk[J].Food Microbiology, 2019, 81:32-39.
[2] 褚发军, 冉陆, 马莉, 等.2008—2010年全国突发公共卫生事件网络报告食物中毒流行病学分析[J].中国食品卫生杂志, 2012, 24(4):387-390.
CHU F J, RAN L, MA L, et al.Analysis on the reported food poisoning incidents in public health emergency events surveillance system in China, 2008—2010[J].Chinese Journal of Food Hygiene, 2012, 24(4):387-390.
[3] 黄晶菁, 罗静, 何宏轩.蜡样芽孢杆菌检测方法研究进展[J].中国畜牧兽医, 2018, 45(3):635-642.
HUANG J J, LUO J, HE H X.Research progress on detection methods for Bacillus cereus[J].China Animal Husbandry &Veterinary Medicine, 2018, 45(3):635-642.
[4] HAVELAAR A H, KIRK M D, TORGERSON P R, et al.World health organization global estimates and regional comparisons of the burden of foodborne disease in 2010[J].PLoS Medicine, 2015, 12(12):e1001923.
[5] ZHANG Y B, LIU X Y, WANG Y F, et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control, 2016, 59:282-289.
[6] WEI L L, YANG M, HUANG L, et al.Antibacterial and antioxidant flavonoid derivatives from the fruits of Metaplexis japonica[J].Food Chemistry, 2019, 289:308-312.
[7] ZHANG Y, WU Y T, ZHENG W, et al.The antibacterial activity and antibacterial mechanism of a polysaccharide from Cordyceps cicadae[J].Journal of Functional Foods, 2017, 38:273-279.
[8] AKHTAR S, ISMAIL T, FRATERNALE D, et al.Pomegranate peel and peel extracts:Chemistry and food features[J].Food Chemistry, 2015, 174:417-425.
[9] 乔树华. 石榴皮抑菌活性的初步研究[D].北京:中国农业科学院, 2009.
QIAO S H.Preliminary reaearch on antifungal activity of the peel of Punica granatun Linn.[D].Beijing:Chinese Academy of Agricultural Sciences, 2009.
[10] 徐云凤, 赵胜娟, 费鹏, 等.石榴皮提取物的抑菌作用及应用研究进展[J].食品与机械, 2021, 37(2):215-219.
XU Y F, ZHAO S J, FEI P, et al.Research progress on antimicrobial effects and application of pomegranate peel extract[J].Food &Machinery, 2021, 37(2):215-219.
[11] SINGH R P, CHIDAMBARA MURTHY K N, JAYAPRAKASHA G K.Studies on the antioxidant activity of pomegranate (Punica granatum) peel and seed extracts using in vitro models[J].Journal of Agricultural and Food Chemistry, 2002, 50(1):81-86.
[12] 李海瑄, 高鹤尘, 陈忠军.乳杆菌产生的抑酵母活性物质抑菌机理的研究[J].中国乳品工业, 2015, 43(10):9-12;17.
LI H X, GAO H C, CHEN Z J.Study on inhibiting mechanism of antiyeast substances produced by Lactobacillus[J].China Dairy Industry, 2015, 43(10):9-12;17.
[13] LI Y Q, HAN Q, FENG J L, et al.Antibacterial characteristics and mechanisms of ɛ-poly-lysine against Escherichia coli and Staphylococcus aureus[J].Food Control, 2014, 43:22-27.
[14] 高娟娟, 贾丽艳, 畅盼盼, 等.枯草芽孢杆菌细菌素A32的抑菌机理研究[J].中国食品学报, 2021, 21(10):56-64.
GAO J J, JIA L Y, CHANG P P, et al.Studies on the inhibition mechanism of bacteriocin A32 producing by Bacillus subtilis[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(10):56-64.
[15] 杜金婷, 张雁, 李雁, 等.茶皂素对食源性腐败酵母的抑菌能力及作用机理[J].现代食品科技, 2022, 38(5):118-125;327.
DU J T, ZHANG Y, LI Y, et al.Antibacterial activity and mechanism of tea saponin against foodborne spoilage yeasts[J].Modern Food Science and Technology, 2022, 38(5):118-125;327.
[16] SHEN S X, ZHANG T H, YUAN Y, et al.Effects of cinnamaldehyde on Escherichia coli and Staphylococcus aureus membrane[J].Food Control, 2015, 47:196-202.
[17] AJIBOYE T O, MOHAMMED A O, BELLO S A, et al.Antibacterial activity of Syzygium aromaticum seed:Studies on oxidative stress biomarkers and membrane permeability[J].Microbial Pathogenesis, 2016, 95:208-215.
[18] LEE H J, CHOI G J, CHO K Y.Correlation of lipid peroxidation in Botrytis cinerea caused by dicarboximide fungicides with their fungicidal activity[J].Journal of Agricultural and Food Chemistry, 1998, 46(2):737-741.
[19] 董周永. 石榴果皮提取物抑菌活性研究[D].杨凌:西北农林科技大学, 2008.
DONG Z Y.Study on antimicrobial activity of pomegranate peel extract[D].Yangling:Northwest A&F University, 2008.
[20] 熊素英. 石榴皮抑菌液的制备及抑菌特性研究[D].杨凌:西北农林科技大学, 2007.
XIONG S Y.Studies on Preparation of antimicrobial liquid and antimicrobial character of pomegranate peel[D].Yangling:Northwest A &F University, 2007.
[21] AL-ZOREKY N S.Antimicrobial activity of pomegranate (Punica granatum L.) fruit peels[J].International Journal of Food Microbiology, 2009, 134(3):244-248.
[22] ZHU X F, ZHANG H X, LO R.Phenolic compounds from the leaf extract of artichoke (Cynara scolymus L.) and their antimicrobial activities[J].Journal of Agricultural and Food Chemistry, 2004, 52(24):7272-7278.
[23] 王华斌. 石榴皮多酚提取纯化及纳米乳制备工艺研究[D].乌鲁木齐:新疆农业大学, 2011.
WANG H B.Study on the extraction, purification and nanoemulsion preparation of polyphenols from pomegranate peel[D].Urumqi:Xinjiang Agricultural University, 2011.
[24] 洪军, 李文玉, 卫夏怡, 等.石榴皮提取物的抑菌活性及其对冷却鸡肉保鲜效果[J].中国调味品, 2020, 45(3):73-76;82.
HONG J, LI W Y, WEI X Y, et al.Antibacterial activity of pomegranate peel extracts and their preservation effect on cooled chicken[J].China Condiment, 2020, 45(3):73-76;82.
[25] 饶苇, 陈奎霖, 方子莹, 等.植物乳杆菌SCB2505代谢物对液化沙雷氏菌的抑菌机理[J].食品与发酵工业, 2024, 50(8):138-145.
RAO W, CHEN K L, FANG Z Y, et al.Antibacterial mechanism of Lactobacillus plantarum SCB2505 metabolites against Serratia liquefaciens[J].Food and Fermentation Industries, 2024, 50(8):138-145.
[26] 阚玉红, 谢笔钧, 孙智达.胭脂红番石榴叶黄酮提取物的抑菌活性及其机理[J].中国调味品, 2021, 46(12):159-166;188.
KAN Y H, XIE B J, SUN Z D.Antibacterial activity and mechanism of flavonoids extracted from leaves of Psidium guajava L[J].China Condiment, 2021, 46(12):159-166;188.
[27] 孙伟, 袁玉华, 余以刚.香芹酚对蜡样芽孢杆菌的抑菌作用评价[J].食品与发酵工业, 2024, 50(18):141-147.
SUN W, YUAN Y H, YU Y G.Evaluation of antibacterial effect of carvacrol on Bacillus cereus[J].Food and Fermentation Industries, 2024, 50(18):141-147.
[28] 刘芮, 张文成.银杏黄酮的抑菌活性及机理[J].食品研究与开发, 2022, 43(24):73-79.
LIU R, ZHANG W C.Antibacterial activity and mechanism of flavonoids from Ginkgo biloba L[J].Food Research and Development, 2022, 43(24):73-79.
[29] PAUL S, DUBEY R C, MAHESWARI D K, et al.Trachyspermum ammi (L.) fruit essential oil influencing on membrane permeability and surface characteristics in inhibiting food-borne pathogens[J].Food Control, 2011, 22(5):725-731.
[30] KOHANSKI M A, DWYER D J, COLLINS J J.How antibiotics kill bacteria:From targets to networks[J].Nature Reviews.Microbiology, 2010, 8(6):423-435.
[31] 赵妗颐, 肖洋, 杨龙, 等.巨大芽孢杆菌L2发酵产物对魔芋软腐病菌的抑菌机制[J].食品科学, 2019, 40(21):14-20.
ZHAO J Y, XIAO Y, YANG L, et al.Antibacterial mechanism of fermentation product from Bacillus megaterium L2 against Erwinia carotovora subsp.carotovora[J].Food Science, 2019, 40(21):14-20.
[32] 陈琦, 张可鑫, 梁泽华, 等.月见草籽粗提物对致病性枯草芽孢杆菌的抑菌能力[J].中国药理学与毒理学杂志, 2019, 33(10):914.
CHEN Q, ZHANG K X, LIANG Z H, et al.Antibacterial ability of evening primrose against Bacillus subtilis[J].Chinese Journal of Pharmacology and Toxicology, 2019, 33(10):914.