肠道微生物群对人类疾病的发生和发展有着重大的影响[1]。肠上皮表面覆盖的一层黏液是宿主抵御微生物侵害的第一道防线[2-3],它限制细菌与肠道上皮接触,其变化与人体健康密切相关[4]。黏蛋白是黏液的主要结构成分,特定的肠道微生物可以调节黏液屏障,从而有利于肠道和宿主的健康,例如,嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila, AKK),但其与黏液相互作用的复杂机制仍需要进一步研究[5]。此外,肠道共生菌和病原菌可以将黏蛋白作为附着位点和能源,从而促进其增殖和定殖。肠上皮可以通过微生物的特定分子模式(microbe-associated molecular patterns, MAMPS)来区分共生菌和致病菌[6]。共生菌可以增加黏液产量并占据黏液上可用的结合位点来防止病原体入侵[6-7]。而病原菌因其能改变黏液pH,降低黏液黏弹性,增加黏液的运动性继而引起感染。再者,部分病原菌还能利用共生细菌降解黏蛋白所释放的产物,如游离岩藻糖和唾液酸从而改变黏液保护屏障的功能[8]。因此,了解不同细菌利用黏蛋白的平衡关系对理解宿主和肠道微生物的关系有着重要作用。
目前发现只有少数肠道微生物群成员可以将黏蛋白作为唯一碳源生长[9],主要有嗜黏蛋白阿克曼氏菌、多形拟杆菌(Bacteroides thetaiotaomicron)、脆弱拟杆菌(Bacteroides fragilis)、瘤胃球菌属(Ruminococcus)、双歧杆菌属(Bifidobacterium)。其中长双歧杆菌长亚种(Bifidobacterium longum subsp.longum)、长双歧杆菌婴儿亚种(Bifidobacterium longum subsp.infantis)、短双歧杆菌(Bifidobacterium breve)、两歧双歧杆菌(Bifidobacterium bifidum)已被报道在体外实验中可以将黏蛋白作为唯一碳源进行代谢活动[10-12]。但是以上部分研究中所使用的培养基成分缺乏科学性,牛肉膏、蛋白胨这样的复杂成分会对结果产生影响。此外,现有研究主要集中于肠道微生物对饮食来源的碳源的代谢特性以及交叉喂养关系,而双歧杆菌利用黏蛋白作为碳源具有哪些代谢特性,其代谢产物具有何种特征,以及不同双歧杆菌之间在利用黏蛋白时是否存在互作关系有待进一步探究。
因此,本研究探究不同双歧杆菌对黏蛋白的利用情况。利用合成培养基,将黏蛋白作为唯一碳源对不同种双歧杆菌进行体外培养,分析双歧杆菌利用黏蛋白并对彼此的交叉喂养行为。通过高分辨非靶向代谢组学技术,对双歧杆菌降解黏蛋白后的发酵液样本进行分析,鉴定双歧杆菌发酵黏蛋白后呈显著变化的差异代谢物,分析发酵液中不同发酵时间(16、24 h)代谢物的变化,并结合KEGG通路探讨双歧杆菌利用黏蛋白的代谢途径。本研究探讨了双歧杆菌利用宿主黏蛋白的代谢产物与宿主健康的关系,为理解双歧杆菌利用黏蛋白行为提供理论参考。
1 材料与方法
1.1 试剂与耗材
MRS肉汤培养基、溴甲酚紫,国药集团化学试剂有限公司;0.22 μm无菌过滤器(SORFA),无锡恒康医疗科技有限公司;蛋白酶K(Adamas-life),上海泰坦科技股份有限公司;黏蛋白Type Ⅲ、色谱甲醇(≥99.5%)、色谱乙腈(≥99.5%),美国Sigma公司;透析袋(麦斯诺),南通市海之星实验器材有限公司。
1.2 材料和设备
5417R冷冻离心机,德国Eppendorf公司;Multiscan Go多功能酶标仪,美国Thermo fisher公司;SX-300型灭菌锅,日本Tomy Digital Biology公司;DG250厌氧工作箱,英国Don Whitley公司;GR60DA压力蒸汽灭菌锅,厦门致微仪器有限公司;ICS-3000离子色谱仪和脉冲安培检测器,美国Dionex公司。
1.3 试验菌株
短双歧杆菌(19株)、长双歧杆菌长亚种(10株)、长双歧杆菌婴儿亚种(10株)、青春双歧杆菌(10株)、动物双歧杆菌(10株)、两歧双歧杆菌(23株),均保藏于江南大学食品生物技术研究中心菌种保藏库。
1.4 实验方法
1.4.1 合成培养基的配制[13]
合成培养基配制具体见表1和表2。
表1 合成培养基的基础成分
Table 1 The basic component of the synthetic medium
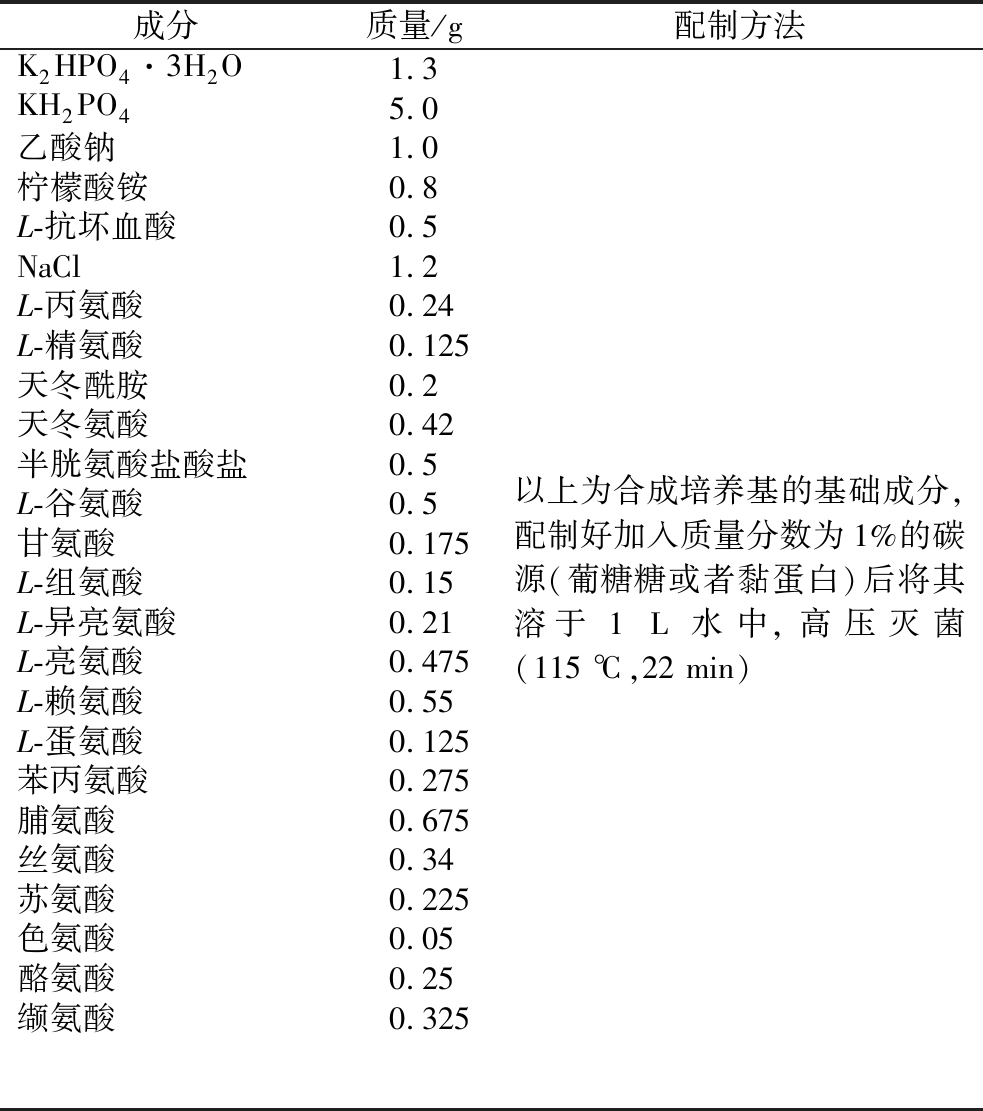
成分质量/g配制方法K2HPO4·3H2O1.3KH2PO45.0乙酸钠1.0柠檬酸铵0.8L-抗坏血酸0.5NaCl1.2L-丙氨酸0.24L-精氨酸0.125天冬酰胺0.2天冬氨酸0.42半胱氨酸盐酸盐0.5L-谷氨酸0.5甘氨酸0.175L-组氨酸0.15L-异亮氨酸0.21L-亮氨酸0.475L-赖氨酸0.55L-蛋氨酸0.125苯丙氨酸0.275脯氨酸0.675丝氨酸0.34苏氨酸0.225色氨酸0.05酪氨酸0.25缬氨酸0.325以上为合成培养基的基础成分,配制好加入质量分数为1%的碳源(葡糖糖或者黏蛋白)后将其溶于1 L水中,高压灭菌(115 ℃,22 min)
表2 合成培养基的其他成分
Table 2 The other component of the synthetic medium
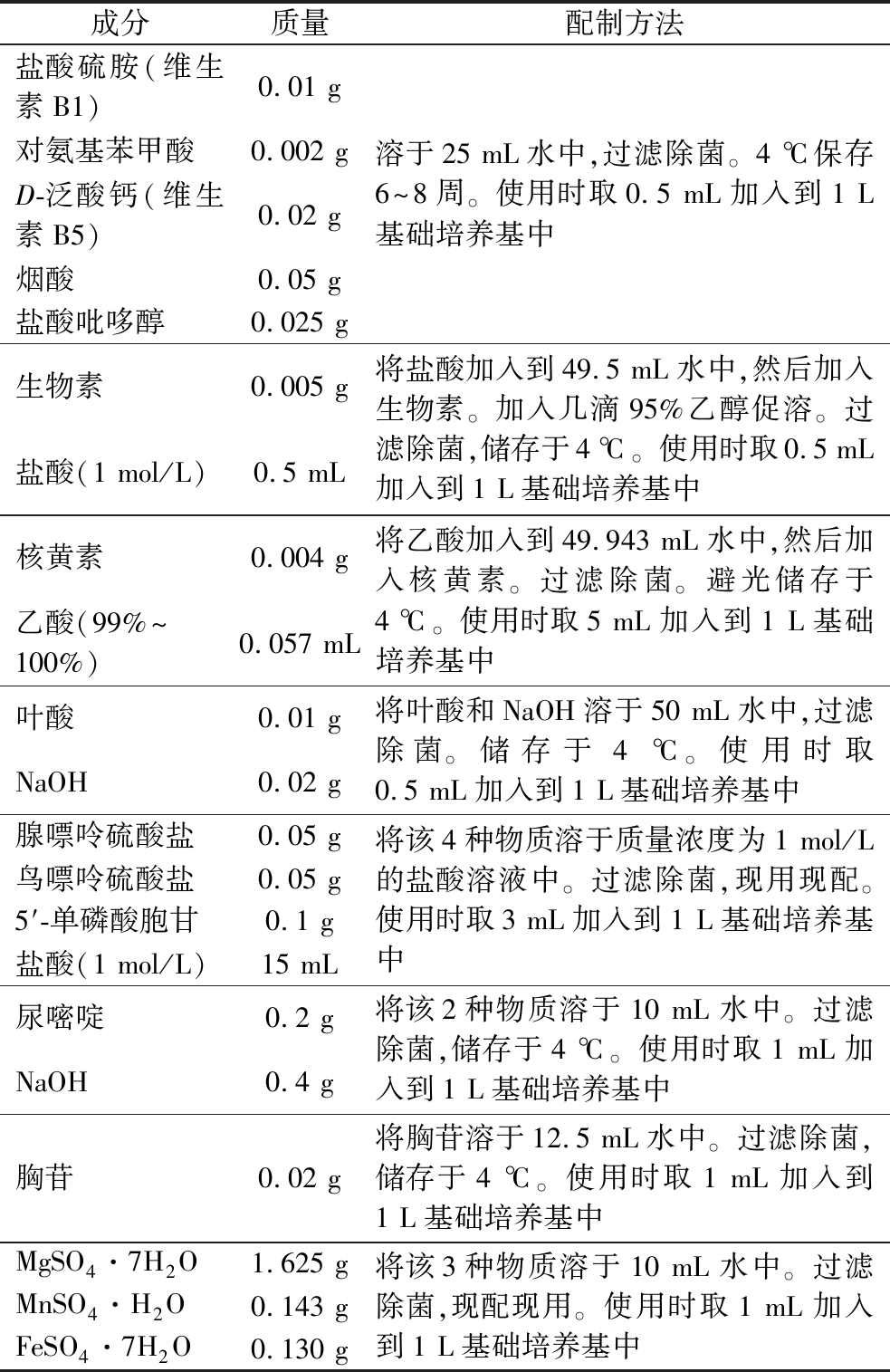
成分质量配制方法盐酸硫胺(维生素B1)0.01 g对氨基苯甲酸0.002 gD-泛酸钙(维生素B5)0.02 g烟酸0.05 g盐酸吡哆醇0.025 g溶于25 mL水中,过滤除菌。4 ℃保存6~8周。使用时取0.5 mL加入到1 L基础培养基中生物素0.005 g盐酸(1 mol/L)0.5 mL将盐酸加入到49.5 mL水中,然后加入生物素。加入几滴95%乙醇促溶。过滤除菌,储存于4 ℃。使用时取0.5 mL加入到1 L基础培养基中核黄素0.004 g乙酸(99%~100%)0.057 mL将乙酸加入到49.943 mL水中,然后加入核黄素。过滤除菌。避光储存于4 ℃。使用时取5 mL加入到1 L基础培养基中叶酸0.01 gNaOH0.02 g将叶酸和NaOH溶于50 mL水中,过滤除菌。储存于4 ℃。使用时取0.5 mL加入到1 L基础培养基中腺嘌呤硫酸盐0.05 g鸟嘌呤硫酸盐0.05 g5′-单磷酸胞甘0.1 g盐酸(1 mol/L)15 mL将该4种物质溶于质量浓度为1 mol/L的盐酸溶液中。过滤除菌,现用现配。使用时取3 mL加入到1 L基础培养基中尿嘧啶0.2 gNaOH0.4 g将该2种物质溶于10 mL水中。过滤除菌,储存于4 ℃。使用时取1 mL加入到1 L基础培养基中胸苷0.02 g将胸苷溶于12.5 mL水中。过滤除菌,储存于4 ℃。使用时取1 mL加入到1 L基础培养基中MgSO4·7H2O1.625 gMnSO4·H2O0.143 gFeSO4·7H2O0.130 g将该3种物质溶于10 mL水中。过滤除菌,现配现用。使用时取1 mL加入到1 L基础培养基中
1.4.2 黏蛋白纯化[14]
将质量分数为2.5%的黏蛋白重悬在缓冲溶液(Tris,100 mmol/L,pH 7.4)中,混合物立即高压灭菌(121 ℃,5 min)。随后将加热的溶液冷却至65 ℃,添加蛋白酶K至终质量浓度为0.1 mg/mL,并将悬浮液孵育16~20 h(50~65 ℃)。将得到的蛋白水解溶液离心去除不溶性物质(4 ℃,12 000×g,30 min),并添加0.1 mol/L的NaOH溶液和1 mol/L的硼氢化钠溶液。将该溶液在55 ℃下孵育16 h,以促进黏蛋白O-聚糖和糖胺聚糖从黏蛋白糖肽中选择性释放。孵育后将溶液的pH值降至7.0并离心(4 ℃,12 000×g,30 min),再使用0.22 μm过滤器过滤以去除剩余的不溶性物质。随后将滤液进行透析(1 kDa截止值)以去除盐和污染的小分子。
1.4.3 双歧杆菌对黏蛋白的利用
将待测的菌株活化二代并培养至对数末期后,以1%的比例(体积分数)接种到黏蛋白或葡萄糖作为唯一碳源的合成培养基中,而后将质量分数为0.5%的溴甲酚紫溶液通过滤膜除菌后加入培养基。于厌氧工作站(37 ℃)中培养16~24 h。期间,观察并记录培养基颜色变化。以添加葡萄糖作为唯一碳源的合成培养基作为空白对照。
1.4.4 双歧杆菌交叉喂养
用接种环蘸取保菌管中的少量菌液,在含有半胱氨酸的MRS固体培养基上划线分离,37 ℃厌氧培养48 h;使用接种环挑单菌落接种于含有半胱氨酸的MRS液体培养基中,37 ℃厌氧培养18~20 h;最后以2%的接种量(体积分数)传代2次,离心收集对数末期的菌体,用等体积的灭菌生理盐水洗涤、重悬菌体。双歧杆菌发酵黏蛋白16 h后的培养基过滤除菌后加入96孔板中(每孔200 μL),以1%的接种量(体积分数)将重悬的其他不同双歧杆菌菌液接种至不同碳源的培养基中(每株菌设置3个平行置),于厌氧工作站(37 ℃)中培养36 h后取出,利用酶标仪测定OD600nm值。以双歧杆菌发酵黏蛋白16 h过滤除菌后的培养基作为空白对照。
1.4.5 非靶向代谢组学分析
取两歧双歧杆菌发酵黏蛋白后16 h和24 h的发酵液以及未添加两歧双歧杆菌的黏蛋白16 h和24 h发酵液,离心(4 ℃、6 000×g、10 min)收集上清液后过0.22 μm滤膜得到无菌发酵液,经400 μL甲醇沉淀蛋白质,离心取上清液真空浓缩蒸发至干,最后以100 μL甲醇溶液(甲醇∶水=4∶1,体积比)复溶待测。
仪器采用Thermo U3000,使用ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm)色谱柱,自动进样器温度设为15 ℃,以0.30 mL/min的流速,40 ℃的柱温,进样2 μL进行梯度洗脱。流动相:(A)100% H2O(25 mmol/L CH3COONH4+25 mmol/L NH4OH),(B)乙腈。梯度洗脱:0~1 min,95% B;1~14 min,95%~65% B;14~16 min,65%~40% B;16~18 min,40% B;18~18.1 min,40%~95% B;18.1~23 min,95% B。采用Compound Discover 3.3软件进行样本的峰识别、提取、对齐和整合。
1.4.6 数据处理
本研究中涉及的各项指标均进行3次重复实验。采用Wilcoxon检验计算任意两组间方差。利用MetaboAnalyst 5.0平台筛选差异显著代谢物并进行多维统计分析,以根据投影中的可变重要性(variable importance projection, VIP)值找到潜在的差异代谢物。火山图在https://www.omicstudio.cn/tool网站完成。差异物质热图在https://www.bioincloud.tech网站完成。
2 结果与分析
2.1 不同双歧杆菌对黏蛋白的利用情况
将6种双歧杆菌在以黏蛋白作为唯一碳源的合成培养基中进行了体外碳水化合物利用能力测试。若培养基中的碳源可以被双歧杆菌所利用,会产生酸性代谢产物使pH值降低,则培养基变为黄色,若不能被利用,则培养基仍为紫色。表3结果表明,以黏蛋白为唯一碳源时所有两歧双歧杆菌都能很好地利用黏蛋白,而其他双歧杆菌则无法直接利用黏蛋白。
表3 双歧杆菌对黏蛋白的利用情况
Table 3 Utilization of Mucin by Bifidobacterium

种属可利用黏蛋白的菌株数短双歧杆菌0/19长双歧杆菌长亚种0/10长双歧杆菌婴儿亚种0/10青春双歧杆菌0/10动物双歧杆菌0/10两歧双歧杆菌23/23
注:表中分子表示该双歧杆菌中可以利用黏蛋白的数量,分母表示本文研究的该双歧杆菌实验的总菌株数量。
2.2 两歧双歧杆菌利用黏蛋白后对其他双歧杆菌增殖的影响情况
现有研究主要集中于肠道微生物对饮食来源的碳源交叉喂养关系,而对肠道微生物利用宿主来源的碳源(黏蛋白)交叉喂养的信息有限。表3结果表明,只有两歧双歧杆菌可以将黏蛋白作为单一碳源,于是作出如下假设,其利用黏蛋白的行为是否对肠道内其他双歧杆菌生长具有影响?本研究随即选取5株地域差异较大的两歧双歧杆菌,将其发酵黏蛋白16 h后的培养基过滤除菌后作为其他双歧杆菌的培养基,观察对其他双歧杆菌增殖的影响。如图1所示,两歧双歧杆菌发酵黏蛋白后的代谢产物可以显著促进婴儿双歧杆菌的生长(P<0.000 1),其中菌株M1D201M5发酵后的培养基中培养的婴儿双歧杆菌OD值最高,OD值均大于0.15。因此推测两歧双歧杆菌代谢黏蛋白所产生的代谢产物(低分子聚糖),可作为其他双歧杆菌的碳源,利于其他肠道共生菌的生长。后续将对这些代谢物进行着重分析。
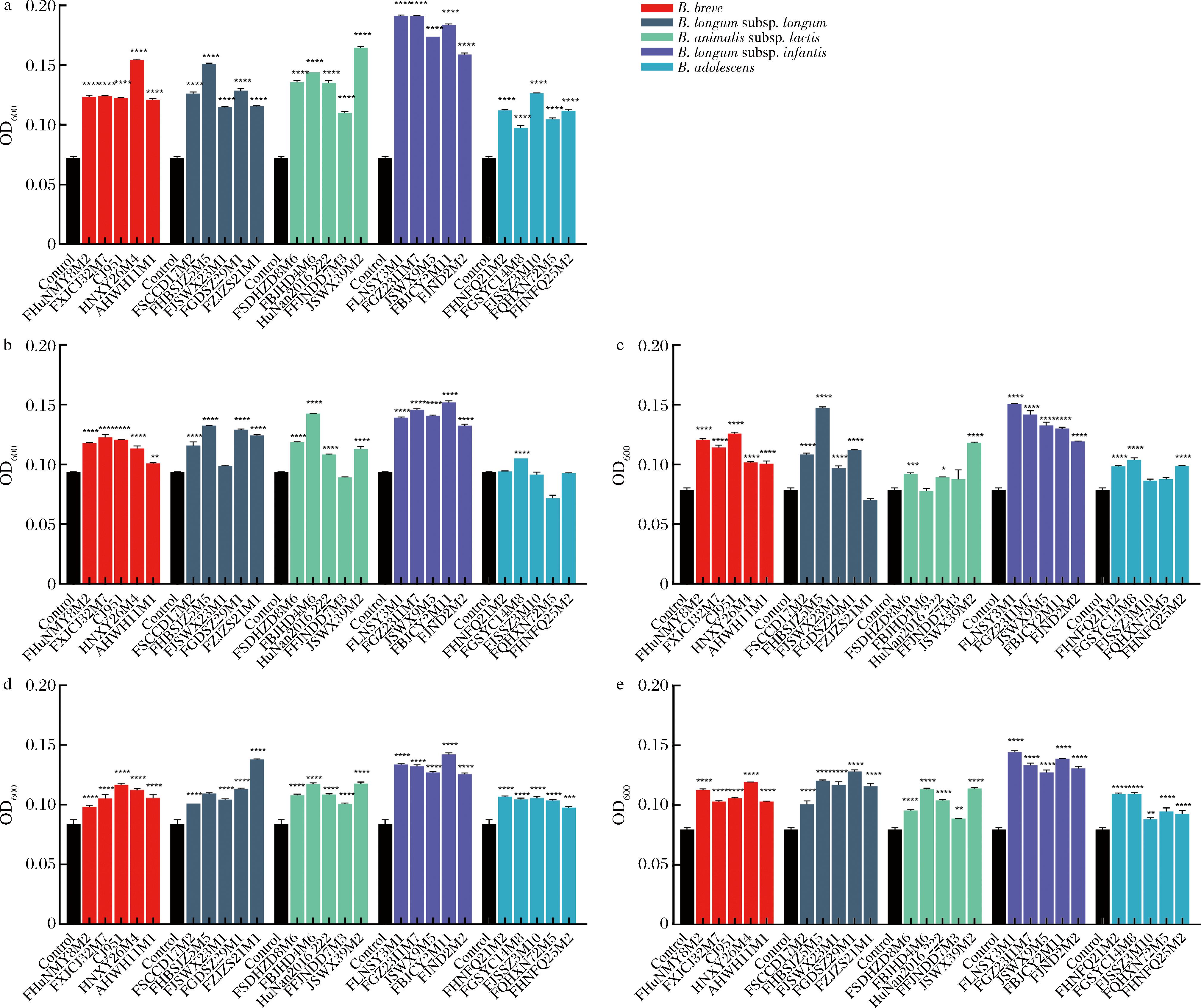
a-菌株M1DZ01M5代谢产物促进其他双歧杆菌增殖的情况;b-菌株FXJCJ22M1代谢产物促进其他双歧杆菌增殖的情况;c-菌株MF35代谢产物促进其他双歧杆菌增殖的情况;d-菌株FFJND15M5代谢产物促进其他双歧杆菌增殖的情况;e-菌株FJSNT162代谢产物促进其他双歧杆菌增殖的情况
图1 两歧双歧杆菌代谢产物促进其他双歧杆菌增殖的情况
Fig.1 Proliferation promotion of other bifidobacteria by metabolites of B.bifidum
注:B.breve:短双歧杆菌;B.longum subsp.longum:长双歧杆菌长亚种;B.animalis subsp.Lactis:动物双歧杆菌乳亚种;B.longum subsp.infantis:
长双歧杆菌婴儿亚种;B.adolescentis:青春双歧杆菌。*表示P<0.05;**表示P<0.01;***表示P<0.001;****表示P<0.000 1,与Control组相比。
2.3 多维统计分析法分析样本中代谢物
2.3.1 主成分分析(principal component analysis, PCA)
根据Compound Discover 3.3软件对样本的峰识别、提取、对齐和整合,筛选出符合数据库配比得分>80等条件的所有代谢物,得到82个(负离子模式)和75个(正离子模式),删去重复合并后共有133个代谢物。本试验首先通过PCA法对空白组(未添加两歧双歧杆菌的16 h黏蛋白发酵液)与试验组的16 h发酵液样本进行分析,从而掌握发酵液中代谢物的整体情况。如图2所示,发酵和未发酵的黏蛋白培养基具有不同的物质成分。发酵16 h的PC1和PC2累计贡献率为63.2%。由点的分布状态可以看出,该模型可以区分样本,且质量控制(quality control, QC)样本稳定可进一步对样本进行差异性分析。
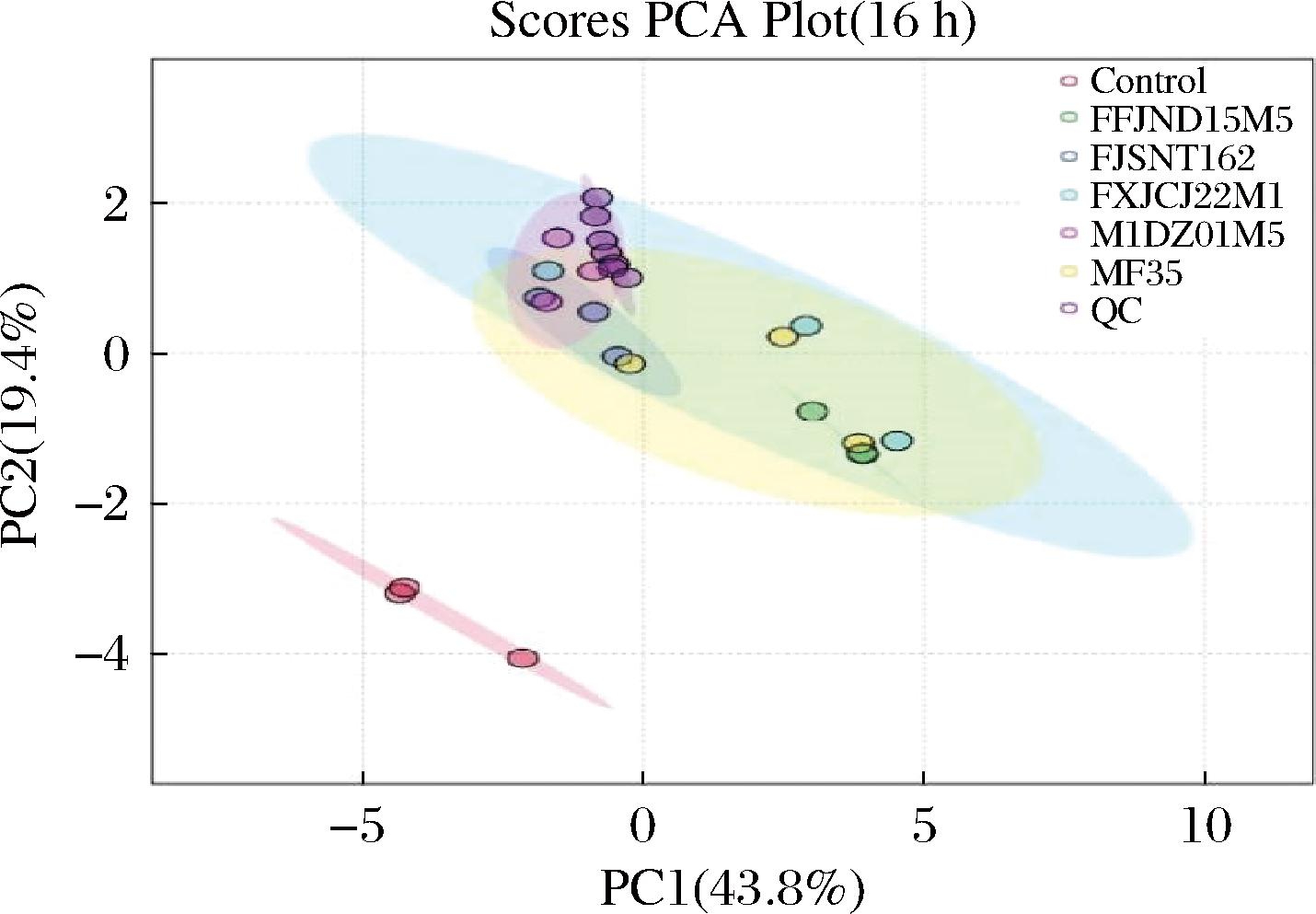
图2 两歧双歧杆菌发酵黏蛋白16 h的PCA得分图
Fig.2 PCA score plot of B.bifidum fermenting Mucin for 16 h
2.3.2 正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)
接着通过构建OPLS-DA模型以筛选出两歧双歧杆菌在两种培养基中的显著性差异代谢物,作为后续筛选发酵液中具有显著性差异代谢物的研究基础(为排除单一菌株的影响,本实验挑选地域差异比较大的5株两歧双歧杆菌作为对比)。如图3所示,OPLS-DA模型能够将两组样本显著区分开,且组内差异较小,结果与PCA模型一致。经1 000次循环交互验证得到模型评价参数R2Y及Q2均接近于1。

a-菌株M1DZ01M5发酵黏蛋白16 h的OPLS-DA得分图;b-菌株MF35发酵黏蛋白16 h的OPLS-DA得分图;c-菌株FJSNT162发酵黏蛋白
16 h的OPLS-DA得分图;d-菌株FFJND15M5发酵黏蛋白16 h的OPLS-DA得分图;e-菌株FXJCJ22M1发酵黏蛋白16 h的OPLS-DA得分图
图3 两歧双歧杆菌发酵黏蛋白16 h的OPLS-DA得分图
Fig.3 OPLS-DA score plot of B.bifidum fermenting Mucin for 16 h
2.3.3 不同两歧双歧杆菌发酵黏蛋白差异代谢物筛选
通过OPLS-DA模型得到变量权重值VIP,试验选取VIP>1,P<0.05,FC>1.5的差异代谢物,观察2组发酵液样本的显著性差异代谢物整体情况,结果如图4所示。本研究的侧重点在于探讨两歧双歧杆菌利用黏蛋白对肠道内其他共生菌交叉喂养情况以及机体健康的影响。因此,呈升高趋势的差异代谢物是本文的重点研究对象。以菌株作为分析切入点发现,与空白组相比,两歧双歧杆菌M1DZ01M5显著上调代谢物共18种,其中降解黏蛋白后的衍生糖为N-乙酰基-D-半乳糖胺-4-硫酸盐(N-acetyl-D-galactosamine 4-sulfate)、L-岩藻糖(L(-)-fucose)、N-乙酰神经氨酸(唾液酸,N-acetylneuraminic acid)、N-羟乙酰神经氨酸(N-glycolylneuraminic acid)。MF35显著上调代谢物共18种,其中降解黏蛋白后的衍生糖为N-乙酰基-D-半乳糖胺-4-硫酸盐、L-岩藻糖、N-乙酰神经氨酸。FJSNT162显著上调代谢物共13种,其中降解黏蛋白后的衍生糖为N-乙酰-D-乳糖胺(N-acetyl-D-lactosamine)。FFJND15M5显著上调代谢物共22种,其中降解黏蛋白后的衍生糖为N-乙酰基-D-半乳糖胺-4-硫酸盐、L-岩藻糖、唾液酸。FXJCJ22M1显著上调代谢物共16种,其中降解黏蛋白后的衍生糖为N-乙酰基-D-半乳糖胺-4-硫酸盐、L-岩藻糖。表明两歧双歧杆菌发酵黏蛋白后差异代谢物存在菌株特异性。

a-菌株M1DZ01M5发酵黏蛋白16 h所产生的显著性差异代谢物;b-菌株MF35发酵黏蛋白16 h所产生的显著性差异代谢物;c-菌株FJSNT162发酵黏蛋白16 h所产生的显著性差异代谢物;d-菌株FFJND15M5发酵黏蛋白16 h所产生的显著性差异代谢物;e-菌株FXJCJ22M1发酵黏蛋白16 h所产生的显著性差异代谢物
图4 两歧双歧杆菌发酵黏蛋白16 h所产生的显著性差异代谢物
Fig.4 Significantly differential metabolites produced by B.bifidum fermentation Mucin for 16 h
结合图1和图4得到的结果,得出以下结论:两歧双歧杆菌降解黏蛋白可以促进肠道其他双歧杆菌的增殖,并产生了L-岩藻糖、N-乙酰基-D-半乳糖胺-4-硫酸盐、唾液酸、N-羟乙酰神经氨酸、N-乙酰-D-乳糖胺。有研究[15-16]发现短双歧杆菌和长双歧杆菌长亚种能够利用唾液酸,其中短双歧杆菌UCC2003被证明可以利用黏蛋白和母乳低聚糖(human milk oligosaccharides, HMO)衍生的单糖唾液酸。BUNESOVA等[17]发现婴儿双歧杆菌、短双歧杆菌可以利用两歧双歧杆菌降解黏蛋白后释放的岩藻糖和己糖。由此推测两歧双歧杆菌降解黏蛋白后的唾液酸、L-岩藻糖可作为其他双歧杆菌的碳源,这可能会影响肠道生态系统中的微生物多样性。然而,多项研究表明,病原体也可以利用黏蛋白降解后的成分。例如,空肠梭菌已被证明可利用岩藻糖作为生长的底物[18],肠出血性大肠杆菌能够使用岩藻糖作为诱导毒力的信号[19]。因此,两歧双歧杆菌利用黏蛋白所产生的唾液酸、岩藻糖也有可能作为肠道致病菌的碳源。
2.3.4 聚类分析及KEGG通路富集分析
为探究差异代谢物之间的联系,本试验进一步尝试通过层次聚类分析法和KEGG通路富集分析寻找种内共性差异。首先,通过层次聚类分析法对两组样本中显著性差异代谢物(VIP>1,P<0.05,FC>1.5)进行整体分析,结果如图5-a和图5-b所示。试验组16 h发酵液相比于空白组(未添加两歧双歧杆菌的16 h黏蛋白发酵液),显著上调的差异代谢物有2-羟基己酸、α-羟基戊二酸、DL-4-羟基苯乳酸、吲哚-3-乳酸、枸橼酸、琥珀酸、反式乌头酸、唾液酸、L-岩藻糖、3-苯基乳酸、N-乙酰-D-半乳糖胺-4-硫酸盐。试验组24 h发酵液相比于空白组(未添加两歧双歧杆菌的24 h黏蛋白发酵液),显著上调的差异代谢物有3-苯基乳酸、琥珀酸显著上升。24 h发酵液差异代谢物相比于16 h发酵液减少,表明两歧双歧杆菌可利用自身降解黏蛋白后的代谢产物,实现自身生长。此外,两歧双歧杆菌发酵黏蛋白16 h的发酵液中芳香族乳酸成分3-苯基乳酸、DL-4-羟基苯乳酸、吲哚-3-乳酸显著上升,24 h的发酵液中芳香族乳酸成分3-苯基乳酸显著上升。芳香族乳酸已被报道作用于芳烃受体(aryl hydrocarbon receptor, AhR)可以强化肠道屏障,防止病原体感染,并影响宿主新陈代谢[20-21]。两歧双歧杆菌发酵黏蛋白16 h和24 h的发酵液中均发现琥珀酸显著上升,已知琥珀酸可以驱动许多病理生理过程,如活性氧(reactive oxygen species, ROS)的过度产生、促炎性巨噬细胞的介导以及参与到机体能量代谢中[22-24]。基于此推测两歧双歧杆菌对肠道黏蛋白的利用可能参与到了机体能量代谢以及病原体感染的调节过程中。
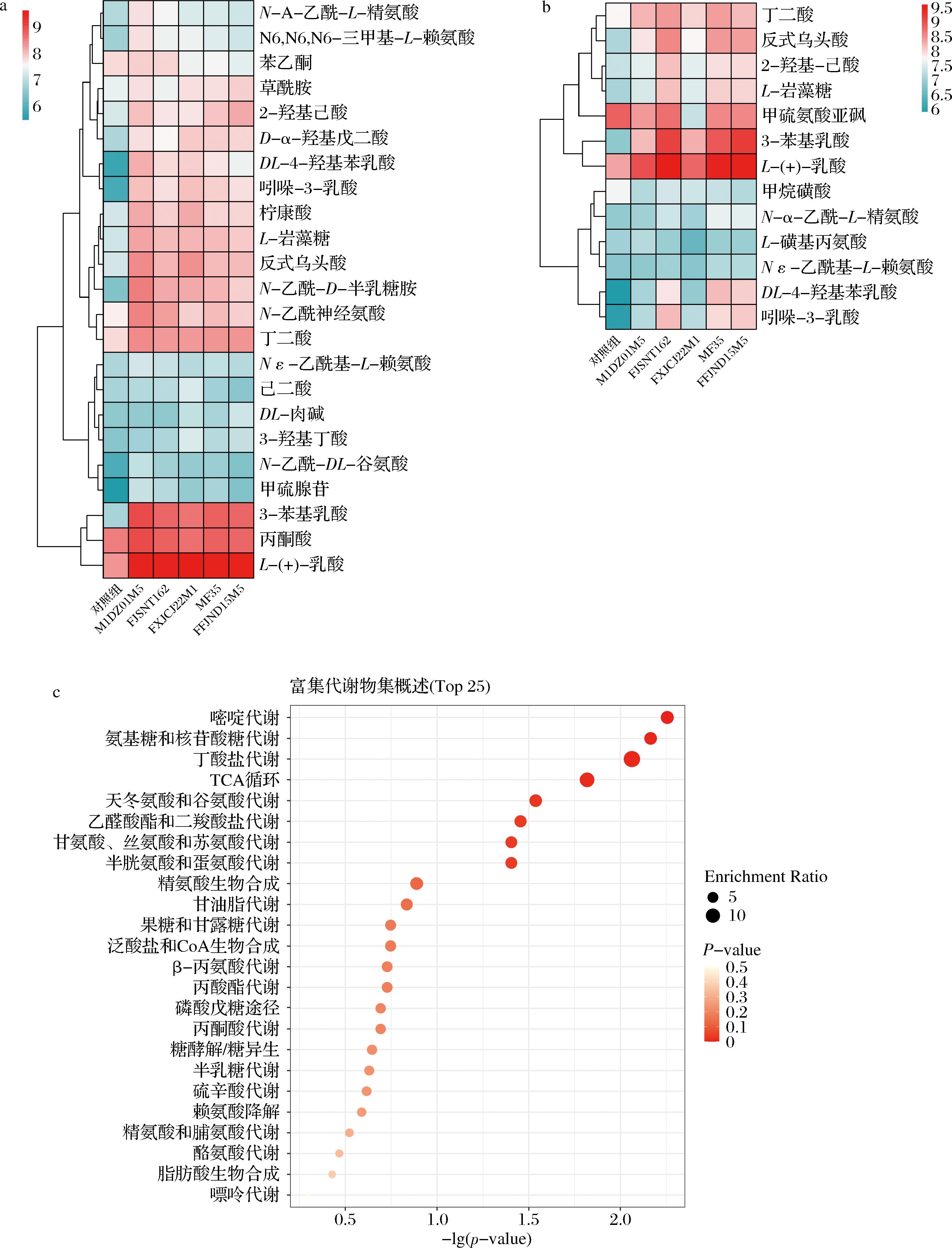
a-两歧双歧杆菌发酵黏蛋白16 h显著性差异代谢物聚类热图;b-两歧双歧杆菌发酵黏蛋白24 h显著性差异代谢物聚类热图;c-两歧双歧杆菌发酵黏蛋白KEGG富集通路图
图5 显著性差异代谢物层次聚类热图及KEGG富集通路图
Fig.5 Heatmap of hierarchical clustering of significant differential metabolites and KEGG enrichment pathway diagram
接着本试验根据P值选择了显著性最高的前25条代谢通路,富集分析的结果以气泡图形式(图5-c)进行展示。富集最显著的8个通路为嘧啶代谢、氨基糖和核苷酸糖代谢、丁酸代谢、柠檬酸盐循环(citrate cycle,TCA循环)、丙氨酸、天冬氨酸和谷氨酸代谢、乙醛酸和二羧酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、半胱氨酸和蛋氨酸代谢且富集到这些通路上的代谢物数量也较多,其中丁酸代谢通路的富集率最高,表明两歧双歧杆菌将黏蛋白作为唯一碳源的生长过程中主要经历了以上8种代谢过程。KEGG的各个通路并非完全独立,存在着普遍的联系,不同代谢通路会涉及相同的代谢物。其中琥珀酸除了在丁酸代谢通路中显著上升,在柠檬酸盐循环以及丙氨酸、天冬氨酸和谷氨酸代谢通路中同样表现为显著上升,可见其在两歧双歧杆菌利用黏蛋白的代谢过程中发挥着重要的作用。
第一个研究的黏蛋白降解细菌是病原体[25-26],因此长期以来黏蛋白降解的研究与微生物的致病性相关。随着深入研究,越来越多的发现指出黏蛋白降解细菌对人类肠道健康和疾病的影响:a)黏蛋白降解可能会给哺乳动物胃肠道中的细菌带来生态优势[27];b)黏蛋白降解细菌在调节黏膜表面肠道炎症反应中发挥着重要作用[28];c)肠道病原体在肠道中繁殖的能力与黏蛋白降解细菌的聚糖代谢密切相关[29]。两歧双歧杆菌利用黏蛋白所产生的代谢产物对病理状态个体的影响以及共生菌对黏蛋白衍生糖的利用行为是否具有与潜在病原体竞争的作用仍需进一步进行体内研究。此外,本研究发现的代谢产物N-乙酰基半乳糖胺-4-硫酸盐与何种酶基因相关仍需进一步解释,之后的工作重点应以纯化的O-连接或N-连接聚糖作为唯一的碳源,鉴定在这些生长条件下菌株被激活的基因,然后用重组蛋白进行详细的酶学表征。将这些酶(例如磺基半乳糖苷酶)的特异性与菌株利用黏蛋白的能力相关联,从而更好地理解菌株特异性。
3 结论
本研究采用黏蛋白作为唯一碳源的合成培养基,对双歧杆菌利用黏蛋白作为碳源的代谢特性以及代谢产物展开研究。研究发现,两歧双歧杆菌可以利用黏蛋白作为唯一碳源且促进其他双歧杆菌的增殖。两歧双歧杆菌降解黏蛋白后差异代谢物存在菌株特异性。推测其所产生的唾液酸、L-岩藻糖可作为其他肠道微生物的碳源。次级代谢产物琥珀酸、3-苯基乳酸、DL-4-羟基苯乳酸、吲哚-3-乳酸代谢产物可能参与到机体能量代谢以及病原体感染中。上述结果为理解两歧双歧杆菌利用黏蛋白行为提供理论参考,后续需将酶基因分析、体内实验与体外实验相结合,深入探究两歧双歧杆菌利用黏蛋白对肠道微生物以及机体健康的影响。
[1] KOH A, B CKHED F.From association to causality:The role of the gut microbiota and its functional products on host metabolism[J].Molecular Cell, 2020, 78(4):584-596.
CKHED F.From association to causality:The role of the gut microbiota and its functional products on host metabolism[J].Molecular Cell, 2020, 78(4):584-596.
[2] MARTENS E C, NEUMANN M, DESAI M S.Interactions of commensal and pathogenic microorganisms with the intestinal mucosal barrier[J].Nature Reviews.Microbiology, 2018, 16(8):457-470.
[3] PAONE P, CANI P D.Mucus barrier, mucins and gut microbiota:The expected slimy partners?[J].Gut, 2020, 69(12):2232-2243.
[4] PAN L, FU T Y, CHENG H, et al.Polysaccharide from edible Alga Gloiopeltis furcata attenuates intestinal mucosal damage by therapeutically remodeling the interactions between gut microbiota and mucin O-glycans[J].Carbohydrate Polymers, 2022, 278:118921.
[5] ZHENG M Y, HAN R, YUAN Y L, et al.The role of Akkermansia muciniphila in inflammatory bowel disease:Current knowledge and perspectives[J].Frontiers in Immunology, 2023, 13:1089600.
[6] FUKATA M, ARDITI M.The role of pattern recognition receptors in intestinal inflammation[J].Mucosal Immunology, 2013, 6(3):451-463.
[7] KIM Y S, HO S B.Intestinal goblet cells and mucins in health and disease:Recent insights and progress[J].Current Gastroenterology Reports, 2010, 12(5):319-330.
[8] DONALDSON G P, LEE S M, MAZMANIAN S K.Gut biogeography of the bacterial microbiota[J].Nature Reviews.Microbiology, 2016, 14(1):20-32.
[9] SHUOKER B, PICHLER M J, JIN C S, et al.Sialidases and fucosidases of Akkermansia muciniphila are crucial for growth on mucin and nutrient sharing with mucus-associated gut bacteria[J].Nature Communications, 2023, 14(1):1833.
[10] TAILFORD L E, CROST E H, KAVANAUGH D, et al.Mucin glycan foraging in the human gut microbiome[J].Frontiers in Genetics, 2015, 6:81.
[11] 刘时捷. 双歧杆菌碳源利用特性及种间互养机制研究[D].无锡:江南大学, 2021.
LIU S J.Study on utilization characteristics of carbon source and interspecific mutualism mechanism of Bifidobacterium[D].Wuxi:Jiangnan University, 2021.
[12] RUIZ L, GUEIMONDE M, COUTÉ Y, et al.Evaluation of the ability of Bifidobacterium longum to metabolize human intestinal mucus[J].FEMS Microbiology Letters, 2011, 314(2):125-130.
[13] ENGEVIK M A, LUK B, CHANG-GRAHAM A L, et al.Bifidobacterium dentium fortifies the intestinal mucus layer via autophagy and calcium signaling pathways[J].mBio, 2019, 10(3):e01087-19.
[14] MARTENS E C, CHIANG H C, GORDON J I.Mucosal glycan foraging enhances fitness and transmission of a saccharolytic human gut bacterial symbiont[J].Cell Host &Microbe, 2008, 4(5):447-457.
[15] WARD R E, NI ONUEVO M, MILLS D A, et al.In vitro fermentability of human milk oligosaccharides by several strains of bifidobacteria[J].Molecular Nutrition &Food Research, 2007, 51(11):1398-1405.
ONUEVO M, MILLS D A, et al.In vitro fermentability of human milk oligosaccharides by several strains of bifidobacteria[J].Molecular Nutrition &Food Research, 2007, 51(11):1398-1405.
[16] EGAN M, O’CONNELL MOTHERWAY M, VENTURA M, et al.Metabolism of sialic acid by Bifidobacterium breve UCC2003[J].Applied and Environmental Microbiology, 2014, 80(14):4414-4426.
[17] BUNESOVA V, LACROIX C, SCHWAB C.Mucin cross-feeding of infant bifidobacteria and Eubacterium hallii[J].Microbial Ecology, 2018, 75(1):228-238.
[18] STAHL M, FRIIS L M, NOTHAFT H, et al.L-fucose utilization provides Campylobacter jejuni with a competitive advantage[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17):7194-7199.
[19] PACHECO A R, CURTIS M M, RITCHIE J M, et al.Fucose sensing regulates bacterial intestinal colonization[J].Nature, 2012, 492(7427):113-117.
[20] ROAGER H M, LICHT T R.Microbial tryptophan catabolites in health and disease[J].Nature Communications, 2018, 9(1):3294.
[21] NATIVIDAD J M, AGUS A, PLANCHAIS J, et al.Impaired aryl hydrocarbon receptor ligand production by the gut microbiota is a key factor in metabolic syndrome[J].Cell Metabolism, 2018, 28(5):737-749.
[22] KOVATCHEVA-DATCHARY P, NILSSON A, AKRAMI R, et al.Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella[J].Cell Metabolism, 2015, 22(6):971-982.
[23] CHIA L W, HORNUNG B V H, AALVINK S, et al.Deciphering the trophic interaction between Akkermansia muciniphila and the butyrogenic gut commensal Anaerostipes caccae using a metatranscriptomic approach[J].Antonie Van Leeuwenhoek, 2018, 111(6):859-873.
[24] XU J, YANG Y C, LI X, et al.Pleiotropic activities of succinate:The interplay between gut microbiota and cardiovascular diseases[J].iMeta, 2023, 2(3):e124.
[25] PRIZONT R.Degradation of intestinal glycoproteins by pathogenic Shigella flexneri[J].Infection and Immunity, 1982, 36(2):615-620.
[26] SLOMIANY B L, MURTY V L N, PIOTROWSKI J, et al.Glycosulfatase activity of Helicobacter pylori toward gastric mucin[J].Biochemical and Biophysical Research Communications, 1992, 183(2):506-513.
[27] B CKHED F, ROSWALL J, PENG Y Q, et al.Dynamics and stabilization of the human gut microbiome during the first year of life[J].Cell Host &Microbe, 2015, 17(5):690-703.
CKHED F, ROSWALL J, PENG Y Q, et al.Dynamics and stabilization of the human gut microbiome during the first year of life[J].Cell Host &Microbe, 2015, 17(5):690-703.
[28] YAMAGUCHI M, YAMAMOTO K.Mucin glycans and their degradation by gut microbiota[J].Glycoconjugate Journal, 2023, 40(4):493-512.
[29] SICARD J F, LE BIHAN G, VOGELEER P, et al.Interactions of intestinal bacteria with components of the intestinal mucus[J].Frontiers in Cellular and Infection Microbiology, 2017, 7:387.