随着人口老龄化速度的不断加快,对衰老及衰老相关疾病的研究已成为全球热点。生物体衰老加速的原因是多样的,其中最主要的是机体不能抵御活性氧自由基造成的氧化损伤。在生命活动的过程中,生物体不可避免地会暴露于不良的外界环境中,如紫外线照射、辐射以及毒素环境等,均可能导致氧化应激的发生。氧化应激是指生物体的细胞和组织中存在过量的氧自由基和氮自由基水平与自身抗氧化防御系统失衡时,自由基对蛋白质、脂质、DNA等生物大分子造成损伤的现象,是生物体发生疾病的主要元凶之一[1]。目前,补充抗氧化剂是平衡氧化还原反应的最有效方式之一。研究表明,膳食中纯天然的植物抗氧化剂可以预防衰老相关疾病的发生,延缓衰老的进程[2],为抗衰老物质研究及相关保健产品研发提供了新思路。由于天然的抗氧化剂来源广泛,如植物来源的多糖、类黄酮化合物、类胡萝卜素、维生素、多酚化合物等[3],毒副作用小且抗氧化能力强,因此对天然抗氧化剂的研究和利用是当前的研究热点。
羊栖菜(Sargassum fusiforme)是我国的六大经济型藻类之一,隶属于褐藻门马尾藻科,广泛分布于我国浙江、福建和广东浅海海域,富含多糖、氨基酸、多酚和膳食纤维等营养和功能成分,营养丰富,具有较高的食用和药用价值。已有大量研究表明羊栖菜是一种具有抗氧化[4]、抗衰老[5]、抗肿瘤[4]、抗病毒[6]、抗菌[5]、促进骨骼生长[7]、调节免疫[8]和皮肤保护[9]等功效的海藻,具有相当大的药物和生物医学潜力,可用于开发营养保健品和药妆品等功能性材料。王艳英等[10]的研究表明羊栖菜提取液中富含的多酚物质有较强的自由基清除能力,能有效保护H2O2诱导的Caco-2细胞的氧化损伤。目前,关于羊栖菜全粉的抗氧化作用研究还鲜有报道。因此,本研究分析测定了羊栖菜速溶粉的总酚、总黄酮含量,以及DPPH自由基、羟自由基、氧自由基和ABTS阳离子自由基清除能力,评价其体外抗氧化活性。进一步以秀丽隐杆线虫为模型,测定羊栖菜速溶粉对秀丽隐杆线虫寿命、繁殖力、脂褐素、热应激、氧化应激、抗氧化酶活性、丙二醛(malondialdehyde,MDA)含量和活性氧(reactive oxygen species,ROS)含量的影响,评价羊栖菜速溶粉的体内抗氧化能力,以期为羊栖菜速溶粉的深入开发利用提供理论依据,提高羊栖菜速溶粉的附加值。
1 材料与方法
1.1 材料与试剂
新鲜羊栖菜,产自浙江洞头;N2野生型线虫(C.elegans)、尿嘧啶缺陷型大肠杆菌(Escherichia coil OP50,简称OP50),美国明尼苏达大学线虫遗传中心。过氧化氢酶(catalase,CAT)试剂盒、MDA试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒,南京建成生物工程研究所;福林酚、Na2CO3、NaOH缓冲液、PBS缓冲液、次氯酸钠等其他所用试剂均为分析纯。
1.2 仪器与设备
HH-8CJ恒温磁力搅拌水浴锅,常州市金坛友联仪器研究所;SW-CJ-2F双人单面垂直送风净化工作台,广州吉迪仪器有限公司;Thermo Scientific 3111恒温培养箱、多功能酶标仪、高速落地离心机,美国赛默飞公司;双螺杆实验机DSE32,济南盛润机械有限公司;MSI Minishaker涡旋混合仪,德国IKA公司;JXFSTPRP-64L全自动研磨仪,上海净信实业发展有限公司;AllegraX-15R,冷冻离心机,德国BECKMAN公司;真空冷冻干燥机,韩国ilShin公司;THZ-103B 恒温培养摇床,上海一恒有限公司;B60F正立生物荧光显微镜,DZX-50KBS型立式蒸汽灭菌器,上海申安医疗器械厂;SRZ-7045体视显微镜,北京世纪科信科学仪器有限公司。
1.3 实验方法
1.3.1 羊栖菜速溶粉制备方法
基于本团队的前期研究,建立了以挤压膨化为前处理,联合酶解与发酵制备羊栖菜速溶粉的加工工艺,新鲜羊栖菜经60 ℃烘干后粉碎过40目筛,在135 ℃,喂料速度16 Hz,水分含量24%的条件下对物料进行挤压膨化处理,烘干后再粉碎过100目筛,以果胶酶∶纤维素酶∶木聚糖酶质量比为5∶4∶1,复合酶添加量16%,pH 4.5,料液比1∶25(g∶mL),温度50 ℃,时间4 h的条件酶解羊栖菜浆。酶解结束后将羊栖菜浆灭菌(121 ℃,15 min),接种植物乳杆菌ATCC 14917发酵(温度40 ℃,接菌量3%,时间3.5 d),最后离心取上清液冻干,粉碎过100目筛得羊栖菜速溶粉(Sargassum fusiforme instant powder, SFP)。
羊栖菜干制品经粉碎后过100目筛得到普通粉作为对照样品。
1.3.2 总酚含量测定
待测样品提取液制备:称取粉碎过100目筛后的羊栖菜普通粉和羊栖菜速溶粉各1 g置于50 mL离心管中,加入20 mL蒸馏水,称重,75 ℃水浴超声4 h提取,取出冷却至室温后称重,用蒸馏水补足损失质量,随后5 000 r/min离心10 min,取上清液备用[11]。
总酚含量测定方法采用苯酚硫酸法,根据KILIC等[12] 的方法测定并做适当修改。
1.3.3 总黄酮含量测定
待测样品提取液制备同1.3.2节,黄酮含量测定参照SON等[13]的方法并稍作修改。
1.3.4 体外抗氧化能力测定
DPPH自由基清除能力、抑制羟自由基能力、氧自由基能力、ABTS阳离子自由基清除能力使用试剂盒进行测定。
1.3.5 线虫的培养及同期化
N2野生型秀丽隐杆线虫(C.elegans)于20 ℃条件下,在含有OP50的线虫生长培养基(nematode growth medium, NGM)上培养。当线虫生长产卵期时,用裂解液(0.4 mol/L NaOH, 1.2% NaClO,质量分数)对线虫进行同期化。线虫的整个生命周期可分为胚胎期、幼虫期(L1~L4期)、生殖期和衰老期4个阶段,线虫从虫卵孵化到成虫需要72 h左右,以下所有实验都需要使用L4期线虫进行实验。
1.3.6 线虫分组及给药方法
将SFP溶于水,用OP50菌液稀释成低(0.5 mg/mL)、中(1.0 mg/mL)、高(1.5 mg/mL)质量浓度的溶液,取100 μL涂布于NGM板上培养24 h后喂养线虫,以单纯喂养OP50的线虫作为空白对照组进行实验。
1.3.7 线虫寿命实验
将L4时期的线虫挑到含不同质量浓度SFP的NGM板上进行培养,此时记为第0天,之后每天转板,等到产卵期过后,可每2 d转一次板。每天记录线虫死亡数量,直到线虫全部死亡。
1.3.8 线虫运动能力实验
挑取L4期线虫至含不同质量浓度SFP的NGM实验板上,在线虫生长周期的第7、12和18天,观察并评估线虫的运动能力,线虫运动能力的等级划分为A、B、C三个等级,其中A代表线虫能自发运动,C代表线虫仅在给与刺激后出现头部和尾部的反应,B则介于两者之间。
1.3.9 线虫繁殖能力实验
将L4期线虫转移到含不同质量浓度SFP的NGM板上,每个板上放置1条线虫,每组8个平行,每天转板,旧板继续培养1 d后记录后代数目,待线虫不再产卵时结束试验。后代总数目为各组旧板线虫数目的总和。
1.3.10 线虫的脂褐素实验
将L4期线虫转移到含不同质量浓度SFP的NGM板上,喂养5 d后,将各组线虫挑到琼脂糖平板上,滴加盐酸四咪唑进行麻醉。在荧光显微镜下观察脂褐素的分布情况,并拍照记录,用ImageJ 8.0软件分析线虫相对荧光强度。
1.3.11 线虫的热应激实验
将L4期线虫转移到含不同质量浓度SFP的NGM板上,在20 ℃下培养5 d后将线虫转入不含OP50的NGM培养基中,于35 ℃下培养,进行热应激实验,每隔1 h记录线虫的死亡数量,直到线虫全部死亡。
1.3.12 线虫的氧化应激实验
将L4期线虫转移到含不同质量浓度SFP的NGM板上,培养5 d后将线虫转入含100 mmol/L百草枯的NGM板中进行培养,之后每天转板,并记录线虫每天死亡数量,直到线虫全部死亡。
1.3.13 线虫体内抗氧化酶活力及代谢物含量测定
将L4期线虫转移到含不同质量浓度SFP的NGM板上,培养5 d后,用M9缓冲液洗下线虫,用PBS清洗线虫,重复3次以上。收集线虫,用研磨仪研磨3 min,于8 000 r/min,4 ℃条件下离心10 min,取上清液备用。使用试剂盒测定MDA含量及SOD、GSH、CAT活性,用BCA试剂盒进行蛋白定量。
1.3.14 线虫体内ROS含量
将L4期线虫转移到含不同浓度SFP的NGM板上,20 ℃培养5 d后,每组收集500条线虫,进行研磨,8 000 r/min,4 ℃下离心10 min,取上清液备用。分别取线虫提取液和2,7-双氯荧光素蛋白乙酸盐溶液(50 μmol/L)各50 μL于黑色96孔板中,反应2 h后用酶标仪检测荧光强度,激发波长458 nm,发射波长535 nm。
1.4 数据分析
实验设置3平行,使用SPSS 25进行单因素方差分析,用GraphPad Prism 8软件和Origin 2022进行绘图。
2 结果与分析
2.1 总酚和总黄酮含量
由表1可知,羊栖菜速溶粉的总酚含量和总黄酮含量显著高于普通粉,分别提高了32.14 GAE mg/g、31.46 RE mg/g,说明速溶粉加工工艺能够提升羊栖菜全粉的总酚和总黄酮含量。有研究报道乳酸菌发酵可通过破坏植物细胞壁释放酚类、小分子多糖等物质,或是将其他物质转化成酚类化合物,从而提高总酚、总黄酮的含量[14]。挤压膨化与酶解处理可破坏植物细胞壁,促进酚类化合物溶出[15-16],此外,活性物质的增加也与加工工艺处理过程的富集作用有关。
表1 羊栖菜粉中的总酚和总黄酮含量
Table 1 The content of total phenols and total flavonoids in S. fusiforme powder

样品总酚/(GAE mg/g)总黄酮/(RE mg/g)普通粉40.50±0.06b21.51±0.24b速溶粉72.64±0.59a52.97±0.55a
注:表中不同小写字母表示同列数据间差异显著(P<0.05)(下同)。
2.2 体外抗氧化能力测定
羊栖菜粉的体外抗氧化能力见图1,羊栖菜速溶粉和普通粉对4种自由基的清除能力均随羊栖菜粉质量浓度的增大而增强。速溶粉的DPPH自由基清除能力和氧自由基抑制能力显著高于普通粉;速溶粉的ABTS阳离子自由基清除能力则低于普通粉。而在羟基自由基抑制能力上,在质量浓度1~5 mg/mL范围内普通粉的抑制能力优于速溶粉,在质量浓度为10~20 mg/mL范围内速溶粉优于普通粉。结果表明,羊栖菜速溶粉具有良好的体外抗氧化能力。

a-抑制羟自由基能力;b-抑制氧自由基能力;c-DPPH自由基清除能力;d-ABTS阳离子自由基清除能力
图1 羊栖菜粉的体外抗氧化能力
Fig.1 Antioxidant capacity of S. fusiforme powder in vitro
注:图中不同小写字母表示样品不同浓度间有显著差异(P<0.05)(下同)。
2.3 羊栖菜速溶粉对线虫寿命的影响
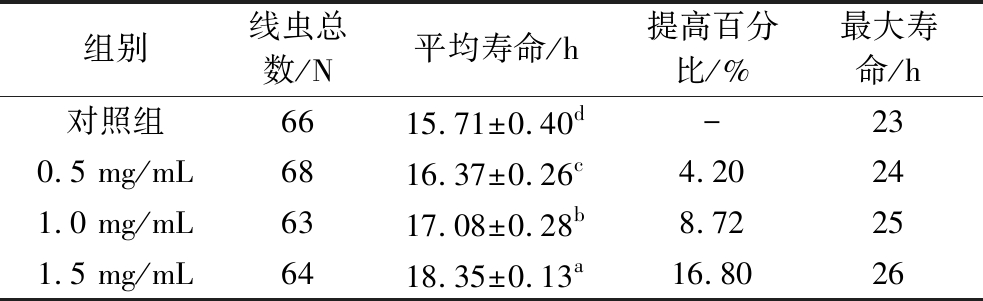
寿命实验结果表明(图2、表2),与空白组相比,低、中、高剂量的SFP可使线虫的生存曲线明显右移,线虫的平均寿命分别从(13.26±0.46) d增加到了(14.16±0.30) d、(15.13±0.29) d和(15.76±0.59) d,平均寿命分别延长了6.7%、14.12%和18.87%,最大寿命从22 d分别延长到了24、25、25 d。实验结果表明,SFP能够延缓线虫的自然衰老,效果随样品质量浓度的增大而增强。吕晨豪等[17]的研究表明,3 mg/mL发酵陈皮水提物能够延长线虫的寿命14.7%,其延缓线虫衰老的趋势与本研究结果基本一致,进一步说明SFP具有良好的抗衰老和抗氧化作用。
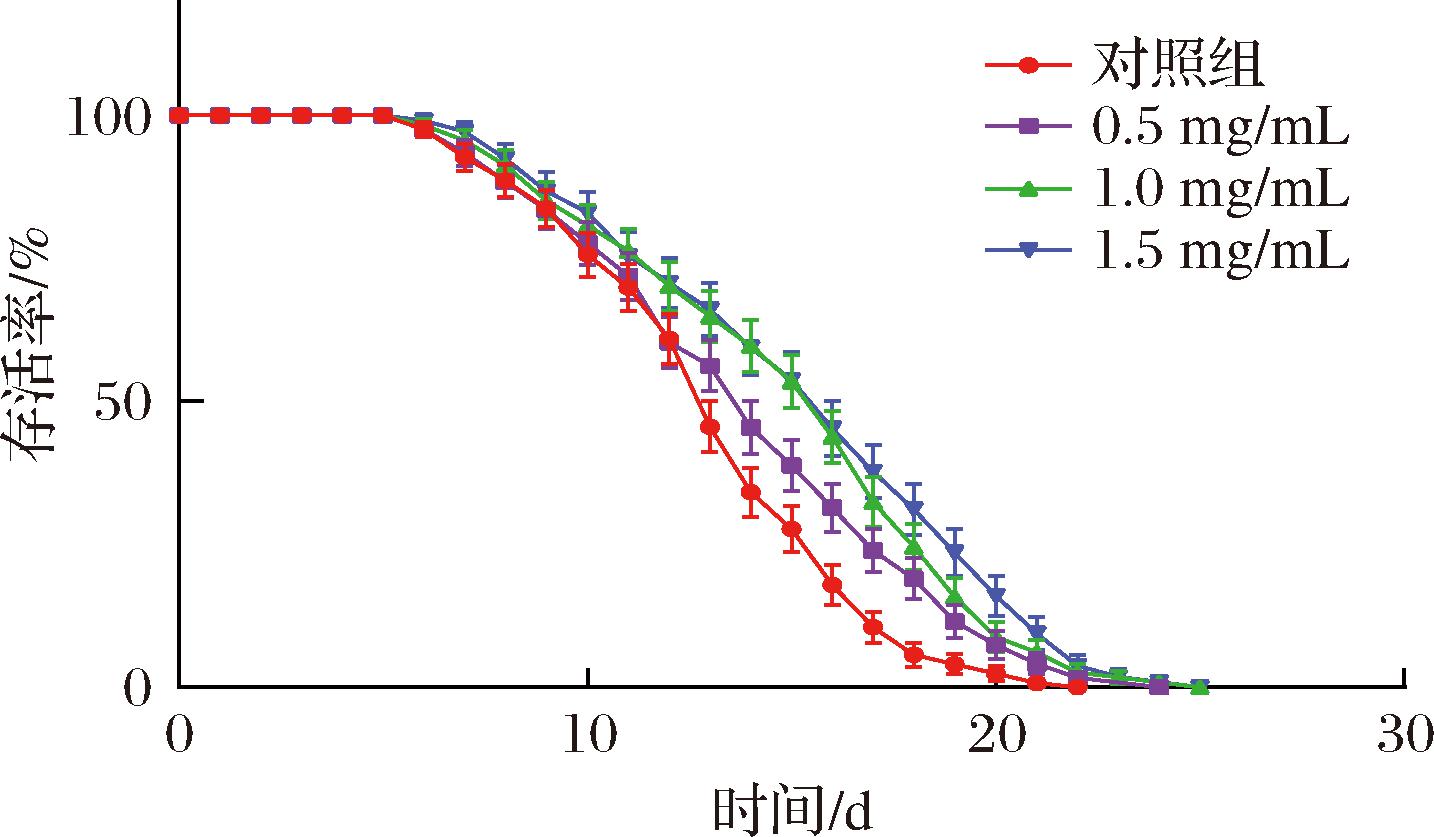
图2 SFP对线虫生存曲线的影响
Fig.2 Effects of SFP on the survival curve of C.elegans
表2 SFP对线虫寿命影响
Table 2 Effects of SFP on the lifespan of C.elegans

组别线虫总数(N)平均寿命/d提高百分比/%最大寿命/d对照组12313.26±0.46c-220.5 mg/mL12014.16±0.30b6.79241.0 mg/mL11315.13±0.29a14.12251.5 mg/mL10515.76±0.59a18.8725
2.4 羊栖菜速溶粉对线虫运动能力的影响
随着线虫年龄的增长,其行为能力和抗氧化应激能力也随之减弱。为了探究SFP能否改善线虫的运动能力,考察了SFP对不同时期线虫运动能力的影响,结果如图3所示。在SFP作用的第7天,空白对照组与SFP处理组的线虫大部分处于A级运动;在作用的第12天,大约60%的线虫处于B级运动;18 d后,空白对照组的所有线虫都已进入C级运动,SFP处理组还有小部分线虫处于B级运动,且随SFP浓度的增加,线虫出现C类运动的时间有延缓现象。结果表明,SFP可延缓线虫产生C级运动的时间,明显改善线虫的运动能力,且呈现剂量依赖性。
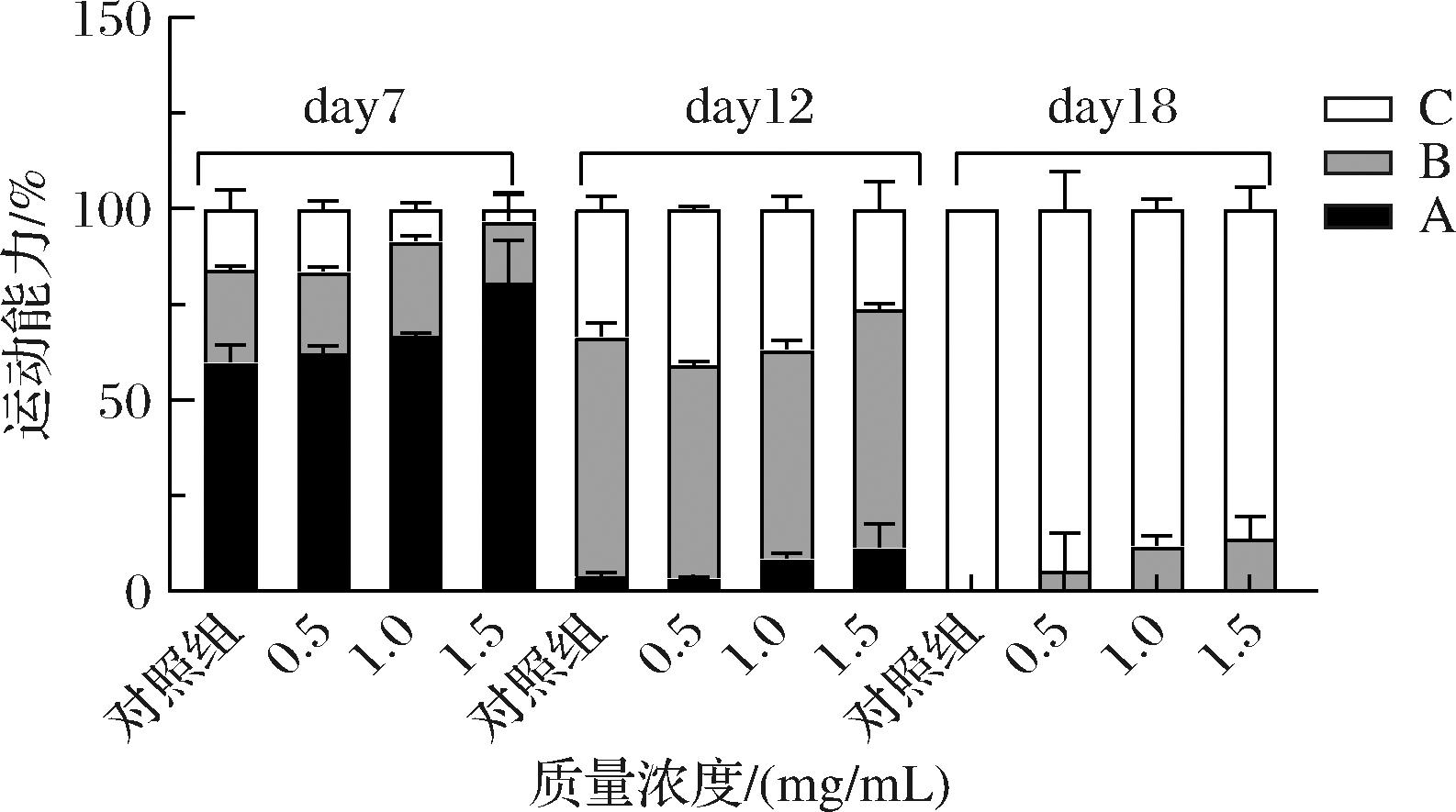
图3 SFP对线虫运动能力的影响
Fig.3 Effects of SFP on the exercise capacity of C.elegans
2.5 羊栖菜速溶粉对线虫繁殖能力的影响
繁殖能力是研究线虫衰老与健康寿命的重要组成,是线虫基础的生理指标之一。SFP对线虫繁殖力的影响见图4,与对照组相比,经SFP处理的线虫后代数目减少,与SFP质量浓度的增加呈负相关现象。经低、中、高质量浓度的SFP喂养后,后代数目分别减少了7.0%、22.44%和32.95%。根据能量守恒原则,线虫寿命的延长往往可能会伴随其繁殖力的下降[18]。GRUBER等[19]的报道表明,秀丽隐杆线虫的生殖能力与寿命之间存在“利弊权衡”现象,即寿命的延长可能是以降低或丧失生殖能力为代价的。实验结果表明SFP对线虫的生殖能力有毒害作用,其寿命延长效果与生殖能力遵循能量守恒原则。
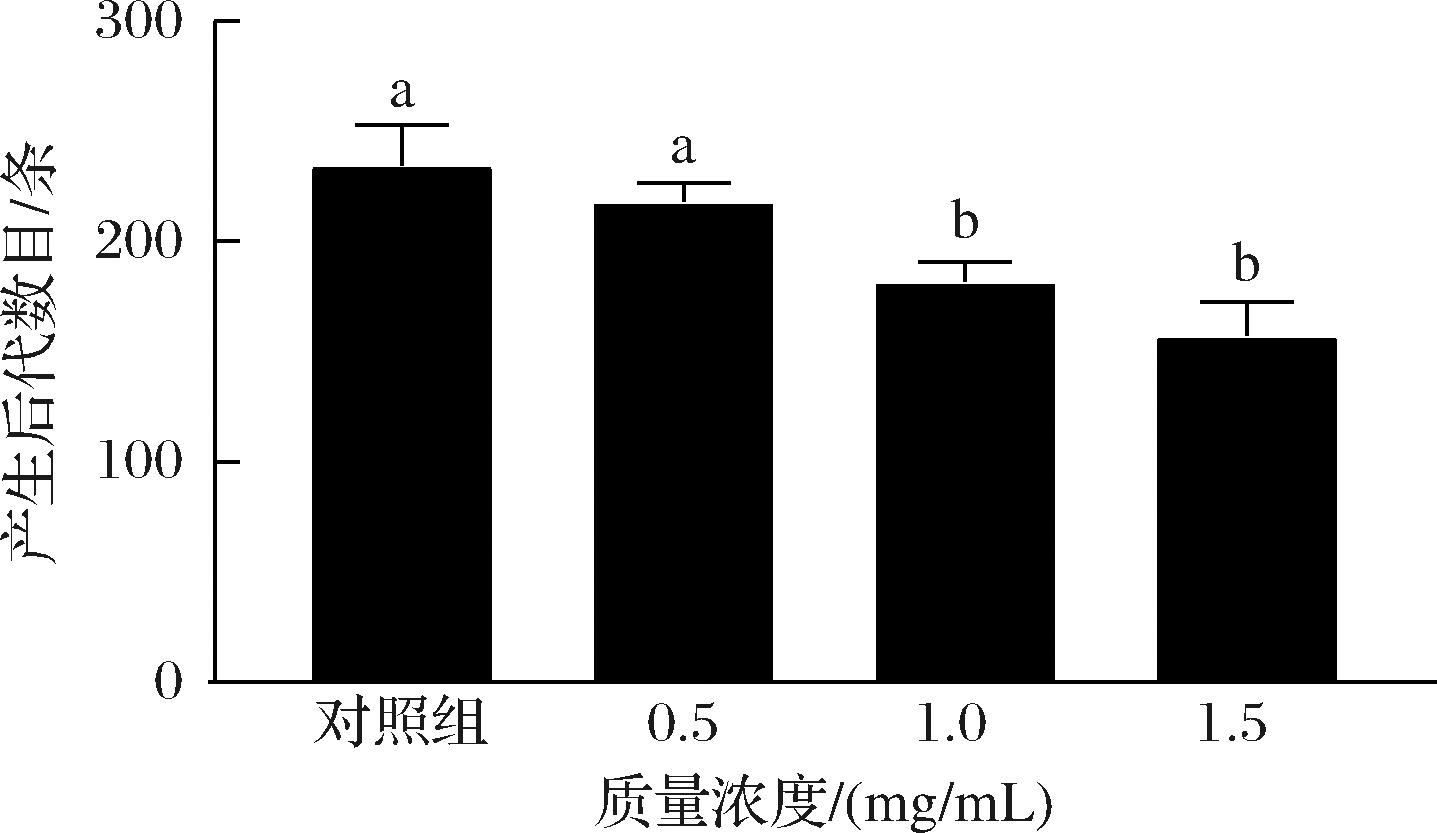
图4 SFP对线虫繁殖能力的影响
Fig.4 Effects of SFP on the reproductive capacity of C.elegans
注:组间不同小写字母之间表示差异显著(P<0.05)(下同)。
2.6 羊栖菜速溶粉对线虫脂褐素的影响
脂褐素是线虫衰老的一个重要指标,由溶酶体和脂质残基消化产物组成[20-21]。脂褐素的荧光强度随着线虫的衰老而逐渐积累,可作为线虫的“衰老斑”[21-22]。SFP对线虫脂褐素积累的影响见图5,用不同质量浓度的SFP处理线虫后,在显微镜下观察到线虫体内的荧光强度减弱,说明样品组线虫的脂褐素积累减少,且具有剂量依赖性。与对照组相比,低、中、高质量浓度样品组线虫的脂褐素水平分别降低了7.22%、28.6%和32.6%,证明SFP具有良好的抗氧化和抗衰老能力。
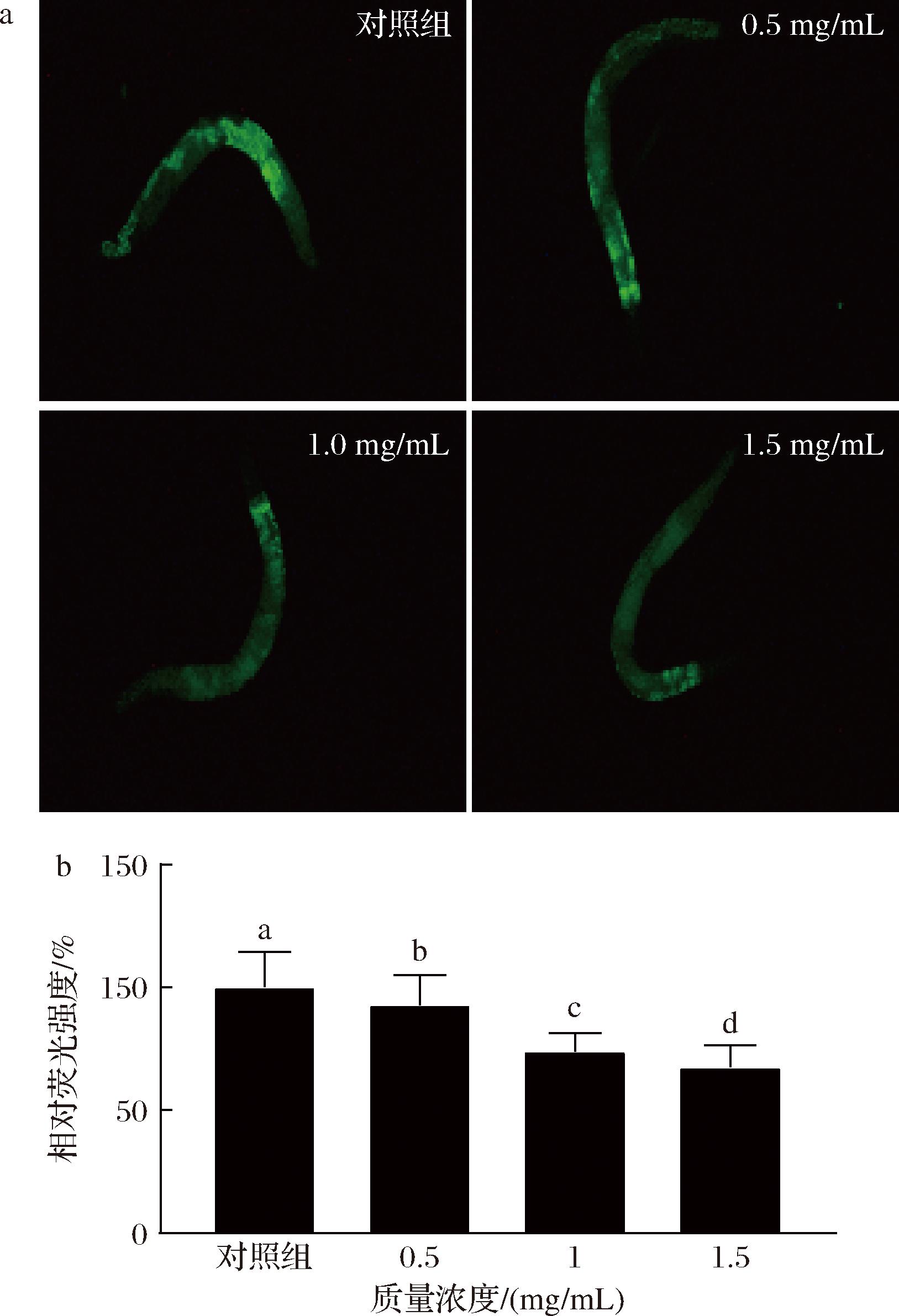
a-线虫脂褐素积累的荧光图片;b-线虫脂褐素的相对荧光强度
图5 SFP对线虫脂褐素积累的影响
Fig.5 Effects of SFP on lipofuscin accumulation in C.elegans
2.7 羊栖菜速溶粉对线虫热应激损伤的保护作用
在正常条件下,线虫体内活性氧含量处于动态平衡状态,35 ℃的高温可引起线虫体内代谢紊乱,产生大量的活性氧导致体内细胞和组织损伤,从而减少线虫寿命[23]。SFP对线虫热应激损伤的影响见图6、表3,在热应激条件下,低、中、高质量浓度的SFP可将线虫的平均寿命从(15.71±0.40) h延长至(16.37±0.26)、(17.08±0.28)、(18.35±0.13) h,平均寿命分别延长了4.2%、8.72%和16.8%;最大寿命从23 h分别延长至24、25、26 h,线虫生存曲线明显右移。结果说明,SFP对线虫的热应激损伤具有保护作用,可以提高线虫抵抗热应激的能力,延长线虫寿命,改善线虫的生理健康指标。刘云鹏[24]的研究报道了以螺旋藻发酵产物饲喂线虫,显著提高了线虫在热应激实验中的存活率,这与本研究的结果是相似的。
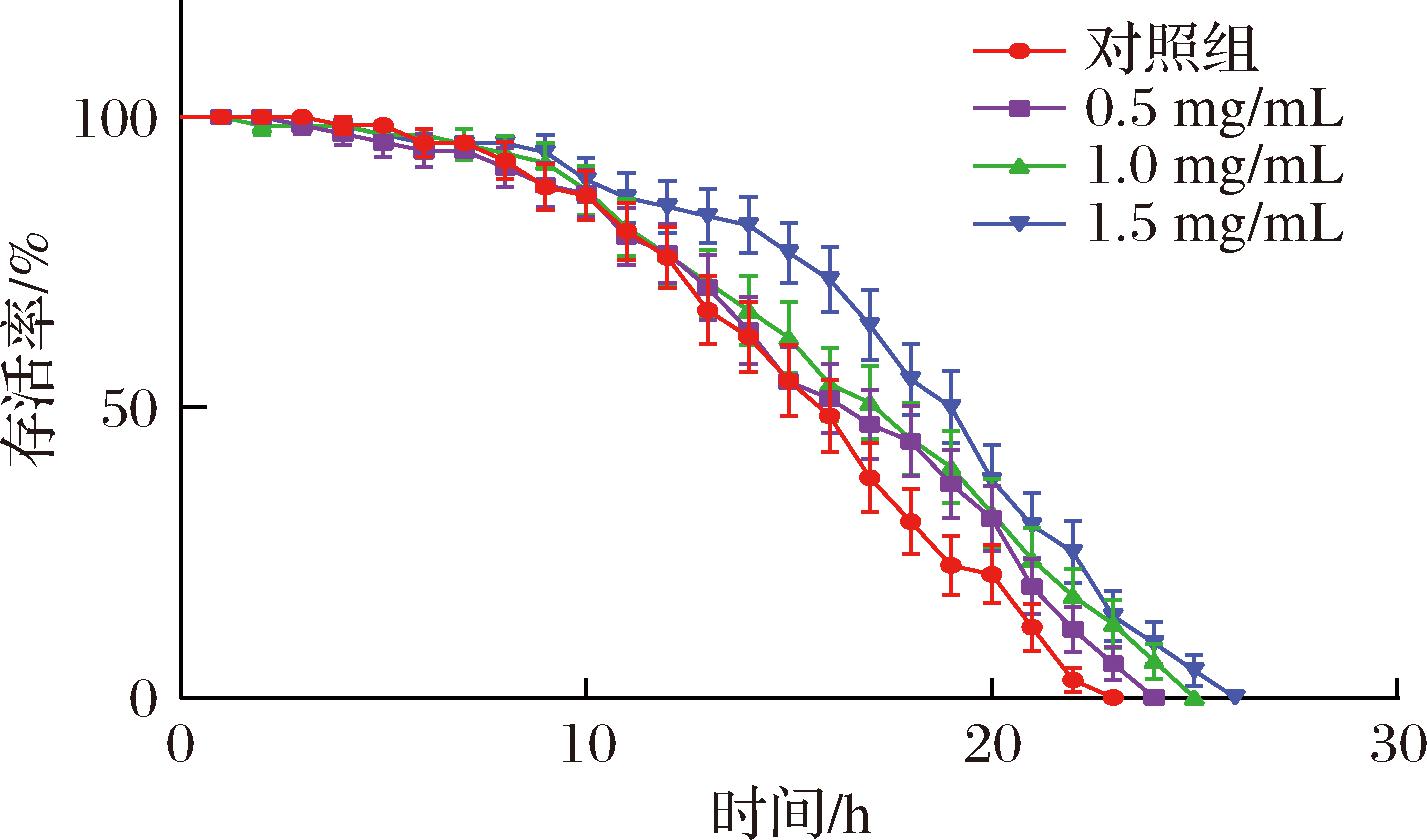
图6 热应激下SFP对线虫生存曲线的影响
Fig.6 Effects of SFP on the survival curve of C.elegans under heat stress
表3 热应激下SFP对线虫寿命的影响
Table 3 Effects of SFP on the lifespan of C.elegans under heat stress
组别线虫总数/N平均寿命/h提高百分比/%最大寿命/h对照组6615.71±0.40d-230.5 mg/mL6816.37±0.26c4.20241.0 mg/mL6317.08±0.28b8.72251.5 mg/mL6418.35±0.13a16.8026
2.8 羊栖菜速溶粉对线虫氧化应激损伤的保护作用
为进一步考察SFP对线虫外界刺激损伤的保护作用,用百草枯建立氧化应激损伤模型,实验结果见图7和表4。在氧化应激条件下,低、中、高质量浓度的SFP可将线虫的平均寿命从(4.49±0.71) d延长至(5.49±0.40)、(5.77±0.34)、(6.37±0.12) d,平均寿命分别延长了22.12%、28.41%和41.82%;最大寿命从12 d分别延长到了13、14、15 d。结果表明,SFP能够提高线虫在氧化应激状态下的抗氧化能力,延长了线虫的寿命。线虫抵御氧化应激能力是评价抗氧化能力高低的指标之一,结果证明,SFP可作为植物源的抗氧化剂增强线虫的抗逆性、修复线虫的氧化损伤,具有良好的抗氧化作用。
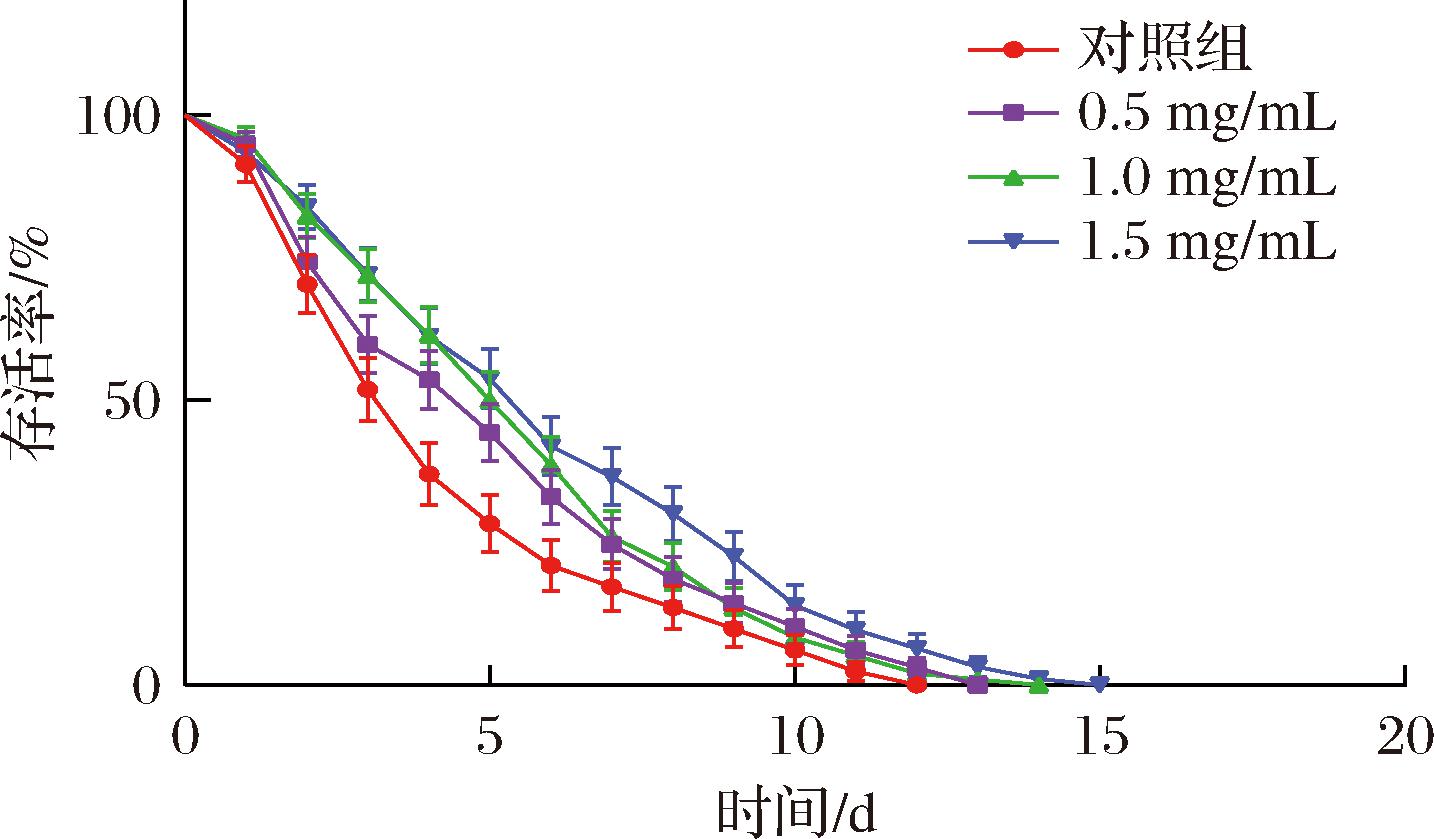
图7 氧化应激下SFP对线虫生存曲线的影响
Fig.7 Effects of SFP on the survival curve of
C.elegans under oxidative stress
表4 氧化应激下SFP对线虫寿命的影响
Table 4 Effects of SFP on the lifespan of C.elegans under oxidative stress

组别线虫总数/N平均寿命/h提高百分比/%最大寿命/h对照组814.49±0.71c-120.5 mg/mL975.49±0.40b22.12131.0 mg/mL965.77±0.34b28.41141.5 mg/mL936.37±0.12a41.8215
2.9 羊栖菜速溶粉对线虫体内代谢物及抗氧化酶活性的影响
生物体的抗氧化防御体系涉及多种酶,主要包括CAT、SOD和GSH,它们可以清除体内积累的自由基,维持氧化还原平衡。MDA是细胞中多不饱和脂肪酸过氧化的最终代谢产物,常被应用评价生物体氧化损伤的指标。线虫体内抗氧化酶活性及MDA含量如图8所示,与对照组相比,经SFP处理后,线虫体内SOD、GSH、CAT活性随质量浓度的升高而升高,MDA含量与样品质量浓度呈负相关。SOD活性提升了0.72%~30.65%;GSH提升了3.24%~28.7%;CAT提升了11.21%~49.66%;MDA含量降低了2.38%~39.68%。结果表明,SFP可以通过提高线虫体内的抗氧化酶活性来清除自由基,从而增强线虫的抗氧化能力。
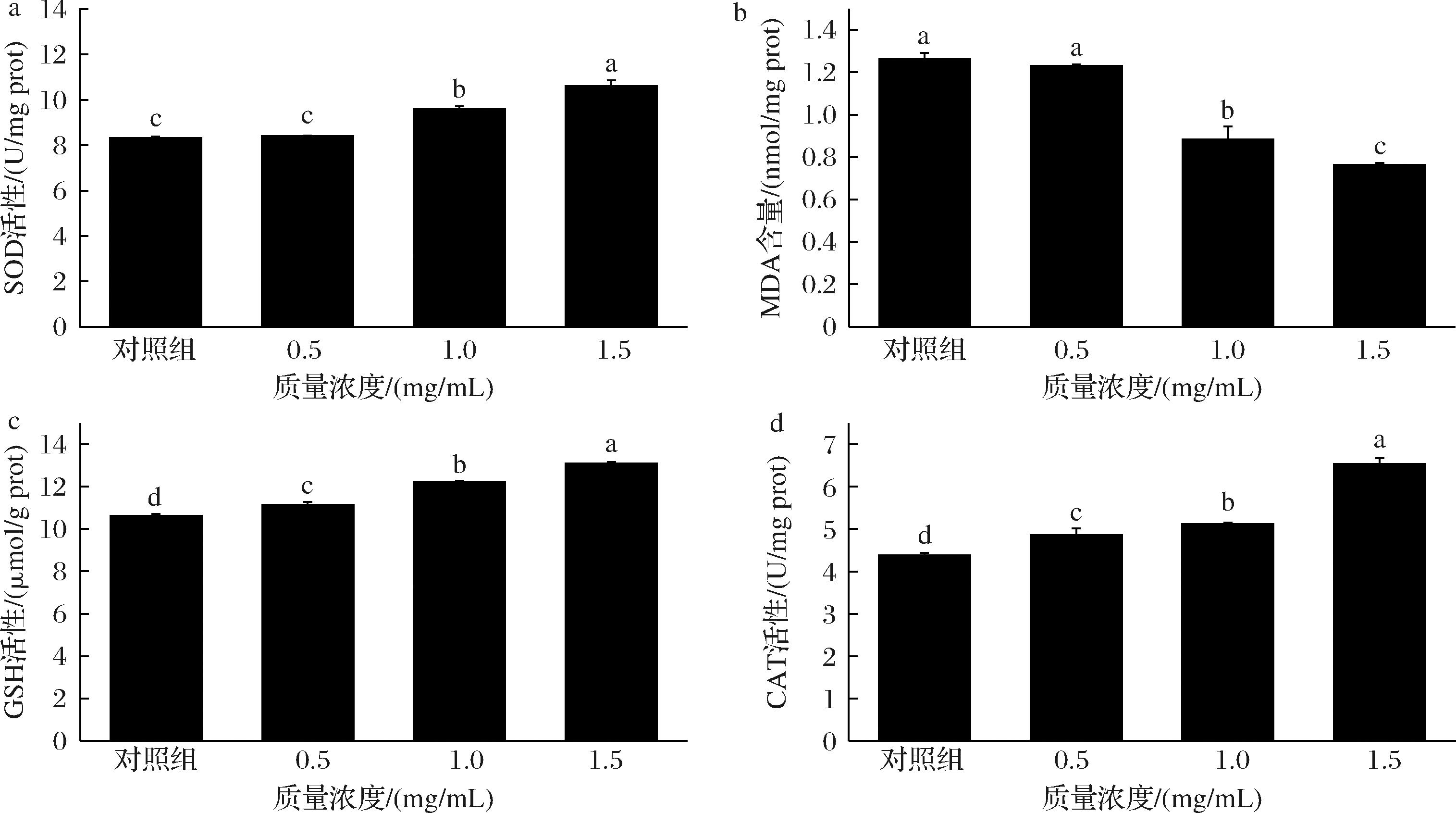
a-SOD活性;b-MDA含量;c-GSH活性;d-CAT活性
图8 SFP对线虫抗氧化酶活性及MDA含量的影响
Fig.8 Effects of SFP on antioxidant enzyme activity and MDA content in C.elegans
2.10 羊栖菜速溶粉对线虫体内ROS含量的影响
在线虫机体的衰老过程中,活性氧大量积累会造成组织的氧化损伤,线虫寿命的缩短[21,25]。线虫体内ROS含量如图9所示,以低、中、高质量浓度SFP喂养线虫后,线虫体内ROS水平与空白对照组相比,分别降低了18.54%、18.61%和29.46%,1.5 mg/mL的SFP对减小ROS含量的影响最为显著。结果说明,SFP能够降低线虫体内的ROS含量,减少自由基对线虫机体的损伤,增强了线虫的抗氧化应激能力。
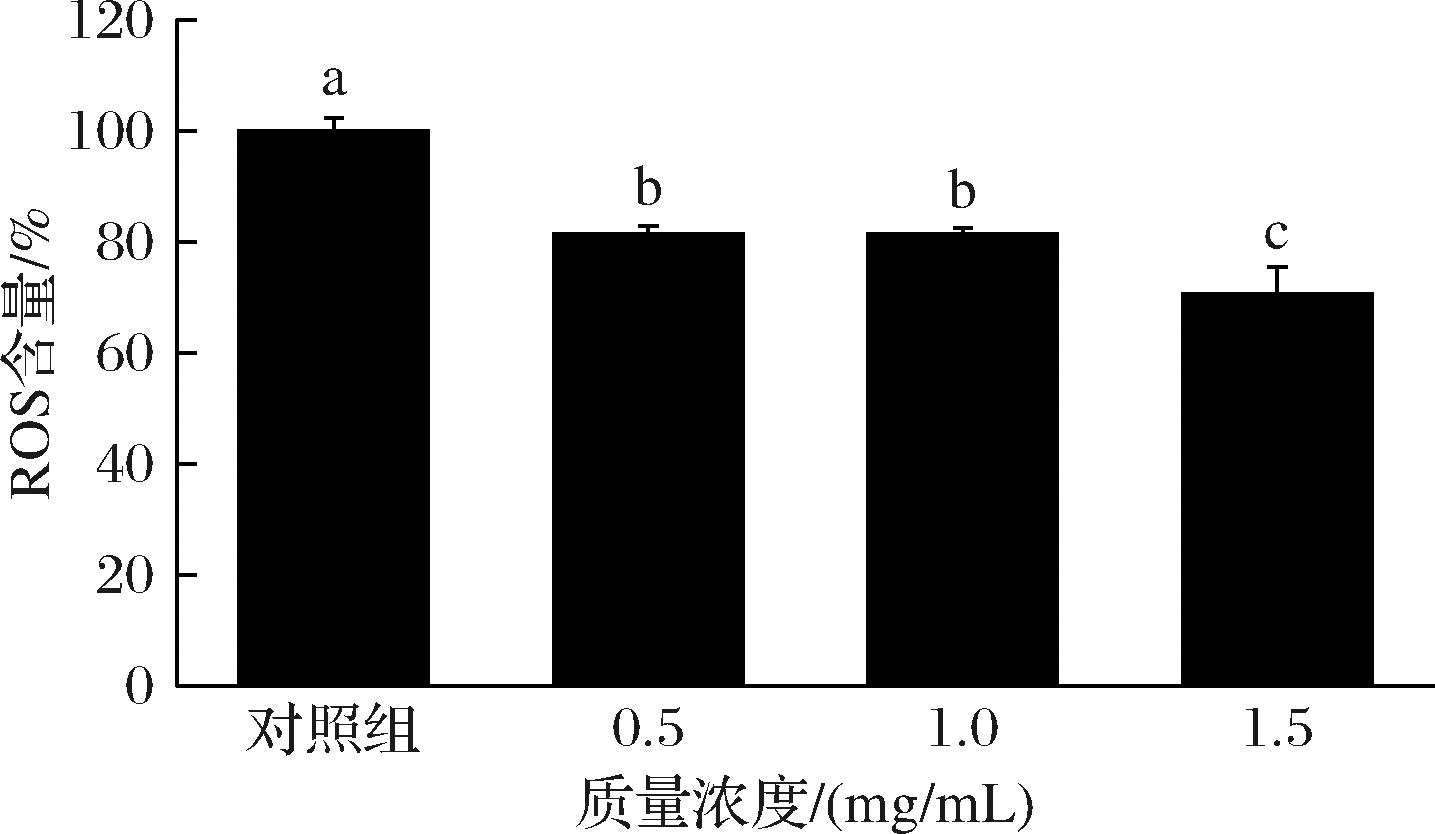
图9 SFP对线虫体内ROS含量的影响
Fig.9 Effects of SFP on ROS content in C.elegans
3 结论
本研究测定了SFP的总黄酮和总酚含量,评价了SFP的体外抗氧化活性及对秀丽隐杆线虫的抗氧化作用。结果表明,与普通粉相比,羊栖菜速溶粉的总酚和总黄酮的含量较高;羊栖菜速溶粉的DPPH自由基清除能力、氧自由基、羟自由基的抑制能力较强,ABTS阳离子自由基清除能力较弱。秀丽隐杆线虫实验结果表明,SFP延长了线虫的寿命,低、中、高剂量组能分别提高线虫的平均寿命6.7%、14.12%和18.87%。SFP改善了线虫的运动能力,减少了脂褐素积累,提高了线虫修复氧化应激损伤和热应激损伤的能力,同时也提高了线虫体内抗氧化酶SOD、CAT和GSH活力,降低了MDA和ROS的水平。本研究反映了SFP的体内外抗氧化能力,为羊栖菜速溶粉在抗氧化领域的应用提供了理论依据,提高了羊栖菜速溶粉的附加值,但SFP对秀丽隐杆线虫抗氧化作用的相关机制仍需进一步探究。
[1] RAMALINGAM V, RAJARAM R.A paradoxical role of reactive oxygen species in cancer signaling pathway:Physiology and pathology[J].Process Biochemistry, 2021, 100:69-81.
[2] CARVALHO M J, PEDROSA S S, MENDES A, et al.Anti-aging potential of a novel ingredient derived from sugarcane straw extract (SSE)[J].International Journal of Molecular Sciences, 2023, 25(1):21.
[3] 孔雪晴, 沙咏怡, 项敏泓.氧化应激及天然食物中的抗氧化剂在干眼中的作用研究进展[J].眼科新进展, 2024, 44(3):235-238.
KONG X Q, SHA Y Y, XIANG M H.Research progress on oxidative stress and effects of antioxidants from natural foods on dry eyes[J].Recent Advances in Ophthalmology, 2024, 44(3):235-238.
[4] TANG M T, JIANG H, WAN C, et al.Hypolipidemic activity and mechanism of action of Sargassum fusiforme polysaccharides[J].Chemistry &Biodiversity, 2023, 20(8):e202300264.
[5] LI Y T, CHEN B J, WU W D, et al.Antioxidant and antimicrobial evaluation of carboxymethylated and hydroxamated degraded polysaccharides from Sargassum fusiforme[J].International Journal of Biological Macromolecules, 2018, 118:1550-1557.
[6] PASKALEVA E E, LIN X D, DUUS K, et al.Sargassum fusiforme fraction is a potent and specific inhibitor of HIV-1 fusion and reverse transcriptase[J].Virology Journal, 2008, 5:8.
[7] LEE D G, PARK S Y, CHUNG W S, et al.Fucoidan prevents the progression of osteoarthritis in rats[J].Journal of Medicinal Food, 2015, 18(9):1032-1041.
[8] LIU J C, YA J N, CAI F K, et al.Study on extraction,purification and immunobiological activities of polysaccharides from Sargassum fusiforme[J].Chinese Journal of Marine Drugs, 2017, 36(3):81-88.
[9] YE Y H, JI D S, YOU L J, et al.Structural properties and protective effect of Sargassum fusiforme polysaccharides against ultraviolet B radiation in hairless Kun Ming mice[J].Journal of Functional Foods, 2018, 43:8-16.
[10] 王艳英, 田周萍, 康臆玲, 等.羊栖菜多酚的制备及抗氧化活性研究[J].福建师范大学学报(自然科学版), 2023, 39(3):63-69; 77.
WANG Y Y, TIAN Z P, KANG Y L, et al.Antioxidant activity and preparation of polyphenols from Sargassum fusiforme[J].Journal of Fujian Normal University (Natural Science Edition), 2023, 39(3):63-69; 77.
[11] THADHANI V M, LOBEER A, ZHANG W, et al.Comparative analysis of sugar and mineral content of Sargassum spp.collected from different coasts of Sri Lanka[J].Journal of Applied Phycology, 2019, 31(4):2643-2651.
[12] KILIC T, KOYUNCU G.Effect of plant addition and ripening on total phenol content, antioxidant capacity, volatile compounds and sensory properties of kashar cheese[J].Journal of Food Science and Technology, 2024, 61(4):734-742.
[13] SON H L, LUYNH B N C, MINH T V.Effect of different drying methods on the total phenolic and flavonoid content and DPPH free-radical scavenging activity of Pandanus amaryllifolius Roxb.planted in Mekong Delta[J].Asian Journal of Biotechnology and Bioresource Technology, 2023, 9(2):36-45.
[14] RICCI A, CIRLINI M, CALANI L, et al.In vitro metabolism of elderberry juice polyphenols by lactic acid bacteria[J].Food Chemistry, 2019, 276:692-699.
[15] JAGATEE S, ROUT J R, BEHERA S, et al.Effect of enzymatic hydrolysis on structural, chemical and elemental properties of sweet potato flour[J].Waste and Biomass Valorization, 2021, 12(2):687-697.
[16] NONGMAITHEM R, MEDA V, NIRANJAN T, et al.Effect of extrusion process on germinated lentil (Lens culinaris) based snack foods:Impact on starch digestibility, physio-functional, and antioxidant properties[J].Measurement:Food, 2024, 13:100132.
[17] 吕晨豪, 李俊健, 陈昶安, 等.发酵陈皮水提物体外抗氧化活性及对秀丽隐杆线虫抗衰老作用[J].食品工业科技, 2023, 44(17):428-437.
LYU C H, LI J J, CHEN C A, et al.Anti-aging and in vitro antioxidant effects of water extracts of fermented pericarpium citri reticulatae on Caenorhabditis elegans[J].Science and Technology of Food Industry, 2023, 44(17):428-437.
[18] ARANTES-OLIVEIRA N, BERMAN J R, KENYON C.Healthy animals with extreme longevity[J].Science, 2003, 302(5645):611.
[19] GRUBER J, TANG S Y, HALLIWELL B.Evidence for a trade-off between survival and fitness caused by resveratrol treatment of Caenorhabditis elegans[J].Annals of the New York Academy of Sciences, 2007, 1100:530-542.
[20] HOU Z Y, ZHU D Q, GAO X C, et al.Antiaging and antioxidative effects of water extract of Zizyphus jujuba Mill on Caenorhabditis elegans[J].Journal of Functional Foods, 2023, 110:105829.
[21] 邓永飞. 裂褶菌-葛根双向发酵条件优化及发酵产物抗衰老活性研究[D].南宁:广西大学,2022.
DENG Y F.Optimization of two-way fermentation conditions of Schizophyllum commune-Pueraria lobata and anti-aging activity of fermentation products[D].Nanning:Guangxi University, 2022.
[22] LI R, TAO M F, XU T T, et al.Small berries as health-promoting ingredients:A review on anti-aging effects and mechanisms in Caenorhabditis elegans[J].Food &Function, 2022, 13(2):478-500.
[23] ZHAO D, YAN M, XU H L, et al.Antioxidant and antiaging activity of fermented coix seed polysaccharides on Caenorhabditis elegans[J].Nutrients, 2023, 15(11):2474.
[24] 刘云鹏. 螺旋藻乳酸菌发酵工艺优化及发酵产物抗衰老作用的研究[D].济南:山东师范大学,2021.
LIU Y P.Study on the optimization of fermentation process of lactic acid bacteria from Spirulina and the anti-aging effect of fermentation products[D].Jinan:Shandong Normal University, 2021.
[25] KUMAR S, PRANEET N S, SUCHIANG K.Lactobacillus brevis MTCC 1750 enhances oxidative stress resistance and lifespan extension with improved physiological and functional capacity in Caenorhabditis elegans via the DAF-16 pathway[J].Free Radical Research, 2022, 56(7-8):555-571.