过量饮酒是一个全球性的健康问题,被认为是引发肝脏损伤的关键因素之一[1]。短期急性暴饮和长期酗酒都会对肝脏造成伤害,严重的可能会导致脂肪肝、酒精性肝炎、肝硬化甚至肝细胞癌等[2-3]。酒精对肝脏的损伤与其诱导的脂质代谢紊乱密切相关,酒精可增加脂肪在肝脏的沉积进而导致脂肪肝和其他肝病的发生[4-5]。酒精摄入还会导致肝细胞损伤和氧化应激,进一步加剧肝脂代谢紊乱[6]。也有研究表明,酒精代谢产物乙醛会抑制脂质代谢途径中关键酶的活性,干扰脂肪酸的正常氧化代谢[7]。因此,发掘对酒精性肝损伤具有作用的天然活性物质,并深入研究其保护肝脏的机制对于酒精性肝损伤的改善至关重要。
枳椇(Hovenia dulcis)又称拐枣,在我国分布广泛,自古就被认为有解酒护肝的功效。占枳椇果实90%总重的枳椇果梗(可食用肉质部分)富含以多糖为主的多种活性物质,极具开发利用价值[8]。枳椇果梗多糖(Hovenia dulcis fruit peduncle polysaccharides,HDPs)作为枳椇最主要的活性成分之一,已显示出可通过调节乙醇脱氢酶、谷胱甘肽过氧化物酶的活性以及促进酒精代谢,改善急性酒精性肝损伤[9];通过抗炎、抗脂质过氧化和调节肠道通透性来调节慢性酒精性肝损伤的潜能[10-11]。最近的一项研究从枳椇果梗中提取了HDPs,并证实它能有效清除氧自由基,抑制体外生物大分子(蛋白质、脂质和DNA)氧化[12]。这些研究表明,HDPs可在改善酒精引起的肝损伤方面发挥重要作用,但其保护效应及内在机制仍需要进一步明确。
因此,本研究以HDPs为研究对象,旨在探究HDPs对酒精诱导的急性肝损伤的保护效应,并基于肝脏代谢组学进一步了解其可能的作用机制。研究结果可为明确HDPs对急性酒精性肝损伤的改善效果及机制,扩展枳椇资源在功能食品中的应用提供参考。
1 材料与方法
1.1 材料与试剂
雄性C57BL/6小鼠[6周龄,许可证号:SCXK(湘)2019-0004],湖南斯莱克景达实验动物有限公司,实验动物饲养于标准屏蔽环境(温度22~24 ℃,湿度45%~55%,12 h光/暗循环),自由饮水,本实验所有动物操作均经茅台学院动物管理和使用委员会批准(动物伦理编号:MTI-IACUC-2022-007)。
食用酒精(纯度95%),鑫河阳酒精有限公司;HDPs 按项目组前期研究结果提取获得[12];总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒、IL-4、干扰素-γ(interferon-γ,IFN-γ)、TNF-α酶联免疫吸附试验(ELISA)试剂盒、肝糖原试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
数字幻灯片扫描仪,匈牙利布达佩斯3DHISTECH公司;超高效液相色谱-电喷雾电离四极杆质谱联用系统,美国Thermo公司。
1.3 实验方法
1.3.1 分组与给药
80只C57BL/6雄性小鼠按体质量随机分为4组(n=20),分别为对照组、11.4 μL酒精组、114 μL酒精组和HDPs(100 mg/kg)+114 μL酒精组(HDPs干预组)。根据人均酒精消费量(32.8 g/d),换算出小鼠的酒精暴露剂量为114 μL/20 g[13]。对照组每天灌胃等量蒸馏水,而酒精暴露组小鼠每天分别灌胃11.4 μL/20 g和114 μL/20 g食用酒精;HDPs干预组小鼠首先灌胃100 mg/kg HDPs,2 h后灌胃114 μL/20 g酒精[14]。受试鼠连续处理15 d后抽取血液,并收集肝脏样本用于后续检测分析。
1.3.2 血清生化分析
采血后,在4 ℃下以2 000 r/min的转速离心小鼠血液10 min,收集血清。使用试剂盒测定血清中TC、TG、LDL-C和HDL-C的水平,以及ALT和AST的活性。
1.3.3 肝脏器系数及组织学检查
在给药期间,所有小鼠的体重被记录。实验结束后,取小鼠的整个肝脏组织进行称重(g),肝脏器系数按公式(1)计算:
肝脏器系数![]()
(1)
将各组小鼠的新鲜肝组织在4%(质量分数)多聚甲醛中室温固定24 h,常规脱水后包埋于石蜡中,切片厚度为5 μm,进行苏木精-伊红染色。同时,对去石蜡切片进行周期性酸-希夫染色,以观察肝组织中糖原的变化。这些切片由数字幻灯片扫描仪扫描,并通过CaseViewer软件进行观察和分析。
1.3.4 肝损伤相关因子检测
采集小鼠肝脏组织,采用ELISA商用检测试剂盒检测IL-4、IFN-γ和TNF-α水平及肝糖原含量。样本中的蛋白质浓度用 BCA 蛋白质分析试剂盒测定。
1.3.5 肝脏代谢组学分析
收集每组小鼠的肝脏进行非靶向代谢组学分析[15]。将约50 mg肝组织(3只小鼠肝组织混合为1个技术样本,n=4个技术样本)加入200 μL水均质物中,涡旋60 s,再加入800 μL甲醇/乙腈(1∶1,体积比)溶液,涡旋60 s。低温超声波(40 kHz)2次,每次30 min,然后将样品置于-20 ℃冰箱中冷冻1 h,沉淀蛋白质。使用UHPLC-ESI-Q-Exactive HF-X系统分析样品。色谱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm);流动相A为95%水+5%乙腈(含0.1%甲酸均为体积分数,下同),流动相B为47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸);进样量3 μL,柱温40 ℃。质谱条件:样品采用电喷雾电离,分别以正离子和负离子扫描模式收集质谱信号,质量扫描范围为70~1 050 m/z。鞘气流速50 psi,辅助气流速13 psi,辅助气加热温度425 ℃。一级质谱分辨率60 000,二级质谱分辨率7 500,应用DDA模式采集数据。
1.3.6 qRT-PCR分析
使用Trizol试剂盒从肝组织中提取总RNA,并用RevertAid First Strand cDNA Synthesis Kit反转录成cDNA。使用HieffTMqPCR SYBR® Green Master Mix Kit和CFX384 Real-Time PCR系统进行实时PCR。qPCR程序为:95 ℃预变性4 min,随后进行40个循环,每个循环包括95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸20 s。胆汁酸相关基因(cyp7a1、fxr、fgf15)qRT-PCR的引物序列见表1。目标基因的相对表达量采用2-ΔΔCT值来表示,以gapdh为内参基因。
表1 关键基因引物序列表
Table 1 Sequence of key gene primers

基因正向引物序列(5′→3′)反向引物序列(5′→3′)基因库编号引物长度cyp7a1GGGATTGCTGTGGTAGTGAGCGGTATGGAATCAACCCGTTGTC>NM_007824.3100fxrGGCAGAATCTGGATTTGGAATCGGCCCAGGTTGGAATAGTAAGACG>NM_009108.2101fgf15ATGGCGAGAAAGTGGAACGGCTGACACAGACTGGGATTGCT>NM_008003.2109gapdhCCTCGTCCCGTAGACAAAATGTGAGGTCAATGAAGGGGTCGT>NM_001411843.1249
1.4 数据分析
代谢数据及差异通路分析如下:原始数据经过Pareto缩放预处理,并通过正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)进行统计分析。获得的代谢物使用Progenesis QI软件进行代谢物标注和数据处理。在VIP>1、P<0.05以及倍数变化(fold change)≥1.5的条件下,使用上海美吉云平台结合MetaboAnalyst 5.0在线平台(http://www.metaboanalyst.ca/)筛选和分析具有显著差异的代谢物,以确定代谢物之间的相互作用;代谢通路根据KEGG(http://www.metaboanalyst.ca/)富集分析构建。
使用GraphPad Prism 8.0 绘制统计图,除代谢组学分析外,数据均以“平均值±标准误差”表示;采用单因素方差分析(ANOVA),比较组间差异,P<0.05表示差异显著。
2 结果与分析
2.1 各组小鼠的血脂和肝功能变化
由表2可知,与对照组相比,11.4 μL酒精组和114 μL酒精组小鼠血清T-CHO、TG、LDL-C和HDL-C水平显著升高(P<0.05);与114 μL酒精组相比,HDPs干预组的TG、TC和LDL-C水平显著降低(P<0.05)。血清中ALT和AST活性被看作酒精性急性肝功能的指标之一;与对照组相比,酒精暴露组明显增加了血清ALT和AST活性,HDPs干预后血清ALT和AST活性降低。以上结果提示,HDPs能降低酒精暴露小鼠血脂水平的升高,改善急性肝功能异常。
表2 HDPs对酒精暴露小鼠血脂水平的影响(n=6)
Table 2 Effect of HDPs on blood lipid levels in alcohol-exposed mice (n=6)

分组指标T-CHO/(mmol/L)TG/(mmol/L)LDL-C/(mmol/L)HDL-C/(mmol/L)ALT/(U/L)AST/(U/L)对照组0.49±0.011.3±0.130.67±0.090.47±0.0217.9±1.6430.1±0.9911.4 μL酒精组0.79±0.06∗1.6±0.110.75±0.030.58±0.0630.2±1.14∗∗68.5±2.47∗∗114 μL酒精组1.6±0.08∗∗2.6±0.14∗∗1.3±0.13∗∗0.76±0.05∗∗58.0±1.27∗∗128.9±1.12∗∗HDPs干预组0.96±0.04##1.6±0.18##0.75±0.08##0.73±0.0440.1±1.79##76.9±3.45##
注:与对照组相比,*P<0.05,**P<0.01;与114 μL酒精组相比,#P<0.05,##P<0.01(下同)。
2.2 各组小鼠肝组织病理与肝糖原变化
由图1可知,与对照组相比,11.4 μL酒精组和114 μL酒精组肝脏器系数增加,伴有明显的病理变化,如肝细胞空泡化和部分炎症细胞浸润以及中心静脉狭窄(P<0.05,量化见图1-b);与114 μL酒精组相比,HDPs干预组没有出现明显的肝细胞空泡化和炎症细胞浸润。由图2可知,与对照组相比,11.4 μL酒精组和114 μL酒精组肝糖原含量减少,HDPs干预后肝糖原含量明显上升(P<0.05,量化见图2-b)。以上结果提示,HDPs可减轻酒精暴露小鼠肝组织的损伤和糖原消耗。
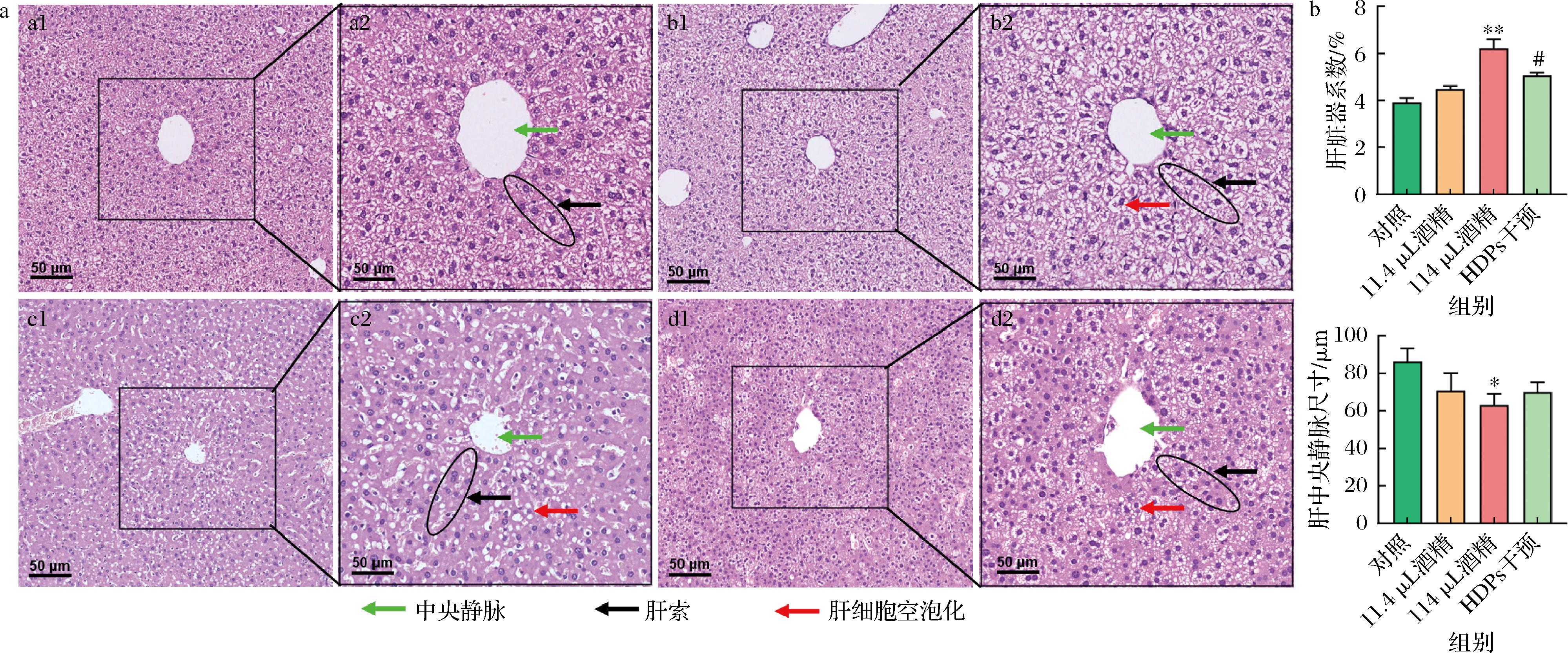
a-苏木精-伊红染色的肝组织病理学变化(Bar=50 μm);b-肝脏器系数(n=6)与肝中央静脉尺寸(n=3)
图1 HDPs对酒精暴露小鼠肝组织病理的影响
Fig.1 Effects of HDPs on liver histopathology in alcohol-exposed mice
注:a1、a2:对照(a1表示×20、a2表示×40),b1、b2:11.4 μL酒精(b1表示×20、b2表示×40),c1、c2:114 μL酒精组(c1表示×20、c2表示×40),d1、d2:HDPs干预(d1表示×20、d2表示×40);与对照组相比,*P<0.05,**P<0.01;与114 μL酒精组相比,#P<0.05(下同)。

a-周期性酸-希夫染色的肝糖原变化(Bar=50 μm);b-肝糖原含量(n=6)
图2 HDPs对酒精暴露小鼠肝糖原的影响
Fig.2 Effects of HDPs on hepatic glycogen in alcohol-exposed mice
2.3 各组小鼠肝脏炎症细胞因子的变化
测定小鼠肝脏的促炎细胞因子(IL-4、IFN-γ和TNF-α)水平,可确定HDPs的抗炎作用。由表3可知,与对照组相比,11.4 μL酒精组和114 μL酒精组小鼠肝脏组织中的IL-4、IFN-γ和TNF-α水平显著升高(P<0.01);与114 μL酒精组相比,HDPs干预组的这些促炎细胞因子水平明显降低(P<0.05)(表3)。以上结果提示,HDPs可发挥对酒精暴露小鼠肝组织的抗炎作用。
表3 HDPs对酒精暴露小鼠肝脏炎症细胞因子的影响(n=6)
Table 3 Effects of HDPs on hepatic inflammatory cytokines in alcohol-exposed mice (n=6)
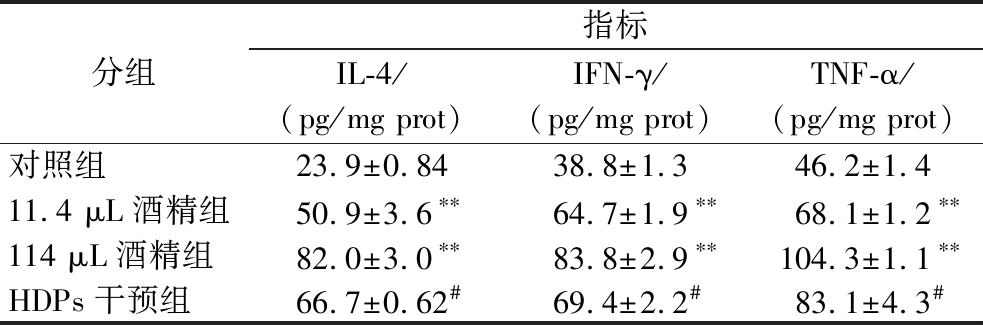
分组指标IL-4/(pg/mg prot)IFN-γ/(pg/mg prot)TNF-α/(pg/mg prot)对照组23.9±0.8438.8±1.346.2±1.411.4 μL酒精组50.9±3.6∗∗64.7±1.9∗∗68.1±1.2∗∗114 μL酒精组82.0±3.0∗∗83.8±2.9∗∗104.3±1.1∗∗HDPs干预组66.7±0.62#69.4±2.2#83.1±4.3#
2.4 各组小鼠肝脏代谢组学变化
为进一步了解HDPs对酒精暴露小鼠肝脏代谢的影响,对肝脏进行了代谢组学分析。使用韦恩图和PLS-DA对不同处理组的肝脏代谢物进行了区分,以寻找肝脏中潜在的差异生物代谢物。韦恩图分析显示,不同处理组的代谢物数量存在差异,114 μL酒精组的差异代谢物数量高于对照组(图3-a)。应用PLS-DA模型[R2Y(cum)和Q2Y(cum)的值接近1表示模型可靠]以揭示HDPs的干预效果,11.4 μL酒精组、114 μL酒精组和HDPs干预组都有明显的聚类区分。对照组与酒精暴露组之间有明显的分离,表明酒精暴露后肝脏代谢谱发生了明显的生化变化;而HDPs组的聚类趋势更好,这可能提示HDPs发挥了干预作用(图3-b)。对鉴定出的代谢物进行的HMDB分类显示,不同处理组中发生差异变化的代谢物主要为脂类(303个),其占总代谢物数量的30.98%(图3-c)。

a-各组差异代谢的韦恩图分析;b-PLS-DA图(QC:质控样本);c-HMDB分类
图3 HDPs对酒精暴露小鼠肝脏代谢谱的影响
Fig.3 Effects of HDPs on hepatic metabolic profiles in alcohol-exposed mice

a-KEGG富集分析结果图;b-各组肝脏胆汁酸相对含量;c-各组肝脏差异胆汁酸相对含量(n=4)
图4 HDPs对酒精暴露小鼠肝脏胆汁酸代谢的影响
Fig.4 Effects of HDPs on hepatic bile acid metabolism in alcohol-exposed mice
注:c图中红色表示响应值升高,黄色表示响应值降低。
为了确定受影响的重要代谢通路,进行了基于KEGG的代谢分析,不同处理组的KEGG功能富集结果被依次归类为氨基酸代谢、脂质代谢、辅因子和维生素代谢等(图4-a)。应用MetaboAnalyst进一步分析脂质代谢发现,与114 μL酒精组相比,HDPs干预组改变的主要重要代谢途径包括胆汁酸代谢、甘油磷脂代谢和亚油酸代谢等。胆汁酸代谢在调控胆固醇和脂质代谢中起着至关重要的作用,而肝脏是胆汁酸合成和代谢的主要场所。肝脏胆汁酸代谢结果分析显示,114 μL酒精组小鼠肝脏组织中的胆汁酸相对含量显著高于对照组,而HDPs干预组小鼠肝脏组织中的胆汁酸相对含量显著低于114 μL酒精组(图4-b)。
各组鉴定出了7种差异胆汁酸,114 μL酒精组肝脏胆汁酸除牛磺胆酸、牛磺脱氧胆酸外,其他胆汁酸含量均高于对照组(其中胆酸、N-胆酰甘氨酸显著升高);而HDPs干预组肝脏胆汁酸代谢物较114 μL酒精组均出现不同程度地下降,其中牛磺胆酸、鹅去氧胆酸牛磺酸、磺基乙酰胆碱甘氨酸、甘胆酸显著下降(图4-c)。
2.5 各组小鼠肝脏胆汁酸通路相关基因表达的变化
为了进一步明确HDPs对酒精暴露小鼠肝脏胆汁酸通路的影响,对胆汁酸代谢中的几个重要关键基因,如cyp7a1、fxr和fgf15进行检测,这些基因在肝脏胆汁酸代谢过程中的调控与作用见图5-a。与对照组相比,114 μL酒精组小鼠肝脏组织中cyp7a1 mRNA表达显著下调(P<0.05),而fxr和fgf15 mRNA表达显著上调(P<0.01,P<0.05);与114 μL酒精组相比,HDPs干预组cyp7a1 mRNA表达显著上调(P<0.05),而fxr和fgf15 mRNA表达显著下调(P<0.05)(图5-b~图5-d)。以上结果提示,HDPs可能通过调节肝脏中胆汁酸代谢相关基因的表达来发挥其对酒精暴露诱导的肝脏损伤的保护作用。
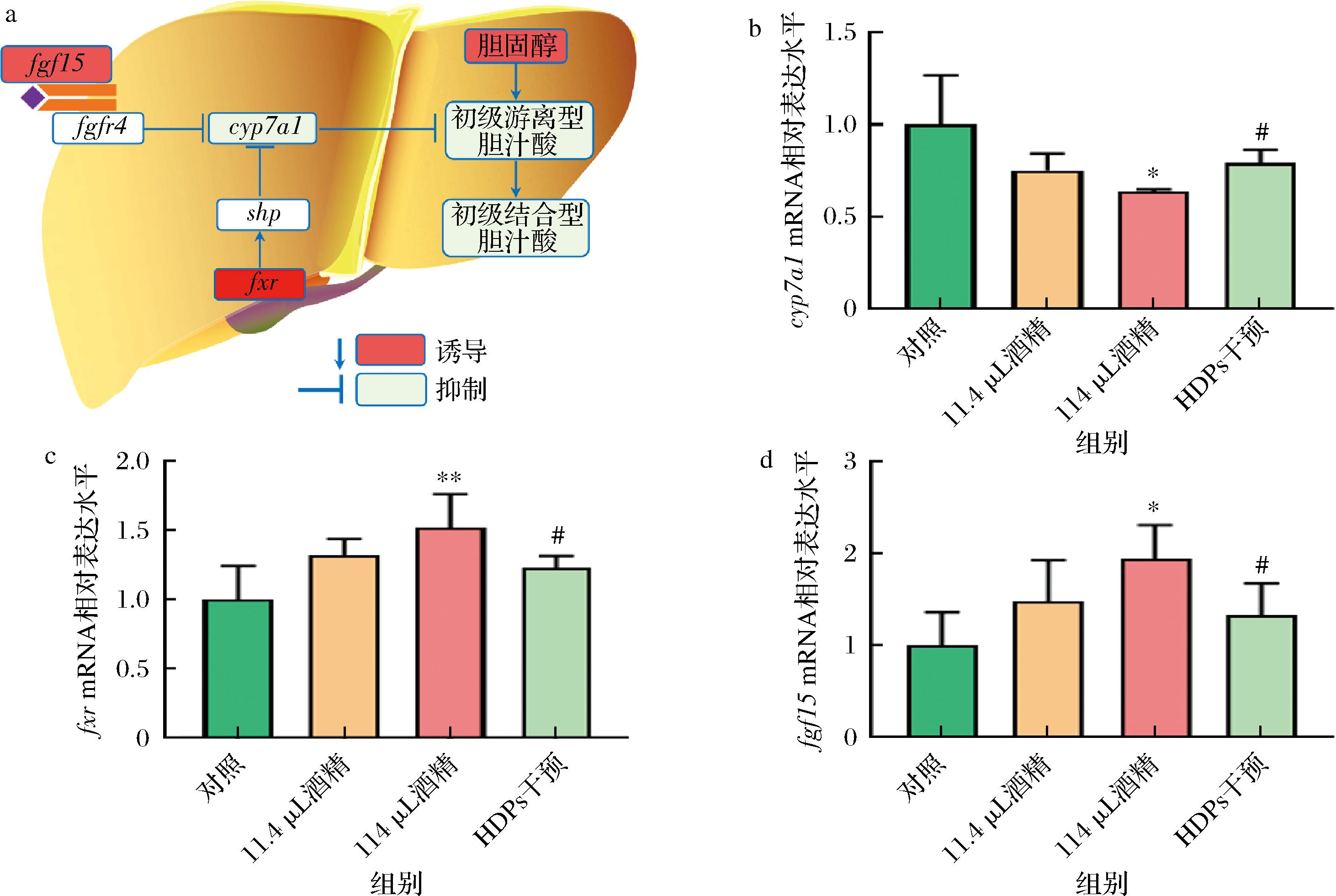
a-肝脏胆汁酸通路图;b-cyp7a1 mRNA表达;c-fxr mRNA表达;d-fgf15 mRNA表达
图5 HDPs对酒精暴露小鼠肝脏胆汁酸通路相关基因表达的影响(n=3)
Fig.5 Effects of HDPs on the expression of bile acid pathway-related genes in the liver of alcohol-exposed mice
3 讨论
本研究探究了HDPs对酒精诱导的小鼠急性肝损伤的改善作用,并分析了其潜在的作用机制。研究发现,酒精暴露显著影响了小鼠肝脏的脂质代谢状态,特别是导致血脂水平异常、肝糖原含量降低、炎症细胞因子的高表达以及胆汁酸谱紊乱,这些变化与肝脏损伤和功能障碍紧密相关。HDPs的干预有效地逆转了这些变化,HDPs可能通过多途径发挥对酒精诱导的肝损伤的保护作用,包括:a)通过降低血脂水平,减轻肝脏脂质负担;b)抗炎作用减轻肝脏炎症损伤;c)调节胆汁酸代谢谱及相关基因表达,恢复胆汁酸合成和代谢平衡。这些发现为HDPs在功能食品中的应用提供了理论依据。
3.1 HDPs对酒精性肝损伤的改善效应
本项研究探讨了酒精暴露对小鼠血清生化指标的影响,并评估了HDPs对这些影响的潜在改善效应。研究发现,在酒精暴露的条件下,小鼠血清中的T-CHO、TG、LDL-C和HDL-C水平显著升高。这些生化指标的异常升高是酒精性肝损伤的典型生物标志,它们不仅反映了肝脏损伤的程度,也指示了脂质代谢的紊乱状态[16]。此外,酒精暴露还导致了肝脏酶类指标,如ALT和AST活性的显著增加,这些酶的活性升高通常被视为肝脏细胞损伤的敏感指标[17]。在本研究中,HDPs的干预显著降低了血脂水平,并且降低了ALT和AST的活性;这与先前关于枳椇子的研究类似,MENG等[18]研究表明枳椇子提取物能显著降低急性酒精性肝损伤小鼠血清中的ALT和AST活性以及TG水平。以上表明HDPs具有潜在的改善酒精引起的血脂及肝功能异常的能力。
酒精暴露引起的肝细胞空泡化、炎症细胞浸润以及中心静脉狭窄是酒精性肝损伤的另一典型病理特征。这些病理变化反映了肝脏在酒精代谢过程中所遭受的损伤,其中肝细胞空泡化是由于细胞内脂肪沉积造成的,炎症细胞浸润则表明肝脏存在炎症反应,而肝细胞中心静脉狭窄可能影响肝脏的血液供应和代谢功能。这些特征的出现,不仅影响了肝脏的正常结构和功能,还可能导致肝脏纤维化甚至肝硬化。本研究发现,HDPs干预组小鼠未出现明显的肝细胞损伤,这表明HDPs可能具有保护肝细胞免受酒精毒性损伤的能力。类似的研究也表明,枳椇果及花梗提取物可降低大鼠血液中的乙醇浓度,并提高肝脏中乙醇脱氢酶和乙醛脱氢酶的活性,发挥解酒保肝的作用[19]。此外,肝糖原含量的恢复进一步证实了HDPs对肝脏功能的保护作用。肝糖原是肝脏储存能量的重要形式,其含量的降低通常与肝脏功能障碍有关[20]。HDPs干预后肝糖原含量的恢复,可能有助于维持肝脏的能量平衡和代谢稳态[21]。
酒精暴露还显著提高了小鼠肝脏中促炎细胞因子IL-4、IFN-γ和TNF-α的水平;这些促炎因子的增加与肝脏炎症反应和组织损伤密切相关[22]。而HDPs的干预降低了这些促炎细胞因子的水平,显示了其抗炎作用。相关的多糖提取物研究指出,这种抗炎作用可能通过抑制炎症信号通路的激活、减少炎症细胞的浸润或调节免疫细胞的活性来实现[23]。本研究结果表明,HDPs对酒精性肝损伤具有改善作用,能够减轻酒精引起的糖原消耗,并通过抑制炎症反应减轻肝脏损伤。
3.2 HDPs对酒精性肝损伤的改善作用机制或与调节胆汁酸通路相关
在本项研究中,代谢组学分析揭示了HDPs对肝脏代谢谱的影响,特别是脂类代谢物的变化。本研究通过KEGG通路分析显示HDPs干预影响了胆汁酸代谢等重要途径。胆汁酸代谢是肝脏功能的重要组成部分,在维持肝脏健康中扮演着重要角色。现代药理学研究揭示,摄入酒精能够干扰胆汁酸的生成,导致肝脏中的胆汁积累,然而,通过调整胆汁酸的水平可以促进酒精性肝病的恢复[24]。特别是,HDPs降低了酒精暴露小鼠肝脏中胆汁酸的相对含量,表明其可能通过调节胆汁酸代谢来改善肝脏的代谢状态,减轻酒精对肝脏的损伤。
cyp7a1编码的胆固醇7α-羟化酶是胆汁酸生物合成途径中的限速酶,主要负责催化胆固醇转化为胆汁酸的第一步反应。FXR作为胆汁酸受体通过与胆汁酸结合形成异二聚体复合物,进而调控下游基因的表达;FXR的激活还可以抑制CYP7A1的表达,减少胆汁酸的合成。成纤维细胞生长因子15是肠道中FXR激活后诱导分泌的一种激素,它通过与肝细胞上的FGFR4/β-Klotho复合物结合,启动信号传导途径,进而抑制CYP7A1的表达和胆汁酸的合成。这3种基因和它们编码的蛋白质在胆汁酸代谢中相互作用,共同维持体内胆固醇和胆汁酸水平的稳定[25]。本研究进一步的基因表达分析显示,在114 μL酒精组中观察到的cyp7a1 mRNA表达的显著下调可能反映了酒精暴露对肝脏胆汁酸合成途径的抑制作用。而HDPs干预组中cyp7a1 mRNA表达的显著上调表明HDPs可能促进了胆固醇向胆汁酸的转化,这有助于维持胆汁酸池的稳定,并可能减轻酒精引起的胆固醇积累和相关的肝脏损伤。酒精暴露导致fxr和fgf15 mRNA表达的上调可能指示了肝脏对胆汁酸合成负反馈调节机制的激活。然而,在HDPs干预组中观察到的fxr和fgf15 mRNA表达的下调可能说明HDPs通过减弱这一负反馈机制,促进了胆汁酸的合成和分泌,从而有助于改善酒精引起的胆汁淤积和肝功能异常。这些结果提示,HDPs对这些关键基因表达的调节作用可能共同影响了肝脏胆汁酸的合成、代谢和转运,可能为酒精暴露引起的肝脏损伤提供了一种新的改善机制。这种机制可能有助于恢复酒精暴露引起的胆汁酸代谢失衡,降低肝脏损伤的风险,对预防酒精性肝损伤具有积极作用。
除调节胆汁酸通路外,HDPs干预的重要代谢途径还可能涉及甘油磷脂代谢和亚油酸代谢。甘油磷脂是细胞膜的重要成分,参与多种生理功能,包括细胞信号传导和代谢过程。在代谢组学研究中,甘油磷脂的紊乱与多种代谢异常有关,例如内质网应激、肥胖、胰岛素抵抗和血脂异常[26]。在本研究中,HDPs干预后,可以观察到甘油磷脂代谢途径中特定代谢物的变化。例如,磷脂酰胆碱(phosphatidyl cholines,PC)水平的变化与脂质从头合成途径相关,并且与糖尿病发病风险有关[27]。HDPs的干预可能会影响PC的水平,从而对细胞的能量代谢产生影响。此外,亚油酸及其代谢物如12,13-diHOME,被发现与体重指数和胰岛素抵抗呈负相关,HDPs的干预可能在调节能量代谢和产热方面发挥作用[28]。另一方面,亚油酸是合成前列腺素、白三烯和其他生物活性物质的前体,这些物质在炎症反应、血管舒张和收缩等生理过程中发挥作用[29]。HDPs干预还可能通过影响亚油酸的代谢来改善血脂异常,如降低血清中的总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平。甚至,HDPs可能通过影响亚油酸的去饱和酶活性,进而影响其下游代谢产物的形成。综上所述,HDPs对缓解酒精暴露引起的肝脏代谢紊乱具有潜在的积极作用,这些发现为进一步研究HDPs的生物学功能和开发新的治疗策略提供了重要信息。
4 结论
HDPs作为一种天然功能活性物质,对酒精诱导的肝脏损伤显示出有效的改善作用,其作用机制可能涉及多方面的代谢调节,特别是对胆汁酸代谢通路的调控。本研究为HDPs在功能性食品中的应用提供了理论依据。未来的研究需要进一步探索HDPs对肝脏胆汁酸代谢及相关信号通路的长期影响和相关机制。
[1] IM P K, WRIGHT N, YANG L, et al.Alcohol consumption and risks of more than 200 diseases in Chinese men[J].Nature Medicine, 2023, 29(6):1476-1486.
[2] LE GARF S, N GRE V, ANTY R, et al.Metabolic fatty liver disease in children:A growing public health problem[J].Biomedicines, 2021, 9(12):1915.
GRE V, ANTY R, et al.Metabolic fatty liver disease in children:A growing public health problem[J].Biomedicines, 2021, 9(12):1915.
[3] 向琴, 张国泰, 芦润青, 等.基于文献计量分析药食同源物质缓解酒精性肝损伤研究进展[J].食品工业科技, 2024, 45(2):1-11.
XIANG Q, ZHANG G T, LU R Q, et al.Research progress on the alleviation of alcoholic liver injury based on bibliometric analysis of medicinal and food homologous substances[J].Science and Technology of Food Industry, 2024, 45(2):1-11.
[4] JEON S, CARR R.Alcohol effects on hepatic lipid metabolism[J].Journal of Lipid Research, 2020, 61(4):470-479.
[5] 邓斌, 陈洁, 李想, 等.基于网络药理学探讨沙棘治疗酒精性肝损伤的作用机制[J].食品工业科技, 2024, 45(14):25-33.
DENG B, CHEN J, LI X, et al.Exploring the mechanism of action of sea buckthorn in the treatment of alcoholic liver injury based on network pharmacology[J].Science and Technology of Food Industry, 2024, 45(14):25-33.
[6] 叶丽云, 孟国良, 吴龙月, 等.灵芝子实体多糖对小鼠急性酒精肝损伤预防的代谢组分析[J].菌物学报, 2021, 40(9):2376-2389.
YE L Y, MENG G L, WU L Y, et al.Preventive effects of the Ganoderma lingzhi fruit-body polysaccharides on the acute alcoholic injury of mice liver based on metabonomics analysis[J].Mycosystema, 2021, 40(9):2376-2389.
[7] 贾岚, 王蕾蕾, 孟靓, 等.白芍对酒精性肝损伤肝阴虚证的保护功效和机制[J].北京中医药大学学报, 2020, 43(3):203-211.
JIA L, WANG L L, MENG L, et al.Effects of Baishao on liver Yin deficiency pattern in alcoholic liver injury and its mechanism[J].Journal of Beijing University of Traditional Chinese Medicine, 2020, 43(3):203-211.
[8] 王楠. 枳椇乳酸菌发酵饮料对小鼠酒精肝损伤的保护作用[D].杨凌:西北农林科技大学, 2016.
WANG N.Effect of Lactic acid fermented beverage from peduncles of Hovenia dulcis on alcohol-induced liver damage in mice[D].Yangling:North West Agriculture and Forestry University, 2016.
[9] WANG M C, ZHU P L, JIANG C X, et al.Preliminary characterization, antioxidant activity in vitro and hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles of Hovenia dulcis[J].Food and Chemical Toxicology, 2012, 50(9):2964-2970.
[10] LIU Y, QIANG M L, SUN Z G, et al.Optimization of ultrasonic extraction of polysaccharides from Hovenia dulcis peduncles and their antioxidant potential[J].International Journal of Biological Macromolecules, 2015, 80:350-357.
[11] YANG B, WU Q J, LUO Y X, et al.High-pressure ultrasonic-assisted extraction of polysaccharides from Hovenia dulcis:Extraction, structure, antioxidant activity and hypoglycemic[J].International Journal of Biological Macromolecules, 2019, 137:676-687.
[12] 刘旭东, 张玉超, 朱思洁, 等.枳椇果梗多糖的提取工艺优化及其抗氧化性[J].食品工业科技, 2023, 44(11):230-237.
LIU X D, ZHANG Y C, ZHU S J, et al.Optimization of extraction process of polysaccharides from Hovenia dulcis fruit pedicels and its antioxidant activity[J].Science and Technology of Food Industry, 2023, 44(11):230-237.
[13] WORLD HEALTH ORGANIZATION.Global status report on alcohol and health 2018[R].World Health Organization Publications:Geneva, Switzerland, 2018, 38-60.
[14] YANG B, WEI X Y, LUO Y X, et al.Hypoglycemic effect of low-sugar juice derived from Hovenia dulcis on type Ⅰ diabetes mellitus rats[J].Journal of the Science of Food and Agriculture, 2021, 101(11):4818-4828.
[15] 邵仕娟, 王浩, 史雯馨, 等.基于代谢组学探究葛根素对慢性酒精性肝损伤小鼠的保护作用[J].食品工业科技, 2024, 45(16):25-35.
SHAO S J, WANG H, SHI W X, et al.Protective effect of puerarin on chronic alcoholic liver injury in mice based on metabolomics[J].Science and Technology of Food Industry, 2024, 45(16):25-35.
[16] 李芳芳, 张蕊萌, 丛贺, 等.榆干离褶伞溶栓酶对酒精诱导大鼠肝损伤的保护作用[J].食品科学, 2021, 42(17):121-126.
LI F F, ZHANG R M, CONG H, et al.Protective effects of fibrinolytic enzyme from Lyophyllum ulmarium on alcohol-induced liver injury in rats[J].Food Science, 2021, 42(17):121-126.
[17] ZHANG W L, ZHONG W, SUN Q, et al.Hepatic overproduction of 13-HODE due to ALOX15 upregulation contributes to alcohol-induced liver injury in mice[J].Scientific Reports, 2017, 7(1):8976.
[18] MENG X, TANG G Y, ZHAO C N, et al.Hepatoprotective effects of Hovenia dulcis seeds against alcoholic liver injury and related mechanisms investigated via network pharmacology[J].World Journal of Gastroenterology, 2020, 26(24):3432-3446.
[19] NIIYA M, SHIMATO Y, OHNO T, et al.Effects of Hovenia dulcis fruit and peduncle extract on alcohol metabolism[J].Journal of Ethnopharmacology, 2024, 321:117541.
[20] 李嘉鑫, 于嘉祥, 吕雪辉, 等.基于“土壅木郁” 理论探讨益糖康调控FXR对T2DM大鼠肝糖原合成的影响[J].中华中医药杂志, 2023, 38(5):2424-2429.
LI J X, YU J X, LYU X H, et al.Discussion on the effects of Yitangkang on hepatic glycogen synthesis in T2DM rats by regulating FXR based on the theory of ‘earth stagnation and wood depression’[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2023, 38(5):2424-2429.
[21] PETERSEN M C, VATNER D F, SHULMAN G I.Regulation of hepatic glucose metabolism in health and disease[J].Nature Reviews.Endocrinology, 2017, 13(10):572-587.
[22] MA Y, LIU G, TANG M Y, et al.Epigallocatechin gallate can protect mice from acute stress induced by LPS while stabilizing gut microbes and serum metabolites levels[J].Frontiers in Immunology, 2021, 12:640305.
[23] LIM S J, KIM M, RANDY A, et al.Effects of Hovenia dulcis Thunb.extract and methyl vanillate on atopic dermatitis-like skin lesions and TNF-α/IFN-γ-induced chemokines production in HaCaT cells[J].Journal of Pharmacy and Pharmacology, 2016, 68(11):1465-1479.
[24] 李楠, 赵雪, 阿娜丽, 等.胆汁酸在酒精性肝病中的作用研究进展[J].实用医学杂志, 2024, 40(15):2187-2193.
LI N, ZHAO X, ANARI, et al.Research progress on the role of bile acids in alcoholic liver disease[J].Journal of Practical Medicine, 2024, 40(15):2187-2193.
[25] MANLEY S, DING W X.Role of farnesoid X receptor and bile acids in alcoholic liver disease[J].Acta Pharmaceutica Sinica.B, 2015, 5(2):158-167.
[26] CHEN S S, ZONG G, WU Q Q, et al.Associations of plasma glycerophospholipid profile with modifiable lifestyles and incident diabetes in middle-aged and older Chinese[J].Diabetologia, 2022, 65(2):315-328.
[27] KENNELLY J P, VAN DER VEEN J N, NELSON R C, et al.Intestinal de novo phosphatidylcholine synthesis is required for dietary lipid absorption and metabolic homeostasis[J].Journal of Lipid Research, 2018, 59(9):1695-1708.
[28] VASAN S K, NOORDAM R, GOWRI M S, et al.The proposed systemic thermogenic metabolites succinate and 12, 13-diHOME are inversely associated with adiposity and related metabolic traits:Evidence from a large human cross-sectional study[J].Diabetologia, 2019, 62(11):2079-2087.
[29] NUNES D O, MARQUES V B, ALMENARA C C P, et al.Linoleic acid reduces vascular reactivity and improves the vascular dysfunction of the small mesentery in hypertension[J].The Journal of Nutritional Biochemistry, 2018, 62:18-27.