糖尿病是一种以高血糖为主要标志的具有糖、脂肪及蛋白质代谢紊乱特征的慢性代谢性疾病,临床特征为典型的“三多一少”即多饮、多食、多尿、体重减少,是全球性最为严重的公共卫生问题之一[1]。根据《柳叶刀》与全球糖尿病地图第10版最新数据表明,2021年全球有5.29亿糖尿病患者,其中我国患者数量(约1.4亿人)排名全球第一,情况不容乐观[2-3]。糖尿病无法完全治愈,患者主要通过化学合成类药物来稳定血糖水平,目前市面上的降血糖药物包括消化酶抑制剂、磺脲类、双胍类等,这些药物不仅无法有效地控制糖尿病并发症,长期服用还易引起肝功能损伤、肠胃胀气胀痛及耐药性增强等问题[4]。随着人们生活水平的不断提高,对健康问题的关注度也逐步上涨。相比于化学药物,从天然物质中提取的降血糖成分不仅无毒副作用,种类繁多,且具有多靶点、多途径、多向性的药理特点,可降低并发症发生的概率,是日常保健、调理的良好手段[5]。目前,从植物中提取得到的降糖活性成分包括多糖类、皂苷类、黄酮类、活性肽类等,这些天然活性物质在抑制淀粉消化酶及调节血糖水平等方面均表现出显著的作用,其降糖应用潜力较大[6-7]。
海红米是我国特有的在盐碱地区培育出来的一种耐盐碱水稻,富含多种营养物质,具有良好的抗氧化、抗炎和免疫调节等多种促进人体健康的功效[8-9]。海红米种皮中丰富的花色苷是一种类黄酮物质,在调节血糖方面有显著的优势,但因其不稳定性而在食品与药物领域没有得到广泛的应用[10-11]。目前提高花色苷稳定性的研究方法包括以蛋白质、抗氧化剂、辅色剂、金属离子等为载体进行相互作用,其中,小分子肽作为蛋白质水解或合成的产物,更易暴露与多酚的相互作用位点[12]。研究表明,从牡蛎中提取的活性肽被认为具有清除自由基[13]、改善男性功能[14]、抗骨骼肌萎缩[15]等作用,在代替降糖剂方面也表现出优异的潜力[16]。
牡蛎肽和花色苷是2种具有良好降糖活性的天然功能因子,尽管国内外已开发出不少牡蛎肽和花色苷的产品,但关于它们复配应用的研究较少,且两者均存在不稳定性的问题。本研究将挖掘牡蛎肽与花色苷复合应用的潜力,研发一种新型的牡蛎肽-花色苷复合饮料,探究其最佳制备工艺及降血糖作用,为降糖功能性饮料的研发提供新思路。
1 材料与方法
1.1 原材料及试剂
海红米,广东省湛江市遂溪县建新镇苏二村;新鲜牡蛎肉,广东省湛江市霞山水产市场;α-葡萄糖苷酶(70万 U/mL)、α-淀粉酶(猪胰腺,5 U/mg)、可溶性淀粉、对硝基苯-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside, p-NPG)、PBS(0.1 mol/L,pH=6.8),上海源叶生物科技有限公司;阿卡波糖、3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)试剂,北京索莱宝科技有限公司;动物水解蛋白酶,广西庞博生物科技有限公司;果胶、羧甲基纤维素钠(carboxymethyl cellulose-Na, CMC-Na)、柠檬酸、罗汉果粉、甜菊糖苷,晟发生物科技有限公司;无特定病原体(specific pathogen free, SPF)级辐照饲料、D12492型(60% fat)高脂饲料,小黍有泰(北京)生物科技有限公司;D-无水葡萄糖、链脲佐菌素(streptozocin, STZ),上海麦克林生化科技股份有限公司;10%多聚甲醛通用型组织固定液,兰杰柯科技有限公司;丙二醛(malondialdehyde, MDA)、糖原(glycogen, GLY)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)、黄嘌呤氧化酶(xanthine oxidase, XOD)试剂盒,南京建成生物工程研究所;小鼠二肽基肽酶4(dipeptidyl peptidase-IV, DPP-IV)、小鼠胰高血糖素样肽1(glucagon-like peptide-1, GLP-1)、小鼠胰岛素(insulin, INS)试剂盒,江苏酶免实业有限公司;盐酸、冰醋酸、无水乙醇均为分析纯。
1.2 仪器与设备
ATY 124电子天平,日本岛津公司;HH-S4数显恒温水浴锅,金坛市朗博仪器制造有限公司;PHS-3C pH计,上海雷磁-上海仪电科学仪器有限公司;Varioskan Flash全自动酶标仪,美国Thermo公司;N-4000旋蒸浓缩系统,东京理化器械公司;KQ-500DB数控超声仪,昆山市超声仪器有限公司;GM-0.33A隔膜真空泵过滤器,天津市津腾实验设备有限公司;5810R高速台式冷冻离心机,美国Eppendorf公司;G-425-2血糖仪与血糖试纸,爱奥乐医疗器械有限公司;XW-80A旋涡混合器,苏州利鸿普贸易经营有限公司;Forma370培养恒温箱,美国Thermo公司。
1.3 复合饮料的工艺优化
1.3.1 海红米花色苷的制备
海红米种皮→分选、清除杂质→粉碎→超声醇提→离心过滤→浓缩→海红米花色苷。
操作要点:海红米花色苷的制备参考课题组前期研究[17]。海红米种皮用蒸馏水洗净,晾干后粉碎,过60目筛,得到海红米种皮粉末。在85%乙醇(体积分数,pH=0.75),料液比为1∶15(g∶mL)的避光条件下,采用超声辅助法在45 ℃的温度下浸提30 min,获得海红米提取液。将提取液在3 000 r/min条件下离心15 min,经真空抽滤和减压浓缩后,得到海红米花色苷浓缩液,置于4 ℃保存备用。
1.3.2 牡蛎肽的制备
牡蛎肉→分选、清除黏膜→匀浆→酶解→脱腥→离心过滤→浓缩→牡蛎肽。
操作要点:牡蛎肽的制备参考柏昌旺[18]的方法并略做修改。新鲜牡蛎肉洗净裙边黑色黏膜部分后,加水(1∶3.9,g∶mL)匀浆,按3 300 U/g加入动物水解蛋白酶并在45 ℃酶解3 h。将酶解液放入沸水中灭酶处理10 min后冷却至室温,加入4 g/L罗汉果粉搅拌脱腥。后经8 000 r/min离心15 min,过滤取上清液。通过减压浓缩得牡蛎肽原浆,4 ℃保存备用。
1.3.3 单因素试验
确定牡蛎肽与甜菊糖苷的添加量为分别为1%与0.08%(质量分数,下同),在花色苷溶液添加量分别为0.6%~1.4%的条件下进行单因素试验,由评定小组进行感官评定。
确定花色苷与甜菊糖苷的添加量为分别为1%与0.08%,在牡蛎肽添加量分别为1%~3%的条件下进行单因素试验,由评定小组进行感官评定。
确定花色苷与牡蛎肽的添加量为分别0.8%与1%,在甜菊糖苷添加量分别为0.04%~0.12%的条件下进行单因素试验,由评定小组进行感官评定。
对制备好的复合饮料进行感官评定。评审小组成员共20人,男女比例相等。所选人群各项感知能力均正常,无吸烟酗酒、色盲色弱等问题,由评审小组对复合饮料的组织状态、色泽、气味和滋味4个指标进行感官评价。评价次数3次,分值取平均值。
表1 感官评分标准
Table 1 Sensory scoring criteria

项目评分标准分值组织状态(20分)质地均匀,无沉淀与分层14~20质地均匀,有少量沉淀分层7~13质地不匀,沉淀与分层明显<7色泽(20分)橘红色,色泽清明透亮14~20淡橘色,色泽清明7~13偏灰褐色,光泽暗淡<7气味(30分)无糊味腥味21~30腥味糊味较淡11~20有较重腥味糊味或其他异味<11滋味(30分)口感细腻,酸甜度协调,无后味21~30口感柔和,酸甜度偏高或低,稍有后味11~20口感粗糙,腥味后味较重<11
1.3.4 正交试验
基于单因素试验结果,取影响感官评定最大的3个因素:牡蛎肽、海红米花色苷和甜菊糖苷添加量,每个因素设计3个水平按照L9(34)正交表进行试验,确定牡蛎肽-花色苷新型复合饮料的最佳制备工艺。
1.3.5 稳定剂实验
以CMC-Na和果胶为稳定剂,分别选取0、0.05%、0.1%、0.15%、0.2%、0.25%六个水平的CMC-Na与0、0.05%、0.1%、0.15%、0.2%、0.25%六个水平的果胶,在3 000 r/min的条件下离心10 min,在660 nm处测定离心前后的吸光度值,以稳定率为标准,进行单因素试验,根据实验结果各选取三个水平进行L9(34)正交试验,考察添加稳定剂对复合饮料稳定性的影响。公式如下(1)。
稳定率![]()
(1)
式中:A1、A2分别为离心前、后的吸光度值。
1.3.6 复合饮料的制备
原辅料调配→稳定剂→均质→巴氏杀菌→无菌灌装→感官、贮藏稳定性、理化评定。
1.3.7 复合饮料贮藏稳定性评定
设置常温(25 ℃)和低温(4 ℃)两个水平。将饮料做好标记后,分别置于不同环境下,在第0、1、3、8天取部分在3 000 r/min的条件下离心10 min,660 nm处测定离心前后的吸光度值,按公式(2)测定复合饮料的变化率,评价其贮藏稳定性。
变化率![]()
(2)
式中:A1、A2分别为离心前、后的吸光度值。
1.3.8 复合饮料体外降糖作用
1.3.8.1 α-葡萄糖苷酶抑制作用
采用4-硝基苯基β-D-葡萄糖醛酸法测定复合饮料对α-葡萄糖苷酶的抑制作用[19]。准确吸取110 μL PBS于96孔板中,分别将1.80、2.25、2.70、3.15、3.60 mg/mL的样品溶液10 μL与等体积的α-葡萄糖苷酶(28 U/mL)溶液混合均匀,在37 ℃下孵育 10 min,后加入20 μL p-NPG底物(10 mmol/L),在37 ℃继续反应20 min,最后以80 μL Na2CO3溶液(0.1 mol/L)终止反应,于405 nm处测定吸光度值。实验设置样品组、样品空白组、对照组、空白组,以阿卡波糖作为阳性对照,重复上述试验操作并按公式(3)计算复合饮料对α-葡萄糖苷酶的抑制率。
酶抑制率![]()
(3)
式中:A1、A2、A3与A4分别为样品组,样品空白组,对照组与空白组的吸光度值。
1.3.8.2 α-淀粉酶抑制作用
采用二硝基水杨酸法测定复合饮料对α-淀粉酶的抑制作用[20]。吸取1.80、2.25、2.34、2.70、3.06 mg/mL的样品溶液100 μL与相同体积的α-淀粉酶溶液(1 U/mL)于10 mL离心管中混合均匀,在37 ℃水浴中预反应10 min。加入1%可溶性淀粉100 μL,37 ℃水浴继续反应20 min后,吸入500 μL DNS试剂,在沸水浴中10 min进行显色反应。冰浴冷却,加入蒸馏水终止反应,并在540 nm处检测吸光度值。以阿卡波糖作为阳性对照,重复上述试验操作。根据公式(3)计算复合饮料对α-淀粉酶的抑制率。
1.3.9 复合饮料微生物指标测定
菌落总数按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法测定;大肠埃希氏菌群按照GB 4789.38—2012《食品安全国家标准 食品微生物学检验 大肠埃希氏菌计数》中的方法测定。
1.3.10 复合饮料体内降血糖作用
1.3.10.1 Ⅱ型糖尿病小鼠造模及分组
32只SPF级健康4周龄雄性昆明小鼠(体质量23~25 g)并随机分为4组,每组8只,在动物房(温度21~25 ℃,湿度45%~65%)适应性暂养1周,每天更换垫料,房内昼夜照明时间12 h/12 h,进食进水自由。1周后,打乱并随机选取8只小鼠作为空白组,喂养普通饲料,剩余24只小鼠作为模型组,喂养D12492型高脂饲料,持续4周后,模型组小鼠禁食不禁水12 h,进行Ⅱ型糖尿病(type 2 diabetes mellitus mice, T2DM)小鼠模型建立。用预冷的0.1 mol/L、pH=4.5柠檬酸缓冲溶液配制10 mg/mL STZ注射液,现配现用,按100 mg/kg于小鼠腹腔处注射,30 min内注射完毕。正常组注射相同剂量的空白缓冲液。观察小鼠状态,并于3 d后测量所有小鼠尾部空腹血糖(fasting blood glucose,FBG)。若FBG>11.1 mmol/L即视为T2DM小鼠造模成功。按下表对小鼠进行灌胃干预,灌胃频率为1次/d,每日到动物房观察小鼠生长情况与生理活动。整个实验已获国家动物伦理委员会和广东海洋大学实验动物伦理委员会批准。实验单位使用许可证编号:SYXK(粤)2019-0204;许可证号:SYXK(粤)2020-0051;动物伦理审查编号:GDOU-LAE-2023-034。
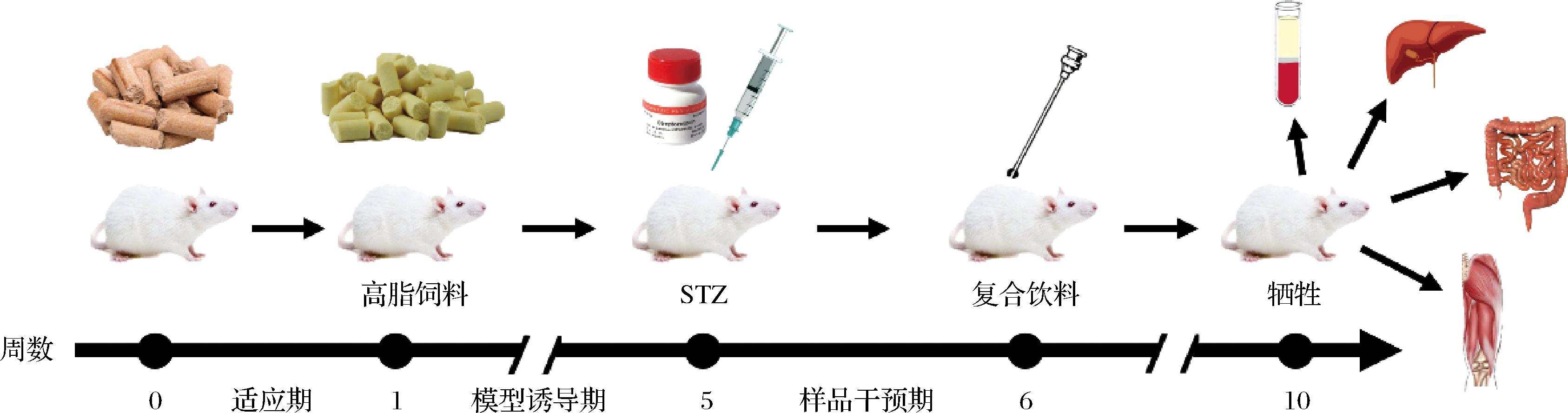
图1 小鼠实验流程
Fig.1 The experiment process of mice
表2 小鼠分组及干预情况
Table 2 Grouping and administration of mice
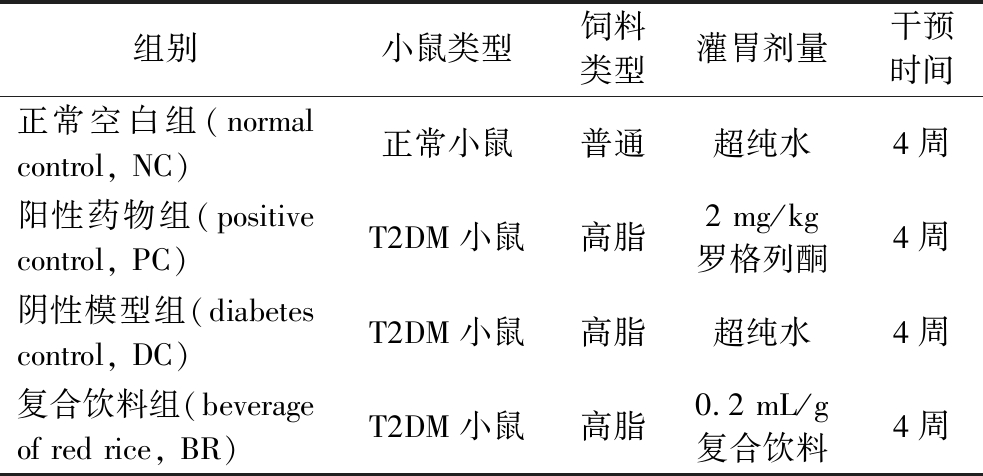
组别小鼠类型饲料类型灌胃剂量干预时间正常空白组(normal control, NC)正常小鼠普通超纯水4周阳性药物组(positive control, PC)T2DM小鼠高脂2 mg/kg罗格列酮4周阴性模型组(diabetes control, DC)T2DM小鼠高脂超纯水4周复合饮料组(beverage of red rice, BR)T2DM小鼠高脂0.2 mL/g复合饮料4周
1.3.10.2 空腹血糖与口服葡萄糖耐量试验
测定前1晚所有小鼠进水自由,空腹12 h后,采用血糖仪与配套血糖试纸测定并整理其FBG变化,1周1次。末次干预后,禁食不禁水12 h,进行口服葡萄糖耐量(oral glucose tolerance test, OGTT)实验。灌以40%(体积分数)葡萄糖溶液(2.0 g/kg b.w.),2 h内每隔0.5 h分别测定小鼠FBG,并绘制OGTT曲线。
1.3.10.3 动物牺牲处理
实验结束,所有小鼠进水自由,禁食处理至少12 h,眼球取血法采血后通过颈椎脱位对其实施安乐死,全血静置30 min后在3 000 r/min条件下离心20 min,仔细采集上清液。用消毒后的专业手术刀小心摘取肝脏、回肠、结肠和肌肉组织,用生理盐水清洗干净后放入液氮速冻,同血清一起放入-80 ℃冰箱备测。另分装部分肝脏、肾脏与胰腺组织,浸泡于10%(质量分数)多聚甲醛溶液中,进行苏木精-伊红(hematoxylin-eosin staining, HE)染色实验。
1.3.10.4 血清与肠组织中胰岛素与肠促胰素相关指标分析
提前取出待测血清、回肠与结肠组织置于冰上解冻,小鼠组织按说明书操作加入生理盐水匀浆离心后获得上清液进行试剂盒检测。血清中INS与GLP-1、血清与肠组织中的DPP-IV活性采用江苏酶免ELISA试剂盒检测,具体步骤遵照测试盒说明书的指导。
1.3.10.5 肝脏、肌肉中糖异生和氧化指标分析
提前取出待测肝脏与肌肉组织置于冰上解冻,按说明书操作加入碱液试剂获组织水解液,进行糖原含量测定。另取部分肝脏加入生理盐水匀浆离心,取上清液进行氧化指标的测定。肝脏与肌肉组织中的GLY含量,肝脏中SOD、GSH-PX、XOD活力以及MDA含量均采用南京建成试剂盒检测,具体步骤遵照测试盒说明书的指导。
1.3.10.6 组织损伤的修复作用分析
将固定好的小鼠肝脏、肾脏和胰腺组织加工成厚度小于0.5 cm的小块,并用梯度乙醇脱水,使组织透明。立即嵌入熔化的石蜡中进行包埋,硬化后使用切片机切下薄片(4 μm)在热水中烫平转移到载玻片干燥处理。使用苏木精和伊红染料对组织的细胞核、细胞质及细胞外基质染色,在400×显微镜下观察肝脏、肾脏和胰腺组织的病理学变化。
1.4 统计分析
所有试验数据经Microsoft Excel 2021初步处理后,用Origin 2017软件处理及生成图像。所有数据均以“平均值±标准差”呈现,并用SPSS 26进行单因素方差分析(One-way ANOVA),差异显著性采用Duncan分析并进行多重比较,P<0.05表示组间差异显著。
2 结果与分析
2.1 单因素试验分析
经1.3.1节提取出的海红米花色苷含量为1.66 mg/mL,提取率约为34.60%;经1.3.2节提取出的牡蛎肽经证实得率可达58.53%,主要为分子质量在1 000 Da以下的小分子多肽,占比84.01%[18]。由表3可知,当牡蛎肽添加量为1.0%时,感官评分最高,为85.2分,后随着添加量增加评分呈现下降趋势,可能是由于牡蛎肽原浆伴随一定的腥糊味,过多添加使饮料中的后味难以协调,感官评分随之减小;当海红米花色苷添加量为0.6%时,感官评分最高,为84.1分,花色苷pH值较低,继续增加可能使得饮料中酸甜度失衡,有苦涩感;当甜菊糖苷添加量为0.08%时,感官评分达到90.9分,说明适当加入甜味剂可更好地中和花色苷的酸度,优化口感。基于单因素试验结果,在每一因素中选择评分较高的三个水平进行正交试验。
表3 单因素试验结果设计表
Table 3 The design table of single factor experimental results
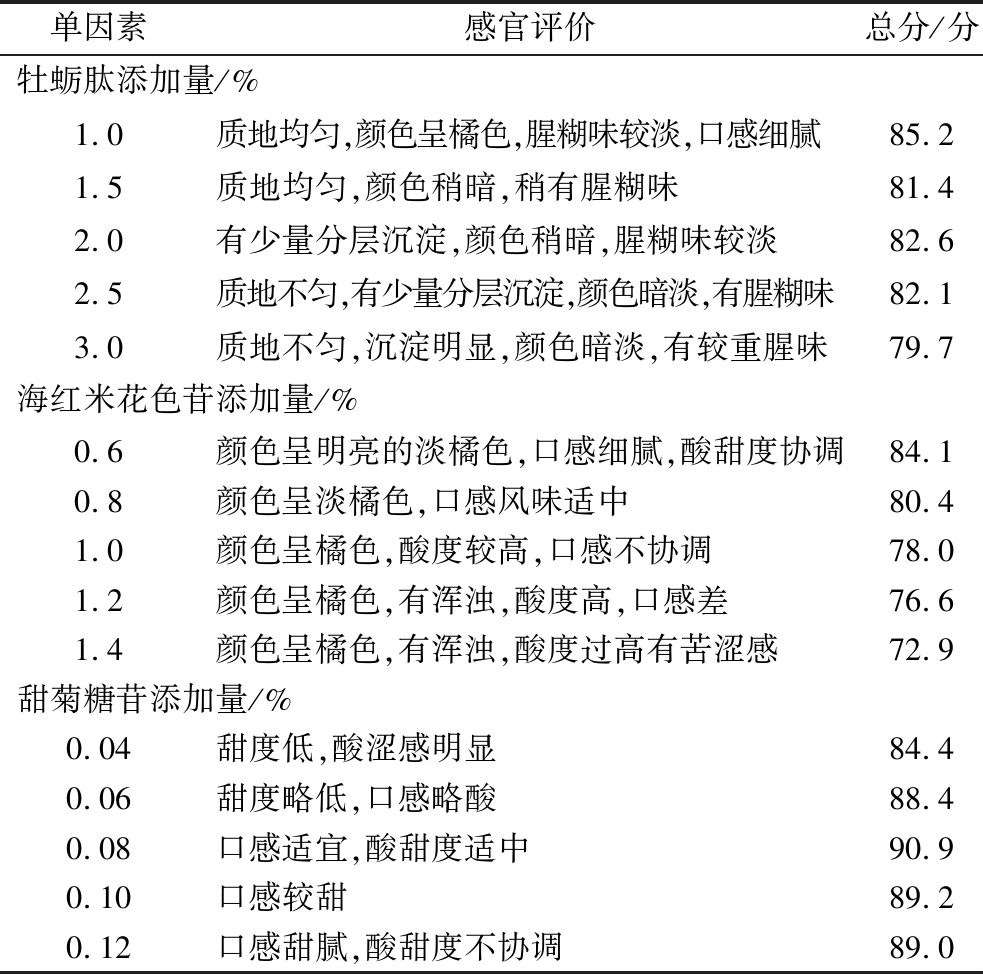
单因素感官评价总分/分牡蛎肽添加量/%1.0质地均匀,颜色呈橘色,腥糊味较淡,口感细腻85.21.5质地均匀,颜色稍暗,稍有腥糊味81.42.0有少量分层沉淀,颜色稍暗,腥糊味较淡82.62.5质地不匀,有少量分层沉淀,颜色暗淡,有腥糊味82.13.0质地不匀,沉淀明显,颜色暗淡,有较重腥味79.7海红米花色苷添加量/%0.6颜色呈明亮的淡橘色,口感细腻,酸甜度协调84.10.8颜色呈淡橘色,口感风味适中80.41.0颜色呈橘色,酸度较高,口感不协调78.01.2颜色呈橘色,有浑浊,酸度高,口感差76.61.4颜色呈橘色,有浑浊,酸度过高有苦涩感72.9甜菊糖苷添加量/%0.04甜度低,酸涩感明显84.40.06甜度略低,口感略酸88.40.08口感适宜,酸甜度适中90.90.10口感较甜89.20.12口感甜腻,酸甜度不协调89.0
2.2 正交试验分析
由表4结果可以得出,影响感官评价的因素主次顺序为牡蛎肽>花色苷>甜菊糖苷,复合饮料最佳配方组合为A3B2C2,即牡蛎肽含量为1%、花色苷为0.8%、甜菊糖苷为0.1%,对该组合进行验证,得感官评分为93.3,高于试验中的所有组合,进一步验证了该组合的优越性。此条件下制备的复合饮料整体呈淡橘色,色泽透亮,质地均匀,口感细腻,酸甜度协调无异味。
表4 正交试验结果设计表
Table 4 The design table of orthogonal test results
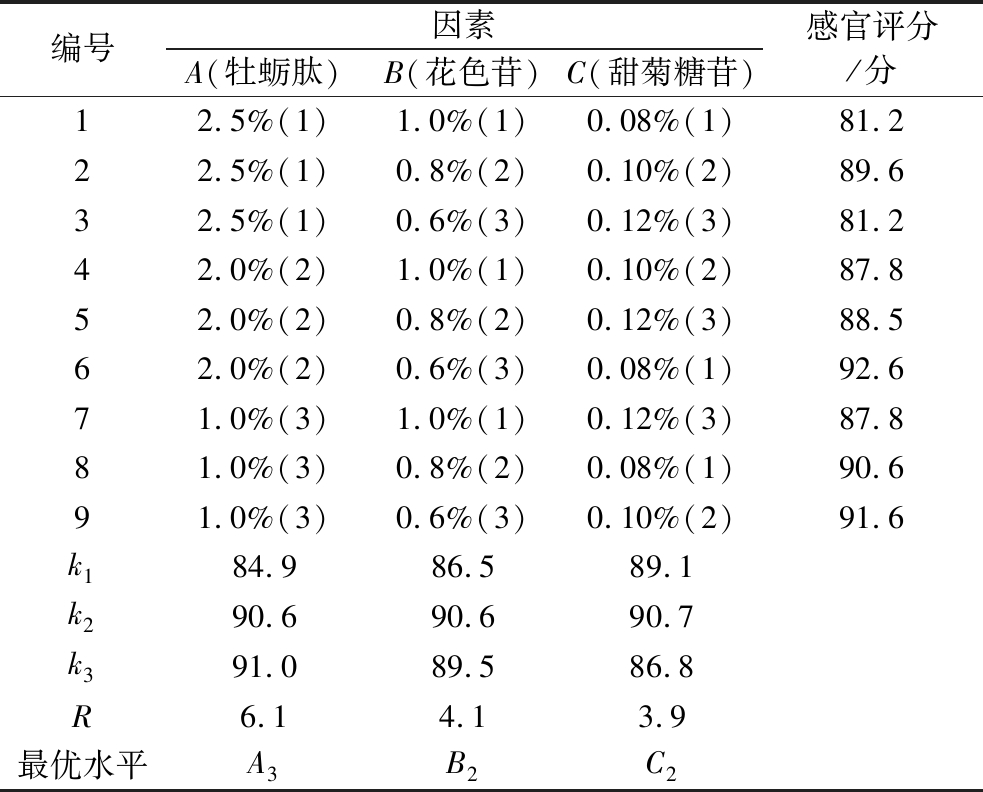
编号因素A(牡蛎肽)B(花色苷)C(甜菊糖苷)感官评分/分12.5%(1)1.0%(1)0.08%(1)81.222.5%(1)0.8%(2)0.10%(2)89.632.5%(1)0.6%(3)0.12%(3)81.242.0%(2)1.0%(1)0.10%(2)87.852.0%(2)0.8%(2)0.12%(3)88.562.0%(2)0.6%(3)0.08%(1)92.671.0%(3)1.0%(1)0.12%(3)87.881.0%(3)0.8%(2)0.08%(1)90.691.0%(3)0.6%(3)0.10%(2)91.6k184.986.589.1k290.690.690.7k391.089.586.8R6.14.13.9最优水平A3B2C2
2.3 稳定剂分析
图2-a显示,饮料的稳定性随CMC-Na添加量增多呈现先上升后下降的趋势,当添加量为0.15%时,稳定率最高为80.26%,显著高于其他添加量下的稳定率(P<0.05)。图2-b中稳定性整体趋势同图2-a,当果胶添加量为0.20%时,稳定率可达96.54%。以上结果表明,适当添加稳定剂可有效提高饮料的稳定性,增强黏度并优化口感。但过量加入不仅弱化饮料色泽,增加浑浊度,还会影响饮料的口感与品质。

a-CMC-Na添加量;b-果胶添加量
图2 CMC-Na和果胶添加量对复合饮料稳定性的影响
Fig.2 Effect of CMC-Na and pectin addition on the stability of composite beverage
注:不同字母表示经方差分析差异有统计学意义(P<0.05)(下图同)。
由表5可知,最优复合稳定剂组合为A1B2,即CMC-Na添加量为0.15%、果胶添加量为0.2%,此时稳定率为97.97%。
表5 稳定剂正交试验结果极差分析表
Table 5 The range analysis table of orthogonal experiments results of stabilizers
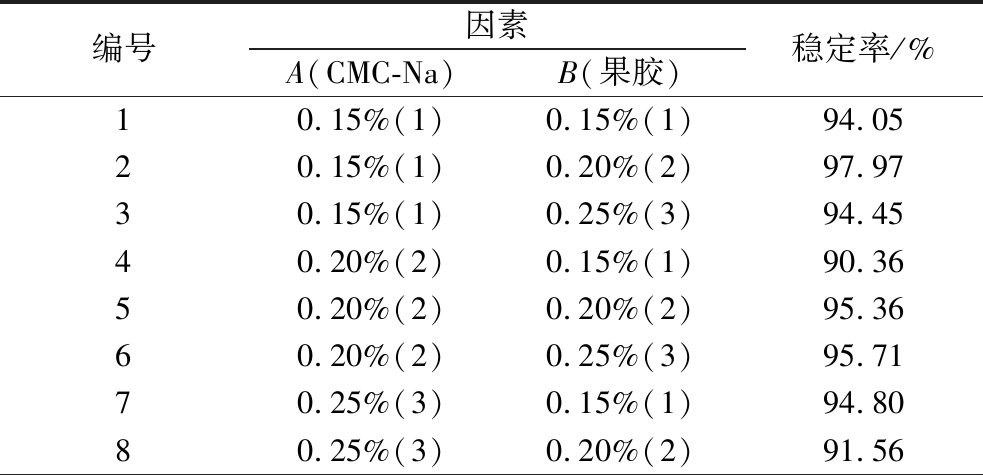
编号因素A(CMC-Na)B(果胶)稳定率/%10.15%(1)0.15%(1)94.0520.15%(1)0.20%(2)97.9730.15%(1)0.25%(3)94.4540.20%(2)0.15%(1)90.3650.20%(2)0.20%(2)95.3660.20%(2)0.25%(3)95.7170.25%(3)0.15%(1)94.8080.25%(3)0.20%(2)91.56
续表5
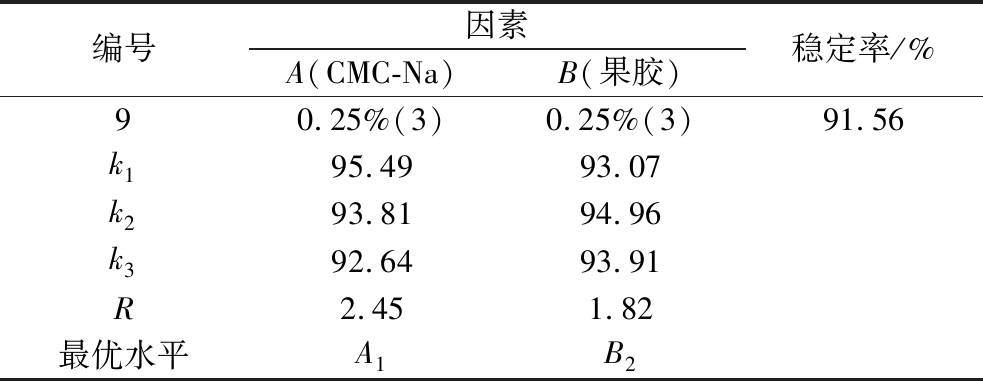
编号因素A(CMC-Na)B(果胶)稳定率/%90.25%(3)0.25%(3)91.56k195.4993.07k293.8194.96k392.6493.91R2.451.82最优水平A1B2
2.4 贮藏稳定性分析
由图3可知,随着贮藏时间的增加,复合饮料的变化率呈现明显增加的趋势。其中,常温25 ℃条件下贮藏的复合饮料在第1天变化率便达到8.49%,远高于低温4 ℃条件下的2.55%(P<0.05)。贮藏的8 d内,低温条件的变化率为11.02%,较常温条件下更低。低温可以减缓化学反应速率和抑制微生物生长,从而延缓复合饮料中成分的分解和变质。以上结果表明,牡蛎肽-花色苷新型复合饮料在低温条件下的稳定性更高,更适宜其储存。
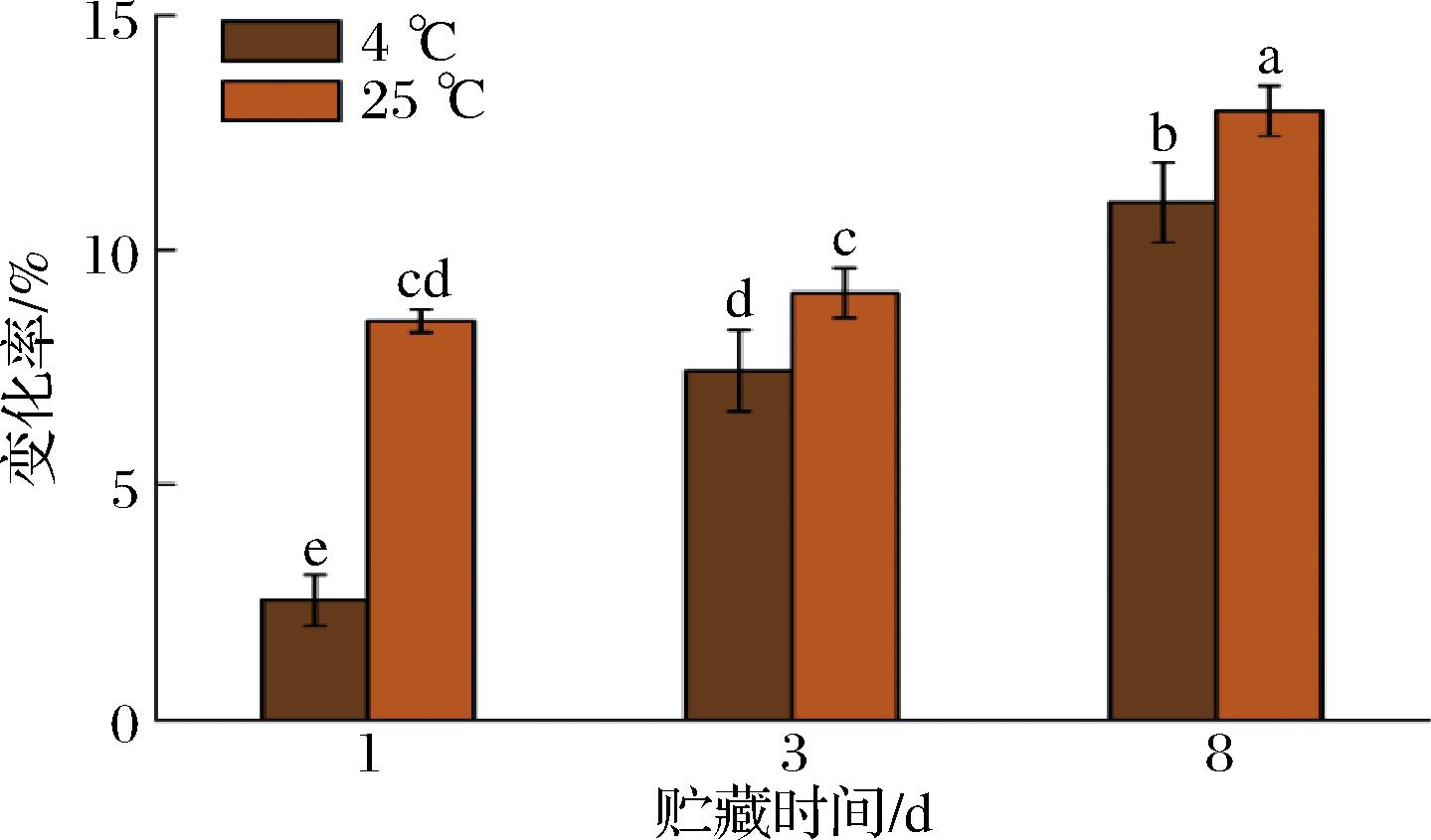
图3 贮藏条件对复合饮料稳定性的影响
Fig.3 Effect of storage conditions on the stability of composite beverage
2.5 体外降糖作用分析
由图4可知,海红米花色苷-牡蛎肽复合饮料对α-葡萄糖苷酶、α-淀粉酶均具有较强的抑制作用,且随着样品一定质量浓度的增加,其抑制能力增强,呈现一定的量效关系。当质量浓度在1.80~3.60 mg/mL时,复合饮料对α-葡萄糖苷酶的抑制率递增,最高达84.68%,其IC50值为2.50 mg/mL;当质量浓度1.80~3.06 mg/mL,复合饮料对α-淀粉酶的抑制率呈先上升后下降趋势,在质量浓度为2.70 mg/mL时抑制率达到最大值85.16%,其IC50值为0.10 mg/mL。当样品质量浓度继续增加至3.06 mg/mL,抑制率下降,可能是反应体系中过高质量浓度的抑制剂在底物周围形成黏度大的保护层,阻碍酶与底物接触,减缓了反应的进行[21]。

a-α-葡萄糖苷酶;b-α-淀粉酶
图4 复合饮料对α-葡萄糖苷酶、α-淀粉酶的抑制作用
Fig.4 α-glucosidase and α-amylase inhibitory effects of composite beverage
2.6 微生物指标分析
根据GB 7101—2022《食品安全国家标准 饮料》规定:每1 mL饮料中,菌落总数不得超过100 CFU/mL,大肠埃希氏菌群不得超过1 CFU/mL。经检测,牡蛎肽-花色苷复合饮料菌落总数为4 CFU/mL,大肠埃希氏菌群含量<1 CFU/mL,检测结果均符合国家限量标准。
2.7 体内降血糖作用分析
2.7.1 复合饮料对T2DM小鼠FBG与OGTT的改善作用
FBG的升高是T2DM的典型症状之一,OGTT可评价糖尿病小鼠的恢复情况。由图5-a可得,饲养4周,NC组小鼠FBG保持稳定并处于正常区间(7.2~8.4 mmol/L),而DC组小鼠的FBG显著高于NC组,4周后FBG值可达22.8 mmol/L。与DC组相比,加入复合饮料进行干预的小鼠FBG值显著下降(P<0.05),第4周已降至18.3 mmol/L。由图5-b可知,灌胃葡萄糖溶液后,DC组小鼠的FBG在120 min后仍居高不下,而BR组小鼠FBG在灌胃葡萄糖溶液期间均显著低于DC组(P<0.05)。以上结果说明海红米花色苷-牡蛎肽新型复合饮料能够有效的抑制血糖峰值的升高,提高糖尿病小鼠的葡萄糖耐量,缓解高血糖症状。
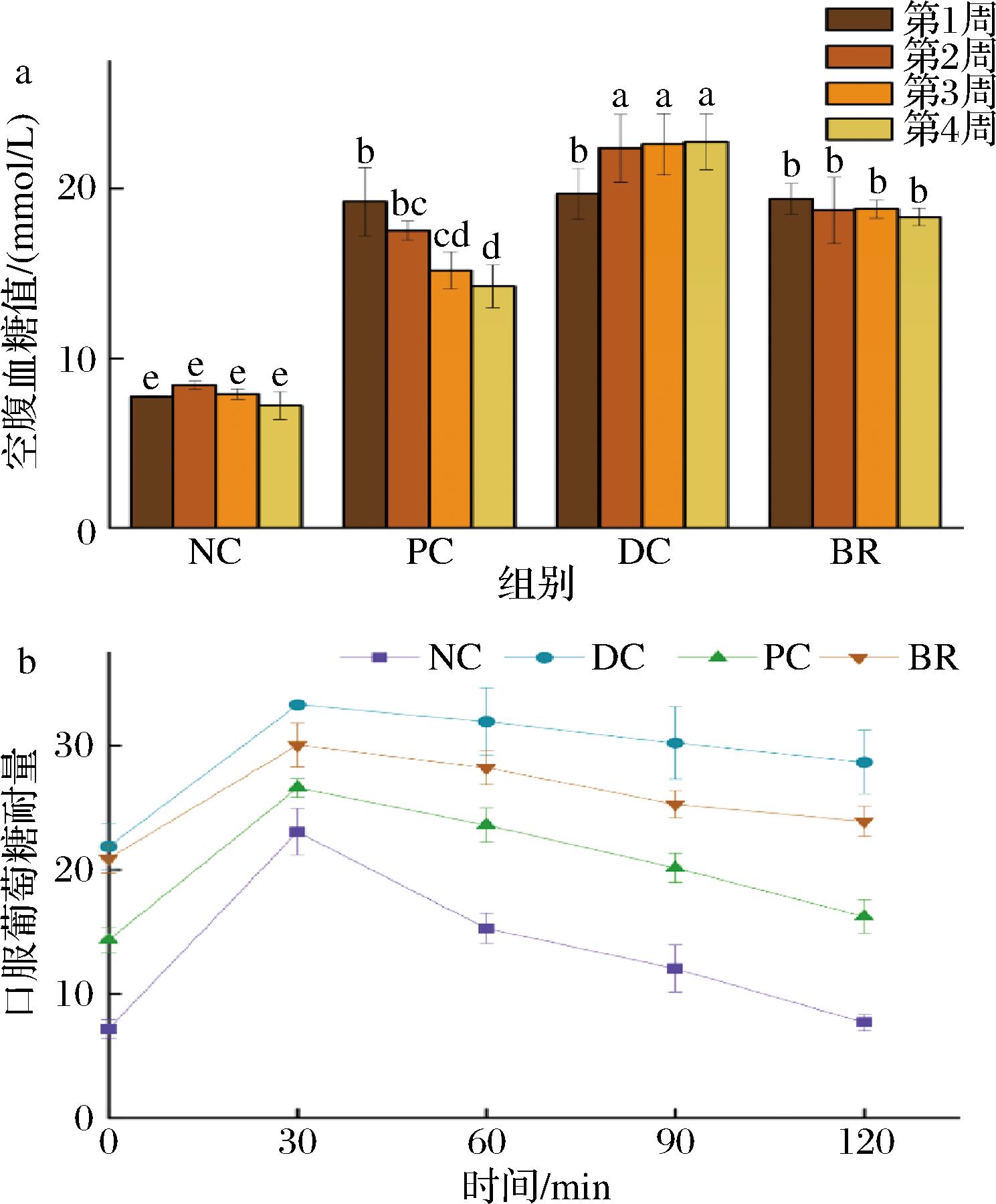
a-FBG;b-OGTT
图5 复合饮料对T2DM小鼠空腹血糖值及
口服葡萄糖耐量的改善作用
Fig.5 Improvement effect of composite beverage on FBG and OGTT in T2DM mice
2.7.2 复合饮料对T2DM小鼠血清、回肠与结肠中DPP-IV酶活性的调节作用
DPP-IV是一种多功能酶,以催化活性的可溶性形式存在于血浆和大多数细胞表面,通过抑制胰岛素分泌、加速胰岛β细胞凋亡,使血糖升高[22]。图6显示,BR组的T2DM小鼠的血清中(608.78 pg/mL)DPP-IV活性较回肠(551.67 pg/mL)与结肠(591.84 pg/mL)中高。DC组小鼠的DPP-IV活性显著高于其余组(P<0.05),进一步证明其高血糖水平。而与DC组相比,BR组血清、回肠与结肠中DPP-IV活性(238.75、82.20、39.03 pg/mL)分别显著降低了28.17%、12.97%与6.19%(P<0.05)。说明复合饮料可能通过有效降低T2DM小鼠的DPP-IV活性,进而促进GLP-1的分泌,达到降低血糖的作用[23]。

图6 复合饮料对血清、回肠与结肠中DPP-IV调节作用
Fig.6 The regulatory of composite beverage on DPP-IV in serum, ileum and colon of T2DM mice
2.7.3 复合饮料对T2DM小鼠血清INS与GLP-1含量的调节作用
GLP-1是一种能刺激胰岛素分泌的肠促胰岛素激素,是外周和神经系统中的重要信号,能够系统调控血糖水平,参与维持葡萄糖和能量稳态[23]。当人体摄入食物时,小肠中的GLP-1会经受DPP-IV的灭活,因此只有少量的GLP-1可以顺利离开肠道进入胰腺细胞,促进胰岛素分泌[24]。由图7-a和图7-b可得,与DC组(INS:28.93 mIU/L,GLP-1:2.44 pmol/L)相比,BR组小鼠血清中INS含量降低至25.94 mIU/L(P<0.05)。同时,其GLP-1含量增加至2.65 pmol/L(P<0.05),改善效果与PC组无显著差异。说明海红米花色苷-牡蛎肽新型复合饮料可在一定程度上促进T2DM小鼠GLP-1的分泌,保护其胰岛功能,使胰岛β细胞功能逐步恢复,缓解胰岛素抵抗症状,进而发挥降血糖作用。

a-胰岛素;b-胰高血糖素样肽-1
图7 复合饮料对T2DM小鼠血清中胰岛素与胰高血糖素样肽-1的调节作用
Fig.7 Regulatory effect of composite beverage on insulin and GLP-1 in the serum of T2DM mice
2.7.4 复合饮料对T2DM小鼠肝糖原、肌糖原合成困难的调节作用
肝脏和肌肉中糖原合成困难也是T2DM的表现之一,因此是评价糖尿病患者病症改善的重要指标。由图8所示,与NC组小鼠对比,DC组小鼠的肝、肌糖原含量显著降低2倍以上(P<0.05),而BR干预的T2DM小鼠,肝、肌糖原含量分别为6.84、0.41 mg/g,均显著高于DC组的4.80与0.28 mg/g(P<0.05)。可见复合饮料可能通过促进肝糖原和肌糖原合成,缓解体内糖原合成困难,以减少多余的血糖释放到外周组织,减轻因T2DM引起的糖代谢紊乱症状,维持机体葡萄糖稳态[25]。
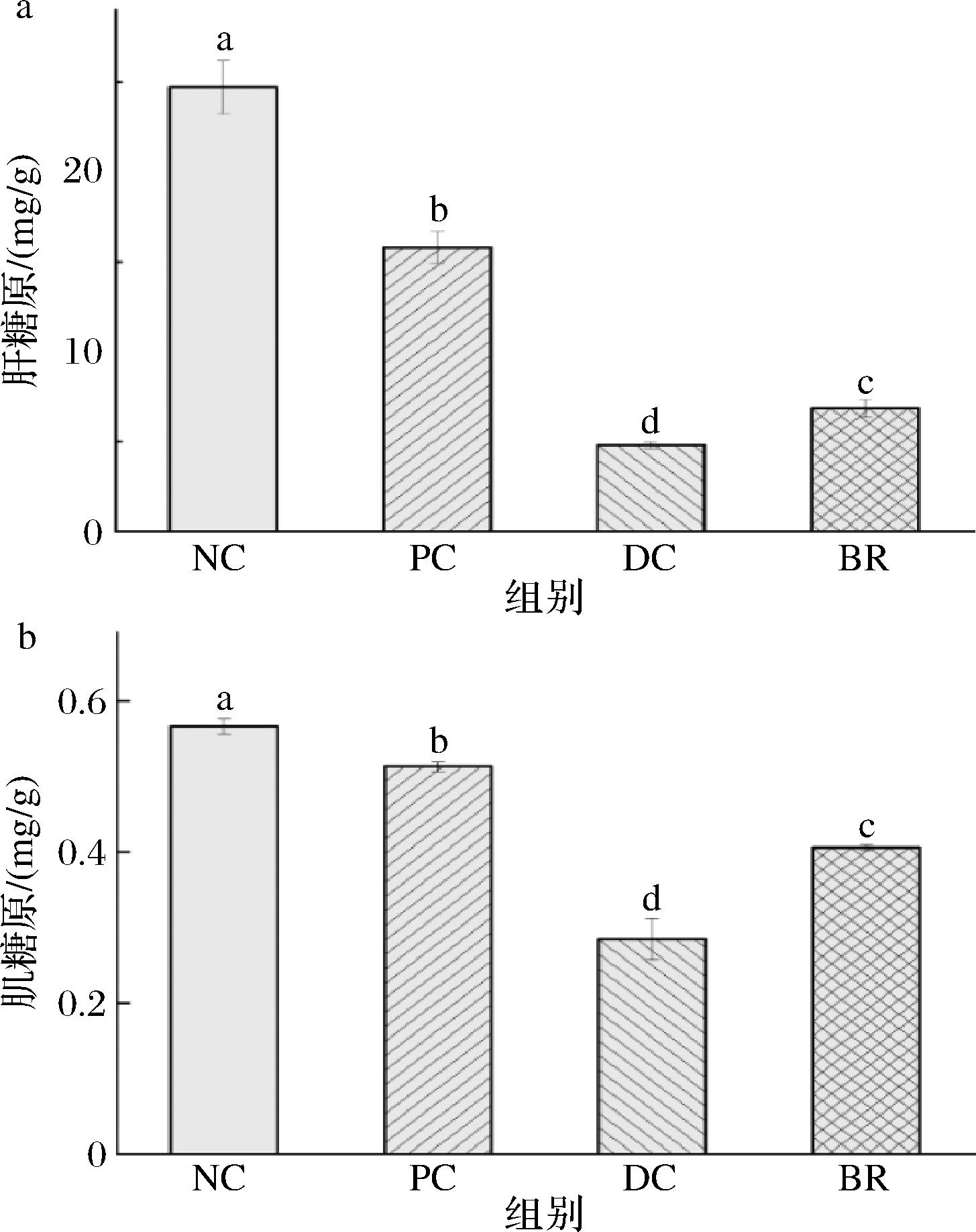
a-肝糖原;b-肌糖原
图8 复合饮料对T2DM小鼠肝糖原、肌糖原含量的影响
Fig.8 Effect of composite beverage on the content of liver glycogen and muscle glycogen in T2DM mice
2.7.5 复合饮料对T2DM小鼠肝脏中氧化指标的调节作用
研究表明,机体细胞内过高的氧化压力对于糖尿病的发展有重要的诱导作用,当血液和组织中的抗氧化酶含量少时,会产生大量的氧自由基与脂质过氧化物等,使机体出现氧化损伤[26]。由表6可知,在提示肝细胞损伤指标中,BR组小鼠肝脏中的XOD活力(29.44 U/g prot)和MDA含量(27.47 nmol/mg prot)显著低于DC组,GSH-PX活力(365.30 mol/L)显著高于DC组(P<0.05),SOD活力(17.83 U/mg prot)与PC组(18.63 U/mg prot)相当。以上结果表明,复合饮料可降低T2DM小鼠体内氧化压力,对其肝脏具有调节保护作用。
表6 复合饮料对T2DM糖尿病小鼠肝脏中氧化指标的影响
Table 6 Effect of composite beverage on oxidation index in the liver of T2DM mice
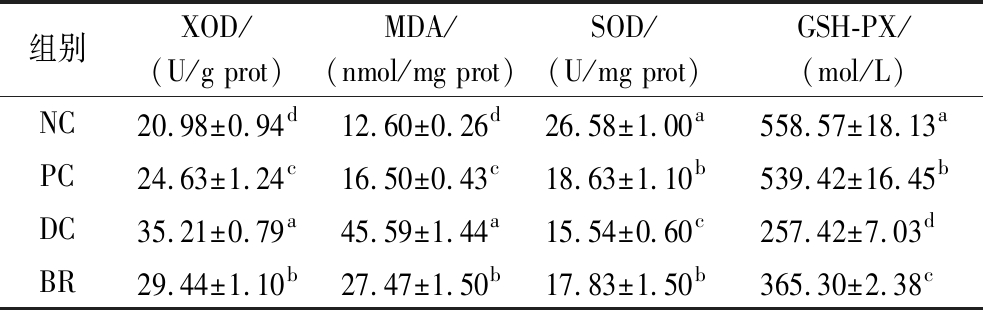
组别XOD/(U/g prot)MDA/(nmol/mg prot)SOD/(U/mg prot)GSH-PX/(mol/L)NC20.98±0.94d12.60±0.26d26.58±1.00a558.57±18.13aPC24.63±1.24c16.50±0.43c18.63±1.10b539.42±16.45bDC35.21±0.79a45.59±1.44a15.54±0.60c257.42±7.03dBR29.44±1.10b27.47±1.50b17.83±1.50b365.30±2.38c
注:同列不同字母表示经方差分析差异有统计学意义(P<0.05)。
2.7.6 T2DM小鼠组织病理学分析
图9-a~9-c分别反映了T2DM小鼠肝脏、肾脏与胰腺组织病理损伤情况。由图9-a可知,NC组肝细胞形态正常,排列有序;DC组肝细胞可见境界清晰的圆形空泡,似脂肪变,伴随着水分浓缩出现嗜酸小体,部分细胞已坏死,并出现小灶性炎症细胞浸润,表明DC组小鼠出现了肝脏氧化应激损伤。通过BR的干预,有效减少了肝脏炎症细胞数量,并减缓了细胞脂变。如图9-b所示,NC组小鼠肾小球形态正常,球囊腔清晰可见;DC组小鼠的间质血管充血,肾小管均质红染,出现嗜酸小体,以及大量慢性炎细胞浸润,BR组小鼠炎症、均质红染及球囊腔模糊等症状均得到了显著改善。由图9-c可知,NC组小鼠胰腺组织形态规则,排列紧密,而DC组出血明显,炎细胞浸润,小叶结构紊乱。BR能够调节腺小叶结构,缓解炎症情况。以上结果表明,海红米花色苷-牡蛎肽复合饮料可以一定程度上改善肝脏、肾脏以及胰腺的病理性损伤,效果接近PC组。
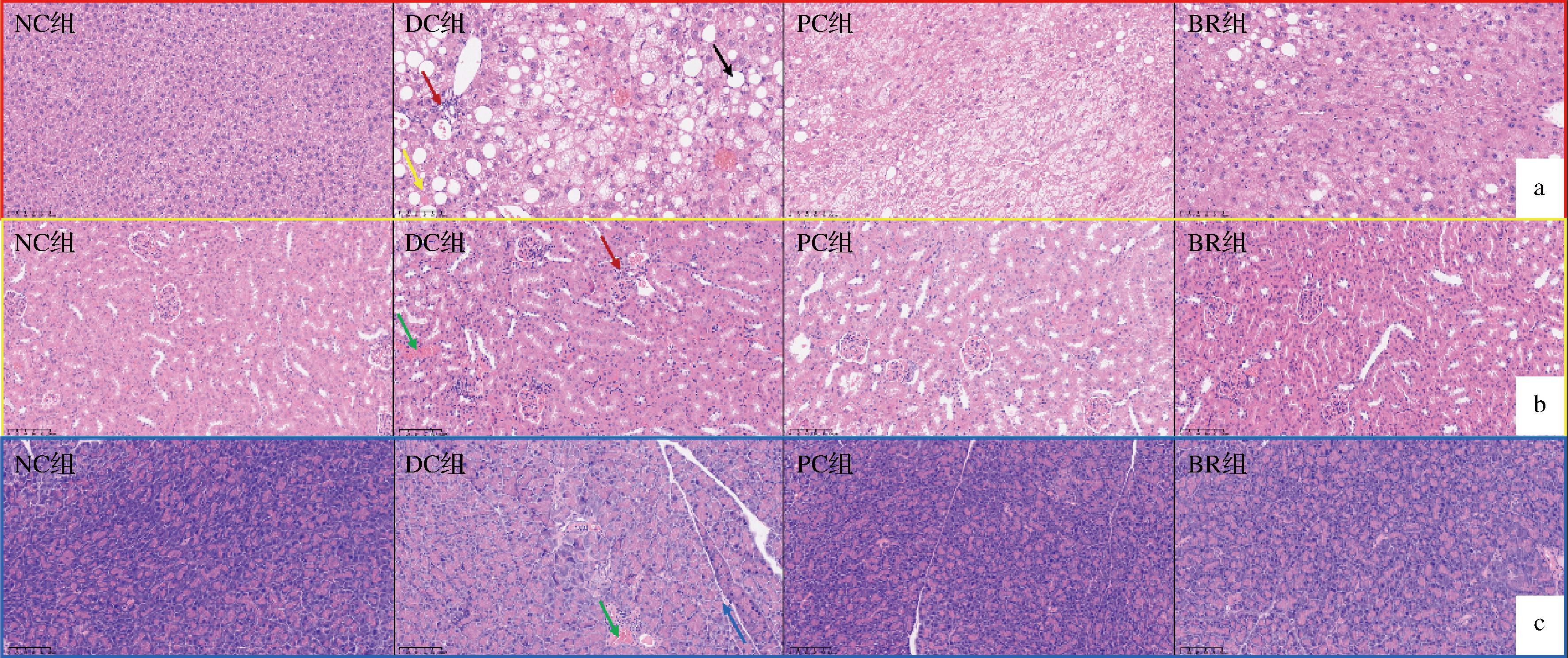
a-肝脏;b-肾脏;c-胰腺
图9 复合饮料对T2DM小鼠肝脏、肾脏、胰腺损伤的改善作用
Fig.9 Effect of composite beverage on liver, kidney and pancreas injury in T2DM mice
注:黄色箭头-嗜酸小体;黑色箭头-脂变;红色箭头-炎症细胞浸润;绿色箭头-均质红染;蓝色箭头-腺小叶结构紊乱。
综上所述,海红米花色苷-牡蛎肽新型复合饮料可显著降低T2DM小鼠空腹血糖值,改善葡萄糖耐量水平,呈现显著的降血糖效果,可能的机理包括:通过保护胰岛β细胞,增加组织细胞对胰岛素敏感性,以降低体内利用度低的胰岛素含量。在血清、回肠与结肠中,通过抑制DPP-IV的活性,促进GLP-1的分泌与肝、肌糖原的合成来调节糖代谢,维持葡萄糖稳态。提高肝脏抗氧化酶活性,减缓体内氧化压力,改善肝脏、肾脏以及胰腺的病理性损伤,对于肝脏脂肪空泡化、炎症细胞浸润,肾小管腔内均质红染、肾间质血管扩张充血,胰腺小叶结构紊乱等损伤问题有较好的改善作用。
3 结论
本文以牡蛎肽和天然海红米花色苷为原料,优化了海红米花色苷-牡蛎肽新型复合饮料的制备工艺,制备出的饮料呈淡橘色,色泽清亮,酸甜适中,无腥糊异味,此饮料宜在低温条件下贮藏,可以保持其品质和稳定性,且具有显著的α-葡萄糖苷酶和α-淀粉酶抑制作用。体内降血糖活性研究表明,此饮料可以通过抑制T2DM小鼠DPP-IV活性,促进GLP-1分泌,降低小鼠的血糖值并改善其糖耐量,促进糖原的合成以及减缓体内氧化压力以达到降低血糖的目的,此外,对于小鼠组织病理性损伤的恢复也具有显著的效果。本研究为功能性饮料的研发提供了新思路和可能性,推动了我国功能食品市场的特色发展。
[1] LA RÉDACTION. World Health Statistics 2016: monitoring health for the SDGs, sustainable development goals, WHO, Geneva(2016), ISBN 978 92 4 156526 4[R/L]. (2016-05-01)[2024-04-20].http://www.who.int/gho/publications/world_health_statistics/en.
[2] COLLABORATORS G 2 D.Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050:A systematic analysis for the Global Burden of Disease Study 2021[J].Lancet, 2023, 402(10397):203-234.
[3] MAGLIANO D J, BOYKO E J, IDF diabetes atlas 10th edition scientific committee.IDF diabetes atlas.In:IDF diabetes atlas 10th edition[J].International Diabetes Federation, 2022.
[4] TIAN J L, SI X, WANG Y H, et al.Bioactive flavonoids from Rubus corchorifolius inhibit α-glucosidase and α-amylase to improve postprandial hyperglycemia[J].Food Chemistry, 2021, 341:128149.
[5] ZHU H J, TIAN L, ZHANG L, et al.Preparation, characterization and antioxidant activity of polysaccharide from spent Lentinus edodes substrate[J].International Journal of Biological Macromolecules, 2018, 112:976-984.
[6] WU T, CHENG J H, ZHANG J X, et al.Hypoglycemic activity of self-assembled gellan gum-soybean isolate composite hydrogel-embedded active substance-saponin[J].Foods, 2022, 11(22):3729.
[7] ZHU X A, OUYANG W, LAN Y Q, et al.Anti-hyperglycemic and liver protective effects of flavonoids from Psidium guajava L.(guava) leaf in diabetic mice[J].Food Bioscience, 2020, 35:100574.
[8] WANG G, SONG B B, JIA X J, et al.Ceramides from sea red rice bran improve health indicators and increase stress resistance of Caenorhabditis elegans through insulin/IGF-1 signaling (IIS) pathway and JNK-1[J].Journal of Agricultural and Food Chemistry, 2022, 70(48):15080-15094.
[9] WANG G, JIA X J, SONG B B, et al.Extraction optimization, UHPLC-triple-TOF-MS/MS analysis and antioxidant activity of ceramides from sea red rice bran[J].Foods, 2022, 11(10):1399.
[10] OLADZADABBASABADI N, MOHAMMADI NAFCHI A, GHASEMLOU M, et al.Natural anthocyanins:Sources, extraction, characterization, and suitability for smart packaging[J].Food Packaging and Shelf Life, 2022, 33:100872.
[11] ECHEGARAY N, MUNEKATA P E S, GULL N P, et al.Recent advances in food products fortification with anthocyanins[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1553-1567.
N P, et al.Recent advances in food products fortification with anthocyanins[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1553-1567.
[12] DIAS R, BR S N F, PÉREZ-GREGORIO M, et al.A multi-spectroscopic study on the interaction of food polyphenols with a bioactive gluten peptide:From chemistry to biological implications[J].Food Chemistry, 2019, 299:125051.
S N F, PÉREZ-GREGORIO M, et al.A multi-spectroscopic study on the interaction of food polyphenols with a bioactive gluten peptide:From chemistry to biological implications[J].Food Chemistry, 2019, 299:125051.
[13] ULAGESAN S, PARK S J, NAM T J, et al.Antioxidant and protective effects of a peptide (VTAL) derived from simulated gastrointestinal digestion of protein hydrolysates of Magallana gigas against acetaminophen-induced HepG2 cells[J].Fisheries Science, 2023, 89(1):71-81.
[14] ZHANG W W, WEI Y F, CAO X X, et al.Enzymatic preparation of Crassostrea oyster peptides and their promoting effect on male hormone production[J].Journal of Ethnopharmacology, 2021, 264:113382.
[15] JEON S H, CHOUNG S Y.Oyster hydrolysates attenuate muscle atrophy via regulating protein turnover and mitochondria biogenesis in C2C12 cell and immobilized mice[J].Nutrients, 2021, 13(12):4385.
[16] 蒋美龄, 陈忠琴, 秦小明, 等.牡蛎降糖肽的结构表征及其协同花色苷的活性增效作用[J].大连海洋大学学报, 2023, 38(3):455-463.
JIANG M L, CHEN Z Q, QIN X M, et al.Structural characterization and the synergistic effects with anthocyanin of oyster hypoglycemic peptides[J].Journal of Dalian Ocean University, 2023, 38(3):455-463.
[17] 钟凯翠, 刘思炜, 巫雨桐, 等.海红米花色苷的提取工艺优化及其体外降糖作用研究[J].食品与发酵工业, 2024, 50(14):97-103.
ZHONG K C, LIU S W, WU Y T, et al.Study on extraction process optimization of anthocyanins from sea red rice and its hypoglycemic effect in vitro[J].Food and Fermentation Industries, 2024, 50(14):97-103.
[18] 柏昌旺. 可控酶解制备牡蛎短肽工艺及其产品开发[D].湛江:广东海洋大学, 2019.
BAI C W.Study on the process of controlled enzymatic hydrolysis of oyster oligopeptides and its product development[D].Zhanjiang:Guangdong Ocean University, 2019.
[19] JI Y L, LIU D, JIN Y, et al.In vitro and in vivo inhibitory effect of anthocyanin-rich bilberry extract on α-glucosidase and α-amylase[J].LWT, 2021, 145:111484.
[20] MITTAL A, SINGH A, BENJAKUL S.α-amylase inhibitory activity of chitooligosaccharide from shrimp shell chitosan and its epigallocatechin gallate conjugate:Kinetics, fluorescence quenching and structure-activity relationship[J].Food Chemistry, 2023, 403:134456.
[21] 梁莎, 畅姝怡, 齐元锦, 等.牛乳清蛋白源脂肪酶抑制肽的制备及影响因素研究[J].中国乳品工业, 2021, 49(6):11-16.
LIANG S, CHANG S Y, QI Y J, et al.Study on the preparation and influencing factors of lipase inhibitory peptides derived from bovine whey protein[J].China Dairy Industry, 2021, 49(6):11-16.
[22] OBAROAKPO J U, LIU L, ZHANG S W, et al.In vitro modulation of glucagon-like peptide release by DPP-IV inhibitory polyphenol-polysaccharide conjugates of sprouted quinoa yoghurt[J].Food Chemistry, 2020, 324:126857.
[23] LIN C P, HUANG P H, CHEN C Y, et al.Sitagliptin attenuates arterial calcification by downregulating oxidative stress-induced receptor for advanced glycation end products in LDLR knockout mice[J].Scientific Reports, 2021, 11(1):17851.
[24] BABU S N, GOVINDARAJAN S, VIJAYALAKSHMI M A, et al.Role of zonulin and GLP-1/DPP-IV in alleviation of diabetes mellitus by peptide/polypeptide fraction of Aloe vera in streptozotocin- induced diabetic wistar rats[J].Journal of Ethnopharmacology, 2021, 272:113949.
[25] 杨路达, 张海森, 李超, 等.生物钟调控肝糖原代谢与葡萄糖稳态的研究进展[J].中国细胞生物学学报, 2022, 44(5):856-865.
YANG L D, ZHANG H S, LI C, et al.Research progress on circadian regulation of hepatic glycogen metabolism and glucose homeostasis[J].Chinese Journal of Cell Biology, 2022, 44(5):856-865.
[26] RAHAYU W M, ASTUTI M, MARSONO Y.Improved hypoglycemic effect of anthocyanin extract combination from red rice and black soybean[J].Journal of Physics:Conference Series, 2019, 1146:012015.