当前,随着养殖种类及数量不断扩大,我国水产品加工行业已跻身为世界水产大国行列。养殖水产品作为我国农业的重要组成部分,不仅是人类膳食的重要组成部分,也是蛋白质、脂质等营养物质的重要来源[1]。鲜活鱼类具有肉质鲜美、风味突出、营养价值高等优点,已经受到越来越多消费者的青睐。然而在水产品的养殖、运输及加工过程中,鱼类会不可避免地受到外界应激源(如禁食、高密度养殖、宰杀方式等)的刺激。大量研究表明,宰前处理和宰杀期间的应激性与产品的后续品质密切相关,鱼类宰杀过程中产生的应激反应,作为一种短时且剧烈的应激形式,不仅直接影响鱼类福利而且对鱼体生理代谢及鱼肉品质有显著影响[2]。因此,需要选择合适的宰杀方式,并尽可能快速、无痛地宰杀鱼类,以最大限度地提高鱼类的福利及产品品质[3]。鱼类的宰杀方法有多种,如头部击晕、CO2麻醉、去鳃、电击等,其中CO2作为一种惰性气体且价格低廉,安全无毒,被视为一种有效的麻醉剂。目前,低温联合CO2麻醉鱼体,不仅能降低鱼体的新陈代谢,还能降低鱼体的宰杀应激与损伤,具有较好的发展与应用前景[4]。
DONG等[5]比较了不同宰杀方法对大黄鱼肌原纤维蛋白的影响,表明CO2麻醉处理组样品在冷藏期间保持了良好的抗氧化酶活性、肌纤维结构和凝胶特性。CAMPAGNOLI等[6]比较了CO2麻醉与冰水致晕下的罗非鱼的品质影响,发现CO2麻醉组罗非鱼片具有较高的明度、白度、硬度值。目前,已有大量研究集中于不同宰杀方式对冷藏鱼肉品质的影响,而对冻藏期间鱼肉品质及蛋白特性的研究较少,因此本研究将CO2麻醉作为一种友好宰杀方式,研究CO2麻醉法与传统击晕法对草鱼冻藏过程中鱼肉品质及蛋白质特性的影响,分析4种宰杀方式(击头-剖肚、击头-断尾、CO2麻醉-剖肚、CO2麻醉-断尾)对冻藏期间草鱼的质构特性、挥发性盐基氮值(total volatile basic nitrogen, TVB-N)、三氯乙酸(trichloroacetic acid, TCA)可溶性肽含量、巯基和羰基含量、蒸煮损失、Ca2+-ATPase活性变化的影响,并结合SDS-PAGE蛋白谱分析,探讨宰杀方式对草鱼冻藏期间蛋白特性的影响,旨在为淡水鱼的品质保持和质量控制提供新的理论支持和研究思路。
1 材料与方法
1.1 材料与试剂
鲜活草鱼[均重(1.21±0.25)kg,长度(42.50±2.50)cm]试验前禁食暂养4 h,购于浙江湖州秋山水产市场;NaCl、盐酸,分析纯,杭州邦易化工有限公司;乙二胺四乙酸、三羟甲基氨基甲烷、5,5′二硫代双(2-硝基苯甲酸)、二硝基苯肼、盐酸胍、三氯乙酸、硫代巴比妥酸、硫酸亚铁、钼酸铵,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
F6/10高速分散剂,德国Fluko公司;HH-4数显恒温水浴锅,上海邦西科技仪器有限公司;AR2130分析天平,上海力衡仪器仪表有限公司;TU-1900双束紫外可见分光光度计,北京普析通用仪器有限责任公司;CR21GIII高速冷冻离心机,日立Hitachi公司;K9840自动凯氏定氮仪,威海开米泰克商贸有限公司;WIX-EP3000电泳仪,韦克斯科技有限公司;QH-1500汽水混合机,浙江瑞安宝利达机械厂。
1.3 实验方法
1.3.1 原料及宰杀处理
草鱼随机分为4组,分别记录体重和身长。采取以下4种宰杀方式:T1,击昏头部-剖肚放血,木棍击晕草鱼头部,直至昏迷无反应后剖肚放血;T2,击昏头部-断尾放血,木棍击晕草鱼头部,直至昏迷无反应后断尾放血;T3,CO2麻醉-剖肚放血,CO2麻醉至草鱼停止鳃盖运动后,剖肚放血;T4,CO2麻醉-断尾放血,CO2麻醉至草鱼停止鳃盖运动后,断尾放血。之后将每条草鱼切成2块鱼片,清洗干净,水分沥干后均匀地置于-18 ℃冰箱冻藏6个月。每隔1个月从T1、T2、T3、T4组中随机取3片鱼肉进行后续指标测定,测定前将每组鱼肉置于流水下解冻30 min。
1.3.2 鱼肉质构测定
参考LU等[7]的方法并做适当修改。使用TA.XT Plus物性分析仪进行质构测定,并采用全质构分析模式(textural properties analysis,TPA)。选择P36/R探头,设置测前速度1.0 mm/s,测试速度1.0 mm/s,测后速度1.0 mm/s,应变比50%,测试力10 g,时间间隔5.0 s。实验时将草鱼肌肉切成20 mm×20 mm×15 mm的均匀立方体,水平放置于探头底座上进行测定。每组样品测定6次后取平均值。
1.3.3 TVB-N值测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中自动凯式定氮仪法并稍作修改。称取10.0 g绞碎的鱼肉于离心管中,加入75 mL蒸馏水,高速均质15 s后浸渍30 min,之后在3 500 r/min 下离心3 min。取5 mL上清液于消化管中,加入等量氧化镁悬浊液(10 g/L),混合均匀后进行后续蒸馏、滴定等工作,采用0.01 mol/L盐酸标准溶液滴定。空白组以5 mL蒸馏水代替样品滤液。按照公式(1)计算TVB-N值:
TVB-N值![]()
(1)
式中:V1,样品消耗盐酸标准滴定溶液的体积,mL;V2,空白组消耗盐酸标准滴定溶液的体积,mL;c,盐酸标准滴定溶液的浓度,mol/L;14,滴定1.0 mL盐酸(CHCl=1.00 mol/L)标准滴定溶液相当的氮的质量;m,样品质量,g。
1.3.4 TCA可溶肽含量测定
参考YU等[8]的方法并作适当修改。准确称取3.0 g搅碎的鱼肉样品,加入27 mL预冷的50 g/L三氯乙酸溶液,10 000 r/min下均质1 min,之后在冰上静置30 min。在4 ℃下以10 000 r/min离心5 min,采用福林-酚法测定上清液中的TCA可溶性肽含量,最终结果表示为μmol tyrosine/g。
1.3.5 鱼肉肌原纤维蛋白提取及巯基含量测定
参考PAN等[9]的方法并做适当修改。称取2.0 g鱼肉加入20 mL预冷的0.05 mol/L NaCl-20 mmol/L Tris-马来酸溶液(pH 7.0),8 000 r/min下均质30 s,在4 ℃下以10 000 r/min离心10 min。收集沉淀,加入20 mL预冷的0.6 mol/L NaCl-20 mmol/L Tris-马来酸溶液(pH 7.0),在8 000 r/min下均质30 s,4 ℃静置1 h后,样品在4 ℃下以10 000 r/min离心10 min,然后收集上清液并在4 ℃下过滤。为避免肌原纤维蛋白变性,所有蛋白质提取过程均在4 ℃下进行。
参考ZHANG等[10]的方法并做适当修改。将4.5 mL缓冲液A(8 mol/L尿素、3 mmol/L EDTA、1%SDS、0.2 mol/L Tris-HCl)(pH 8.0)加入到0.5 mL肌原纤维蛋白溶液(4 mg/mL)中,充分混匀,再取4 mL混合液,加入0.5 mL缓冲液B(10 mmol/L DTNB、0.2 mol/L Tris-HCl)(pH 8.0),混匀后于40 ℃恒温水浴锅中温育25 min,在412 nm下测量其吸光值。空白对照组用0.6 mol/L NaCl(pH 7.0)代替样品。按照公式(2)计算巯基含量:
巯基含量/(mol/105 g蛋白![]()
(2)
式中:a,吸光值;b,待测液蛋白浓度,mg/mL;c,分子吸光系数,值为13 600 mol/(cm·L);d,稀释倍数,11.25。
1.3.6 羰基含量测定
参考ZHANG等[10]的方法并做适当修改。取1 mL肌原纤维蛋白溶液(2 mg/mL)加入等体积的10 mmol/L DNPH-HCl溶液(溶剂为2 mol/L HCl),涡旋混匀,并使其在黑暗中反应1 h(每隔15 min涡旋一下)。反应完毕后加入100 g/L三氯乙酸溶液停止反应,在10 000 r/min条件下离心5 min。去除上清液,用乙醇/乙酸乙酯溶液(1∶1,mL∶mL)洗涤沉淀中未反应的DNPH 3次。随后,加入3 mL 6 mol/L 盐酸胍溶解洗涤后的沉淀,并在37 ℃水浴中孵育15 min。待溶液恢复至室温后,将反应液于10 000 r/min下离心3 min,取上清液在370 nm条件下测定吸光度值(A370)。空白对照组用2 mol/L HCl溶液代替样品。按照公式(3)计算羰基含量:
羰基含量/(nmol/mg蛋白)![]()
(3)
式中:A370,待测样品在370 nm条件下测定的吸光值,A空白,空白对照组在370 nm条件下测定的吸光值。
1.3.7 蒸煮损失的测定
蒸煮损失的测定参照LI等[11]的方法并稍作改动。将鱼肉切成1 cm×1 cm×1 cm的鱼块,称重(m0)装袋后在85 ℃的水浴中煮15 min。待鱼块恢复至室温后,擦去鱼肉表面水分后称重(mt,其中t为贮藏时间)。蒸煮损失表示为鱼肉蒸煮后损失的质量(m0-mt)占初始质量的百分比。
1.3.8 Ca2+-ATPase活性测定
参考赵瑞云[12]的方法并做适当修改。准确吸取3.5 mL肌原纤维蛋白溶液,加入0.3 mL 0.5 mol/L Tris-马来酸溶液(pH 7.0)和0.5 mL 0.1 mol/L的CaCl2溶液,再加入20 mmol/L ATP溶液0.25 mL,在25 ℃恒温水浴锅准确反应10 min。加入2.5 mL预冷的150 g/L三氯乙酸终止反应。空白对照组先加入150 g/L三氯乙酸再加入ATP。反应结束后在10 000 r/min下离心5 min,吸取0.5 mL上清液,加入2.5 mL蒸馏水,涡旋混匀后加入2 mL硫酸亚铁-钼酸铵溶液,在660 nm下测其吸光值。按照公式(4)计算Ca2+-ATPase活性:
Ca2+-ATPase活性![]()
(4)
式中:m,生成的无机磷量,μmol Pi;t,反应时间,min;M,肌原纤维蛋白质量,mg。
1.3.9 肌原纤维蛋白SDS-PAGE
参考ZHANG等[13]的方法并做适当修改。将提取得到的肌原纤维蛋白溶液稀释至4 mg/mL,将肌原纤维蛋白样品与上样缓冲液按体积比1∶4的比例涡旋混合,沸水浴下加热3~5 min。分离胶浓度120 g/L,浓缩胶浓度50 g/L,上样量10 μL,电压80 V,待电泳条带到达距离分离胶底部约1 cm,关闭电源。将凝胶小心用小刀刮下,放入考马斯亮蓝染色液中边摇边染色20 min,随后移入脱色液中边摇边脱色,直至蛋白条带清晰。
1.4 统计分析
各实验组取3个平行的平均数作为实验结果,采用Origin 2024和SPSS 26对所得实验数据进行整理、分析、处理、绘图,结果采用“平均值±标准差”形式表示,对所得数据用单因素方差分析法(One-way ANOVA)进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 宰杀方式对草鱼冻藏过程质构的影响
质构特性是评价鱼肉新鲜度及品质质量的一个重要指标,鱼体宰后其肌肉逐渐变软,质构发生劣变。硬度是指使鱼肉达到一定程度变形时所需要的力;弹性反映了外力作用时变形及去力后的恢复情况;咀嚼性被定义为胶着性×弹性,是肌肉硬度下降,肌肉细胞间凝聚力降低,肌肉弹性变小等综合作用的结果[14]。不同宰杀方式对草鱼冻藏过程质构特性的影响如表1所示。贮藏初期(0个月),CO2麻醉组(T3和T4)鱼肉的硬度和弹性显著高于击晕组(T1和T2)(P<0.05),而放血方式对鱼肉质构无显著性影响(P>0.05)。其中T4组的硬度、弹性和咀嚼性均最高,T1组的硬度、弹性和咀嚼性最低。该结果表明宰杀方式产生的应激可能破坏了鱼肉的肌纤维结构或影响了肌纤维膜的完整性,从而引起鱼肉质构特性初始值的明显变化。冻藏期间,4组鱼肉的硬度、弹性、咀嚼性均呈下降趋势。到冻藏末期(6个月),T1、T2、T3、T4组的硬度分别下降64.62%、63.60%、66.44%、64.45%,弹性分别下降29.63%、29.09%、29.31%、25.86%,咀嚼性分别下降41.91%、41.45%、40.37%、40.75%。结果表明,T4处理组在冻藏过程中质构特性相关指标的变化程度更小,硬度和弹性保持能力更好。T1处理组在冻藏过程中硬度和咀嚼性下降程度最大,可能原因是击晕-剖肚处理产生应激反应较强烈,鱼体无氧呼吸增加导致乳酸水平上升,体内糖原被分解为葡萄糖,葡萄糖继续被分解为H2O和CO2,导致肌肉中的水分含量增加,鱼肉的硬度和咀嚼性降低,在长期冷冻储存过程中,宰杀应激以及冻藏中冷冻变性的交互影响,导致T1组鱼片的硬度下降更快[15-16]。
表1 宰杀方式对草鱼冻藏过程质构特性的影响
Table 1 Effects of slaughter methods on textural properties of grass carp fillets during frozen storage
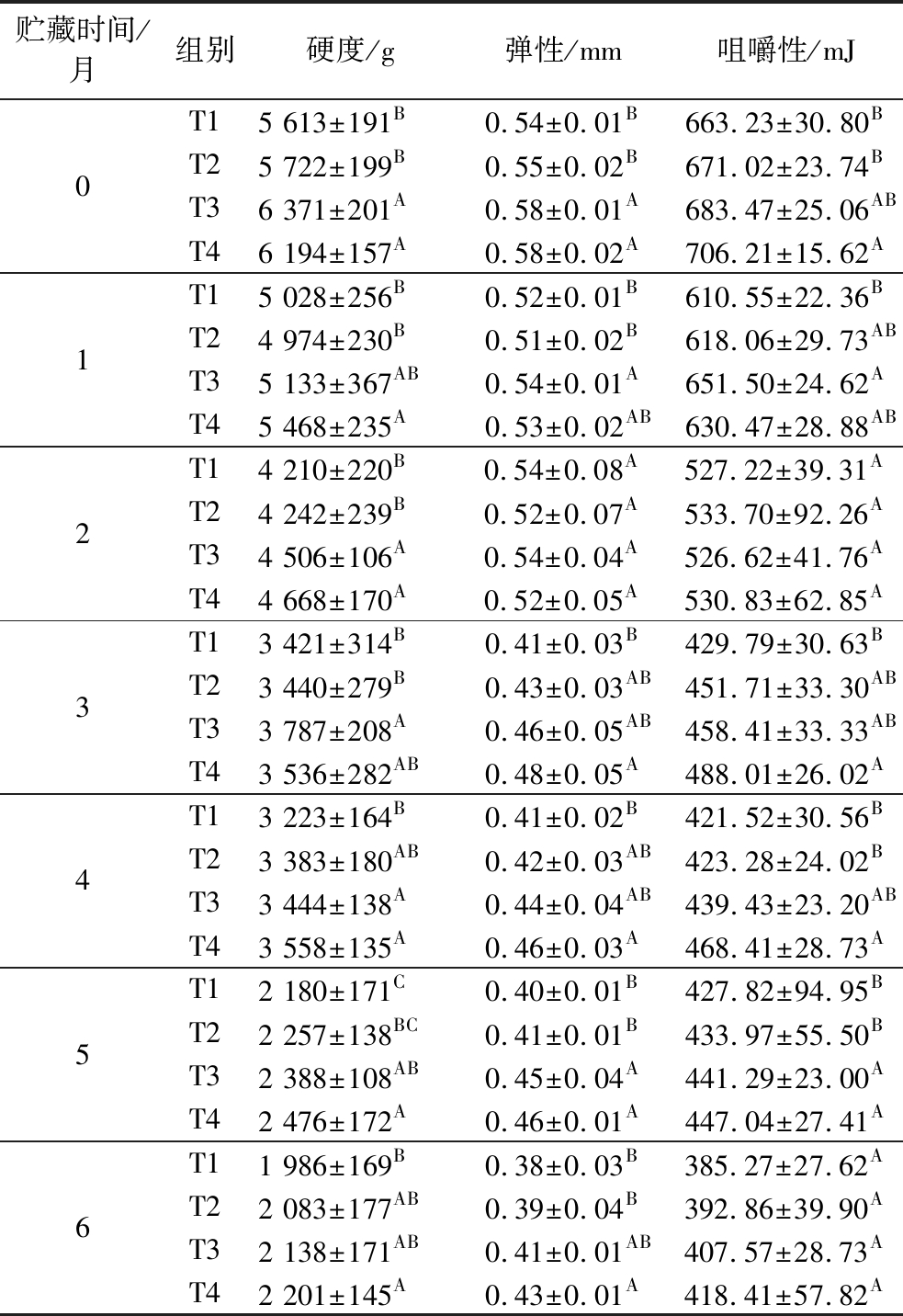
贮藏时间/月组别硬度/g弹性/mm咀嚼性/mJ0T15 613±191B0.54±0.01B663.23±30.80BT25 722±199B0.55±0.02B671.02±23.74BT36 371±201A0.58±0.01A683.47±25.06ABT46 194±157A0.58±0.02A706.21±15.62A1T15 028±256B0.52±0.01B610.55±22.36BT24 974±230B0.51±0.02B618.06±29.73ABT35 133±367AB0.54±0.01A651.50±24.62AT45 468±235A0.53±0.02AB630.47±28.88AB2T14 210±220B0.54±0.08A527.22±39.31AT24 242±239B0.52±0.07A533.70±92.26AT34 506±106A0.54±0.04A526.62±41.76AT44 668±170A0.52±0.05A530.83±62.85A3T13 421±314B0.41±0.03B429.79±30.63BT23 440±279B0.43±0.03AB451.71±33.30ABT33 787±208A0.46±0.05AB458.41±33.33ABT43 536±282AB0.48±0.05A488.01±26.02A4T13 223±164B0.41±0.02B421.52±30.56BT23 383±180AB0.42±0.03AB423.28±24.02BT33 444±138A0.44±0.04AB439.43±23.20ABT43 558±135A0.46±0.03A468.41±28.73A5T12 180±171C0.40±0.01B427.82±94.95BT22 257±138BC0.41±0.01B433.97±55.50BT32 388±108AB0.45±0.04A441.29±23.00AT42 476±172A0.46±0.01A447.04±27.41A6T11 986±169B0.38±0.03B385.27±27.62AT22 083±177AB0.39±0.04B392.86±39.90AT32 138±171AB0.41±0.01AB407.57±28.73AT42 201±145A0.43±0.01A418.41±57.82A
注:不同大写字母表示在同一贮藏时间下宰杀方式间存在显著差异(P<0.05)(下同)。
2.2 宰杀方式对草鱼冻藏过程TVB-N值的影响
TVB-N值是评价水产品鲜度的重要指标,草鱼在冻藏期间受内源性酶及少量微生物作用,蛋白质及非蛋白类含氮化合物(如氨基酸、核苷酸分解代谢产物)不断降解,生成氨、胺类等碱性含氮挥发性物质,TVB-N值不断上升[17]。根据中华人民共和国国家标准GB 2733—2015 《食品安全国家标准 鲜、冻动物性水产品》,淡水鱼虾的可接受标准含量为TVB-N≤20 mg/100 g。不同宰杀方式下草鱼冻藏过程TVB-N值的变化如图1所示,结果显示,草鱼的初始TVB-N值保持在6.24~6.26 mg/100 g且各组间无显著性差异(P>0.05)。随着贮藏时间的延长,鱼肉在内源酶和微生物的作用下不断分解蛋白质产生小肽和游离氨基酸,进一步分解为具有挥发性的氨以及胺类等碱性含氮物质,导致各组的TVB-N值均显著升高(P<0.05),鱼肉品质不断下降。到冻藏末期(6个月),T1、T2组分别达到了23.19和21.18 mg/100 g,分别是初始值的3.71、3.38倍,且均已超出淡水鱼的可接受标准。而T3和T4组为18.30和17.56 mg/100 g,分别是初始值的2.93、2.81倍,但均未超出淡水鱼的可接受标准。BARTON[18]研究显示敲头击晕对草鱼产生的强烈应激,加速了鱼体的肌肉活动,葡萄糖厌氧糖酵解产生乳酸以及ATP降解释放无机磷酸盐导致鱼肉初始pH值降低,肌肉渗透压在死后数小时内增加,而肌肉pH下降和渗透压变化能够导致线粒体和肌浆网退化,进一步引起细胞溶胶中钙离子的释放。游离钙的浓度升高能够激活部分内源性酶(如钙蛋白酶、组织蛋白酶)的活性,导致含硫氨基酸(半胱氨酸和蛋氨酸)和芳香族氨基酸(酪氨酸和苯丙氨酸)的一系列修饰(氧化、脱氨和脱羧)并产生氨、胺类化合物[19-20]。而CO2麻醉处理能抑制鱼体脑神经细胞的兴奋性,并影响脑脊液环境的离子浓度,从而减轻鱼体麻醉时的意识水平,引起草鱼较小的应激反应[21]。鱼体内储存的糖原和ATP消耗减慢,肌肉pH值较高,鱼肉的内源性酶活性较低,一定程度上延缓了碱性含氮物质的生成。随着冻藏时间的延长,4组鱼肉中的碱性含氮挥发性物质在持续生成,TVB-N值持续积累上升,CO2麻醉处理能够一定程度延缓氨、胺类等碱性含氮挥发性物质的生成,延缓TVB-N值的上升,较好地维持鱼肉冻藏品质。
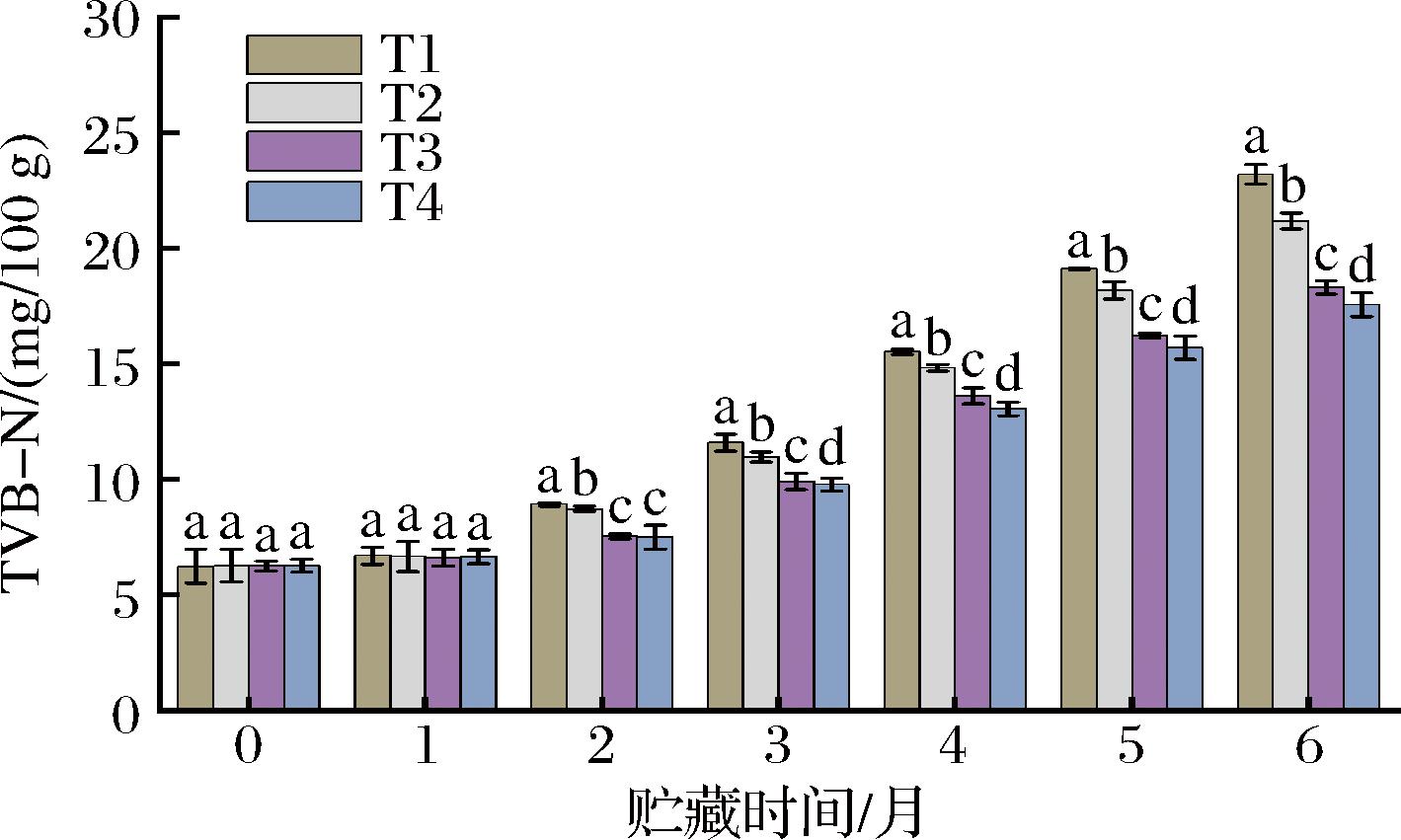
图1 宰杀方式对草鱼冻藏过程TVB-N值的影响
Fig.1 Effects of slaughter methods on TVB-N of grass carp during frozen storage
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 宰杀方式对草鱼冻藏过程TCA可溶肽含量的影响
TCA可溶性肽被认为是评价鱼类肌肉蛋白质降解的有效指标之一,不同宰杀方式下草鱼冻藏过程TCA可溶性肽含量的变化如图2所示,各组鱼肉TCA可溶性肽初始含量分别为0.73、0.74、0.71及0.70 μmol tyrosine/g,各组间没有显著性差异。随着贮藏时间的延长,各组鱼肉蛋白的降解程度加剧,TCA可溶性肽含量均显著升高(P<0.05)。在冻藏前2个月,4组鱼肉的TCA可溶性肽含量明显上升,可能原因是冻藏前期内源性组织蛋白酶引起蛋白的水解持续发生。有研究证明内源蛋白酶(组织蛋白酶B、L、钙蛋白酶和丝氨酸蛋白酶等)的活性与TCA可溶性肽含量呈正相关,而宰杀应激会影响鱼体的肌肉活动和厌氧糖酵解速率,引起肌肉pH下降和渗透压变化,导致线粒体和肌浆网退化释放Ca2+,进而激活部分内源性酶的活性,内源性蛋白酶水解活性的增加引起肌球蛋白重链的降解自溶以及肌原纤维的蛋白水解产生新的片段,导致TCA可溶性肽含量上升[22-23]。蛋白质降解产生的代谢产物为微生物的生长繁殖提供了有利条件,腐败菌在鱼肉贮藏过程中产生的蛋白酶和肽酶进一步促进了鱼肉蛋白质降解,进而导致TCA可溶性肽含量持续上升。随着冻藏时间的延长,在低温条件下鱼肉中的内源性蛋白酶及微生物等活性受到抑制,导致肌肉来源的含氮降解产物(如游离氨基酸和肽等)减少,TCA可溶性肽含量上升减缓[24]。冻藏6个月后,T1、T2、T3、T4组的TCA可溶性肽含量分别增长至3.69、3.62、3.84、3.79 μmol tyrosine/g,且T1、T2组的TCA可溶性肽含量显著高于T3、T4组(P<0.05),各组TCA可溶性肽含量较初始值分别增长了4.08、3.92、3.75、3.78倍。CO2麻醉处理能够延缓冻藏草鱼TCA可溶性肽含量的增加,可能是由于CO2麻醉处理引起的草鱼宰杀应激较小,降低了鱼体死后内源性蛋白酶的活性,从而延缓了肌肉蛋白质的降解。
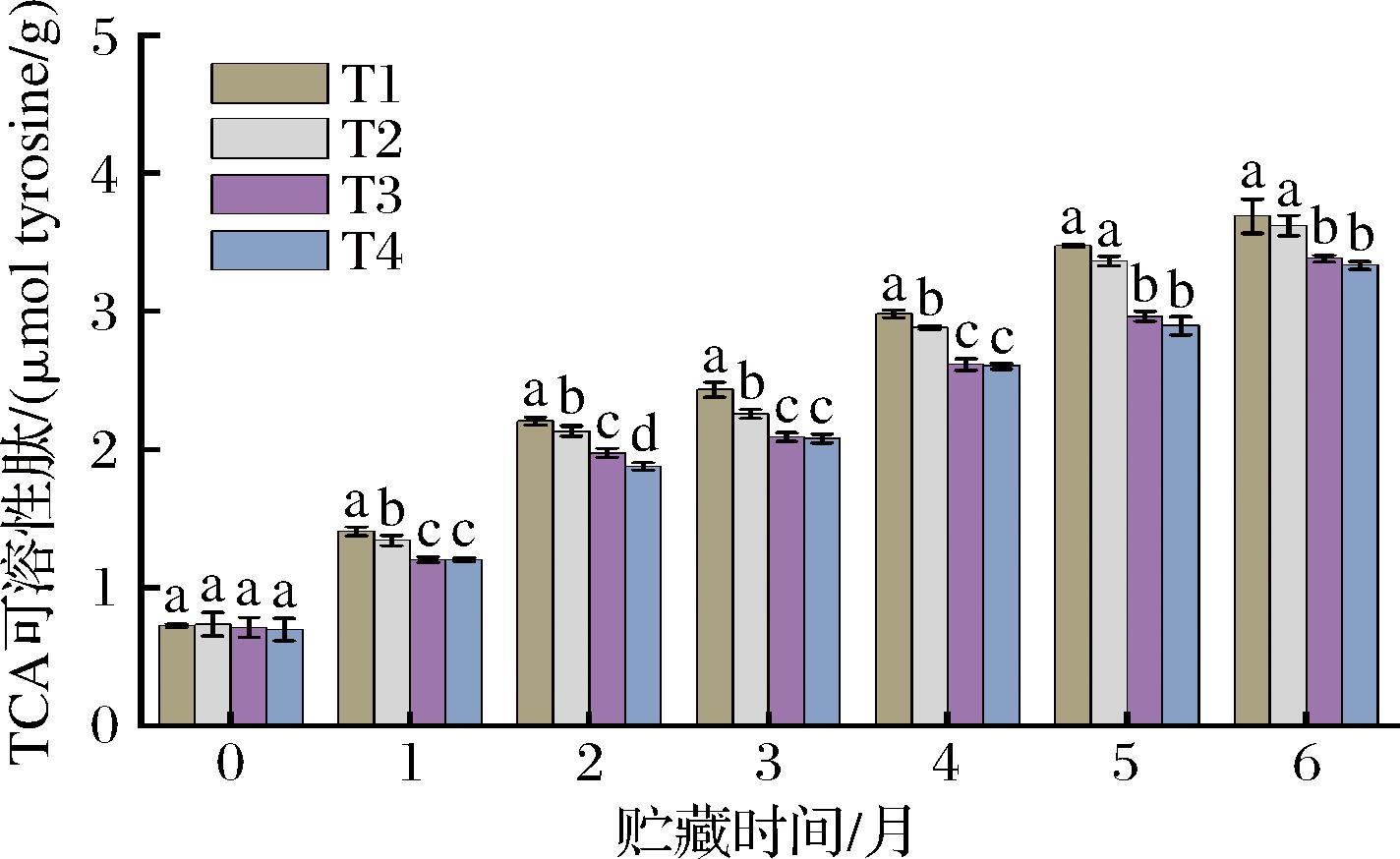
图2 宰杀方式对草鱼冻藏过程TCA可溶性肽含量的影响
Fig.2 Effects of slaughter methods on TCA soluble peptides of grass carp during frozen storage
2.4 宰杀方式对草鱼冻藏过程巯基和羰基含量的影响
巯基(半胱氨酸残基)是蛋白质中最具反应活性的功能性基团之一,巯基不同的还原态和氧化态形式直接影响了生物体的氧化还原稳态,在冷冻贮藏期间蛋白结构的变化会引起巯基位置改变,暴露在空气中被氧化为二硫键,巯基含量变化在一定程度上反映了冻品肌原纤维蛋白氧化情况[25]。不同宰杀方式下鱼肉肌原纤维蛋白中的巯基含量变化如图3-a所示,T1、T2、T3和T4组的初始值分别为8.18、8.10、8.14及8.16 mol/105 g蛋白,且4组之间无显著性差异(P>0.05)。在冻藏前4个月,4组的巯基含量均明显减少,而在冻藏4~6个月过程中巯基含量下降缓慢。主要原因是在冻藏前期氧化的大部分是分子外侧的巯基,随着冻藏期间冰晶的形成使肌原纤维蛋白空间结构发生改变,使原包埋于内部的巯基不断暴露被氧化成二硫键,巯基含量明显减少;冻藏后期随着蛋白质的氧化变性,蛋白质片段重新聚合形成蛋白质聚集体,覆盖一些巯基,使能检测到的巯基含量降低[26]。冻藏6个月后,T1、T2、T3、T4组的巯基含量分别降至3.36、3.46、4.04及4.16 mol/105 g蛋白,分别降至其初始巯基含量的58.87%、57.29%、50.41%及49.03%。其中CO2麻醉处理组在冻藏期间保持了较高的巯基含量,巯基被氧化成二硫键的程度更低,肌原纤维蛋白的氧化程度更低,可能是CO2麻醉处理通过阻碍鱼体呼吸运动的气体交换和改变脑内环境抑制中枢神经系统活动,降低了鱼体的肌肉活动并减轻鱼体产生的宰杀应激,避免了宰杀时活性氧(reactive oxygen species,ROS)自由基的大量生成,半胱氨酸中的巯基被产生的ROS氧化修饰成二硫键的程度较低,能较好地维持巯基含量处于较高水平。结果表明,与击晕组相比,CO2麻醉产生的应激水平更低,肌原纤维蛋白的氧化程度更低,其中在贮藏过程中T4组保持较高的巯基含量,可能原因是T4处理组产生的宰杀应激最小,延缓了肌原纤维蛋白的氧化程度,巯基被氧化成二硫键的程度更低。

a-巯基;b-羰基
图3 宰杀方式对草鱼冻藏过程巯基含量和羰基含量的影响
Fig.3 Effects of slaughter methods on sulfhydryl group contentand carbonyl content of grass carp during frozen storage
羰基衍生物是蛋白质氧化的重要标志物之一,主要通过氨基酸侧链的直接氧化或肽链骨架的断裂产生。肌原纤维蛋白中羰基的形成主要有4种途径,分别为氨基酸(赖氨酸、脯氨酸等)的侧链氧化反应、非酶糖基化反应、α-酰胺化导致的肽链断裂、与非蛋白羰基化合物(丙二醛等)的共价结合[27]。如图3-b所示,不同宰杀方式下鱼肉肌原纤维蛋白中的羰基含量的初始值无显著差异,T1、T2、T3、T4组的初始羰基含量分别为0.41、0.40、0.38及0.39 nmol/mg蛋白。冻藏6个月后,T3和T4组的羰基含量分别升高至2.44 nmol/mg蛋白和2.20 nmol/mg蛋白,分别为初始值的6.36、5.66倍;而T1和T2组的羰基含量分别升高至2.91 nmol/mg蛋白和2.66 nmol/mg蛋白,分别为初始值的7.05、6.58倍。羰基含量的明显上升表明冻藏过程中各组均发生了蛋白氧化,而各组的羰基含量上升情况不同又说明不同处理组的蛋白氧化情况存在差异。
研究发现鱼体在宰杀应激时会产生大量ROS自由基,高浓度条件下的活性氧自由基(如羟基自由基、超氧阴离子自由基等)会引发一系列的自由基链式反应,肌肉蛋白中的一些氨基酸残基(如半胱氨酸、甲硫氨酸等)易受到ROS的攻击,发生氧化修饰,生成羰基衍生物,此外,蛋白质的肽链骨架也可以被ROS攻击发生β-断裂,使肽链断裂并产生羰基衍生物[28-29]。同时,在冻藏期间,冰晶的形成引起的细胞损伤会释放出促氧化剂,进一步促进蛋白质的氧化,导致羰基化合物持续生成且随着冻藏时间的延长不断增加[30]。有研究证明CO2麻醉处理组样品的抗氧化酶活性较高,可以维持鱼体抗氧化防御系统的稳定性,及时螯合超氧化物自由基和H2O2,使鱼体免受氧化损伤,降低鱼肉蛋白的氧化程度[5]。在冻藏过程中,羰基含量升高值T1>T2>T3>T4,说明4组鱼肉蛋白质均发生了一定程度的氧化,而CO2麻醉处理组的宰杀应激更小,避免了宰杀时ROS的大量生成,鱼体内的抗氧化防御系统能够及时清除体内积累的自由基,延缓了肌原纤维蛋白的氧化程度,羰基衍生物生成速率降低,巯基被氧化成二硫键的程度更低,且T4处理组产生的宰杀应激最小,肌原纤维蛋白的氧化程度最低。
2.5 宰杀方式对草鱼冻藏过程蒸煮损失的影响
肉类中的水包括结合水、非流动水和自由水,除了结合水含量相对稳定外,非流动水和自由水在外界因素(蒸煮、离心、高压等)下容易迁移,导致水分流失[31]。鱼肉在储存和加工过程中,质地的变化更多与蛋白质的氧化修饰和肌原纤维蛋白的蛋白水解有关,蛋白质氧化对肌肉食品的持水能力,嫩度和多汁性有着负面影响[32]。肉类的持水能力直接影响了肉类的口感、营养成分、色泽等品质,蒸煮损失是衡量肌肉持水能力的重要指标之一。不同宰杀方式下草鱼冻藏过程蒸煮损失的变化如图4所示,T1、T2、T3和T4组鱼肉的初始蒸煮损失分别为18.41%、17.75%、16.99%及16.83%。在冷冻贮藏期间,一方面随着蛋白质变性程度的增加,鱼肉蛋白质的水合环境发生变化,维持蛋白质结构的力的平衡被破坏,水—蛋白质或蛋白质—蛋白质复合物之间的氢键减弱,鱼肉的蛋白质与水分的结合不再紧密导致鱼肉持水力下降[33]。另一方面冷冻期间冰晶生成和内部应力造成肌肉组织的压缩和变形,导致细胞间隙的扩张或细胞膜破裂,细胞外液体和部分细胞内液体的流出,因此4组鱼肉的蒸煮损失呈现显著上升的趋势(P<0.05)。到冻藏末期(6个月),T1、T2、T3、T4组的蒸煮损失分别增至35.02%、34.33%、30.85%及29.65%,是蒸煮损失初值的1.90、1.93、1.81及1.76倍。结果表明,CO2麻醉组(T3、T4)的鱼肉持水能力下降程度低于击晕组(T1、T2),且T3和T4处理组鱼肉的持水能力显著强于击晕组。导致该结果的可能原因是冻藏过程中鱼肉蛋白质发生氧化(生成羰基及二硫键)使蛋白构象发生改变,肌肉细胞受到损伤,使鱼肉的持水能力降低,而CO2麻醉组的肌原纤维蛋白氧化降解的程度较低,肌球蛋白的解离及肌动蛋白重链和轻链的降解程度更低,草鱼的肌纤维间连接的断裂程度及骨架蛋白的完整性破坏程度更低,肌原纤维之间空隙部分的水分不易流失,肌肉的持水能力更好[34]。
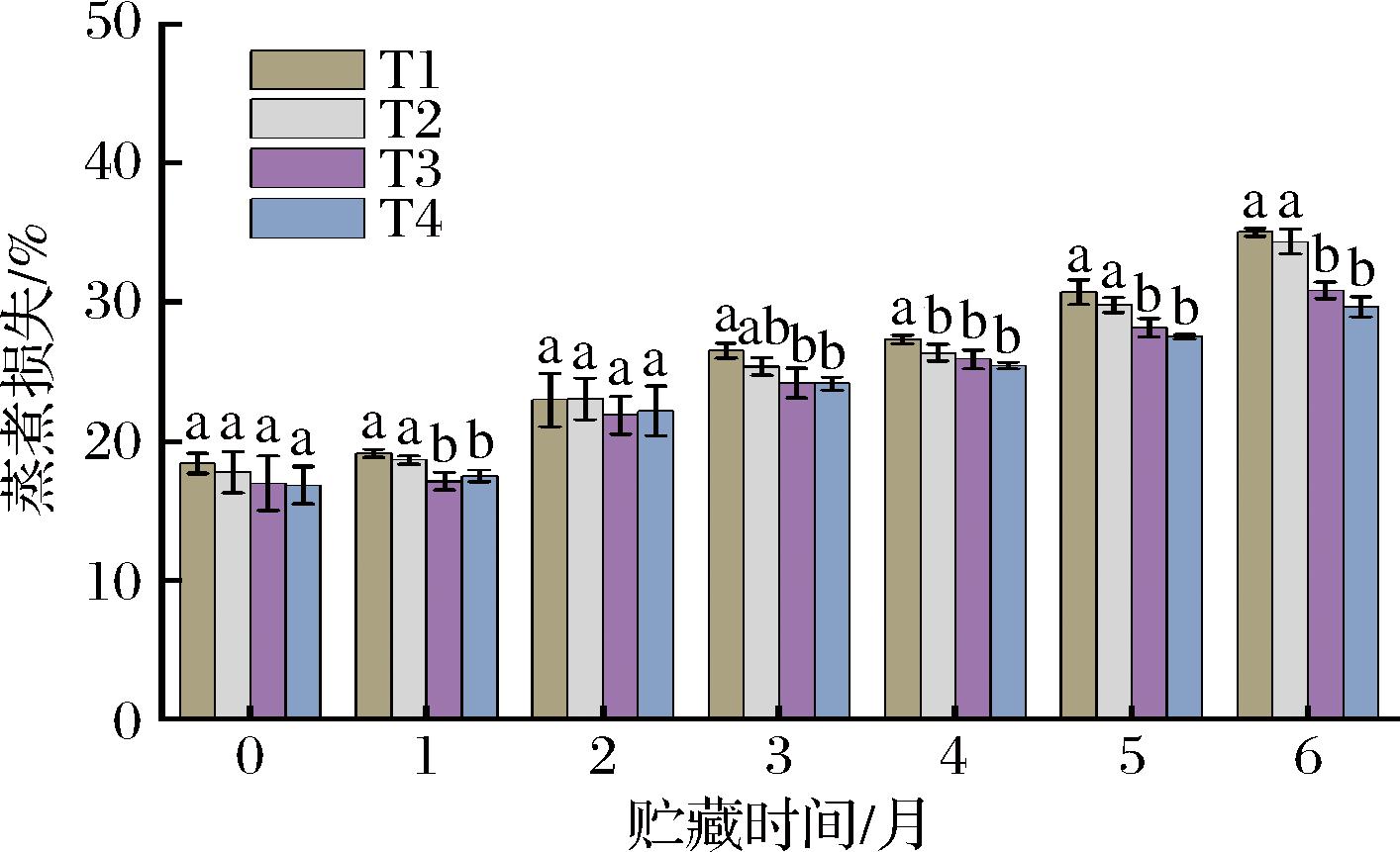
图4 宰杀方式对草鱼冻藏过程蒸煮损失的影响
Fig.4 Effects of slaughter methods on cooking loss of grass carp during frozen storage
2.6 宰杀方式对草鱼冻藏过程Ca2+-ATPase活性的影响
Ca2+-ATPase活性来自于鱼肉肌球蛋白的球状头部结构,其对温度敏感,是反映鱼肉或鱼糜蛋白变性的常用指标,而蛋白质的变性程度又往往与鱼肉品质有密切关联[35]。不同宰杀方式下草鱼冻藏过程Ca2+-ATPase活性的变化如图5所示,各组初始Ca2+-ATPase活性分别为0.487、0.474、0.476及0.479 μmol Pi/(mg·min),且各组间无显著性差异。冻藏2个月后,T1、T2、T3、T4组的Ca2+-ATPase活性分别降至0.279、0.282、0.297及0.315 μmol Pi/(mg·min),且各组间开始出现差异显著,其中T4组的Ca2+-ATPase活性显著高于其他3组(P<0.05)。冻藏4个月后,各组的Ca2+-ATPase活性降低趋势较明显,之后降低趋势较缓慢。冻藏6个月后,T1、T2、T3、T4各组的Ca2+-ATPase活性分别降至0.086、0.092、0.103及0.112 μmol Pi/(mg·min),且T4处理组的Ca2+-ATPase活性显著高于其他组(P<0.05);各组Ca2+-ATPase活性较初始值分别降低了82.34%、80.59%、78.36%、76.41%,且Ca2+-ATPase活性降低值T1>T2>T3>T4。有研究认为,巯基氧化形成二硫键导致分子聚合是Ca2+-ATPase活性下降的主要原因,因为巯基氧化形成二硫键首先发生在肌球蛋白球状头部S1区域,而ATP酶的活性位点也在肌球蛋白球状头部S1区域[36-37]。在冻藏期间随着肌原纤维蛋白氧化程度的增加,肌球蛋白头部的巯基发生氧化形成二硫键引发分子聚合以及该部分的蛋白发生相互聚集,引起肌球蛋白头部构象发生变化,破坏了肌球蛋白分子球状头部的完整性,从而引起Ca2+-ATPase活性下降[38]。在冷冻贮藏期间,生成的冰晶颗粒也会破坏肌原纤维蛋白结构,从而引起Ca2+-ATPase活性持续的降低。由TVB-N值及TCA可溶性肽含量测定的结果可知,与击晕组相比,CO2麻醉处理延缓了肌原纤维蛋白的降解水平;根据巯基测定结果可知,与击晕组相比,CO2麻醉处理延缓了鱼肉肌原纤维蛋白的氧化程度,巯基被氧化成二硫键的程度更低,因此肌球蛋白头部功能区域的破坏更小,Ca2+-ATPase活性降低得较慢,且T4处理组的Ca2+-ATPase活性降低的最慢。
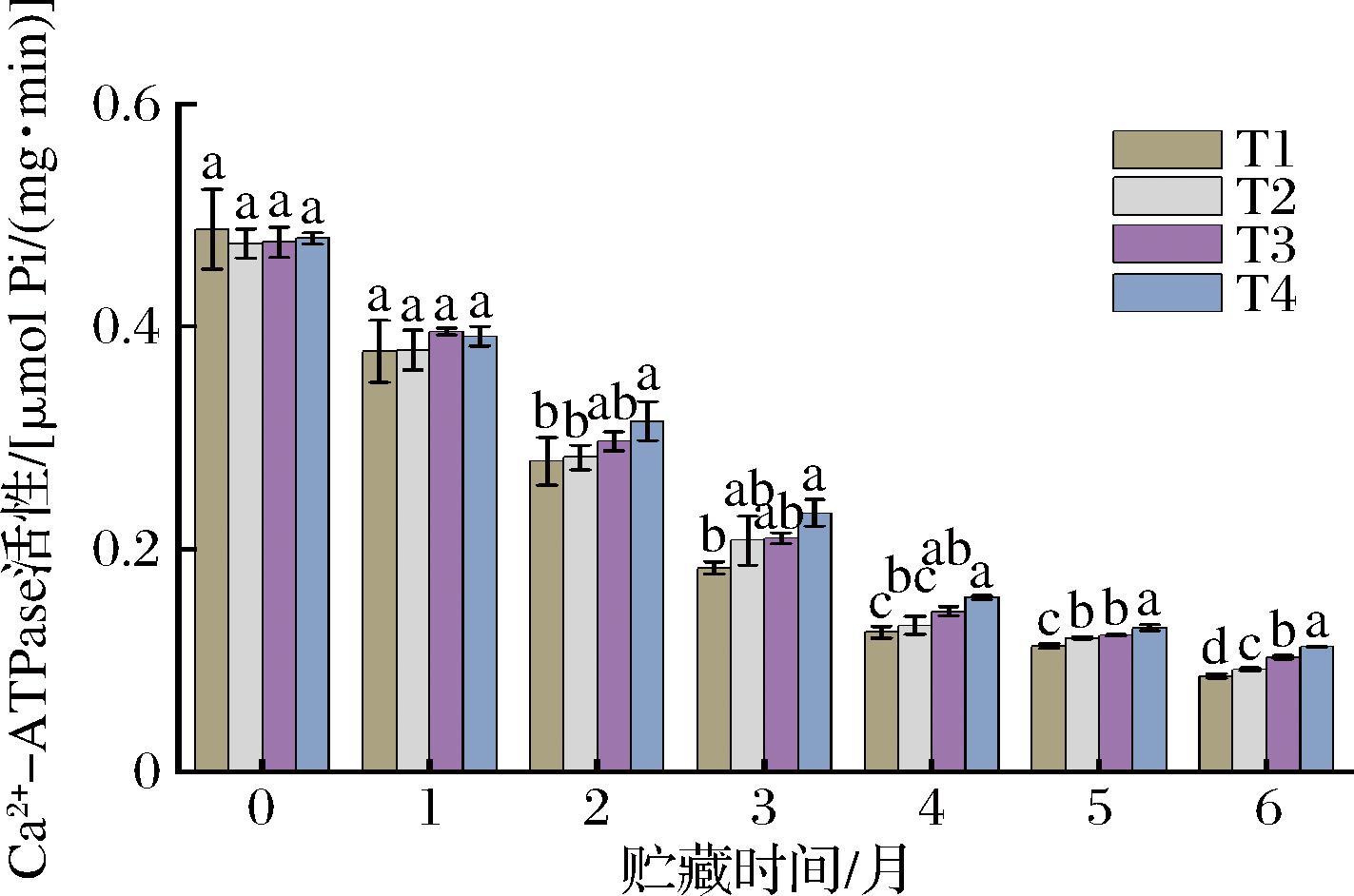
图5 宰杀方式对草鱼冻藏过程Ca2+-ATPase活性的影响
Fig.5 Effects of slaughter methods on Ca2+-ATPase activity of grass carp during frozen storage
2.7 宰杀方式对草鱼冻藏过程SDS-PAGE的影响
SDS-PAGE蛋白谱图是提供蛋白质降解程度的可视化表征,不同宰杀方式下草鱼冻藏过程SDS-PAGE变化如图6所示。草鱼肌原纤维蛋白条带分子质量主要分布于11~245 kDa,主要包括肌球蛋白重链(MHC,220 kDa)、肌动蛋白(Actin,42 kDa)、原肌球蛋白(36 kDa)、肌球蛋白轻链(11~17 kDa)[36]。不同宰杀方式下草鱼样品在初始过程中蛋白条带分布的模式基本一致,冻藏6个月后,观察到肌球蛋白重链(myosin heavy chain,MHC)、肌动蛋白(Actin)条带丰度的明显变化。与T3组相比,T1组的MHC条带丰度降低更为明显,这表明击晕产生的宰杀应激可能导致蛋白完整性被破坏,蛋白质结构不稳定且氨基酸残基等被暴露,加速了蛋白质的氧化,导致MHC的溶解性或提取性降低,蛋白质丰度因此下降。而放血方式对蛋白的氧化程度也有显著性影响,T2组的Actin条带丰度变化不如T1组明显,可能原因是T1组的剖肚放血出血量降低,肉中残留的血液相当于保留了更多的血红蛋白,对肉质的贮藏稳定性产生影响,加速了鱼肉中蛋白质的氧化。此外,在63~100 kDa观察到T1组一些微小条带的明显加深,可能原因是T1组蛋白氧化降解程度的明显增加,MHC持续水解导致蛋白质分子在这区间发生交联聚集。与此同时,还观察到4组原肌球蛋白(36 kDa)、肌球蛋白轻链条带的明显变化,原肌球蛋白的条带变浅且部分肌球蛋白轻链消失,说明原肌球蛋白可能发生部分变性,4组蛋白质在一定程度上发生降解。结合先前测定的各组TCA可溶性肽含量的变化可以表征,鱼肉肌原纤维蛋白的降解程度有一定差异,即在冻藏期间T1组蛋白的降解程度更高。

图6 宰杀方式对草鱼冻藏过程肌原纤维蛋白SDS-PAGE的影响
Fig.6 Effects of slaughter methods on SDS-PAGE in myofibrillar protein of grass carp during frozen storage
3 结论
本文主要探究了击头-剖肚、击头-断尾、CO2麻醉-剖肚、CO2麻醉-断尾4种宰杀方式对草鱼冻藏期间品质变化和蛋白氧化的影响。结果表明,随着冻藏时间的延长,4组鱼肉的冻藏品质在不断下降,蛋白氧化程度在不断上升。击头-剖肚组鱼肉的质构特性变化程度更大,TVB-N值上升更快,蛋白降解程度更高,鱼肉品质不断下降。CO2麻醉处理能够一定程度延缓蛋白及非蛋白类含氮化合物的降解,较好地维持鱼肉的冻藏品质和持水能力,并且CO2麻醉处理组的羰基、TCA可溶性肽含量更低,肌原纤维蛋白的氧化和降解程度更低。其中CO2麻醉-断尾放血在冻藏品质保持及蛋白抗氧化方面表现更好,因此CO2麻醉-断尾放血可以作为冻藏草鱼的优选宰杀方式。
[1] 董双林. 论我国水产养殖业生态集约化发展[J].中国渔业经济, 2015, 33(5):4-9.
DONG S L.On ecological intensification of aquaculture systems in China[J].Chinese Fisheries Economics, 2015, 33(5):4-9.
[2] MATOS E, GONÇALVES A, NUNES M L, et al.Effect of harvesting stress and slaughter conditions on selected flesh quality criteria of gilthead seabream (Sparus aurata)[J].Aquaculture, 2010, 305(1-4):66-72.
[3] ZHANG L T, ZHANG Y Q, JIA S L, et al.Stunning stress-induced textural softening in silver carp (Hypophthalmichthys molitrix) fillets and underlying mechanisms[J].Food Chemistry, 2019, 295:520-529.
[4] 范秀萍, 张家胜, 郭侨玉, 等.珍珠龙胆石斑鱼CO2麻醉无水保活效果的因素影响[J].广东海洋大学学报, 2021, 41(6):73-81.
FAN X P, ZHANG J S, GUO Q Y, et al.Effect of CO2 anesthesia on water-free live-transport of the grouper (Epinephelus fuscoguttatus♀ × Epinephelus laceolatus♂)[J].Journal of Guangdong Ocean University, 2021, 41(6):73-81.
[5] DONG Y X, ZHANG H Z, MEI J, et al.Effect of different stunning methods on antioxidant status, myofibrillar protein oxidation, and gelation properties of large yellow croaker during postmortem[J].Food Chemistry:X, 2023, 18:100709.
[6] CAMPAGNOLI DE OLIVEIRA FILHO P R, DO AMARAL SOBRAL P J, DE CARVALHO BALIEIRO J C, et al.Comparison of stunning methods on the physicochemical properties of frozen Nile Tilapia (Oreochromis niloticus) fillets[J].Journal of Aquatic Food Product Technology, 2017, 26(3):325-334.
[7] LU H, LIU X C, ZHANG Y M, et al.Effects of chilling and partial freezing on rigor mortis changes of bighead carp (aristichthys nobilis) fillets:Cathepsin activity, protein degradation and microstructure of myofibrils[J].Journal of Food Science, 2015, 80(12):C2725-C2731.
[8] YU D W, REGENSTEIN J M, ZANG J H, et al.Inhibitory effects of chitosan-based coatings on endogenous enzyme activities, proteolytic degradation and texture softening of grass carp (Ctenopharyngodon idellus) fillets stored at 4 ℃[J].Food Chemistry, 2018, 262:1-6.
[9] PAN J F, SHEN H X, LUO Y K.Changes in salt extractable protein and Ca2+-ATPase activity of mince from silver carp (Hypophthalmichthys mollitrix) during frozen storage:A kinetic study[J].Journal of Muscle Foods, 2010, 21(4):834-847.
[10] ZHANG L T, LI Q, HONG H, et al.Prevention of protein oxidation and enhancement of gel properties of silver carp (Hypophthalmichthys molitrix) surimi by addition of protein hydrolysates derived from surimi processing by-products[J].Food Chemistry, 2020, 316:126343.
[11] LI D P, JIA S L, ZHANG L T, et al.Effect of using a high voltage electrostatic field on microbial communities, degradation of adenosine triphosphate, and water loss when thawing lightly-salted, frozen common carp (Cyprinus carpio)[J].Journal of Food Engineering, 2017, 212:226-233.
[12] 赵瑞云. 金枪鱼鱼肉匀浆和肌原纤维蛋白黏度特性及其与品质的相关性[D].上海:上海海洋大学, 2017.
ZHAO R Y.The viscosity of homogenate and myofibrillar protein of tuna and the correlation between viscosity and quality[D].Shanghai:Shanghai Ocean University, 2017.
[13] ZHANG D, LI H J, EMARA A M, et al.Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles[J].Food Chemistry, 2020, 315:126226.
[14] 戴志远, 崔雁娜, 王宏海.不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究[J].食品与发酵工业, 2008, 34(8):188-191.
DAI Z Y, CUI Y N, WANG H H.Changes of textural properties of cultured pseudosciaena crocea muscle under different frozen storage conditions[J].Food and Fermentation Industries, 2008, 34(8):188-191.
[15] 王琪, 梅俊, 谢晶.低温保活运输对海鲈鱼应激及品质的影响[J].中国食品学报, 2022, 22(7):203-213.
WANG Q, MEI J, XIE J.Effects of low temperature and alive transportation on stress and meat quality of sea bass (Lateolabrax maculatus)[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):203-213.
[16] ANDERS N, BREEN M, SKÅRA T, et al.Effects of capture-related stress and pre-freezing holding in refrigerated sea water (RSW) on the muscle quality and storage stability of Atlantic mackerel (Scomber scombrus) during subsequent frozen storage[J].Food Chemistry, 2023, 405:134819.
[17] SCHERER R, AUGUSTI P R, BOCHI V C, et al.Chemical and microbiological quality of grass carp (Ctenopharyngodon idella) slaughtered by different methods[J].Food Chemistry, 2006, 99(1):136-142.
[18] BARTON B A.Stress in fishes:A diversity of responses with particular reference to changes in circulating corticosteroids[J].Integrative and Comparative Biology, 2002, 42(3):517-525.
[19] DELBARRE-LADRAT C, CHÉRET R, TAYLOR R, et al.Trends in postmortem aging in fish:Understanding of proteolysis and disorganization of the myofibrillar structure[J].Critical Reviews in Food Science and Nutrition, 2006, 46(5):409-421.
[20] BEKHIT A E D A, HOLMAN B W B, GITERU S G, et al.Total volatile basic nitrogen (TVB-N) and its role in meat spoilage:A review[J].Trends in Food Science &Technology, 2021, 109:280-302.
[21] 徐建国. 二氧化碳的生理影响和临床意义[J].国外医学资料.麻醉与复苏, 1980, 1(1):1-8.
XU J G.Physiological effects and clinical significance of carbon dioxide[J].International Journal of Anesthesiology and Resuscitation, 1980, 1(1):1-8.
[22] ZENG X Y, JIAO D X, YU X N, et al.Effect of ultra-high pressure on the relationship between endogenous proteases and protein degradation of Yesso scallop (Mizuhopecten yessoensis) adductor muscle during iced storage[J].Food Chemistry:X, 2022, 15:100438.
[23] AHMED Z, DONKOR O, STREET W A, et al.Calpains- and cathepsins-induced myofibrillar changes in post-mortem fish:Impact on structural softening and release of bioactive peptides[J].Trends in Food Science &Technology, 2015, 45(1):130-146.
[24] ZHUANG S, LI Y, HONG H, et al.Effects of ethyl lauroyl arginate hydrochloride on microbiota, quality and biochemical changes of container-cultured largemouth bass (Micropterus salmonides) fillets during storage at 4 ℃[J].Food Chemistry, 2020, 324:126886.
[25] 王发祥, 李强, 俞健, 等.草鱼冷藏过程中肌肉蛋白质结构特征的变化[J].食品与发酵工业, 2015, 41(6):196-199.
WANG F X, LI Q, YU J, et al.Changes in structural properties of muscle protein in grass carp during cold storage[J].Food and Fermentation Industries, 2015, 41(6):196-199.
[26] 李学鹏, 周明言, 周凯, 等.大黄鱼冻藏过程中肌原纤维蛋白氧化及其功能性质的变化[J].中国食品学报, 2018, 18(7):171-179.
LI X P, ZHOU M Y, ZHOU K, et al.Changes of myofibrillar protein oxidation and functional properties in large yellow croaker (Pseudosciaena crocea) during frozen storage[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):171-179.
[27] 刘颖, 付湘晋.肉制品中活泼羰基化合物累积规律及促蛋白质氧化研究进展[J].食品科技, 2017, 42(5):102-105.
LIU Y, FU X J.Accumulation and effect on protein oxidation of active carbonyl compounds in meat products[J].Food Science and Technology, 2017, 42(5):102-105.
[28] ZHANG L T, LI Q, JIA S L, et al.Effect of different stunning methods on antioxidant status, in vivo myofibrillar protein oxidation, and the susceptibility to oxidation of silver carp (Hypophthalmichthys molitrix) fillets during 72 h postmortem[J].Food Chemistry, 2018, 246:121-128.
[29] DE OLIVEIRA P, GIRAO P, DE MELO M, et al.Indicators of stress tilapia subjected to different stunning methods[J].Boletim Do Instituto De Pesca, 2015, 41(2):335-343.
[30] LIU Q, CHEN Q, KONG B H, et al.The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J].LWT-Food Science and Technology, 2014, 57(2):603-611.
[31] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes:A review[J].Meat Science, 2011, 89(2):111-124.
[32] HUFF LONERGAN E, ZHANG W G, LONERGAN S M.Biochemistry of postmortem muscle—Lessons on mechanisms of meat tenderization[J].Meat Science, 2010, 86(1):184-195.
[33] WANG Y Y, LIU X F, JIANG P F, et al.Inhibition of protein denaturation and oxidation of prepared shrimp paste by sturgeon skin collagen peptide[J].Food Bioscience, 2024, 58:103766.
[34] HUFF-LONERGAN E, LONERGAN S M.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science, 2005, 71(1):194-204.
[35] 孙蕾蕾, 黄卉, 李来好, 等.影响宰后鱼肉能量代谢和质构的酶及其活性测定方法研究进展[J].食品科学, 2014, 35(11):348-355.
SUN L L, HUANG H, LI L H, et al.Enzymes associated with postmortem energy metabolism and texture of fish muscle and assays to detect them[J].Food Science, 2014, 35(11):348-355.
[36] 李学鹏, 陈杨, 王金厢, 等.冷藏大菱鲆新鲜度评价辅助蛋白指标和指示物[J].中国食品学报, 2018, 18(4):193-202.
LI X P, CHEN Y, WANG J X, et al.Studies on the auxiliary evaluation indexes and indicators of freshness for refrigerated turbot(Scophthalmus maximus)[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(4):193-202.
[37] MEHTA N K, ELAVARASAN K, REDDY A M, et al.Effect of ice storage on the functional properties of proteins from a few species of fresh water fish (Indian major carps) with special emphasis on gel forming ability[J].Journal of Food Science and Technology, 2014, 51(4):655-663.
[38] JIANG L F, WU S J.Pullulan suppresses the denaturation of myofibrillar protein of grass carp (Ctenopharyngodon idella) during frozen storage[J].International Journal of Biological Macromolecules, 2018, 112:1171-1174.