随着生活水平的提高,人们越来越关注饮食和食物成分之间的关系及其对健康的影响,更多的消费者开始寻找更健康的加工食品。猪肉、牛肉中的固体脂肪含有饱和脂肪酸和反式脂肪酸,若人们摄入过量,会增加患肥胖、心血管疾病和Ⅱ型糖尿病的风险[1]。消费者越来越担忧由高脂饮食引起的健康问题,与此同时,许多研究者关注开发更具营养特性的肉制品的新方法,最常用的策略是减少动物脂肪或用膳食纤维、食用植物油或油凝胶代替动物脂肪。由于油凝胶的质地和结构稳定,其已被认为是替代固体脂肪的合适对象,可以用来提高肉制品的营养和品质[2]。鱼油的ω-3多不饱和脂肪酸含量高,主要是二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)组成,EPA和DHA已被证明可以改善神经元、视网膜、大脑和心血管健康以及免疫功能[3],但其与空气接触容易被氧化,导致感官特性退化,营养价值丧失,限制了鱼油在食品制剂中的使用。因此,提高鱼油的氧化稳定性仍然是一个挑战。
油凝胶化是一种有效的物理过程,制备油凝胶的凝胶剂种类有很多,如蜡种类中的蜂蜡,是生产油凝胶最常见的结构形成剂之一[4],蜂蜡可以将植物油或鱼油转化为半固体或固体凝胶相,而不会改变脂肪酸组成[5],有助于蜂蜡鱼油凝胶作为脂肪替代品添加到肉制品中。G MEZ-ESTACA等[6]将鱼油、橄榄油和姜黄素混合制备成蜂蜡油凝胶作为猪肉汉堡的脂肪替代品,使产品更易保存,拓宽了其在商业中的应用;TARTÉ等[7]将米糠蜡和传统的大豆油混合制备成油凝胶作为香肠中的脂肪替代品,使患心血管疾病的风险因素减小,促进了香肠的商业可行性;KIM等[8]使用葡萄籽油作为脂肪替代品替代猪肉脂肪,使瘦肉具有更强的硬度。
MEZ-ESTACA等[6]将鱼油、橄榄油和姜黄素混合制备成蜂蜡油凝胶作为猪肉汉堡的脂肪替代品,使产品更易保存,拓宽了其在商业中的应用;TARTÉ等[7]将米糠蜡和传统的大豆油混合制备成油凝胶作为香肠中的脂肪替代品,使患心血管疾病的风险因素减小,促进了香肠的商业可行性;KIM等[8]使用葡萄籽油作为脂肪替代品替代猪肉脂肪,使瘦肉具有更强的硬度。
目前,油凝胶以植物油作为油相的研究较多,其特性方面的研究已经较为成熟,而关于使用鱼油制备油凝胶的报道还较为少见。鱼油保藏温度耗能大,限制了鱼油在食品制备中的应用,寻找合适的保藏温度保藏蜂蜡鱼油凝胶并系统分析其物理特性,对于开发新型鱼油产品具有重要意义。本研究以沙丁鱼油作为基料油,蜂蜡作为凝胶剂,研究不同保藏温度(-80、-18、4、25 ℃)对蜂蜡鱼油凝胶物理特性的影响,确定蜂蜡鱼油凝胶的最适保藏温度,为鱼油的工业化应用提供理论依据,开发其巨大的应用价值和市场潜力。
1 材料与方法
1.1 材料与试剂
沙丁鱼油(食用级),陕西天雷生物科技有限公司;天然蜂蜡(食用级),东光县汇恒蜡制品厂;猪油(食用级),四川高金食品股份有限公司。
1.2 仪器与设备
智能数显磁力加热搅拌器,杭州米欧仪器有限公司;CX43型光学显微镜,日本Olympus公司;JIDI-20R型台式多用途高速冷冻离心机,广州吉迪仪器有限公司;TA-XTplus型物性分析仪,英国SMS公司;HAAKE-MARSⅢ型高级模块化流变仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 凝胶样品制备
参考韩宗元等[9]、刘书成等[10]的方法并稍作修改。取若干个100 mL的烧杯,称取10%的蜂蜡在60 ℃预热后加入到装有鱼油的烧杯中,在80 ℃下加热搅拌,直到得到澄清的溶液。然后将溶液取出,于常温冷却至蜂蜡鱼油凝胶(F)形成,再转入-80、-18、4和25 ℃的温度中保藏24 h备用,分别命名为-80F、-18F、4F和25F。以猪油(L)为材料,在上述4种温度中保藏,并命名为-80L、-18L、4L和25L 4个对照组。
1.3.2 外观形态观测
将制备的油凝胶样品分装至20 mL具塞透明玻璃瓶中,分别瓶口向上、向下放置进行拍照,观测蜂蜡鱼油凝胶外观形态。
1.3.3 保油率测定
参考MENG等[11]的方法并稍作修改。称取离心空管质量,记为m0,取一定量蜂蜡鱼油凝胶样品于5 mL的离心管中,称取质量记为m1,室温10 000 r/min离心15 min后,倒置离心管30 min,以析出液体油,用滤纸吸干液体油后称量剩余样品和离心管的总质量计为m2,通过公式(1)计算保油率(oil-binding capacity,OBC)。
(1)
式中:m0,离心空管质量,g;m1,蜂蜡鱼油凝胶样品质量,g;m2,经上述条件反应后剩余样品和离心管的总质量,g。
1.3.4 硬度和凝胶强度测定
硬度和凝胶强度的测定参考ZHU等[12]的方法并稍作修改。采用物性分析仪测定蜂蜡鱼油凝胶的凝胶强度。选用直径10 mm的圆柱形P10探针,测试前速度2 mm/s,测试中速度1 mm/s,测试后速度2 mm/s,穿刺距离20 mm,触发值0.01 N。
1.3.5 油凝胶流变行为分析
静态流变和动态流变参考PAN等[13]的方法并稍作修改。取适量蜂蜡鱼油凝胶均匀涂于直径为35 mm的平行板(P35)上,所有样品均在25 ℃下进行,几何间隙1 mm。
静态流变是测定不同剪切速率下蜂蜡鱼油凝胶的表观黏度,分别测定-80、-18、4、25 ℃条件下保藏的蜂蜡鱼油凝胶表观黏度,剪切速率范围0.01~100 s-1,固定应变0.01%。
动态流变的测定是对-80、-18、4、25 ℃条件下保藏的蜂蜡鱼油凝胶进行动态频率扫描,固定振幅,频率范围为1~10 Hz,记录扫描过程中样品随频率变化的G′和G″。
1.3.6 微观结构观察
参考CHENG等[5]的方法并稍作修改。取蜂蜡鱼油凝胶样品20 μL于载玻片中间,轻轻盖上盖玻片,避免气泡产生,置于光学显微镜载物台上进行观察。使用ImageJ软件对盒计数分形维数(Db)进行定量分析。计算如公式(2)所示:
Db=-logΝε/logε
(2)
式中:N,分型实体中单位长度的数量;ε,单位长度和原图相比的缩小比例。通过图像分析得到的Db基于二维空间的计算。
1.3.7 数据统计分析
质构实验重复6次,其他实验重复3次,结果数据为“平均值±标准偏差”。使用JMP Pro 16统计软件对数据进行方差分析和Tukey’s HSD多重比较分析,置信度为95%(P<0.05)。
2 结果与分析
2.1 蜂蜡鱼油凝胶的外观形态
由图1可知,10%的蜂蜡鱼油凝胶在4种保藏温度下均不流动,制备的油凝胶均形成相对稳定的凝胶结构,瓶倒置时内壁均无液体流动,质地较为均匀。不同保藏温度下形成的蜂蜡鱼油凝胶呈现淡黄色和不透明状态,其颜色接近鱼油本身的颜色,对照组在不同保藏温度下均呈现乳白色和不透明状态。因此,在4种保藏温度下鱼油凝胶均形成了凝胶结构。

图1 不同保藏温度中鱼油凝胶的外观形态图
Fig.1 Morphological diagram of fish oil oleogel at different storage temperatures
2.2 蜂蜡鱼油凝胶的保油率
蜡型油凝胶的保油率是决定其在食品中的功能的主要特征之一[14]。保油率应当与油凝胶样品的机械强度相关,因为蜂蜡具有较高的结晶度,与鱼油混合制备的油凝胶形成了稳定的凝胶网络。10%蜂蜡鱼油凝胶在4、-18和-80 ℃保藏温度下的保油率均达到99%以上,无显著性差异(P>0.05)。由图2可知,在4、-18和-80 ℃保藏温度下的保油率与25 ℃相比显著升高,说明较低温度更有利于蜂蜡鱼油凝胶的保藏。通过试验表明,添加10%蜂蜡、在4 ℃下保藏的蜂蜡鱼油凝胶的保油率可达到100%,蜂蜡鱼油凝胶的稳定性高,这可能是因为该温度下保藏使油凝胶的分子结构更紧密[15],凝胶网络不易被破坏。由上述分析可知,降低保藏温度能提高保油率,减少保藏过程中油的损失,但同样在保藏温度为4 ℃制备而成的猪油的保油率低至90%,存在显著差异(P<0.05),这可能与猪油的结构性质有关,在4 ℃保藏的猪油聚合物网络中的半结晶可引起油凝胶的失油[11]。在4 ℃保藏的蜂蜡鱼油凝胶其晶体网络能够提供更大的吸收表面积,具有更高的保油率,这与DOAN等[16]对蜂蜡油凝胶凝胶化的研究结果趋势相似。由此说明,4 ℃的保藏温度下鱼油凝胶的保油率高,最适宜蜂蜡鱼油凝胶保藏。
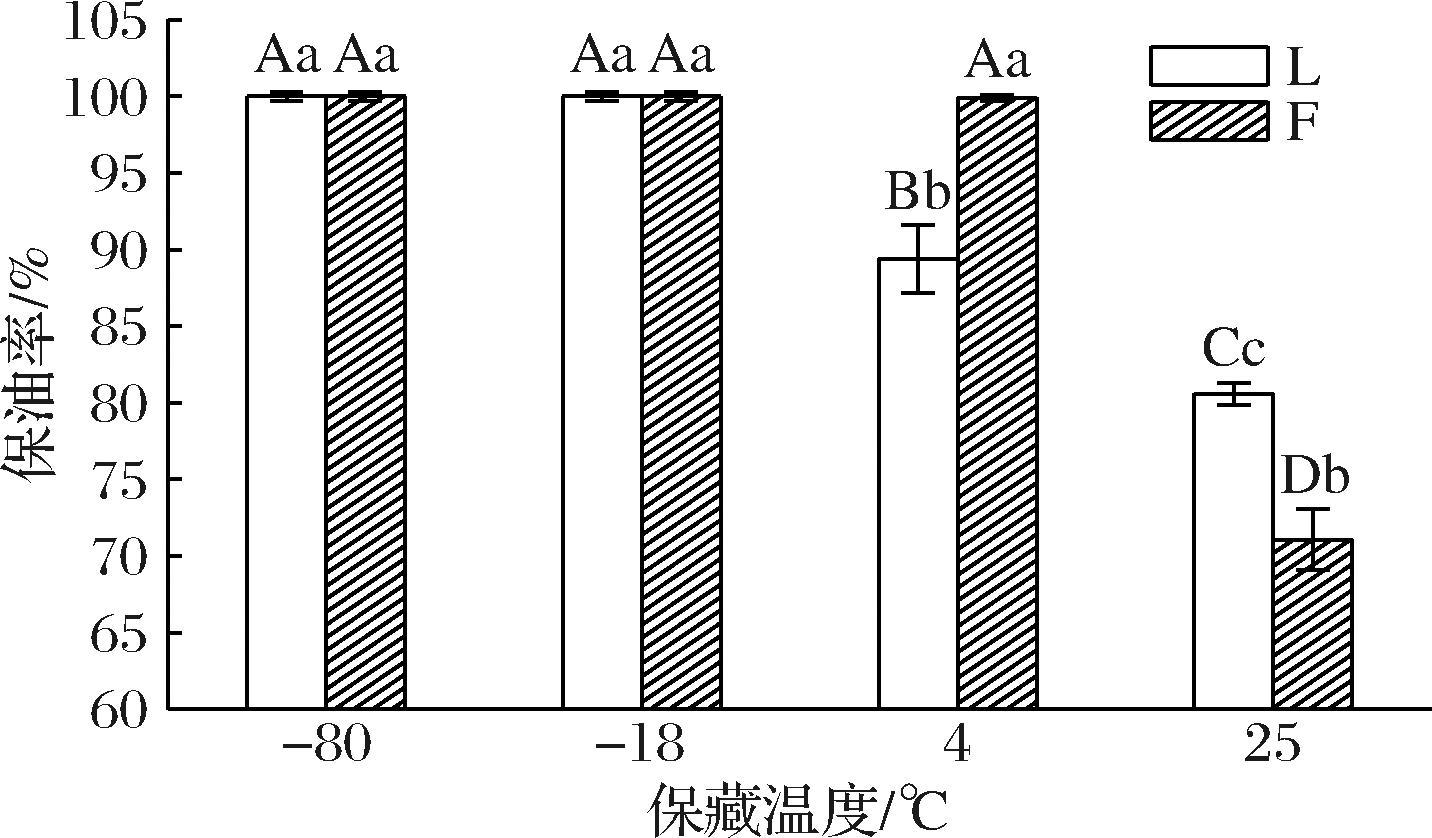
图2 不同保藏温度对鱼油凝胶保油率的影响
Fig.2 Effect of different shelf life temperatures on the oil retention rate of fish oil oleogel
注:不同大写字母代表所有样品的均值具有显著性差异(P<0.05);不同小写字母代表同种油脂加工过程之间具有显著性差异
(P<0.05)(下同)。
2.3 蜂蜡鱼油凝胶硬度
凝胶硬度是凝胶最重要的结构特征,较高的硬度值被认为是油凝胶的理想性能[17]。由图3可知,硬度随着保藏温度的降低而显著提高(P<0.05),说明保藏温度对蜂蜡鱼油凝胶和对照组的硬度影响很大。在-80 ℃保藏的蜂蜡鱼油凝胶和在-18、-80 ℃保藏的对照组的硬度值超出仪器测量范围,可能的原因是过低的温度诱导更快的成核,导致更多的晶体失配和分支。极性组分对油凝胶网络的结构有显著影响,从而导致油凝胶的结构性质发生显著变化[18]。与25 ℃保藏相比,在4 ℃保藏的蜂蜡鱼油凝胶的硬度显著增大,说明随着保藏温度的降低,凝胶与油相之间的网络结构变得更强,这有两个可能的原因:4 ℃保藏可以减小油凝胶晶体网络的孔径[19],从而增加网络结构的密度,最终导致油凝胶硬度的增加;4 ℃保藏时鱼油凝胶内部形成的氢键、范德华力等非共价键之间的相互作用力增大,导致包裹液体油的三维网络结构的紧密性增加[20],根据凝胶-凝胶相互作用以及溶剂性质,会形成强或弱凝胶,从而防止相分离,该结果与SARKISYAN等[21]对蜂蜡油凝胶的研究结果趋势相似。在25 ℃保藏的蜂蜡鱼油凝胶和对照组的硬度均较小,可能是随着温度的升高,分子间作用力下降,油从油凝胶中分离,硬度特征下降。由此说明,在4 ℃保藏有利于形成硬度适宜的蜂蜡鱼油凝胶,且相较于-18 ℃保藏节约能源。
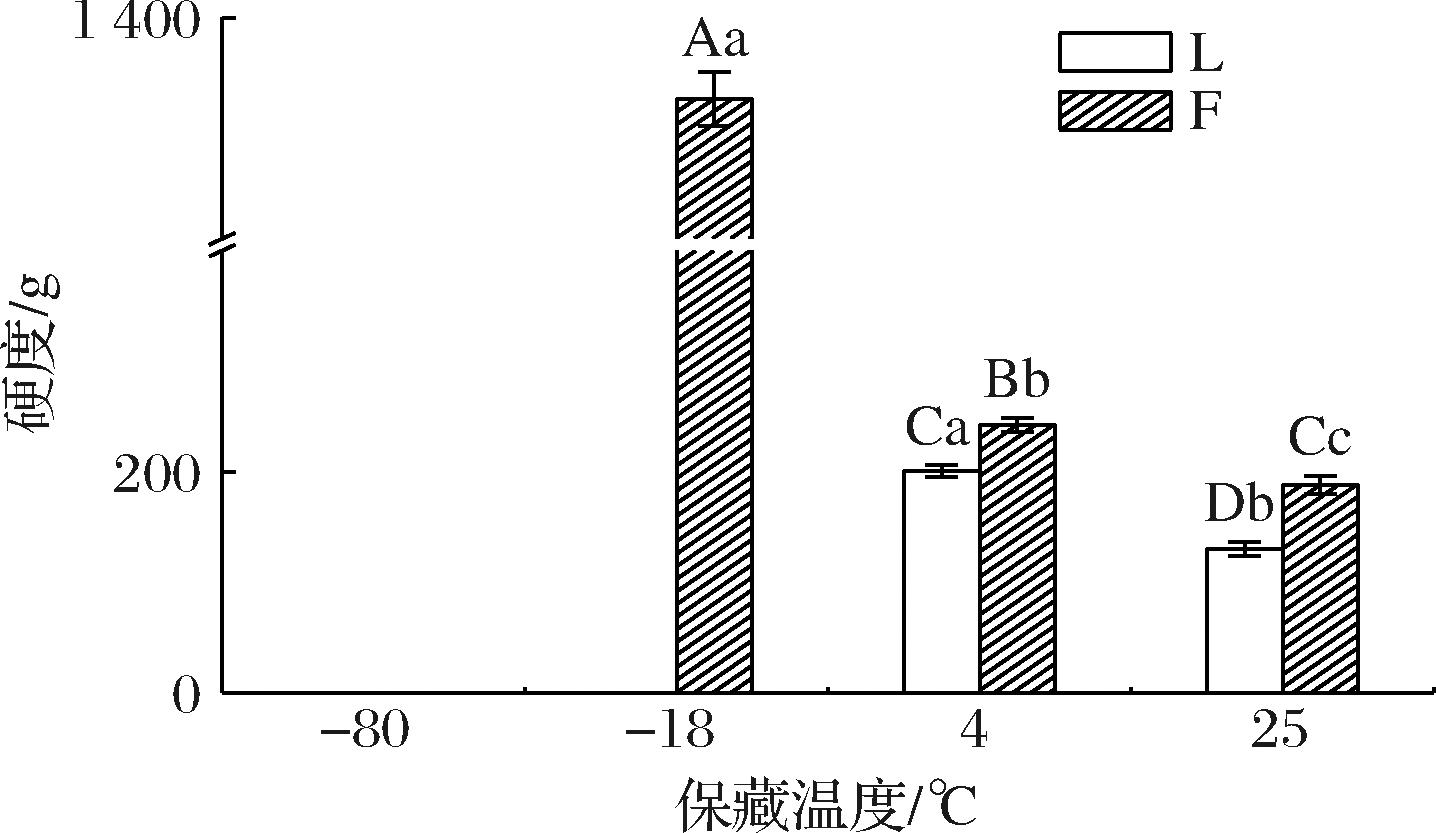
图3 不同保藏温度对鱼油凝胶硬度的影响
Fig.3 Effect of different shelf life temperatures on the gel hardness of fish oil oleogel
2.4 蜂蜡鱼油凝胶的凝胶强度
凝胶强度是能反映高分子材料分子结构稳定的一个参数,其被定义为破碎力和变形量的乘积[22]。蜡晶体网络的形态和结构决定油凝胶的凝胶强度,高熔点蜂蜡形成的致密针状网络能提供较强的机械性能。由图4所示,降低保藏温度,蜂蜡鱼油凝胶的凝胶强度显著增大。在25 ℃的保藏温度下,蜂蜡鱼油凝胶和对照组的凝胶强度均较小,可能的原因是保藏温度较高,延缓了成核和晶体的形成,导致晶体更大、密度更低,从而导致凝胶强度更弱[23]。在4 ℃的保藏温度下,对照组的凝胶强度显著高于蜂蜡鱼油凝胶,可能的原因是较低的保藏温度会增加蜂蜡晶体在液体油中的溶解度和黏度,从而抑制结晶。蜂蜡鱼油凝胶在-80 ℃保藏温度和对照组在-18和-80 ℃保藏温度下,凝胶的硬度值超出仪器测量范围(未经过解冻除去表面冷凝水后进行测量),故无法测量,可能的原因是过低的温度诱导更快的成核,导致更多的晶体失配和分支。由此说明,凝胶强度不是由单个物质的物理、化学性质决定的,而是由所有内部物质的相互作用决定的,保藏温度直接影响成核和结晶动力学,可以调节晶体网络[24]。上述结果表明,在4 ℃保藏有利于形成高强度的蜂蜡鱼油凝胶,且相较于-18 ℃保藏节约能源。
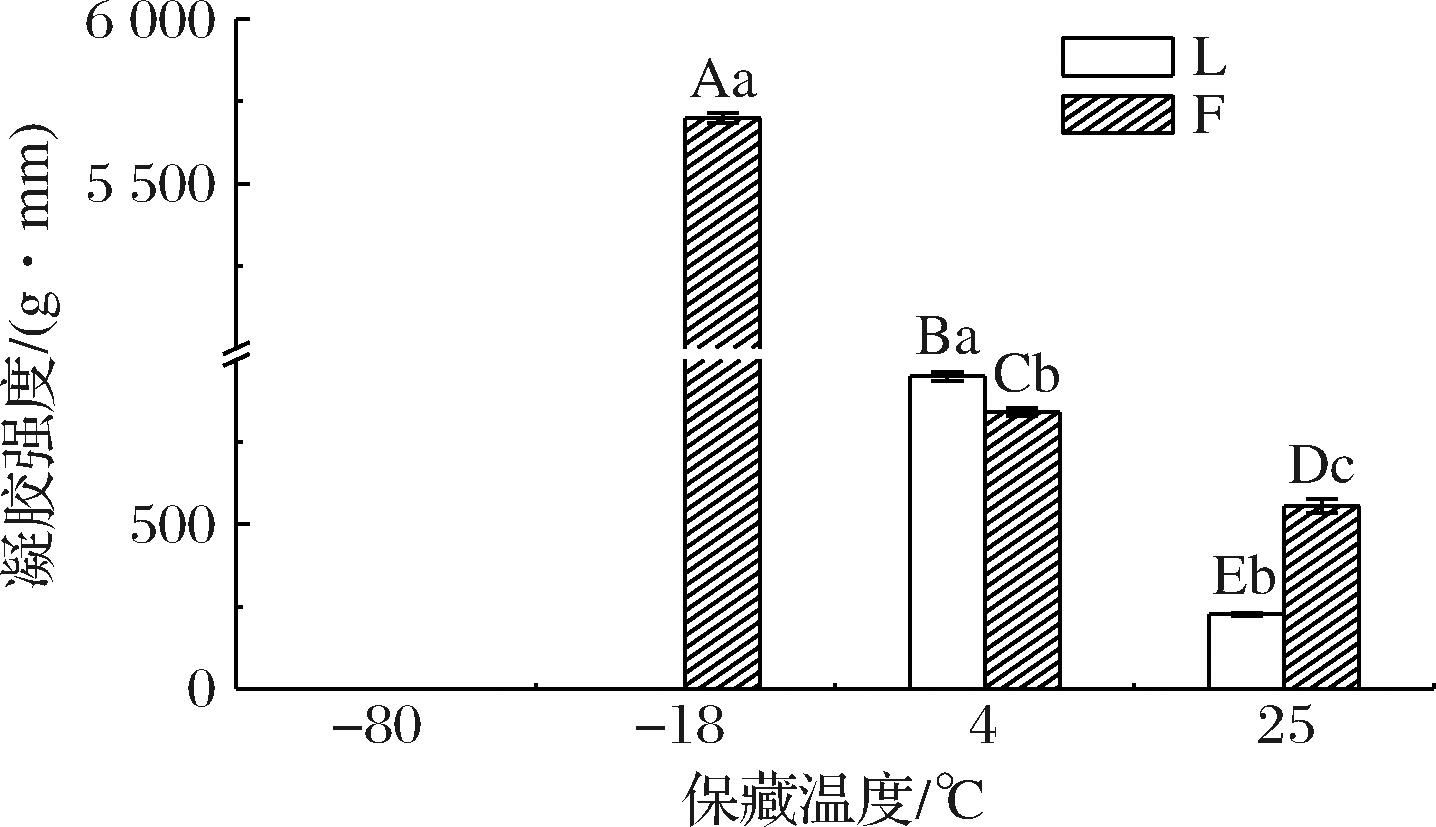
图4 不同保藏温度对鱼油凝胶强度的影响
Fig.4 Effect of different shelf life temperatures on the gel strength of fish oil oleogel
2.5 蜂蜡鱼油凝胶的流变行为
2.5.1 静态流变行为
静态流变行为是在一定剪切作用下,聚合物流体在固定方向上产生的形变。不同保藏温度下蜂蜡鱼油凝胶表观黏度随剪切速率的变化如图5所示。在-80 ℃保藏的蜂蜡鱼油凝胶样品和在-18 和-80 ℃保藏的对照组由于保藏温度过低,油凝胶的表观黏度过大,无法使用仪器进行测量。由图5可以看出,随着剪切速率的增加,表观黏度均逐渐降低,流变曲线表现出剪切稀化和屈服应力行为。黏度随剪切速率的增加而降低,表明蜂蜡鱼油凝胶中存在弱网络结构,且随着剪切速率的增加,蜂蜡鱼油凝胶的表观黏度均大于对照组,这可能是因为高剪切速率下蜂蜡鱼油凝胶结构的有序分布使其流动阻力降低,从而产生剪切稀化特性[25],所以各温度下的蜂蜡鱼油凝胶相较于对照组的表观黏度曲线更加平缓。与-80、-18、25 ℃保藏相比,4 ℃保藏后的蜂蜡鱼油凝胶表观黏度的变化趋势较小,进一步说明该温度下保藏的蜂蜡鱼油凝胶体系稳定性增加。
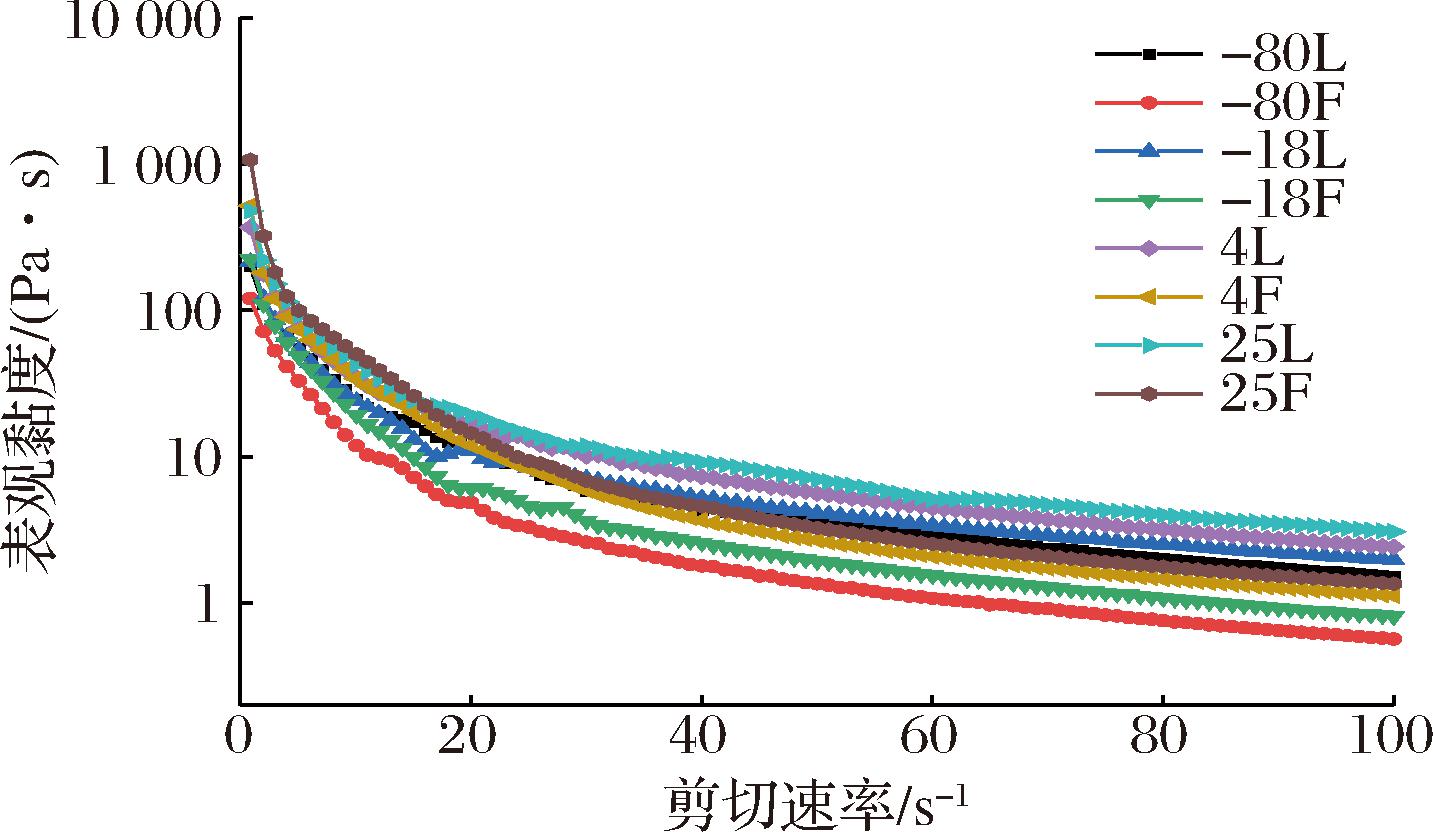
图5 不同保藏温度对鱼油凝胶表观黏度的影响
Fig.5 Effect of different storage temperatures on the apparent viscosity of fish oil oleogel
2.5.2 动态流变行为
在多相体系中,如聚合物共混物,可以通过黏弹性研究来监测结构和配位强度。动态流变揭示了组分对弹性模量(G′)和黏性模量(G″)的影响[26]。不同保藏温度形成的蜂蜡鱼油凝胶的流变性能如图6所示。首先通过应力扫描确定不同蜂蜡鱼油凝胶样品的线性黏弹区,随后在线性黏弹区内,通过频率扫描得到样品的G′和G″,发现蜂蜡鱼油凝胶样品均表现出固体性行为(G′>G″),油凝胶的G′值高于G″值,表明其具有更强的弹性特征。整个频率范围呈动态稳定趋势,说明蜂蜡鱼油凝胶样品内部形成了相对致密的凝胶结构,内部由强晶体连接,具有良好的变形耐受能力,这与ZHAO等[27]对油橄榄凝胶作为饼干的脂肪替代品的研究结果相似。除了在-80 ℃保藏的蜂蜡鱼油凝胶样品和在-18和-80 ℃保藏的对照组无法使用仪器进行测量外,由图6可以看出,随着频率的增大,油凝胶G′和G″曲线的正斜率均逐渐减小,在4 ℃保藏温度中蜂蜡鱼油凝胶与对照组的G′的曲线均呈稳定不变的趋势,说明适宜的保藏温度增强了油凝胶的稳定性。在相同频率中,蜂蜡鱼油凝胶的G′和G″显著高于对照组,这可能是因为蜂蜡鱼油凝胶中的蜂蜡晶体形成了更强的网络。蜂蜡鱼油凝胶在频率为4~6 Hz时G″发生突变,可能的原因是在蜂蜡存在的情况下,油凝胶内部的疏水相互作用和范德华力相互作用(主要来自蜡酯和甘油三酯)加强了油凝胶之间的物理交联,导致G″峰值较高。由此说明在适宜的保藏温度下,油凝胶结晶度越高,G′和G″值也越高,这一结果与HAN等[28]对不同多不饱和脂肪酸油脂的蜂蜡基油橄榄的结晶网络结构及稳定性的研究结果趋势相似。总的来说,动态流变学结果表明,适宜的保藏温度可以增加油凝胶的结晶度,有助于晶体网络更好地形成和更好地油凝胶化,从而进一步影响油凝胶的稳定性。
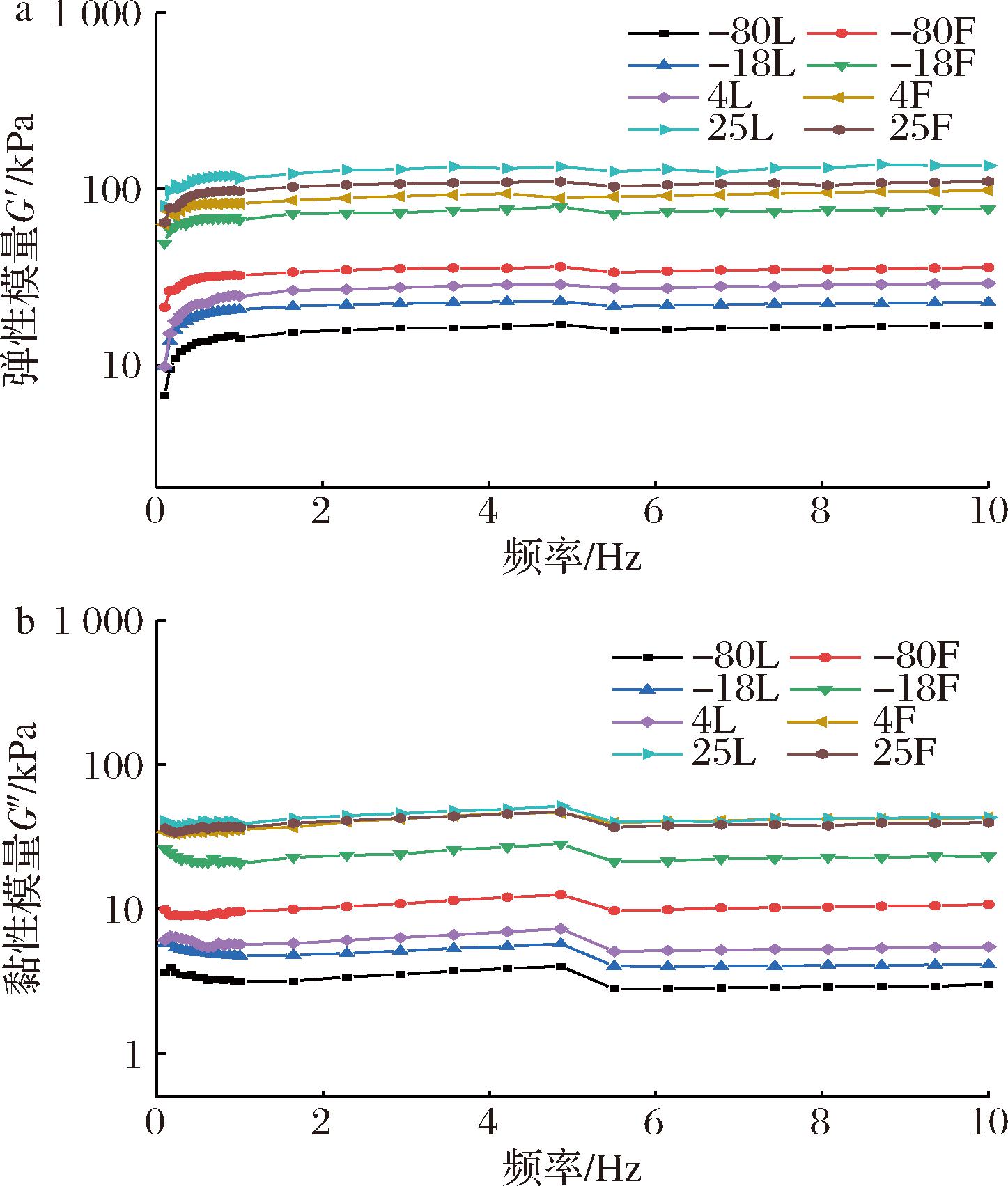
a-弹性模量;b-黏性模量
图6 不同保藏温度对鱼油凝胶弹性模量(G′)和黏性模量(G″)的影响
Fig.6 Effects of different storage temperature on the elastic modulus (G′) and viscous modulus (G″) of fish oil oleogel
2.6 微观结构
不同保藏温度形成的蜂蜡基油凝胶的微观结构如图7所示。在不同保藏温度下保藏的蜂蜡鱼油凝胶的晶体状态为针状或板状,说明保藏温度对蜂蜡鱼油凝胶的微观影响程度较大。由图7可知,-18和-80 ℃样品在室温下观测,由于温差较大导致样品融化,此时的晶体细小、分布稀疏,这与孟宗等[29]对植物蜡及液态植物油构建油凝胶的物性研究趋势相似。蜂蜡作为有效的胶凝剂,能形成稳定的三维网络结构,进而将大量的液态油捕获形成一个凝胶状结构,实现连续相液态油的固定化。晶体网络结构决定塑性脂肪机械特性和感官特性,蜂蜡鱼油凝胶与传统塑性脂肪在分子水平结构上都表现出“同质多晶”现象。其中α、β、β′是脂肪晶体的3种常见晶型,稳定性和熔点依次升高。蜂蜡晶体均以β′晶型为主,β′晶型表现为垂直正交形态,具有均匀细小的针状晶体,是生产塑性脂肪的理想晶型,能够使塑性脂肪呈现光滑、细腻的外观[30]。在脂肪结晶的过程中,控制不同的结晶条件可以使油脂表现出不同的晶型,从而调控脂肪结晶网络结构,获得理想的脂肪。与25 ℃保藏相比,4 ℃保藏的蜂蜡鱼油凝胶样品晶体分布更为密集,形成的凝胶网络结构更紧密,这可能是由于晶体生长速度的差异造成的[31],且在该温度下保藏的蜂蜡鱼油凝胶的晶体结构呈更加明显的细针状,相邻晶体之间距离较小,这是因为平行于晶层平面的晶体生长速度比垂直于晶层平面的晶体生长速度慢,产生具有针状或片状形貌的薄晶体。与球形晶体相比,针状晶体具有更强的相互作用,因此能够更好地捕获液态油[32]。对照组与蜂蜡鱼油凝胶的微观图上存在差异,对照组的微观结构更不规则,这可能与球状晶体有关,球状晶体不利于大量油脂的保留[33]。由此说明,在适宜的保藏温度下,蜂蜡鱼油凝胶结晶完全,容易形成均匀的晶体。综上所述,在4 ℃保藏可以改善蜂蜡鱼油凝胶的结晶度,从而提高晶体网络结构的一致性。
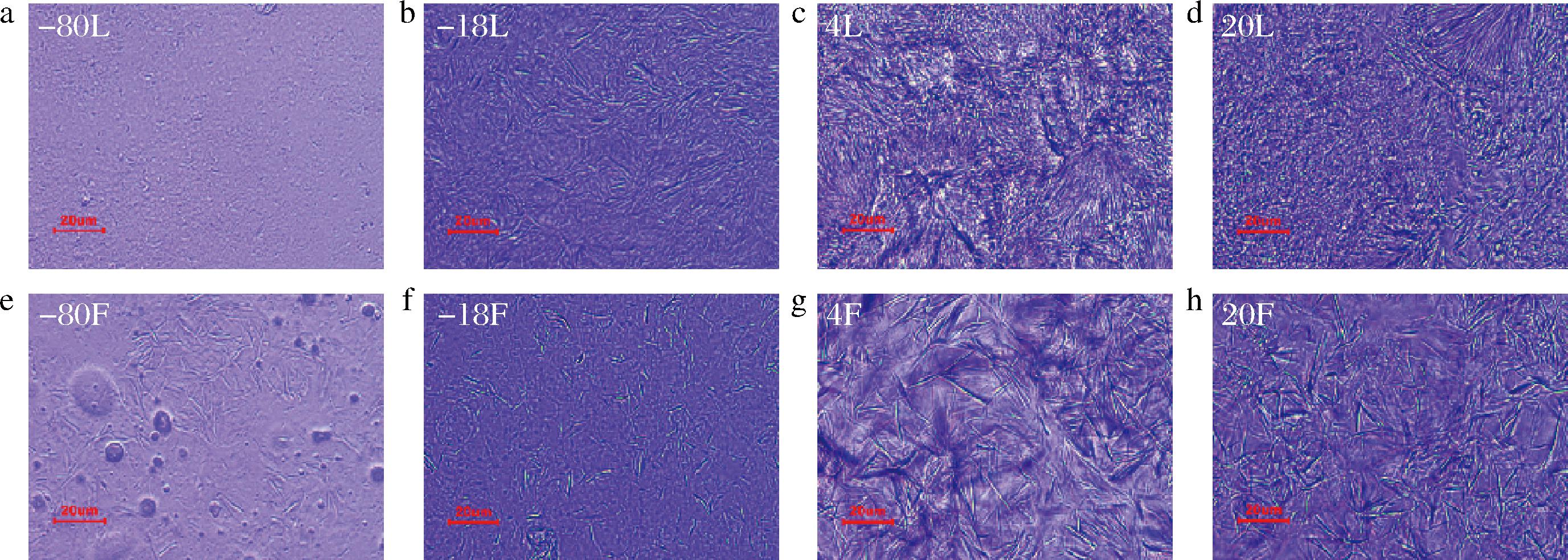
a--80L;b--18L;c-4L;d-20L;e--80F;f--18F;g-4F;h-20F
图7 不同保藏温度对鱼油凝胶微观结构的影响
Fig.7 Microstructure diagram of fish oil oleogel at different shelf life
晶体分布的均匀性通过晶体网络的分形维度(Db)进行了评估。Db反映了晶体成核机制和晶体行为。由图8看出,25、-18和-80 ℃保藏下蜂蜡沙丁鱼油凝胶的Db均显著低于4 ℃保藏。这可能是因为较高的保藏温度会影响晶核的形成数量和生长方向,导致晶体的大小、分布、生长方向发生变化,无法形成牢固的连接区[34],导致25 ℃保藏的鱼油凝胶Db值略低;较低的温度加速了晶体的成核和生长,促进了针状晶体的形成,增加了网络结构的密度,所以4 ℃保藏的鱼油凝胶Db值最高;更低的温度抑制了晶核的形成数量和生长方向,因此-18和-80 ℃保藏的鱼油凝胶Db值低于4 ℃保藏的沙丁鱼油凝胶。JANA等[35]证明了结晶网络的分布与冷却速度有关,冷却速率的增加导致成核速率的增加以及晶体尺寸的减小,降低了网络结构的密度。由此说明,在4 ℃保藏的沙丁鱼油凝胶的分型维度最高,稳定性好。

图8 不同保藏温度中鱼油凝胶的分型维度图
Fig.8 Dimension diagram of fish oil oleogel at different storage temperatures
3 结论
4 ℃的保藏温度有利于蜂蜡鱼油凝胶保持良好的机械性能和塑性脂肪的熔化特性。4 ℃保藏的蜂蜡鱼油凝胶保油率、硬度及凝胶强度均更高,并且在该保藏温度下油凝胶中的组装结构体排列的更加规整,油凝胶稳定性更好,最终形成了更加完整且坚固的凝胶体系。综上所述,4 ℃保藏后形成的蜂蜡鱼油凝胶的稳定性好、效果最佳,并且在该保藏温度下设备能耗较低,节约能源。为生产富含ω-3多不饱和脂肪酸的蜂蜡鱼油凝胶提供了数据支持。此外,经4 ℃保藏后的蜂蜡鱼油凝胶在食品方面的应用有待进一步深入研究。
[1] PATEL A R, LECERF J M, SCHENKER S, et al.The contribution of modern margarine and fat spreads to dietary fat intake[J].Comprehensive Reviews in Food Science and Food Safety, 2016, 15(3):633-645.
[2] DOS SANTOS M, OZAKI M M, RIBEIRO W O, et al.Emulsion gels based on pork skin and dietary fibers as animal fat replacers in meat emulsions:An adding value strategy to byproducts[J].LWT, 2020, 120:108895.
[3] AITTA E, DAMERAU A, MARSOL-VALL A, et al.Enzyme-assisted aqueous extraction of fish oil from Baltic herring (Clupea harengus Membras) with special reference to emulsion-formation, extraction efficiency, and composition of crude oil[J].Food Chemistry, 2023, 424:136381.
[4] FROLOVA Y, SARKISYAN V, SOBOLEV R, et al.The influence of edible oils’ composition on the properties of beeswax-based oleogels[J].Gels, 2022, 8(1):48.
[5] CHENG K X, PAN Y M, HAN Z Y, et al.A sight of self-assembly mechanism in fish oil oleogels:Phase transition, crystal structure and non-covalent interaction[J].Food Chemistry, 2024, 433:137323.
[6] G MEZ-ESTACA J, PINTADO T, JIMÉNEZ-COLMENERO F, et al.The effect of household storage and cooking practices on quality attributes of pork Burgers formulated with PUFA- and curcumin-loaded oleogels as healthy fat substitutes[J].LWT, 2020, 119:108909.
MEZ-ESTACA J, PINTADO T, JIMÉNEZ-COLMENERO F, et al.The effect of household storage and cooking practices on quality attributes of pork Burgers formulated with PUFA- and curcumin-loaded oleogels as healthy fat substitutes[J].LWT, 2020, 119:108909.
[7] TARTÉ R, PAULUS J S, ACEVEDO N C, et al.High-oleic and conventional soybean oil oleogels structured with rice bran wax as alternatives to pork fat in mechanically separated chicken-based bologna sausage[J].LWT, 2020, 131:109659.
[8] KIM T K, YONG H I, JUNG S, et al.Effects of replacing pork fat with grape seed oil and gelatine/alginate for meat emulsions[J].Meat Science, 2020, 163:108079.
[9] 韩宗元, 刘雨杉, 梁嘉翰, 等.冷却方式对蜂蜡基鱼油凝胶宏观性质与微观结构的影响[J].广东海洋大学学报, 2023, 43(5):60-66.
HAN Z Y, LIU Y S, LIANG J H, et al.Effect of cooling mode on macroscopic properties and microstructure of beeswax-based fish oil oleogel[J].Journal of Guangdong Ocean University, 2023, 43(5):60-66.
[10] 刘书成, 马健康, 王蔚雯, 等.蜂蜡添加量对鱼油凝胶宏观性质及微观结构的影响[J].中国食品学报, 2024, 24(4):90-98.
LIU S C, MA J K, WANG W W, et al.Effect of beeswax addition on the macroscopic properties and microstructure of sardine fish oleogel[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(4):90-98.
[11] MENG Z, QI K Y, GUO Y, et al.Effects of thickening agents on the formation and properties of edible oleogels based on hydroxypropyl methyl cellulose[J].Food Chemistry, 2018, 246:137-149.
[12] ZHU S C, CHEN X C, ZHENG J N, et al.Emulsion surimi gel with tunable gel properties and improved thermal stability by modulating oil types and emulsification degree[J].Foods, 2022, 11(2):179.
[13] PAN Y M, SUN Q X, LIU Y, et al.The relationship between rheological and textural properties of shrimp surimi adding starch and 3D printability based on principal component analysis[J].Food Science &Nutrition, 2021, 9(6):2985-2999.
[14] NOONIM P, RAJASEKARAN B, VENKATACHALAM K.Structural characterization and peroxidation stability of palm oil-based oleogel made with different concentrations of carnauba wax and processed with ultrasonication[J].Gels, 2022, 8(12):763.
[15] CHANG T, WANG C J, WANG X F, et al.Effects of soybean oil, moisture and setting on the textural and color properties of surimi gels[J].Journal of Food Quality, 2015, 38(1):53-59.
[16] DOAN C D, TAVERNIER I, OKURO P K, et al.Internal and external factors affecting the crystallization, gelation and applicability of wax-based oleogels in food industry[J].Innovative Food Science &Emerging Technologies, 2018, 45:42-52.
[17] ZHONG Y J, YANG L, DAI T T, et al.Flavonoids enhance gel strength of ovalbumin:Properties, structures, and interactions[J].Food Chemistry, 2022, 387:132892.
[18] MARTINS A J, CERQUEIRA M A, FASOLIN L H, et al.Beeswax organogels:Influence of gelator concentration and oil type in the gelation process[J].Food Research International, 2016, 84:170-179.
[19] BLAKE A I, MARANGONI A G.The use of cooling rate to engineer the microstructure and oil binding capacity of wax crystal networks[J].Food Biophysics, 2015, 10(4):456-465.
[20] 傅红, 张虹, 郑丽婷, 等.有机凝胶构筑液态油脂晶体网络的研究进展[J].中国粮油学报, 2015, 30(2):136-141.
FU H, ZHANG H, ZHENG L T, et al.Research advance of fat crystal network of liquid oil structured by organogels[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(2):136-141.
[21] SARKISYAN V, SOBOLEV R, FROLOVA Y, et al.A study of the quantitative relationship between yield strength and crystal size distribution of beeswax oleogels[J].Gels, 2022, 8(1):39.
[22] HUANG J L, YE B B, WANG W, et al.Incorporation effect of inulin and microbial transglutaminase on the gel properties of silver carp (Hypophthalmichthys molitrix) surimi[J].Journal of Food Measurement and Characterization, 2021, 15(1):1-11.
[23] LIU L Y, ACOSTA RAMIREZ I S, YANG J S, et al.Evaluation of oil-gelling properties and crystallization behavior of Sorghum wax in fish oil[J].Food Chemistry, 2020, 309:125567.
[24] LIU L Y, CIFTCI O N.Effects of high oil compositions and printing parameters on food paste properties and printability in a 3D printing food processing model[J].Journal of Food Engineering, 2021, 288:110135.
[25] QI W H, LI T, ZHANG Z S, et al.Preparation and characterization of oleogel-in-water Pickering emulsions stabilized by cellulose nanocrystals[J].Food Hydrocolloids, 2021, 110:106206.
[26] MENG Q, WANG Q, CHEN L, et al.Rheological properties and thickening effect of high molecular weight exopolysaccharide and intracellular polysaccharide from Schizophyllum commune[J].Food Hydrocolloids, 2023, 144:108920.
[27] ZHAO M X, LAN Y, CUI L Q, et al.Physical properties and cookie-making performance of oleogels prepared with crude and refined soybean oil:A comparative study[J].Food &Function, 2020, 11(3):2498-2508.
[28] HAN W J, CHAI X H, LIU Y F, et al.Crystal network structure and stability of beeswax-based oleogels with different polyunsaturated fatty acid oils[J].Food Chemistry, 2022, 381:131745.
[29] 孟宗, 李陆茵, 李兴伟, 等.植物蜡及液态植物油构建油凝胶的物性研究[J].中国油脂, 2019, 44(11):17-22.
MENG Z, LI L Y, LI X W, et al.Physical properties of oleogels strutured by vegetable wax and liquid vegetable oil[J].China Oils and Fats, 2019, 44(11):17-22.
[30] 孙雅晖, 韩立娟, 苏凌志, 等.κ-卡拉胶对蜂蜡基乳液凝胶微观结构和性质的影响[J].食品科学, 2023, 44(12):25-33.
SUN Y H, HAN L J, SU L Z, et al.Effect of κ-carrageenan on the microstructure and properties of beeswax-based emulsion gels[J].Food Science, 2023, 44(12):25-33.
[31] DREHER J, BLACH C, TERJUNG N, et al.Influence of protein content on plant-based emulsified and crosslinked fat crystal networks to mimic animal fat tissue[J].Food Hydrocolloids, 2020, 106:105864.
[32] KODA R, ORIGASA T, NAKAJIMA T, et al.Observing bubble cavitation by back-propagation of acoustic emission signals[J].IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2019, 66(5):823-833.
[33] SHI Z J, CAO L L, KANG S M, et al.Influence of wax type on characteristics of oleogels from Camellia oil and medium chain triglycerides[J].International Journal of Food Science &Technology, 2022, 57(4):2003-2014.
[34] HAN W J, CHAI X H, ZAABOUL F, et al.Beeswax crystals form a network structure in highly unsaturated oils and O/W emulsions under supersaturation and cool temperature conditions[J].LWT, 2022, 164:113594.
[35] JANA S, MARTINI S.Effect of high-intensity ultrasound and cooling rate on the crystallization behavior of beeswax in edible oils[J].Journal of Agricultural and Food Chemistry, 2014, 62(41):10192-10202.