智能包装是一种能够在产品流通与销售过程中自动监测、记录和传输产品实时状况和环境条件,从而达到监测、溯源等功能的系统。智能包装在食品领域的应用,不仅可优化库存管理,减少食品浪费和经济损失,也便于消费者及时获取食品品质和安全信息[1]。目前,用于感知食品品质或贮藏环境的食品智能包装指示器按工作原理可分为三大类:传感器类、指示标签类、数据载体类[2]。新鲜度指示型智能包装一般通过特异性地感知或识别食品品质劣变过程中产生的特定物质,将其转化为颜色、光、电等信号来指示食品的新鲜度变化[3]。
鲜牛奶具有营养丰富,活性物质含量高等特点,市场份额逐年递增。但经巴氏杀菌后,鲜牛奶中仍然存在部分嗜热菌、耐热性菌及芽孢,货架期通常仅为2~7 d,且极易受储运条件和包装密封性等因素的影响[4]。一方面,误食变质牛奶后会对消费者的健康造成较为严重的威胁;另一方面,临期但未变质的牛奶常常被丢弃而造成食品浪费。因此,如能将新鲜度指示器用于牛奶包装,实时准确地对牛奶的新鲜度进行指示,对于保障食品安全和减少浪费均有重要意义。
由于鲜牛奶的变质通常伴随酸度的增加,因此可通过制备pH响应变色的指示器来表征其新鲜度。花青素是一种安全无毒的天然色素,基本结构为3,5,7-三羟基-2苯基苯并吡喃[5]。在不同的pH下,花青素会发生相应的结构变化,导致其对可见-紫外光的吸收发生变化而呈现出不同的颜色,因而具有良好的pH敏感特性[6]。同时,花青素具有较强的抗氧化性,且安全无毒,因此除了作为食品色素以外,近年来也被广泛用于制备食品新鲜度指示器。研究者们通常将花青素与天然高分子复合制备成复合膜,目前已成功用于新鲜牛肉[7]、鸡肉[8]、鱼[9]、虾[10]等肉类的新鲜度指示。相较于新鲜肉类,新鲜度指示膜在鲜牛奶中的应用研究相对较少,且通常在牛奶变质时的颜色变化不明显[11]。主要原因可能是鲜牛奶变质时的pH变化较小,因此需对指示膜中花青素的来源、化学组成和复合膜基材进行优化,从而提高其对牛奶的新鲜度指示灵敏性[12]。
基于此,本研究分别从蝶豆花、桑葚、紫薯中提取了3种花青素,将其添加到可溶性淀粉(soluble starch,SS)和聚乙烯醇(polyvinyl alcohol,PVA)基材中制备复合膜,在对3种膜的结构和性能进行表征后,比较了3种膜对鲜牛奶新鲜度的指示效果,以期筛选出具有较高灵敏度的牛奶新鲜度指示标签,以推动其在鲜牛奶包装中的实际应用。
1 材料与方法
1.1 材料与试剂
蝶豆花干花、冻干桑葚和新鲜紫薯,均购自重庆本地市场;天友鲜牛奶,购自重庆永辉超市,均为当天生产的巴氏杀菌乳。
可溶性淀粉(分析纯),天津市科密欧化学试剂有限公司;丙三醇(分析纯),成都金山化学试剂有限公司;聚乙烯醇(分析纯,平均聚合度为1 799±50),成都市科隆化学品有限公司。
1.2 仪器与设备
SCW-500电子拉力试验机、W3/060水蒸气透过率测试仪,济南兰光机电技术有限公司;TU-1950紫外-可见分光光度计,北京普析通用;Spectrum Two傅里叶红外光谱仪,美国PerkinElmer公司;phenom Pro 10102电子扫描显微镜,荷兰phenom world公司。
1.3 花青素的提取
蝶豆花花青素(butterfly pea flower anthocyanins,BPA)的提取参照采用薛瑾[13]的方法,稍作修改。具体步骤如下:选取干燥的蝶豆花,去除花萼后45 ℃下干燥至恒重,然后粉碎至粉末,称取一定质量加入到浓度为75%的乙醇溶液中,固液比为1∶10(g∶mL),在4 ℃下萃取48 h。将混合物抽滤后得到滤液,旋蒸去除乙醇后得到花青素浓缩液,冷冻干燥后得到花青素粉末。
桑葚花青素和紫薯花青素的提取参照HE等[14]的方法。将冻干桑葚或干燥后的紫薯块粉碎后,按照1∶10(g∶mL)的固液比将50 g桑葚粉末加入到500 mL乙醇和盐酸的混合溶液中(乙醇和盐酸的质量分数分别为80%和1%)中,4 ℃下萃取48 h。然后经旋蒸和冻干分别得到桑葚花青素(mulberry anthocyanins,MA)和紫薯花青素(purple potato anthocyanins,PPA)粉末。
1.4 花青素溶液的表征
1.4.1 pH敏感性测定
称取一定量的上述3种花青素粉末,分别溶解于一定量的去离子水中,得到花青素质量分数均为10%的3种花青素溶液。分别吸取一定量的上述3种花青素溶液加入到10 mL pH值为3~11的缓冲液中,摇匀后避光静置15 min,观察并拍照记录溶液颜色。
1.4.2 紫外-可见吸收光谱测定
配制质量分数均为5%的3种花青素溶液,分别滴加一定量至10 mL pH值为3~11的缓冲液中,摇匀后,采用紫外-可见分光光度计测定其在400~800 nm波长范围的紫外-可见吸收光谱。
1.5 花青素复合膜的制备
称取1 g可溶性淀粉分散于100 mL去离子水中,搅拌至完全溶解后,加入1 g聚乙烯醇,在90 ℃水浴下加热搅拌2 h至粉末完全溶解,得到混合溶液。然后,缓慢滴入与该混合溶液体积比为1∶100的丙三醇,搅拌30 min得到均匀混合的溶液。待其冷却后,分别加入质量分数为24%(以可溶性淀粉和聚乙烯醇总干重计)的蝶豆花、桑葚、紫薯花青素粉末,室温下搅拌30 min得到混合膜液。量取56 mL膜液倒入边长为120 mm的正方形聚苯乙烯培养皿中,在温度设置为35 ℃的干燥箱中干燥至溶剂完全挥发,分别得到蝶豆花花青素复合膜(SS/PVA-BPA)、桑葚花青素复合膜(SS/PVA-MA)和紫薯花青素复合膜(SS/PVA-PPA)。将薄膜小心揭取下来后,在温度为(23±2) ℃、相对湿度为(50±5)%的条件下储存备用。制备不含花青素的薄膜(SS/PVA)时除不添加花青素外,其余步骤与上述相同。
1.6 花青素复合膜的表征
1.6.1 复合膜的红外光谱测定
采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪的透过模式对各膜样品进行扫描。扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描4次。
1.6.2 复合膜在不同pH下的颜色测定
为验证复合膜对pH的敏感性,将复合膜裁剪为尺寸2 cm×2 cm的正方形,浸没于不同pH(3、4、5、6、7、8、9、10、11)的缓冲液中,待其颜色稳定后取出,观察并拍照记录复合膜的颜色变化。
1.6.3 复合膜的微观结构表征
通过扫描电子显微镜,在合适的视野中采集膜的微观图像。膜样品经过溅射喷金处理。
取一定尺寸的膜样品在液氮中淬断得到横截面,然后将膜表面和横截面样品分别用导电胶固定在样品台上进行喷金处理。用扫描电子显微镜分别观察膜的表面和横截面,加速电压为10 kV。
1.6.4 复合膜的厚度与机械性能测定
分别在复合膜上随机取10个点,用电子测厚仪测定其厚度,精确到0.001 mm,结果以平均值±标准差的形式表示。
拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EB)的测定方法参考GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》,将待测样品裁剪成尺寸为120 mm×10 mm长条,固定于电子拉力机的夹头上,初始夹距为100 mm,拉伸速度为100 mm/min,至样品拉断为止。每组样品测试10个平行,计算平均值与方差。抗拉强度和断裂伸长率的计算公式见式(1)和式(2)。
TS/MPa=F/(w×d)
(1)
式中:TS,拉伸强度,MPa;F,试样拉伸过程中承受的最大拉力,N;w,试样宽度,mm;d,试样厚度,mm。
EB/%=l1/l0×100
(2)
式中:EB,断裂伸长率,%;l1,试样断裂时的拉伸长度,mm;l0,试样初始夹距,mm。
1.6.5 复合膜的水蒸气透过系数测定
参考GB/T 1037—2021《塑料薄膜与薄片水蒸气透过性能测定 杯式增重与减重法》的测试方法,对其稍作修改,使用水蒸气透过率仪在温度为29 ℃,湿度为70%的条件下,测定复合膜的水蒸气透过系数。
1.6.6 复合膜的含水率、溶胀度、溶解度的测定
采用质量分析法测定薄膜含水率。将复合膜裁剪成尺寸为1 cm×1 cm的正方形,放置于105 ℃的烘箱中干燥24 h,对复合膜进行测量至恒重。
根据BERTOLO等[15]及秦靖萱[16]的方法稍作修改,将复合膜裁剪成尺寸为1 cm×1 cm的样条,测定溶解度和溶胀度。将复合膜试样放在105 ℃条件下烘干至恒重,得到初始质量m0。然后将试样放入20 mL的烧杯中,加入15 mL的去离子水,在25 ℃下保存24 h,用滤纸轻轻擦去试样表面的水,然后称重得到m1。再置于105 ℃的烘箱中烘干至恒重,得到最终质量m2。
溶解度和溶胀度的计算如公式(3)(4)所示:
溶解度/%=(m0-m2)/m0×100
(3)
溶胀度/%=(m1-m0)/m0×100
(4)
1.7 花青素复合膜用于牛奶的新鲜度指示
将花青素复合膜分别在室温下放置0、12、24、36和48 h的鲜牛奶中,浸泡2~3 min后取出观察颜色变化,并拍照记录。
1.7.1 牛奶中菌落总数的测定
将当天生产的巴氏杀菌鲜牛奶放置于25 ℃下贮藏,每隔12 h取样,按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》对牛奶贮存期间的菌落总数进行测定。以GB 19645—2010《食品安全国家标准 巴氏杀菌乳》的细菌总数标准对牛奶的品质进行评价。
1.7.2 牛奶中pH的测定
取少量牛奶置于无菌无霉的烧杯中,利用pH计测得牛奶的pH值。
1.7.3 牛奶中滴定酸度的测定
根据 GB 5009.239—2016《食品安全国家标准 食品酸度的测定》测定巴氏杀菌乳的酸度。称取10 g牛奶样品于150 mL的锥形瓶中,加入20 mL煮沸后冷却至室温的蒸馏水,混匀,加入2 mL酚酞指示剂,混匀后用物质的浓度为0.1 mol/L的NaOH溶液进行滴定﹐直到样品颜色与参比溶液的颜色相近且5 s内不消退为止,整个滴定过程控制在45 s内完成。记录消耗的NaOH标准溶液滴定体积,根据公式(5)计算牛奶样品的酸度:
X=c×(V1-V0)/(m×0.1)
(5)
式中:X,样品的酸度,°T;c,NaOH标准溶液的物质的浓度,mol/L;V1,样品滴定时所消耗NaOH标准溶液的体积,mL;V0,空白实验所消耗NaOH标准溶液的体积,mL;m,样品的质量,g。
1.8 数据处理
除特别指出外,各数据均做3组平行实验,结果表示为平均值±标准差。数据采用单因素方差(One-way ANOVA)和Duncan’s多重比较法进行显著性分析,差异显著性水平为0.05。
2 结果与分析
2.1 花青素的pH颜色响应性
图1所示为分别从蝶豆花、桑葚、紫薯提取的3种花青素溶解在pH值为 3~11的缓冲溶液中,放置0和24 h后的外观颜色。3种花青素在不同pH值下呈现出不同的颜色,即均有较为灵敏的pH响应性。这是由于花青素在较低pH值(2~3)下是以红色阳离子的形式存在。随着pH值的升高,花青素发生水合反应,一方面可形成无色的甲醇假碱结构进而转变微黄色的查尔酮结构,另一方面也可形成蓝紫色的醌类,因此其颜色变化主要由这几种物质在不同pH值下的浓度所共同决定[17]。同时,从图1中可看出3种花青素的颜色随pH值的变化各不相同,其中蝶豆花花青素溶液的颜色经历了紫色-蓝紫-蓝绿-绿色的变化,桑葚花青素溶液为橘红-紫红-紫色,紫薯花青素溶液的颜色最浅,颜色变化为粉红-浅粉-淡绿-黄绿。这可能是具有多种不同来源的花青素,其化学组成有较大差异,因此在不同pH值下所呈现出的颜色也有所不同。

图1 三种花青素溶液在pH 3~11缓冲液中的颜色和稳定性
Fig.1 Color and stability of three anthocyanin solutions in different pH 3-11 buffers
注:左图为新鲜配制的溶液,右图为放置24 h后的溶液。
放置24 h后,3种花青素溶液的颜色均有所加深,但蝶豆花花青素溶液的变化最小,而紫薯花青素颜色变化最大。这是由于不同来源的花青素其组成有所不同,酰化花青素含量较高时,其稳定性较好,这是因为酰基能够较好地延缓花青素的氧化。同时,在pH≤6时,3种花青素的颜色在放置24 h后变化较小,pH>6时,溶液颜色均有明显加深,尤其是桑葚和紫薯花青素颜色均转变为褐色。由此可看出,花青素的稳定性也与pH有关,在酸性条件下,花青素分子以黄烊盐阳离子形式存在, 结构较为稳定, 当 pH>6.0 时, 花青素分子结构向醌型碱形式转变,稳定性变差[18]。
图2为新鲜配制的3种花青素溶液的UV-Vis光谱图。3种花青素的吸收波长和强度均有较大差异,进一步说明了3种花青素的组成差异较大。但随着pH值由低到高变化,蝶豆花花青素和桑葚花青素的吸收光谱均从500 nm处的单一吸收峰逐渐变为400~650 nm的两个及以上吸收峰。这是由于随着pH的升高,花青素逐渐发生结构的转变,因此形成了具有多种不同形式结构的混合物,从而出现了多个吸收峰[17]。但紫薯花青素的吸收峰则随pH的升高而逐渐红移,且吸收强度减弱。
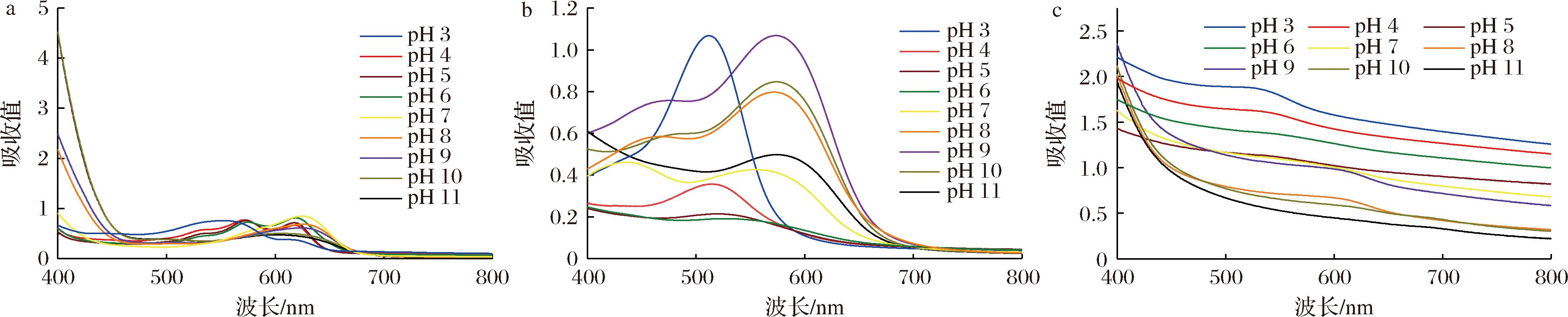
图2 三种花青素溶液在pH 3~11缓冲液中的UV-Vis光谱
Fig.2 UV-Vis spectra of three anthocyanin solutions in pH 3-11 buffers
2.2 复合膜的pH颜色响应性
将3种花青素分别添加到可溶性淀粉和聚乙烯基材中制备出复合膜,然后分别浸泡在pH 3~11的缓冲溶液中,其颜色变化如图3所示。3种复合膜在不同pH下具有不同的颜色,且颜色变化与图1中所示的3种花青素溶液颜色随pH的变化趋势较为一致,说明将花青素添加到淀粉中并没有改变其pH颜色响应性。同时,3种花青素膜中,添加蝶豆花花青素的SS/PVA-BPA在不同pH下的颜色变化最容易被肉眼所识别,具有最好的pH颜色响应性。WU等[19]分别将玫瑰叶提取物、枸杞提取物和桑葚提取物添加到魔芋葡甘露聚糖/玉米蛋白中制备复合膜,结果表明,由于3种花青素的化学组成和总花青素的含量有较大差异,它们不仅对薄膜的机械性能和气体透过性有不同影响,同时也会使薄膜表现出不同的pH响应性和挥发性氨的响应性。因此,在以花青素为指示剂制备新鲜度指示标签时,应根据食品的pH变化范围,筛选具有适宜pH变色灵敏度的花青素。

图3 三种花青素复合膜在不同pH缓冲液中的颜色
Fig.3 Colors of three anthocyanin composite films in pH 3-11 buffers
2.3 复合膜的红外谱图
复合膜的FTIR谱图如图4所示。SS/PVA的谱图中可观察到淀粉和聚乙醇两者的特征峰:993 cm-1处为淀粉的葡萄糖吡喃糖环骨架伸缩振动,1 416和1 033 cm-1处分别归属于聚乙烯醇的—CH2弯曲振动和C—O伸缩振动,2 920和3 283 cm-1处则分别为淀粉和聚乙烯醇共有的C—H伸缩振动和O—H伸缩振动[20]。添加3种花青素后,复合膜的谱图和SS/PVA相比变化较小,仅能观察到复合膜1 033 cm-1处的峰向低波数方向偏移,从而与993 cm-1处的峰发生重合在一起,可能是由花青素与淀粉、聚乙烯醇之间的氢键作用所导致。MIAO等[21]和QI等[22]分别研究了花青素和单一的淀粉与聚乙烯醇之间的相互作用,得到了类似结果,即花青素与这两种高分子之间仅存在氢键作用,因此对两者的红外光谱影响较小。但也正是由于花青素与基材之间主要为物理相互作用,因此添加到复合膜中的花青素能够较好地保持其pH颜色响应性。
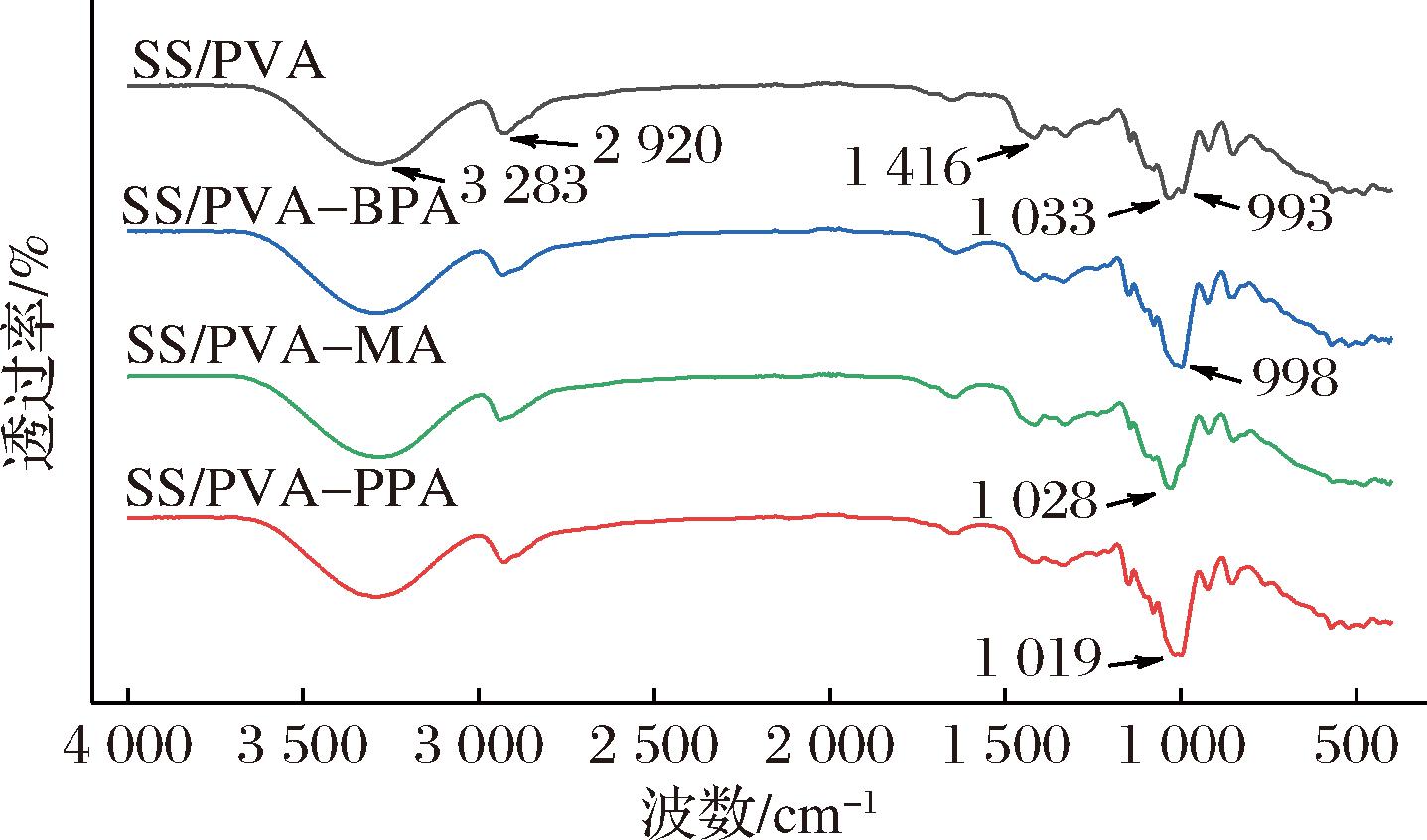
图4 复合膜的FTIR谱图
Fig.4 FTIR spectra of the composite films
2.4 复合膜的微观形貌
各复合膜的表面和横截面微观形貌如图5所示。SS/PVA膜的表面和横截面均呈现为致密均匀的结构,说明淀粉与聚乙烯醇之间具有良好的相容性。而添加不同种类的花青素对复合膜的微观结构影响也有所不同。其中,桑葚花青素对复合膜的结构影响最小,SS/PVA-MA膜表面虽然也有极少量小孔出现,但从横截面形貌可观察到复合膜的结构仍然保持了较为致密的结构。而SS/PVA-BPA膜的横截面则可观察到较多微米级的孔洞,SS/PVA-PPA膜则出现了很多细小的裂纹。由此说明,不同来源的花青素由于其化学组成的不同,对复合膜的微观形貌也有不同影响。

图5 复合膜的SEM图片
Fig.5 SEM images of the composite films
注:上图为表面,下图为横截面。
2.5 复合膜的机械性能
表1所示为3种复合膜的厚度和机械性能。可看出,添加蝶豆花和紫薯花青素以后,膜的厚度显著增加(P<0.05),但桑葚花青素的添加则对复合膜厚度无显著影响(P>0.05)。添加花青素后,复合膜的抗拉强度均显著下降。其中下降程度最低的是SS/PVA-MA,而强度降低最多的是SS/PVA-PPA,相较于SS/PVA下降了近50%。但不同来源的花青素对膜的断裂伸长率影响则各不相同。其中,添加桑葚花青素使膜的断裂伸长率提高了27.36%,添加蝶豆花花青素则使其降低了38.66%,而紫薯花青素则对其无显著影响(P>0.05)。总体而言,花青素分散在高分子中会起到类增塑作用,减少淀粉和聚乙烯醇的分子内或分子间氢键作用,从而使其拉伸强度降低。但不同来源的花青素中所含的其他物质如果胶等的种类和含量不同,对膜的机械性能也有不同影响[19]。各复合膜的微观形貌(图5)反映出,SS/PVA-MA的结构最为致密,说明桑葚花青素与基材之间具有较好的相容性,从而对复合膜的强度影响较小,且能提高其断裂伸长率,其他两种复合膜则出现了孔洞或裂缝,也是造成其机械性能显著下降的原因。
表1 复合膜的厚度和机械性能
Table 1 Mechanical properties of the composite films
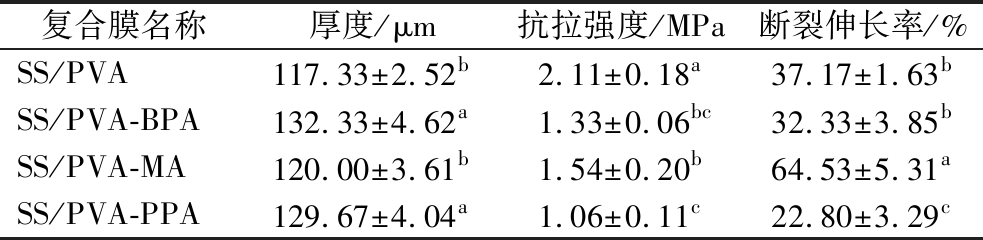
复合膜名称厚度/μm抗拉强度/MPa断裂伸长率/%SS/PVA117.33±2.52b2.11±0.18a37.17±1.63bSS/PVA-BPA132.33±4.62a1.33±0.06bc32.33±3.85bSS/PVA-MA120.00±3.61b1.54±0.20b64.53±5.31aSS/PVA-PPA129.67±4.04a1.06±0.11c22.80±3.29c
注:同列数值中的不同小写字母上标表示数据间存在显著性差异(P<0.05)(下同)。
2.6 复合膜的溶解度、溶胀度与水蒸气透过性能
复合膜的溶解度、溶胀度及水蒸气透过系数如表2所示。
表2 复合膜的溶解度、溶胀度及水蒸气透过系数
Table 2 Solubility, swelling and water vapor permeability coefficient of the composite films

复合膜名称溶解度/%溶胀度/%水蒸气透过系数/[×10-12 g·cm/(cm2·s·Pa)]SS/PVA38.38±1.66b13.09±1.78c6.86±0.05bSS/PVA-BPA35.61±0.31c43.06±4.03ab6.92±0.07bSS/PVA-MA41.16±0.89a37.16±5.45b5.97±0.11cSS/PVA-PPA38.53±0.96b49.37±3.74a7.16±0.03a
从表2中数据可看出,3种花青素对复合膜溶解度的影响各不相同,其中蝶豆花花青素显著降低了膜的溶解度(P<0.05),桑葚花青素使其显著增加(P<0.05),紫薯花青素则对其无显著影响(P>0.05)。对复合膜的溶胀度而言,3种花青素的添加均使其显著增加了2倍及以上(P<0.05),尤以SS/PVA-PPA复合膜的溶胀度最高,可能是由于花青素的添加降低了淀粉与聚乙醇的分子间氢键作用,使得膜的结构变得疏松,从而膜内部可容纳更多的水分子。与溶胀度结果类似,紫薯花青素的添加显著增加了复合膜的水蒸气透过系数(P<0.05),桑葚花青素使其显著降低(P<0.05),蝶豆花花青素则对其无显著影响(P>0.05)。水分子在薄膜中的透过速率是由吸附和扩散共同决定的,膜的结构越疏松,则使其扩散越容易,因此花青素对复合膜水蒸气透过系数的影响与溶胀度的影响类似。
2.7 复合膜在鲜牛奶新鲜度指示中的应用
牛奶由于其营养丰富、水分含量高,很容易被病原微生物所污染,巴氏杀菌的鲜牛奶中的致病菌检出率高达10%以上[23],且这些微生物的生长速率受牛奶贮藏条件的影响。牛奶中的某些微生物在生长繁殖过程中会产生乳酸、有机酸、CO2等代谢产物,从而引起牛奶pH的降低,因此采用pH响应性指示标签来实时指示其新鲜度变化,对于保证食品安全具有重要意义。图6-a所示为牛奶在25 ℃贮藏时的pH值和滴定酸度。可看出,牛奶的pH值在前12 h无显著变化,均为6.6以上(P>0.05),在第24 h时出现显著变化,降至6.5(P<0.05),而滴定酸度则在第36 h后才发生了显著变化(P>0.05)。图6-b所示为牛奶中的菌落总数变化以及与牛奶相接触的3种复合膜颜色变化。结果表明,牛奶中的微生物繁殖速度较快,菌落总数在贮藏12 h后就已经达到4.9 lg CFU/g,24 h时已经超过了GB 19645—2010《食品安全国家标准 巴氏杀菌乳》中规定的100 000 CFU/g,即5 lg CFU/g。与此同时,和鲜牛奶接触的3种复合膜颜色也随牛奶存储时间而发生变化,表1为各复合膜的颜色参数。其中,变化最明显的是SS/PVA-BPA膜,从湖蓝色(12 h)逐渐变为蓝色(24 h)和紫色(48 h),在牛奶变质时(12~24 h)具有肉眼可观察到的颜色变化。从颜色参数上也可看出(表3),随着牛奶储存时间的延长,复合膜的亮度显著降低,a*和b*值均显著升高,在24 h时,与第0 h的色差值ΔE为8.48,已经超过人眼可识别的色差阈值3[24]。其次为SS/PVA-MA膜,在12~24 h时也发生了肉眼可见的颜色变化(紫红-深红),与第0 h相比,第24 h时的颜色参数均发生了显著变化(P<0.05),且ΔE>3。而SS/PVA-PPA膜在整个牛奶的储存期内颜色变化均较小,第24 h时仅b*值有显著变化(P<0.05),且ΔE<3,因此不能用于牛奶的新鲜度指示。这一结果与复合膜在缓冲液中的颜色变化趋势(图3)较为一致,即当pH值在6~7变化时,SS/PVA-BPA和SS/PVA-MA的颜色变化较为明显,而S/PVA-PPA则只在更高或更低的pH范围内才有明显的颜色变化。同时,本研究中牛奶菌落总数超标时其pH值仅下降了0.1,因此引起的复合膜颜色变化相对有限。牛奶在贮藏过程中的pH变化可能与其被污染的微生物种类有关,MOAZAMI等[25]的研究结果则表明牛奶从新鲜到变质时,pH值均从6.6降至5.7。因此,新鲜度指示膜的颜色变化不仅与膜中所用的花青素种类有关,也受牛奶染菌情况的影响。
表3 与不同储存时间的牛奶接触的复合膜颜色参数变化
Table 3 Color parameters of the composite films in contact with milk of different storage time
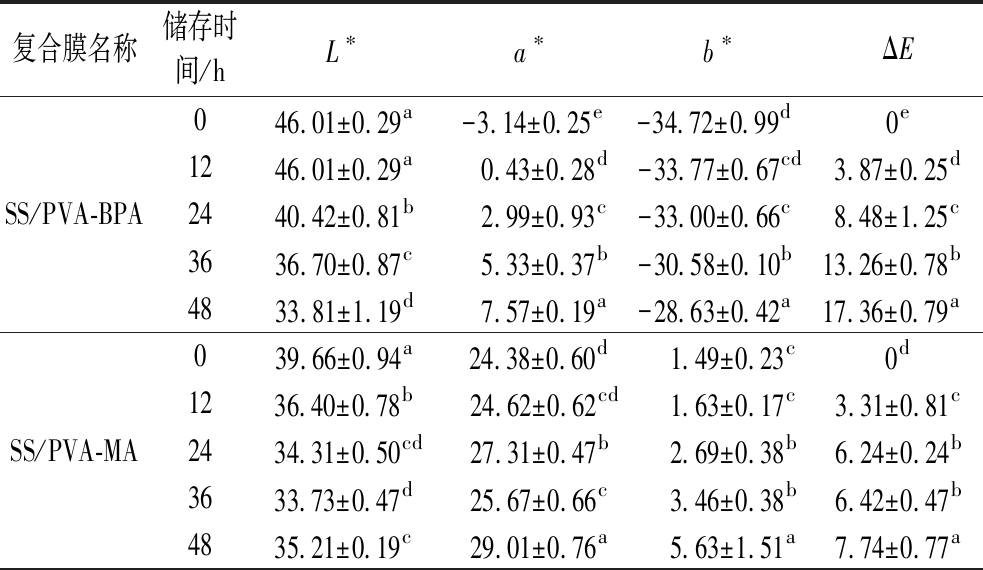
复合膜名称储存时间/hL∗a∗b∗ΔESS/PVA-BPA046.01±0.29a-3.14±0.25e-34.72±0.99d 0e1246.01±0.29a 0.43±0.28d-33.77±0.67cd3.87±0.25d2440.42±0.81b2.99±0.93c-33.00±0.66c8.48±1.25c3636.70±0.87c5.33±0.37b-30.58±0.10b13.26±0.78b4833.81±1.19d7.57±0.19a-28.63±0.42a17.36±0.79aSS/PVA-MA039.66±0.94a24.38±0.60d 1.49±0.23c0d1236.40±0.78b24.62±0.62cd 1.63±0.17c3.31±0.81c2434.31±0.50cd27.31±0.47b2.69±0.38b6.24±0.24b3633.73±0.47d25.67±0.66c3.46±0.38b6.42±0.47b4835.21±0.19c29.01±0.76a5.63±1.51a7.74±0.77a
续表3
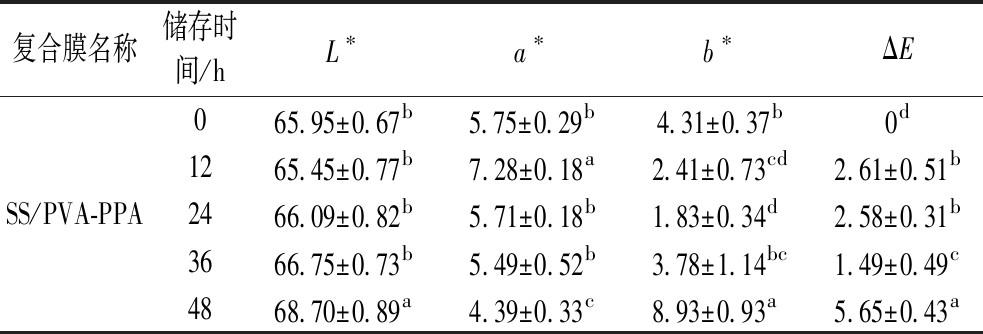
复合膜名称储存时间/hL∗a∗b∗ΔESS/PVA-PPA065.95±0.67b5.75±0.29b4.31±0.37b0d1265.45±0.77b7.28±0.18a2.41±0.73cd2.61±0.51b2466.09±0.82b5.71±0.18b1.83±0.34d2.58±0.31b3666.75±0.73b5.49±0.52b3.78±1.14bc1.49±0.49c4868.70±0.89a4.39±0.33c8.93±0.93a5.65±0.43a
注:相同样品同列数值中的不同小写字母上标表示数据间存在显著性差异(P<0.05)。
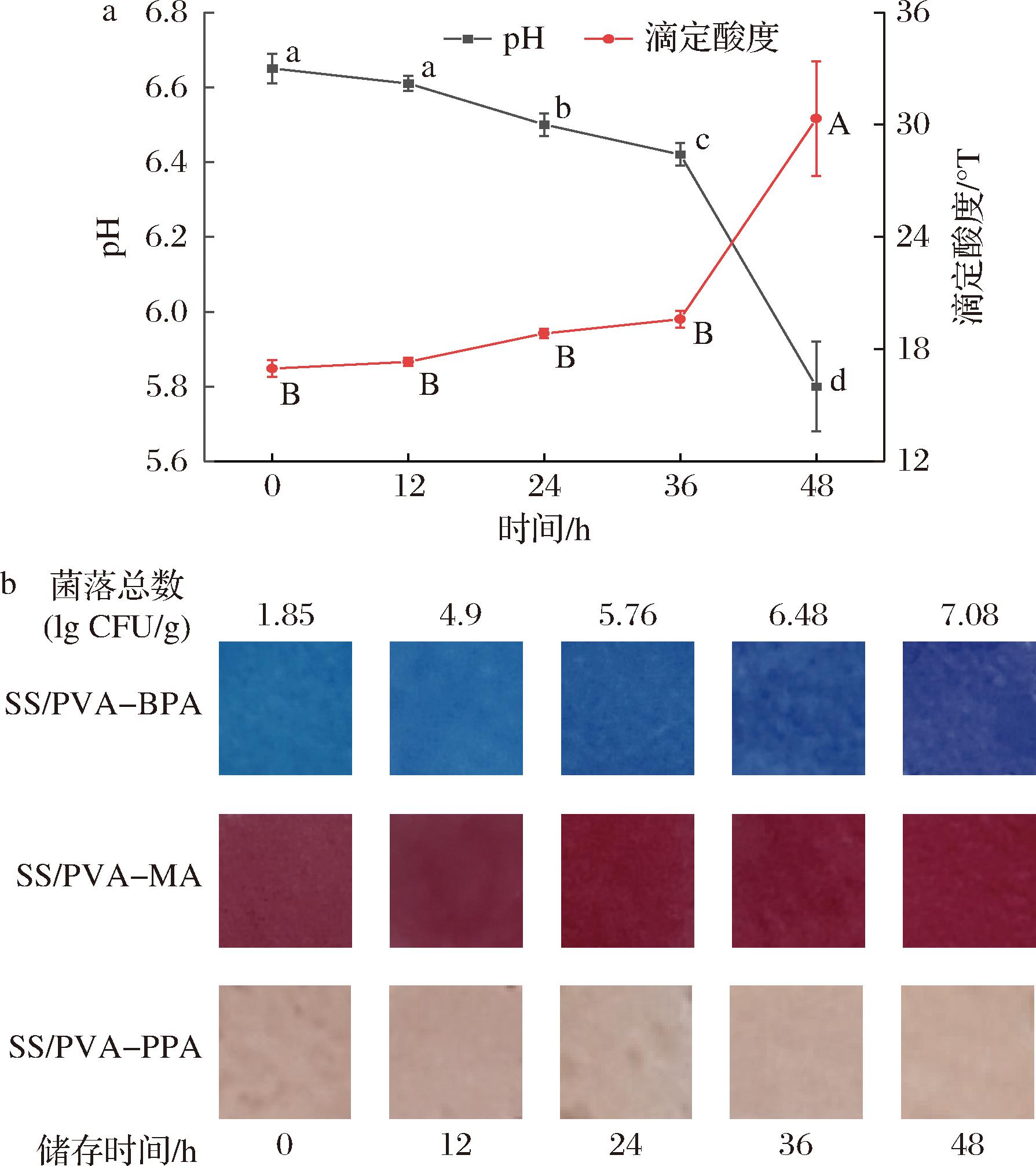
a-鲜牛奶的pH值和滴定酸度值;b-不同储存时间鲜牛奶菌落总数及与之接触的复合膜颜色
图6 鲜牛奶在25 ℃贮藏时的pH和滴定酸度变化和鲜牛奶的菌落总数及与之接触的复合膜颜色变化
Fig.6 Changes of pH and titration acidity of fresh milk stored at 25 ℃ and changes of the total viable count of fresh milk and the color change of the composite film in contact with them
3 结论
本研究分别将蝶豆花、桑葚和紫薯花青素与可溶性淀粉和聚乙烯醇复合得到3种具有pH响应性的膜,对其进行了表征和新鲜度指示效果评价。结果表明,蝶豆花花青素随pH的颜色变化最明显,且稳定性好。将3种花青素添加到复合膜中,可较好保持其pH灵敏度,但对膜结构和性能的影响取决于花青素的种类。紫薯花青素使复合膜保持了致密的微观结构,因此对膜强度的影响较小,且提高了其断裂伸长率,增强了其对水蒸气的阻隔性;蝶豆花和桑葚花青素则破坏了膜的致密结构,导致膜机械性能下降,溶胀度增加。在鲜牛奶菌落总数超标时,SS/PVA-BPA膜和SS/PVA-MA膜均发生了肉眼可识别的颜色变化,SS/PVA-PPA膜的颜色变化则不明显。因此,本研究通过对花青素来源的筛选,制备得到了具有较高灵敏度的复合膜,为其在牛奶新鲜度指示中的应用提供了参考。
[1] KISHORE A, MITHUL A S, KUMAR P, et al.Innovative packaging strategies for freshness and safety of food products:A review[J].Packaging Technology and Science, 2024, 37(5):399-427.
[2] 梁勇军. 智能包装技术的研究及应用发展[J].印刷工业, 2023, 18(5):29-32.
LIANG Y J.Research and application development of intelligent packaging technology[J].Print China, 2023, 18(5):29-32.
[3] NIU H H, ZHANG M, SHEN D B, et al.Sensing materials for fresh food quality deterioration measurement:A review of research progress and application in supply chain[J].Critical Reviews in Food Science and Nutrition, 2024, 64(22):8114-8132.
[4] 付翠霞, 董振玲, 李艳娟, 等.不同塑料软包膜对鲜牛奶风味性能的影响[J].中国乳品工业, 2022, 50(12):55-58.
FU C X, DONG Z L, LI Y J, et al.Influence of different soft package of liquid plastic film on the flavor of fresh milk[J].China Dairy Industry, 2022, 50(12):55-58.
[5] 王海歌, 鲍梦圆, 徐心雨, 等.植物食材花青素结构特性及对其功效机制研究进展[J].中国食品添加剂, 2024, 35(2):299-307.
WANG H G, BAO M Y, XU X Y, et al.Research progress on the structural characteristics of anthocyanins in plant food and their efficacy mechanism[J].China Food Additives, 2024, 35(2):299-307.
[6] WANG J D, ZHAO Y Q, SUN B, et al.The structure of anthocyanins and the copigmentation by common micromolecular copigments:A review[J].Food Research International, 2024, 176:113837.
[7] HASSANPOUR A, MORADI M, TAJIK H, et al.Development of two types of intelligent indicators based on cellulose, black carrot, and grape anthocyanins for monitoring food freshness/spoilage[J].Journal of Food Measurement and Characterization, 2022, 16(6):4295-4302.
[8] AHMED M, BOSE I, NOUSHEEN, et al.Development of intelligent indicators based on cellulose and Prunus domestica extracted anthocyanins for monitoring the freshness of packaged chicken[J].International Journal of Biomaterials, 2024, 2024(1):7949258.
[9] GHORBANI M, DIVSALAR E, MOLAEI R, et al.A halochromic indicator based on polylactic acid and anthocyanins for visual freshness monitoring of minced meat, chicken fillet, shrimp, and fish roe[J].Innovative Food Science &Emerging Technologies, 2021, 74:102864.
[10] ABDILLAH A A, LIN H H, CHARLES A L.Development of halochromic indicator film based on arrowroot starch/iota-carrageenan using Kyoho skin extract to monitor shrimp freshness[J].International Journal of Biological Macromolecules, 2022, 211:316-327.
[11] GAO R C, HU H L, SHI T, et al.Incorporation of gelatin and Fe2+ increases the pH-sensitivity of zein-anthocyanin complex films used for milk spoilage detection[J].Current Research in Food Science, 2022, 5:677-686.
[12] LUO X Y, ZAITOON A, LIM L T.A review on colorimetric indicators for monitoring product freshness in intelligent food packaging:Indicator dyes, preparation methods, and applications[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2489-2519.
[13] 薛瑾. 基于花青素的三文鱼新鲜度指示型包装材料研究[D].无锡:江苏大学, 2019.
XUE J.Research on freshness indicator packaging material of salmon based on anthocyanin[D].Wuxi:Jiangsu University, 2019.
[14] HE Y, LI B X, DU J, et al.Development of pH-responsive absorbent pad based on polyvinyl alcohol/agarose/anthocyanins for meat packaging and freshness indication[J].International Journal of Biological Macromolecules, 2022, 201:203-215.
[15] BERTOLO M R V, DIAS L D, DE OLIVEIRA FILHO J G, et al.Central composite design optimization of active and physical properties of food packaging films based on chitosan/gelatin/pomegranate peel extract[J].Food Packaging and Shelf Life, 2022, 34:100986.
[16] 秦靖萱. 生物质基新鲜度指示标签的制备研究[D].西安:西安理工大学, 2022.
QIN J X.Study on preparation and properties of freshness indicator label based on biomass[D].Xi’an:Xi’an University of Technology, 2022.
[17] TORSKANGERPOLL K, ANDERSEN Ø M.Colour stability of anthocyanins in aqueous solutions at various pH values[J].Food Chemistry, 2005, 89(3):427-440.
[18] 叶红玲, 卢永梦, 黄新雅, 等.安庆地区5个高产蓝莓品种花青素稳定性研究[J].食品安全质量检测学报, 2024, 15(6):218-227.
YE H L, LU Y M, HUANG X Y, et al.Study on the stability of 5 high-yielding blueberry anthocyanins in Anqing region[J].Journal of Food Safety &Quality, 2024, 15(6):218-227.
[19] WU K, ZHU D D, ZENG Y, et al.Impact of anthocyanin extract sources on the physical properties and pH sensitivity of konjac glucomannan/zein composite film[J].Food and Bioprocess Technology, 2024, 17(11):3926-3943.
[20] LIN X Q, LI N, XIAO Q, et al.Polyvinyl alcohol/starch-based film incorporated with grape skin anthocyanins and metal-organic framework crystals for colorimetric monitoring of pork freshness[J].Food Chemistry, 2022, 395:133613.
[21] MIAO L G, XU Y, JIA C H, et al.Structural changes of rice starch and activity inhibition of starch digestive enzymes by anthocyanins retarded starch digestibility[J].Carbohydrate Polymers, 2021, 261:117841.
[22] QI Y Y, LI Y N.Colorimetric films based on polyvinyl alcohol and anthocyanins extracted from purple tomato to monitor the freshness of shrimp[J].Polymers, 2024, 16(4):495.
[23] 范宏颖. 朝阳市鲜牛奶染菌情况调查[J].中国实用医药, 2012, 7(20):265-266.
FAN H Y.Investigation on contamination of fresh milk with bacteria in Chaoyang City[J].China Practical Medicine, 2012, 7(20):265-266.
[24] KIM D H, CHA J H, LIM J Y, et al.Colorimetric dye-loaded nanofiber yarn:Eye-readable and weavable gas sensing platform[J].ACS Nano, 2020, 14(12):16907-16918.
[25] MOAZAMI GOODARZI M, MORADI M, TAJIK H, et al.Development of an easy-to-use colorimetric pH label with starch and carrot anthocyanins for milk shelf life assessment[J].International Journal of Biological Macromolecules, 2020, 153:240-247.