果胶是一种结构复杂的天然植物多糖,存在于植物的初生细胞壁、胞间层和次生壁中[1]。目前,果胶结构模型主要分为四类:同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖I型(rhamnogalacturonan-Ⅰ,RG-I)、鼠李糖半乳糖醛酸聚糖Ⅱ型(rhamnogalacturonan-Ⅱ,RG-Ⅱ)以及木糖半乳糖醛酸聚糖(xylogalacturonan,XG)[2]。聚半乳糖醛酸甲酯化程度、单糖组成和糖苷键类型及比例等结构性质与果胶来源和提取方式密切相关[3]。基于甲酯化程度(degree of methyl esterification,DM)的差异,可分为高酯果胶(DM>50%)和低酯果胶(DM<50%),果胶受到DM的影响呈现出多样化的胶凝行为[4]。果胶广泛应用于食品行业,常用作增稠剂、凝胶剂和乳化剂等[5]。尽管果胶普遍存在于植物的果实、根、茎、叶中,但被用于商业生产的植物材料有限,主要为苹果渣和橘皮[6]。因此,评估潜在的果胶原料,成为当下亟待解决的关键问题。
豆腐柴(Premna microphylla Turcz)为马鞭草科豆腐柴属植物,该物种在我国华东、中南、华南等地广泛分布,同时也在日本有所分布[7]。鉴于其适应性强,生长快速且资源丰富等优势,豆腐柴具有极高的开发利用潜力。作为药食两用植物,其叶可用于提取果胶,还可加工成神仙豆腐或清凉饮料,深受消费者喜爱,而且,其全株均可入药,可用于清热解毒及消肿止血等[8]。此外,豆腐柴还富含果胶多糖、蛋白质、粗纤维和矿物质元素,其中,果胶多糖的含量高达30%~40%[9]。相较于常用果胶原料,如苹果渣和橘皮等,豆腐柴中果胶含量明显更高,且具有良好的胶凝能力,因此,它可以作为果胶的良好来源,是一种提取商业果胶的新型原材料。现阶段对于豆腐柴的研究主要集中在对其叶中化学成分[10]、果胶[7]和黄酮类[11]等物质的提取及理化性质分析等方面,据报道,豆腐柴果胶的分子质量分布范围为18.35[9]~980.67 kDa[7],酯化度在5.64%~85.87%[7,12]。豆腐柴果胶的单糖种类多样,主要由半乳糖醛酸,半乳糖、鼠李糖、阿拉伯糖等组成,且部分果胶还含有丰富的岩藻糖、葡萄糖等[13-14]。但其分子精细结构尚不清楚,有待进一步研究。
本研究以热水为萃取剂从豆腐柴中提取果胶,通过分级醇沉收集产率较高且具有单一对称峰的组分,并对其化学成分、相对分子质量、单糖种类和糖苷键类型及连接方式进行分析以表征豆腐柴果胶的分子结构。这将有助于为豆腐柴果胶后续构效关系的深入解析提供一定的理论支撑,并进一步推进豆腐柴资源的开发利用,提升其经济价值。
1 材料与方法
1.1 主要材料与试剂
豆腐柴粉(300目),重庆丰都圣龙农业发展有限公司;葡聚糖标准品(T-10、40、70、500、2 000),北京索莱宝科技有限公司;岩藻糖(Fuc)、鼠李糖(Rha)、阿拉伯糖(Ara)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)、半乳糖醛酸(GalA)、葡萄糖醛酸(GlcA),美国Sigma公司;碘甲烷、硼氘化钠、重水,安徽泽升科技有限公司;二甲基亚砜,北京华威锐科化工有限公司。除特殊说明外,其他所有化学品和试剂均为分析纯购自天津市江天化工技术股份有限公司。
1.2 仪器与设备
LC-20A高效凝胶排阻色谱,日本岛津公司;IS50傅里叶变换红外光谱仪,尼高利公司;Agilent 6890N三重四级杆气质联用仪,美国Agilent公司;ICS-5000+高效阴离子交换色谱仪,美国Thermo Scientific公司;AVANCE III 600核磁共振波谱仪,Bruker公司;TA.XT Plus质构仪,英国Stable Micro System公司;Infinite M200 Pro酶标仪,瑞士TECAN公司。
1.3 试验方法
1.3.1 豆腐柴果胶的提取与纯化
参考CHEN等[7]的方法并稍作修改。将干燥的豆腐柴粉用无水乙醇进行脱色除脂处理(1∶30,g∶mL),常温持续搅拌6 h,重复处理4次,得到醇不溶性固体,风干备用。预处理过的豆腐柴粉与去离子水以1∶20(g∶mL)的比例混合,并在80 ℃下提取2 h,将提取液冷却至25 ℃,3 800 r/min离心20 min后,收集上清液,加入3倍体积的无水乙醇,4 ℃静置过夜。3 800 r/min离心20 min后收集沉淀物,蒸馏水溶解后透析72 h(截留分子质量8~14 kDa),冷冻干燥后即获得水提豆腐柴果胶(water-soluble pectin,WSP)粗提物。
根据KANG等[15]的方法,稍加修改后用于WSP粗提物的分级醇沉。将0.01 g/mL WSP水溶液于60 ℃下搅拌8 h,冷却,8 000 r/min离心30 min后收集上清液,按体积分数5%的比例梯度增加乙醇体积分数进行分级醇沉(5%~80%)。采用高效尺寸排除色谱(high performance size exclusion chromatography,HPSEC)对其进行分析,收集得率高且具有单一对称峰的WSP纯化组分(乙醇体积分数50%~55%)进一步分析,命名为WSP-55。
1.3.2 化学成分分析
以葡萄糖为标准品,采用苯酚-硫酸法测定豆腐柴果胶的总糖含量[16]。以牛血清白蛋白为标准品,采用Bradford蛋白浓度测定试剂盒对可溶性蛋白进行定量[17]。采用间羟基二苯基比色法测定豆腐柴果胶的糖醛酸含量,并以D-半乳糖醛酸作为参考标准[18]。
1.3.3 相对分子质量的测定
使用HPSEC对豆腐柴果胶及其分级醇沉组分的相对分子质量和分布情况进行分析[15]。
1.3.4 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
将一定量的果胶样品和KBr按照质量比1∶150的比例研磨至完全混匀,压成薄片,使用FT-IR光谱仪分析果胶的官能团,并根据公式(1)计算果胶DM值[19]。
(1)
式中:Abs1730和Abs1630分别代表样品在1 730 cm-1和1 630 cm-1处的峰面积。
1.3.5 甲基化分析
按照GUO等[20]的方法对果胶样品进行糖醛酸还原与甲基化分析,并根据公式(2)计算豆腐柴果胶的支化度(degree of branching,DB)。
(2)
式中:NT、NB和NL分别代表果胶末端、支链和直链残基的摩尔百分比。
1.3.6 部分酸水解
使用0.05 mol/L三氟乙酸(trifluoroacetic acid,TFA)对WSP-55进行部分酸水解,水解产物经超纯水透析48 h(截留分子质量为3 500 Da),收集豆腐柴水溶性果胶的截留组分(retentate from water-soluble pectin with 50%~55% ethanol-induced precipitation,WSP-55-R)和豆腐柴水溶性果胶的渗出组分(permeate from water-soluble pectin with 50%~55% ethanol-induced precipitation,WSP-55-P),对WSP-55-R和WSP-55-P进行单糖组成测定,并对WSP-55-R进行甲基化和NMR分析,以辅助WSP-55的结构解析[21]。
1.3.7 单糖组成测定
使用高效阴离子交换色谱-脉冲安培法(high performance anion exchange chromatography-pulsed amperometric detection,HPAEC-PAD)[22]对部分酸水解产物WSP-55-R和WSP-55-P进行单糖组成的测定。
1.3.8 1D/2D NMR分析
将样品溶解于重水(20 mg/mL),反复冻融3次,利用核磁共振波谱仪进行检测。所测项目包括1H NMR、13C NMR、同核化学位移相关谱(correlation spectroscopy,COSY)、异核单量子相关谱(heteronuclear single quantum correlation,HSQC)、异核多键相关谱(heteronuclear multiple bond connectivity,HMBC)、总相关谱(total correlated spectroscopy,TOCSY)。
1.4 数据分析
所有统计实验均重复3次。统计结果采用SPSS 26.0软件进行数据分析,以“平均值±标准差”的形式表示。数据由Origin 2023、Adobe Illustrator 2023软件绘制。
2 结果与讨论
2.1 化学成分和理化性质
如表1所示,水提果胶粗提物WSP得率为12.59%,且半乳糖醛酸含量为70.30%,高于食品化学品法典所规定的65%的限值。WSP的蛋白质含量较低,仅为1.57%。以上结果说明粗提物纯度较高。与WSP相比,纯化组分WSP-55的半乳糖醛酸含量(73.52%)增加,蛋白质(0.54%)降低,说明分级醇沉提高了果胶的纯度。
表1 WSP及其分级醇沉组分的化学组成和分子特征
Table 1 Chemical composition and molecular characterization of WSP and its purified fraction

组别得率/%蛋白质/%糖醛酸/%中性糖/%相对分子质量/kDaDM/%WSP12.59±0.43a1.57±0.1470.30±5.3528.70±0.1357116815.22±1.09WSP-557.29±0.34b0.54±0.3073.52±4.0934.04±0.5213916.67±0.85
注:a以豆腐柴干粉为基准计算粗提物(WSP)占比;b以WSP质量为基准计算分级醇沉组分(WSP-55)的占比。
通过分级醇沉得到的WSP-55的相对分子质量为139 kDa(表1)。图1为WSP及其纯化组分WSP-55的相对分子质量分布。由HPSEC图谱可知,WSP存在明显的肩峰,经分级醇沉纯化后的WSP-55组分在HPSEC中表现出相对狭窄和对称的峰,表明其分子质量分布集中,组分较为单一,可用于进一步的结构研究。
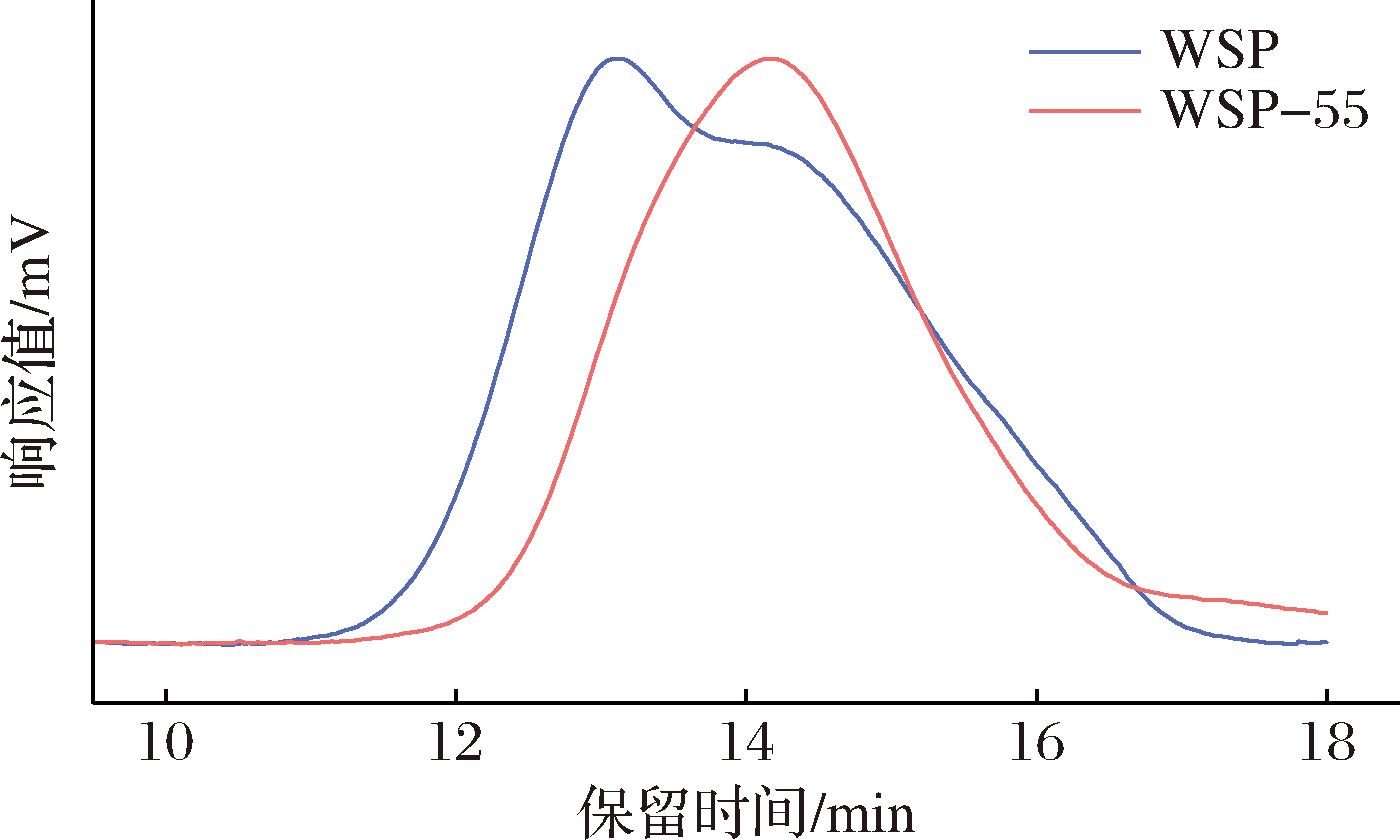
图1 WSP及其分级醇沉组分的HPSEC图谱
Fig.1 HPSEC profiles of WSP and its purified fraction
2.2 FT-IR分析
WSP和WSP-55的FT-IR如图2所示。O—H伸缩振动特征峰出现在3 423 cm-1附近,3 000~2 800 cm-1范围内存在的吸收峰由不对称的C—H伸缩振动引起。此外,1 730 cm-1处的谱带与甲基酯化或质子化的羧基相对应,而1 630 cm-1处的谱带则对应羧基中羰基(C![]() O)的不对称伸缩振动,果胶组分之间最明显的差异出现在1 730和1 630 cm-1[7]。在低酯果胶(DM<50%)中,自由羧基键的含量相较于羧酸酯更为丰富,这一特性在红外光谱图中表现为1 630 cm-1处的吸收峰面积及其强度>1 730 cm-1处的吸收峰。WSP和WSP-55的DM值分别为15.22%、16.67%(表1),证明WSP及WSP-55为低酯果胶。CHEN等[7]通过热水浸提得到了酯化度为25.09%的低酯果胶,而本文中提到的WSP及WSP-55所表现出的更低的酯化度可能归因于提取工艺及原料来源的差异。
O)的不对称伸缩振动,果胶组分之间最明显的差异出现在1 730和1 630 cm-1[7]。在低酯果胶(DM<50%)中,自由羧基键的含量相较于羧酸酯更为丰富,这一特性在红外光谱图中表现为1 630 cm-1处的吸收峰面积及其强度>1 730 cm-1处的吸收峰。WSP和WSP-55的DM值分别为15.22%、16.67%(表1),证明WSP及WSP-55为低酯果胶。CHEN等[7]通过热水浸提得到了酯化度为25.09%的低酯果胶,而本文中提到的WSP及WSP-55所表现出的更低的酯化度可能归因于提取工艺及原料来源的差异。
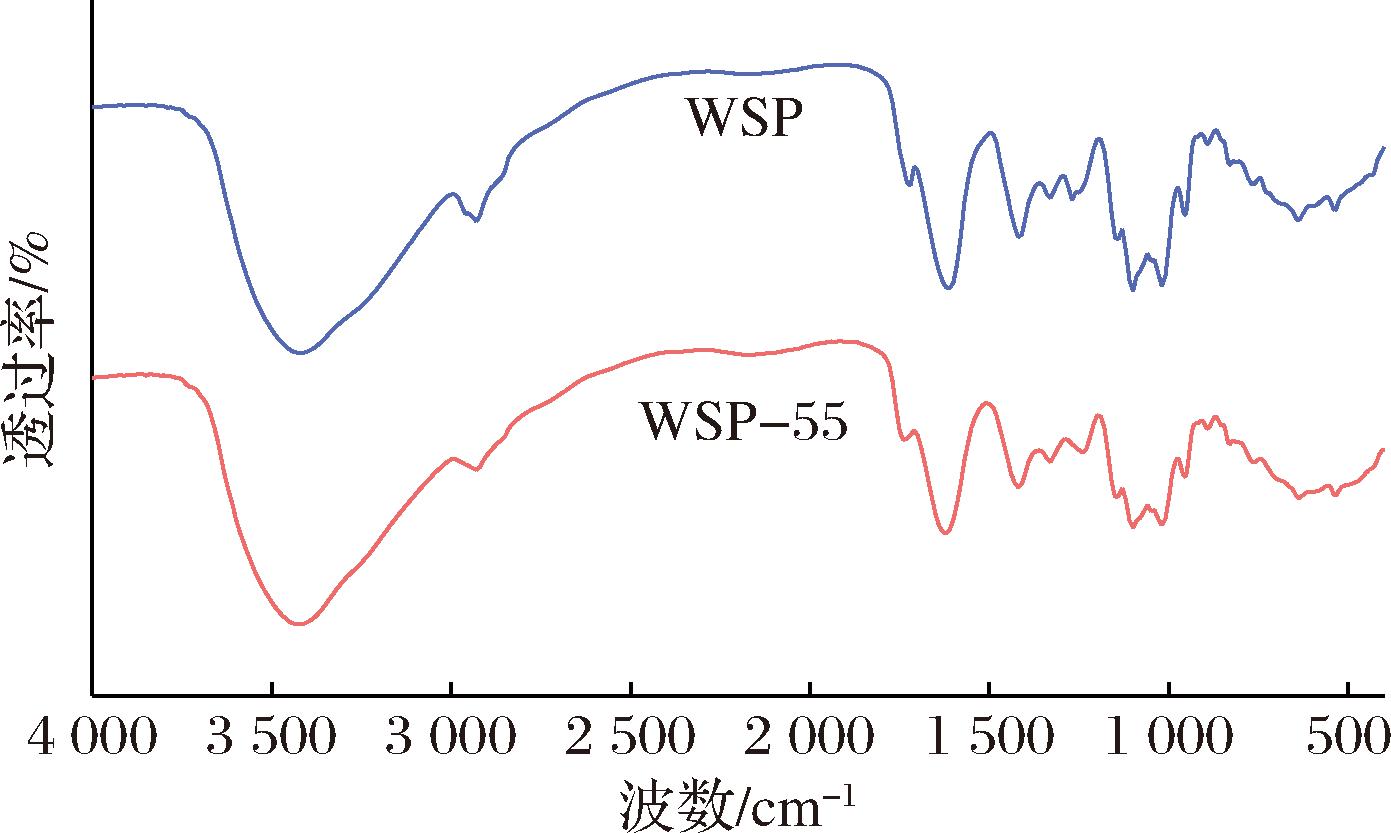
图2 WSP及其分级醇沉组分的红外光谱图
Fig.2 FT-IR spectrum of WSP and its purified fraction
2.3 甲基化分析
甲基化分析结果如表2所示,WSP-55有15种以上的连接方式。其中,GalpA糖残基的含量最多。在这些连接方式中,占比最高的是→4)-GalpA-(1→,达到65.62%。此外,还存在其他形式的GalpA糖残基,如GalpA-(1→,→2,4)-GalpA-(1→,→3,4)-GalpA-(1→以及→4,6)-GalpA-(1→等。同时,少量的→2)-Rhap-(1→和→2,4)-Rhap-(1→糖残基表明RG-I主链较短。此外,Araf-(1→,→5)-Araf-(1→和Galp-(1→)的存在,进一步证实了RG-I中阿拉伯聚糖和/或阿拉伯半乳聚糖-I(arabinogalactan I,AG-I)果胶侧链的存在。同时,Galp-(1→,→3)-Galp-(1→,→6)-Galp-(1→以及→3,6)-Galp-(1→等连接方式表明RG-I结构域中存在阿拉伯半乳聚糖-Ⅱ(arabinogalactan Ⅱ,AG-Ⅱ)侧链。→4)-Galp-(1→和→4,6)-Galp-(1→这2种残基可能源自RG-I的半乳聚糖和/或AG-I侧链[23]。总非还原性末端残基(NT)和总分支点摩尔比(NB)分别为10.25%和14.62%。根据公式(2)计算得到WSP-55的DB值为24.89%(表2),表明WSP-55具有相对较低的支链结构[20]。综上,WSP-55富含HG型结构域,并含有较短的RG-I主链,Araf糖残基和Galp残基作为RG-I的侧链结构存在。
表2 WSP-55的连接方式和相应的摩尔比
Table 2 Linkage patterns and relative molar ratios of WSP-55

PMAA糖苷键类型含量/mol%阿拉伯糖5.59±0.552,3,5-Me3-ArafAraf-(1→2.32±0.572,3,4-Me3-ArapArap-(1→2.07±0.112,3-Me2-Araf→5)-Araf-(1→1.20±0.12鼠李糖1.23±0.172,3,4-Me3-RhapRhap-(1→-3,4-Me2-Rhap→2)-Rhap-(1→-2,4-Me2-Rhap→3)-Rhap-(1→1.23±0.173-Me-Rhap→2,4)-Rhap-(1→-葡萄糖7.02±0.852,3,4,6-Me4-GlcpGlcp-(1→0.64±0.112,3,6-Me3-Glcp→4)-Glcp-(1→5.71±0.882,3-Me2-Glcp→4,6)-Glcp-(1→0.66±0.08半乳糖醛酸/半乳糖86.16±0.832,3,4,6-Me4-GalpGalpAa-(1→ or Galp-(1→5.22±0.612,4,6-Me3-Galp→3)-Galp-(1→-2,3,6-Me3-Galp→4)-GalpAa-(1→ or →4)-Galp-(1→65.62±3.662,3,4-Me3-Galp→6)-Galp-(1→1.36±0.183,6-Me2-Galp→2,4)-GalpA-(1→ or →2,4)-Galp-(1→2.92±0.602,6-Me2-Galp→3,4)-GalpA-(1→ or →3,4)-Galp-(1→5.16±0.692,4-Me2-Galp→3,6)-GalpA-(1→ or →3,6)-Galp-(1→0.63±0.042,3-Me2-Galp→4,6)-GalpA-(1→ or →4,6)-Galp-(1→4.50±0.566-Me-Galp→2,3,4)-Galp-(1→0.74±0.15DB24.89±3.58
注:a在GalpA和Galp的混合物中占主导地位;-表示痕量;PMAA表示部分甲基化的糖醇乙酸酯(partially methylated alditol acetate)(下同)。
2.4 WSP-55的部分降解产物的结构解析
2.4.1 部分酸水解样品单糖组成分析
为了更深入地揭示WSP-55的糖链结构特征,对其进行了部分酸水解处理。水解产物WSP-55-R和WSP-55-P,采用HPAEC-PAD分析其单糖组成,结果如表3所示。与渗出组分(WSP-55-P)相比,截留组分(WSP-55-R)中Ara和Gal含量显著下降,由此可以推测,Ara和Gal可能主要分布于支链上或还原末端。由于GalA作为HG及RG-I结构域主链的主要组成部分,不容易被TFA水解,致使GalA的占比较高,为84.19%。
表3 WSP-55-R和WSP-55-P的单糖组成 单位:mol%
Table 3 Monosaccharide compositions of WSP-55-R and WSP-55-P
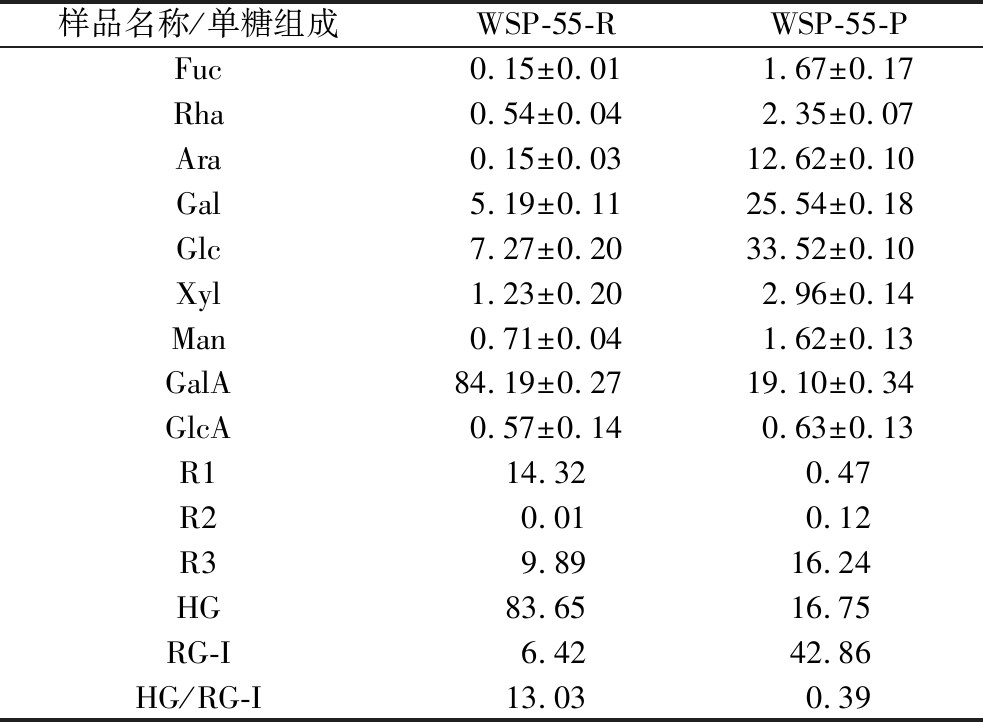
样品名称/单糖组成WSP-55-RWSP-55-PFuc0.15±0.011.67±0.17Rha0.54±0.042.35±0.07Ara0.15±0.0312.62±0.10Gal5.19±0.1125.54±0.18Glc7.27±0.2033.52±0.10Xyl1.23±0.202.96±0.14Man0.71±0.041.62±0.13GalA84.19±0.2719.10±0.34GlcA0.57±0.140.63±0.13R114.320.47R20.010.12R39.8916.24HG83.6516.75RG-I6.4242.86HG/RG-I13.030.39
注:R1=GalA/(Rha+Ara+Gal);R2=Rha/GalA;R3=(Ara+Gal)/Rha;HG=GalA-Rha;RG-I=2×Rha+Ara+Gal[24]。
2.4.2 部分酸水解样品甲基化分析
WSP-55-R的甲基化分析结果如表4所示。与WSP-55的甲基化结果相比(表2),WSP-55-R中GalpA等相关糖残基含量升高,其中→4)-GalpA-(1→含量高达74.20%。而→3,4)-Galp-(1→及→4,6)-Galp-(1→等中性糖残基含量减少,→5)-Araf-(1→糖残基未检出,这与单糖结果一致(表3)。这可能是由于GalpA糖残基通常源于HG/RG-I骨架,而Araf和Galp糖残基位于侧链易被水解。
表4 WSP-55-R的糖苷键连接方式分析
Table 4 Linkage patterns analysis of WSP-55-R

PMAA糖苷链类型含量/mol%阿拉伯糖-2,3,5-Me3-ArafAraf-(1→-2,3,4-Me3-ArapArap-(1→-鼠李糖0.81±0.063,4-Me2-Rhap→2)-Rhap-(1→0.81±0.06葡萄糖5.84±0.782,3,4,6-Me4-GlcpGlcp-(1→1.15±0.242,3,6-Me3-Glcp→4)-Glcp-(1→4.69±0.54半乳糖醛酸/半乳糖93.35±0.842,3,4,6-Me4-GalpGalpAa-(1→ or Galp-(1→14.91±2.482,4,6-Me3-Galp→3)-Galp-(1→0.94±0.07
续表4

PMAA糖苷链类型含量/mol%2,3,6-Me3-Galp→4)-GalpAa-(1→ or →4)-Galp-(1→74.20±4.242,3,4-Me3-Galp→6)-Galp-(1→-3,6-Me2-Galp→2,4)-GalpA-(1→ or →2,4)-Galp-(1→0.77±0.192,6-Me2-Galp→3,4)-GalpA-(1→ or →3,4)-Galp-(1→1.32±0.382,3-Me2-Galp→4,6)-GalpA-(1→ or →4,6)-Galp-(1→1.22±0.286-Me-Galp→2,3,4)-Galp-(1→-DB19.36±3.57
注:a在GalpA和Galp的混合物中占主导地位;-表示痕量。
2.4.3 NMR分析
由于WSP-55的结构复杂,导致其1H NMR的异头氢区出现信号峰重叠现象,无法获得相对有效的信息(图3-a)。因此,为了对WSP-55分子结构进行深入解析,利用1H NMR(图3-a)、13C NMR(图3-b)、COSY(图3-c)、HSQC(图3-d)、HMBC(图3-e)以及TOCSY(图3-f)等核磁共振技术对其部分酸水解产物(WSP-55-R)进行了测定。并将WSP-55-R的糖残基化学位移结果列于表5中。接下来对相关糖残基的1H 和13C信号归属进行详细分析。
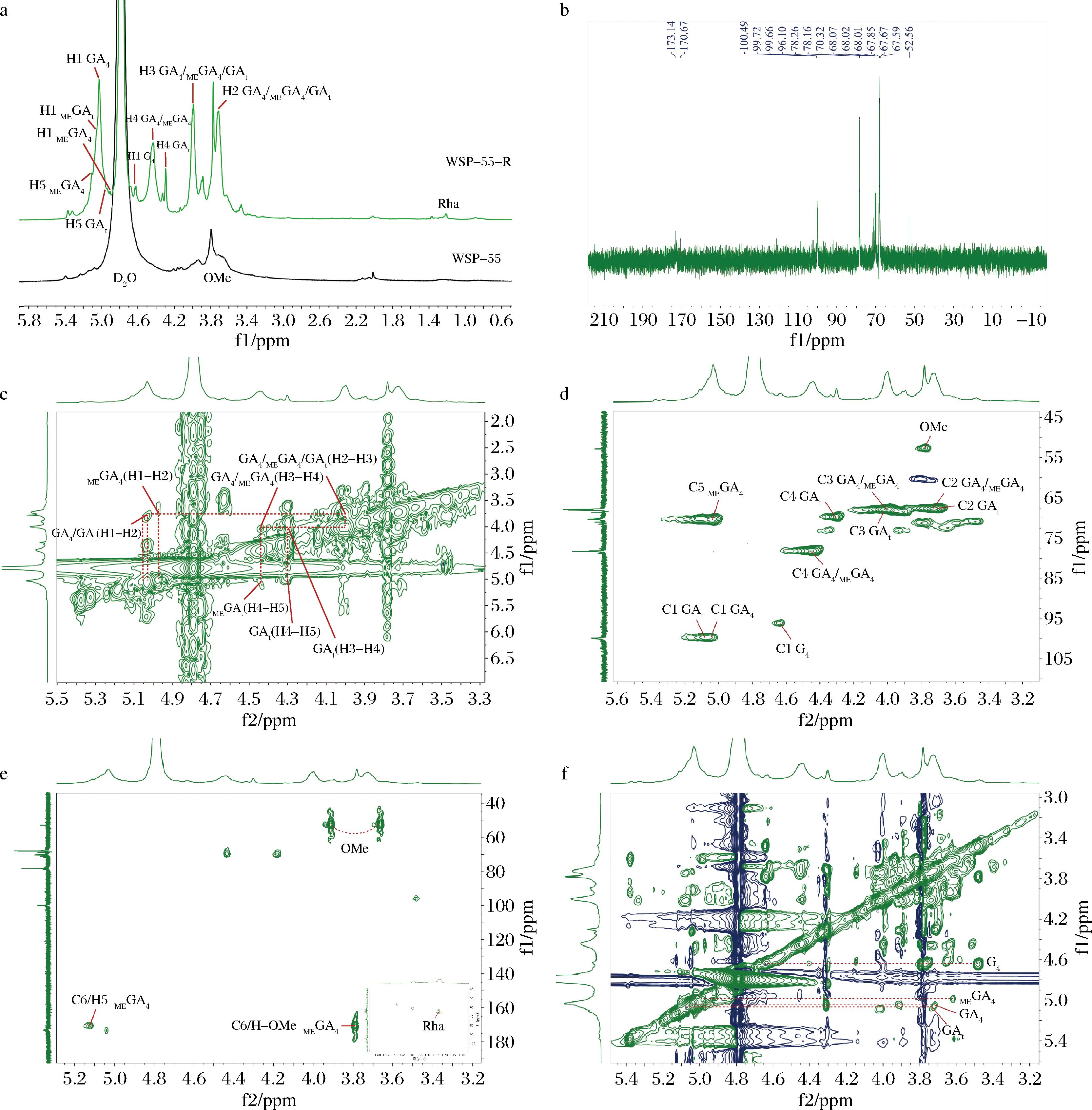
a-WSP-55-R和WSP-55的1H NMR谱;b-WSP-55-R的13C NMR谱;c-WSP-55-R的COSY谱;d-WSP-55-R的HSQC谱;e-WSP-55-R的HMBC谱;f-WSP-55-R的TOCSY谱
图3 豆腐柴果胶的一维和二维核磁谱图
Fig.3 1D/2D NMR spectra of pectin from P. microphylla Turcz
表5 WSP-55-R的1H和13C的化学位移
Table 5 The chemical shifts of1H and13C NMR chemical shifts of WSP-55-R
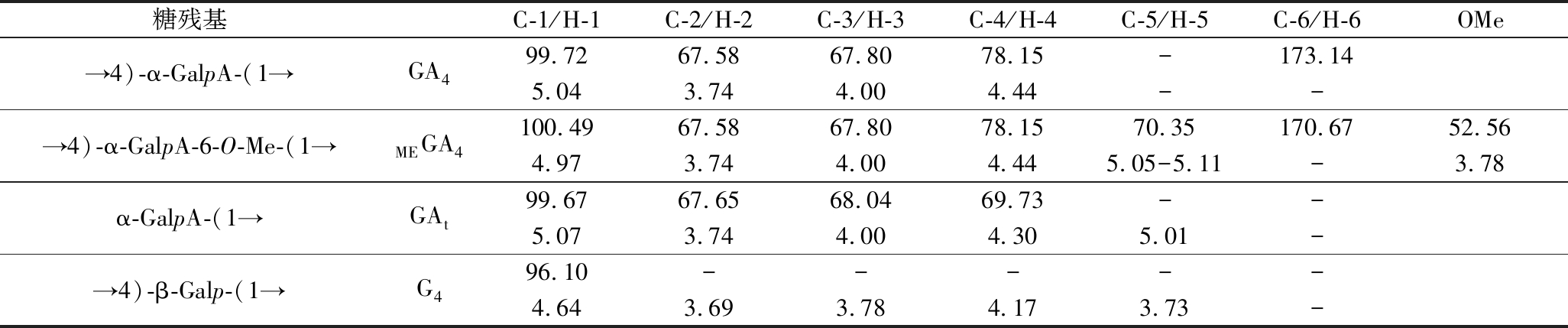
糖残基C-1/H-1C-2/H-2C-3/H-3C-4/H-4C-5/H-5C-6/H-6OMe→4)-α-GalpA-(1→GA499.7267.5867.8078.15-173.145.043.744.004.44--→4)-α-GalpA-6-O-Me-(1→MEGA4100.4967.5867.8078.1570.35170.6752.564.973.744.004.445.05-5.11-3.78α-GalpA-(1→GAt99.6767.6568.0469.73--5.073.744.004.305.01-→4)-β-Galp-(1→G496.10-----4.643.693.784.173.73-
注:-表示未检测到相关信号。
结合单糖和甲基化结果得知,WSP-55-R中→4)-α-GalpA-(1→(GA4)含量最高,含有丰富的HG型结构域。根据COSY谱图(图3-c)归属WSP-55-R中GA4的H-2~H-4的化学位移,对应的耦合信号分别为δ 5.04/3.74(H-1/H-2)、δ 3.74/4.00(H-2/H-3)、δ 4.00/4.44(H-3/H-4)。并以此为依据,找到HSQC谱图中归属C-1~C-4的耦合信号,分别为δ 99.72、67.58、67.80、78.15。HSQC谱图中δ 52.56/3.78处的化学信号揭示了甲氧基(-OCH3)的存在,表明部分→4)-α-GalpA-(1→糖残基在O-6处发生了甲基酯化,即存在→4)-α-GalpA-6-O-Me-(1→(MEGA4)。上述结果表明GalpA主要以→4)-α-GalpA-(1→(GA4)及→4)-α-GalpA-6-O-Me-(1→(MEGA4)形式存在。通过HSQC谱图对α-GalpA残基非还原端(α-GalpA-(1→, GAt)的H-4/C-4(δ 4.30/69.73)化学位移进行归属[25]。
在1H NMR和HMBC谱图中,观察到1.23处Rhap的H-6信号[26]。然而,鉴于Rhap残基的含量相对较低,无法完全归属其相关糖残基的13C/1H化学位移,但Rhap的存在证明WSP-55-R中存在较短的RG-I主链。这与甲基化和单糖结果一致。
Galp糖残基主要以→4)-β-Galp-(1→(G4)的形式存在。通过HSQC谱图分析,发现其13C/1H的相关信号为δ 96.10/4.64。此外,可以通过COSY、HMBC、TOCSY验证G4糖残基的存在。但由于其含量较少,信号较弱,在本实验条件下,无法对13C进行归属。
结合上述结果及DM值分析,WSP-55以HG结构域为主,并含有较短的RG-I主链。其中HG结构域由→4)-α-GalpA-(1→和→4)-α-GalpA-6-O-Me-(1→以4∶1的摩尔比构成,RG-I结构域的主链是由→4)-α-GalpA-(1→和→2)-α-Rhap-(1→交替连接而成。因此,推测WSP可能的重复单元如图4所示。
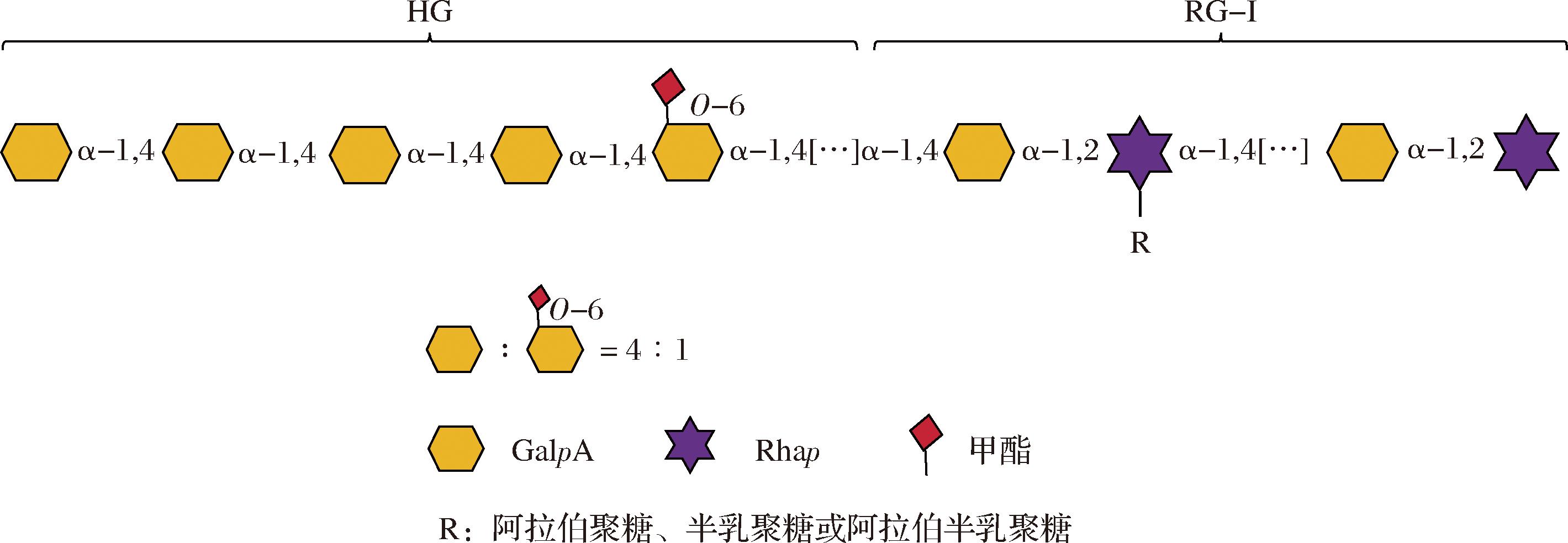
图4 WSP-55可能的重复结构单元
Fig.4 The proposed repeating units of WSP-55
3 结论
本文通过热水提取法从豆腐柴中提取果胶,并根据果胶在不同体积分数乙醇中溶解性的差异进行纯化得到组分WSP-55,测定其化学成分及理化性质,通过FT-IR、HPSEC、GC-MS和NMR等仪器对豆腐柴果胶进行结构表征。通过HPSEC分析结果表明,经纯化后的WSP-55分子质量分布集中且组分较为单一,其相对分子质量为139 kDa。结构分析表明,WSP-55主要由GalA、Glc、Gal、Ara组成,并具有较低的酯化度(16.67%),以HG结构域(65.62%)为主,并含有较短的RG-I主链,其中→4)-α-GalpA-(1→和→4)-α-GalpA-6-O-Me-(1→以4∶1的摩尔比组成HG结构域,RG-I结构域的主链结构则由重复单元[→2)-α-Rhap-(1→4)-α-GalpA-(1→]n构成,Araf糖残基和Galp糖残基存在于RG-I的侧链。本文深入研究了豆腐柴果胶的结构,丰富了现有的数据体系,也为豆腐柴果胶的深入利用和广泛开发提供坚实的理论基础,进而推动其在多个领域的应用与发展。
[1] CAFFALL K H, MOHNEN D.The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydrate Research, 2009, 344(14):1879-1900.
[2] REICHEMBACH L H, L CIA DE OLIVEIRA PETKOWICZ C.Pectins from alternative sources and uses beyond sweets and jellies:An overview[J].Food Hydrocolloids, 2021, 118:106824.
CIA DE OLIVEIRA PETKOWICZ C.Pectins from alternative sources and uses beyond sweets and jellies:An overview[J].Food Hydrocolloids, 2021, 118:106824.
[3] YOO S H, LEE B H, LEE H, et al.Structural characteristics of pumpkin pectin extracted by microwave heating[J].Journal of Food Science, 2012, 77(11):C1169-C1173.
[4] SILA D N, VAN BUGGENHOUT S, DUVETTER T, et al.Pectins in processed fruits and vegetables:Part Ⅱ—Structure-function relationships[J].Comprehensive Reviews in Food Science and Food Safety, 2009, 8(2):86-104.
[5] MELLINAS C, RAMOS M, JIMÉNEZ A, et al.Recent trends in the use of pectin from agro-waste residues as a natural-based biopolymer for food packaging applications[J].Materials, 2020, 13(3):673.
[6] MÜLLER-MAATSCH J, BENCIVENNI M, CALIGIANI A, et al.Pectin content and composition from different food waste streams[J].Food Chemistry, 2016, 201:37-45.
[7] CHEN J, LIANG R H, LIU W, et al.Extraction of pectin from Premna microphylla Turcz leaves and its physicochemical properties[J].Carbohydrate Polymers, 2014, 102:376-384.
[8] ZHAN Z J, TANG L, SHAN W G.A new triterpene glycoside from Premna microphylla[J].Chemistry of Natural Compounds, 2009, 45(2):197-199.
[9] LU J K, LI J J, JIN R C, et al.Extraction and characterization of pectin from Premna microphylla Turcz leaves[J].International Journal of Biological Macromolecules, 2019, 131:323-328.
[10] DUAN H, WANG W, LI Y X, et al.Identification of phytochemicals and antioxidant activity of Premna microphylla Turcz.stem through UPLC-LTQ-Orbitrap-MS[J].Food Chemistry, 2022, 373:131482.
[11] WANG D Y, XU S Y.Two new xanthones from Premna microphylla[J].Natural Product Research, 2003, 17(1):75-77.
[12] 胡予, 张攀, 陈信, 等.不同月份豆腐柴叶果胶理化性质差异研究[J].食品工业科技, 2020, 41(1):38-43, 49.
HU Y, ZHANG P, CHEN X, et al.Study on the difference of the physicochemical properties of pectin from Premna microphylla Turcz leaves in different months[J].Science and Technology of Food Industry, 2020, 41(1):38-43, 49.
[13] CHEN Y Y, LIU X, LEI X J, et al.Premna microphylla Turcz pectin protected UVB-induced skin aging in BALB/c-nu mice via Nrf2 pathway[J].International Journal of Biological Macromolecules, 2022, 215:12-22.
[14] SU Y D, CHEN Y, QIN Y T, et al.Pectin extracted from Premna microphylla Turcz for preparation of a “sandwich” multi-property sensor film involved with deep eutectic solvent[J].International Journal of Biological Macromolecules, 2023, 253:127171.
[15] KANG J, HUANG-FU Z Y, TIAN X N, et al.Arabinoxylan of varied structural features distinctively affects the functional and in vitro digestibility of wheat starch[J].Food Hydrocolloids, 2023, 140:108615.
[16] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry, 1956, 28(3):350-356.
[17] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[18] BLUMENKRANTZ N, ASBOE-HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry, 1973, 54(2):484-489.
[19] SINGTHONG J, CUI S W, NINGSANOND S, et al.Structural characterization, degree of esterification and some gelling properties of Krueo Ma Noy (Cissampelos pareira) pectin[J].Carbohydrate Polymers, 2004, 58(4):391-400.
[20] GUO Q B, DU J H, JIANG Y, et al.Pectic polysaccharides from hawthorn:Physicochemical and partial structural characterization[J].Food Hydrocolloids, 2019, 90:146-153.
[21] ZHU J X, CHEN Z Y, CHEN L, et al.Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J].International Journal of Biological Macromolecules, 2019, 130:388-398.
[22] WOOD P, WEISZ J, BLACKWELL B.Structural studies of (1→3), (1→4)-β-D-glucans by13C-nuclear magnetic resonance spectroscopy and by rapid analysis of cellulose-like regions using high-performance anion-exchange chromatography of oligosaccharides released by lichenase[J].Cereal Chemistry, 1994, 71:301-307.
[23] MOHNEN D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology, 2008, 11(3):266-277.
[24] AL-AMOUDI R H, TAYLAN O, KUTLU G, et al.Characterization of chemical, molecular, thermal and rheological properties of medlar pectin extracted at optimum conditions as determined by Box-Behnken and ANFIS models[J].Food Chemistry, 2019, 271:650-662.
[25] LIU D, TANG W, HUANG X J, et al.Structural characteristic of pectin-glucuronoxylan complex from Dolichos lablab L.hull[J].Carbohydrate Polymers, 2022, 298:120023.
[26] SHAKHMATOV E G, MAKAROVA E N, BELYY V A.Structural studies of biologically active pectin-containing polysaccharides of pomegranate Punica granatum[J].International Journal of Biological Macromolecules, 2019, 122:29-36.