食品在加工、储存、运输过程中容易变质,引发食源性疾病,造成严重的食品安全问题[1]。微生物是导致食物变质的主要原因,因此有效控制病原体的生长和繁殖是避免食物变质的关键措施[2]。在食品加工和生产中,化学防腐剂广泛应用于抑制微生物的生长和繁殖,延长保质期,提高食品质量[3]。然而,随着人们越来越关注化学防腐剂的致癌性和毒性问题,对天然植物防腐剂的需求正在增长[4]。粘红酵母分布广泛,普遍存在于土壤、空气以及整个植物圈之中。由于其在0~4 ℃下能够快速生长,会腐败酸奶、奶酪、黄油以及新鲜和加工的肉类、蔬菜和海鲜等乳制品[5]。抗菌肽在20世纪80年代被发现,由生物体基因编码中的小分子肽组成。抗菌肽具有来源于天然、耐热性强和广谱抗菌且多靶点的抑菌机制,不易使病原菌产生耐药性的特点[6],因而,抗菌肽将成为新一代抗菌药物及有可能在食品防腐方面得到广泛的开发和应用[7]。目前报道的抗菌肽通过多种机制抑制细胞,包括细胞壁生物合成、破坏细胞膜、抑制DNA、蛋白质和RNA合成[8-11]。典型作用机制通常包括与质膜的静电相互作用,随后形成孔,导致细胞内容物泄漏,从而引起细胞死亡[12-14]。现在关于乳酸菌抗菌肽研究较多,但是大多是抑制细菌的抗菌肽,对于乳酸菌抗真菌肽研究较少。之前的研究结果显示,从内蒙古传统发酵食品中分离出的副干酪乳杆菌ALAC-4产生的抗菌肽APT已被证实具有广谱的抗菌特性,特别是对真菌的抑制作用[15-16]。本文是对于抗真菌肽对粘红酵母的抑菌机制进行初探。
1 材料与方法
1.1 材料与仪器
粘红酵母菌(Rhodotorula glutinis)CICC 31229,中国工业微生物菌种保藏管理中心;副干酪乳杆菌ALAC-4,分离自内蒙古传统发酵食品,于本实验室保存。正十六烷、苯胺蓝,Macklin公司;钙荧光白(calcofluor white,CFW),Sigma公司;5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(5,6-carboxyfluorescein diacetate succinimidy ester,cFDA)、碘化丙锭(propidium iodide,PI),Molecular Probes 公司;其他试剂均为国产分析纯。
G 100葡聚糖凝胶,北京索莱宝科技有限公司;ZA3300原子吸收分光光度计、SU8100扫描电子显微镜、HT7800/HT7700透射电子显微镜,日本 Hitachi公司;Varioskan LUX Multimode酶标仪,美国赛默飞有限公司;CytoFLEX流式细胞仪,美国Beckman 公司。
1.2 实验方法
1.2.1 抗真菌肽APT的提取方法
将副干酪乳杆菌ALAC-4以4%(体积分数)接种量接种于MRS培养基,在37 ℃下培养24 h后取培养后的发酵液离心(6 500 r/min,10 min),收集上清液。用0.22 μm滤膜过滤上清液,然后真空浓缩后,添加饱和硫酸铵溶液饱和至60%(质量分数)后,置于4 ℃冰箱静置24 h。在4 ℃、8 000 r/min条件下离心10 min,沉淀用PBS(20 mmol/L,pH 6.2)溶解,以磷酸盐缓冲液为透析液并置于4 ℃冰箱中透析14 h,再经超滤、G-50凝胶过滤层析分离后冷冻干燥处理获得乳杆菌源物质,该物质在先前研究中已被证实为肽,将纯化后的APT进行后续抑菌机理研究[17-18]。
1.2.2 抗真菌肽对粘红酵母抑菌率的影响
APT对粘红酵母菌的最低抑菌浓度(minimum inhibitory concentration, MIC)采用二倍稀释法测定,取1×105 CFU/mL的粘红酵母菌培养物500 μL到无菌的Eppendorf管中,加入不同浓度的APT。在30 ℃条件下振荡孵育42 h后分别作1×101、1×102、1×103、1×104、1×105倍稀释,分别取100 μL涂布于YEPD平板,30 ℃培养42 h后,记录板上的菌落数量。MIC终点是在Eppendorf管中没有可见的生长。在培养前后观察试管的视觉浊度,以确认MIC值并计算抑菌率,如公式(1)所示:
抑菌率![]()
(1)
式中:A1,对照管细胞数;A2,实验细胞数。
1.2.3 抗真菌肽处理粘红酵母后细胞壁完整性变化
用PBS将对数期粘红酵母菌细胞的浓度调节至1×106 CFU/mL与不同浓度APT(4 MIC、2 MIC、1 MIC、0.5 MIC、0 MIC)置于30 ℃振荡培养(180 r/min)4 h。孵育结束后用PBS(20 mmol/L,pH 6.2)洗涤细胞后并重悬,各组加入0.1%(体积分数)的苯胺蓝溶液或各组加入8 μg/mL的CFW。避光30 ℃孵育5 min后用PBS(20 mmol/L,pH 6.2)洗涤细胞去除过量的苯胺蓝或CFW后并重悬。使用多功能酶标仪(苯胺蓝:λex/λem=398 nm/508 nm;CFW:λex/λem=365 nm/435 nm)检测荧光强度,以确定β-1,3-葡聚糖和几丁质的暴露量[19]。
1.2.4 K+泄漏实验分析粘红酵母细胞膜通透性
通过测定APT引起的粘红酵母菌细胞内K+的泄漏量来评价其粘红酵母菌细胞膜的破坏作用。用生理盐水将对数期粘红酵母菌细胞的浓度调节至1×106 CFU/mL与不同浓度APT(4 MIC、2 MIC、1 MIC、0.5 MIC、0 MIC)置于 30 ℃振荡培养(180 r/min)4 h,无APT处理组作为对照。孵育结束后离心,取上清液使用原子吸收分光光度计检测上清液中细胞泄漏 K+浓度[20]。
1.2.5 扫描电镜观察抗真菌肽对菌体表面形态的影响
取对数生长期的粘红酵母调整细胞个数为1×106,加入APT使其终浓度分别为4 MIC、2 MIC、1 MIC、0.5 MIC、0 MIC,置于30 ℃恒温振荡培养箱培养4 h,以不加APT处理为空白对照组。孵育结束后用PBS洗涤3次。加入 400 μL 2.5%(质量分数)戊二醛,固定4~6 h。将固定好的菌悬液依次用 30%、50%、70%、80%、90%、100%的乙醇梯度脱水,每次15 min,其中100%乙醇脱水2次。最后于叔丁醇中置换 2 次,每次 30 min并真空干燥 4~5 h。将脱水后的样品在金属箔片上均匀的涂开,用扫描电镜拍照观察结果[21]。
1.2.6 透射电镜观察抗真菌肽对菌体细胞膜的影响
取对数生长期的粘红酵母调整细胞个数为1×106,加入APT,使其终浓度为4 MIC、2 MIC、1 MIC、0.5 MIC、0 MIC,混匀后置于30 ℃摇床振荡培养8 h,以不加APT处理为空白对照组。孵育后用 PBS 洗涤加入 1 mL 2.5%戊二醛固定,固定完毕后用1%锇酸(2%四氧化锇)在 PBS 中固定 2 h。然后依次用30%、50%、70%、80%、90%、100%的乙醇将菌悬液梯度脱水。然后先将脱水后的样品浸入丙酮中脱水 2 次,再分别用体积比为 1∶1 和 1∶3 的丙酮与环氧树脂混合液处理2 h,最后加入纯环氧树脂包埋过夜。将经渗透处理的样品进行包埋,70 ℃加热过夜,并在超薄切片机中切片(60~80 nm)。将上述切片经 2%柠檬酸铅溶液和 3%醋酸双氧铀溶液各染色 20 min,然后在场发射透射电镜下拍照观察[22]。
1.2.7 流式细胞仪测定APT对粘红酵母菌细胞膜和酶活力影响
1.2.7.1 PI、cFDA 单独标记
用PBS将对数期粘红酵母菌细胞的浓度调节至1×106 CFU/mL与APT(4 MIC)置于30 ℃振荡培养(180 r/min)不同时间。孵育结束后用PBS(20 mmol/L,pH 6.2)洗涤细胞后重悬,各组加入50 mmol/L 的 cFDA或30 mmol/L 的 PI。各组样品避光30 ℃孵育10 min后用PBS(20 mmol/L,pH 6.2)洗涤细胞去除过量的 cFDA后重悬。使用流式细胞仪(cFDA:λex/λem=398 nm/508 nm;PI:λex/λem=398 nm/508 nm)进行细胞膜通透性分析。
1.2.7.2 PI、cFDA 双标记
取对数生长期的粘红酵母调整细胞个数为1×106,与APT(4 MIC)置于30 ℃振荡培养(180 r/min)不同时间。孵育结束后用PBS(20 mmol/L,pH 6.2)洗涤细胞后重悬,与35 mmol/L 的 PI 在冰浴中充分染色10 min,离心(8 000 r/min,5 min,4 ℃),用无菌PBS缓冲溶液洗涤 2 次去除过量的 PI,然后与60 mmol/L 的 cFDA 在37 ℃充分染色10 min,离心(8 000 r/min,5 min,4 ℃),用无菌PBS洗涤3次去除过量的 cFDA,使用流式细胞仪(cFDA:λex/λem=398 nm/508 nm;PI:λex/λem=398 nm/508 nm)进行细胞内酶失活状况与细胞膜的破损的分析,实验重复 3 次。
1.3 数据处理
采用SPSS 24.0版进行统计分析(方差分析和Turkey检验)。所有数据均数据以3个独立实验的“平均值±标准差”表示。P<0.05表示差异显著。
2 结果与分析
2.1 抗真菌肽对粘红酵母抑菌率的影响
通过测定APT对粘红酵母菌的抑制效果发现,APT的MIC为15.62 mg/mL,此时抑菌率为65%(表1)。
表1 APT对粘红酵母菌的抑制效果
Table 1 Inhibitory effected by APT on R.glutinis

指标质量浓度/(mg/mL)015.6231.2562.5细胞数量/(CFU/mL)(4.53±0.68)×104a(1.57±0.21)×104b(0.80±0.33)×104c(3.23±1.18)×103d抑菌率/%0658293
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 APT处理粘红酵母后细胞壁完整性变化
通过苯胺蓝和CFW两种荧光试剂检测葡聚糖和几丁质的暴露含量来确定APT对粘红酵母对细胞壁的干扰能力。苯胺蓝和CFW能够分别选择性地与细胞壁的β-1,3-葡聚糖和几丁质特异性结合而产生荧光。采用0.5 MIC、1MIC、2 MIC、4 MIC的APT对粘红酵母进行处理,结果发现随着APT浓度的升高,荧光强度也增加(图1),表明APT可以破坏粘红酵母细胞壁的结构,增加β-1,3-葡聚糖和几丁质的暴露量,从而抑制细胞生长。
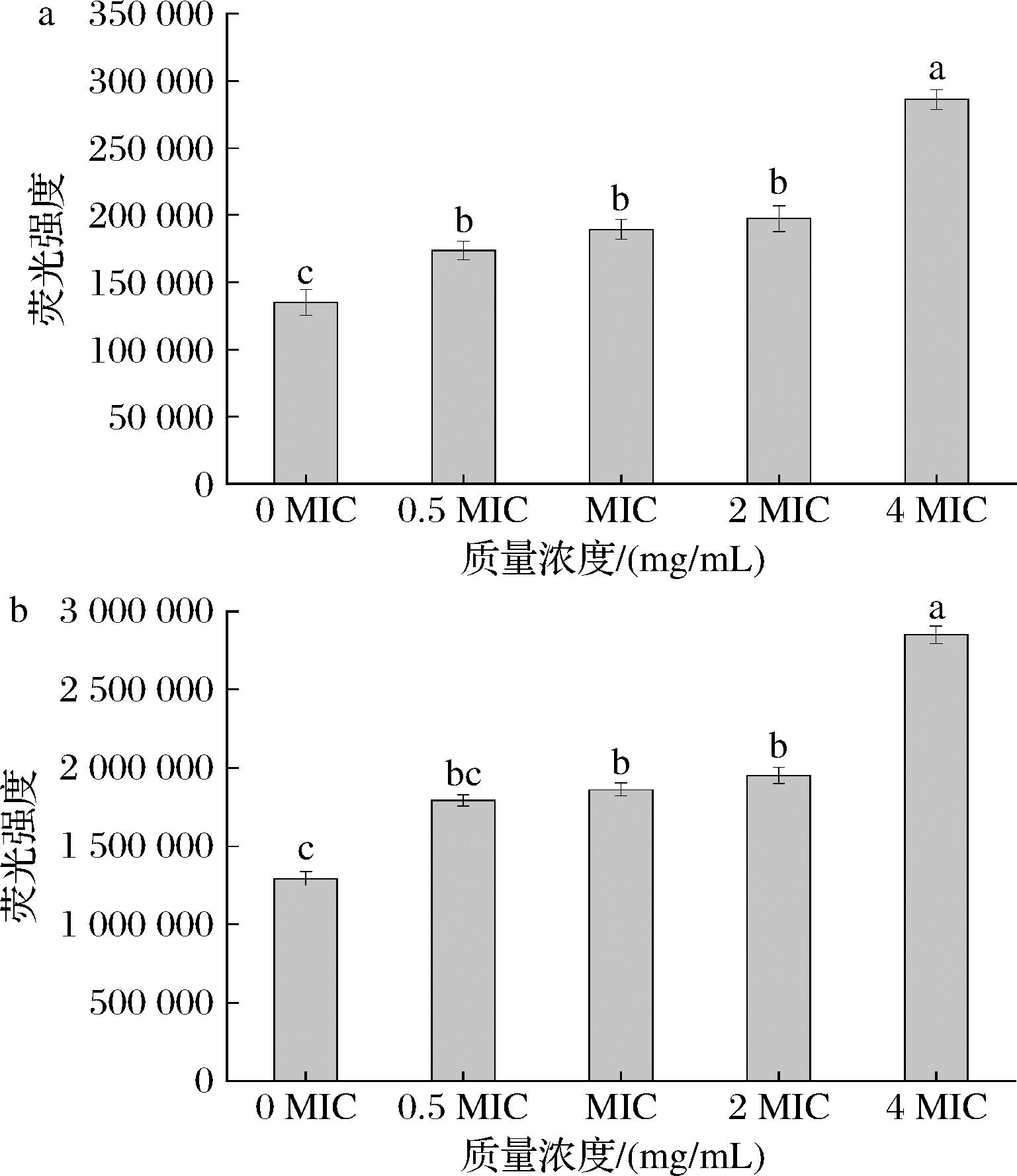
a-苯胺蓝结合葡聚糖的荧光强度;b-CFW结合几丁质的荧光强度
图1 APT对粘红酵母菌细胞壁成分的影响
Fig.1 The influence of the APT on cell wall composition of R.glutinis
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 APT对粘红酵母细胞膜通透性的影响
细胞K+ 的泄漏是细胞离子泄漏的典型指数之一,K+的质量浓度可以反应细胞膜通透性的变化,故通过K+泄漏来确定APT对粘红酵母细胞膜通透性的影响。结果发现随着APT浓度的增加K+泄漏的浓度也增加(图2),表明APT可以通过破坏粘红酵母细胞膜,使细胞离子发生泄漏,导致粘红酵母细胞膜的通透性增加。
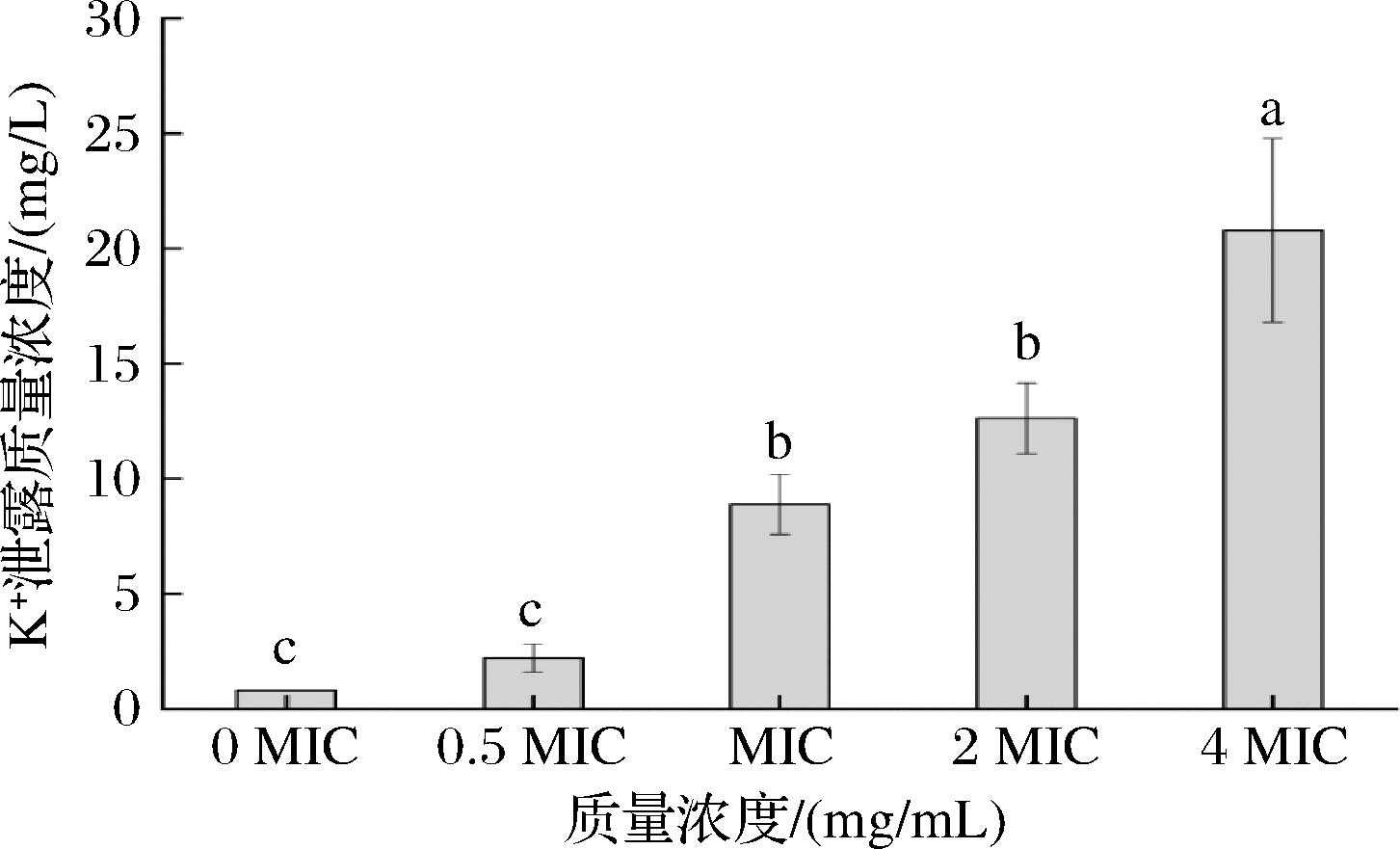
图2 APT诱导粘红酵母菌细胞内 K+泄漏浓度
Fig.2 APT induces intracellular K+leakaged in R.glutinis
2.4 扫描电镜观察APT对菌体表面形态的影响
如图3所示,未经APT作用的粘红酵母菌细胞形态完整,表面饱满,无破损(图3-a);经过APT(0.5 MIC)处理 4 h 后,白假丝酵母菌细胞表面结构都发生了一定程度的变化,细胞表面出现凹陷,褶皱(图3-b);经过APT(MIC、2 MIC)处理 4 h 后,菌体细胞表面轮廓出现严重的变形,呈不规则状态,细胞呈波纹状皱缩(图3-c、图3-d),4 MIC浓度的APT处理4 h后部分细胞表面出现孔洞(图3-e)。结果表明APT可使其粘红酵母细胞表面出现一定程度的损伤。

a-未经处理;b-0.5 MIC APT处理4 h;c-MIC APT处理4 h;d-2MIC APT处理4 h;e-4 MIC APT处理4 h
图3 APT处理粘红酵母扫描电镜图
Fig.3 SEM of R.glutinis treated by APT
2.5 透射电镜观察APT对菌体细胞膜的影响
采用透射电镜观察APT对粘红酵母菌细胞膜的损伤情况及超微结构的变化,研究其对菌体细胞内部结构的影响,结果如图4所示。未经APT作用的菌体具有完整的细胞膜和细胞壁,细胞形态规则,表面光滑(图4-a);APT(0.5 MIC、MIC)作用 4 h 后,细胞质内出现空泡的现象,细胞壁形状出现不规则的现象(图4-b、图4-c);APT(2 MIC)作用 4 h 后细胞膜不连续,部分细胞发生溶解,形成大小各异的孔隙(图4-d);APT(4 MIC)作用 4 h 后观察到细胞壁外形阴影出现涣散,细胞内部液泡化,细胞质内出现空泡的现象,细胞形态发生明显的改变,细胞膜出现破损(图4-e)。

a-未经处理粘红酵母菌;b-0.5 MIC APT处理 4 h 粘红酵母菌;c-MIC APT处理 4 h 粘红酵母菌;d-2MIC APT处理4 h粘红酵母菌;e-4 MIC APT处理 4 h 粘红酵母菌
图4 APT处理粘红酵母透射电镜图
Fig.4 TEM of R.glutinis treated by APT
2.6 流式细胞仪测定APT对粘红酵母菌细胞膜和酶活影响
2.6.1 PI 和 cFDA 单标记
当APT(4 MIC)孵育 60 min 时粘红酵母细胞内酶开始失活,但此时 PI 荧光增强没有显著性,表明细胞膜仍然保持完整,胞内酶系开始紊乱;180 min时细胞内酶进一步失活,此时观察到进入细胞的 PI 量显著增加,表明细胞通透性增加,细胞膜破裂(图5、图6)。由此可见,粘红酵母菌细胞细胞膜的破损与细胞内酶系紊乱并非同步进行的,即APT(4 MIC)在影响细胞的生理代谢反应时细胞膜并没有破损。
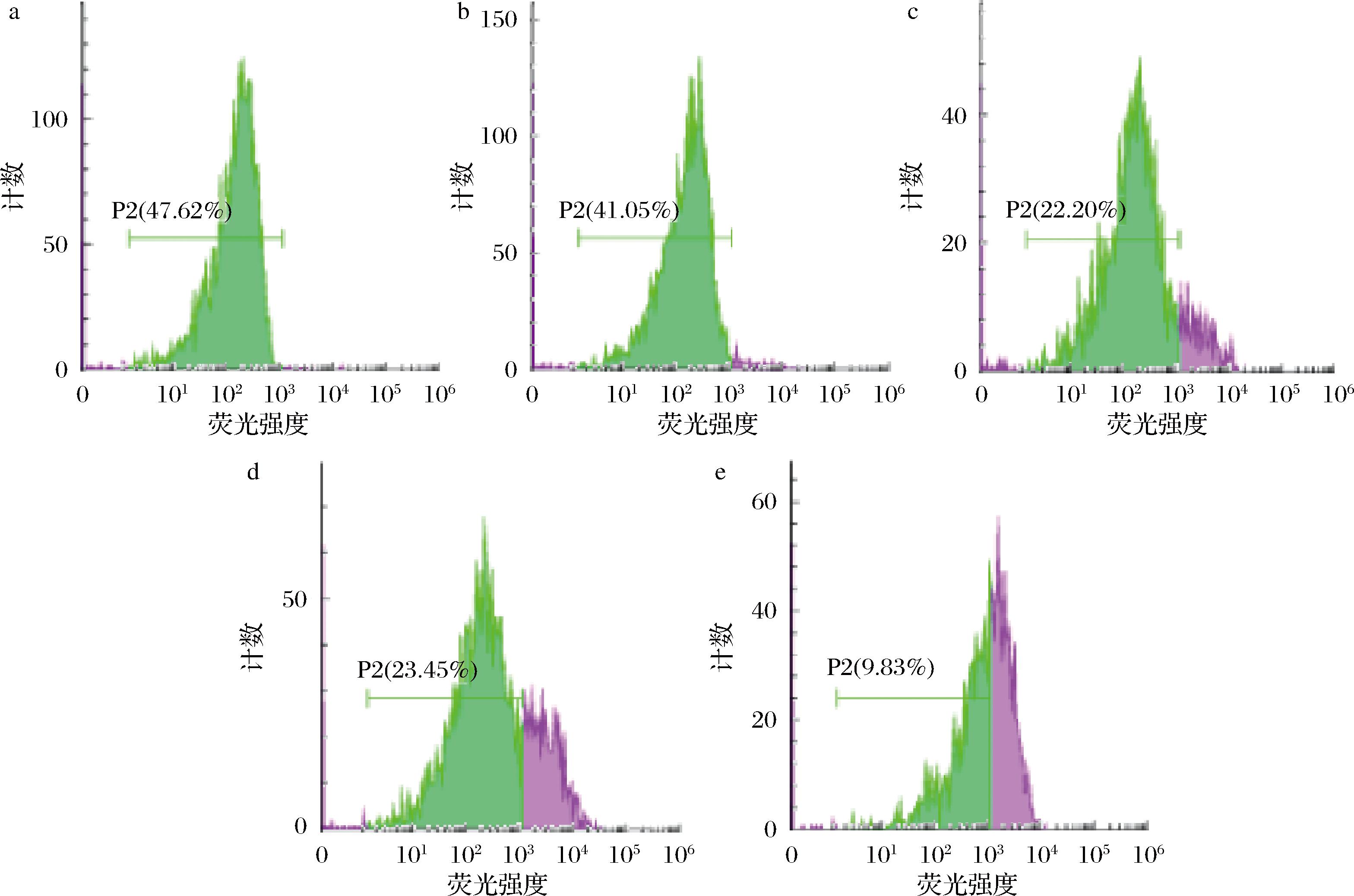
a-APT处理0 min;b-APT处理 60 min;c-APT处理 120 min;d-APT处理 180 min;e-APT处理 240 min
图5 APT处理粘红酵母菌PI流式细胞图
Fig.5 Flow cytometry chart of R.glutinis PI treated by APT
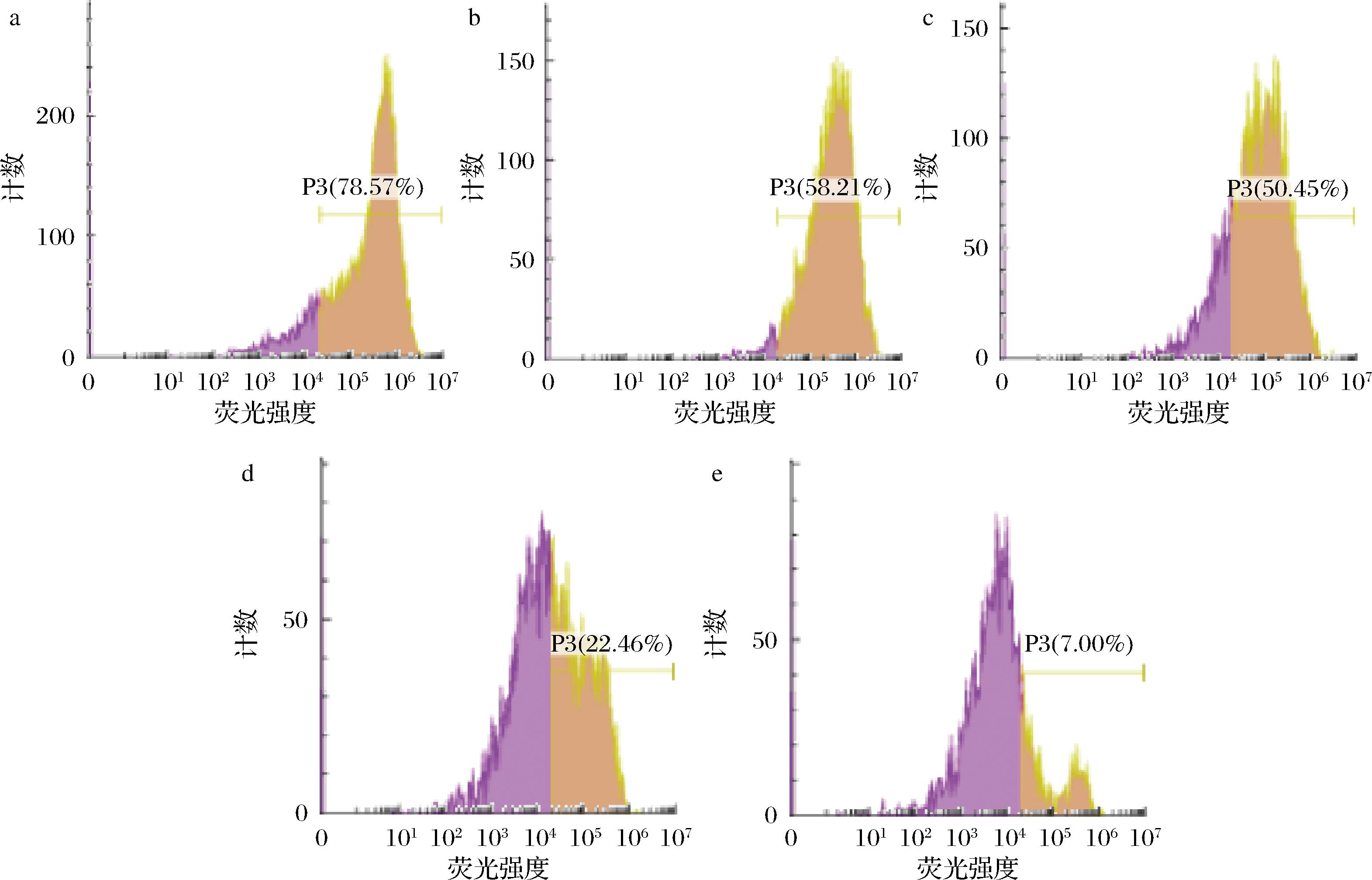
a-APT处理 0 min;b-APT处理 60 min;c-APT处理 120 min;d-APT处理 180 min;e-APT处理 240 min
图6 APT处理粘红酵母菌cFDA流式细胞图
Fig.6 Flow cytometry chart of R.glutinis cFDA treated with APT
2.6.2 PI、cFDA双标记
在使用流式细胞仪cFDA/PI双染法进行细胞生化检测时,可将所有细胞归为4类:未染色细胞(R1,cF- PI-),为细胞碎片或严重破损的细胞;cFDA染色细胞(R2,cF+PI-),细胞膜完整,胞内酶系正常的细胞;PI染色细胞(R3,cFPI+),细胞膜破损细胞;cFDA/PI双染细胞(R4,cF+ PI+),这部分细胞已被证明为损伤亚死细胞[23-24]。如图7 所示,随着与APT 孵育时间的延长,粘红酵母菌的细胞膜破损增多,内酶系出现紊乱,处于亚致死状态的细胞也逐渐增多(R4),这表明APT对与粘红酵母菌的作用非瞬时致死而是经过亚致死阶段,然后逐渐死亡。
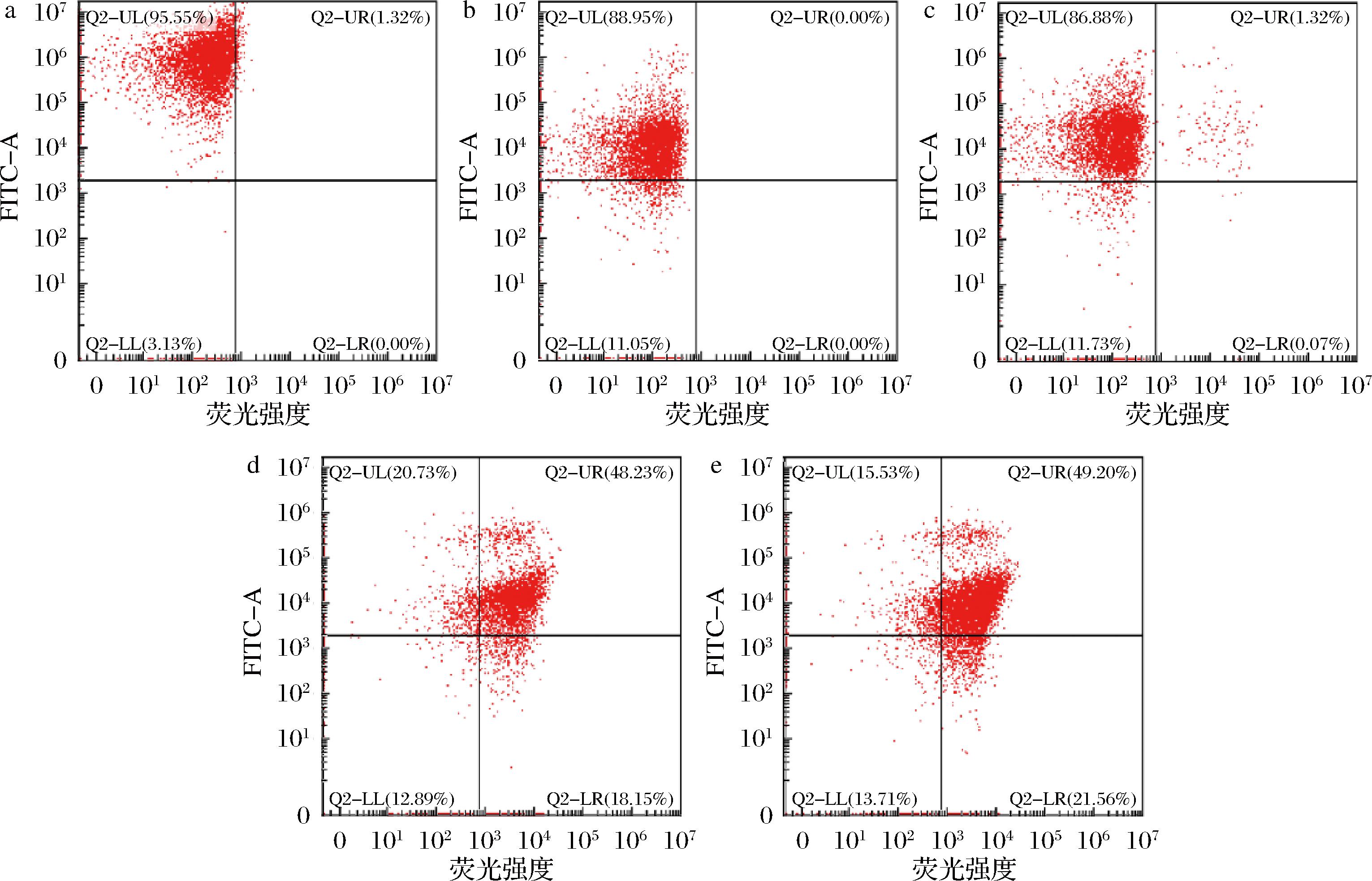
a-APT处理 0 min;b-APT处理 60 min;c-APT处理 120 min;d-APT处理 180 min;e-APT处理 240 min
图7 粘红酵母细胞的cFDA/PI双染色流式细胞图
Fig.7 cFDA/PI double stained flow cytometry of R.glutinis cells
3 讨论
本实验从副干酪乳杆菌ALAC-4的抗真菌肽APT对粘红酵母菌的细胞壁、细胞膜及胞内酶活力的影响方面探索了 APT 对粘红酵母的抗菌作用。结果发现 APT 对粘红酵母菌有较强的抑菌效果。通过苯胺蓝和CFW实验发现荧光强度随着APT浓度的升高而增加,表明APT可以破坏粘红酵母细胞壁的结构,增加β-1,3-葡聚糖和几丁质的暴露量,从而抑制细胞生长。
细胞膜的完整性对于细胞维持胞内环境的相对稳定以及各种生化反应有序运行有十分关键的作用。K+泄露实验结果显示,APT(4 MIC)处理粘红酵母细胞后,K+浓度升高,表明APT破坏了细胞膜完整性。扫描电镜和透射电镜的结果也证实了 APT(4 MIC)使粘红酵母菌形态结构改变、破坏粘红酵母细胞壁膜结构完整性,从而导致细胞死亡,从而有效抑制粘红酵母细胞生长。以上结果表明,抗菌肽APT可通过破坏粘红酵母菌的细胞膜进入细胞发挥抗真菌作用。
通过PI和cFDA测定了APT处理粘红酵母细胞膜破损和内酶系紊乱的时间,结果表明细胞内酶失活状况与细胞膜的破损并非同步进行的,而且APT对粘红酵母菌的杀伤作用非瞬时致死,而是经过一个亚致死阶段,即细胞受损但仍存活阶段。因此, APT对粘红酵母菌的抑制作用主要通过破坏细胞壁、细胞膜,同时引起胞内酶系统紊乱导致细胞损伤。
综上可知抗菌肽APT对粘红酵母细胞壁膜以及胞内酶系造成影响从而起到抑菌作用。
[1] ALFEI S, MARENGO B, ZUCCARI G.Nanotechnology application in food packaging:A plethora of opportunities versus pending risks assessment and public concerns[J].Food Research International, 2020, 137:109664.
[2] KUMARIYA R, GARSA A K, RAJPUT Y S, et al.Bacteriocins:Classification, synthesis, mechanism of action and resistance development in food spoilage causing bacteria[J].Microbial Pathogenesis, 2019, 128:171-177.
[3] RAHMAN M M, DIPTI T T, ISLAM M N, et al.Chemical composition, antioxidant and antibacterial activity of Piper chaba stem extracts with preservative effects on storage of raw beef patties[J].Saudi Journal of Biological Sciences, 2023, 30(6):103663.
[4] GUTIÉRREZ-DEL-R O I, L
O I, L PEZ-IB
PEZ-IB
 EZ S, MAGAD
EZ S, MAGAD N-CORPAS P, et al.Terpenoids and polyphenols as natural antioxidant agents in food preservation[J].Antioxidants, 2021, 10(8):1264.
N-CORPAS P, et al.Terpenoids and polyphenols as natural antioxidant agents in food preservation[J].Antioxidants, 2021, 10(8):1264.
[5] PITT J I, HOCKING A D.Fungi and Food Spoilage[M].New York:Springer-Verlag, 2009.
[6] YEAMAN M R, YOUNT N Y.Mechanisms of antimicrobial peptide action and resistance[J].Pharmacological Reviews, 2003, 55(1):27-55.
[7] 王亚平, 余维维, 秦梦茹, 等.抗菌肽的作用机理及应用[J].湖北农业科学, 2018, 57(5):9-13;70.
WANG Y P, YU W W, QIN M R, et al.Antibacterial mechanism and application of antimicrobial peptides[J].Hubei Agricultural Sciences, 2018, 57(5):9-13;70.
[8] HEYDARIAN A, FALAH F, YAZDI F T, et al.Optimization of dairy sludge fermentation culture medium to produce extracts containing bioactive peptides using co-culture of Limosilactobacillus fermentum and Saccharomyces cerevisiae[J].Journal of Functional Foods, 2024, 112:105982.
[9] BOMAN H G, AGERBERTH B, BOMAN A.Mechanisms of action on Escherichia coli of cecropin P1 and PR-39, two antibacterial peptides from pig intestine[J].Infection and Immunity, 1993, 61(7):2978-2984.
[10] GRAF M, MARDIROSSIAN M, NGUYEN F, et al.Proline-rich antimicrobial peptides targeting protein synthesis[J].Natural Product Reports, 2017, 34(7):702-711.
[11] ZHANG Y, LIU S C, LI S M, et al.Novel short antimicrobial peptide isolated from Xenopus laevis skin[J].Journal of Peptide Science, 2017, 23(5):403-409.
[12] BROGDEN K A.Antimicrobial peptides:Pore formers or metabolic inhibitors in bacteria?[J].Nature Reviews.Microbiology, 2005, 3(3):238-250.
[13] NGUYEN L T, HANEY E F, VOGEL H J.The expanding scope of antimicrobial peptide structures and their modes of action[J].Trends in Biotechnology, 2011, 29(9):464-472.
[14] NICOLAS P.Multifunctional host defense peptides:Intracellular-targeting antimicrobial peptides[J].The FEBS Journal, 2009, 276(22):6483-6496.
[15] CHEN Z J, LI X T, GAO H C.Production of proteinaceous antifungal substances from Lactobacillus plantarum ALAC-4 isolated from Inner Mongolian traditional fermented dairy food[J].International Journal of Dairy Technology, 2018, 71(S1):223-229.
[16] WANG S, ZHANG Y J, MANDLAA, et al.Properties and mechanism of the antimicrobial peptide APT produced by Lactobacillus ALAC-4[J].LWT, 2022, 165:113713.
[17] LEE H, HWANG J S, LEE D G.Scolopendin, an antimicrobial peptide from centipede, attenuates mitochondrial functions and triggers apoptosis in Candida albicans[J].Biochemical Journal, 2017, 474(5):635-645.
[18] PERUMAL V, VENKATESAN A.Antimicrobial, cytotoxic effect and purification of bacteriocin from vancomycin susceptible Enterococcus faecalis and its safety evaluation for probiotization[J].LWT, 2017, 78:303-310.
[19] 杨开, 胡君荣, 何荣军, 等.食药用菌功能性 β-葡聚糖荧光法测定研究[J].菌物学报, 2009, 28(3):399-406.
YANG K, HU J R, HE R J, et al.Fluorometry method for quantitative determination of functional β-glucans from edible and medicinal mushrooms[J].Mycosystema, 2009, 28(3):399-406.
[20] 黄巍, 王建清, 张倩.香旱芹精油对金黄色葡萄球菌抑菌机理的研究[J].中国调味品, 2017, 42(12):7-11;22.
HUANG W, WANG J Q, ZHANG Q.Study on the antibacterial mechanism of ajowan essential oil against Staphylococcus aureus[J].China Condiment, 2017, 42(12):7-11;22.
[21] XIANG W L, LIANG H Z, LIU S, et al.Isolation and performance evaluation of halotolerant phosphate solubilizing bacteria from the rhizospheric soils of historic Dagong Brine Well in China[J].World Journal of Microbiology and Biotechnology, 2011, 27(11):2629-2637.
[22] WANG T M, SHI G X, SHAO J, et al.In vitro antifungal activity of baicalin against Candida albicans biofilms via apoptotic induction[J].Microbial Pathogenesis, 2015, 87:21-29.
[23] AMOR K B, BREEUWER P, VERBAARSCHOT P, et al.Multiparametric flow cytometry and cell sorting for the assessment of viable, injured, and dead Bifidobacterium cells during bile salt stress[J].Applied and Environmental Microbiology, 2002, 68(11):5209-5216.
[24] GRAÇA DA SILVEIRA M, VIT RIA SAN ROM
RIA SAN ROM O M, LOUREIRO-DIAS M C, et al.Flow cytometric assessment of membrane integrity of ethanol-stressed Oenococcus oeni cells[J].Applied and Environmental Microbiology, 2002, 68(12):6087-6093.
O M, LOUREIRO-DIAS M C, et al.Flow cytometric assessment of membrane integrity of ethanol-stressed Oenococcus oeni cells[J].Applied and Environmental Microbiology, 2002, 68(12):6087-6093.