氧化应激是指生物体内自由基过量导致氧化防御系统紊乱所产生的一系列自适应性反应[1]。过量的自由基会攻击蛋白质、磷脂、核酸等生物大分子,造成组织损伤和遗传信息丢失,进而危害机体健康。对此,采用最广泛的策略是利用外源性抗氧化剂来清除活性氧的积累[2]。然而,传统商业抗氧化剂,如叔丁基对羟基茴香醚、二丁基羟基甲苯等,普遍存在一定的毒副作用[3]。因此,寻找并开发新型天然抗氧化剂在现代食品工业中尤为重要。多糖是单糖通过α或β糖苷键连接而成的一类天然高分子聚合物,不仅是构成生命活动的基本物质之一,而且广泛参与体内自由基的控制及细胞损伤的修复[4-5],这使得多糖产品在发酵工业、食品工业、医药等领域受到广泛关注。
马尾藻(Sargassum)是马尾藻科马尾藻属的一种可食用褐藻,广泛分布于全球各地,富含多种营养成分,如多糖、蛋白质、维生素和膳食纤维等[6],一直被用作治疗性药物佐剂。前期研究表明,马尾藻多糖在预防肿瘤发生、消化道炎症、心血管疾病上发挥着重要作用,与增强氧化耐受性有着紧密的联系[5,7-8]。因此,马尾藻多糖在功能性食品领域具有较好的开发前景。多糖的提取方式显著影响产物的结构特性,包括单糖组成、分子形状和官能团分布等[9]。这些性质又进一步影响其生物功能活性,尤其是抗氧化活性。据报道,多糖的抗氧化和免疫调节活性与硫酸基团含量呈正相关,同时糖醛酸和半乳糖的含量则显著影响血管紧张素转化酶的功能性[10-11]。因此,筛选并优化出合适的制备工艺是获得稳定且具有良好生物活性多糖产物的技术基础。超声波提取法可以通过超声的空化效应破坏植物细胞壁,使内部多糖渗出,具有能源利用率高、多糖完整性好、产物制备效率高等优势,常用于多糖提取[4,12-13]。此外,WEI等[12]发现超声法提取多糖的抗氧化能力要高于传统的热水提取法。
本文对超声波辅助提取法的工艺进行优化,系统性地研究马尾藻多糖的化学组成、多尺度结构和表观形貌等结构和理化特性。在此基础上,评价其体外抗氧化活性,以期为马尾藻多糖的产业化发展和综合应用提供理论基础。
1 材料与方法
1.1 材料与试剂
马尾藻干品,山东省荣成市海聚水产有限公司,使用磨样机磨碎后过100目筛,装袋备用。
葡萄糖、95%乙醇,西陇科学有限公司;维生素C,上海麦克莱恩生化试剂有限公司;苯酚、浓硫酸,中国医药集团化学试剂有限公司;KBr,麦克林化学试剂有限公司;超氧阴离子自由基(·O2-)清除能力试剂盒,索莱宝科技有限公司;铁离子还原能力检测试剂盒,上海琮益科技有限公司。
1.2 仪器与设备
PR224ZH/E电子天平,奥豪斯仪器有限公司;XM-400VDE超声机,小美超声仪器有限公司;H2050R高速离心机,湖南湘仪实验室仪器开发公司;DHG-9240干燥箱,上海精宏仪器设备有限公司;Readmax 1900酶标仪,上海闪谱生物科技有限公司;RE-3000旋转蒸发仪,上海亚荣生化仪器厂;ICS5000离子色谱仪,赛默飞世尔科技公司;Rheodyne 7725i注射器、miniDAWN®-3多角度激光散射仪、Optilab T-rEX示差折光检测器,怀雅特技术公司;X,Pert3 X射线衍射仪,荷兰帕纳科公司;S-3400 N冷场发射扫描电子显微镜,日本电子株式会社;VEC70R-33傅里叶变换红外光谱仪、Cypher S原子力显微镜,德国布鲁克公司;Shodex RI-101示差检测器,昭和电工株式会社。
1.3 实验方法
1.3.1 马尾藻成分分析
参照GB/T 6433—2006《饲料中粗脂肪的测定》对粗脂肪进行测定,GB/T 20806—2022 《饲料中中性洗涤纤维(NDF)的测定》对中性洗涤纤维进行测定,GB/T 20805—2006 《饲料中酸性洗涤木质素(ADL)的测定》对酸性洗涤木质素进行测定,GB/T 6438—2007《饲料中粗灰分的测定》对粗灰分进行测定,GB/T 6435—2014《饲料中水分的测定》对水分进行测定,GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》对粗蛋白进行测定,NY/T 1459—2022《饲料中酸性洗涤纤维的测定》对酸性洗涤纤维进行测定。
1.3.2 马尾藻多糖提取
称取一定量的马尾藻粉于50 mL离心管中,固定提取温度为60 ℃、料液比为1∶30(g∶mL)、提取时间为45 min,筛选不同超声频率(28、45、100 kHz)对多糖提取率的影响。在提取率最高的条件下,改变料液比(1∶15、1∶30、1∶45、1∶60、1∶75,g∶mL),探究料液比对多糖提取率的影响。在提取效果最高的条件下,改变提取温度(30、40、50、60、70 ℃),探究提取温度对提取率的影响。最后在上述最优条件下,探究提取时间(45、90、135、180、225 min)对提取率的影响。提取后进行离心(8 000 r/min,10 min),收集上清液。
1.3.3 多糖提取率测定
通过苯酚-硫酸法测定多糖含量,以葡萄糖为标准绘制标准曲线,标准曲线方程为y=3.983x+0.023,R2=0.999 3。将测定的吸光度(490 nm)通过标准曲线换算成质量浓度ρ。
多糖提取率按如下公式进行计算:
提取率![]()
(1)
式中:mdaf,原料质量(去除灰分和水分),g;ρ,多糖质量浓度,mg/mL;V,提取液体积,mL;P,稀释倍数。
1.3.4 马尾藻多糖分离
对多糖提取液进行旋转蒸发进行浓缩后,以1∶4(体积比)比例加入95%(体积分数)乙醇,4 ℃静置12 h后离心(8 000 r/min,10 min),收集沉淀,烘干后得马尾藻多糖。
1.3.5 马尾藻多糖分子质量及分子形状解析
分别通过甲苯、右旋糖苷校正多角度激光散射仪(size-exclusion chromatographic analysis with multiangle laser light scattering detection,SEC-MALLS)的90°光电二极管极管检测器和其余17个不同角度光电二极管检测器,采用牛血清白蛋白明确SEC-MALLS和示差折光检测器(refractive index detector,RI)间的体积延迟。并通过不同角度的光散射强度测定马尾藻多糖的分子质量和均方根旋转半径。流动相(0.1 mol/L NaCl)流速为0.5 mL/min,绝对折射率增量为0.145 mL/g。
1.3.6 马尾藻多糖的组成及结构分析
a)单糖组成测定
使用离子色谱仪(ion chromatography,IC)对马尾藻单糖组成进行测定。精密称量5 mg样品置于安瓿瓶中,加入3 mol/L三氟乙酸2 mL,120 ℃水解3 h。准确吸取酸水解溶液转移至管中N2吹干,加入5 mL去离子水后涡旋混匀,吸取50 μL样品加入950 μL去离子水,12 000 r/min离心5 min。取上清进IC分析。
色谱条件:色谱柱:Dionex CarbopacTM PA20(3 mm×150 mm);流动相:A:H2O,B:15 mmol/L NaOH;C:15 mmol/L NaOH &100 mmol/L CH3COONa;流速:0.3 mL/min;进样量:25 μL;柱温:30 ℃。
b)傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
称取干燥样品5 mg,以1∶100(质量比)的比例与KBr粉末(光谱级)混合,采用FTIR仪对马尾藻多糖的红外光谱进行测定。频率范围为500~4 000 cm-1,分辨率为4 cm-1。
c)核磁共振谱(nuclear magnetic resonance,NMR)分析
样品溶解于D2O中后转移至5 mm口径核磁管。使用400 MHz核磁共振光谱仪在25 ℃记录核磁共振的1H-NMR谱图。
d)X射线衍射仪(X-ray diffraction,XRD)分析
采用XRD仪从分析5°~40°的衍射数据,腔内电压和电流分别设置为 40 kV和 40 mA,扫描频率固定在2.5 °/min。
e)扫描电子显微镜(scanning electron microscope,SEM)分析
多糖粉末进行喷金处理后,置于SEM样品室中抽真空,当真空度达到5×10-3时,在20 000倍数下采用冷场发射扫描电子显微镜观察多糖样品的微观形貌,加速电流为5 kV。
f)原子力显微镜(atomic force microscope,AFM)分析
将20 μL马尾藻多糖溶液(0.1 μg/mL)滴至云母片表面,稳定1 min后,通过氮气对其缓慢干燥,然后利用AFM对多糖的表观形貌进行观察。
1.3.7 马尾藻多糖体外抗氧化测定
a)铁离子还原能力
采用铁离子还原能力检测试剂盒对不同质量浓度马尾藻多糖和维生素C(0.4、0.8、1.2、1.6、2.0 mg/mL)的铁离子还原能力进行检测。在700 nm处测定吸光度,吸光度越大,铁还原能力越强。
b)超氧阴离子自由基(·O2-)清除能力
采用·O2-清除能力检测试剂盒对不同质量浓度马尾藻多糖和维生素C(0.02、0.04、0.06、0.08、1.0 mg/mL)的·O2-清除能力进行检测,在530 nm处测定吸光度A,以蒸馏水为空白对照,马尾藻多糖溶液对·O2-的清除率按如下公式计算:
·O2-清除率![]()
(2)
式中:A1,空白组吸光值;A2,测定组吸光值。
1.4 数据处理与分析
各指标的测定重复3次,取平均值,使用GraphPad Prism 8 和AI进行绘图,采用Minitab 21.1进行数据分析。
2 结果与分析
2.1 马尾藻的组成成分分析
马尾藻成分分析结果如表1所示,马尾藻中含有丰富的营养物质,其中碳水化合物是其最主要的成分,其质量比重约占33.1%,显著高于紫菜、石花菜等经济藻类[14-15],这为以马尾藻多糖为研究对象提供理论依据。
表1 马尾藻成分分析 单位:%
Table 1 Component analysis of Sargassum
成分碳水化合物脂肪蛋白质木质素灰分水分含量33.1±0.851.0±0.0312.0±0.4210.3±0.2827.9±0.8715.7±0.3
2.2 马尾藻多糖超声波提取法工艺优化
2.2.1 超声频率对马尾藻多糖提取率影响
如图1所示,马尾藻多糖的提取率随超声波频率的增加而逐渐降低,当频率为28 kHz时,多糖的提取率达到最大值(7.02%)。超声波作为一类机械波,频率越低,衰减系数越慢、能量密度越高,产生的穿透力、空化作用和剪切应力就越强。因此,多糖更容易从细胞壁中释放出来[12-13]。因此,选择频率28 kHz进行后续实验。
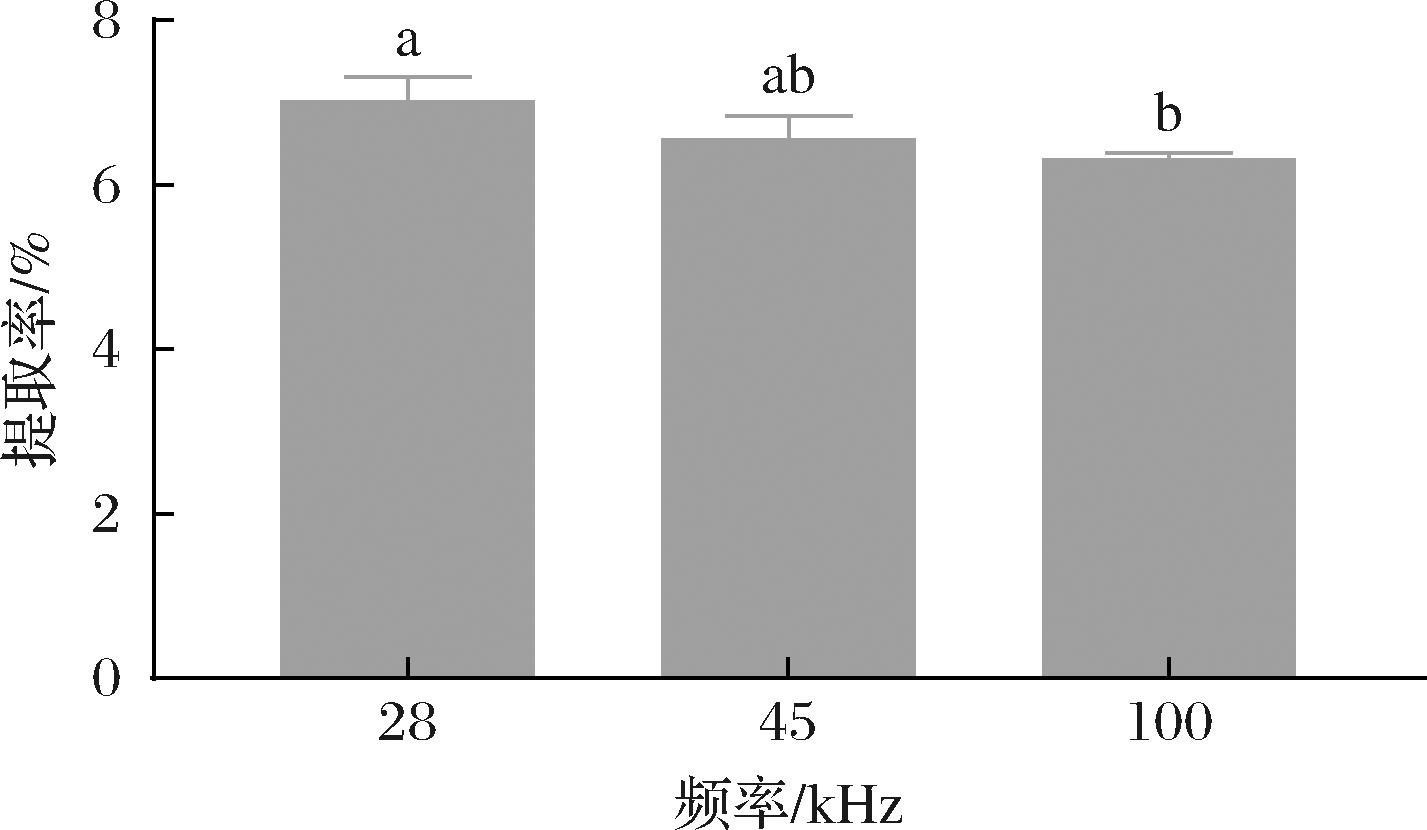
图1 超声波频率对马尾藻多糖提取率的影响
Fig.1 Effect of ultrasonic frequency on the extraction rate of Sargassum polysaccharide
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2.2 料液比对马尾藻多糖提取率影响
如图2所示,马尾藻多糖的提取率随料液比的增加先升高再降低,料液比为1∶60(g∶mL)时,多糖的提取率达到最大值(8.09%)。增加溶剂的比例可提高马尾藻细胞的分散程度,使多糖更易于从细胞质中直接扩散出来,但溶剂的增加可能会导致其他杂质溶出,这些成分在超声波条件下易于与多糖相互作用形成复杂的聚合物,从而引起产率下降[16],同时过多的溶剂添加会造成额外的资源浪费。因此,选择料液比1∶60(g∶mL)进行后续实验。
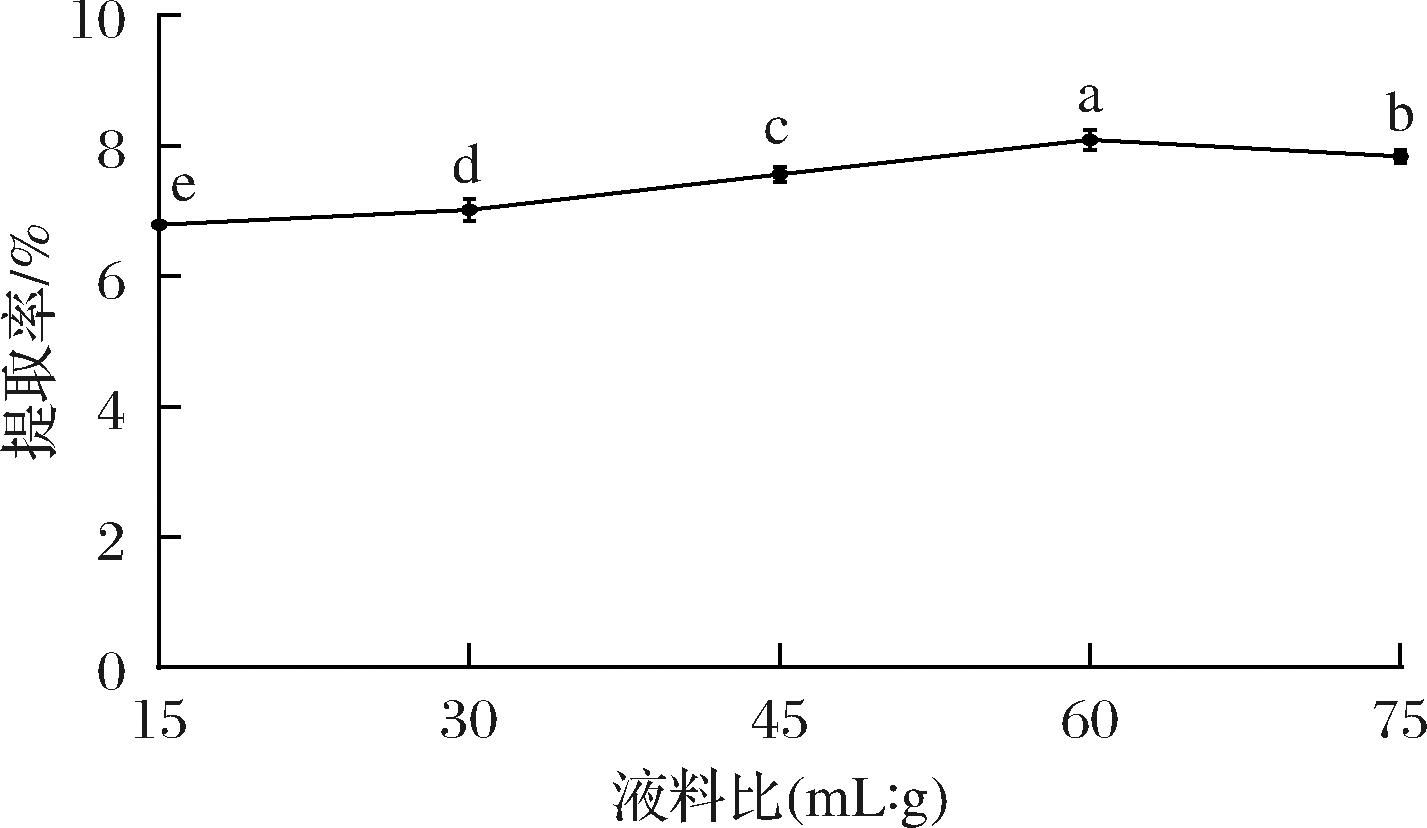
图2 液料比对马尾藻多糖提取率的影响
Fig.2 Effect of liquid-mass ratio on the extraction rate of Sargassum polysaccharide
2.2.3 提取温度对马尾藻多糖提取率影响
如图3所示,马尾藻多糖的提取率随温度的增加先升高再降低,当温度为70 ℃时,多糖的提取率达到最大值(8.28%)。温度升高,马尾藻细胞壁机械强度下降,更容易被超声波空化作用穿透,加快了细胞内容物的扩散速度,促进了多糖的溶解。当超声波温度过高,细胞逐渐倾向于凝聚,这些团聚结构抑制了细胞质内多糖的析出[17-18]。因此,选择提取温度70 ℃进行后续实验。
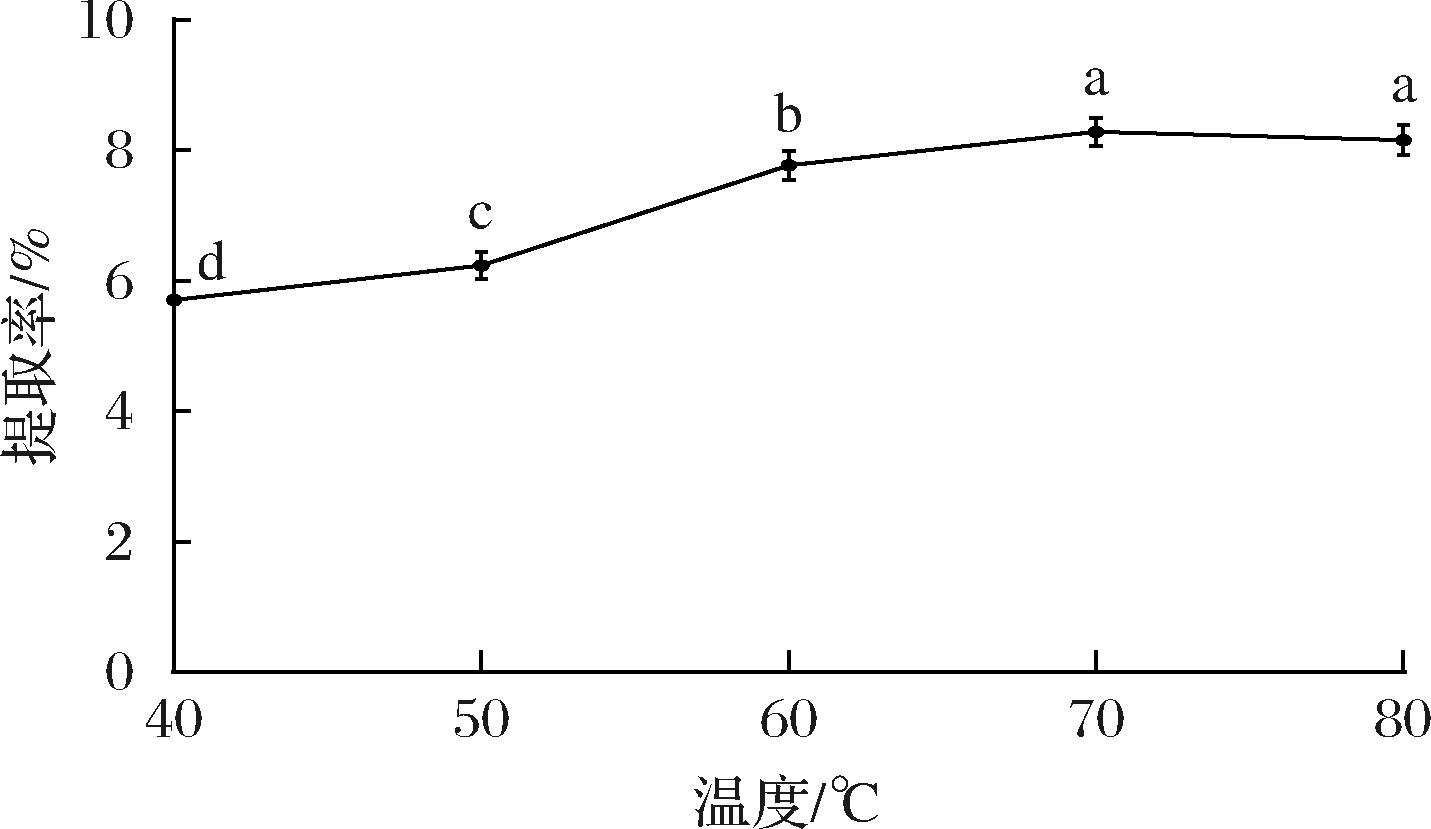
图3 温度对马尾藻多糖提取率的影响
Fig.3 Effect of temperature on the extraction rate of Sargassum polysaccharide
2.2.4 提取时间对马尾藻多糖提取率影响
如图4所示,马尾藻多糖的提取率随超声波提取时间的增加先升高再降低,随着超声波时间的延长,超声波的空化效应引发的局部高温高压使糖苷键断裂的概率提高,部分多糖开始降解为小分子物质,多糖产率即出现下降趋势[19]。当时间为180 min时,多糖的提取率达到最大值(9.73%)。因此,选择时间180 min对多糖进行提取。
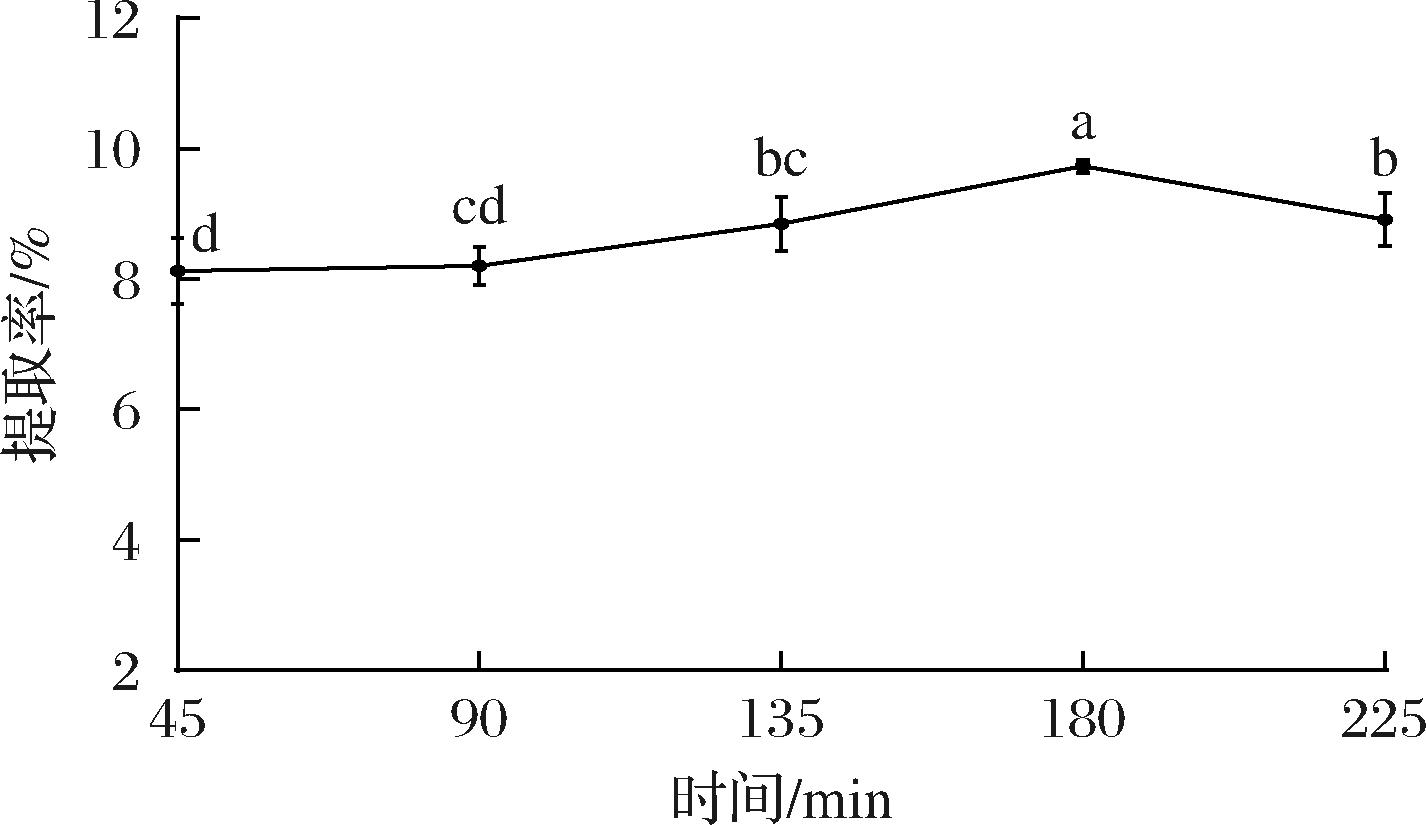
图4 超声时间对马尾藻多糖提取率的影响
Fig.4 Effect of ultrasonic time on the extraction rate of Sargassum polysaccharide
2.3 马尾藻多糖多尺度结构表征
2.3.1 马尾藻多糖分子质量以及分子链构象的研究
多糖的理化和功能性质与其相对分子质量密切相关。如图5-a所示,马尾藻多糖的重均分子质量(weight-average molecular weight,Mw)为1.18×107(±3.13%)g/mol,其分子质量显著高于金桔多糖和人参多糖[20]。研究表明,同一类多糖分子质量越大、分布越宽,其凝胶性能和流变特性也就越强。因此,马尾藻多糖作为一类典型的大分子碳水化合物,在现代食品加工中具有一定的应用潜力。同时观察到样品的多分散系数仅为1.145左右,说明通过超声波辅助法得到的马尾藻多糖组分均一性较强,为后续的结构研究奠定基础。
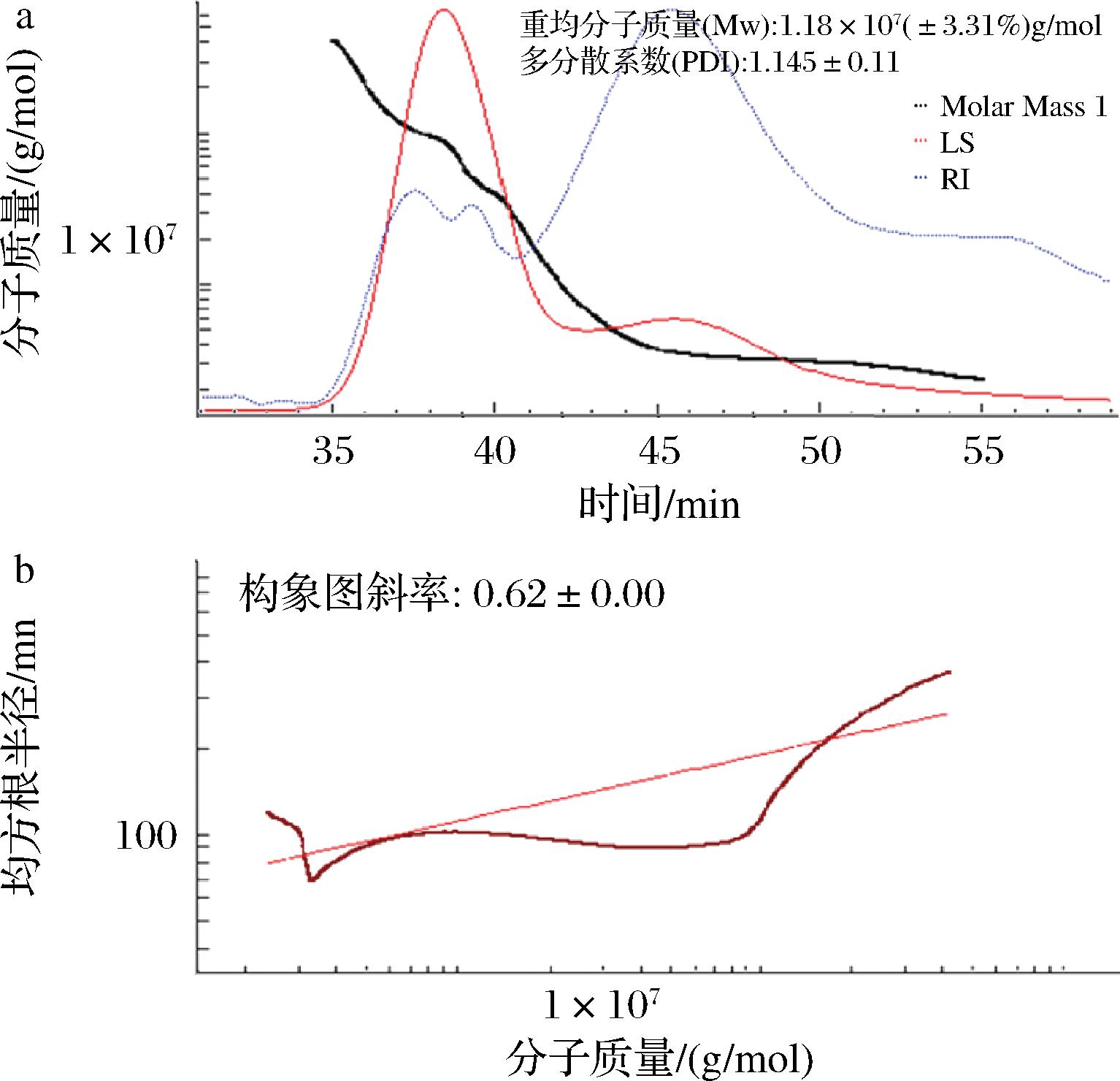
a-分子质量分布色谱图;b-糖链构象色谱图
图5 马尾藻多糖的色谱图
Fig.5 Chromatogram of Sargassum polysaccharide
本研究还借助SEC-MALLS-RI系统考察了高分子的Mw与其均方旋转半径(S2)之间的关系获得关于多糖分子构象的信息。根据图5-b可知,Mw与S2之间存在着明显的线性关系,通过拟合可得到其斜率(k)为0.62,因此马尾藻多糖可被认为是以无规则卷曲构象存在于溶液中。由于多糖分子质量较大,推测马尾藻多糖链具有较高的分子柔性并伴随着较弱的分子内作用力(氢键、范德华力)。
2.3.2 单糖组成分析
单糖组成不仅是影响多糖结构的重要因素,而且与多糖的活性也有密切的关系[21-22]。如图6-a和图6-b所示,马尾藻多糖峰分离度较好,可作为多糖单糖组成进一步分析的依据,马尾藻多糖中主要含有果糖(Fru)、糖醛酸(Uronic acid)、岩藻糖(Fuc)、半乳糖(Gal)和甘露糖(Man)等,其摩尔比为56.6∶16.2∶8.4∶8.3∶6.8(图6-c)。其中,糖醛酸被认为广泛存在于植物细胞壁中,与细胞的氧化耐受性密切相关[23]。
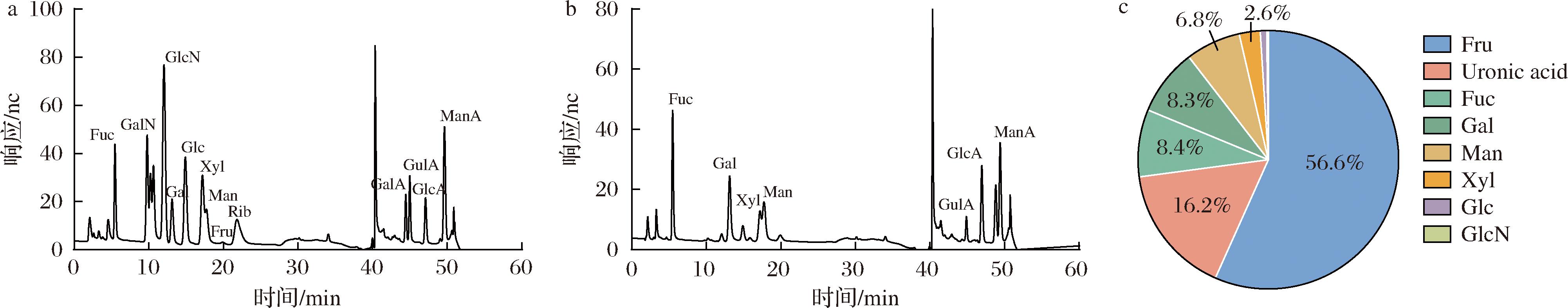
a-标准单糖离子色谱图;b-马尾藻多糖离子色谱图;c-马尾藻多糖单糖比例
图6 马尾藻多糖的离子色谱图及单糖组成
Fig.6 Ion chromatogram and monosaccharide composition of Sargassum polysaccharide
注:Fuc-岩藻糖;GalN-氨基半乳糖盐酸盐;GlcN-盐酸氨基葡萄糖;Gal-半乳糖;Glc-葡萄糖;Xyl-木糖;Man-甘露糖;Fru-果糖;Rib-核糖;GalA-半乳糖醛酸;GulA-古罗糖醛酸;GlcA-葡萄糖醛酸;ManA-甘露糖醛酸;Uronic acid-糖醛酸。
2.3.3 FTIR分析
由图7可知,马尾藻多糖在3 000~3 500 cm-1出现较宽的吸收峰,主要是多糖中O—H、N—H伸缩振动的结果,位于2 926 cm-1附近出现较弱的吸收峰,是—CH3或—CH2—的C—H键弱伸缩振动的结果,这两个特殊的吸收峰可以证明该产物是通过糖苷键聚合[24-25]。1 606 cm-1附近较宽的特征吸收峰,与多糖分子内或分子间C![]() O不对称伸缩振动有关。在1 414 cm-1附近的吸收峰为糖醛酸中C
O不对称伸缩振动有关。在1 414 cm-1附近的吸收峰为糖醛酸中C![]() O对称伸缩振动形成,说明糖链中含有糖醛酸[26-27],且可能主要是以—COO—形式存在[28]。值得注意的是,在1 730 cm-1并未观察到红外吸收信息,证实糖醛酸没有被酯化[29]。1 240和1 034 cm-1处的吸收峰分别是由糖环上C—O—C与C—O—H结构中C—O的伸缩振动引起的,是作为吡喃环特征性吸收峰,表明多糖的结构单元中含有至少含有一个吡喃糖环[30]。此外,近红外890 cm-1处的弱红外吸收峰是源于β-D-葡萄糖二异构体上次甲基(—CH2—)中C—H变角振动[31]。
O对称伸缩振动形成,说明糖链中含有糖醛酸[26-27],且可能主要是以—COO—形式存在[28]。值得注意的是,在1 730 cm-1并未观察到红外吸收信息,证实糖醛酸没有被酯化[29]。1 240和1 034 cm-1处的吸收峰分别是由糖环上C—O—C与C—O—H结构中C—O的伸缩振动引起的,是作为吡喃环特征性吸收峰,表明多糖的结构单元中含有至少含有一个吡喃糖环[30]。此外,近红外890 cm-1处的弱红外吸收峰是源于β-D-葡萄糖二异构体上次甲基(—CH2—)中C—H变角振动[31]。
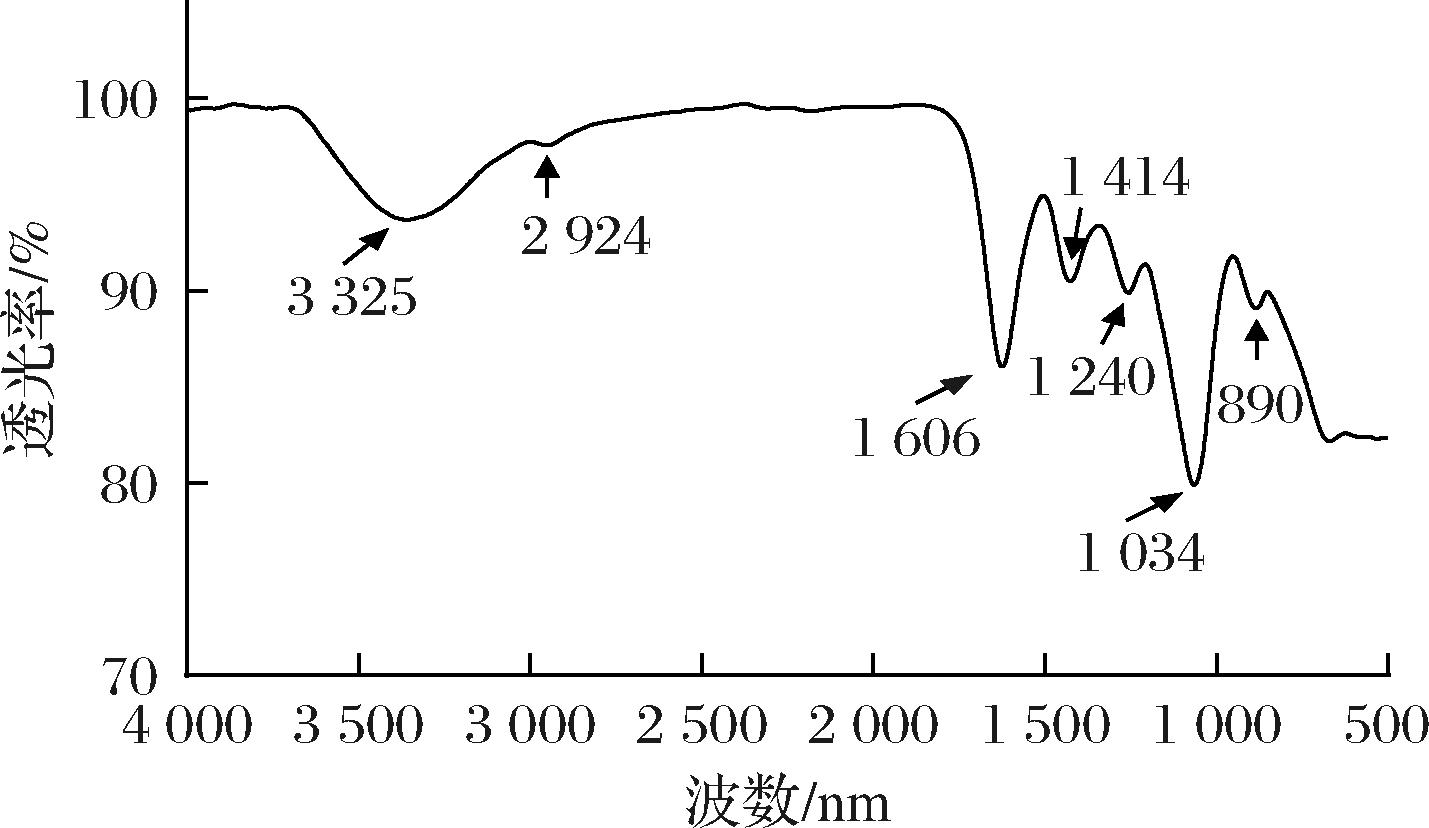
图7 马尾藻多糖的FTIR图谱
Fig.7 FTIR spectrum of Sargassum polysaccharide
2.3.4 NMR分析
为了进一步探讨马尾藻多糖中糖苷键构型问题,对其进行1H NMR扫描,根据1H NMR光谱(图8),δ3.40~4.85为多糖的糖环质子信号,其中δ4.79 为溶剂峰,而H2~H6的化学位移分布在δ3.63~4.42[32]。马尾藻多糖在δ4.59、δ4.38、δ3.99,δ3.84、δ3.80、δ3.74、δ3.71、δ3.61处的异头氢信号证表明多糖含有八类端基质子。通常α型糖苷异头碳的质子信号大于δ5.0,而β型糖苷异头碳的质子信号小于δ5.0[24],马尾藻多糖的1H NMR光谱主要集中在δ3.00~5.00,这阐明了马尾藻多糖是以β-型糖苷键构型存在。另一方面,高场区δ2.1处微弱的核磁峰是6位脱氧糖的甲基(H-6)质子信号,揭示了部分碳基(C![]() O)可能被乙酰化 (COCH3)[33],更高场中δ1.15处的信号说明—OH与—C
O)可能被乙酰化 (COCH3)[33],更高场中δ1.15处的信号说明—OH与—C![]() O存在着分子间氢键作用,这可能与多糖卷曲的空间构象有关[32]。
O存在着分子间氢键作用,这可能与多糖卷曲的空间构象有关[32]。
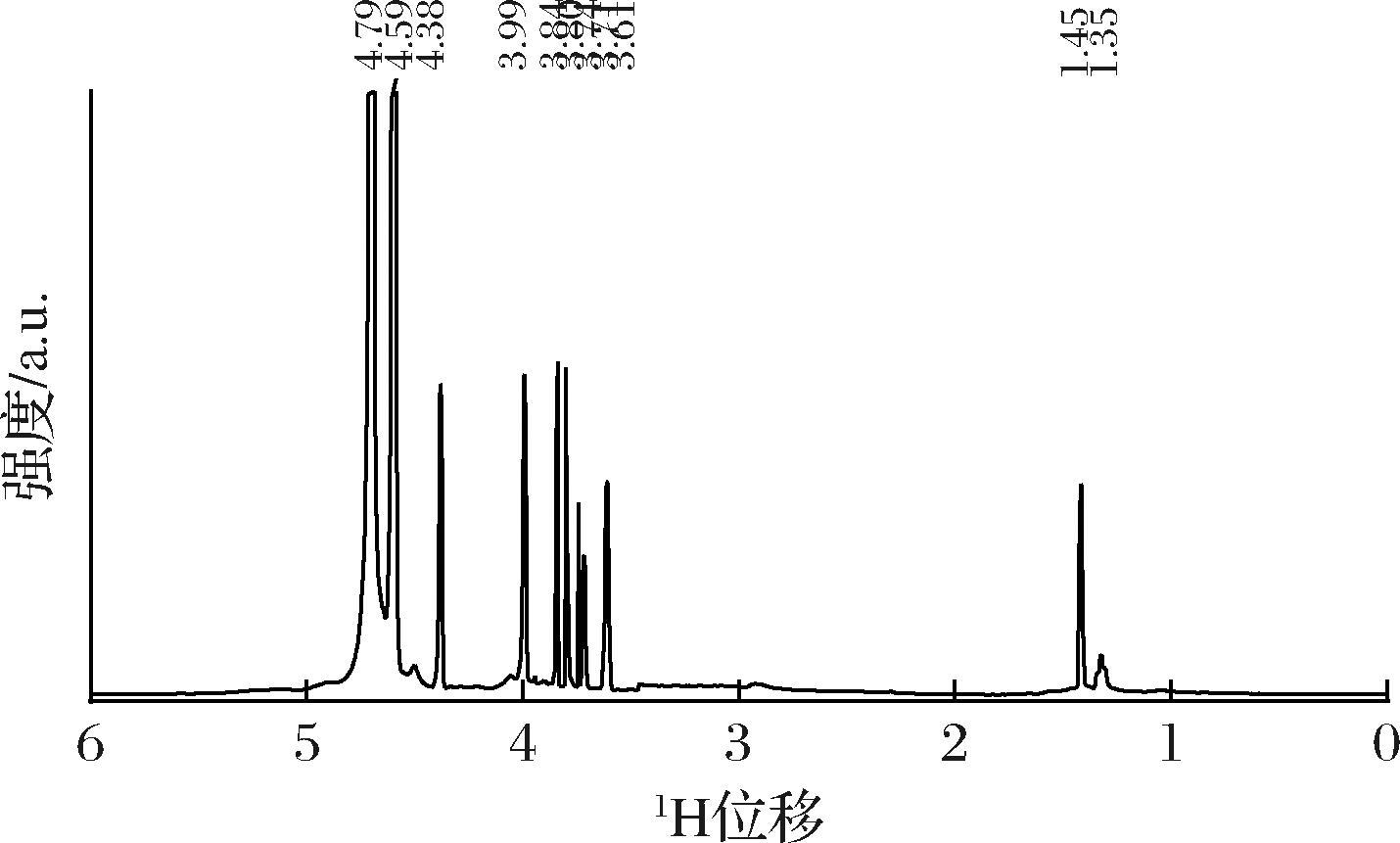
图8 马尾藻多糖的核磁共振谱
Fig.8 1H NMR spectra of Sargassum polysaccharide
2.3.5 XRD分析
由图9所示,马尾藻多糖在22°呈现一个较宽的衍射峰,说明多糖聚合物主要以无定形结构形式存在,这主要是源于多糖之间松散的相互作用[34]。此外,12°~13.5°可观察到明显的结晶峰,表明其中多糖同时存在小部分结晶区,这可能是由于在干燥过程中,剧烈的脱水效应导致部分聚合物快速聚合,使原本松散的结构压缩成相对致密的结构[35-36]。研究结果表明马尾藻多糖具有半结晶材料的应用潜力。
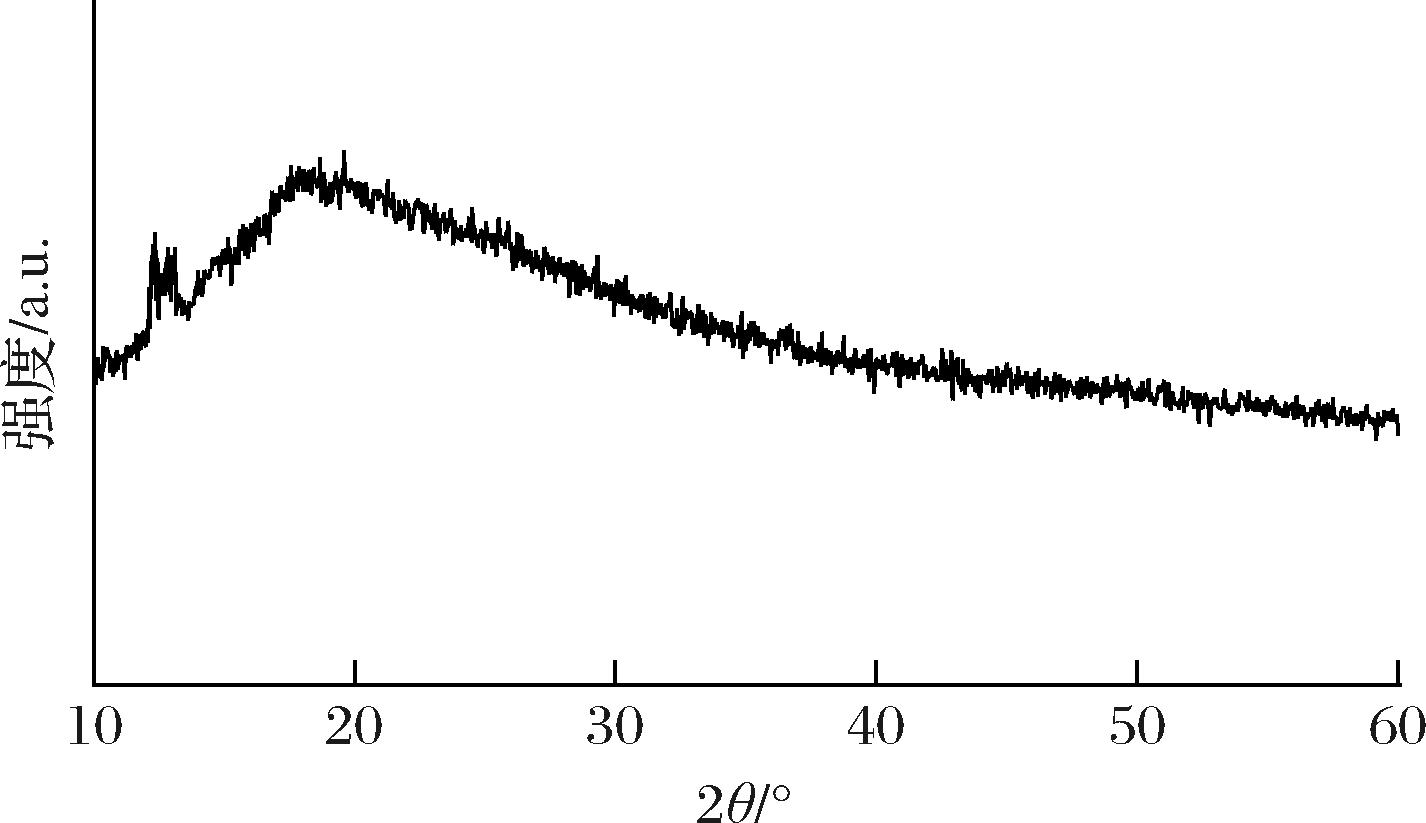
图9 马尾藻多糖的X射线衍射曲线
Fig.9 XRD of Sargassum polysaccharide
2.3.6 SEM分析
如图10所示,在低质量浓度(0.1 mg/mL)条件下,马尾藻多糖倾向于聚合成粒径为50 nm左右的颗粒状结构,并且其表面较为光滑、平整。这可能由于当多糖质量浓度较低时,分子间氢键、范德华力、静电作用等分子力主导糖链的相互作用,多糖的分子结构快速达到吸附-解离平衡,难以形成较大的聚集结构[37]。然而,随着质量浓度的提升,多糖体系发生一定程度的相变,此时糖链之间的缠链作用成为影响聚集的主要因素[38]。当质量浓度达到1.0 mg/mL时,马尾藻多糖聚合形成0.5~1.0 μm的无规则多相簇状结构,其表面变得粗糙、复杂。此外,研究发现基底表面布满多糖网状纤维,这是由于在脱水过程中,大量多糖-水的互作被多糖-多糖取代,其通过高分子缩聚作用形成细纤维状结构[39]。
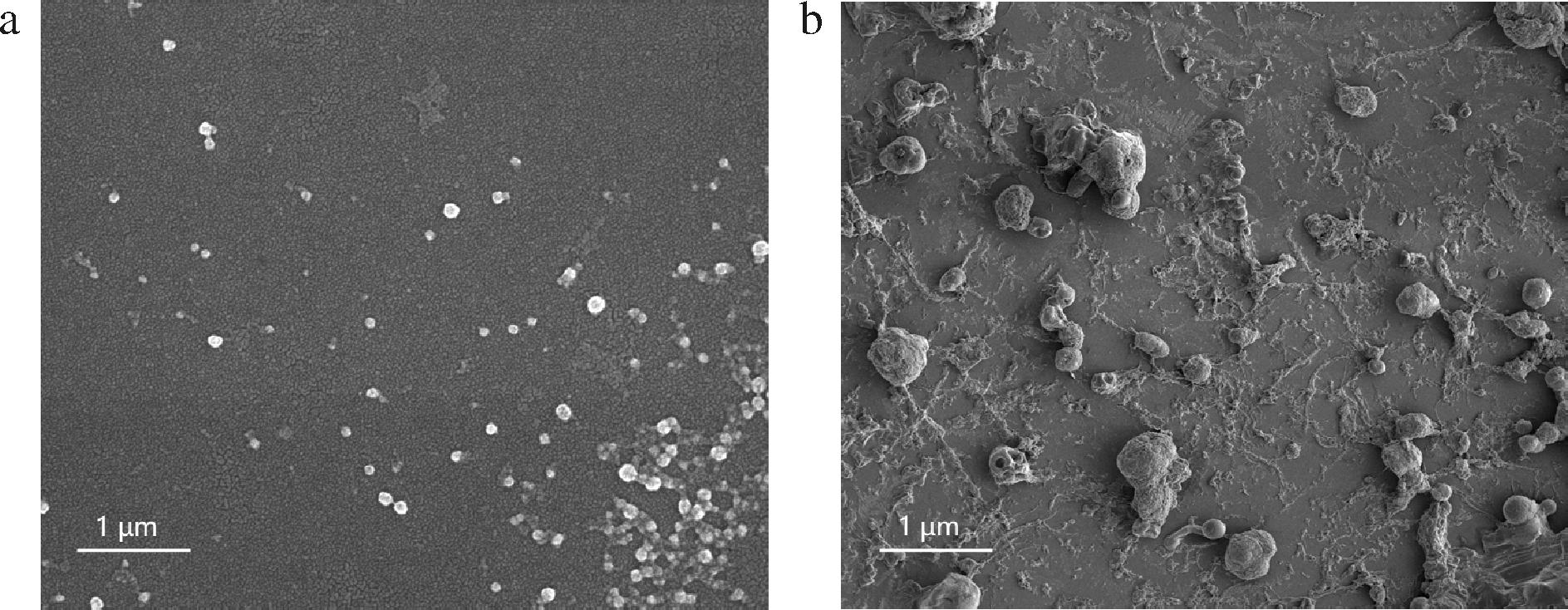
a-低质量浓度(0.1 mg/mL);b-高质量浓度(1.0 mg/mL)
图10 马尾藻多糖的电子显微镜扫描
Fig.10 SEM of Sargassum polysaccharide
2.3.7 AFM分析
AFM常用来观察生物大分子的表观形貌。如图11所示,多糖在云母片上脱水并自组装为10~100 nm块状结构,分子间弱氢键是驱动该结构形成并维持其稳定性的主要作用力[40]。在氢键缔合过程中,马尾藻多糖的聚集能力较弱,更倾向于松散且连续的块状结构,这与SEM观察结论基本相符。然而,少量以晶体形式存在的多糖颗粒不易受到脱水、氢键缔合的影响,难以与外部(无定形区)产生分子间氢键网络[41]。这些结构区域与其他结构间的连续性明显减弱,表现出较强的独立性。本研究可通过AFM观察进一步阐明了马尾藻多糖半结晶结构特性,为其后续功能性开发提供理论基础。

a-二维形貌;b-三维形貌
图11 马尾藻多糖的原子力显微镜扫描图
Fig.11 AFM images of Sargassum polysaccharide
2.4 抗氧化活性
·O2-清除能力、铁离子还原能力是从不同角度评价体外抗氧化剂活性的重要指标[42]。抗氧化剂能将铁氰化钾还原,再利用亚铁离子生成普鲁士蓝,普鲁士蓝生成量越大,抗氧化能力越强。马尾藻多糖的铁离子还原能力如图12-a所示,随着多糖质量浓度从0.4 mg/mL增加到2.0 mg/mL时,铁离子还原能力也逐渐提高,并呈现出一定的量效关系。这与ZHAO等[43]的研究结果一致。
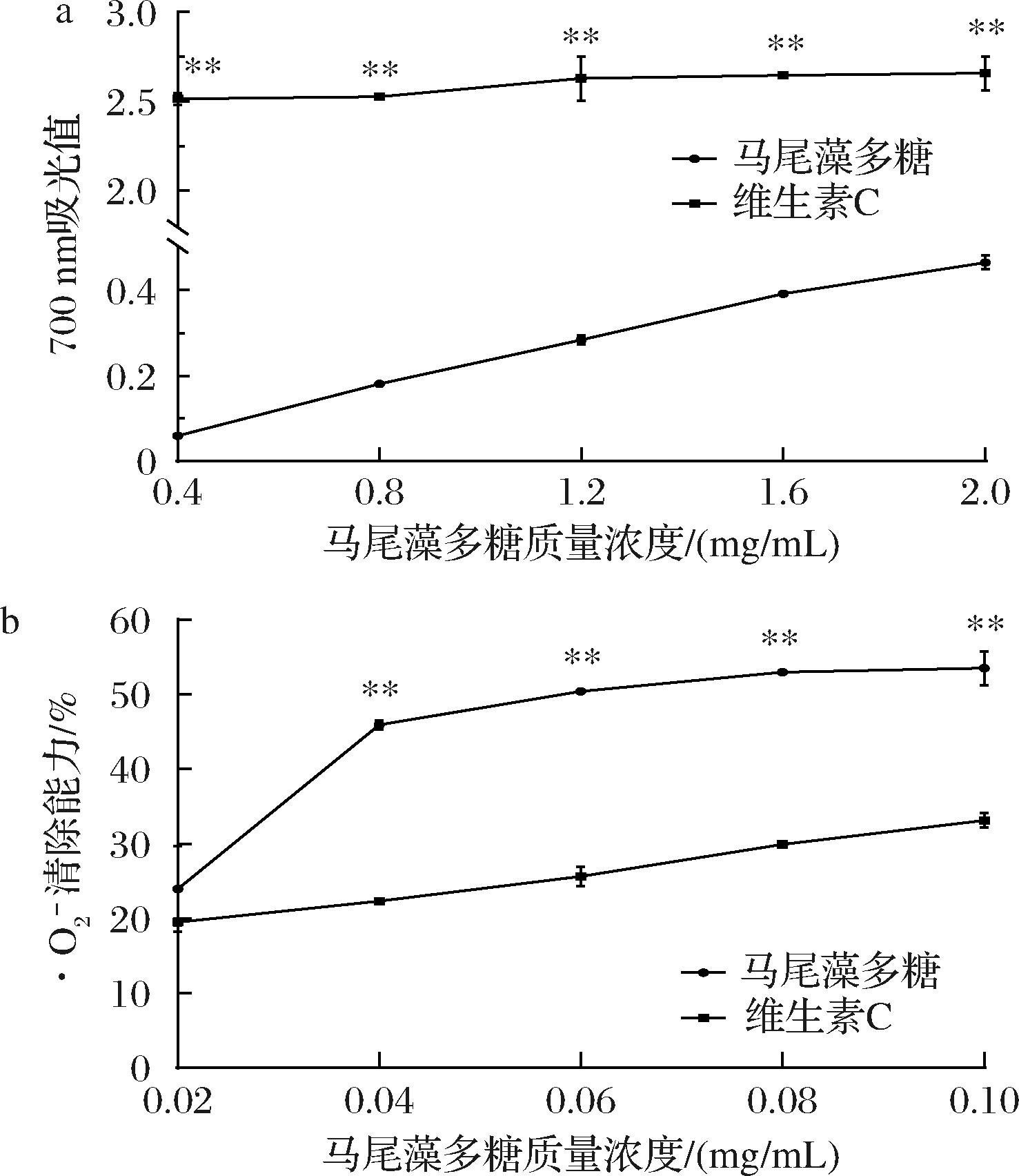
a-铁离子还原能力;b-·O2-清除能力
图12 马尾藻多糖的抗氧化活性
Fig.12 Antioxidant activity of Sargassum polysaccharide
注:**代表两组之间存在极显著性差异(P<0.001)。
·O2-是一类自由基中间产物,能迅速转变为氧化性极强的活性氧如羟自由基、单线态氧等,从而对细胞、组织等造成一系列不可逆的损伤[44],进而导致癌症等病理现象的发生。因此,研究马尾藻多糖的·O2-清除能力对其在功能性食品上的应用具有重要意义。如图12-b所示,马尾藻多糖的·O2-清除能力随多糖质量浓度的增加而增强。在低质量浓度时,多糖清除·O2-的能力随着质量浓度升高而迅速升高;当质量浓度较高时,这种上升趋势逐渐变得平缓,但仍保持较高水平且清除·O2-的能力要高于同质量浓度维生素C。经与前期调查比对表明,马尾藻多糖对·O2-的IC50显著低于山芋多糖、玉竹多糖和洋葱多糖等[45-47],这可能与本研究中马尾藻多糖中糖醛酸含量比较高(21.86%)有关,研究表明,糖醛酸含量越高,多糖供电子的能力越强,其稳定自由基中间体能力越强[48],·O2-清除能力也越强。由于马尾藻多糖在清除·O2-层面上具有高效性和特异性,在预防或治疗由活性氧引发系列慢性疾病上具备较好的开发潜力。
3 结论
本文优化了马尾藻多糖的超声波辅助提取条件,分析了多糖的组分和结构,在此基础上,对其体外抗氧化活性进行评价。结果表明,最优提取条件为超声频率28 kHz、料液比1∶60、提取温度70 ℃、提取时间180 min,该条件下马尾藻多糖提取率达到9.73%。根据SEC-MALLS-RI,由超声辅助法提取多糖样品均一性较强,平均分子质量为1.18×107(± 3.13%)g/mol,其空间构型呈无规则卷曲。马尾藻多糖主要是由果糖、糖醛酸、半乳糖、岩藻糖和甘露糖等通过β-1.4糖苷键聚合形成的一种含有大量无定形结构的半晶聚合物。在此基础上,通过扫描电镜和原子力显微镜发现多糖链易于通过分子间弱氢键作用缔合为50 nm左右的片状结构,并表现出较为均相的表面形貌。此外,马尾藻多糖抗氧化功能被证实主要是源于其优异的·O2-清除能力,为其在功能性食品领域中的应用提供了一定的理论基础。
[1] ZENG F S, YAO Y F, WANG L F, et al.Polysaccharides as antioxidants and prooxidants in managing the double-edged sword of reactive oxygen species[J].Biomedicine &Pharmacotherapy, 2023, 159:114221.
[2] GUEHAZ K, BOUAL Z, ABDOU I, et al.Microalgae’s polysaccharides, are they potent antioxidants? Critical review[J].Archives of Microbiology, 2023, 206(1):14.
[3] ISMAIL G A, GHEDA S F, ABO-SHADY A M, et al.In vitro potential activity of some seaweeds as antioxidants and inhibitors of diabetic enzymes[J].Food Science and Technology, 2020, 40(3):681-691.
[4] LI C Y, WANG C S, WANG S F, et al.Optimization of ultrasonic-assisted extraction technology of Sargassum fusiforme polysaccharides and evaluation of their antioxidant activity[J].Food Science and Technology Research, 2013, 19(2):157-162.
[5] FAN X Q, XIAO X J, YU W, et al.Yucca schidigera purpurea-sourced arabinogalactan polysaccharides augments antioxidant capacity facilitating intestinal antioxidant functions[J].Carbohydrate Polymers, 2024, 326:121613.
[6] FANG R E, WEI Y J, FANG S Y, et al.Effects of Sargassum-derived oligosaccharides, polysaccharides and residues on ameliorating enteritis and dysbiosis in a murine model of food allergy[J].Journal of Functional Foods, 2023, 110:105844.
[7] FAN S R, YU G Q, NIE W J, et al.Antitumor activity and underlying mechanism of Sargassum fusiforme polysaccharides in CNE-bearing mice[J].International Journal of Biological Macromolecules, 2018, 112:516-522.
[8] 袁慧情, 胡佳敏, 刘思溢, 等.马尾藻多糖拮抗LPS诱导的巨噬细胞极化及铁死亡[J].中国免疫学杂志, 2023, 39(10):2034-2040.
YUAN H Q, HU J M, LIU S Y, et al.Sargassum polysaccharides antagonize LPS-induced macrophage polarization and ferroptosis[J].Chinese Journal of Immunology, 2023, 39(10):2034-2040.
[9] JIANG H, YANG S Q, CHAKKA V P, et al.Purification and biological activities of enzymatically degraded Sargassum fusiforme polysaccharides[J].Chemistry &Biodiversity, 2021, 18(3):e2000930.
[10] WEN C T, ZHANG J X, ZHANG H H, et al.Plant protein-derived antioxidant peptides:Isolation, identification, mechanism of action and application in food systems:A review[J].Trends in Food Science &Technology, 2020, 105:308-322.
[11] ABDELHEDI O, NASRI R, SOUISSI N, et al.Sulfated polysaccharides from common smooth hound:Extraction and assessment of anti-ACE, antioxidant and antibacterial activities[J].Carbohydrate Polymers, 2016, 152:605-614.
[12] WEI Q, ZHANG Y H.Ultrasound-assisted polysaccharide extraction from Cercis chinensis and properites, antioxidant activity of polysaccharide[J].Ultrasonics Sonochemistry, 2023, 96:106422.
[13] OTERO P, CARPENA M, GARCIA-OLIVEIRA P, et al.Seaweed polysaccharides:Emerging extraction technologies, chemical modifications and bioactive properties[J].Critical Reviews in Food Science and Nutrition, 2023, 63(13):1901-1929.
[14] PE ALVER R, LORENZO J M, NIETO G.Bioaccessibility, digestibility and nutritional properties of algae and Cyanophyceae as basis of their potential as functional food ingredients[J].Applied Food Research, 2024, 4(1):100404.
ALVER R, LORENZO J M, NIETO G.Bioaccessibility, digestibility and nutritional properties of algae and Cyanophyceae as basis of their potential as functional food ingredients[J].Applied Food Research, 2024, 4(1):100404.
[15] YANG T H, YAO H T, CHIANG M T.Red algae (Gelidium amansii) reduces adiposity via activation of lipolysis in rats with diabetes induced by streptozotocin-nicotinamide[J].Journal of Food and Drug Analysis, 2015, 23(4):758-765.
[16] CHEN L, CHEN J S, WU K G, et al.Improved low pH emulsification properties of glycated peanut protein isolate by ultrasound Maillard reaction[J].Journal of Agricultural and Food Chemistry, 2016, 64(27):5531-5538.
[17] GUO L N, KONG N, ZHANG X Y, et al.Multimode ultrasonic extraction of polysaccharides from maca (Lepidium meyenii):Optimization, purification, and in vitro immunoregulatory activity[J].Ultrasonics Sonochemistry, 2022, 88:106062.
[18] WELCH E C, CHALTAS K, TRIPATHI A.Ultrasound frequency sonication facilitates high-throughput and uniform dissociation of cellular aggregates and tissues[J].SLAS Technology, 2023, 28(2):70-81.
[19] 梁杰, 邓波, 刘涛, 等.响应面法优化坛紫菜抗氧化肽酶法制备工艺[J].食品研究与开发, 2020, 41(5):1-6.
LIANG J, DENG B, LIU T, et al.Preparation of antioxidant peptides from Porphyra haitanensis via response surface optimization[J].Food Research and Development, 2020, 41(5):1-6.
[20] CHEN P L, YOU Q X, LI X, et al.Polysaccharide fractions from Fortunella margarita affect proliferation of Bifidobacterium adolescentis ATCC 15703 and undergo structural changes following fermentation[J].International Journal of Biological Macromolecules, 2019, 123:1070-1078.
[21] LIU X G, BIAN J, LI D Q, et al.Structural features, antioxidant and acetylcholinesterase inhibitory activities of polysaccharides from stem of Physalis alkekengi L[J].Industrial Crops and Products, 2019, 129:654-661.
[22] SHI H M, LI J C, YU J, et al.Extraction, purification and antioxidant activity of polysaccharides from different parts of Hibiscus manihot L[J].Journal of Molecular Structure, 2024, 1295:136598.
[23] YANG M, ZHOU D Q, XIAO H, et al.Marine-derived uronic acid-containing polysaccharides:Structures, sources, production, and nutritional functions[J].Trends in Food Science &Technology, 2022, 122:1-12.
[24] 何坤明, 王国锭, 白新鹏, 等.山茱萸籽多糖分离纯化、结构表征及抗氧化活性[J].食品科学, 2021, 42(19):81-88.
HE K M, WANG G D, BAI X P, et al.Isolation, purification, structure characterization and antioxidant activity of Cornus officinalis seed polysaccharides[J].Food Science, 2021, 42(19):81-88.
[25] CAO W, WU J P, ZHAO X Y, et al.Structural elucidation of an active polysaccharide from Radix Puerariae lobatae and its protection against acute alcoholic liver disease[J].Carbohydrate Polymers, 2024, 325:121565.
[26] 王青芬, 敖新宇, 宫树森, 等.海巴戟果实多糖的结构特征及体外抗氧化活性研究[J].林产化学与工业, 2023, 43(6):81-88.
WANG Q F, AO X Y, GONG S S, et al.Structural characteristics and antioxidant activity of polysaccharide from Morinda citrifolia fruit in vitro[J].Chemistry and Industry of Forest Products, 2023, 43(6):81-88.
[27] JRIDI M, MEZHOUDI M, ABDELHEDI O, et al.Bioactive potential and structural characterization of sulfated polysaccharides from Bullet tuna (Auxis Rochei) by-products[J].Carbohydrate Polymers, 2018, 194:319-327.
[28] 蒋茂婷, 冉艳红, 刘娜, 等.蒜皮水溶性多糖的制备及结构表征[J].食品科学, 2022, 43(6):57-65.
JIANG M T, RAN Y H, LIU N, et al.Preparation and structural characterization of water-soluble polysaccharide from garlic skin[J].Food Science, 2022, 43(6):57-65.
[29] NEP E I, CARNACHAN S M, NGWULUKA N C, et al.Structural characterisation and rheological properties of a polysaccharide from sesame leaves (Sesamum radiatum Schumach.& Thonn.)[J].Carbohydrate Polymers, 2016, 152:541-547.
[30] 刘鹏, 李静静, 乔彦良, 等.黄芩多糖的提取及结构表征[J].中国畜牧兽医, 2023, 50(6):2518-2530.
LIU P, LI J J, QIAO Y L, et al.Extraction and structure characterization of Scutellaria baicalensis polysaccharide[J].China Animal Husbandry &Veterinary Medicine, 2023, 50(6):2518-2530.
[31] MEDELEANU M A, H D
D RUG
RUG D I, MUNTEAN C V, et al.Structure-property relationships on recrystallized β-cyclodextrin solvates:A focus on X-ray diffractometry, FTIR and thermal analyses[J].Carbohydrate Polymers, 2021, 265:118079.
D I, MUNTEAN C V, et al.Structure-property relationships on recrystallized β-cyclodextrin solvates:A focus on X-ray diffractometry, FTIR and thermal analyses[J].Carbohydrate Polymers, 2021, 265:118079.
[32] BUTT H S, ULRIKSEN E S, RISE F, et al.Structural elucidation of novel pro-inflammatory polysaccharides from Daphne mezereum L[J].Carbohydrate Polymers, 2024, 324:121554.
[33] WANG S N, ZHAO H K, QU D N, et al.Destruction of hydrogen bonding and electrostatic interaction in soy hull polysaccharide:Effect on emulsion stability[J].Food Hydrocolloids, 2022, 124:107304.
[34] WANG L B, LI L Y, GAO J Y, et al.Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots[J].Carbohydrate Polymers, 2021, 260:117796.
[35] HUANG H L, TSAI I L, LIN C, et al.Intelligent films of marine polysaccharides and purple cauliflower extract for food packaging and spoilage monitoring[J].Carbohydrate Polymers, 2023, 299:120133.
[36] WANG Q, HAO L, ZHANG A Q, et al.Extraction and characterization of polysaccharides from Schisandra sphenanthera fruit by Lactobacillus plantarum CICC 23121-assisted fermentation[J].International Journal of Biological Macromolecules, 2024, 259:129135.
[37] HOLUBOV M, LOBAZ V, LOUKOTOV
M, LOBAZ V, LOUKOTOV L, et al.Does polysaccharide glycogen behave as a promoter of amyloid fibril formation at physiologically relevant concentrations?[J].Soft Matter, 2021, 17(6):1628-1641.
L, et al.Does polysaccharide glycogen behave as a promoter of amyloid fibril formation at physiologically relevant concentrations?[J].Soft Matter, 2021, 17(6):1628-1641.
[38] SANTO K P, FABIJANIC K I, CHENG C Y, et al.Modeling of the effects of metal complexation on the morphology and rheology of xanthan gum polysaccharide solutions[J].Macromolecules, 2021, 54(18):8675-8692.
[39] DONG R H, HUANG Z Y, MA W J, et al.Fabrication of nano complexes for anthocyanins delivery by ovalbumin and differently dense sulphate half-ester polysaccharides nanocarriers:Enhanced stability, bio-accessibility, and antioxidant properties[J].Food Chemistry, 2024, 432:137263.
[40] CADO G, KERDJOUDJ H, CHASSEPOT A, et al.Polysaccharide films built by simultaneous or alternate spray:A rapid way to engineer biomaterial surfaces[J].Langmuir, 2012, 28(22):8470-8478.
[41] LIU R, YAN Z, CHU F X, et al.Comparative study on chain conformations, physicochemical and rheological properties of three acidic polysaccharides from Opuntia dillenii Haw.fruits[J].International Journal of Biological Macromolecules, 2024, 262:130027.
[42] WU Y J, XU X, JIANG X J, et al.Valorisation of harmful algae bloom (Enteromorpha prolifera) for polysaccharide and crude bio-oil production[J].Fuel, 2022, 324:124482.
[43] ZHAO L, WANG L, GUO Z M, et al.Polysaccharides from Pogostemon cablin (blanco) Benth.:Characterization and antioxidant activities[J].Frontiers in Pharmacology, 2022, 13:933669.
[44] 李学秀, 刘海棠, 安永贞, 等.桉木预水解液中半纤维素多糖分离纯化及抗氧化活性研究[J].中国造纸, 2022, 41(4):30-37.
LI X X, LIU H T, AN Y Z, et al.Study on separation, purification and antioxidant activities of hemicellulose polysaccharides from Eucalyptus pre-hydrolysate[J].China Pulp &Paper, 2022, 41(4):30-37.
[45] ZHOU S Y, HUANG G L, HUANG H L.Extraction, derivatization and antioxidant activities of onion polysaccharide[J].Food Chemistry, 2022, 388:133000.
[46] JAYASREE SUBHASH A, BABATUNDE BAMIGBADE G, AL-RAMADI B, et al.Characterizing date seed polysaccharides:A comprehensive study on extraction, biological activities, prebiotic potential, gut microbiota modulation, and rheology using microwave-assisted deep eutectic solvent[J].Food Chemistry, 2024, 444:138618.
[47] ZHANG L Y, WANG S R, ZHANG W M, et al.Prospects of yam (Dioscorea) polysaccharides:Structural features, bioactivities and applications[J].Food Chemistry, 2024, 446:138897.
[48] YANG J J, ZHANG X, DAI J F, et al.Effect of fermentation modification on the physicochemical characteristics and anti-aging related activities of Polygonatum kingianum polysaccharides[J].International Journal of Biological Macromolecules, 2023, 235:123661.