脐橙是柑橘类水果的一种,因其味美多汁而深受消费者喜爱。我国江西赣南地区拥有大面积的脐橙种植基地,脐橙成为赣南地区乡村振兴的支柱产业之一。目前,脐橙的利用仅局限于果肉的加工,其附加值还未得到充分挖掘,这对脐橙产业的可持续发展来说远远不足。在脐橙鲜食和加工过程中,会产生大量果皮废弃物,通常当作垃圾处理,造成资源浪费和环境污染。脐橙果皮是精油、类黄酮、类胡萝卜素和果胶等生物活性物质的重要来源[1-3],是脐橙加工中重要的高附加值产品,对脐橙果皮进行精深加工具有重要的经济价值。
果胶是一种存在于植物细胞壁中的天然多糖,在柑橘类果皮中,果胶含量可达30%。果胶是由α-1,4-糖苷键连接的D-半乳糖醛酸残基与鼠李糖、阿拉伯糖、半乳糖等多种中性糖形成的酸性杂多糖,其主要结构包括同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖I(rhamnus galacturonoglycan I,RG-I)、鼠李半乳糖醛酸聚糖Ⅱ(rhamnus galacturonoglycan ⅡI,RG-Ⅱ)和木糖半乳糖醛酸聚糖[4]。根据酯化程度的不同,果胶又可分为高甲氧基果胶(high methoxyl pectin,HMP,酯化度>50%,甲氧基含量>7%)和低甲氧基果胶(low methoxyl pectin,LMP,酯化度<50%,甲氧基含量<7%)[4]。果胶的结构和酯化度等特征与其来源和提取方法等有着密切的联系,从而影响果胶的理化特性和功能应用[5],如HMP能够在高浓度糖和酸性条件下,通过甲基之间的疏水相互作用以及羟基、羧基之间的氢键形成凝胶,而LMP含有更多的非甲基化半乳糖醛酸,添加的Ca2+可以与果胶链上不同羧酸盐之间形成离子键,从而形成稳定的凝胶。此外,果胶还可作为增稠剂、乳化剂和生物活性物质等应用于食品和生物医药等领域[6]。
目前,商业果胶的生产原料主要是柑橘和苹果,其提取、结构特征和应用特性的研究均较为深入[5-9]。然而,脐橙作为柑橘类水果的一种,其果胶成分研究相对较少,主要集中于提取制备等方面。GUO等[2]将超高压技术应用于脐橙皮果胶(pectin from navel orange peels,NOP)的提取,并与微波萃取和传统热水提取比较,证明超高压萃取可将果胶提取率提高至20.44%,且果胶产品的表观黏度和稳定性都有所提高。PATIENCE等[10]则采用超声波萃取NOP,表明通过脉冲超声模式和降低溶剂pH均可提高果胶的提取率,节约能源消耗。杜超等[11]则采用超声微波协同萃取高酯NOP(酯化度为74.10%),并通过NaOH溶液处理改性制备低酯果胶(酯化度为33.27%),改性后的果胶具有更强的抗氧化性和抑制淀粉消化的作用。然而,各种辅助技术对NOP的提取率都较为有限,且这些技术在果胶提取中还未实现工业化应用;此外,在果胶的提取制备中,溶剂pH对提取率仍然发挥着重要作用[12]。
目前,商业果胶主要采用酸提醇沉法进行生产,通过改变pH和酸的种类,可制备得到不同性质的果胶产品[13-14]。随着脐橙果汁加工产业的大力发展,大量的果皮副产物需要进行再利用,使得NOP的生产加工有了原料保障。为此,本研究试图采用工业生产中常规的酸提醇沉法提取制备NOP,对提取液pH、料液比、提取时间和提取温度等因素进行优化,采用响应面分析确定最优提取条件,在此基础上,对NOP的结构特征和流变学性质进行分析,以期为NOP的开发应用和脐橙的精深加工提供参考依据。
1 材料与方法
1.1 材料与试剂
脐橙(纽荷尔)购自于江西赣州,剥皮后,脐橙皮经灭酶、烘干、粉碎,备用。
盐酸、无水乙醇、咔唑、浓硫酸、苯酚、NaNO3、NaOH,上海源叶科技有限公司;单糖标准品包括L-岩藻糖(Fuc)、L-鼠李糖(Rha)、D-阿拉伯糖(Ara)、D-半乳糖(Gal)、D-葡萄糖(Glc)、D-木糖(Xyl)、D-甘露糖(Man)、D-核糖(Rib)、D-半乳糖醛酸(GalA)和D-葡萄糖醛酸(GlcA),美国Sigma-Aldrich化学公司;质量分数50%的NaOH溶液,无水乙酸钠(纯度>99.9%),美国Thermo-Fisher公司;实验用水均为超纯水。
1.2 仪器与设备
Avanti JXN-26冷冻离心机,美国贝克曼库尔特有限公司;分子排阻色谱串联DAWN HELEOS-II多角度激光光散射,美国WYATT公司;ICS-5000+离子色谱仪,美国Thermo公司;DHR-3旋转流变仪,美国TA仪器;752型紫外可见分光光度计,上海光谱仪器有限公司;HH-S21恒温水浴锅,上海博讯实业有限公司。
1.3 实验方法
1.3.1 NOP的提取
将新鲜脐橙皮洗净后于沸水中加热10 min灭酶,烘干后,用高速粉碎机将其粉碎,过40目筛,获得果皮粉,将果皮粉用95%(体积分数)乙醇浸泡以除去脂溶性成分和小分子物质。经预处理后的果皮粉干燥、粉碎后,取适量果皮粉于烧杯中,加入一定量盐酸提取液,在一定温度下边加热边搅拌提取一段时间。提取完成后,离心取上清液,并缓慢加入2倍体积的无水乙醇,在4 ℃下过夜醇沉,醇沉结束后,离心得到沉淀物,沉淀经真空干燥后制备获得果胶提取物。NOP提取率按公式(1)计算:
NOP提取率![]()
(1)
式中:m1,果胶提取物的质量,mg;m2,预处理后的脐橙果皮粉质量,mg。
1.3.2 单因素试验
分别称取脐橙果皮粉0.3 g,对提取时间、提取液pH、提取温度和料液比4个因素进行单因素试验。分别设置提取时间(80、95、110、125、140 min)、提取液pH(0.5、1.0、1.5、2.0、2.5)、提取温度(60、70、80、90、100 ℃)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g∶mL),分析不同提取条件对NOP提取率的影响。
1.3.3 Box-Behnken响应面试验设计
基于单因素的实验结果,选择对实验结果影响较大的提取时间、提取液pH和料液比为影响因素,以NOP提取率为响应值,用Design-Expert 13软件,依据Box-Benhnken的中心组合实验设计原理,采用三因素三水平的设计方案进行实验设计。实验因素水平值设计见表1。整个实验设计共17组,如表2所示,中心点实验重复5组以减少实验的随机误差,实验顺序随机以减少实验过程中的系统误差。
表1 响应面试验设计的因素水平值及编码
Table 1 Codes and levels of the variables in response surface experiments

因素水平-101A(提取时间)/min100110120B(pH)1.251.51.75C(料液比)(g∶mL)1∶251∶301∶35
表2 Box-Behnken响应面试验设计方案及结果
Table 2 Box-Behnken experimental design and results
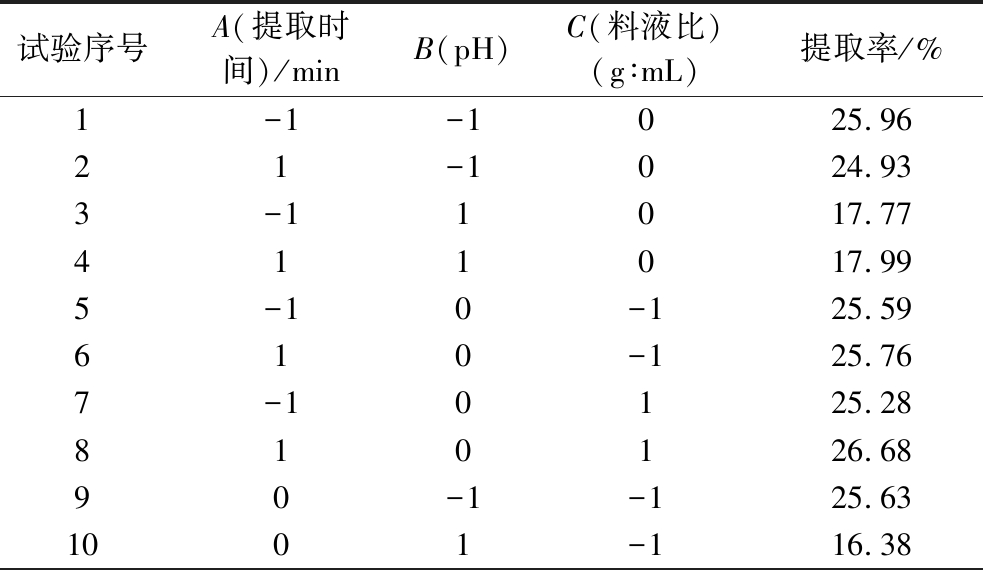
试验序号A(提取时间)/minB(pH)C(料液比)(g∶mL)提取率/%1-1-1025.9621-1024.933-11017.77411017.995-10-125.59610-125.767-10125.28810126.6890-1-125.631001-116.38
续表2
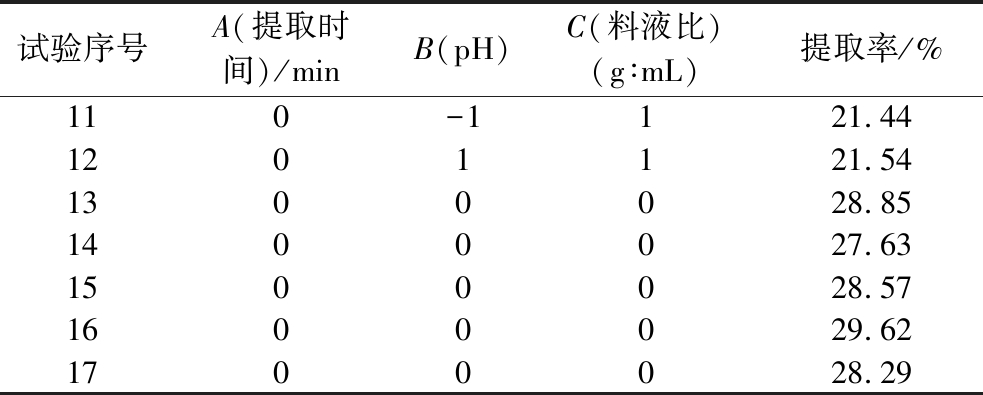
试验序号A(提取时间)/minB(pH)C(料液比)(g∶mL)提取率/%110-1121.441201121.541300028.851400027.631500028.571600029.621700028.29
1.3.4 果胶含量测定
采用硫酸-咔唑比色法[15]测定半乳糖醛酸的含量。配制质量浓度为1.00 mg/mL的半乳糖醛酸标准溶液,分别吸取0、1.0、2.0、3.0、4.0、5.0 mL至容量瓶中,蒸馏水定容至50 mL,摇匀得到质量浓度为0、20、40、60、80、100 μg/mL的标准溶液,分别吸取不同质量浓度标准溶液1 mL于试管中,冰浴中加入6 mL浓硫酸,再沸水浴反应30 min后冷却至室温,加入0.20 mL 0.15%(体积分数)的咔唑乙醇溶液,摇匀后室温放置2 h。在530 nm处测定吸光度,以吸光度(Y)为纵坐标,质量浓度(mg/mL)为横坐标绘制标准曲线。同时配制一定质量浓度的样品溶液,经稀释后,相同操作下测定样品的吸光度,按公式(2)计算样品中半乳糖醛酸含量:
半乳糖醛酸含量![]()
(2)
式中:c,配制的样品质量浓度,mg/mL;c1,根据标准曲线换算的稀释液中半乳糖醛酸质量浓度,μg/mL;N,样品溶液稀释倍数。
1.3.5 酯化度(degree of esterification,DE)测定
果胶DE采用皂化法[16]测定。称取0.5 g样品于250 mL锥形瓶,加入100 mL去离子水(新煮沸的并冷却),搅拌至样品全部溶解,加入5滴酚酞指示剂,用0.1 mol/L NaOH溶液滴定至粉红色30 s不褪色,记录所用NaOH溶液体积V1,继续加入25 mL 0.25 mol/L的NaOH溶液,用力振摇后静置30 min,加入25 mL 0.25 mol/L的盐酸溶液,振摇至粉红色消失,然后用0.1 mol/L NaOH溶液滴定,至粉红色30 s不褪色,记录体积V2。果胶酯化度按公式(3)计算:
(3)
式中:V1和V2分别为第1次和第2次滴定NaOH溶液所消耗体积,mL。
1.3.6 分子质量测定
采用高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)串联多角度激光光散射器(multi-angle laser light scattering detector,MALLS)、示差折光检测器(refractive index detector,RID)、紫外检测器(ultraviolet visible detector,UV)和差压式黏度检测器(differential pressure viscosity detector,DP)分析样品的分子质量及其分布、特性黏度[η]和回旋半径Rg等参数[17]。色谱柱为OHpak SB-805HQ(8.0 mm×300 mm)和OHpak SB-803HQ(8.0 mm×300 mm)串联;流动相为0.1 mol/L NaNO3溶液;流速0.6 mL/min;柱温40 ℃;样品用流动相配制成1 mg/mL的溶液,过0.22 μm微孔滤膜后直接进样;进样体积100 μL,使用ASTRA 7.1.3软件进行数据的采集和分析。
1.3.7 单糖组成分析
称取样品5 mg于具塞试管中,冰浴条件下加入0.5 mL浓硫酸,室温反应30 min,缓慢加水将硫酸稀释至2 mol/L,混匀后于100 ℃的油浴中水解2 h。取出迅速冷却,稀释50~100倍后,用0.22 μm微孔膜过滤,采用Thermo ICS-5000+高效阴离子交换色谱串联脉冲安培检测器(high performance anion exchange chromatography coupled with pulsed amperometric detector,HPAEC-PAD)分析样品的单糖组成。同时配制一系列的单糖标准和混标,在相同色谱条件下进行定性和定量分析。色谱条件:色谱柱为CarboPacTM PA20 (3 mm×150 mm);流动相A为超纯水,B为250 mmol/L的NaOH溶液,C为1 mol/L的NaOAc溶液,进行梯度洗脱,洗脱程序参照ZHANG等[18]并进行适当修改。
1.3.8 流变学特性分析
配制不同样品溶液,在DHR-3旋转流变仪上选用40 mm不锈钢平板夹具进行稳态剪切流变和动态黏弹性测试,平板与底板间样品的测试间距为1 000 μm。分别考察不同样品浓度、温度和pH对果胶样品剪切黏度和黏弹性的影响。采用TA instruments Trios对数据进行采集、处理和拟合模式分析。
1.3.8.1 稳态剪切流变测试
使用Discovery HR-3流变仪对不同样品进行稳态剪切速率扫描测试,剪切速率范围:0.1~1 000 s-1。根据流变参数变化图,通过Power-law模型(公式4)进行拟合,分析NOP的剪切流变特性。
σ=Kγn
(4)
式中:σ,剪切应力,Pa;γ,剪切速率,s-1;K,稠度系数,Pa·sn;n,剪切稀化指数,无量纲。
1.3.8.2 动态流变学分析
首先在25 ℃和0.1 Hz条件下对0.1%~10%的形变范围扫描,确定样品的线性黏弹区,在线性黏弹区内设定形变值为1%。样品的频率扫描程序为25 ℃,strain设定为1%,角频率扫描范围为0.1~100 rad/s,测定样品的储能模量(G′)和损耗模量(G″)变化情况,分析NOP在不同条件下的动态黏弹性。
1.3.9 数据处理
所有实验平行测量3次。数据均采用“平均值±标准差”表示。采用SPSS 17.0软件进行单因素方差分析及多重比较分析,P<0.05为差异显著,有统计学意义。
2 结果与讨论
2.1 NOP提取条件优化
2.1.1 单因素试验
分别考察了提取时间、pH、提取温度和料液比等因素对NOP提取率的影响,结果如图1所示。在料液比为1∶30(g∶mL)、提取温度为90 ℃、提取液pH值为1.0的条件下,不同提取时间对NOP提取率的影响如图1-a所示。由图可知,在80~110 min时,NOP提取率随着提取时间的增加而增加,当提取时间进一步增加时,果胶提取率呈现下降趋势,这可能是因为在高温酸性的条件下,果胶分子被逐渐水解为小片段,不利于后续的醇沉析出,从而导致果胶提取率降低。
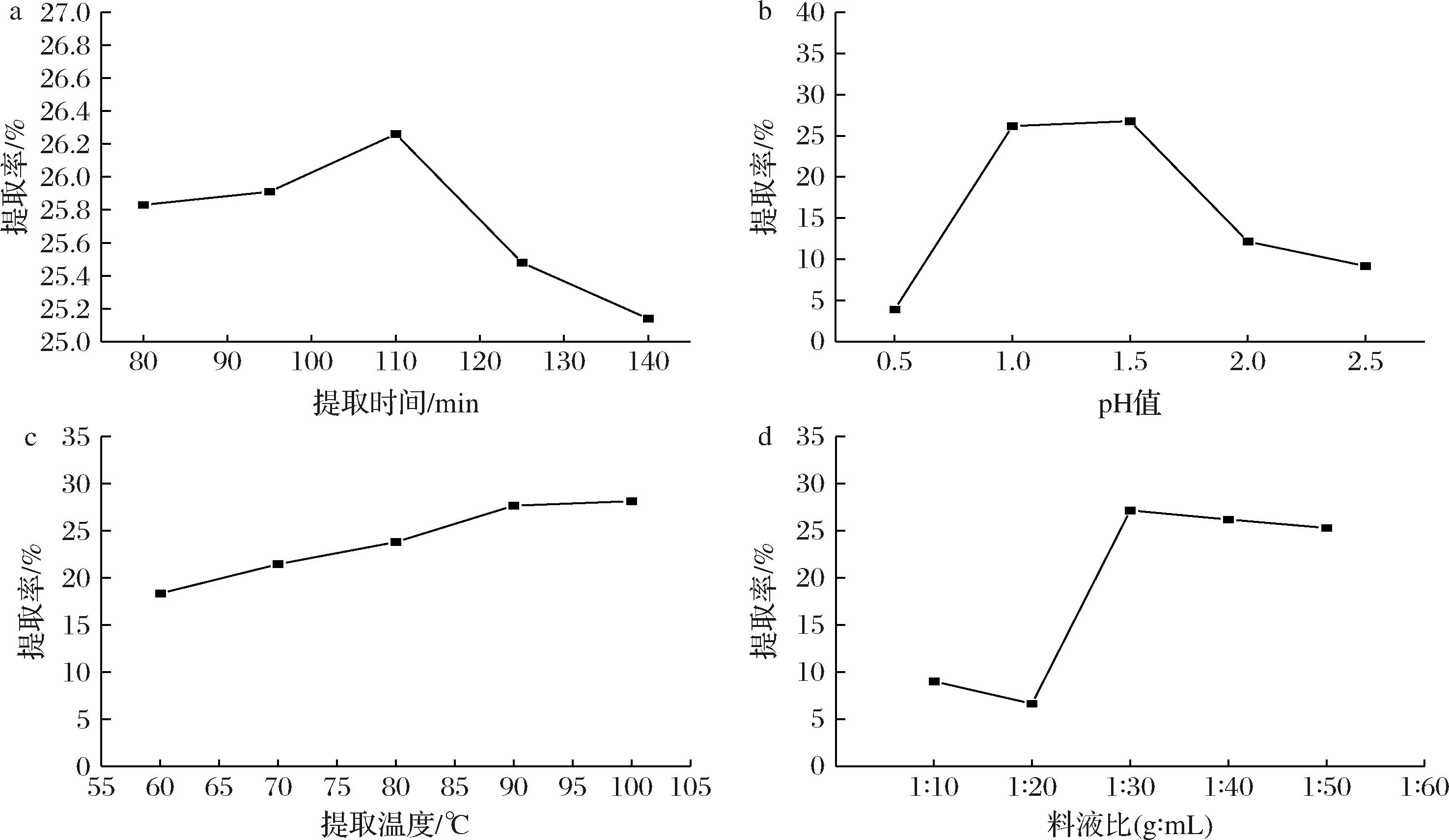
a-提取时间;b-提取液pH;c-提取温度;d-料液比
图1 不同提取因素对NOP提取率的影响
Fig.1 Effects of different extraction factors on the yield of NOP
在上述结果基础上,选择提取时间为110 min,提取料液比为1∶30(g∶mL)、提取温度为90 ℃条件下,分析不同提取液pH对NOP提取率的影响,结果如图1-b所示,随着pH由2.5降低至1.5,NOP提取率逐渐增加,在pH 1.5达到最大值,而随着pH值从1.0降至0.5,NOP提取率显著降低。研究表明,酸性环境可以促进非水溶性原果胶转化为水溶性果胶,提高果胶的溶出能力,但过酸的环境同时会导致果胶分子被酸解为小分子片段,导致果胶提取率降低,同时果胶的酯化度降低[19]。因此,选择pH 1.5进行后续试验。
进一步,在提取时间为110 min、pH 1.5、提取料液比为1∶30(g∶mL)的条件下,测定不同提取温度对NOP提取率的影响,结果如图1-c所示。结果表明,随着提取温度的升高,NOP提取率也随之提高,但在90~100 ℃之间,提取率无显著性差异,考虑到能耗等因素,选择90 ℃作为NOP提取优化条件。
在上述优化结果的基础上,进一步分析了料液比对果胶提取率的影响。由图1-d可知,当料液比低于1∶30(g∶mL),NOP提取率较低,料液比为1∶30(g∶mL)时,提取率最高,而进一步提高料液比,提取率趋于稳定,无显著差异。在较小料液比的情况下,脐橙果皮粉在提取液中的分散不够彻底,提取液黏度较大,不利于果胶的浸提;当料液比增大到一定量时,果胶成分的浸出达到一个动态平衡,提取率最高,此时,进一步提高料液比,果胶提取率不会有显著差异,甚至较高的料液比还可能导致其他非糖类物质的溶出,从而使得果胶的提取率略有降低。
根据以上结果,NOP的提取条件为:提取时间110 min、提取液pH 1.5、温度90 ℃、料液比1∶30(g∶mL)。为了进一步优化提取效率,选择对提取率影响较大的3个因素进行响应面分析,其因素水平设计为:提取时间(100、110、120 min)、提取液pH(1.25、1.50、1.75)、料液比(1∶25、1∶30、1∶35,g∶mL)。
2.1.2 响应面分析
表2为不同条件下提取率的结果,采用Design-Expert 13对其进行分析,得到回归方程模型为:Y=28.59+0.095 0A-3.03B+0.197 5C+0.312 5AB+0.307 5AC+2.34BC-1.17A2-5.75B2-1.59C2。
表3为模型的方差分析结果,由表可知,回归模型F值为27.77,P值为0.000 1,回归方程极显著;失拟项F值为3.24,P值为0.143 2(P>0.05),差异不显著,表明拟合模型可信,具备预测试验的真实性。通过三因素F值的大小可知,三因素对NOP提取率的影响由强到弱依次为提取液pH、料液比、提取时间。TWINOMUHWEZI等[12]研究也发现,pH在不同原料的果胶提取中都会显著影响其提取率。
表3 响应面模型方差分析
Table 3 Analysis of variance for the response surface model
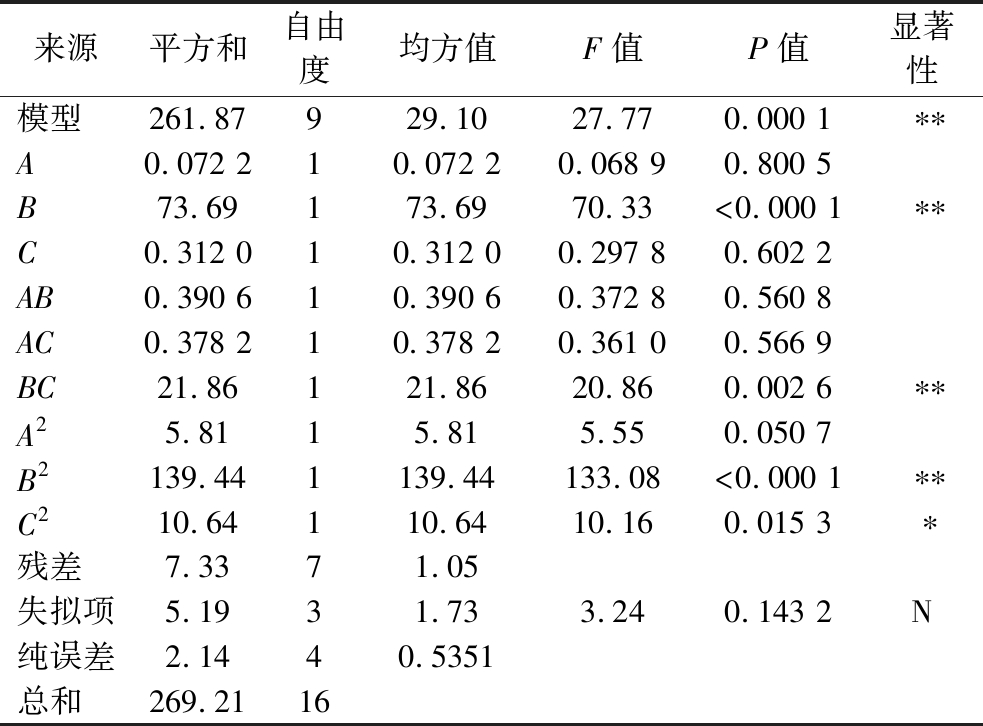
来源平方和自由度均方值F值P值显著性模型261.87929.1027.770.000 1∗∗A0.072 210.072 20.068 90.800 5B73.69173.6970.33<0.000 1∗∗C0.312 010.312 00.297 80.602 2AB0.390 610.390 60.372 80.560 8AC0.378 210.378 20.361 00.566 9BC21.86121.8620.860.002 6∗∗A25.8115.815.550.050 7B2139.441139.44133.08<0.000 1∗∗C210.64110.6410.160.015 3∗残差7.3371.05失拟项5.1931.733.240.143 2N纯误差2.1440.5351总和269.2116
注:*P<0.05差异显著,**P<0.01差异极显著,N表示不显著。
为了更好地理解不同变量之间的交互作用,对提取时间、提取液pH和料液比等因素的两两交互作用进行响应面分析,结果如图2所示。结果表明,影响果胶提取率的最主要因素为提取液pH,而料液比和提取时间的交互作用对于NOP提取率的影响作用较小。根据所得模型,运用Design-Expert 13软件对模型进行分析,预测出NOP最优提取工艺条件为:提取时间109.81 min、料液比1∶29.22(g∶mL)、提取液pH 1.42,在该条件下预测果胶提取率最大值为29.03%。考虑到实际操作的可实施性,将最优工艺条件调整为:提取时间110 min、料液比1∶29(g∶mL)、溶液pH 1.4。在该实验条件下,重复平行试验,得出NOP提取率平均值为28.99%,与预测值吻合较好,表明模型方程可用于预测最优响应值。

a-提取时间与料液比;b-提取液pH与提取时间;c-提取液pH与料液比
图2 不同因素交互作用对NOP提取率的响应面分析
Fig.2 Response surface analysis of pairwise interaction effects of different factors on the yield of NOP
2.2 NOP的化学组成及结构特征
2.2.1 NOP的化学组成分析
在最优提取条件下,提取制备了NOP,经硫酸-咔唑法测定半乳糖醛酸含量为94.35%,显著高于商业化的柑橘果胶和苹果果胶[20],表明NOP可能是一类高纯度的HG。酯化度是果胶的一个重要的理化参数,通过皂化法测定NOP的DE值为30.52%,显著低于一般柑橘类果胶的DE值[20-21],表明NOP为一种低酯果胶。不同研究表明,果胶产品的DE值与来源和提取方法有密切关系。CIRIMINNA等[21]采用微波热水萃取从红橙、柠檬和葡萄皮中提取果胶,发现红橙果皮来源的果胶DE值最低(25%),而柠檬皮来源的果胶DE值最高(40%)。HOSSEINI等[22]采用超声波结合酸溶液(pH 1.5)从酸橙中提取果胶,发现其DE值(6.77%)显著低于商业化的柑橘果胶。而采用超高压、微波或超声微波协同萃取的NOP均为高酯果胶[2,11],这可能与所选用的脐橙品种不一致有关,也可能与提取溶剂的酸碱性有关,TWINOMUHWEZI等[12]也证实提取液的pH不仅会影响果胶的提取率,还会影响果胶的化学组成,如酯化度和甲氧基含量等。
2.2.2 NOP的分子参数及构象特征
分子质量等不同分子结构参数是果胶重要的性质指标之一,一般来说,分子质量越高,果胶胶凝性和黏度越高,在食品体系中的凝胶和增稠效果越好。采用HPSEC-MALLS分析了NOP的分子参数,结果如图3所示,示差检测器出现2个主要的色谱峰,而光散射和黏度检测器均只有1个主要的色谱峰,推测peak 1是大分子组分,即NOP果胶组分,而peak 2为小分子片段或寡聚物,因此,本研究重点分析peak 1组分的分子参数信息。经计算,NOP组分(peak 1)的重均分子质量(weight-average molecular weight,Mw)为156.1 kDa,数均分子质量(number-average molecular weight,Mn)为49.49 kDa,多分散系数PDI(Mw/Mn)为3.15,均方回旋半径(Rg)为34.1 nm,特性黏度[η]为30.01 dL/g(表4)。之前研究发现,不同提取方法对果胶的分子大小影响较为显著,GUO等[2]发现传统热水提取得到的NOP的分子质量为152.1 kDa,而超高压萃取制备的NOP分子质量可达到306.3 kDa;WANG等[23]也发现热水提取得到的果胶分子质量最小(109.2 kDa),而酸提取得到的果胶分子质量最大(212.9 kDa)。
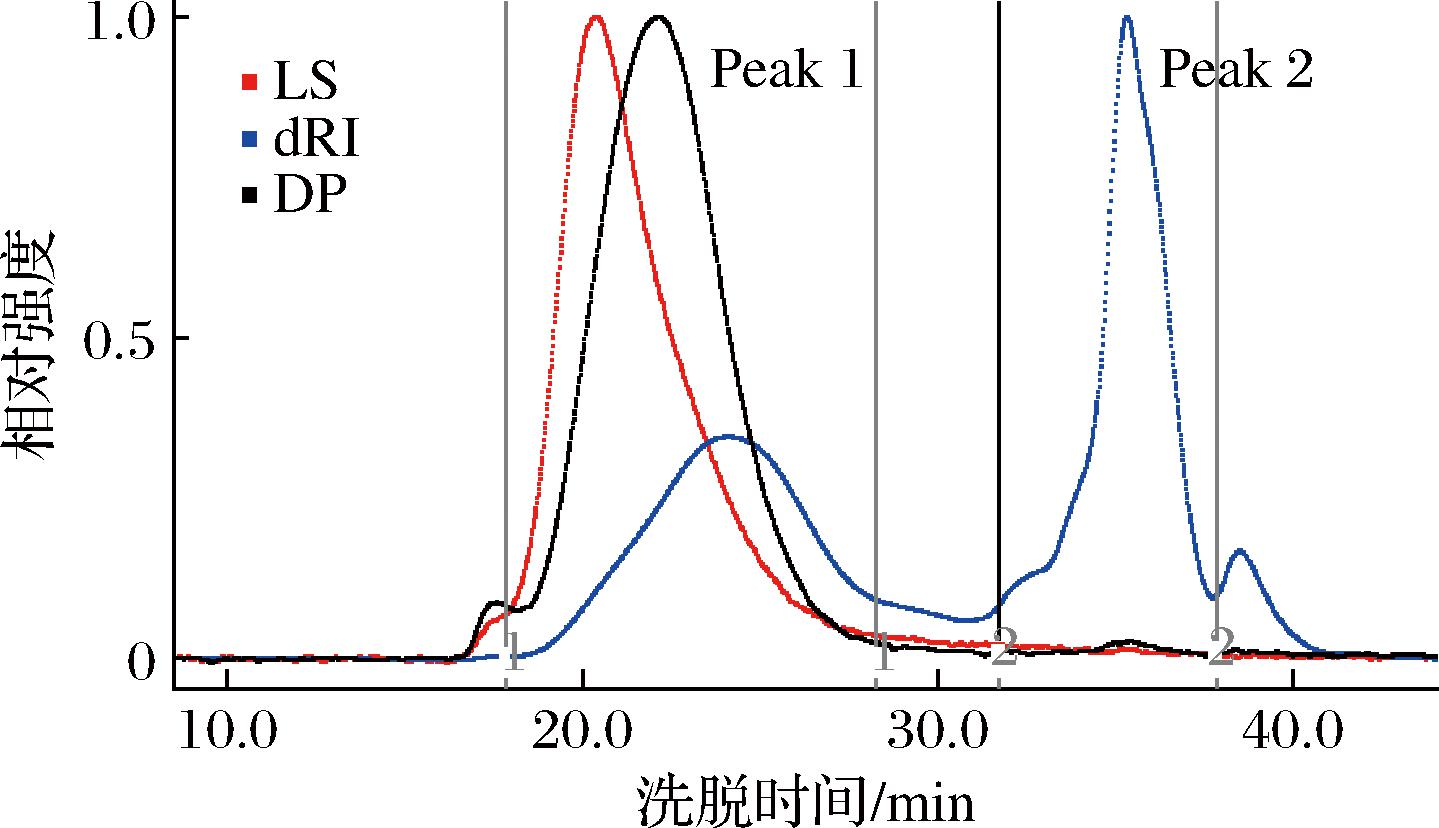
图3 NOP的HPSEC色谱图
Fig.3 HPSEC eluted profiles of NOP
表4 NOP的分子参数和结构特征
Table 4 Molecular parameters and structural features of NOP
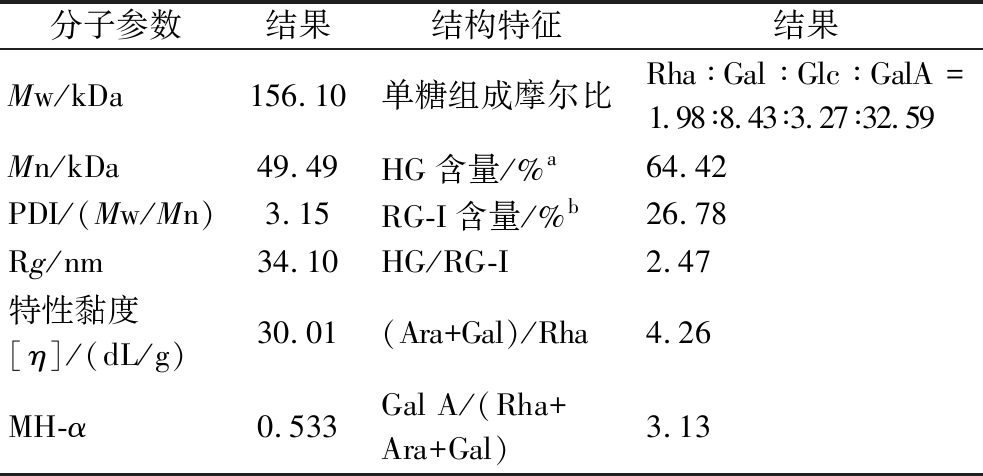
分子参数结果结构特征结果Mw/kDa156.10单糖组成摩尔比Rha∶Gal∶Glc∶GalA=1.98∶8.43∶3.27∶32.59Mn/kDa49.49HG含量/%a64.42PDI/(Mw/Mn)3.15RG-I含量/%b26.78Rg/nm34.10HG/RG-I2.47特性黏度[η]/(dL/g)30.01(Ara+Gal)/Rha4.26MH-α0.533Gal A/(Rha+Ara+Gal)3.13
注:aGalA与Rha的摩尔百分数之差,b2Rha、Ara和Gal摩尔百分数之和。
Mark-Houwink方程([η]=kMwɑ)构建了Mw与[η]之间的关系,通过该方程的α指数大小可以判断聚合物分子链在溶液中的构象特征,当α<0.5时,表明聚合物为球形结构;当α值介于0.5~0.8时,为无规线团;而α值介于0.8~2时,为刚性棒状结构[24]。通过计算,NOP的α值为0.533(表4),表明NOP为较紧凑的无规线团,该结果与冬枣皮果胶结果一致[25],这可能与其单糖组成和果胶结构有着密切关系。
2.2.3 NOP的单糖组成分析
为了进一步明确NOP的结构特征,采用HPAEC-PAD对其进行单糖组成分析,结果表明:NOP主要由半乳糖醛酸(GalA),含有少量的鼠李糖(Rha)、半乳糖(Gal)和葡萄糖(Glc),其摩尔比为Rha∶Gal∶Glc∶GalA=1.98∶8.43∶3.27∶32.59(表4),该结果与比色法测定的半乳糖醛酸含量结果一致。根据单糖组成,NOP分子链中主要为HG片段,含量达到66.16%,而RG-I片段含量为26.78%,HG/RG-I比例为2.47;果胶分子链中的RG-I支化情况可通过(Ara+Gal)/Rha比值进行评价[26],NOP的(Ara+Gal)/Rha比值4.26,表明其分支程度较小,而NOP的线性化程度Gal A/(Rha+Ara+Gal)为3.13,表明NOP线性化程度较高。结合酯化度的测定,证明酸提NOP是一类以线性HG为主,支化度较低的低酯果胶。WANG等[23]发现酸提NOP的HG含量为64.42%,HG/RG-I的比例为2.70,显著高于碱提果胶,而(Ara+Gal)/Rha比值(4.05)则显著低于碱提果胶;冬枣果胶也有类似结果,采用酸提法从冬枣皮中提取的果胶为一类高纯度的HG果胶[25]。这可能是因为半乳糖醛酸作为果胶结构里的主要骨架线性链存在,在半乳糖醛酸单元中穿插少量鼠李糖以及支链分布的半乳糖和葡萄糖构建RG-I区域,当在酸性环境下提取时,果胶侧链会发生部分降解,导致果胶RG-I所占比例减少,而作为主要结构的以α-1,4-半乳糖醛酸长链构成的HG区域占比不受影响。
2.3 NOP的流变特性
2.3.1 NOP的静态剪切流变特性
果胶的结构组成对其理化性质有着重要影响,为了研究NOP的流变学特性,分别考察了浓度、温度和pH对NOP溶液剪切流变特性的影响(图4)。图4-a为不同浓度NOP溶液表观黏度随剪切速率的变化曲线,由图可知,NOP溶液在1%质量浓度下表观黏度最低,随着浓度的增加,表观黏度逐渐升高,呈一定的浓度依赖性。此外,不同浓度的NOP溶液,随着剪切速率的变化,均呈现明显的剪切稀化假塑性流体特征,且随着浓度的增加,剪切稀化更加显著,这与其他一些低酯果胶的剪切流变特性一致[27-28]。进一步对不同浓度NOP溶液的剪切黏度曲线进行Power-Law模型拟合,获得较好的拟合度(R2=0.946 4~0.992 9),由此计算稠度系数K和剪切稀化指数n,结果如表5所示。不同浓度下NOP溶液的n值均<1,且随着浓度的升高,n值呈降低趋势,表明提高浓度可以显著增强NOP的剪切稀化行为;随着浓度的增加,K值显著升高,表明NOP在水溶液中的稠度随着浓度的升高而升高[29]。
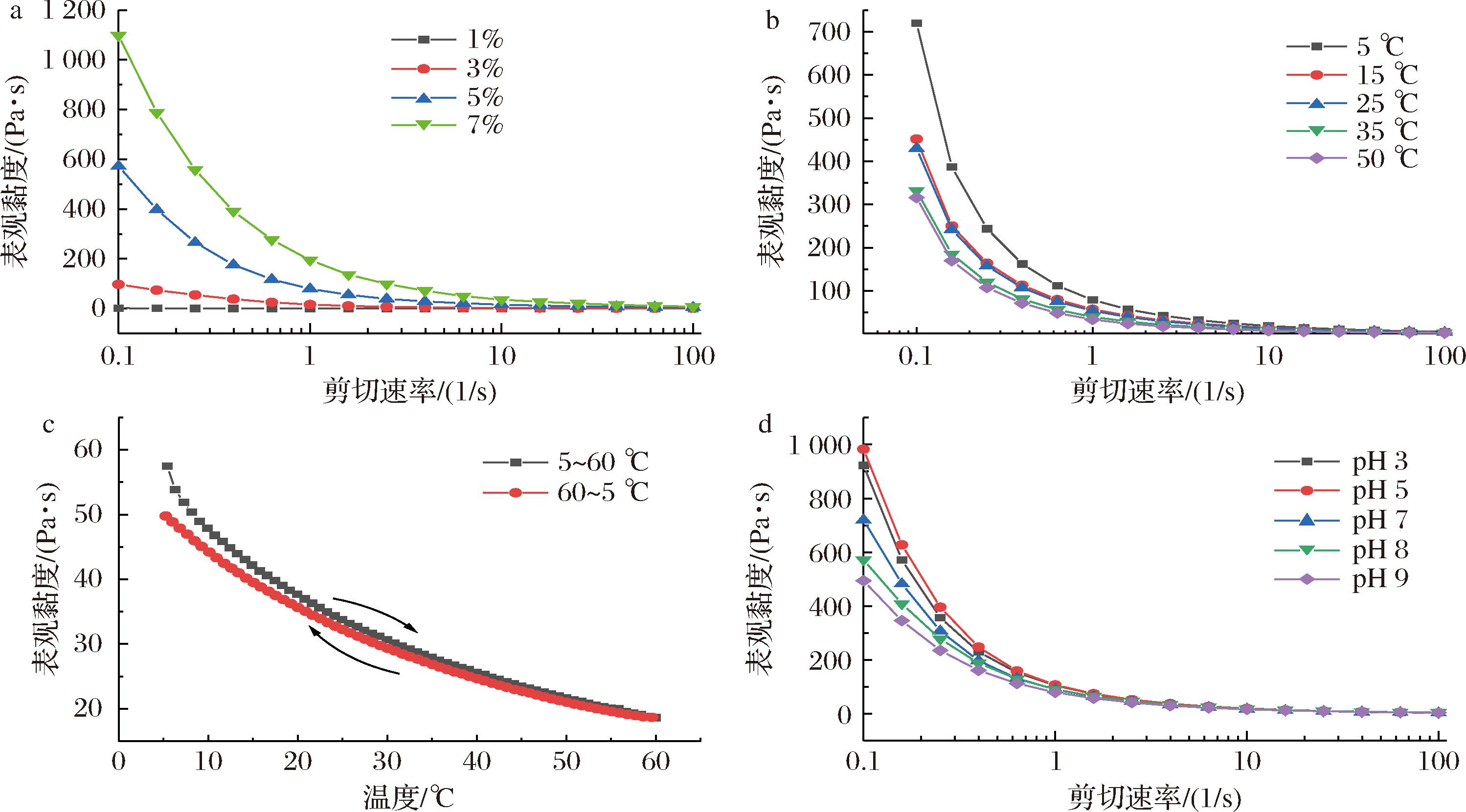
a-质量浓度;b-温度;c-温度扫描曲线;d-pH
图4 浓度、温度及pH对NOP溶液的剪切流变特性的影响
Fig.4 Effects of concentration, temperature, and pH on the shear rheological properties of NOP
表5 不同浓度、温度和pH下Power-Law拟合参数
Table 5 Effects of concentration, temperature, and pH on the Power-Law fitting parameters
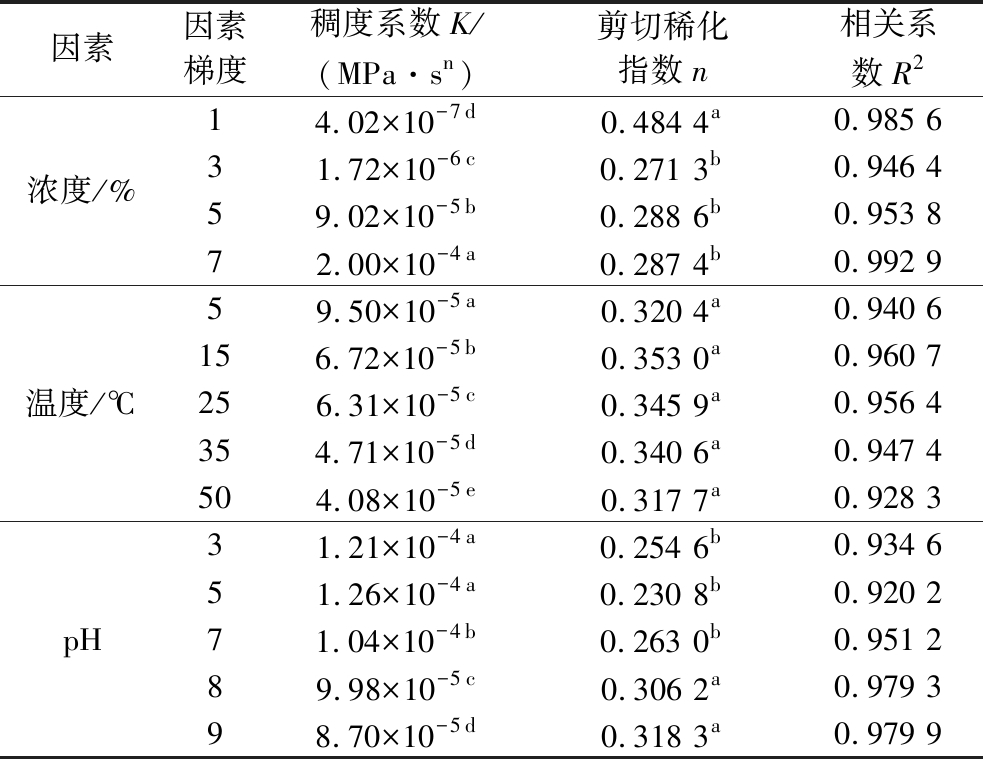
因素因素梯度稠度系数K/(MPa·sn)剪切稀化指数n相关系数R2浓度/%14.02×10-7d0.484 4a0.985 631.72×10-6c0.271 3b0.946 459.02×10-5b0.288 6b0.953 872.00×10-4a0.287 4b0.992 9温度/℃59.50×10-5a0.320 4a0.940 6156.72×10-5b0.353 0a0.960 7256.31×10-5c0.345 9a0.956 4354.71×10-5d0.340 6a0.947 4504.08×10-5e0.317 7a0.928 3pH31.21×10-4a0.254 6b0.934 651.26×10-4a0.230 8b0.920 271.04×10-4b0.263 0b0.951 289.98×10-5c0.306 2a0.979 398.70×10-5d0.318 3a0.979 9
注:同一列不同小写字母表示具有显著性差异。
温度对果胶的流体特性具有重要影响,图4-b显示了不同温度下(5、15、25、35、50 ℃)NOP的剪切黏度变化。在低剪切速率下,NOP的表观黏度随温度升高而降低,随着剪切速率增大,表观黏度显著降低,呈现剪切稀化的假塑性流体行为,这在一些果胶溶液中也报道了类似的结果[30]。对不同温度下NOP溶液的剪切黏度曲线进行Power-Law模型拟合,如表5所示,不同温度下NOP溶液的n均<1,但无显著差异,说明在此温度梯度下,NOP均表现出类似的假塑性特性;K值随着温度的升高而显著降低,则说明NOP的稠度随着温度的升高而降低。
进一步的,通过温度扫描程序分析了NOP溶液的热稳定性和热可逆性,结果如图4-c。结果表明,在升温过程中(5 ℃→60 ℃),NOP溶液的剪切黏度逐渐降低,在冷却过程中(60 ℃→5 ℃),剪切黏度逐渐升高。这是因为高温加剧了果胶分子的运动,破坏了分子间的相互作用,导致果胶溶液的热稳定性下降[31]。此外,升温和降温过程的黏度变化曲线基本重合,表明NOP具有良好的热可逆性。
为了探讨pH对NOP溶液表观黏度的影响,分别在pH为3、5、7、8、9的环境中测试了NOP溶液的剪切流变,如图4-d所示。从图中可知,不同pH环境下,NOP溶液均呈显著的剪切稀化假塑性流体行为;其中在pH 5的溶液中,NOP表观黏度最大,酸化或碱化溶液环境均导致表观黏度的降低,但显然地,与降低pH比较,升高溶液pH对NOP表观黏度的影响更为显著。通过Power-Law模型拟合也发现(表5),pH 5时,溶液稠度最高(K值最大),而升高pH则显著降低溶液稠度(K值显著降低),剪切稀化效果也减弱(n值增大),这表明NOP具有一定的耐酸性,但对碱性环境敏感。这可能是因为酸性环境能够抑制半乳糖醛酸的电离,减弱氢键作用,而增强疏水相互作用;但在碱性环境中,果胶分子中大量羧基被羟基中和,使得分子间的聚集和缠绕作用下降,同时碱会对果胶分子中的酯化基团产生水解作用,削弱疏水相互作用,从而使得NOP表观黏度呈现下降趋势[32]。
2.3.2 NOP的动态黏弹特性
在线性黏弹区(strain为1%)不同浓度NOP 溶液的角频率扫描如图5-a所示,随着角频率的增加,所有样品的G′和G″均呈现上升趋势,表现出一定的频率依赖性;在测试频率范围内(0.1~100 rad/s),不同浓度NOP溶液的G′均大于G″,仅在低浓度(1%)下,tanδ值趋近于1,而随着浓度升高,G′显著大于G″,表明较高浓度的NOP在水溶液具有良好的成胶特性,可形成凝胶[27]。不同结构的果胶被认为具有不同的成胶特性,其中LMP和HMP的凝胶机制就有显著不同,LMP被认为是一种离子响应性凝胶,即在盐离子(如Ca2+)作用下,形成一定强度的凝胶,而HMP则在较低pH或高浓度蔗糖作用下可形成凝胶[33]。然而,果胶的凝胶特性还与结构组成、分子大小和分子链构象有着密切关系。NOP的成胶特性可能与其平滑区(HG)和毛发区(RG-I)的比例以及一定含量的甲氧基有关,平滑区片段一定含量的甲氧基促进了疏水相互作用,而毛发区片段则通过氢键/静电相互作用,形成缠绕结合区域,从而形成凝胶结构[34]。
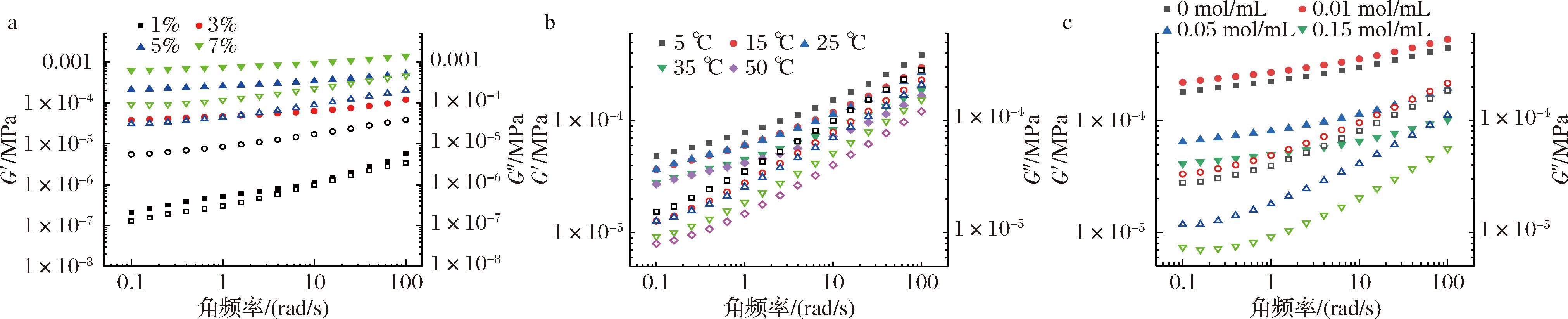
a-质量浓度;b-温度;c-Ca2+浓度
图5 浓度、温度和Ca2+浓度对NOP溶液的储能模量(G′,实心)和损耗模量(G″,空心)频率扫描曲线的影响
Fig.5 Effects of concentration, temperature, and Ca2+ on the storage modulus (G′, solid) and loss modulus (G″, hollow) of NOP
温度对果胶的黏弹特性也会有重要影响,本研究分别在5~50 ℃进行了NOP溶液的动态频率扫描,结果如图5-b所示,随着温度的升高,G′和G″均呈下降趋势,且tanδ值逐渐减小,尤其在高频率下,温度对凝胶结构的影响更为显著,该结果表明随着温度升高,分子运动加剧,果胶分子间的相互作用减弱,导致成胶能力下降;此外,热能的增加也会导致果胶分子间距离增加,导致了更低的表观黏度和黏弹性[35]。
Ca2+被认为对LMP的成胶性有重要影响,其主要是通过果胶非甲氧基化(non-methoxylated galacturonic,NMG)残基与Ca2+结合形成蛋盒连接区,能够有效地提高果胶的成胶性。为此,本研究探讨了不同浓度Ca2+对NOP溶液黏弹特性的影响,结果如图5-c。由图可知,在低浓度Ca2+(0.01 mol/L)作用下,NOP的G′和G″均有所上升,表明其成胶性有所提高;但随着Ca2+浓度增加,其G′和G″均显著下降,果胶的黏弹性有所降低。其原因可能是在0.01 mol/mL Ca2+条件下果胶系统由液态转为溶胶系统,但随着钙离子浓度的增大,解聚的果胶的羧基量不足以和过量钙离子形成网络结构,更倾向于形成结构脆弱的棒状连接区域,导致G′和G″降低[36]。
3 结论
本研究优化了NOP的提取工艺,得到最优提取条件为:提取温度90 ℃、提取时间110 min、料液比1∶29(g∶mL)、pH 1.4,在该实验条件下,NOP提取率可达28.99%。提取得到的NOP是一类以线性HG为主,支化度较低的低酯果胶,其分子质量为135.4 kDa,在溶液中呈紧凑的无规线团。流变学研究表明,NOP在水溶液中呈剪切稀化的假塑性流体特征,具有一定的浓度依赖性;NOP对温度和碱性环境较敏感,升温和提高pH能显著降低其表观黏度,但具有良好的热可逆性和耐酸性;动态黏弹特性分析表明NOP具有良好的成胶性,增加浓度和低浓度Ca2+均可提高其凝胶能力,但升温和较高浓度的Ca2+则会降低其黏弹特性。该研究表明优化的提取条件可用于低酯NOP的制备,而有研究表明低酯果胶相较于高酯果胶,具有更好的抗氧化、保护细胞氧化损伤和抑制淀粉消化等功能[11,23]。下一步将对NOP的精细结构、构效关系及其与食品组分相互作用进行深入探讨,以期为NOP的商业化应用和脐橙高值化开发奠定理论基础。
[1] SINGH B, SINGH J P, KAUR A, et al.Insights into the chemical composition and bioactivities of citrus peel essential oils[J].Food Research International, 2021, 143:110231.
[2] GUO X F, HAN D M, XI H P, et al.Extraction of pectin from navel orange peel assisted by ultra-high pressure, microwave or traditional heating:A comparison[J].Carbohydrate Polymers, 2012, 88(2):441-448.
[3] YANG C, CHEN H, CHEN H L, et al.Antioxidant and anticancer activities of essential oil from Gannan navel orange peel[J].Molecules, 2017, 22(8):1391.
[4] SINGHAL S, SWAMI HULLE N R.Citrus pectins:Structural properties, extraction methods, modifications and applications in food systems-A review[J].Applied Food Research, 2022, 2(2):100215.
[5] CUI J F, ZHAO C Y, FENG L P, et al.Pectins from fruits:Relationships between extraction methods, structural characteristics, and functional properties[J].Trends in Food Science &Technology, 2021, 110:39-54.
[6] MOSLEMI M.Reviewing the recent advances in application of pectin for technical and health promotion purposes:From laboratory to market[J].Carbohydrate Polymers, 2021, 254:117324.
[7] LIN J W, LEI H Q, HAN Z, et al.Conformational flexibility and molecular weight influence the emulsification performance of pectin:A comparative study of sugar beet pectin and citrus pectin[J].Food Hydrocolloids, 2024, 146:109272.
[8] ZHANG M, BAI B Y, CHENG H, et al.A method for gel grade determination and application evaluation of two citrus pectins[J].International Journal of Biological Macromolecules, 2023, 250:126129.
[9] CHEN M R, FALOURD X, LAHAYE M.Sequential natural deep eutectic solvent pretreatments of apple pomace:A novel way to promote water extraction of pectin and to tailor its main structural domains[J].Carbohydrate Polymers, 2021, 266:118113.
[10] PATIENCE N A, SCHIEPPATI D, BOFFITO D C.Continuous and pulsed ultrasound pectin extraction from navel orange peels[J].Ultrasonics Sonochemistry, 2021, 73:105480.
[11] 杜超, 刘佳慈, 曹漫钰, 等.赣州脐橙皮果胶的提取工艺优化及其改性前后理化性质和生物活性的研究[J].食品工业科技, 2022, 43(21):235-244.
DU C, LIU J C, CAO M Y, et al.Optimization extraction of pectin from Ganzhou navel orange peel and investigation of its physicochemical properties and biological activities before and after modification[J].Science and Technology of Food Industry, 2022, 43(21):235-244.
[12] TWINOMUHWEZI H, GODSWILL A C, KAHUNDE D.Extraction and characterization of pectin from orange (Citrus sinensis), lemon (Citrus limon) and tangerine (Citrus tangerina)[J].American Journal of Physical Sciences, 2020, 1(1):17-30.
[13] DAUD N Z A, SAID B N M, JA’AFAR F, et al.pH-dependent yield and physicochemical properties of pectin isolated from Citrus maxima[J].International Journal of Technology, 2019, 10(6):1131.
[14] KAYA M, SOUSA A G, CRÉPEAU M J, et al.Characterization of citrus pectin samples extracted under different conditions:Influence of acid type and pH of extraction[J].Annals of Botany, 2014, 114(6):1319-1326.
[15] 卢泳强, 周朝曦, 张丽丽, 等.苹果果胶的理化特性、抗氧化及降血脂作用研究[J].食品与发酵工业, 2024, 50(7):61-68.
LU Y Q, ZHOU Z X, ZHANG L L, et al.Physicochemical properties, antioxidant, and hypolipidemic effects of pectin from Malus pumila[J].Food and Fermentation Industries, 2024, 50(7):61-68.
[16] PINHEIRO E R, SILVA I M D A, GONZAGA L V, et al.Optimization of extraction of high-ester pectin from passion fruit peel (Passiflora edulis flavicarpa) with citric acid by using response surface methodology[J].Bioresource Technology, 2008, 99(13):5561-5566.
[17] ZHANG H, CHEN J L, LI J H, et al.Extraction and characterization of RG-I enriched pectic polysaccharides from mandarin citrus peel[J].Food Hydrocolloids, 2018, 79:579-586.
[18] ZHANG H, NIE S P, YIN J Y, et al.Structural characterization of a heterogalactan purified from fruiting bodies of Ganoderma atrum[J].Food Hydrocolloids, 2014, 36:339-347.
[19] JOYE D D, LUZIO G A.Process for selective extraction of pectins from plant material by differential pH[J].Carbohydrate Polymers, 2000, 43(4):337-342.
[20] 冯爽, 李祖迪, 岳伟, 等.番茄皮渣果胶结构表征与流变学特性研究[J].食品与发酵工业, 2024, 50(24):51-57.
FENG S, LI Z D, YUE W, et al.Study on structural and rheological properties of pectin from tomato pomace[J].Food and Fermentation Industries, 2024, 50(24):51-57.
[21] CIRIMINNA R, FIDALGO A, DELISI R, et al.Controlling the degree of esterification of citrus pectin for demanding applications by selection of the source[J].ACS Omega, 2017, 2(11):7991-7995.
[22] HOSSEINI S S, KHODAIYAN F, KAZEMI M, et al.Optimization and characterization of pectin extracted from sour orange peel by ultrasound assisted method[J].International Journal of Biological Macromolecules, 2019, 125:621-629.
[23] WANG T, TAO Y H, LAI C H, et al.Influence of extraction methods on navel orange peel pectin:Structural characteristics, antioxidant activity and cytoprotective capacity[J].International Journal of Food Science &Technology, 2023, 58(3):1382-1393.
[24] ZHANG H, NIE S P, GUO Q B, et al.Conformational properties of a bioactive polysaccharide from Ganoderma atrum by light scattering and molecular modeling[J].Food Hydrocolloids, 2018, 84:16-25.
[25] SUN S G, LAN W Z, JI L, et al.A homogalacturonan from peel of winter jujube (Zizyphus jujuba mill.cv.Dongzao):Characterization and protective effects against CCl4-induced liver injury[J].Foods, 2022, 11(24):4087.
[26] CHEN Y, WANG Y J, XU L L, et al.Ultrasound-assisted modified pectin from unripe fruit pomace of raspberry (Rubus chingii Hu):Structural characterization and antioxidant activities[J].LWT, 2020, 134:110007.
[27] CHEN J F, YE F Y, ZHOU Y, et al.Thiolated Citrus low-methoxyl pectin:Synthesis, characterization and rheological and oxidation-responsive gelling properties[J].Carbohydrate Polymers, 2018, 181:964-973.
[28] PATOVA O A, SMIRNOV V V, GOLOVCHENKO V V, et al.Structural, rheological and antioxidant properties of pectins from Equisetum arvense L.and Equisetum sylvaticum L[J].Carbohydrate Polymers, 2019, 209:239-249.
[29] ZHANG H, ZHANG N, XIONG Z Q, et al.Structural characterization and rheological properties of β-D-glucan from hull-less barley (Hordeum vulgare L.var.nudum Hook.f.)[J].Phytochemistry, 2018, 155:155-163.
[30] ZIOGA M, TSOUKO E, MAINA S, et al.Physicochemical and rheological characteristics of pectin extracted from renewable orange peel employing conventional and green technologies[J].Food Hydrocolloids, 2022, 132:107887.
[31] QI T T, REN J N, LI X, et al.Structural characteristics and gel properties of pectin from citrus physiological premature fruit drop[J].Carbohydrate Polymers, 2023, 309:120682.
[32] MOREIRA H R, MUNARIN F, GENTILINI R, et al.Injectable pectin hydrogels produced by internal gelation:pH dependence of gelling and rheological properties[J].Carbohydrate Polymers, 2014, 103:339-347.
[33] CHAN S Y, CHOO W S, YOUNG D J, et al.Pectin as a rheology modifier:Origin, structure, commercial production and rheology[J].Carbohydrate Polymers, 2017, 161:118-139.
[34] THAKUR B R, SINGH R K, HANDA A K.Chemistry and uses of pectin:A review[J].Critical Reviews in Food Science and Nutrition, 1997, 37(1):47-73.
[35] 张莹楠. 蜜瓜皮果胶的提取及流变特性的测定[D].呼和浩特:内蒙古农业大学, 2016.
ZHANG Y N.Extraction and determination of rheological properties of pectin from muskmelon peels[D].Hohhot:Inner Mongolia Agricultural University, 2016.
[36] YULIARTI O, MARDYIAH BINTE OTHMAN R.Temperature dependence of acid and calcium-induced low-methoxyl pectin gel extracted from Cyclea barbata Miers[J].Food Hydrocolloids, 2018, 81:300-311.