茯砖茶是以黑毛茶为原料,经多种工序加工而成的一种后发酵黑茶,其独特的“发花”工序是茯砖茶不同于其他黑茶的关键[1]。“发花”指的是将原料压制成砖坯,在合适的温度、湿度等条件的烘房中,优势菌生长并产生黄色的闭囊壳——“金花”的过程[2-3]。这个过程促使黑茶中内含物质被转化成多种生物活性成分,形成独特的香气、滋味等[4],并赋予黑茶抗氧化、降糖降脂、调节肠道功能、抗肿瘤、抑菌等功效[5]。目前黑茶采用开放式自然发酵体系,“发花”过程中微生物种类和生长难以控制,其品质易不稳定,存在安全问题。
“金花”菌是发花过程中的优势菌,有着丰富的遗传多样性。目前报道的“金花”菌有冠突曲霉(Aspergillus cristatus)、灰绿曲霉(Aspergillus glaucus)、谢瓦氏曲霉(Aspergillus chevalieri)、假灰绿曲霉(Aspergillus pseudoglaucus)和赤散囊菌(Aspergillus rubrum)等[6]。用纯化的“金花”菌发酵黑毛茶汤色浓红,口感醇厚,提升了发酵茶品质。例如黄群等[7]用冠突曲霉发酵茶叶,其茶汤中活性成分如氨基酸、儿茶素、茶色素等物质含量大幅度提高。不同冠突曲霉菌株产生胞外酶以及活性物质不同,使得其发酵的黑茶品质有差异。赵宏朋等[8]从湖南白沙溪茯砖茶中分离鉴定了3株冠突曲霉,不同冠突曲霉菌株发酵绿茶的活性物质存在显著差异性。因此,筛选优质“金花”菌,人工接种精准调控发酵是解决安全问题及保证黑茶品质的重要途径。
本研究从湖南安化茶厂生产的茯砖茶中分离到一株“金花”菌(AH10),对其形态学特征进行观察,并基于β-微管蛋白(tub2)、Ca调节蛋白(CaM)和RNA聚合酶Ⅱ(RPB2)多基因构建系统发育树[9];利用顶空气相离子迁移谱(headspace gas chromatography ion mobility spectrometry,GC-IMS)结合气相色谱-质谱联用(gas chromatography mass spectrometry,GC-MS)技术对发酵茶活性成分进行检测分析,研究冠突曲霉发酵对黑茶特征风味物质形成的影响。
1 材料与方法
1.1 材料与培养基
菌株和茶样:“金花”菌分离自湖南安化茶厂生产的茯砖茶;发酵茶样为湖南安化黑毛茶。
培养基:YPD培养基(g/L):胰蛋白胨20.0,葡萄糖20.0、琼脂20.0,煮沸20 min,pH 6.5~7.0,121 ℃灭菌20 min。
察氏酵母膏琼脂培养基(czapek yeast autolysate agar,CYA)(g/L):蔗糖30.0,酵母提取物5.0,NaNO3 3.0,MgSO4·7H2O 0.5,KCl 0.5,FeSO4·7H2O 0.01,K2HPO4·3H2O 1.0,琼脂15.0,煮沸20 min,pH 6.5~7.0,121 ℃灭菌15 min。
氯硝铵甘油培养基(dichloran glycerol agar base,DG18)(g/L):甘油200 mL,酪蛋白胨5.0,无水葡萄糖10.0,K2HPO4·3H2O 1.0,MgSO4·7H2O 0.5,氯硝胺0.002,琼脂15.0,煮沸20 min,pH 6.5~7.0,121 ℃灭菌15 min。
麦芽提取物琼脂培养基(malt extract agar,MEA)(g/L):麦芽提取物30.0,大豆蛋白胨3.0,琼脂15.0,煮沸20 min,pH 6.5~7.0,121 ℃灭菌15 min。
1.2 试剂与仪器
试剂:真菌DNA提取试剂盒、2×PCR Master Mix、DL2000 DNA Marker、核酸染料,生工生物工程(上海)股份有限公司;C4~C9混合正构酮标准品(色谱纯),北京索莱宝生物科技有限公司;衍生试剂(甲氧基氨基盐酸盐、双(三甲基硅烷基)三氟乙酰胺(Bis(trimethylsilyl)trifluoroacetamide,BSTFA)[含有体积分数为1%三甲基氯硅烷(Chlorotrimethylsilane,TMCS)]),美国Sigma-Aldrich公司;其他试剂为分析纯。
仪器:FlavourSpec®GC-IMS仪,德国G.A.S.公司;Agilent7820气相色谱,美国Agilent科技公司;Ci7800色差测试仪,上海爱色丽色彩科技有限公司;M205FCA体视荧光显微镜,徕卡有限公司;TD-5Z型低速离心机,四川蜀科仪器有限公司;FD5-2.5真空冷冻干燥机,美国SIM公司;SW-CJ-2F超净工作台,苏州净化设备有限公司。
1.3 方法
1.3.1 “金花”菌的分离纯化
称取茯砖茶茶样25 g,于225 mL 8.5 g/L无菌生理盐水(带玻璃珠)中,在28 ℃恒温摇床中,180 r/min振荡20 min。孢子悬液梯度稀释,分别取200 μL稀释液涂布于YPD平板上,于28 ℃恒温倒置培养3~7 d。对不同的真菌菌落进行分离、纯化,纯化的斜面保存于4 ℃冰箱中。
1.3.2 “金花”菌形态和分子生物学鉴定
形态学鉴定:纯化的菌株于28 ℃活化48 h,0.5 cm2的菌丝块分别接种于DG18、MEA和CYA培养基平板上28 ℃倒置培养7 d,记录各培养基上菌落形态和生长情况。
分子生物学鉴定:使用ITS1和ITS4[10]、Bt2a和Bt2b[11]、CMD5和CMD6[12]、fRPB2-5F和fRPB2-7CR[13] 4对引物,利用PCR扩增内源转录间隔区(internal transcribed spacer,ITS)、tub2、CaM、RPB2基因片段,纯化的DNA送商业公司测序。使用PhyloSuite v.1.2.3和mega 6.0的最大似然法(maximum likelihood,ML)对tub2、CaM、RPB2的序列构建多基因系统发育树。
1.3.3 茶叶发酵及感官评审
称取20 g黑毛茶(加7 mL无菌水)于121 ℃灭菌20 min后冷却备用。将1 mL的菌株AH10孢子悬液(血球计数板计数至2×106CFU/mL)接种于高压灭菌茶叶中;在28 ℃、相对湿度80%的培养箱中发酵14 d后收集样本并进行物质成分分析(以接种1 mL无菌水的样品作为对照,CK)。每组样品重复发酵3次。
1.3.3.1 色差分析
以1∶50(m∶v)的比例用沸水冲泡茶样品5 min后将茶汤沥入评茶碗,在室温25 ℃的条件下,将茶汤静置45 min以冷却至室温。以蒸馏水为参照,通过色差仪测定茶样品的色差,颜色表示为L*、a* 和b*,分别表示亮度、红绿值和黄蓝值。
1.3.3.2 感官评价
参照GB/T 23776—2018《感官审评方法——黑茶(散茶)》进行审评,主要审评滋味、香气、汤色3项因子。由5位茶叶审评员组成审评小组(3男2女)对样品进行3项因子综合评判,单项因子满分为100分,品质得分按加权评分法计算,各品质因子的评分系数为滋味40%,香气40%,汤色20%。
1.3.4 GC-IMS分析
分别称取2.0 g茶叶样品,置于20 mL顶空瓶中,编号待检,每个样品重复3次。
进样条件:孵育温度50 ℃、孵育时间20 min、进样针温度65 ℃、顶空自动进样500 μL、转速500 r/min。
GC-IMS条件:使用MXT-5金属毛细管气相色谱柱(60 mm×0.25 mm,0.25 μm);色谱柱温度60 ℃;载气程序:初始流速2 mL/min,保持2 min,18 min内流速匀速升至100 mL/min,保持100 mL/min至30 min,漂移气流速保持,150 mL/min(高纯N2,纯度99.999%)。
采用Vocal软件进行数据查看、定性和图谱分析,使用软件内置的IMS数据库和NIST RI数据库进行物质定性分析。
1.3.5 GC-MS非靶向代谢组
提取方法:收集100 mg冷冻干燥的茶叶,并加入0.4 mL V(甲醇)∶V(氯仿)=3∶1,涡旋30 s。加入瓷珠研磨4 min,冰水浴中超声波5 min,重复处理3次,离心收集上清液。通过甲烷硅基化处理0.4 mL上清液,真空干燥抽提物,加入40 μL甲氧胺盐试剂,混匀后放入烘箱中80 ℃孵育30 min。向各样品中加入60 μL BSTFA,将混合物于70 ℃孵育1.5 h。冷却至室温后,在样品中加入一定量的饱和脂肪酸甲酯标准混合液。
色谱条件:HP-5色谱柱(30 mm×0.25 mm×0.25 μm);起始温度为70 ℃,保持3 min;以5 ℃/min升温至300 ℃,保持5 min;载气:高纯He、流速1 mL/min、进样量为1 μL;分流比10∶1。
质谱条件:传输线温度为290 ℃;离子源温度为280 ℃;扫描模式为全扫描(SCAN);母离子m/z 285;启动电压1.5 V;质量扫描范围m/z 35~500。
1.4 数据分析与处理
利用Agilent7820气相色谱-飞行时间质谱联用仪对样品进行检测,获得代谢物信息。使用Mass hunter软件对质谱数据进行了峰提取、基线矫正、解卷积、峰积分、峰对齐等分析。在FiehnBinbase数据库中使用Chroma TOF 4.3X software对物质进行定量分析;用SIMCA14.1和R软件(R版本3.4.3)等进行单变量和多元变量统计。
2 结果与分析
2.1 菌株的分离纯化及鉴定
2.1.1 菌落形态特征
利用YPD培养基从湖南安化茯砖茶中分离得到了1株“金花”菌AH10。将AH10菌株活化后在DG18、MEA、CYA培养基上28 ℃培养10 d,观察菌落形态。AH10在DG18和CYA培养基上菌落呈现中央黄褐色,边缘金黄色,黄色闭囊壳丰富;菌丝致密,干燥粗糙无渗出液,未见扩散色素(图1-a、图1-c)。在MEA培养基上,菌落直径25~30 mm,菌落呈现中央浅褐色,边缘浅黄色;表面干燥粗糙无渗出液,未见扩散色素(图1-b)。通过菌落形态特征分析,可初步判断AH10菌株为曲霉属内具有黄色闭囊壳的真菌菌株。

a、b、c-菌株AH10分别在DG18、MEA、CYA培养基上的菌落形态;d、e-发育中的闭囊壳和产孢结构;f-破裂的闭囊壳;h-电子显微镜下整体形态;i-闭囊壳;g-子囊
图1 菌株AH10的菌落形态和显微结构特征
Fig.1 The colony and microscopic morphology of the strain AH10
2.1.2 显微结构特征
显微观察发现,闭囊壳逐渐发育成型,呈球形或近球形(图1-d、图1-e),大量闭囊壳缠绕混生于菌丝中(图1-g、图1-h)。闭囊壳里含大量子囊,成熟后破裂释放子囊(图1-f)。子囊近球形,大小10 μm左右,每个子囊含有8个子囊孢子(图1-i)。根据前述形态学特征结合显微镜观察结果,可初步判断AH10菌株为曲霉属内冠突曲霉。
2.1.3 ITS序列比对和多基因系统发育分析
将AH10的ITS序列与GenBank数据库收录序列进行同源性比对,菌株AH10的ITS序列(GenBank登录号:PP126609)与同数据库中多种曲霉的ITS序列相似度接近,未能准确鉴定到物种。进一步构建基于tub2(GenBank登录号:PP437810)、CaM(GenBank登录号:PP437828)、RPB2(GenBank登录号:PP516471)的多基因系统发育树(图2),菌株AH10与A.cristatus CCF4702聚为一支。因此,基于形态学及多基因系统发育分析,菌株AH10被鉴定为冠突曲霉。

图2 基于菌株AH10的tub2、CaM和RPB2基因构建的系统发育树(ML)
Fig.2 Phylogenetic tree of the strain AH10 based on sequences of tub2, CaM and RPB2(ML)
注:T-模式菌株;括号中表示菌株保藏编号;分支点上的数字表示相关类群聚集在一起的百分比;参考菌株从GenBank数据库中下载曲霉属同一菌株的tub2、CaM和RPB2基因序列。
2.2 AH10发酵茶叶及物质检测分析
2.2.1 茶样的感官品质分析
运用感官审评方法对纯菌发酵黑茶(AH10)、自然发酵的安化茯砖茶(FZ)和对照组茶样(CK)的茶汤色泽和滋味品质进行数值量化(表1)。L*值表示茶汤的亮度范围为0(黑色)至100(白色),a*表示茶汤的绿色(负值)至红度(正值)的程度,b*值表示茶汤蓝色(负值)至黄色(正值)程度。茶样的L*变化趋势为:CK>FZ>AH10,CK与FZ明亮度优于AH10;AH10的a*与b*均大于CK与FZ组,AH10的a*为28.83,b*为79.57,说明AH10发酵茶样色泽较明亮且偏向红褐色,与感官审评中的“红褐色、较明亮”评价相符。发酵黑茶与对照组感官总评分为:FZ>AH10>CK。在滋味方面,AH10接种发酵黑茶使得口感醇香浓厚,青辛味减少。在香气方面,AH10散发令人愉悦的菌花香,稍有泥土气。由黑毛茶发酵的黑茶汤色红浓、口感醇厚、具有陈香味道[14]。从感官审评结果可知,AH10接种发酵黑茶具有“金花”茂盛,茶汤红褐、明亮,“菌花香”浓郁持久,口感醇厚回甘等品质特征。
表1 三种茶样的感官评审及色度
Table 1 Sensory evaluation and color of three tea samples
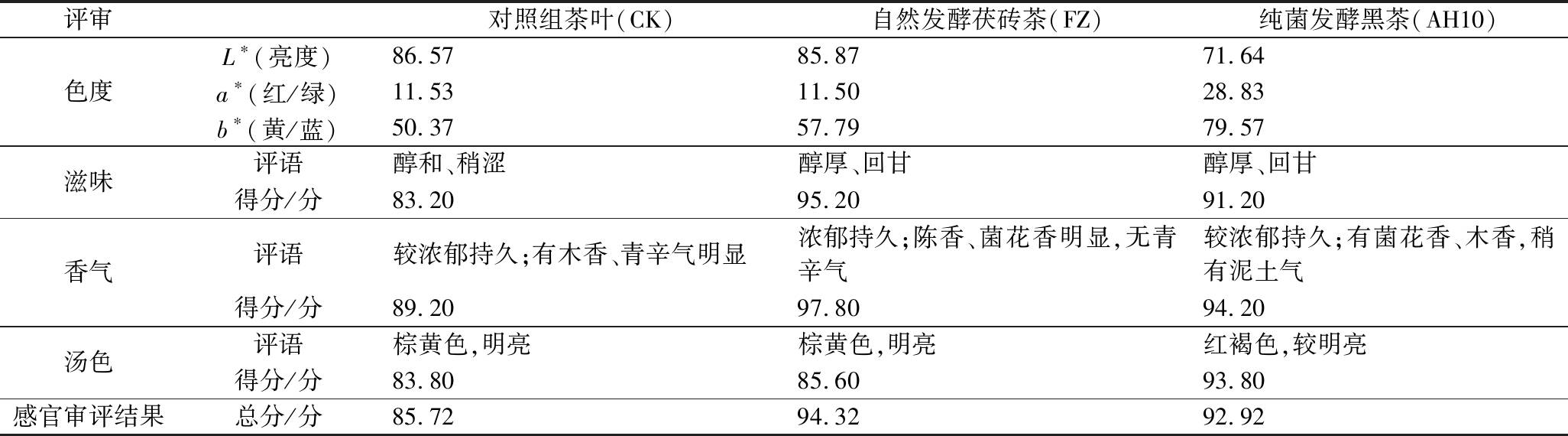
评审对照组茶叶(CK)自然发酵茯砖茶(FZ)纯菌发酵黑茶(AH10)色度 L∗ (亮度)86.5785.8771.64 a∗ (红/绿)11.5311.5028.83 b∗ (黄/蓝)50.3757.7979.57 滋味 评语醇和、稍涩醇厚、回甘醇厚、回甘得分/分83.2095.2091.20香气 评语较浓郁持久;有木香、青辛气明显浓郁持久;陈香、菌花香明显,无青辛气较浓郁持久;有菌花香、木香,稍有泥土气得分/分89.2097.8094.20汤色 评语棕黄色,明亮棕黄色,明亮红褐色,较明亮得分/分83.8085.6093.80感官审评结果总分/分85.7294.3292.92
2.2.2 GC-IMS分析
GC-IMS在对照组与AH10样品中共检测到67种挥发性化合物(部分物质含有单体与二聚体2种形式)。包括20种醛、16种醇、13种酮、9种酯、1种酸、3种碳氢化合物、5种杂环化合物,大部分是黑茶中常见的香味成分。
GC-IMS指纹图谱如图3所示,两框之间的物质为发酵茶和对照组茶样共有的25种风味物质,分别为丁醛、壬醛、乙酸异戊酯、乙酸乙酯、乙酸甲酯、三醋酸甘油酯、四氢噻吩、2-乙基己醇、庚醛、2-异丁基-3-甲基吡嗪、δ-3-蒈烯、1,3-丁二醇、2-己醇、乙酸己酯、2-辛醇、乙醇、丙烯酸乙酯、乙基乙烯基酮、丙醛、叔丁醇、芳樟醇氧化物、芳樟醇、1-苯乙酮。发酵后黑茶的20种特有物质(以红框标示),分别为水杨酸甲酯、β-月桂烯、异戊醛、(E)-2-己烯醛、4-甲基苯甲醛、戊醛、2-甲基丁醛、2-甲基-2-戊烯醛、乙缩醛、香柠檬醛、2-戊酮、环己酮、环戊酮、4-甲基-2-戊酮、2-甲基吡嗪、异戊二烯醇、异戊醇、1-辛烯-3-醇。发酵后醇、醛、酮、酯等香气物质种类增多,这对利用冠突曲霉AH10发酵黑茶品质形成具有重要意义。

图3 发酵茶叶代谢物的GC-IMS分析
Fig.3 GC-IMS analysis of metabolites in fermentation tea
在对照组及发酵后样品代谢物的正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型中,R2得分为0.885,Q2得分为0.881,表明所建的模型稳定可靠,它们之间的代谢物差异明显(图4-a)。为了进一步筛选出发酵茶叶和对照样品间的差异物质,本研究构建了S-Plot模型(图4-b),以VIP>1结合S-plot图(|P(corr)|>0.58)为标准,筛选出11种发酵后黑茶的关键风味物质,分别为乙酸乙酯、1-辛烯-3-醇、水杨酸甲酯、2-甲基吡嗪、环己酮、戊醛、(E)-2-己烯醛、2-甲基丁醛、异戊醇、异戊醛和2-戊酮。本研究所检测的特征物质与其他研究人员利用冠突曲霉发酵黑茶及湖南紧压黑茶成品茶中的特征物质不同[15-17],不同的发花菌种可能是造成特征物质差异的主要原因。
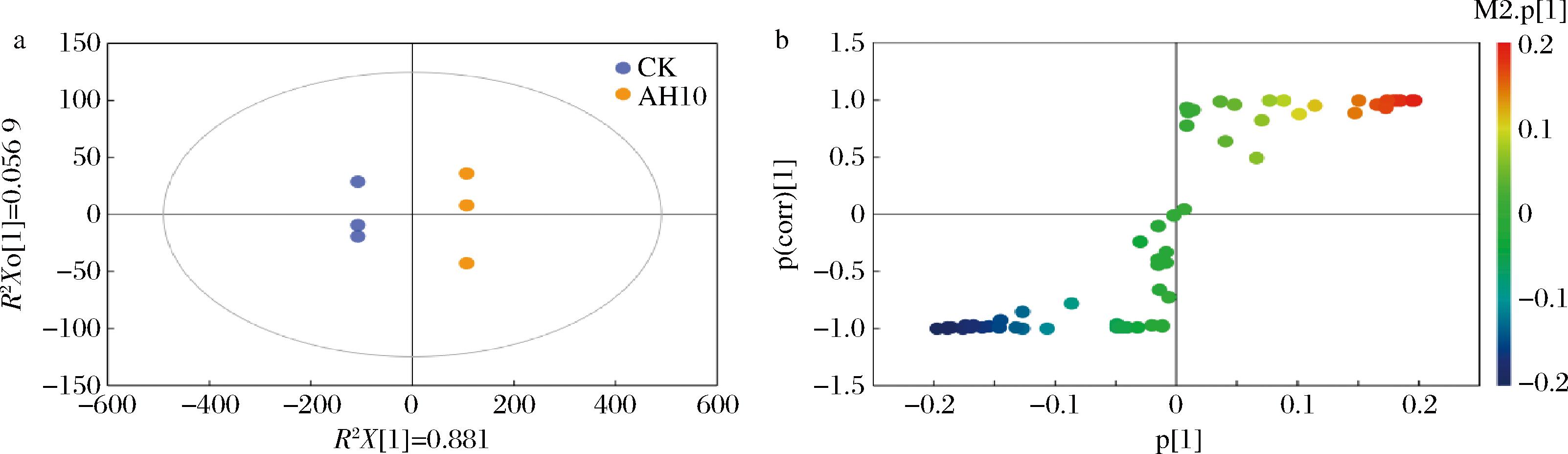
a-OPLS-DA图;b-S-plot图
图4 发酵茶叶代谢物OPLS-DA和S-plot分析
Fig.4 OPLS-DA and S-plot analysis of metabolites in fermentation tea
特征物质所产生的“菌花”、泥土、木质等特征香气对黑茶香气品质的形成具有重要作用。例如1-辛烯-3-醇呈现泥土香和蘑菇香[18],水杨酸甲酯呈现冬青油香[19]。环己酮、(E)-2-己烯醛具有薄荷、清鲜、草木青气[20],是发酵黑茶清香风味的主要物质,异戊醇、乙酸乙酯、戊醛、2-戊酮、异戊醛、2-甲基丁醛、2-甲基吡嗪对构成发酵黑茶甜香、果香、辛辣味、巧克力气味、烘焙香气的复合气味具有重要贡献。这与感官评审结果中发酵茶香气浓郁持久,具有“菌花香”、木香、稍有泥土气的结果一致。对菌花香有重要贡献的1-辛烯-3-醇、(E)-2-己烯醛和水杨酸甲酯等关键特征物质在本研究中显著增加,这与成品茶中的检测结果一致[21-22]。由此说明,利用冠突曲霉发酵的黑茶具有和成品茶相近的菌花香物质基础。
2.2.3 非靶向代谢组分析
GC-MS在对照组样品(CK)与发酵后样品(AH10)中鉴定到89种代谢物。主成分分析(principal component analysis,PCA)表明,样本之间存在显著的物质差异(图5)。根据OPLS-DA模型分析结果,筛选出18种差异代谢物(VIP>1,P<0.05),主要包括糖、有机酸、脂肪酸、氨基酸及其衍生物等,其中12个显著下调,6个显著上调。
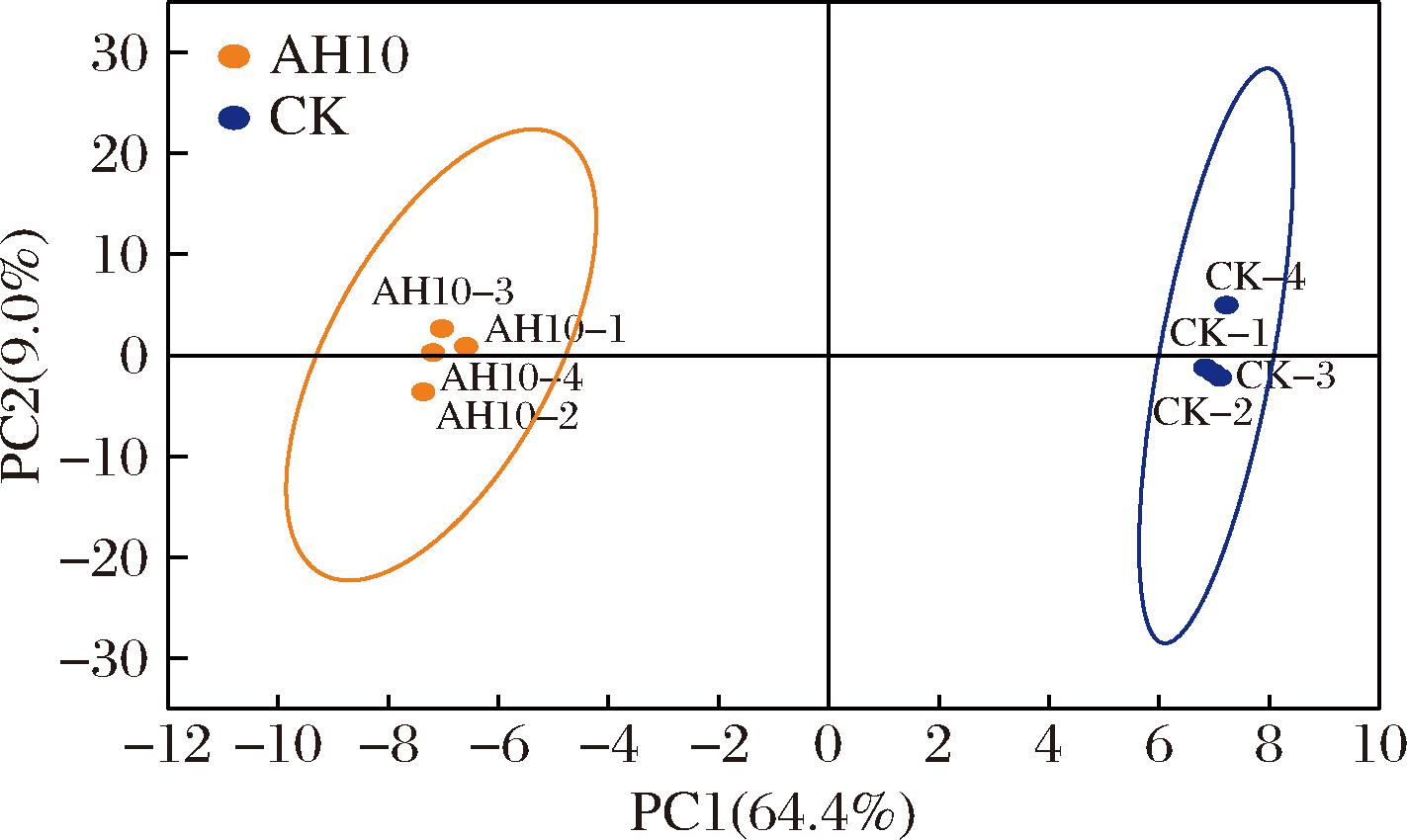
图5 发酵茶叶代谢物的主成分分析
Fig.5 PCA of metabolites in fermentation tea
对差异代谢物进行热图分析,结果如图6所示,6种糖类差异代谢物中D-山梨醇、乳糖、蔗糖含量均上调。与对照组相比,发酵茶叶中D-山梨醇平均含量上调2.52倍,D-核糖、甘油和肌醇平均含量分别下调0.96、3.38和2.95倍。糖类中呈现二糖含量下调,单糖含量上调明显趋势。推测在发酵过程中的渗透胁迫或微生物生长代谢导致二糖水解生成单糖,从而增强了黑茶的甘甜味和厚度[23]。有机酸类差异代谢物共9种,其中甘油酸和没食子酸分别上调1.08与2.36倍,间苯三酚酸、柠檬酸、琥珀酰丙酮、苹果酸、核糖酸、莽草酸及奎宁酸下调1.53~7.22倍,脂肪酸中2,3,4-三羟基丁酸下调4.40倍。有机酸类整体呈下调趋势,甘油酸磷酸化后的3-磷酸甘油酸是能量代谢的中间产物;柠檬酸、奎宁酸和苹果酸是水溶性有机酸,溶于水后提升茶汤酸度,柠檬酸呈温和爽快酸味,苹果酸呈爽快酸略带苦[24];没食子酸是发酵后茶叶中主要的酚酸类物质,与发酵茶叶的苦味与涩味相关,具有抗氧化功能[25]。氨基酸中5-氧脯氨酸下调6.39倍,5-氧脯氨酸是生成谷氨酸的前体物质。以上结果表明,发酵样品与对照组的代谢物存在显著的差异性,说明发酵过程促进黑茶中物质成分发生转变,进而影响发酵黑茶的滋味特征。
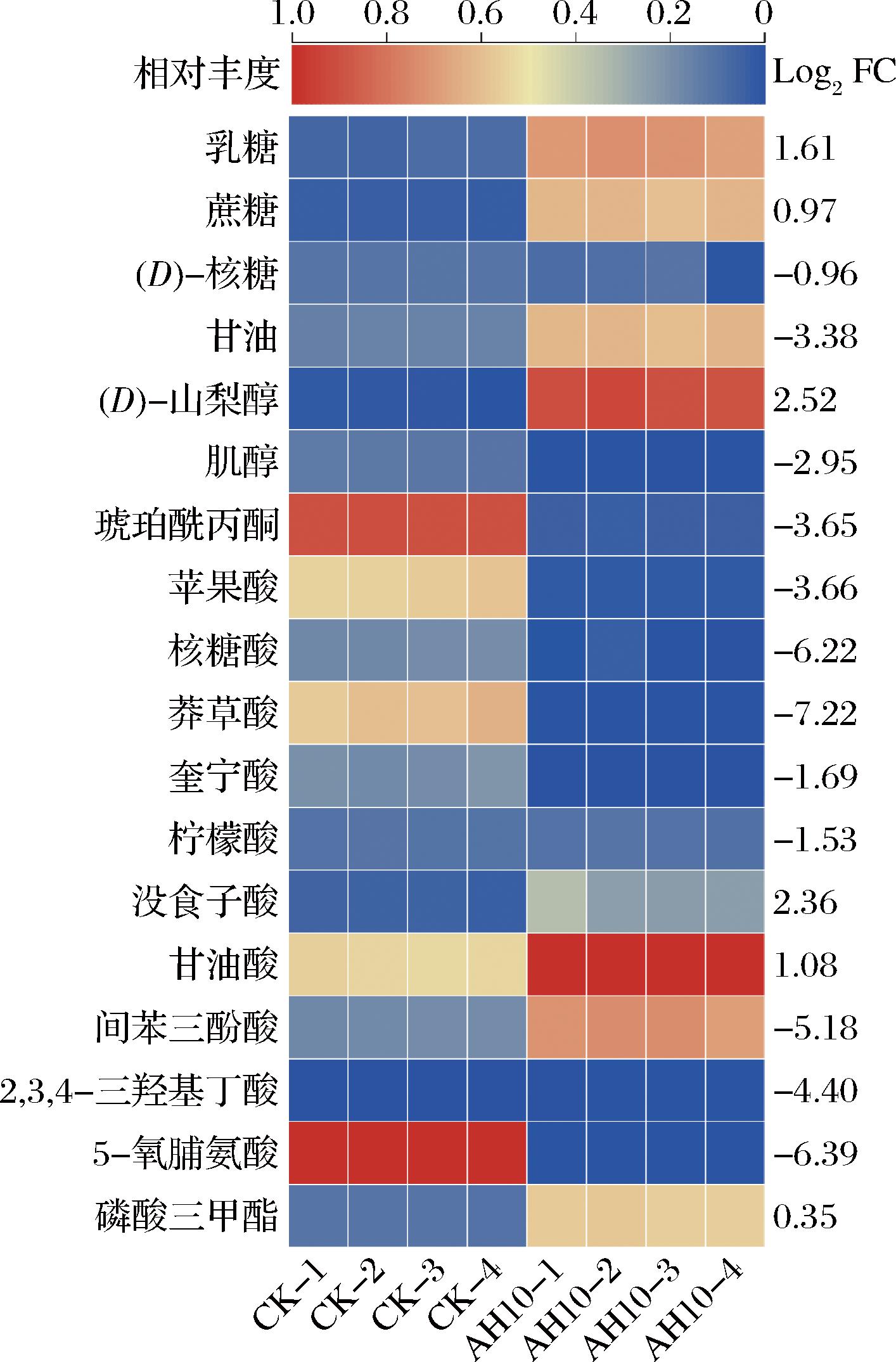
图6 发酵茶叶差异代谢物的热图分析
Fig.6 Heatmap of different metabolites in fermentation tea
3 结论
茯砖茶是以冠突曲霉为主的多菌混合发酵,加工工艺复杂、很难控制,一些杂菌容易生长繁殖,产生有害物质,故茯砖茶品质不稳定。人工接种“金花”菌并精准调控发酵是解决安全问题及保证黑茶品质的有效方法。本研究从湖南安化茯砖茶中筛选得到一株“金花”菌AH10,基于菌落形态、显微特征、ITS序列比对和tub2、CaM、RPB2的多基因系统发育分析,该菌株被鉴定为冠突曲霉。将冠突曲霉AH10接种于灭菌黑毛茶中进行固态发酵,进而对发酵茶样的感官特征及物质成分检测分析,探究纯菌发酵对黑茶品质的影响。发酵后,茶汤的感官特征也随之发生变化,a*值、b*值及汤色、滋味、香气的感官评分均显著升高,L*值显著降低,形成黑茶“金花”茂盛、茶汤红褐明亮,“菌花香”较浓郁持久,口感醇厚回甘的品质特征。利用冠突曲霉AH10发酵的黑茶与湖南安化茯砖茶品质特征相近。
茯砖茶特征香气“菌花香”是一种复合型香气类型,是“金花菌”和茶体香气共同作用的结果[26]。为了探究冠突曲霉AH10发酵的黑茶香气物质基础,利用GC-IMS法对照组与发酵后黑茶的挥发性物质分析,共检测到挥发性化合物67种,其中1-辛烯-3-醇、水杨酸甲酯、环己酮、(E)-2-己烯醛,异戊醇、乙酸乙酯、戊醛、2-戊酮、异戊醛、2-甲基丁醛、2-甲基吡嗪为发酵黑茶的关键物质,这11种关键物质对利用冠突曲霉发酵黑茶产生独特香气具有重要作用。对菌花香有重要贡献的1-辛烯-3-醇、(E)-2-己烯醛和水杨酸甲酯等关键物质在本研究中显著增加,这使得利用冠突曲霉发酵的黑茶具备和成品茶相近的菌花香物质基础。GC-MS法共检测到89种代谢物,18种差异代谢物(VIP>1,P<0.05),其中12个显著下调,6个显著上调,如D-山梨醇、没食子酸、甘油酸上调,而奎宁酸、苹果酸等物质下调,这些物质对发酵后茶叶醇厚回甘滋味形成以及苦涩味减少具有重要贡献。本研究为“金花”菌菌种优选和发酵黑茶质量提升方面提供理论基础。
[1] 周祎炜, 燕飞, 曲东, 等.冠突散囊菌对茶叶品质的影响及其发酵茶的功能活性研究进展[J].茶叶通讯, 2024, 51(1):16-22.
ZHOU Y W, YAN F, QU D, et al.Research progress on the effect of Eurotium cristatum on the quality of tea and the functional activity of fermented tea[J].Journal of Tea Communication, 2024, 51(1):16-22.
[2] 姜良珍, 王罗, 杨涛, 等.冠突散囊菌及其发酵应用研究进展[J].食品工业科技, 2022, 43(4):454-462.
JIANG L Z, WANG L, YANG T, et al.Research progress on Eurotium cristatum and its fermentation application[J].Science and Technology of Food Industry, 2022, 43(4):454-462.
[3] 赵燕妮, 陈丹, 陈雪峰, 等.基于脂质组学的不同原料茯茶 “发花” 前后脂类变化研究[J].陕西科技大学学报, 2021, 39(3):40-47.
ZHAO Y N, CHEN D, CHEN X F, et al.Study on the change of lipids before and after fungal-fermentation process of Fu brick tea with different raw materials based on lipidomics[J].Journal of Shaanxi University of Science &Technology, 2021, 39(3):40-47.
[4] 朱明君, 刘刚, 梅雪然, 等.冠突散囊菌固态发酵对栘(木衣)茶品质和成分影响的研究[J].食品与生物技术学报, 2017, 36(8):834-842.
ZHU M J, LIU G, MEI X R, et al.Effect of solid-state fermentation with Eurotium cristatum on the quality and chemical compositions of Docynia indica tea[J].Journal of Food Science and Biotechnology, 2017, 36(8):834-842.
[5] 王亚丽, 秦俊哲, 黄亚亚, 等.冠突散囊菌对茯砖茶品质形成的影响[J].食品与发酵工业, 2018, 44(4):194-197.
WANG Y L, QIN J Z, HUANG Y Y, et al.Effect of the quality of Fuzhuan brick tea fermented in Eurotium cristatum[J].Food and Fermentation Industries, 2018, 44(4):194-197.
[6] 梁瑞娜, 刘警鞠, 李聪, 等. 茯砖茶真菌多样性分析、分离鉴定及优势“金花菌”的分类物种名称探讨[J/OL]. 菌物研究, 2024: 1-10. (2024-07-08). http://kns.cnki.net/kcms/detail/22.1352.S.20240705.1403.002.html.
LAING R N, LIU J J, LI C, et al. Diversity analysis, isolation and identification of fungi in Fuzhuan tea and discussion on taxonomic species name of "golden fungus"[J/OL]. Journal of Fungal Research, 2024: 1-10. (2024-07-08). http://kns.cnki.net/kcms/detail/22.1352.S.20240705.1403.002.html.
[7] 黄群, 李彦坡, 陈林杰, 等.冠突散囊菌液态发酵过程中黑茶活性成分变化研究[J].食品科学, 2007, 28(12):231-234.
HUANG Q, LI Y P, CHEN L J, et al.Study on changes of active components in dark tea during liquid fermentation by Eurotium cristatum [J].Food Science, 2007, 28(12):231-234.
[8] 赵宏朋, 黄斯晨, 施丽娟, 等.茯砖茶优势菌株分离鉴定及发酵低级绿茶分析[J].食品科学, 2022, 43(6):89-95.
ZHAO H P, HUANG S C, SHI L J, et al.Isolation and identification of predominant fungus in Fuzhuan tea and their application for fermentation of low-grade green tea[J].Food Science, 2022, 43(6):89-95.
[9] CHEN A J, HUBKA V, FRISVAD J C, et al.Polyphasic taxonomy of Aspergillus section Aspergillus (formerly Eurotium), and its occurrence in indoor environments and food[J].Studies in Mycology, 2017, 88:37-135.
[10] WHITE T J, BRUNS T, LEE S, et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]. Amsterdam:Elsevier, 1990:315-322.
[11] GLASS N L, DONALDSON G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J].Applied and Environmental Microbiology, 1995, 61(4):1323-1330.
[12] HONG S B, GO S J, SHIN H D, et al.Polyphasic taxonomy of Aspergillus fumigatus and related species[J].Mycologia, 2005, 97(6):1316-1329.
[13] LIU Y J, WHELEN S, HALL B D.Phylogenetic relationships among ascomycetes:Evidence from an RNA polymerse Ⅱ subunit[J].Molecular Biology and Evolution, 1999, 16(12):1799-1808.
[14] LU H Q, YUE P X, WANG Y W, et al.Study of bioactive components and color properties of dark tea infusion manufactured by Eurotium cristatum using submerged fermentation[J].Advance Journal of Food Science and Technology, 2016, 10(8):591-596.
[15] 侯晓慧, 张婷, 张萌, 等.基于GC-IMS和HS-SPME-GC-MS分析泾阳茯砖茶的特征风味物质[J].食品科学, 2023, 44(14):245-257.
HOU X H, ZHANG T, ZHANG M, et al.Identification of characteristic flavor substances of Jingyang Fu brick tea by gas chromatography-ion mobility spectrometry and headspace solid phase microextraction-gas chromatography-mass spectrometry[J].Food Science, 2023, 44(14):245-257.
[16] 邓见田烨, 晏美红, 尚铂昊, 等.基于HS-SPME-GC-MS技术分析不同种类黑茶香气成分[J].食品工业科技, 2023, 44(18):378-386.
DENG J, YAN M H, SHANG B H, et al.Study on aroma components in different types of dark tea based on HS-SPME-GC-MS[J].Science and Technology of Food Industry, 2023, 44(18):378-386.
[17] XIAO Y, HUANG Y X, CHEN Y L, et al.Discrimination and characterization of the volatile profiles of five Fu brick teas from different manufacturing regions by using HS-SPME/GC-MS and HS-GC-IMS[J].Current Research in Food Science, 2022, 5:1788-1807.
[18] LI Q, LI Y D, LUO Y, et al.Characterization of the key aroma compounds and microorganisms during the manufacturing process of Fu brick tea[J].LWT, 2020, 127:109355.
[19] ZHENG X X, HONG X, JIN Y L, et al.Characterization of key aroma compounds and relationship between aroma compounds and sensory attributes in different aroma types of Fu brick tea[J].Food Chemistry, 2022, 13:100248.
[20] ZHANG W C, CAO X, LIU S Q.Aroma modulation of vegetable oils-a review[J].Critical Reviews in Food Science and Nutrition, 2020, 60(9):1538-1551.
[21] 金友兰, 黄甜, 蒋容港, 等.不同类型发花砖茶特征香气成分研究[J].食品与发酵工业, 2021, 47(3):188-196.
JIN Y L, HUANG T, JIANG R G, et al.Characteristic volatile components of different types of fermented brick tea[J].Food and Fermentation Industries, 2021, 47(3):188-196.
[22] XU X Q, MO H Z, YAN M C, et al.Analysis of characteristic aroma of fungal fermented Fuzhuan brick-tea by gas chromatography/mass spectrophotometry[J].Journal of the Science of Food and Agriculture, 2007, 87(8):1502-1504.
[23] 严俊, 王秀丽.中国名茶可溶性总糖的含量研究[J].茶业通报, 1993, 15(3):36-39.
YAN J, WANG X L.Study on the content of total soluble sugars in Chinese famous teas[J].Journal of Tea Business, 1993, 15(3):36-39.
[24] 刘盼盼, 钟小玉, 许勇泉, 等.茶叶中有机酸及其浸出特性研究[J].茶叶科学, 2013, 33(5):405-410.
LIU P P, ZHONG X Y, XU Y Q, et al.Study on organic acids contents in tea leaves and its extracting characteristics[J].Journal of Tea Science, 2013, 33(5):405-410.
[25] 马存强, 周斌星, 马冰凇, 等.茶叶微生物发酵过程中没食子酸代谢研究进展[J].中国食品学报, 2024, 24(7):450-459.
MA C Q, ZHOU B X, MA B S, et al.Research advances on gallic acid metabolism during tea-leaves microbial fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(7):450-459.
[26] 蒋容港, 黄燕, 金友兰, 等.茯砖茶呈香挥发性物质及其来源[J].食品与生物技术学报, 2021, 40(9):101-111.
JIANG R G, HUANG Y, JIN Y L, et al.Study of aroma compounds and their source in Fu brick tea[J].Journal of Food Science and Biotechnology, 2021, 40(9):101-111.