牡蛎,又称蚝,其肉味道鲜美,营养价值极高,素有“海洋牛奶”的美誉,在全球沿海海域广泛分布。与其他海洋贝类相比较,牡蛎具有地理分布广、食物链短、生长快和产量高等特点,是人类可利用的重要海洋生物资源之一[1]。根据《中国渔业统计年鉴》,我国2022年牡蛎产量达620万吨[2]。生鲜牡蛎营养丰富、含水量高,在运输和销售过程中,极易受到微生物、温度等众多因素的影响,导致感官品质和营养成分下降,甚至腐败变质,失去食用价值[3]。因此,人们常利用干制加工的方式延长牡蛎的保质期,干制加工在减少资源浪费、降低保鲜、运输成本的同时,赋予了牡蛎独特的风味。
牡蛎干制技术的主要类型有自然干燥、热风干燥、冷风干燥、微波干燥、真空干燥和冷冻真空干燥等,目前市场上利用热风干燥进行牡蛎干制比较普及[3]。前期的研究表明,热风干制可以显著增加牡蛎的氮氧化合物浓度[4]。ZHU等[5]研究了5种不同的干燥方法对于半干河豚鱼片品质的影响,结果表明热风干燥比其他干燥方法产生更多的挥发性化合物,并改善气味和咀嚼能力的感官评分。WANG等[6]研究了不同干燥方法对黄芪品质特性和非挥发性味觉成分的影响,表明热风干燥可以使黄芪产生更多与鲜味、甜味有关的化合物。CHEN等[7]研究了加工阶段在华贵类栉孔扇贝衣原体内收物的营养成分变化和特征风味形成中的作用,其结果也印证了这一点。孟维博等[8]研究了不同干燥方法对牡蛎干品质及气味的影响,考查了牡蛎干的质构品质及挥发性物质,但电子鼻检测挥发性物质,具体种类不明确且无法定量;孙鹤等[9]研究了不同干制方式对牡蛎非挥发性滋味物质的影响,着重比较冷风干燥与热风干燥对脂肪酸、氨基酸等主要滋味物质的影响;LIU等[10-11]研究了高静水压处理和温度对鲜牡蛎滋味物质的影响以及高静水压处理鲜牡蛎与蒸牡蛎滋味成分差异。尽管对于鲜牡蛎和牡蛎干各自的风味成分已有不同程度的研究,但是关于牡蛎干制前后营养成分、滋味物质、挥发性物质变化的系统研究,未见相关报道。探究热风干制对牡蛎风味物质的影响效果,明确牡蛎的呈味机制,可以为牡蛎中滋味物质的挖掘及衍生滋味增强剂的开发提供理论基础,有利于牡蛎资源的高值化利用。
本研究以香港牡蛎(Crassostrea hongkongensis)为研究对象,考查热风干制加工前后牡蛎的营养成分及各自水提物的表观特征,比较鲜牡蛎水煮提取物(aqueous extract of fresh oysters,AEFO)和牡蛎干水煮提取物(aqueous extract of dried oysters,AEDO)中滋味物质及挥发性物质的含量,结合滋味活性值(taste activity value,TAV)与等鲜量(equivalent umami concentration,EUC)分析评价各滋味物质的呈味效果,反映牡蛎干的滋味特征;利用电子鼻及气相色谱离子迁移谱联用仪(gas chromatography-ion mobility spectrometry,GC-IMS)对2种牡蛎水提物的挥发性物质分类、明确并做出半定量分析。以期为牡蛎干制加工的风味调控及牡蛎干的精深加工利用提供基础数据。
1 材料与方法
1.1 材料与仪器
香港牡蛎(Crassostrea hongkongensis),2023年6月购于广东省湛江市霞山水产市场;甲醇、乙腈(均为色谱级),上海麦克林生化科技股份有限公司;优级乙醇,西陇科学股份有限公司。
GZX-9140MBE电热鼓风干燥机,上海博迅医疗生物仪器有限公司;Lynx-6000高速落地离心机,美国Thermo公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;NS810分光测色仪,广东三恩时智能科技有限公司;Nanolink SZ901/902系列纳米粒度及zeta电位分析仪,珠海真理光学仪器有限公司;1260 Infinity Ⅱ高效液相色谱仪,安捷伦科技(中国)有限公司;SA402B电子舌,日本Insent公司;PEN3型电子鼻,德国AIRSENSE公司。
1.2 实验方法
1.2.1 样品制备
参考阮仕艳[12]的方法,略有修改。新鲜牡蛎打浆,多次测定水分后计算干基,确定鲜牡蛎取样量,加蒸馏水补至与牡蛎干一致,提取方法相同。
干制及提取工艺:
新鲜牡蛎→取肉、清洗→漂烫(1 min)→干燥[(70±2) ℃、8 h]→绞碎(60目)→称样、加水料液比为1∶4(g∶L)→均质→提取→离心(9 500 r/min)→重复提取→过滤→浓缩、冻干(-80 ℃保存)
1.2.2 鲜牡蛎及牡蛎干基本营养成分测定
水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;脂肪含量测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;灰分含量测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;总糖含量测定参照GB/T 9695.31—2008《肉制品 总糖含量测定》。
1.2.3 牡蛎水提物表观特征测定
1.2.3.1 色泽
颜色是评价食品的重要属性之一,L*值表示牡蛎水提物的亮度值,L*值越低表示色泽越暗淡。W值是指白度,按公式(1)计算:
W=100-[(100-L*)2+(a*)2+(b*)2]0.5
(1)
参考王春雨[13]的方法,样品使用分光测色仪测定,使用前进行黑白校正。盛牡蛎水提物于样品盘中,测量10次,读取色差数值并计算平均值与标准偏差,色差值分别为a*值、b*值、L*值。
1.2.3.2 粒径分布
参考王亮[14]的方法,取样0.1 g,加水100 mL低速搅拌溶解,使用马尔文纳米粒度电位仪测定牡蛎水提物的粒径分布规律以及电位状态,测定温度25 ℃,重复测定10次,测定结果以平均值表示。
1.2.3.3 分子质量分布
利用HPLC测定牡蛎水提物分子质量分布规律。色谱柱TSKgelG2000 swxl(300 mm×7.8 mm),流动相:乙腈∶水∶三氟乙酸=20∶80∶0.1(体积比),标准品:甘氨酸-甘氨酸-甘氨酸、甘氨酸-甘氨酸-酪氨酸-精氨酸、杆菌肽、胰岛素。称样10 mg于10 mL容量瓶,加流动相超声振荡10 min,混匀,加流动相稀释至刻度,过0.45 μm有机相膜,滤液按色谱条件进行分析。
1.2.4 牡蛎水提物滋味物质测定
1.2.4.1 游离氨基酸
利用HPLC(配VWD检测器)进行游离氨基酸的测定,色谱柱ZORBAX Eclipse AAA(4.6 mm×150 mm,3.5 μm),流动相A:40 mmol/L NaH2PO4溶液(pH 7.8);流动相B:乙腈∶甲醇∶水=45∶45∶10(体积比),检测信号:紫外338 nm(0~19 min),266 nm(19.01~25 min),流速:1.0 mL/min,柱温45 ℃。称样0.5 g于10 mL离心管,加0.01 mol/L HCl溶液5 mL,混匀,沸水浴30 min,10 000 r/min离心10 min;取上清液,沉淀加4 mL 0.01 mol盐酸悬浮超声5 min,离心,合并上清液,定容至10 mL,过膜测定。
1.2.4.2 呈味核苷酸
参照饶梦微等[15]的方法并进行调整。称样0.5 g,加10%高氯酸(体积分数)溶解,均质2 min后于4 ℃、10 000 r/min下离心10 min,倒出上清液,再加入2.5 mL高氯酸洗涤沉淀,离心并收集上清液,用5~10 mol/L的KOH溶液调节pH值至6.5,冰浴30 min后过膜备用。HPLC条件:色谱柱Diamonsil Plus C18(250 mm×4.6 mm,5 μm);柱温25 ℃;紫外检测器波长260 nm;流动相:5%的0.05 mol/L KH2PO4-K2HPO4溶液与95%甲醇溶液;流速0.7 mL/min;进样量20 μL。
1.2.4.3 有机酸及甜菜碱
有机酸的测定参照GB 5009.157—2016《食品安全国家标准 食品中有机酸含量的测定》,称样0.5 g,加水25 mL溶解,均质,于4 ℃、10 000 r/min下离心20 min,取上清液。HPLC条件:色谱柱Diamonsil Plus C18(250 mm×4.6 mm,5 μm);柱温30 ℃;紫外检测器波长220 nm;流动相:5%的0.1% KH2PO4-K2HPO4溶液与95%甲醇溶液;流速1 mL/min;进样量20 μL。甜菜碱的含量测定使用甜菜碱含量试剂盒。
1.2.4.4 无机离子
使用电感耦合等离子体质谱仪(inductively coupled plasma-mass spectrometry,ICP-MS)测定牡蛎水提物中的K+、Na+,内标用45 Sc,载气流量1.08 L/min,雾化器气体流量0.15 L/min,等离子体气体流量15.0 L/min,辅助气体流量1.00 L/min,冷却气体流速15 L/min,射频功率1 300 W。称样1.0 g加100 mL超纯水溶解,稀释30倍,样品中离子浓度在ICP-MS检测范围内。参考GB 5009.44—2016《食品安全国家标准 食品中氯化物的测定》测定牡蛎水提取物中Cl-的含量;参考GB 5009.87—2016《食品安全国家标准 食品中磷的测定》测定牡蛎水提取物中![]() 的含量。
的含量。
1.2.4.5 短肽、糖原
0.1 g样品溶于5 mL超纯水,1∶1用10%三氯乙酸(体积分数)溶液沉淀后稀释5倍,使用快速Lowry法蛋白含量测定试剂盒测定牡蛎水提物中的短肽含量,牡蛎水提物中糖原含量参照GB/T 9695.31—2008《肉制品 总糖含量测定》。
1.2.5 等鲜量
等鲜量(equivalent umami concentration,EUC)是指呈味核苷酸[次黄嘌呤核苷酸(inosine monophosphate,IMP);腺嘌呤核苷酸(adenosine monophosphate,AMP)]与鲜味氨基酸(Glu、Asp)共存时对鲜味的协同增效关系,反映相同鲜味强度下所需单一谷氨酸钠的量[16]。按照公式(2)计算:
EUC=∑aibi+1 218(∑aibi)(∑ajbj)
(2)
式中:ai和aj,每个鲜味氨基酸和核苷酸的浓度,μg/g;bi和bj,每个鲜味氨基酸(Asp 0.077,Glu 1)和鲜味5′核苷酸(AMP 0.18,GMP 2.3,IMP 1)的相对浓度(RUC);1218,协同常数。
1.2.6 水提物滋味测定
参考饶梦微等[15]方法利用Insent电子舌系统的预定检测程序进行牡蛎水提物整体滋味的测定,有酸(CAO)、甜(GL1)、苦(COO)、咸(CTO)、鲜(AAE)、涩(AE1)6个传感器。称样0.5 g溶于50 mL水中,过膜备用。每个样品共检测4次,去除第1次测定的结果,以后3次结果为准,利用参比溶液作为对照。
1.2.7 挥发性物质
1.2.7.1 电子鼻测定
利用PEN3电子鼻对牡蛎水提物的气味进行测定,共包含10个金属氧化传感器。准确称取0.5 g样品溶解于5 mL,量取2 mL样品于进样瓶中,置于50 ℃水浴锅中孵育10 min后,用电子鼻探头吸取顶空瓶顶端气体。进样参数:流速300 mL/min,自清120 s,检测时间120 s,取55~60 s为信号采集时间,室温(25±1) ℃,每个样品平行测定3次。
1.2.7.2 GC-IMS测定
量取1.2.7.1节中制备的样品2 mL于顶空进样瓶中,置于孵化器中50 ℃孵育15 min,经1 mL气密加热注射器自动进样500 μL。GC-IMS参数:色谱柱MTX-5(15 m×0.53 mm),柱温60 ℃,进样温度60 ℃,载气为N2(纯度≥99.999%),IMS运行温度45 ℃,流速150 mL/min。以C4~C9正酮类化合物为外标,将算得的各挥发性化合物的保留指数(retention index,RI)和漂移时间与IMS数据库的信息进行对比,对挥发性化合物定性。
1.3 数据分析
使用SPSS Statistics 25软件对数据进行独立样本t检验分析,以“平均值±标准差”表示,t值标记*,表示与鲜牡蛎相比,牡蛎干具有P<0.05水平显著性差异,**具有P<0.01水平极显著差异,***具有P<0.001水平极显著差异;Origin 2021用于主成分分析(principal component analysis,PCA)及绘图。
2 结果与分析
2.1 鲜牡蛎及牡蛎干基本营养成分
以香港牡蛎肉干基成分做比较,由表1可知,牡蛎干肉的基本特征是蛋白质含量高、脂肪含量低。新鲜牡蛎干基中蛋白质含量为63%左右,可溶性糖含量只有20%左右,相比于新鲜牡蛎,干制后的牡蛎中蛋白发生降解,含量降低了约3%,一方面是因为在干制的前处理漂烫单元中有少量含氮浸出物的损失,另一方面是在干制的过程中降解成了氨基酸及小肽片段、酸类、有机酸和胺等[17]。脂肪总含量有少量增加,因为牡蛎经过干制后,由于氧化和水解,游离脂肪酸和饱和脂肪酸含量上升,这对脂质的营养价值有一定影响[18],另外在脂肪测定前的水浴干燥环节,鲜牡蛎的脂肪含量有一定损失。总糖含量没有显著性变化,尽管干制过程伴随着蛋白与脂肪酸的氧化降解,结合的糖分从细胞向汁液中转移,释放了可溶性糖类,但是牡蛎干制时发生的美拉德反应会消耗一定的糖类,所以总糖含量无显著性变化是以上2个方向的反应共同维持的结果;灰分在干制前后无显著性变化。
表1 鲜牡蛎及牡蛎干基本成分含量
Table 1 Basic ingredient contents of fresh oysters and dried oysters
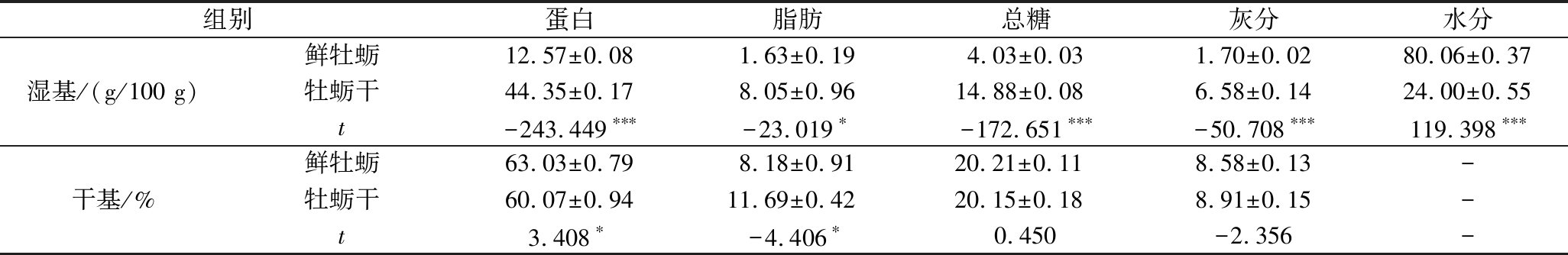
组别蛋白脂肪总糖灰分水分湿基/(g/100 g)鲜牡蛎12.57±0.081.63±0.194.03±0.031.70±0.0280.06±0.37牡蛎干44.35±0.178.05±0.9614.88±0.086.58±0.1424.00±0.55t-243.449∗∗∗-23.019∗-172.651∗∗∗-50.708∗∗∗119.398∗∗∗干基/%鲜牡蛎63.03±0.798.18±0.9120.21±0.11 8.58±0.13-牡蛎干60.07±0.9411.69±0.4220.15±0.188.91±0.15-t3.408∗-4.406∗0.450-2.356-
注:*表示与鲜牡蛎相比,牡蛎干具有P<0.05水平显著性差异,**表示具有P<0.01水平极显著差异,***表示具有P<0.001水平极显著差异,-表示该数据无法进行相同形式的处理或计算,下同。
2.2 表观特征
2.2.1 色泽测定
根据图1可知,在一维的色彩表示方法中:牡蛎干的水提物颜色更有光泽;在三维色彩空间中,除AEFO溶液蓝色更深,AEDO其余色彩(红绿,黑白)均强烈于AEFO溶液。原因可能是在牡蛎干制的前处理即漂烫过程中细胞脱水,损失了水溶性色素,牡蛎内脏中藻类色素蛋白变性也可能导致蓝色色泽大幅消褪[19];此外美拉德反应产生的深色色素也导致了黄色色度的加深。
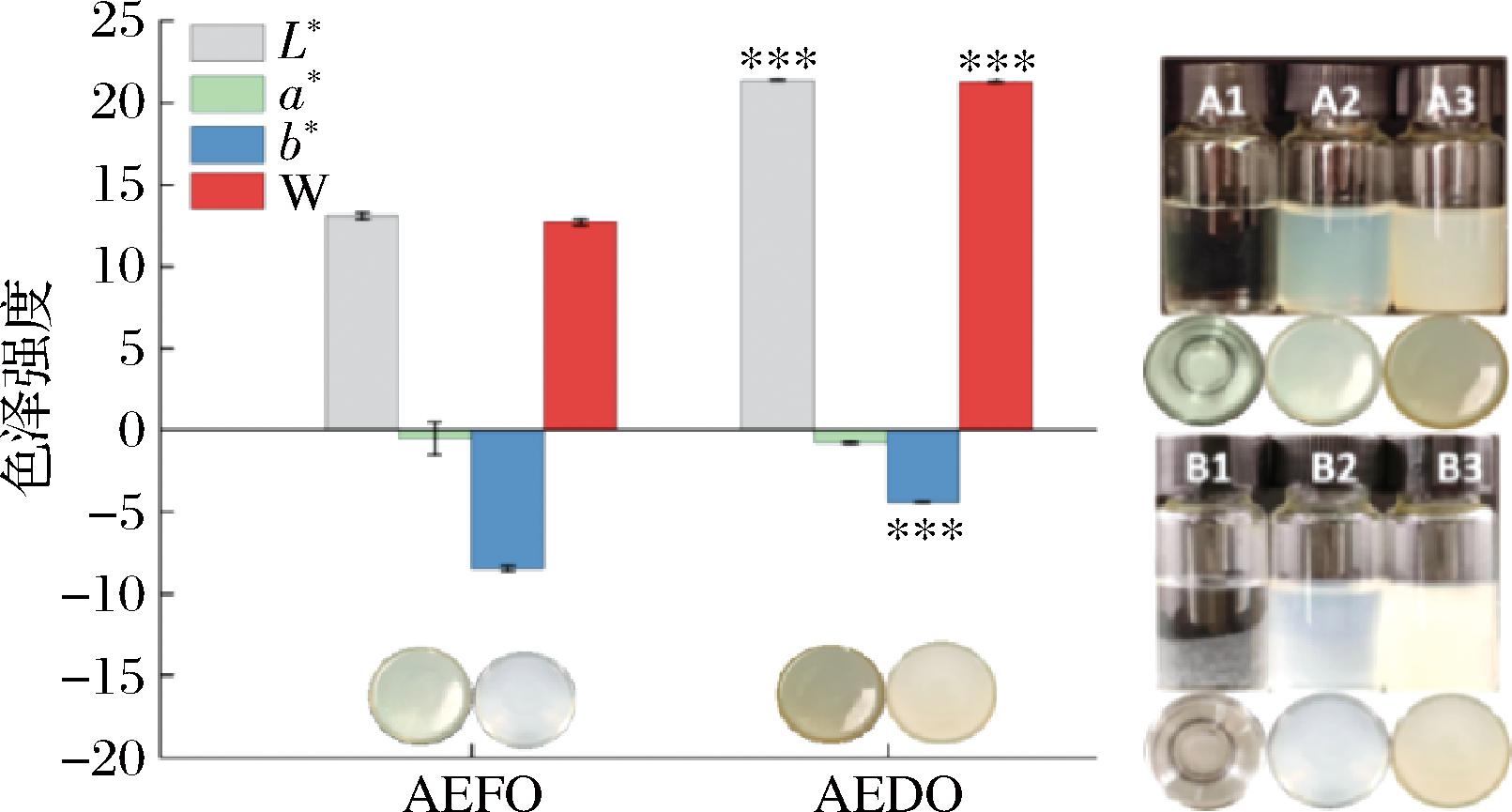
图1 AEFO、AEDO色泽比较图
Fig.1 Comparison of AEFO and AEDO colors
2.2.2 粒径分布及电位
由图2-b可知,AEFO的粒径主要集中分布在90 nm以及900 nm左右,AEDO的粒径分布则主要集中在100 nm左右,干制后的牡蛎水提物粒径分布更为集中;由图2-b可知,AEFO的平均粒径为89.99 nm,电位绝对值为8.89 mV,相比于新AEFO,AEDO的平均粒径显著增大为103.56 nm(P<0.01),电位绝对值也显著增大至14.05 mV(P<0.001),可能是牡蛎在干制过程中的蛋白质变性聚集、卷曲,影响了蛋白颗粒形态,导致水提物粒径有所增大,稳定性也随之增强[20]。

a-粒径分布;b-粒径电位图
图2 AEFO、AEDO粒径分布及粒径电位图
Fig.2 Particle size distribution and particle size potential of AEFO and AEDO
2.2.3 电泳分析、分子质量分布
用分离胶为12%变性聚丙烯酰胺凝胶电泳分离鲜、干牡蛎及其水提物,质量浓度为3 mg/mL,SDS-PAGE电泳如图3-a所示,2种牡蛎水提物在16 kDa以上未出现电泳条带,说明牡蛎水提物的分子质量均<16 kDa,这表明水提物制备时,过滤和离心去除了大多数大分子蛋白质。鲜、干牡蛎做对比,牡蛎干电泳条带明显减少,主要消失的是175、66、52 kDa的分子,88 kDa的条带明显变弱。这表明在牡蛎的干制加工过程中,其肌肉蛋白可能发生了降解;此外,牡蛎干制后蛋白的溶解性变化对本实验结果有一定影响。采用面积归一化法分析牡蛎水提物的分子质量组成。由图3-b所示,将牡蛎水提物的分子质量分为5个区域,从分子质量区间的比例来看,AEDO中小分子质量组分占比更大:>5 kDa的蛋白含量降低了4.26%,其余区间含量都分别上升0.57%、1.25%、0.68%、1.76%,3 kDa以下的区间共增长2.44%。与上述电泳图中的结果一致,表明牡蛎的干制过程可能产生了更多的小分子肽[17],相比之下,小分子蛋白质具有改善风味、易于吸收和增加功能活性等优点。
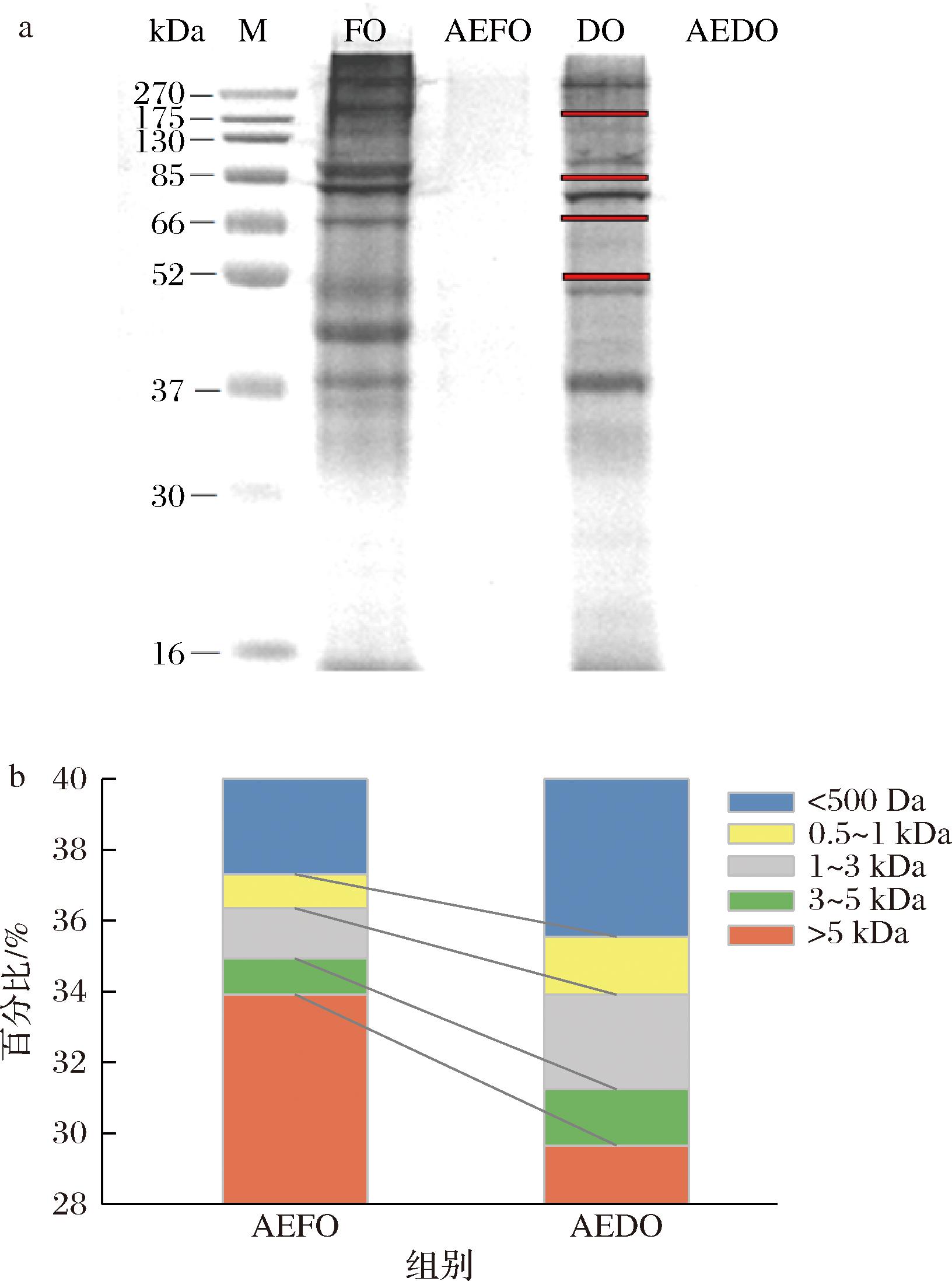
a-电泳图;b-分子质量分布堆叠图
图3 鲜牡蛎、牡蛎干及AEFO、AEDO电泳图、分子质量分布堆叠图
Fig.3 Fresh and dried oysters, AEFO, AEDO electropherogram, molecular weight distribution stacking
2.3 滋味物质分析
各呈味成分含量与该成分呈味阈值之比用TAV表示,可以反映出单一的化合物对食品整体的味觉特征贡献[6]。参考YANG等[21]的方法,计算牡蛎水提物中呈味物质的TAV。
2.3.1 游离氨基酸
由表2可知,AEFO和AEDO中鲜、甜味氨基酸分别占总游离氨基酸的73.46%、77.36%,说明牡蛎中含有丰富的呈味氨基酸,且干制后的牡蛎水提物中,与鲜、甜味有关的氨基酸含量增加了16.46 mg/g,相对含量约占总氨基酸的4%,其中只有天冬氨酸含量降低,表明干制工艺有助于鲜、甜味氨基酸的产生;其中谷氨酸为牡蛎的鲜味做出了重要贡献,尤其是牡蛎干制以后其滋味贡献值高达56.79,占鲜味氨基酸的78.93%;甘氨酸在甜味氨基酸中占比最大,AEFO中,滋味贡献值为12.37,丙氨酸次之,贡献值之差仅为4.00,牡蛎干制以后丙氨酸的TAV高达27.43,约为甘氨酸的2倍,说明丙氨酸是干制牡蛎中的重要甜味氨基酸;此外,所有甜味氨基酸在干制过程中呈现整体上升趋势,丙氨酸尤为明显,增长6.58 mg/g。苦味氨基酸整体含量略有增加,主要是组氨酸、精氨酸、赖氨酸,其中组氨酸、精氨酸滋味贡献最大,赖氨酸含量增加最多为0.90 mg/g,也有研究提出,赖氨酸可能是无味氨基酸,在美拉德反应中与氨基酸反应产生暗物质,对样品颜色产生额外影响[6]。蛋氨酸、苯丙氨酸、亮氨酸、异亮氨酸、色氨酸,赖氨酸等其他苦味氨基酸的含量均降低,加之由于甜味氨基酸的掩蔽效应,苦味氨基酸可能不表现出味觉活动。WEN等[22]研究了蘑菇在干燥过程中游离氨基酸的变化及形成机理,研究也表明干燥可以促进蘑菇中游离氨基酸的产生以及氨基酸与糖之间的美拉德反应,与以上热风干燥有利于产生鲜、甜味氨基酸的研究结果一致。
表2 AEFO、AEDO游离氨基酸含量及TAV
Table 2 Free amino acid content and TAV of AEFO and AEDO

氨基酸种类阈值/(mg/g)含量/(mg/g)TAVAEFOAEDOtAEFOAEDOt天冬氨酸Asp1.004.69±0.014.56±0.01-14.111∗∗∗4.69±0.014.56±0.01-15.922∗∗∗谷氨酸Glu0.3014.42±0.1217.04±0.0038.661∗∗∗48.07±0.3956.79±0.0139.101∗∗∗鲜味氨基酸/总计-19.11±0.1321.59±0.0134.015∗∗∗---丝氨酸Ser1.501.36±0.002.25±0.00126.768∗∗∗0.90±0.001.50±0.0089.000∗∗∗甘氨酸Gly1.3016.08±0.0519.32±0.0670.494∗∗∗12.37±0.0414.86±0.0474.800∗∗∗苏氨酸Thr2.601.95±0.023.16±0.00115.024∗∗∗0.75±0.011.22±0.0081.406∗∗∗丙氨酸Ala0.609.88±0.0416.46±2.454.649∗16.47±0.0627.43±4.084.649∗脯氨酸Pro3.004.46±0.305.59±0.264.988∗∗1.49±0.101.86±0.094.926∗∗甜味氨基酸/总计-33.72±0.3746.78±2.658.483∗∗---组氨酸His0.201.82±0.011.93±0.0123.393∗∗∗9.11±0.039.65±0.0316.000∗∗∗精氨酸Arg0.504.13±0.025.11±0.0096.267∗∗∗8.27±0.0310.21±0.0192.655∗∗∗酪氨酸Tyr0.911.03±0.011.01±0.00-3.024∗1.13±0.011.11±0.00-2.500缬氨酸Val0.400.90±0.011.01±0.0030.619∗∗∗2.24±0.012.52±0.0143.000∗∗∗蛋氨酸Met0.300.86±0.000.66±0.34-17.673∗∗∗2.85±0.012.19±1.13-18.146∗∗∗苯丙氨酸Phe0.900.80±0.000.70±0.00-84.216∗∗∗0.89±0.000.78±0.0013.749∗∗∗异亮氨酸Ile0.900.47±0.000.27±0.15-0.2660.52±0.010.30±0.17-0.273赖氨酸Lys0.501.33±0.012.23±0.0439.727∗∗∗2.67±0.024.45±0.0841.065∗∗∗亮氨酸Leu1.901.05±0.000.89±0.07-3.835∗0.55±0.000.47±0.04-3.571∗色氨酸 Trp0.900.25±0.000.14±0.0010.246∗∗∗0.28±0.000.15±0.0011.492∗∗∗苦味氨基酸/总计-12.38±0.0313.79±0.5427.339∗∗∗---半胱氨酸Cys浓厚肽2.57±0.022.83±0.0012.358∗∗∗---游离氨基酸-71.92±0.4688.38±1.738.416∗∗---
注:TAV>1,该化合物对滋味有贡献;各氨基酸阈值参考文献[23]。
表3 AEFO、AEDO中无机离子含量及其TAV
Table 3 Inorganic ion contents and TAV of AEFO and AEDO
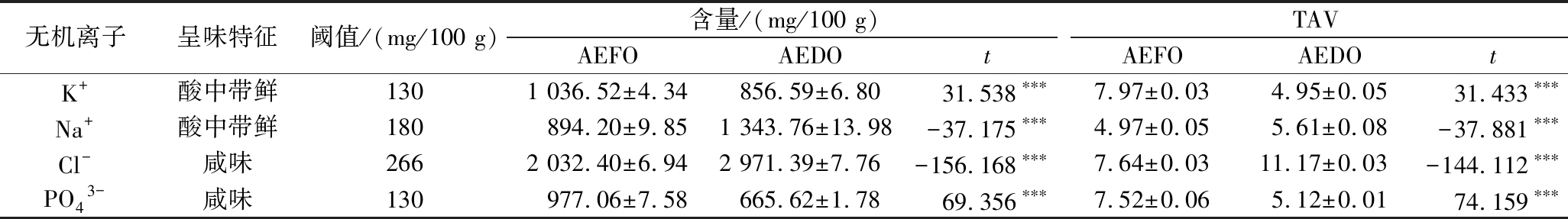
无机离子呈味特征阈值/(mg/100 g)含量/(mg/100 g)TAVAEFOAEDOtAEFOAEDOtK+酸中带鲜1301 036.52±4.34856.59±6.8031.538∗∗∗7.97±0.034.95±0.05 31.433∗∗∗Na+酸中带鲜180894.20±9.851 343.76±13.98-37.175∗∗∗4.97±0.055.61±0.08-37.881∗∗∗Cl-咸味2662 032.40±6.942 971.39±7.76-156.168∗∗∗7.64±0.0311.17±0.03-144.112∗∗∗PO43-咸味130977.06±7.58665.62±1.7869.356∗∗∗7.52±0.065.12±0.0174.159∗∗∗
2.3.2 呈味核苷酸
呈味核苷酸5′-IMP、5′-AMP是水产品重要的呈鲜组分,在与呈味氨基酸结合时,还可以协同增强食品的鲜味强度[24]。由图4可知,牡蛎干制后核苷酸总含量显著增加(P<0.001),5′-IMP、5′-AMP阈值分别为0.25、0.5 mg/g[22],在2种牡蛎水提物中均检测到这2种核苷酸,且牡蛎干制后5′-IMP的含量显著升高,滋味活性值成倍增长,高达24.6;5′-AMP则有所降低,可能在干燥过程中转化为5′-IMP,值得注意的是牡蛎干中5′-AMP的前体物质ADP含量有显著增加,ATP则彻底消失,这可能与干制过程中贝类的ATP降解途径有关(ATP→ADP→AMP→IMP→HxR→Hx→Xt)[25]。核苷酸总含量及滋味活性值显著升高,表明干制加工能使牡蛎具有显著的呈鲜效果。
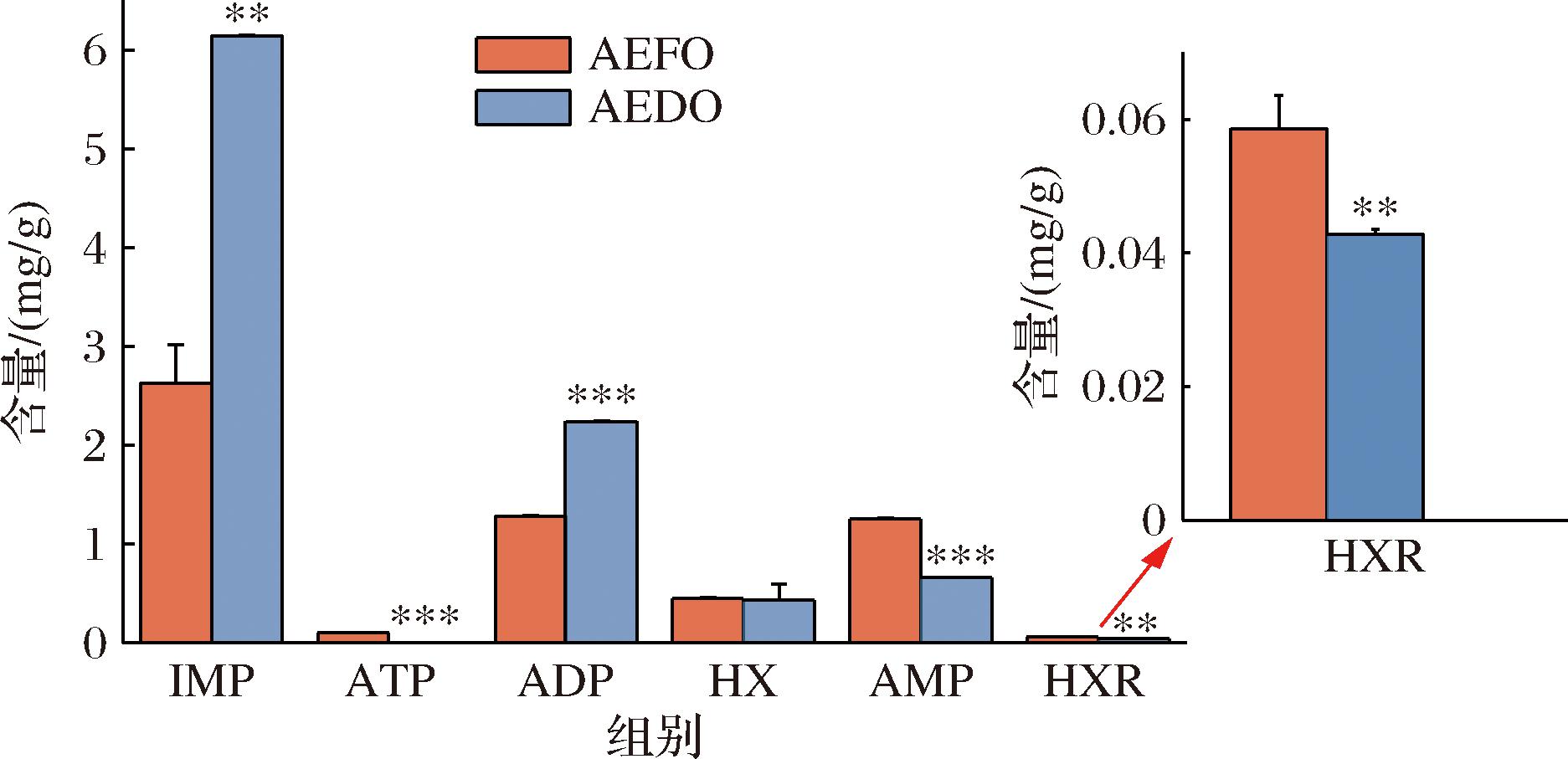
图4 AEFO、AEDO呈味核苷酸分析图
Fig.4 Taste nucleotide analysis of AEFO and AEDO
2.3.3 有机酸和甜菜碱
有机酸能使食品具有酸味,强度与酸的种类、含量以及组成有关,有机酸对鲜味有增强作用,由糖原和氨基酸降解生成[6]。如图5-a所示,牡蛎中以乳酸和苹果酸为主,乳酸含量远高于其他酸,可能与牡蛎生长的季节性以及生活状况有关,这与LIU等[11]的研究中与乳酸和苹果酸是牡蛎蒸煮样品中主要有机酸的结论一致。干制后的牡蛎中苹果酸(P<0.001)、乳酸(P<0.05)均有显著性降低,柠檬酸(P<0.001)和琥珀酸(P<0.05)均有显著性升高,但由图5-b可知,牡蛎水提物的总酸含量没有显著性变化。
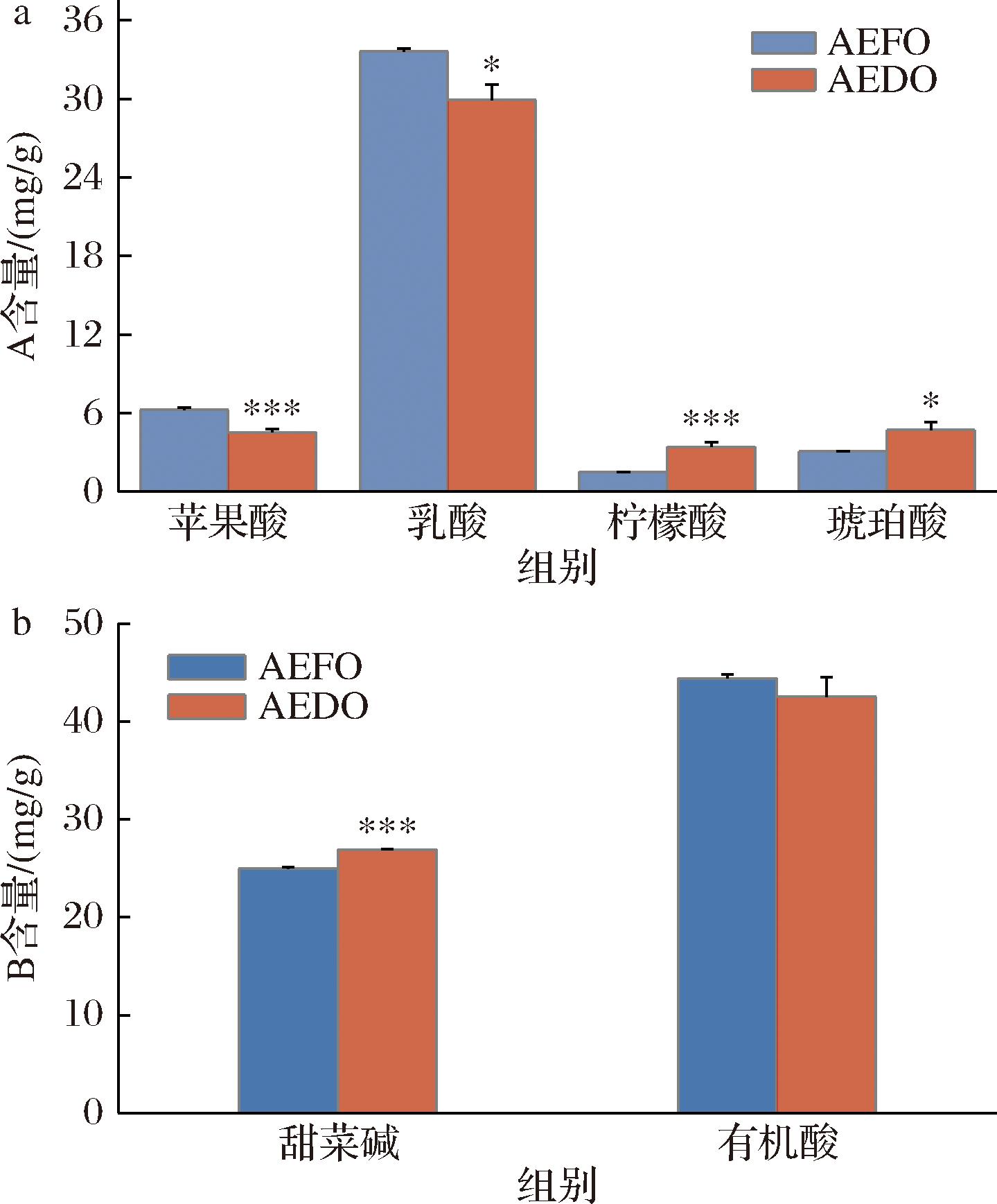
a-有机酸含量;b-有机酸与甜菜碱对比
图5 AEFO、AEDO有机酸含量、有机酸与甜菜碱对比
Fig.5 Organic acid content of AEFO and AEDO, comparison of organic acids and betaine
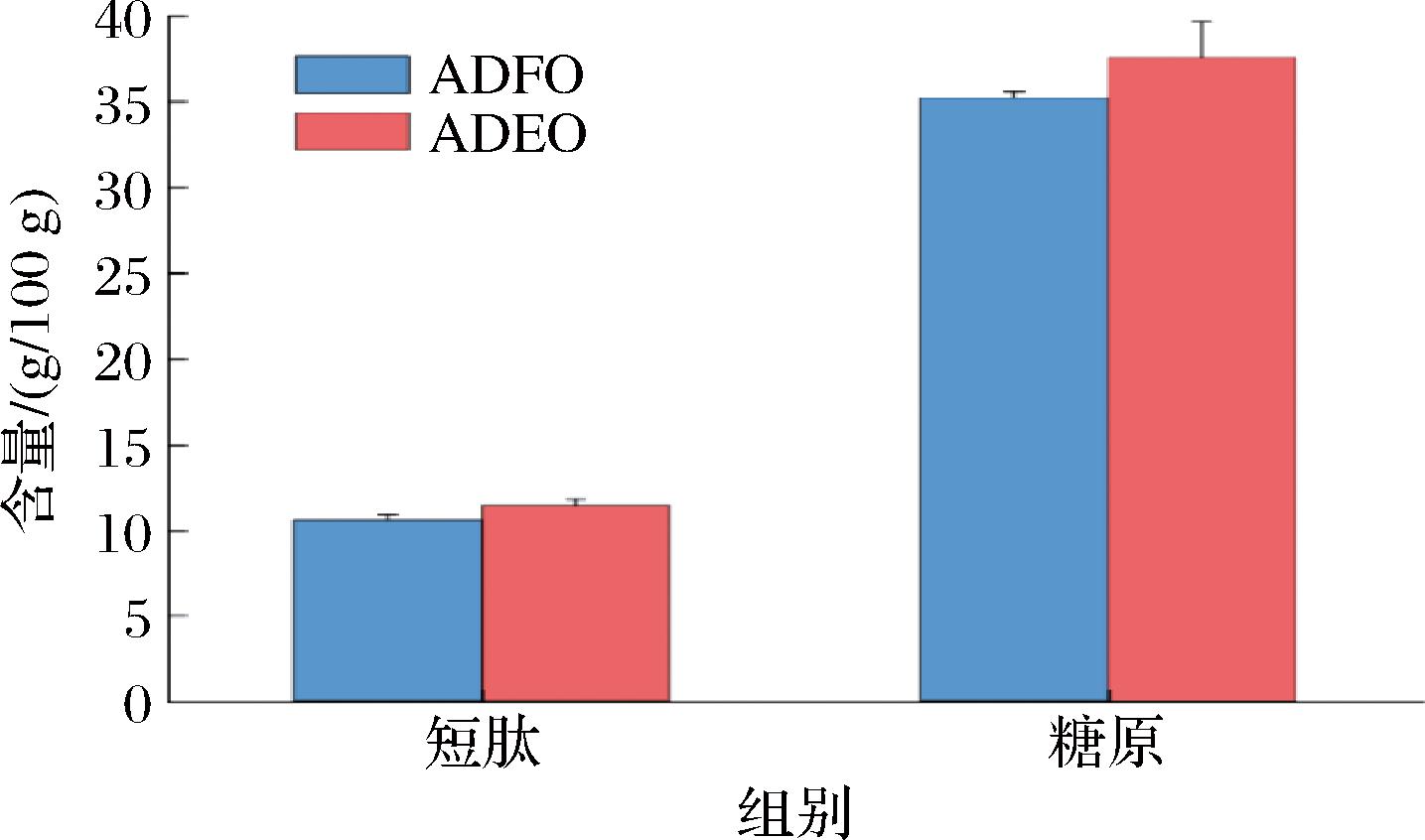
图6 AEFO、AEDO短肽、糖原含量对比图
Fig.6 Comparison of AEFO, AEDO short peptides and glycogen contents
甜菜碱是碱性生物化合物,赋予海鲜特殊的甜味,并有助于海鲜风味[7]。干制后的牡蛎水提物中,甜菜碱含量增加了1.81 mg/g,可能是由于烘烤和干燥过程中蛋白质和脂质代谢引起了甜菜碱的显著增长(P<0.001)[26]。
2.3.4 无机离子
无机离子是海产品中必需的辅助风味成分,![]() 和Cl-可显著促进它们的风味[10],当Na+以及5′-核苷酸和鲜味氨基酸共存时,整体鲜味非常突出;
和Cl-可显著促进它们的风味[10],当Na+以及5′-核苷酸和鲜味氨基酸共存时,整体鲜味非常突出;![]() 的存在可以减少苦味,增强酸味和鲜味。Cl-的增加可以抑制酸味并增强鲜味和甜度[9]。AEFO的4种离子中Cl-含量最高,K+次之,但他们的滋味活性值相当,Na+的滋味贡献最小,其中K+含量远高于LIU等[10]关于牡蛎的研究中的含量,这些差异可归因于物种类型、生长阶段以及生存环境等因素;AEDO中依然是Cl-含量最高且与AEFO相比增长了约900 mg/100 g,对应滋味贡献值显著性增大(P<0.001),Na+次之且含量上升约450 mg/100
的存在可以减少苦味,增强酸味和鲜味。Cl-的增加可以抑制酸味并增强鲜味和甜度[9]。AEFO的4种离子中Cl-含量最高,K+次之,但他们的滋味活性值相当,Na+的滋味贡献最小,其中K+含量远高于LIU等[10]关于牡蛎的研究中的含量,这些差异可归因于物种类型、生长阶段以及生存环境等因素;AEDO中依然是Cl-含量最高且与AEFO相比增长了约900 mg/100 g,对应滋味贡献值显著性增大(P<0.001),Na+次之且含量上升约450 mg/100 ![]() 含量显著性降低(P<0.05)。根据无机离子的变化,可以得出结论:干制能使牡蛎的鲜、咸味变强,但离子的形成机制尚不清楚。
含量显著性降低(P<0.05)。根据无机离子的变化,可以得出结论:干制能使牡蛎的鲜、咸味变强,但离子的形成机制尚不清楚。
2.3.5 短肽及糖原
糖原已被证明是大多数贝类中的重要增味成分,LIU等[27]对太平洋鲍鱼的研究显示:高糖原含量太平洋鲍鱼的鲜味和甜味得分明显更高,风味更好。与新鲜牡蛎相比,AEDO中糖原含量高出0.89 g/100 g,而葡萄糖味觉阈值为0.86 g/100 g[16],说明AEDO中增长的糖原具有显著的味觉潜力。此外,干燥过程中的糖降解和美拉德反应也会影响糖原含量。
干制后的牡蛎水提物中,其短肽含量增加了约2.4 g/100 g,可能是因为在干制过程中蛋白质的降解以及美拉德反应等化学变化过程产生了更多与呈味有关的小分子肽类。这些小分子肽也被发现在鲜味感知中起重要作用,包括鲜味肽和增强肽,有些本身是无味的,但可以增强鲜味[28],美拉德反应也可以产生大豆肽、鸡肽、向日葵肽等美拉德肽[29-30],提供特有的味道特征,所以AEDO中的小分子肽具有一定味觉潜力,但其种类和阈值尚不明确,干制牡蛎的鲜味肽和滋味增强肽有待研究。
2.3.6 鲜味物质分析
EUC(味精g/100 g)指数广泛用于分析食物的鲜味潜力[16],由表4可知,AEFO的EUC为52.27 g/100 g,相比之下,干制后的牡蛎水提物EUC值显著性增加(P<0.001),约为AEFO的2倍,主要是谷氨酸和5′-IMP做出了重要贡献。本研究中鲜牡蛎水提物得率约为6%,而其EUC为52.27 g/100 g,换算后鲜牡蛎的EUC约为3.13 g/100 g,这与LIU等[10]关于高静水压处理和温度对鲜牡蛎滋味物质的影响的研究中,鲜牡蛎的EUC结果相近。相比之下,牡蛎干水提物的得率约为30%,换算后牡蛎干中EUC约为33 g/100 g,高于一般河流牡蛎内脏和内收肌(0.8 g/100 g、26.9 g/100 g)的EUC范围[31],进一步表明干燥加工能增加牡蛎的鲜味强度,提升牡蛎的风味品质。
表4 AEFO、AEDO鲜味氨基酸、核苷酸的含量及其等鲜量
Table 4 Contents of AEFO, AEDO umami amino acids, nucleotides and their EUC

成分阈值/(mg/g)含量/(mg/g)TAVAEFOAEDOtAEFOAEDOtAsp1.004.69±0.014.56±0.01-14.111∗∗∗4.69±0.014.56±0.01-15.922∗∗∗Glu0.3014.42±0.1217.04±0.0038.661∗∗∗48.07±0.3956.79±0.0139.101∗∗∗5′-IMP0.252.63±0.386.15±0.01-15.885∗∗10.52±1.5324.59±0.03-15.875∗∗5‴-AMP0.501.25±0.010.66±0.01103.259∗∗∗2.50±0.021.32±0.0197.228∗∗∗EUC-52.27±0.59112.92±0.89-90.197∗∗∗---
2.3.7 电子舌滋味测定
多通道生物传感器膜的电子舌分析提高了味觉特征分析的客观视角。对电子舌所得滋味值进行分析,各轴各自调整刻度。由图7可知,AEFO中鲜回味、苦回味、酸味均低于无味点,鲜味、涩味和苦味是其关键滋味特征。干制后的牡蛎水提物中酸味依然低于无味点,鲜味值未发生变化,涩味减弱,回味(鲜、苦、涩)、咸味显著增强,可能是由干制过程中的美拉德反应产物的盐度增强效应[32]及暗色物质的特征味增强的。
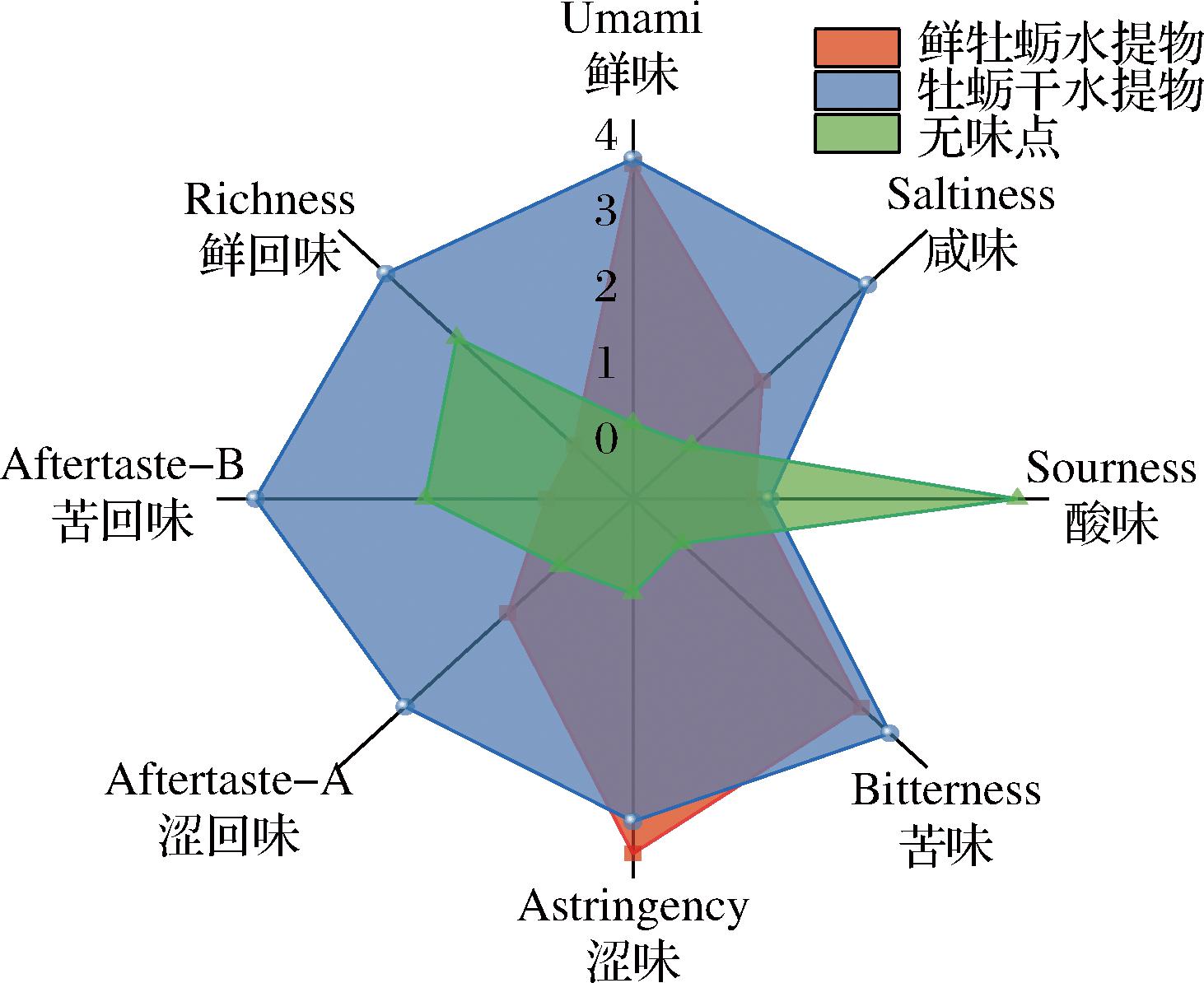
图7 AEFO、AEDO滋味比较图
Fig.7 Comparison of AEFO and AEDO tastes
2.4 挥发性物质测定
2.4.1 电子鼻气味分析
对电子鼻数据进行PCA,由图8-a可知,PC1贡献率为81.3%,PC2贡献率为13.0%,累计贡献率为94.3%,涵盖了绝大部分生物样本信息,能够准确反映原始样本的总体香气的差异;2组样品分布于2个不同的象限内,表明鲜牡蛎与AEDO的挥发性成分具有显著性差异,这与ZHU等[5]关于河豚鱼片不同干制方式的研究中,热风干制可以产生更多的挥发性物质的结果一致。
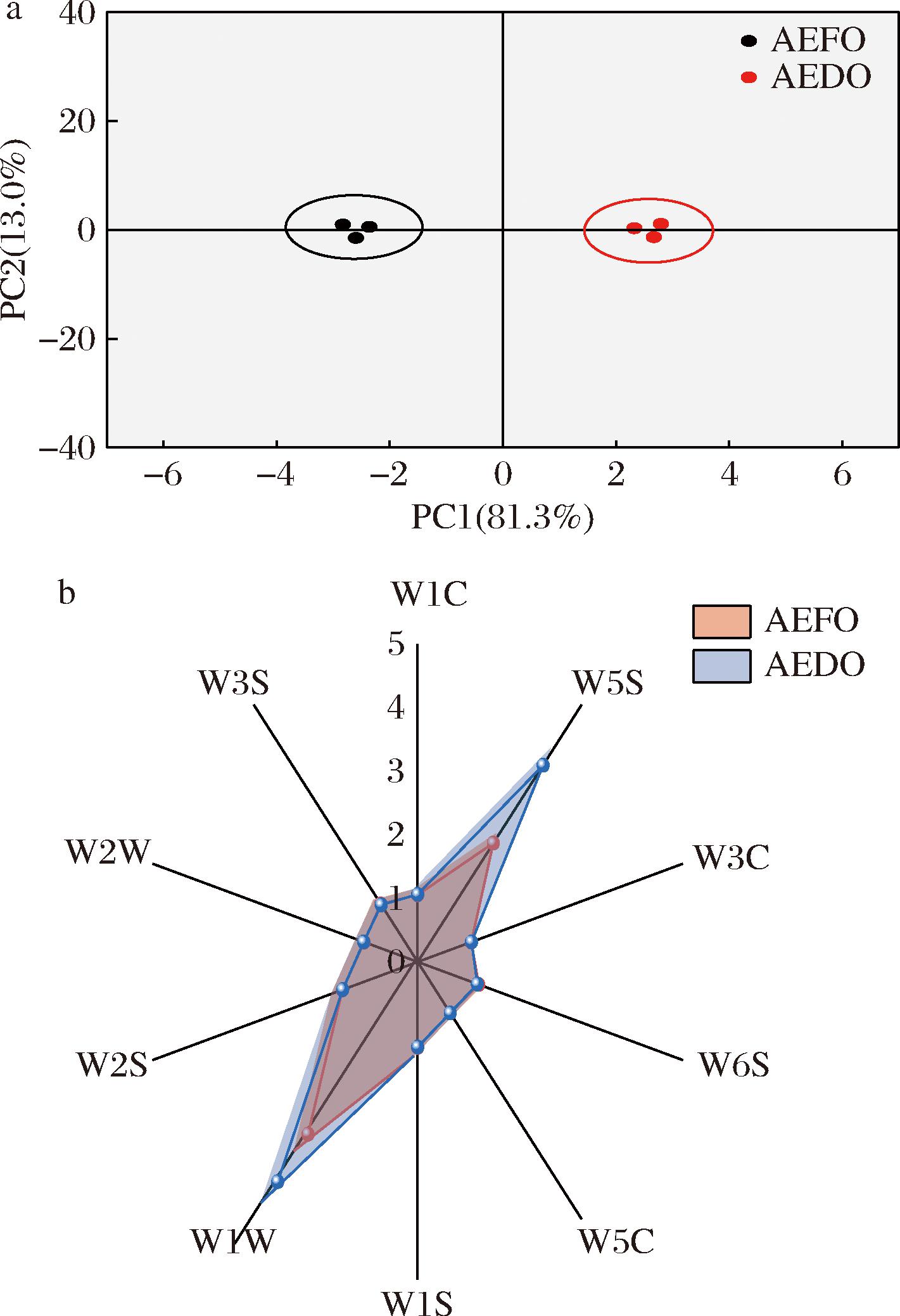
a-PCA图;b-雷达图
图8 AEFO、AEDO气味检测PCA及雷达图
Fig.8 PCA diagram and radar diagram of AEFO and AEDO odor detection
由8-b可知,2种牡蛎水提物的雷达图轮廓相似,在传感器W1W的响应值最高,其次是传感器W5S;说明牡蛎水提物中硫化物和氮氧化合物是主要的挥发性物质,这与此前研究结果一致[4];此外AEDO中的硫化物和氮氧化合物都明显高于AEFO,其中硫化物是与牡蛎相关的特征性挥发物质,可能对风味有负面影响[33],故利用GC-IMS对牡蛎水提物的挥发性物质进一步明确。
2.4.2 GC-IMS分析
2.4.2.1 GC-IMS谱图分析
采用GC-IMS的差异对比模式对样品中的挥发性物质进行了比较,以AEFO的图谱为参照,AEDO的图谱扣除参照,红色表示含量高于对比,蓝色表示低于对比;由图9可知,AEDO的气味物质特征峰的数量和特征峰信号显著增加,这表明干制加工增加了牡蛎中挥发性物质的种类与浓度,提升了感官属性的丰富度[4],以上结果与电子鼻的测定结果一致。
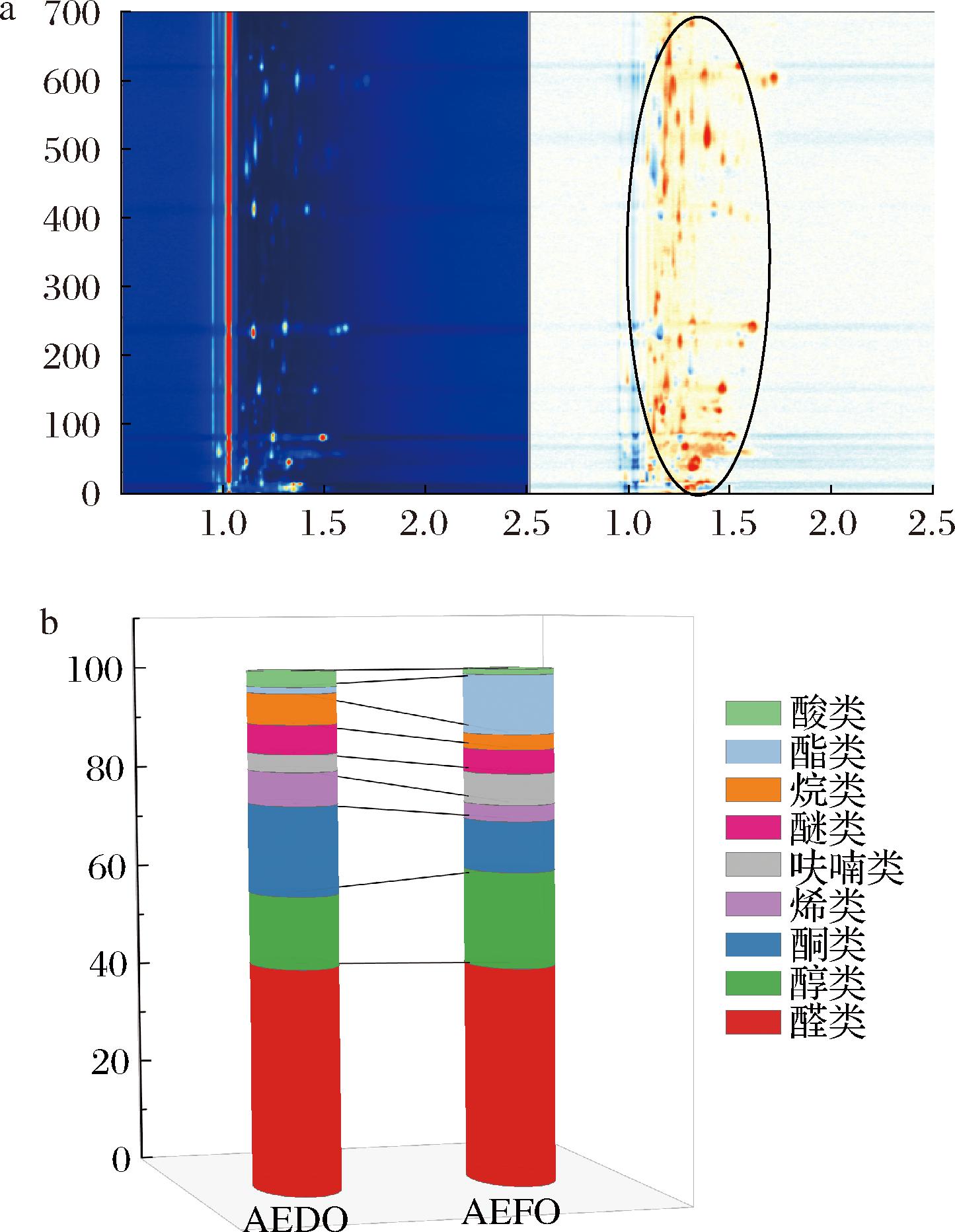
a-GC-IMS(二维)谱图;b-挥发性物质相对含量
图9 AEFO、AEDO挥发性物质的GC-IMS(二维)谱图及挥发性物质相对含量
Fig.9 GC-IMS (two-dimensional) spectra of AEFO and AEDO volatile substances and relative content of volatile substances

图10 AEFO、AEDO挥发性物质的指纹谱图
Fig.10 Fingerprints of AEFO and AEDO volatile substances
2.4.2.2 挥发性物质的定性定量分析
以正酮C4~C9为外标,通过测定各挥发性物质的RI并与仪器的IMS数据库和NIST数据库对比匹配,结合保留时间及迁移时间对挥发性物质进行定性分析。为了进一步探究干制加工对牡蛎挥发性风味的影响,采用面积归一化法对图谱中各挥发性物质进行半定量分析,得到牡蛎水提物中各挥发性化合物的相对含量详见增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.039653)。如图9-b所示,从2种牡蛎水提物中共鉴别出43种单体或二聚体挥发性物质,其中醛类19种、醇类7种、酮类6种、烯类2种、呋喃类2种、醚类2种、烷类2种、酯类2种、酸类1种。AEFO、AEDO挥发性物质相对含量及光谱参数详情见附件1。
由图9-b可知,醛类、醇类、酮类是牡蛎水提物的主要挥发性物质,其中醛类含量最多,为42.42%~43.55%,醛类主要由脂质降解产生且阈值较低,呈现出强烈的青草香、脂香、果香[4]。与AEFO相比,AEDO中的醛类、酮类含量均有显著增加,而醇类物质则一般由醛类、酮类物质的还原及脂质的氧化产生,阈值通常较高,如1-辛烯-3-醇等不饱和醇[34]就是常见水产品的腥味来源,但在牡蛎水提物中未检测到,所以醇类对牡蛎水提物的气味影响不大;酮类是不稳定的中间化合物,一般由氨基酸降解和不饱和脂肪酸的热氧化过程产生,后续则被氧化或还原成相应的醇,可以提供独特的果香味[34]。相比于AEFO,AEDO物中酮类物质相对含量显著性(P<0.001)增加了7%,是AEDO特征气味的重要组成部分,说明干制对牡蛎风味的提升有积极作用。
2.4.2.3 指纹图谱分析
为了进一步区分牡蛎水提物的香气特征,构建了2个样品的指纹图谱,图中每行为1个样品,1个样品重复3次,每列为1种挥发性物质,颜色越红,代表该挥发性物质含量越高;指纹图谱可分为A、B、C、D这4个区域。
A区域是AEDO、AEFO中共有的香气特征物质,包括四氢呋喃、2-乙基己醇、甲酸-3-甲基丁酯、3-庚醇、1-丙醇、2-戊酮、庚醛、4-壬酮、顺式-4-庚烯醛,其中庚醛具有腥味的气味特征[33]。B区为AEFO特有的挥发性物质,包括3-呋喃甲醇、2-羟基苯甲醛,还有赋予AEFO辛辣味的1-戊醇,有煮熟的肉味戊醛、戊醛,以及有青草香、脂肪香的顺式-4-庚烯醛等风味特征物质[4]。C区是干制牡蛎水提物中含量显著增加的挥发性物质,以阈值较低的醛、酮类物质为主,包括二丙基二硫醚、3-甲基丁醛、正己醇、甲基-5-庚烯-2-酮、2-甲基丁醛、1,2-丙二醇、3-甲基丁醛、叔丁基甲醚等,还有具有腥味、青草味的反式-2-戊烯醛,腥味、生油脂和青草气的己醛,腥味的庚醛以及有刺激性气味的2-丁酮,有杏仁香、樱桃及坚果香的苯甲醛等。D区中具有清香、脂肪香的2-己烯醛[33]是AEDO中所特有的,综上,鲜牡蛎水提物的特征气味是腥味、青草味、脂肪香;牡蛎干水提物的特征气味是腥味、清香、脂肪香、杏仁香、樱桃及坚果香。
3 结果与分析
本研究对鲜牡蛎及热风干制牡蛎的水提物的表观特征、各滋味成分呈味特性和含量变化进行了详细对比分析,并通过半定量分析法对鲜牡蛎及热风干制牡蛎的气味成分进行解析。结果显示:牡蛎经热风干制以后,水提物色度加深,电位更稳定,粒径增大且分布更为集中,<5 kDa的分子质量比例增加4.26%,说明热风干制有利于丰富牡蛎的滋味,增强人们对牡蛎中营养物质的吸收;牡蛎经过热风干制后,鲜甜味氨基酸、呈味核苷酸、甜菜碱等滋味物质的含量显著增加,牡蛎干水提物整体的鲜回味、咸味显著增强,表明热风干制有利于牡蛎滋味物质的产生,此外,牡蛎干中的糖原和短肽具有很大的的味觉潜力;热风干制还有利于丰富牡蛎的气味,热风干制后的牡蛎中酮类物质相对含量增加7%,为牡蛎干提供了独特的果香味;鲜牡蛎水提物的特征气味是腥味、青草味、脂肪香;牡蛎干水提物的特征气味是腥味、清香、脂肪香、杏仁香、樱桃及坚果香。
[1] 章超桦. 牡蛎营养特性及功能活性研究进展[J].大连海洋大学学报, 2022, 37(5):719-731.
ZHANG C H.Research progress on nutritional characteristics and bioactivities of oysters:A review[J].Journal of Dalian Ocean University, 2022, 37(5):719-731.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编制.中国渔业统计年鉴—2023[M].北京:中国农业出版社, 2023.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries, et al. Fishery Statistical Yearbook of China[M]. Beijing: China Agriculture Press, 2023.
[3] 陈晓婷, 吴靖娜, 刘淑集, 等.一种即食牡蛎加工工艺[J].广东海洋大学学报, 2020, 40(2):117-122.
CHEN X T, WU J N, LIU S J, et al.Study on the processing technology of a kind of instant oyster[J].Journal of Guangdong Ocean University, 2020, 40(2):117-122.
[4] 王治军, 杨要芳, 李汉琪, 等.不同干制工艺对牡蛎干特征气味的影响[J].食品与发酵工业, 2024, 50(15):289-298.
WANG Z J, YANG Y F, LI H Q, et al.Effect of different drying processes on characteristic odor of dried oysters[J].Food and Fermentation Industries, 2024, 50(15):289-298.
[5] ZHU Y, CHEN X T, PAN N, et al.The effects of five different drying methods on the quality of semi-dried Takifugu obscurus fillets[J].LWT, 2022, 161:113340.
[6] WANG Y L, GUI X R, JIA M Y, et al.Effect of different drying methods on the quality characteristics and non-volatile taste compounds of Hypsizygus marmoreus Pileus and stipe[J].LWT, 2024, 192:115685.
[7] CHEN Z Q, ZHU Y H, CAO W H, et al.Novel insight into the role of processing stages in nutritional components changes and characteristic flavors formation of noble scallop Chlamys nobilis adductors[J].Food Chemistry, 2022, 378:132049.
[8] 孟维博, 刘燕, 伍国杰, 等.不同干燥方法对牡蛎干品质及气味的影响[J].食品科技, 2015, 40(6):174-179.
MENG W B, LIU Y, WU G J, et al.Effect of different drying methods on quality and odour of dried oysters[J].Food Science and Technology, 2015, 40(6):174-179.
[9] 孙鹤, 史梦佳, 谢洪轩, 等.不同干燥方式对牡蛎非挥发性呈味物质的影响[J].食品科技, 2022, 47(5):173-181.
SUN H, SHI M J, XIE H X, et al.Effects of different drying methods on nonvolatile flavor components in oyster[J].Food Science and Technology, 2022, 47(5):173-181.
[10] LIU C S, GU Z F, LIN X X, et al.Effects of high hydrostatic pressure (HHP) and storage temperature on bacterial counts, color change, fatty acids and non-volatile taste active compounds of oysters (Crassostrea ariakensis)[J].Food Chemistry, 2022, 372:131247.
[11] LIU C S, JI W Z, JIANG H Z, et al.Comparison of biochemical composition and non-volatile taste active compounds in raw, high hydrostatic pressure-treated and steamed oysters Crassostrea hongkongensis[J].Food Chemistry, 2021, 344:128632.
[12] 阮仕艳. 罗非鱼下颌水提鲜味肽的呈味特性及其作用机制研究[D].昆明:昆明理工大学, 2021.
RUAN S Y.Study on flavor characteristics and mechanism of umami peptides extracted from jaw water from tilapia[D].Kunming:Kunming University of Science and Technology, 2021.
[13] 王春雨. 淀粉与水分互作对挤压食品色泽调控与品质评价[D].天津:天津科技大学, 2024.
WANG C Y.Interaction between starch and moisture on color regulation and quality evaluation of extruded food[D].Tianjin:Tianjin University of Science and Technology, 2024.
[14] 王亮. 基于摩擦学的流体食品部分口感属性评价方法研究[D].无锡:江南大学, 2023.
WANG L.Research on evaluation method of taste properties of fluid food based on tribology[D].Wuxi:Jiangnan University, 2023.
[15] 饶梦微, 章超桦, 林海生, 等.菲律宾蛤仔肉不同提取物呈味特性[J].广东海洋大学学报, 2022, 42(1):90-97.
RAO M W, ZHANG C H, LIN H S, et al.Sensory characteristic of different extracts from Ruditapes philippinarum[J].Journal of Guangdong Ocean University, 2022, 42(1):90-97.
[16] DUPPETI H, MANJABHATTA S N, MARTIN A, et al.Effects of different processing methods on the biochemical composition, color and non-volatile taste active compounds of whiteleg shrimp (Litopenaeus vannamei)[J].Food Chemistry Advances, 2022, 1:100118.
[17] 陆应林. 南京板鸭加工过程中蛋白降解及风味物质的研究[D].南京:南京农业大学,2013.
LU Y L.Study on protein degradation and flavor compounds in the processing process of Nanjing plate duck[D].Nanjing:Nanjing Agricultural University, 2013.
[18] 刘雁飞. 大连湾牡蛎热风干制过程中脂质的变化与控制[D].大连:大连工业大学, 2020.
LIU Y F.Change and its control of lipids in oyster (Crassostrea talienwhanensis) during hot air drying process[D].Dalian:Dalian Polytechnic University, 2020.
[19] 朱林清, 曾名湧.聚球藻PCC7002藻蓝蛋白提取纯化及热致褪色机理研究[J].食品工业科技, 2022, 43(16):32-40.
ZHU L Q, ZENG M Y.Extraction and purification and heat-induced fading mechanism of Synechococcus sp.PCC7002 phycocyanin[J].Science and Technology of Food Industry, 2022, 43(16):32-40.
[20] 庞志花, 孙梦雅, 李博睿, 等.乳清分离蛋白-壳聚糖复合颗粒的构建及其微观结构表征[J].食品科学技术学报, 2023, 41(1):99-105.
PANG Z H, SUN M Y, LI B R, et al.Construction and microstructural characterization of whey protein isolate-chitosan composite particles[J].Journal of Food Science and Technology, 2023, 41(1):99-105.
[21] YANG F, FU A Z, MENG H Y, et al.Non-volatile taste active compounds and umami evaluation of Agrocybe aegerita hydrolysates derived using different enzymes[J].Food Bioscience, 2024, 58:103772.
[22] WEN X M, LI W, LI W, et al.Quality characteristics and non-volatile taste formation mechanism of Lentinula edodes during hot air drying[J].Food Chemistry, 2022, 393:133378.
[23] 俞铮, 葛小通, 张佳汇, 等.食品中鲜味的来源及其评价方法[J].食品科学, 2022, 43(19):338-347.
YU Z, GE X T, ZHANG J H, et al.Sources and evaluation methods of umami taste in foods[J].Food Science, 2022, 43(19):338-347.
[24] DOS SANTOS HARADA-PADERMO S, DIAS-FACETO L S, SELANI M M, et al.Umami Ingredient:Flavor enhancer from shiitake (Lentinula edodes) byproducts[J].Food Research International, 2020, 137:109540.
[25] 姜明慧, 田元勇, 闫丽新, 等.冷藏过程中虾夷扇贝横纹肌微观结构变化与肌原纤维蛋白稳定性[J].食品科学, 2020, 41(21):175-181.
JIANG M H, TIAN Y Y, YAN L X, et al.Microstructure change and myofibrillar protein stability of Patinopecten yessoensis striated adductor muscle during chilling storage[J].Food Science, 2020, 41(21):175-181.
[26] DONG X J, QIN W H, FU Y Y, et al.Effects of dietary betaine on cholesterol metabolism and hepatopancreas function in gibel carp (Carassius gibelio) fed with a high-fat diet[J].Aquaculture Nutrition, 2021, 27(6):1789-1797.
[27] LIU J Y, YIN Z H, YU W C, et al.The taste characteristics and metabolite variations of two Pacific abalone strains with different glycogen contents[J].LWT, 2024, 195:115820.
[28] ZHAO Y Q, ZHAO X, SUN-WATERHOUSE D, et al.Two-stage selective enzymatic hydrolysis generates protein hydrolysates rich in Asn-Pro and Ala-His for enhancing taste attributes of soy sauce[J].Food Chemistry, 2021, 345:128803.
[29] FU B F, XU X B, ZHANG X, et al.Identification and characterisation of taste-enhancing peptides from oysters (Crassostrea gigas) via the Maillard reaction[J].Food Chemistry, 2023, 424:136412.
[30] FENG Y Q, DENG S B, XIA X, et al.L-cysteine involved Maillard peptides of distillers’ grain hydrolysates:Browning, formation of characteristic flavor and improvement on fracturability of sugared garlic[J].Food Bioscience, 2023, 56:103298.
[31] LIU Y, ZHANG C H, CHEN S J.Comparison of active non-volatile taste components in the viscera and adductor muscles of oyster (Ostrea rivularis Gould)[J].Food Science and Technology Research, 2013, 19(3):417-424.
[32] 许欣, 张爱江, 李昆太, 等.花茶对牡蛎酶解液的脱腥效果及其风味改善作用研究[J].食品与发酵工业, 2024, 50(19):229-235.
XU X, ZHANG A J, LI K T, et al.Deodorization effect and flavor improvement of floral teas on oyster hydrolysates[J].Food and Fermentation Industries, 2024, 50(19):229-235.
[33] WANG Z J, LI H Q, CAO W H, et al.Effect of drying process on the formation of the characteristic flavor of oyster (Crassostrea hongkongensis)[J].Foods, 2023, 12(11):2136.
[34] CHEN C, FAN X K, HU Y Y, et al.Effect of different salt substitutions on the decomposition of lipids and volatile flavor compounds in restructured duck ham[J].LWT, 2023, 176:114541.