微生物污染一直是食品加工储存过程中所面临的重要问题,尤其是致病菌污染引起的食品安全问题不断增加。作为四大食源性致病菌之一的单增李斯特菌引起的疾病具有高死亡性,该致病菌分布在大部分食物中,且在较低温度下能存活甚至繁殖,具有强附着性、抗消毒剂和形成广泛生物被膜的能力,造成严重的食品污染和安全问题[1],加之化学防腐剂的不安全性和细菌对抗生素的耐药性不断增加,天然来源的抗菌肽逐渐被视为化学防腐剂或抗生素的替代品[2-3]。目前各种微生物产的低分子质量抗菌肽(antimicrobial peptides,AMPs)已被鉴定、纯化和表征,如姚佳明等[4]从解淀粉芽孢杆菌的培养物中分离纯化出的抑菌肽LVNPPT;枯草芽孢杆菌B3产生的一种小分子富含脯氨酸的抗菌肽[5]。由于抗菌肽热稳定性好、抗菌谱广、抗菌活性高和生物毒性低;更重要的是,其独特的抑菌机制不易诱导细菌耐药性[2]。因此发掘新型天然微生物源抗菌肽在食品防腐方面具有广泛的应用前景。
同时了解这些抗菌肽对致病菌的作用方式对于确定它们在食品工业中作为生物防腐剂的有效应用也非常重要。大多数抗菌肽通过靶向其膜结构来快速杀死病原体,其机制可以分为“桶板”模型、“毯式”模型和“环形孔”模型3种[6]。另外抗菌肽还通过抑制细菌的生物被膜,防止细菌逃避宿主细胞的免疫识别,避免诱导其发生耐药或者增强其耐药性[7]。因此抗菌肽独特的抗菌机制可以阻止致病菌的繁殖甚至发展成相应的耐药菌株。
本研究针对实验室前期从植物乳杆菌NMGL2发酵液中分离纯化的抗菌肽PNMGL2,其氨基酸序列为LNFLKK。PNMGL2在不同环境下均能保持较好抑菌稳定性,具有广谱抗菌效果[8],但对单增李斯特菌的抑菌效果及抑菌机理尚不明确。本研究以单增李斯特菌为指示菌,探究PNMGL2的抑菌机制,为其在食源性单增李斯特菌生物抑制的理论与应用研究提供技术支撑。
1 材料与方法
1.1 材料与试剂
植物乳杆菌抗菌肽PNMGL2由南京源肽生物科技有限公司合成,纯度95%。敏感菌:单增李斯特菌购买于北纳生物(BNCC185986),源编号CICC21633。
脑心浸出液肉汤(brain heat infusion,BHI)培养基,青岛海博生物技术有限责任公司;ATP、K+、Pi测试试剂盒,南京建成生物工程研究所;乳酸脱氢酶(lactic dehydrogenase,LDH)活性检测试剂盒,北京索莱宝生物科技有限公司;Live/Dead BacLight细菌活力试剂盒,美国赛默飞世尔科技有限公司。
1.2 仪器与设备
Infinite M200 PRO酶标仪,瑞士Tecan公司;Scan 4000全自动超高清抑菌圈分析仪,法国interscience公司;SPECTROstar Omega全波长全自动多功能酶标仪,德国BMG LABTEC公司;SU 8020场发射扫描电子显微镜,日本日立Hitachi公司;JEM 1200EX透射电子显微镜,日本JEOL公司;LSM-800激光共聚焦扫描显微镜,德国蔡司公司;BD FACSAriaTM Fusion流式细胞仪,美国BD公司。
1.3 实验方法
1.3.1 抗菌肽PNMGL2对单增李斯特菌的抑菌活性
1.3.1.1 生长曲线
将对数生长期的单增李斯特菌菌液按1%的接种量转接到新鲜的BHI培养基,取稀释后的菌液加入96孔板,每孔200 μL。处理组中加入终浓度为最小抑菌浓度(minimal inhibit concentration,MIC)的抗菌肽PNMGL2,对照组用无菌磷酸缓冲液(PBS,1 mol/L,pH 7.4)代替抗菌肽。将96孔板放入全波长全自动多功能酶标仪,37 ℃培养24 h,在OD600nm波长下每隔1 h监测细菌的生长情况。
1.3.1.2 杀菌曲线
将终浓度为MIC的抗菌肽PNMGL2添加到处于对数期的单增李斯特菌菌悬液(OD600nm=0.4)中,37 ℃下孵育6 h。分别在0、0.5、1、2、3、4、5、6 h取菌液稀释后在琼脂平板上涂板,37 ℃下培养24 h后进行菌落计数。
1.3.2 抗菌肽PNMGL2对单增李斯特菌细胞膜完整性的影响
1.3.2.1 碘化丙啶(propidium iodide,PI)的摄取
将抗菌肽PNMGL2加入处于对数期的单增李斯特菌菌悬液中,抗菌肽终浓度为MIC,以无菌 PBS (0.1 mol/L,pH 7.4)代替抗菌肽为对照组,37 ℃下恒温分别处理0、1、2、3、4、5、6 h时吸取1 mL菌液,4 ℃、6 000 r/min离心10 min,取上清液,0.22 μm过滤,用试剂盒测定胞外LDH活性。
1.3.2.2 LDH活性
参照NING等[9]的方法稍作修改,使用流式细胞术检测抗菌肽PNMGL2对单增李斯特菌细胞膜完整性进行评估。首先,将用抗菌肽PNMGL2处理的处于对数期的单增李斯特菌菌悬液在37 ℃下孵育4 h,然后在黑暗中用PI(终质量浓度10 μg/mL)在4 ℃下固定30 min。之后,通过以6 000 r/min离心10 min收集细胞,用0.85% NaCl溶液(质量分数,下同)洗涤后重悬。使用流式细胞仪检查PI细胞染色。
1.3.3 抗菌肽PNMGL2对单增李斯特菌细胞形态及内部结构的影响
为了研究抗菌肽对单增李斯特菌细胞形态的影响,参考了WANG等[10]描述的方法。抗菌肽PNMGL2加入单增李斯特菌菌悬液中(106 CFU/mL),抗菌肽终浓度为MIC,37 ℃处理4 h后,6 000 r/min离心5 min 收集菌体,并用无菌 PBS(0.1 mol/L,pH 7.4)冲洗细胞,进行后续实验。以未用抗菌肽处理的指示菌菌悬液作为对照。
1.3.3.1 激光共聚焦显微镜(confocal laser-scanning microscopy,CLSM)
在培养至对数期的单增李斯特菌(OD600nm=0.4)中加入MIC浓度的抗菌肽PNMGL2,在37 ℃分别处理4 h。4 ℃、6 000 r/min离心5 min,用0.85%的NaCl溶液洗去残留的抗菌肽,再将菌体重悬于0.85% NaCl溶液。将3 μL混合染料(SYTO9/PI)加入到1 mL的菌悬液中进行染色,37 ℃闭光孵育30 min,用0.85% NaCl溶液洗去多余的染料,取2 μL菌液加到载玻片上,盖上盖玻片,用CLSM观察。无菌PBS(0.1 mol/L,pH 7.4)代替抗菌肽为对照组。
1.3.3.2 扫描电子显微镜(scanning electron microscope,SEM)
在4 ℃下用25 g/mL戊二醛固定过夜后,再用4 ℃预冷的1%锇酸,在4 ℃固定1 h,然后将细菌在每个浓度下通过分级系列乙醇(30%、50%、70%、80%、90%、95%、100%,体积分数)逐渐脱水15 min。接着进行临界点干燥和真空喷镀法进行喷金(10 kV,220 s),完成后使用扫描电子显微镜成像。
1.3.3.3 透射电子显微镜(transmission electron microscopy,TEM)
样品的前处理与SEM相似,进行固定和脱水后,再使用丙酮和树脂的混合液进行渗透处理。然后使用超薄切片机将树脂样品切成超薄切片(70~90 nm),切片用醋酸双氧轴染液染色15 min,柠檬酸铅染色5 min。晾干后使用透射电子显微镜进行观察。
1.3.4 抗菌肽PNMGL2对单增李斯特菌细胞膜通透性的影响
根据WANG等[10]描述的检测细胞内容物释放到上清液中的方法稍作修改。将抗菌肽PNMGL2加入处于对数期的单增李斯特菌菌悬液中,抗菌肽终浓度为MIC,以无菌 PBS(0.1 mol/L,pH 7.4)代替抗菌肽做为对照组,37 ℃下恒温分别处理0、1、2、3、4、5、6 h时吸取1 mL菌液,6 000 r/min离心10 min取上清液,0.22 μm过滤,用试剂盒测定胞外ATP、K+、Pi 浓度。并使用BCA蛋白试剂盒测定单增李斯特菌的胞外蛋白浓度,实验独立重复3次。
1.3.5 抗菌肽PNMGL2对单增李斯特菌生物被膜形成的影响
将100 μL浓度分别为 2 MIC、MIC、1/2 MIC、1/4 MIC和1/8 MIC的抗菌肽PNMGL2和100 μL处于对数期的单增李斯特菌菌液(OD600nm= 0.4)加入到 96 孔板中,分别以200 μL BHI培养基和指示菌菌悬液为阴性对照和阳性对照,在37 ℃恒温培养24 h后,采用结晶紫染色法测定单增李斯特菌的生物被膜的形成能力[11]。
1.3.6 抗菌肽PNMGL2的溶血性
为了探究抗菌肽PNMGL2的生物安全性,利用血琼脂平板法测定其溶血性[12]。采用滤纸片法将相同体积(10 μL)浓度为4 MIC、2 MIC、MIC、1/2 MIC、1/4 MIC的PNMGL2分别滴加在血琼脂平板中的无菌空白滤纸片上,以0.1% Triton X-100(体积分数,下同)为阳性对照,以PBS溶液(0.1 mol/L,pH 7.4)为阴性对照,置于37 ℃培养箱培养24 h后,观察是否出现溶血圈。
1.3.7 数据处理与统计分析
每次实验重复3次独立平行实验,实验数据以“平均值±标准偏差”表示,利用SPSS 22.0软件进行统计分析,单因素方差分析(analysis of variance,ANOVA)检验计算结果显著性(P<0.05)。并结合OriginPro 2023软件绘图。
2 结果与分析
2.1 抗菌肽PNMGL2的抑菌活性
采用革兰氏阳性菌单增李斯特菌研究抗菌肽PNMGL2的潜在抗菌机制。实验前期测得PNMGL2对单增李斯特菌的最小抑菌质量浓度MIC为7.8 mg/mL。接着检测其经过和未经PNMGL2处理的生长曲线和杀菌动力曲线。如图1-a所示,不含抗菌肽的单增李斯特菌的OD600nm值逐渐增加到1.10。相比之下,暴露于PNMGL2时,单增李斯特菌的OD600nm值降低到0.34。这说明PNMGL2的添加使得菌体密度保持在较低水平,抑制了细菌的生长。
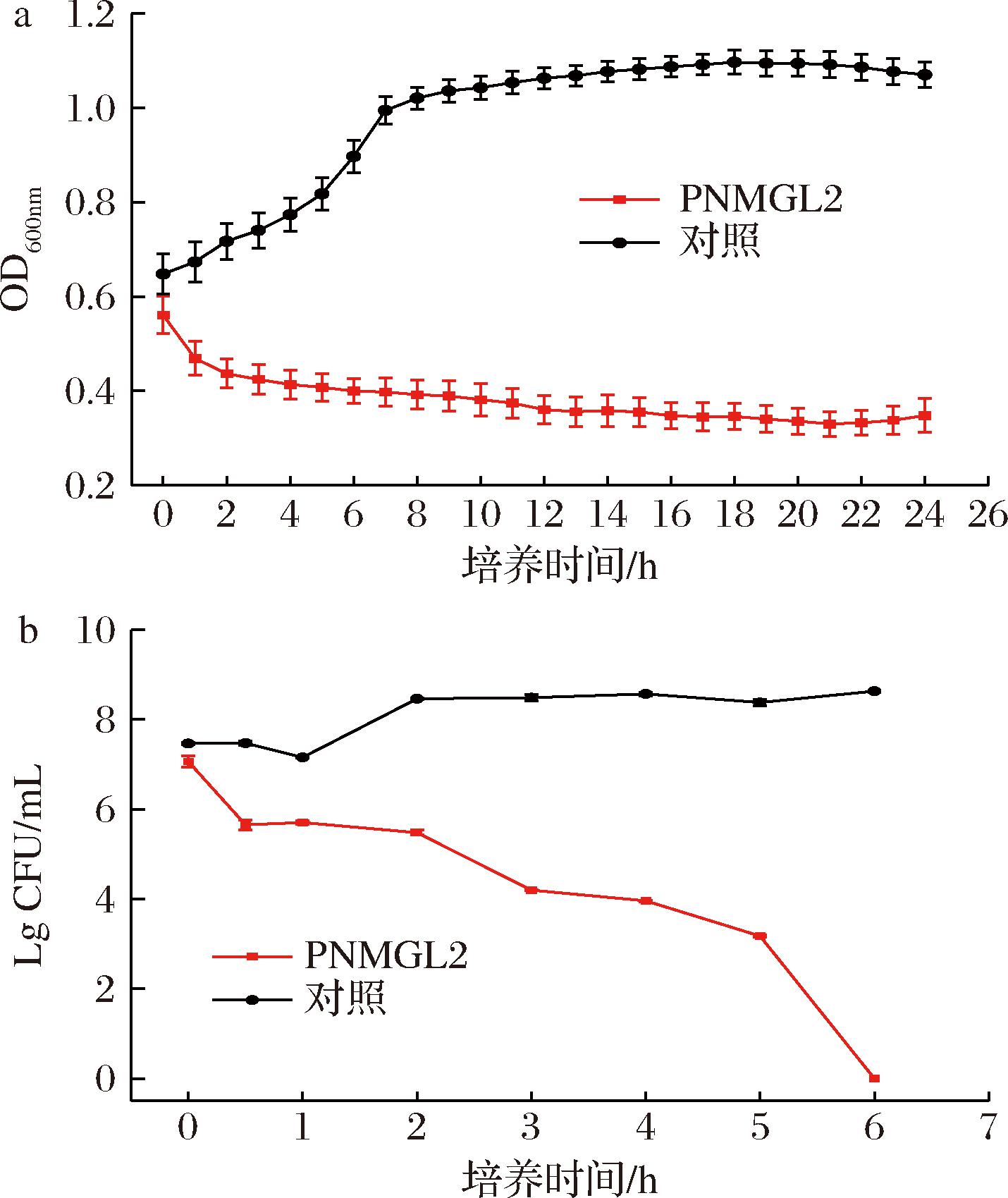
a-生长曲线;b-杀菌动力曲线
图1 抗菌肽PNMGL2对单增李斯特菌的生长曲线和杀菌动力曲线
Fig.1 Growth curve and time-kill curves of antimicrobial peptide PNMGL2 against L.monocytogenes
杀菌动力曲线显示,用PNMGL2处理后,单增李斯特菌细胞的数量显著减少(图1-b)。与对照组相比,单增李斯特菌2、3 h时的lg CFU/mL值分别降低了2.99和4.29个单位。SINGH等[13]表示起始接种物的活菌数减少了3 lg CFU/mL,则99%杀菌。因此,PNMGL2在MIC浓度下具有杀菌作用。
2.2 抗菌肽PNMGL2对细胞膜完整性的影响
通过PI的摄入研究抗菌肽PNMGL2对细胞膜完整性的破坏。PI是一种核酸染色剂,只能进入到膜受损的细胞中与核酸结合进行染色,导致荧光强度增加[9],从而可以判断细胞是否被破坏。因此,通过流式细胞术测定单增李斯特菌的PI染色情况(图2)。对于处理组单增李斯特菌的PI染色率为78.60%,而对照为1.92%。PI的内流表明抗菌肽PNMGL2确实诱导了膜损伤,降低了膜的完整性并增加了膜的通透性。
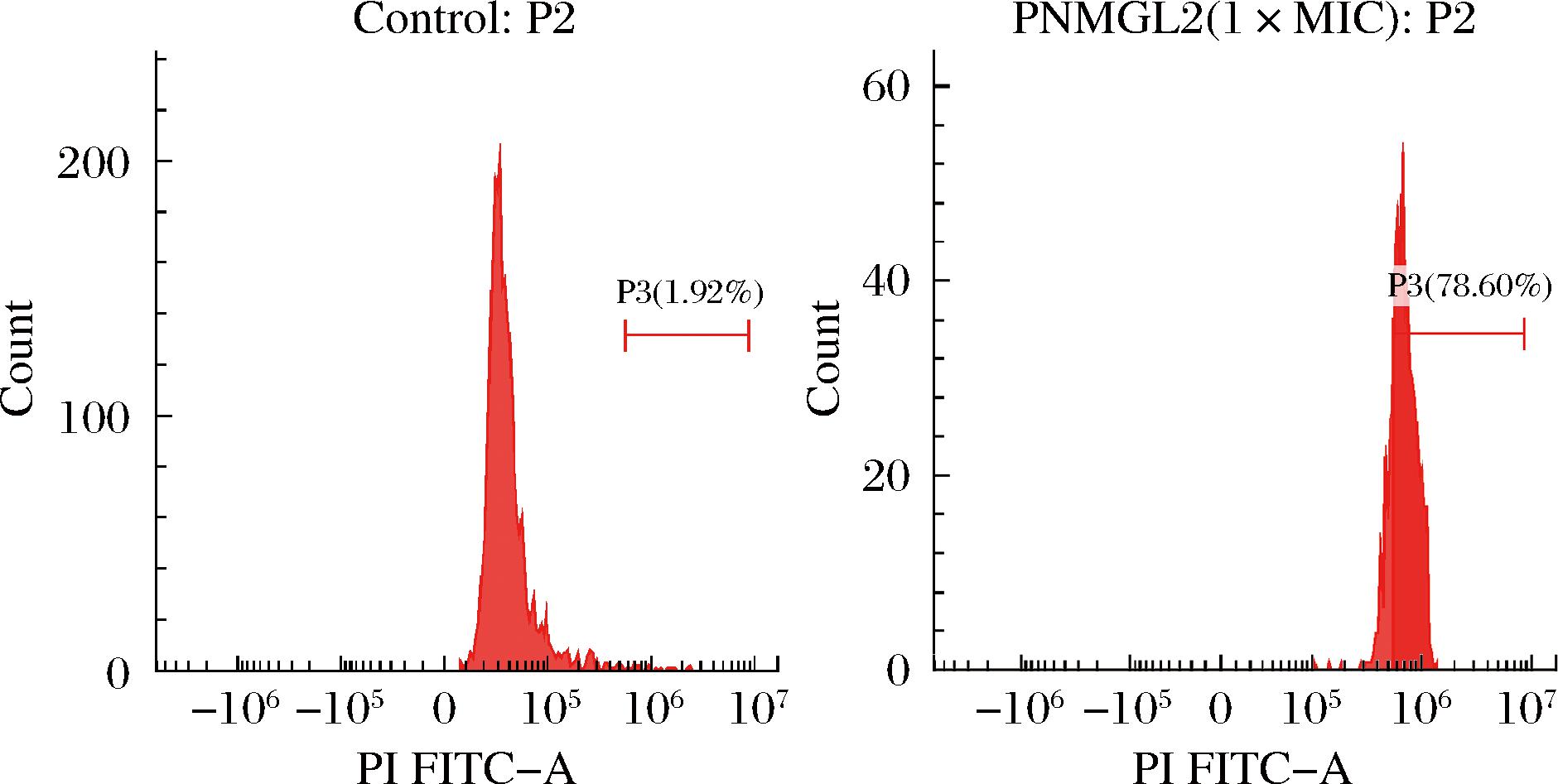
a-对照组;b-PNMGL2处理组
图2 流式细胞术分析抗菌肽PNMGL2对单增李斯特菌细胞膜完整性的影响
Fig.2 Effect of antimicrobial peptide PNMGL2 on the integrity of cell membrane of L.monocytogenes analyzed by flow cytometry
另外LDH的释放也可用作细胞膜完整性的指标[14]。对照组中,LDH活性值始终保持0.006 mmol/L左右;用MIC的抗菌肽处理后,单增李斯特菌细胞的LDH浓度达到最大值0.01 mmol/L(图3),胞内乳酸脱氢酶大量外泄。结果表明抗菌肽PNMGL2对单增李斯特菌细胞膜具有破坏效果,同上述PI摄取的结果一致。
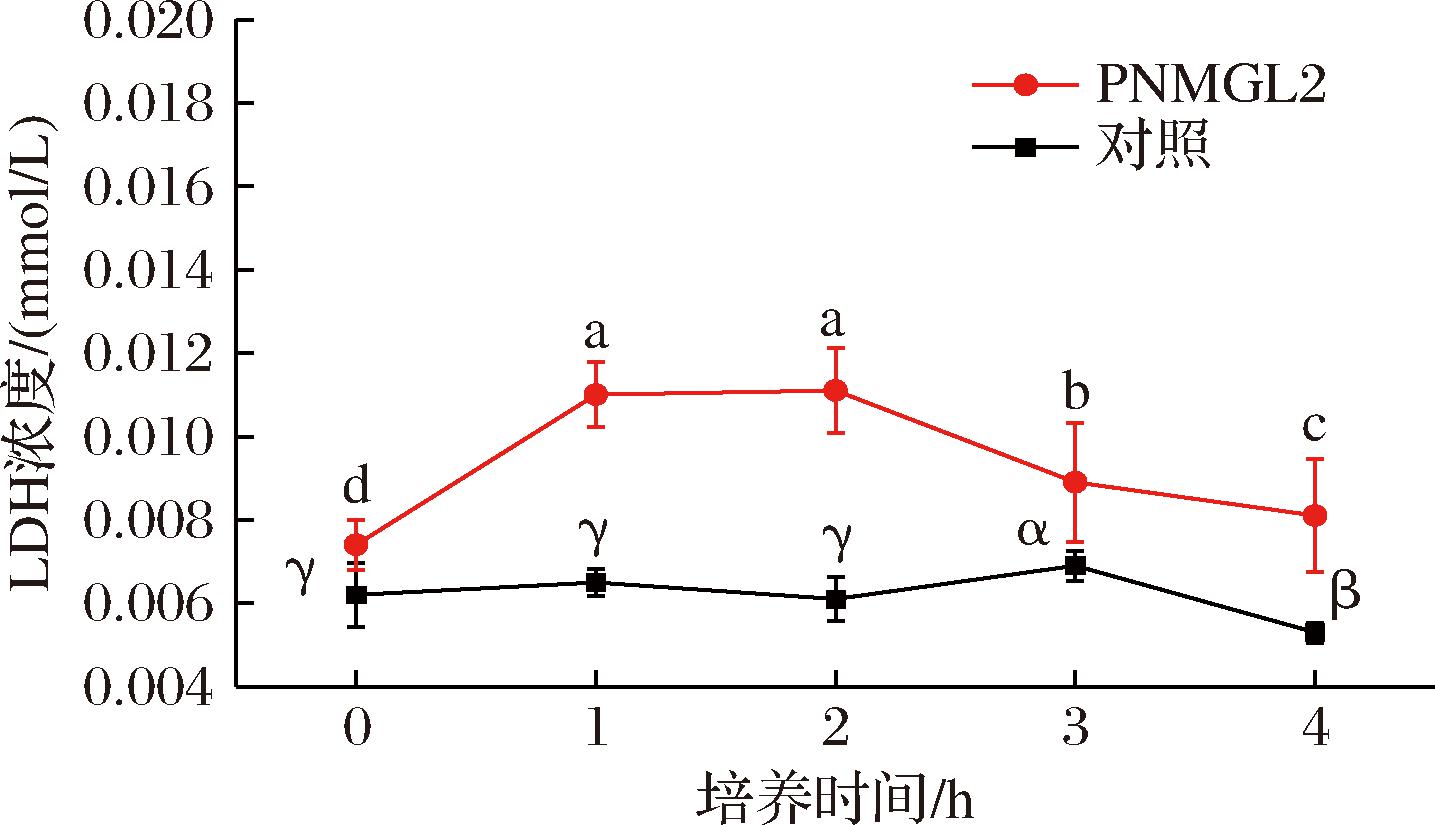
图3 单增李斯特菌中释放的LDH
Fig.3 The release of LDH by L.monocytogenes
注:同组不同字母代表差异显著(P<0.05)。
2.3 抗菌肽PNMGL2对细胞形态和细胞内组织的影响
采用CLSM、SEM和TEM在超微结构水平上观察细胞受损情况。
PI和SYTO9染料已广泛用于细胞膜完整性的检测。完整的细胞发出绿色或黄色荧光,而受损细胞发出红色荧光[15]。对照组的所有细胞都发出绿色荧光(图4-a)。当单增李斯特菌在MIC浓度下用PNMGL2处理时,检测到大量红色荧光(图4-b),表明单增李斯特菌的细胞膜被严重破坏,这进一步表明,抗菌肽PNMGL2的抗菌活性与细菌膜的完整性有关。通过SEM和TEM进行微观结构分析,可以直接观察到菌体细胞表面形态变化和细胞内组织变化。如图4-c对照组菌体细胞表面饱满光滑,PNMGL2处理后发现细胞膜变得粗糙和起皱,出现凹陷变形和聚集成堆的现象(图4-d),通过TEM观察菌体细胞组织内部的微观结构变化,未经处理的正常细菌表面完整光滑,细胞壁结构紧凑,组织分布均匀(图4-e)。而经抗菌肽PNMGL2处理后,细菌细胞膜部分区域变薄,伴有膜模糊,组织分布不均匀,并观察到有孔的形成(图4-f)。这与OMARDIEN等[16]所说的阳离子AMP通过改变膜的组织和流动性在膜插入部位引起“膜泄漏”的结果相似。因此我们推断抗菌肽PNMGL2诱导细胞膜孔形成,破坏了细胞质膜,引起“膜泄漏”,并且细胞膜通透性也可能发生了变化。
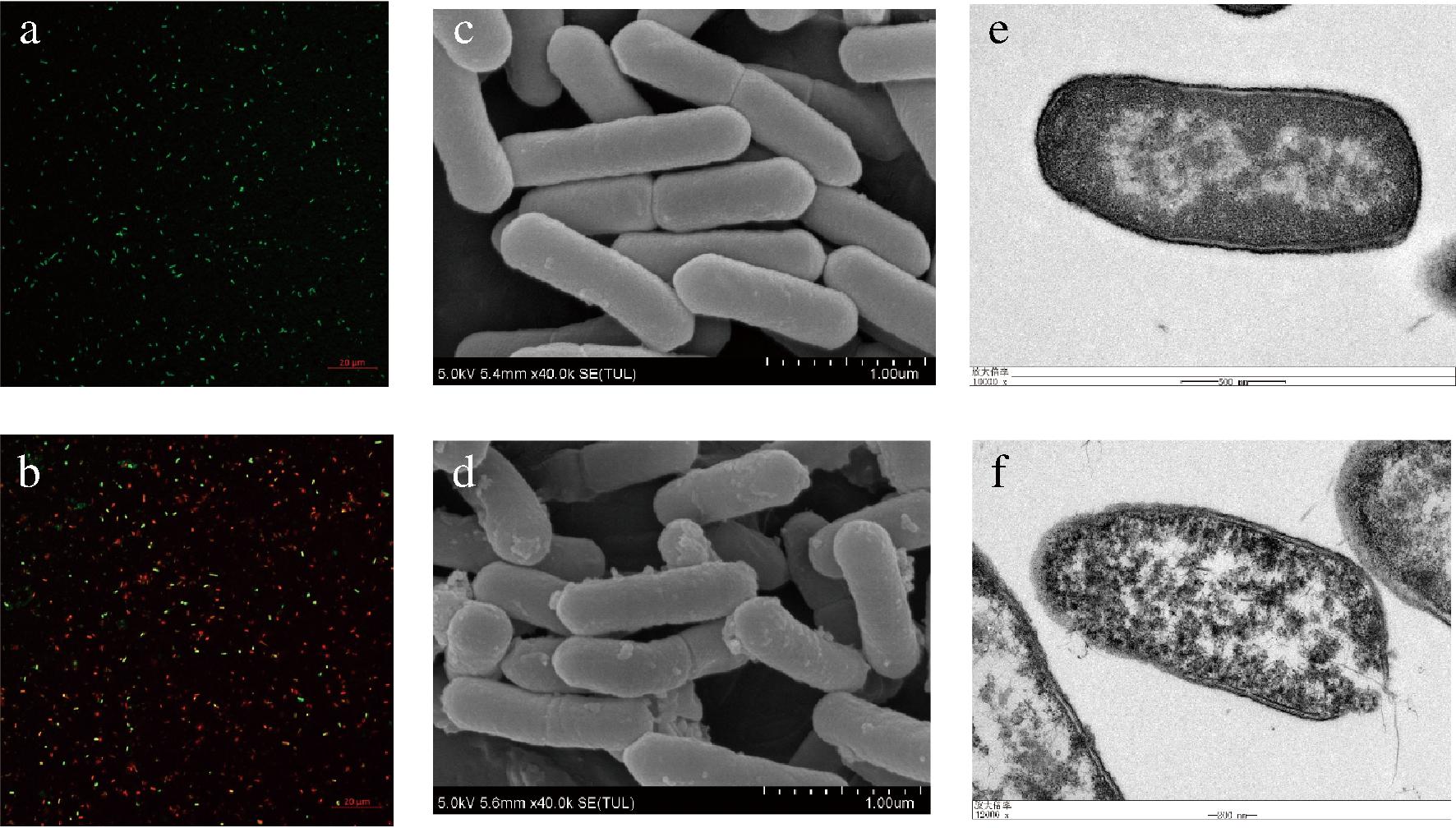
a、b-对照组和PNMGL2处理细菌4 h的CLSM图像;c、d-对照组
和PNMGL2处理细菌4 h的SEM图像;e、f-对照组和PNMGL2处理细菌4 h的TEM图像
图4 单增李斯特菌的电子显微镜分析
Fig.4 Electron microscopy analysis of L.monocytogenes
2.4 抗菌肽PNMGL2对细胞膜通透性的影响
细胞膜孔的形成或损伤将直接造成菌体内容物泄漏,菌体细胞膜通透性改变。为分析细胞膜的通透性,检测了细胞内无机磷酸盐、K+、ATP、蛋白质和核酸的泄露情况[10]。与未处理的对照组相比,PNMGL2处理的细胞引起细胞内容物的外排,使得细胞外无机磷酸盐、K+、ATP、蛋白质和核酸浓度的增加。
如图5所示,对照组K+的最大泄漏量为(0.14±0.04) mmol/L,而细菌经过PNMGL2处理6 h后,K+的泄漏量增加到了(2.50±0.10) mmol/L(图5-a)。细胞外磷浓度与对照组相比也是显著增加(P<0.05),最大泄露量达到(8.70±0.28) mmol/L(图5-b)。结果表明,PNMGL2对单增李斯特菌的结构和膜通透性造成显著损伤,导致磷和钾丢失和细胞生长受到抑制。同样,GAZONI等[17]也表明,甲醇提取物Simaba ferruginea对福氏志贺氏菌和金黄色葡萄球菌的抑菌机制与细胞膜通透性的变化有关,导致K+和核苷酸的泄漏。相似的,SUZUKI等[18]提取的Piscicocin CS526和MCAULIFFE等[19]证明Lacticin 3147可以通过形成孔隙来增加细菌对小离子(无机磷酸盐和K+)的膜通透性。这些结果表明,膜通透性的增加是抗菌机制的决定因素,强调了钾和磷释放对抗菌肽PNMGL2抗菌活性的潜在重要性。

a-钾;b-无机磷酸盐;c-ATP;d-核酸;e-蛋白质的影响
图5 抗菌肽PNMGL2对单增李斯特菌细胞外钾、无机磷酸盐、ATP、核酸、蛋白质的影响
Fig.5 Effects of antibacterial peptide PNMGL2 against L.monocytogenes on potassium,inorganic phosphate,ATP,nucleic acid,and protein
注:同组不同字母代表差异显著(P<0.05)。
ATP参与许多代谢过程,对细胞生命活动至关重要,包括能量转换,营养加工,大分子合成和酶的分泌等[15]。如图5-c所示,未处理细菌的细胞外ATP浓度在0.15~0.24 mmol/L。与对照组相比,经过6 h处理后细菌细胞外ATP浓度从(0.21±0.01) mmol/L增加到(0.42±0.02) mmol/L。这表明暴露于PNMGL2的单增李斯特菌细胞外的ATP浓度显著增加。这可能是抗菌肽增加了单增李斯特菌细胞膜的通透性,导致ATP的大量泄露,最终导致细菌死亡。也可能是其影响了细菌胞内ATP的正常合成和代谢,导致胞内ATP的快速消耗或抑制了ATP的合成,最终紊乱菌体的正常生命活动,甚至导致菌体的死亡[15]。JUNG等[20]的一项类似研究发现,脂质体亚麻酸会破坏幽门螺杆菌的细胞膜,导致ATP大量丢失,最终导致细菌死亡。
还测定了细胞释放的核酸和蛋白质(图5-d、图5-e)。与对照组相比,细胞外核酸(OD260nm)和蛋白质(OD280nm)用抗菌肽处理细菌后在6 h内分别增加到(3.78±0.002)和(21.40±0.15) mg/mL。蛋白质和核酸参与许多代谢过程,包括DNA和RNA复制、转录和翻译。蛋白质和核酸的外排可能会破坏代谢、复制、转录和翻译的过程[2]。
2.5 抗菌肽PNMGL2抑制生物被膜的形成
微生物生物被膜代表了一种独特的细菌生理学,其特征是一种与浮游细菌根本不同的多细胞表型[21]。抗菌肽PNMGL2除了破坏单增李斯特菌细胞膜外,还表现出抗生物被膜效应。
采用结晶紫染色法测定抗菌肽对单增李斯特菌生物膜形成的影响结果如图6所示,与对照相比,用2 MIC、MIC、1/2 MIC、1/4 MIC和1/8 MIC浓度抗菌肽处理后的单增李斯特菌细胞膜形成分别减少了(86.89±0.03)%、(35.10±0.05)%、(19.61±0.12)%、(18.69±0.07)%、(6.23±0.09)%,且PNMGL2对生物膜形成的抑制程度相对依赖于浓度。PNMGL2可显著抑制单增李斯特菌的生物膜形成。PNMGL2对细菌的抑制不仅与细胞表面的物理化学性质有关,例如细胞表面的化学结构和组成或电荷的性质,还与细胞/生物膜与抗菌化合物之间的化学相互作用或细胞与固体表面之间的物理相互作用有关[1]。
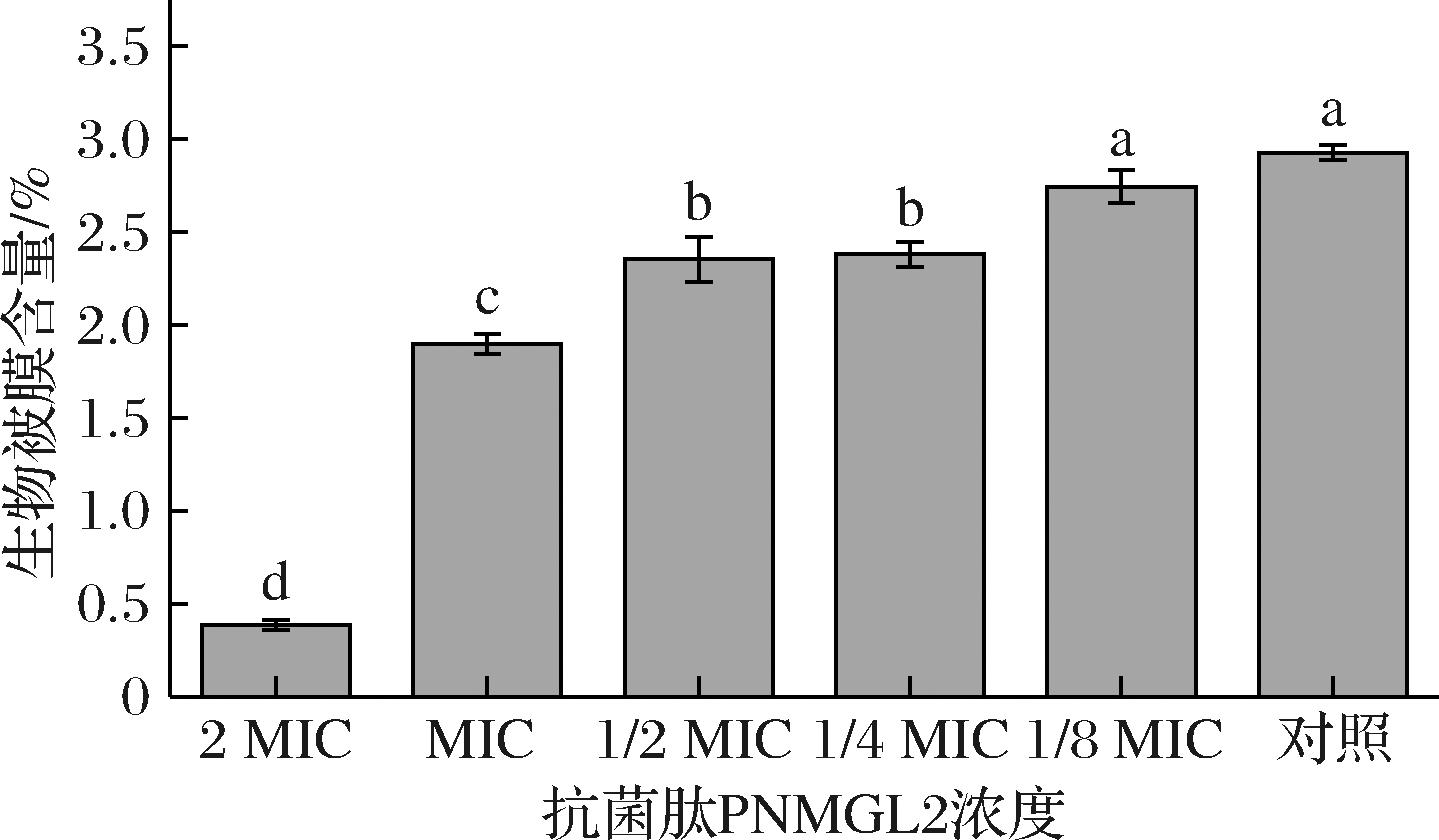
图6 不同浓度的抗菌肽PNMGL2对单增李斯特菌生物被膜形成的影响
Fig.6 Effects of different concentrations of antibacterial peptide PNMGL2 on the formation of biofilm of L.monocytogenes
注:不同字母代表差异显著(P<0.05)。
2.6 抗菌肽PNMGL2的溶血性
为了探究抗菌肽PNMGL2的生物安全性,利用血琼脂平板法测定其溶血活性。结果如图7所示,阳性对照组的Triton X-100出现明显的溶血圈,阴性对照组PBS没有产生溶血圈,不同浓度的抗菌肽PNMGL2同样没有明显的溶血圈,即使在4 MIC高浓度下也没有产生明显的溶血圈,没有浓度依赖性,这说明抗菌肽PNMGL2无溶血性。可能是由于抗菌肽PNMGL2缺乏结合红细胞的能力,降低了对人的细胞毒性[12]。相似的,RON EVI
EVI 等[22]研究发现即使高浓度的Kiadin-5也没有显示出溶血活性,还有细菌素LP01[23]和细菌素BM1122和BM1300[12]。抗菌肽PNMGL2的这种较低溶血性将有助于较高浓度的抗菌肽在临床或食品防腐中的应用。
等[22]研究发现即使高浓度的Kiadin-5也没有显示出溶血活性,还有细菌素LP01[23]和细菌素BM1122和BM1300[12]。抗菌肽PNMGL2的这种较低溶血性将有助于较高浓度的抗菌肽在临床或食品防腐中的应用。
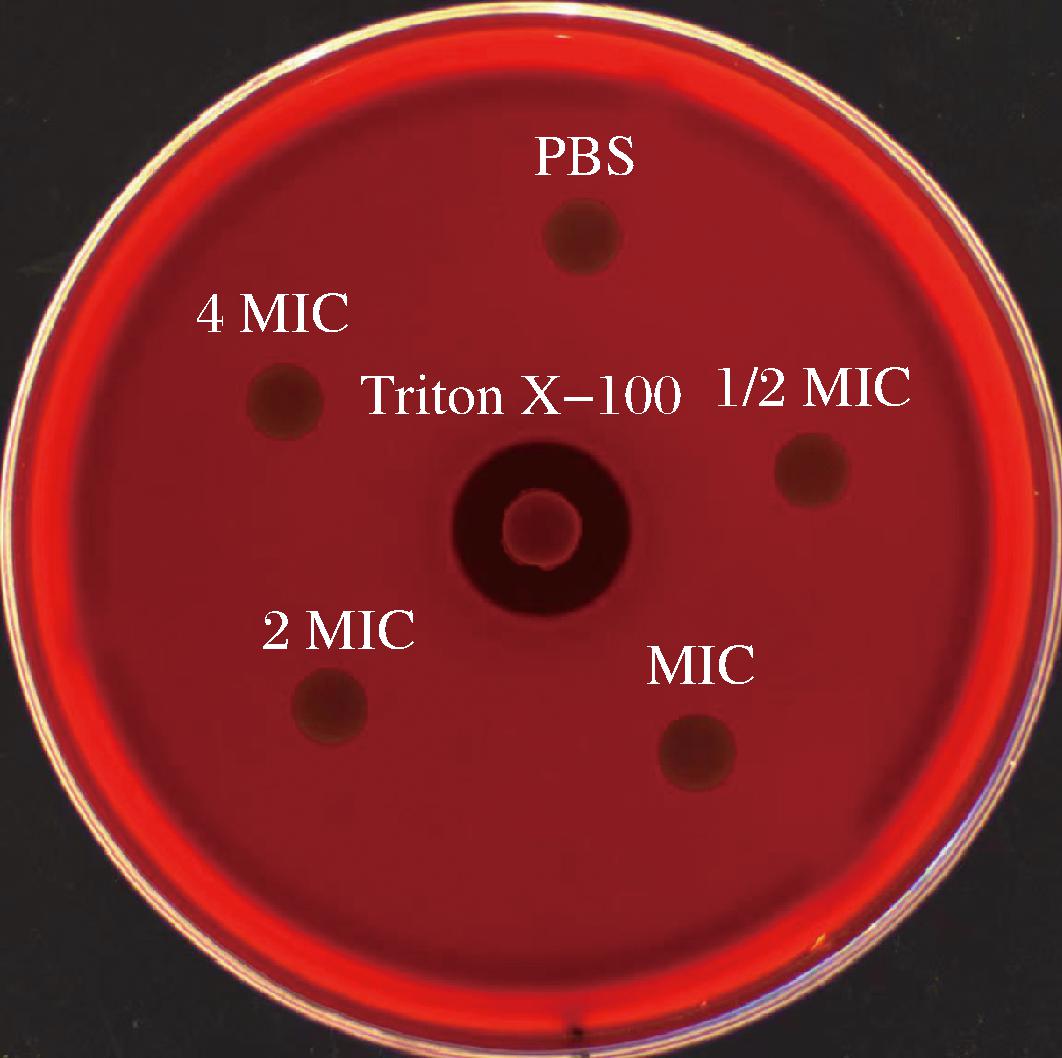
图7 抗菌肽PNMGL2的溶血活性
Fig.7 Hemolysis of Antimicrobial peptide PNMGL2
3 讨论
近年来,有关新型抗菌肽抑菌机制的研究大多以细胞膜作为效应靶点,这可有效解决抗生素对处于缓慢生长期与休眠期的致病菌彻底杀灭的难点[24]。前期研究发现PNMGL2具有α螺旋结构,并带有2个正电荷[8]。据报道,阳离子抗菌肽能够通过静电吸引与带负电荷的细菌细胞膜结合,同时,具有α螺旋结构的C端可以通过疏水作用与磷脂结合,使抗菌肽插入细胞质膜并破坏细胞膜结构,导致膜孔的形成,从而发挥其抑菌活性[14]。因此,PNMGL2可能以上述类似的方式破坏细菌膜。为此,本研究以细胞膜为靶点研究其抑菌机制。首先生长曲线结果显示PNMGL2能抑制单增李斯特菌的生长,杀菌曲线显示了PNMGL2能在3 h内杀死99%细菌,表明PNMGL2的作用方式是杀菌。进一步通过PI摄取观察到经PNMGL2处理的菌体荧光强度增加(图2),以及细胞内LDH释放增加(图3),初步表明了PNMGL2的抗菌机制是破坏细菌细胞膜的完整性。为了进一步证实膜损伤机制,使用CLSM、SEM和TEM更直接地观察膜的形态和超微结构变化(图4)。CLSM结果表明,经PNMGL2处理后的菌体呈现大量红色荧光,表明细胞膜损伤严重。SEM和TEM观察发现经PNMGL2处理后的菌体显示出表面形态改变并且形成孔隙。这与BM1829对金黄色葡萄球菌和大肠杆菌的抑制作用所观察到的菌体形态变化类似[14]。膜孔的形成或损伤将直接造成细胞膜通透性改变,使菌体内容物(无机磷酸盐、K+、ATP、蛋白质和核酸)泄漏(图5)。因此可以推断抗菌肽PNMGL2通过破坏菌体细胞质膜,促进膜孔的形成及细胞膜通透性的增加,导致细胞内容物泄漏,发挥其抑菌作用。
抗菌肽PNMGL2除了通过膜损伤抑制单增李斯特菌之外,还具有对病原菌的抗生物被膜效应。生物被膜通常是指细菌产生的细胞外聚合物,生物被膜的形成有利于细菌抵御不利的外界因素。如单增李斯特菌在低温条件下形成生物被膜后可在食品加工环境中生存并持续污染食品。此外,生物被膜的形成还有利于细菌产生耐药性[25]。本研究发现PNMGL2以浓度依赖性方式抑制单增李斯特菌生物被膜的形成,抑制率高达(86.89±0.03)%(图6),表明PNMGL2是潜在高效的生物被膜抑制剂。据报道,大多数细菌生物被膜的形成与其群体感应(quorum sensing,QS)有关。例如,JIANG等[26]研究报道了抑制Agr转录可以减少单增李斯特菌生物被膜的形成。然而PNMGL2对单增李斯特菌生物被膜形成的抑制机制尚不明确,有待进一步研究。
生物安全性评价是抗菌肽在食品防腐中应用的必要条件。体外溶血实验显示PNMGL2即使在高浓度(4 MIC)下也无溶血圈(图7),说明PNMGL2无明显细胞毒性。这可能是由于PNMGL2缺乏结合红细胞的能力,降低了其细胞毒性[11]。RON EVI
EVI 等[22]也发现高浓度的Kiadin-5没有显示出溶血活性,还有细菌素LP01[23],以及细菌素BM1122和BM1300[12]具有类似的结果。本研究的抗菌肽PNMGL2未观察到溶血现象,表明此抗菌肽在临床或食品防腐中的应用具有良好的安全性。
等[22]也发现高浓度的Kiadin-5没有显示出溶血活性,还有细菌素LP01[23],以及细菌素BM1122和BM1300[12]具有类似的结果。本研究的抗菌肽PNMGL2未观察到溶血现象,表明此抗菌肽在临床或食品防腐中的应用具有良好的安全性。
4 结论
综上,植物乳杆菌抗菌肽PNMGL2对单增李斯特菌的抗菌机制是通过破坏病原菌细胞膜,改变细胞壁的完整性及细胞膜的通透性,发挥其直接抑菌作用;同时PNMGL2还表现出抗生物被膜效应,进一步有效地抑制单增李斯特菌。溶血性试验表明了PNMGL2具有生物安全性。因此,PNMGL2可以作为一种潜在高效的天然防腐剂来减少食源性致病菌的污染。未来需进一步综合运用代谢组学、转录组学、蛋白质组学等方法更深层次、多维度地探讨PNMGL2的抗菌机制,并从分子水平上寻找作用靶点。此外还应系统评价PNMGL2对乳制品和肉制品中病原菌的抑制作用,以及对食品营养和感官品质的影响,以促进PNMGL2在食品保鲜领域的实际应用。
[1] PALMER J, FLINT S, BROOKS J.Bacterial cell attachment, the beginning of a biofilm[J].Journal of Industrial Microbiology &Biotechnology, 2007, 34(9):577-588.
[2] 曹云刚, 张瀚丹, 张鑫, 等.ε-聚赖氨酸抑菌机制及其在肉类保鲜中的应用[J].精细化工, 2022, 39(1):1-6;64.
CAO Y G, ZHANG H D, ZHANG X, et al.Antibacterial mechanism of ε-poly-L-lysine and its application in meat preservation[J].Fine Chemicals, 2022, 39(1):1-6;64.
[3] 付云, 赵谋明, 庞一扬, 等.源自螺旋藻渣枯草芽孢杆菌发酵抗菌肽SP-AP-1和伊枯草菌素对金黄色葡萄球菌抑菌机制对比研究[J].食品科学, 2021, 42(1):108-114.
FU Y, ZHAO M M, PANG Y Y, et al.Comparative study on the Anti-Staphylococcus aureus mechanism of SP-AP-1 and iturin a derived from fermentation of Spirulina residue by Bacillus subtilis[J].Food Science, 2021, 42(1):108-114.
[4] 姚佳明, 田亚平.解淀粉芽孢杆菌抑菌肽的分离鉴定及其抑菌谱表征[J].食品科学, 2020, 41(16):126-131.
YAO J M, TIAN Y P.Isolation and identification of antimicrobial peptides produced by Bacillus amyloliquefaciens and characterization of their antibacterial spectra[J].Food Science, 2020, 41(16):126-131.
[5] 白杰, 贠建民, 祝发明, 等.枯草芽孢杆菌菌株B3抗菌肽的分离纯化与鉴定[J].食品与发酵工业, 2018, 44(8):78-85.
BAI J, YUN J M, ZHU F M, et al.Isolation, purification and identification of antibacterial peptide from Bacillus subtilis strain B3[J].Food and Fermentation Industries, 2018, 44(8):78-85.
[6] MISHRA A K, CHOI J, MOON E, et al.Tryptophan-rich and proline-rich antimicrobial peptides[J].Molecules, 2018, 23(4):815.
[7] JI F Y, ZHAO Y, JIANG F Q, et al.Membrane mechanism of temporin-1CEc, an antimicrobial peptide isolated from the skin secretions of Rana chensinensis, and its systemic analogs[J].Bioorganic Chemistry, 2022, 119:105544.
[8] REN Q X, ZHANG M, XUE R, et al.Purification and characterization of a novel low-molecular-weight antimicrobial peptide produced by Lactiplantibacillus plantarum NMGL2[J].International Journal of Biological Macromolecules, 2023, 248:125932.
[9] NING Y W, YAN A H, YANG K, et al.Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J].Food Chemistry, 2017, 228:533-540.
[10] WANG Y, QIN Y X, ZHANG Y, et al.Antibacterial mechanism of plantaricin LPL-1, a novel class IIa bacteriocin against Listeria monocytogenes[J].Food Control, 2019, 97:87-93.
[11] 刘爽, 黄晓英, 苏雅航, 等.传统发酵食品中分离的乳酸菌粗提物对耐甲氧西林金黄色葡萄球菌抑菌机制研究[J].食品安全质量检测学报, 2023, 14(1):66-73.
LIU S, HUANG X Y, SU Y H, et al.Antibacterial mechanism of crude extracts of lactic acid bacteria isolated from traditional fermented food against methicillin-resistant Staphylococcus aureus[J].Journal of Food Safety &Quality, 2023, 14(1):66-73.
[12] 陆莹莹. 新型细菌素BM1122和BM1300的理化特性和抑菌机制的研究[D].杨凌:西北农林科技大学, 2021.
LU Y Y.Study on physicochemical properties and mode of action of novel bacteriocins BM1122 and BM1300[D].Yangling:Northwest A &F University, 2021.
[13] SINGH S B, DAYANANTH P, BALIBAR C J, et al.Kibdelomycin is a bactericidal broad-spectrum aerobic antibacterial agent[J].Antimicrobial Agents and Chemotherapy, 2015, 59(6):3474-3481.
[14] YAN H, LU Y Y, LI X, et al.Action mode of bacteriocin BM1829 against Escherichia coli and Staphylococcus aureus[J].Food Bioscience, 2021, 39:100794.
[15] WU M, TIAN L, FU J P, et al.Antibacterial mechanism of Protocatechuic acid against Yersinia enterocolitica and its application in pork[J].Food Control, 2022, 133:108573.
[16] OMARDIEN S, DRIJFHOUT J W, VAZ F M, et al.Bactericidal activity of amphipathic cationic antimicrobial peptides involves altering the membrane fluidity when interacting with the phospholipid bilayer[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2018, 1860(11):2404-2415.
[17] GAZONI V F, BALOGUN S O, ARUNACHALAM K, et al.Assessment of toxicity and differential antimicrobial activity of methanol extract of rhizome of Simaba ferruginea A.St.-Hil.and its isolate canthin-6-one[J].Journal of Ethnopharmacology, 2018, 223:122-134.
[18] SUZUKI M, YAMAMOTO T, KAWAI Y, et al.Mode of action of piscicocin CS526 produced by Carnobacterium piscicola CS526[J].Journal of Applied Microbiology, 2005, 98(5):1146-1151.
[19] MCAULIFFE O, RYAN M P, ROSS R P, et al.Lacticin 3147, a broad-spectrum bacteriocin which selectively dissipates the membrane potential[J].Applied and Environmental Microbiology, 1998, 64(2):439-445.
[20] JUNG S W, THAMPHIWATANA S, ZHANG L F, et al.Mechanism of antibacterial activity of liposomal linolenic acid against Helicobacter pylori[J].PLoS One, 2015, 10(3):e0116519.
[21] SHAO S Y, SHI Y G, WU Y, et al.Lipase-catalyzed synthesis of sucrose monolaurate and its antibacterial property and mode of action against four pathogenic bacteria[J].Molecules, 2018, 23(5):1118.
[22] RON EVI
EVI T, VUKI
T, VUKI EVI
EVI D, ILI
D, ILI N, et al.Antibacterial activity affected by the conformational flexibility in Glycine-lysine based α-helical antimicrobial peptides[J].Journal of Medicinal Chemistry, 2018, 61(7):2924-2936.
N, et al.Antibacterial activity affected by the conformational flexibility in Glycine-lysine based α-helical antimicrobial peptides[J].Journal of Medicinal Chemistry, 2018, 61(7):2924-2936.
[23] 张晓妍, 沙沈菲, 郭丽丹, 等.一株后生元菌株的抑菌特性研究及其细菌素基因簇的挖掘[J].食品工业科技, 2022, 43(17):1-10.
ZHANG X Y, SHA S F, GUO L D, et al.Antimicrobial properties of a postbiotic strain and gene cluster mining of its bacteriocin[J].Science and Technology of Food Industry, 2022, 43(17):1-10.
[24] 肖怀秋, 李玉珍, 林亲录, 等.金属抗菌肽SIF4对大肠杆菌的抑菌机制[J].食品与发酵工业, 2022, 48(1):111-116.
XIAO H Q, LI Y Z, LIN Q L, et al.Antimicrobial mechanism of metal antimicrobial peptide SIF4 against Escherichia coli[J].Food and Fermentation Industries, 2022, 48(1):111-116.
[25] YASIR M, WILLCOX M D P, DUTTA D.Action of antimicrobial peptides against bacterial biofilms[J].Materials, 2018, 11(12):2468.
[26] JIANG X B, KANG R, YU T, et al.Cinnamaldehyde targets the LytTR DNA-binding domain of the response regulator AgrA to attenuate biofilm formation of Listeria monocytogenes[J].Microbiology Spectrum, 2023, 11(3):e0030023.