L-缬氨酸也称为2-氨基-3-甲基丁酸,是人类和动物营养的重要组成部分,但在人体的正常代谢中无法直接合成,需要从日常饮食中摄取[1]。因其具有调节血糖、调控蛋白质合成、脂质代谢和提供机体所需要的能量等重要作用[2],L-缬氨酸被广泛应用于食品[3]、饲料[4]、化妆品[5-6]和制药[7-8]等行业。在食品行业中,L-缬氨酸可用作人类膳食补充剂,在饮料中可以减轻肌肉疲劳、强化肝功能;在饲料行业中,L-缬氨酸常被用作安全饲料添加剂,可改善猪和肉鸡的肉质和肉量,提高鸡的产蛋量和猪的泌乳量等;在化妆品行业中, L-缬氨酸用于皮肤的保湿锁水,补充营养;在制药行业中,L-缬氨酸是氨基酸注射液的原料,在慢性肝病治疗中应用广泛。最近的研究表明,L-缬氨酸可以通过激活PI3K/Akt1信号通路,抑制精氨酸酶活性,增加NO的表达,从而增强巨噬细胞对耐药病原体的吞噬作用[9-10]。基于以上L-缬氨酸的卓越功效,其高效生产方式的研究获得了相关工作者的关注。L-缬氨酸的主要生产方法有化学合成法、直接提取法和微生物发酵法3种[11]。化学合成法和直接提取法最早应用于生产L-缬氨酸,但因其原材料有限、反应条件苛刻、所得产物纯度较低等缺陷而被淘汰;随着微生物代谢工程技术的长足发展,使得微生物发酵法不仅可以克服传统方法的局限性,同时还具备原料成本低、反应条件温和、发酵产率较高、经济效益高且易于大规模生产等优势,已经成为最有前景的生产方法[12]。
目前,用于L-缬氨酸生产的菌株主要包括谷氨酸棒杆菌(Corynebacterium glutamicum)和大肠杆菌(Escherichia coli)。其中,C.glutamicum遗传背景研究清晰,发酵产物不含内毒素,已被广泛用于各种氨基酸的生产[13]。生物技术不断的发展和优化使得科研人员能利用更多的新策略,包括高通量筛选、生物传感器和新型基因编辑技术等,构建C.glutamicum工程菌,使其不但能拥有更高的生产能力,更低的副产物积累,且简化了终产物的分离和纯化过程,降低了生产成本。本文就C.glutamicum生物合成L-缬氨酸途径及采用代谢工程策略指导的分子育种提高L-缬氨酸产量的研究工作进行了综述,并就目前存在的问题进行了分析。
1 谷氨酸棒杆菌L-缬氨酸的生物合成途径
在C.glutamicum天然合成L-缬氨酸的生物途径中,葡萄糖经过糖酵解途径生成L-缬氨酸合成的重要前体物质丙酮酸,丙酮酸再在4种酶的催化下合成L-缬氨酸。这4种酶的催化过程如下:首先,由ilvBN编码的乙酰羟酸合成酶(acetohydroxyacid synthase,AHAS)催化两分子丙酮酸发生缩合反应,形成乙酰乳酸;乙酰乳酸由ilvc编码的乙酰羟酸异构还原酶(acetohydroxyacid isomeroreductase,AHAIR)异构化并还原形成二羟基异戊酸;二羟基异戊酸由ilvD编码的二羟酸脱水酶 (dihydroxyacid dehydratase,DHAD)催化其脱水生成α-酮基异戊酸;再由ilvE 编码的转氨酶B(transaminase B,TA)将谷氨酸的氨基转移至α-酮基异戊酸,在细胞内生成终产物L-缬氨酸;最后由brnFE 编码的双组分渗透酶(branched chain amino acid exporter, BrnFE)负责将L-缬氨酸运输到细胞外。其中,BrnFE的表达受全局调控蛋白Lrp的调控,激活Lrp可以促进BrnFE的表达;而L-缬氨酸的输入则由brnQ 编码的蛋白BrnQ完成[14]。具体合成途径见图1。
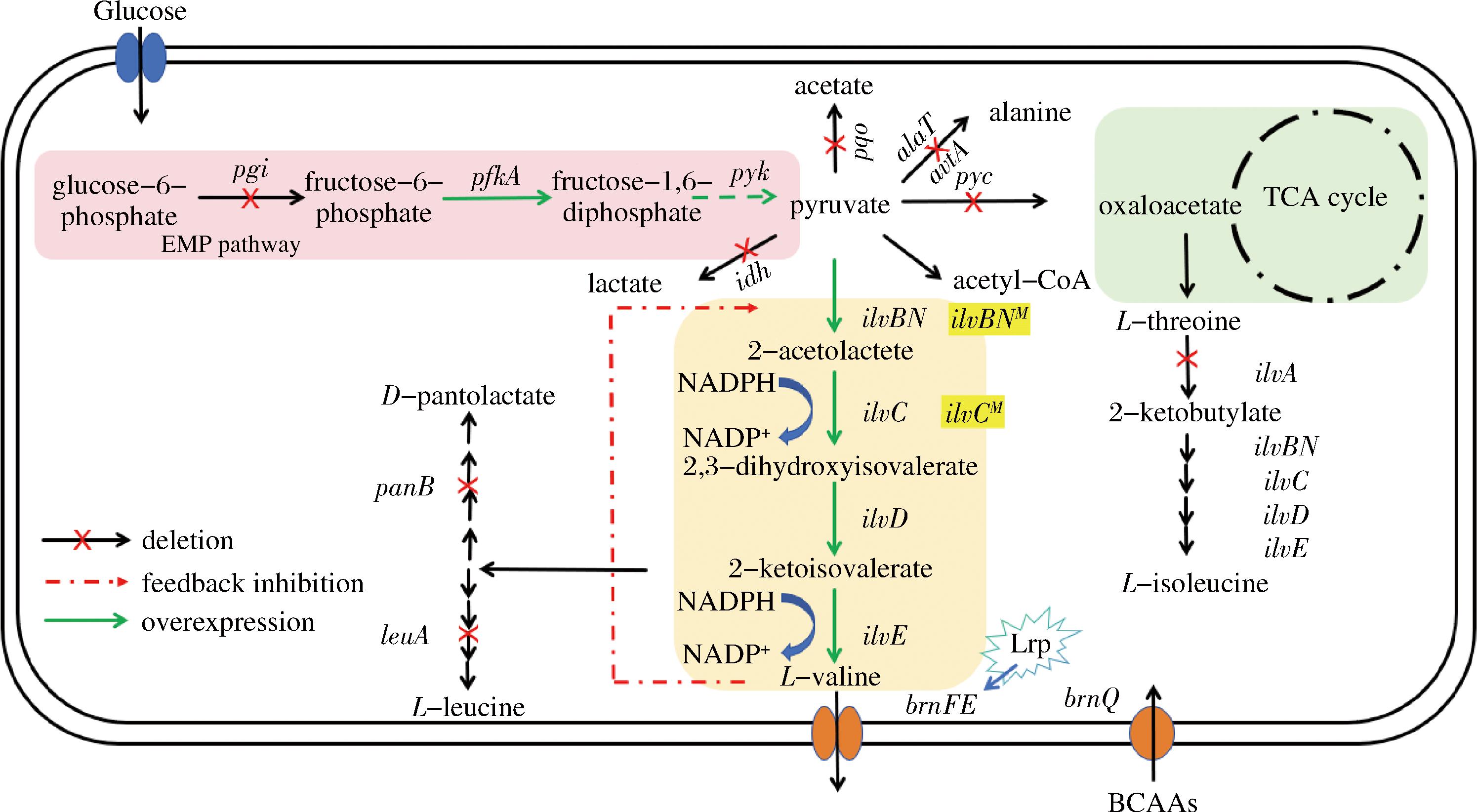
图1 谷氨酸棒杆菌L-缬氨酸生物合成途径
Fig.1 Biosynthetic pathway of L-valine from C. glutamicum
注:glucose:葡萄糖;glucose-6-phosphate:葡萄糖-6-磷酸;fructose-6-phosphate:果糖-6-磷酸;fructose-1,6- diphosphate:果糖-1,6-二磷酸;pyruvate:丙酮酸;oxaloacetate:草酰乙酸;2-acetolatate:乙酰乳酸;2,3-dihydroxyisovalerate:二羟基异戊酸;2-ketoisovalerate:α-酮基异戊酸;2-ketobutylate:2-酮丁酸;acetate:乙酸;lactate:乳酸;alanine:丙氨酸;L-threoine:L-苏氨酸;L-leucine:L-亮氨酸;L-isoleucine:L-异亮氨酸;D-pantolactate:D-泛酸;acetyl- CoA:乙酰CoA。
2 产L-缬氨酸的微生物系统代谢工程策略
在谷氨酸棒杆菌中,由于与支链氨基酸的生物合成途径重叠,且伴随着大量辅因子的消耗和多重抑制,造成以葡萄糖为底物生成单一的L-缬氨酸有许多代谢瓶颈。因此,依据L-缬氨酸的生物合成途径,科研工作者构建高产菌株的代谢工程改造策略主要包括:a)消除副产物,增加丙酮酸供应;b)过表达代谢途径关键基因;c)平衡优化辅因子;d)削减竞争支路;e)强化输出途径。
2.1 增加丙酮酸供应
来自糖酵解的丙酮酸是生产L-缬氨酸的主要前体物质[15],因此减少丙酮酸的消耗使其大量积累有利于提高L-缬氨酸的产量。但丙酮酸作为代谢中心物质流向十分广泛,是多种生物合成途径的底物,如可通过ldhA基因编码的乳酸脱氢酶(lactate dehydrogenase)生成乳酸;通过pqo基因编码的丙酮酸醌氧化还原酶(pyruvate/quinine oxidoreductase)生成乙酸;或者通过alaT和avtA基因编码的丙氨酸转氨酶(alanine transaminase)合成丙氨酸;此外,丙酮酸还有一个主要的流出途径是三羧酸(tricarboxylic acid, TCA)循环,其参与TCA循环有两种方式,一种是直接转化为草酰乙酸,另一种是转化为乙酰CoA。对上述基因进行敲除或修饰有利于提高丙酮酸利用率从而增加丙酮酸向L-缬氨酸合成的碳通量[16]。在C.glutamicum丙酮酸脱氢酶缺陷菌株中敲除pqo,可在24 h内积累12.4 g/L的L-缬氨酸[17]。BLOMBACH等[18]敲除C.glutamicum中的pyc以减少丙酮酸进入TCA循环,将L-缬氨酸提高到了6.74 g/L。MA等[19]对菌株C.glutamicum CP基因组研究发现,由CP_103编码的H+/柠檬酸突变体可以将胞外的柠檬酸转运到胞内,其活性比野生型更强;在培养基中额外添加50 mmol/L柠檬酸后,其可以在TCA循环中被迅速利用,减少了TCA循环对丙酮酸的消耗,L-缬氨酸的产量从20.49 g/L提高到24.33 g/L,提高了18.7%。此外,用稀有密码子替换异柠檬酸脱氢酶编码基因icd的起始密码子ATG能适当减弱TCA循环的碳通量,L-缬氨酸产量增加7.1%,达到57.8 g/L[20]。因此,碳通量的重新分布可以更好地平衡细胞的生长和目的产物的生产。
赵阔等[21]过表达了糖酵解途径的关键酶果糖-6-磷酸激酶编码基因pfkA和丙酮酸激酶编码基因pyk使丙酮酸的积累量较原始菌株提高了88.67%;同时将丙酮酸的代谢副产物乳酸、乙酸、丙氨酸以及琥珀酸合成的相关基因ldh、pta、alaT、pyc和ppc 进行叠加敲除,丙酮酸产量提高到9.4 g/L,在此基础上进一步过表达ilvBN使L-缬氨酸产量达到6.9 g/L。传统的基因编辑技术主要都采用同源重组的方法,随着CRISPR技术的不断进步,CRISPR干扰(CRISPR interference, CRISPRi)技术已被应用于氨基酸的生产中[22]。杜丽红等[23]利用一种应用于谷氨酸棒状杆菌的诱导型CRISPRi技术改造糖酵解和磷酸戊糖途径发现对aceE 编码的丙酮酸脱氢酶亚基E1和由Cgl1576编码的6-磷酸葡萄糖脱氢酶进行叠加弱化时L-缬氨酸的生产效果最佳,产量可达到37.1 g/L。
2.2 强化合成途径
2.2.1 解除反馈抑制
AHAS受到L-缬氨酸、L-亮氨酸和L-异亮氨酸的反馈抑制,其中L-缬氨酸对AHAS的抑制程度最强[15],因此,解除L-缬氨酸对AHAS的反馈抑制是构建L-缬氨酸高效生产菌株的首要任务。有研究发现将AHAS调节亚基的3个氨基酸 Gly20-Ile21-Ile22定点突变为Asp-Asp-Phe就能够解除3种支链氨基酸对AHAS的反馈抑制,L-缬氨酸产量提高了44.44%[15]。张海灵[24]发现,同时突变催化亚基活性区域Ala138Val和调节亚基位点Gly20Asp、Ile21Asp和Ile22Phe时,AHAS活性较高且能够完全耐受10 mmol/L单一或者3种组合的支链氨基酸。将该突变后的重组菌株分批补料发酵后,L-缬氨酸的产量较原始菌株提高了26.9%,达到了37.9 g/L。
此外,截断ilvN编码的AHAS调节亚基C端的53个氨基酸残基也可以减少L-缬氨酸的反馈抑制,在0.59 g/L外源L-缬氨酸存在下,AHAS仍能保持90.8%的活性[25]。在ilvN的保守区域(如A42V、A89V或K136E)进行定点突变也能提高AHAS抗支链氨基酸反馈抑制的能力。突变体A42V/A89V在1.27 g/L支链氨基酸存在下保持了>93%的活性的同时使L-缬氨酸产量从1.95 g/L增加到10.1 g/L[26]。HASEGAWA等[27]发现如果将C.glutamicum中 ilvN基因的156位Gly定点突变成Glu可以有效提高AHAS抗反馈抑制的能力;同时敲除ldhA基因并过表达基因簇ilvBNGECTM,再经过发酵工艺优化后发酵48 h L-缬氨酸产量可达227 g/L。CHEN等[28]发现ilvB基因编码的AHAS催化亚基W503Q和T96S的突变使L-缬氨酸产量升高1.2倍。WEI等[29]将催化亚基A138V定点突变并进行过表达,L-缬氨酸的产量从5.98 g/L增加到9.05 g/L,提高了50%。以上结果表明,解除或削弱终产物对关键酶的反馈抑制有利于L-缬氨酸的积累。
2.2.2 过表达代谢途径关键基因
通过增加前体物质并解除反馈抑制后,增强关键基因在L-缬氨酸合成途径中的表达是进一步提高其产量的一种策略。例如,过表达关键酶AHAS编码基因 ilvBN1M,使 L-缬氨酸产量提高了40%[24];有研究发现过表达ilvBNC、ilvBNCD或ilvBNCE基因簇是促进L-缬氨酸生物合成更加有效的策略[12]。在ilvBN1M后分别串联表达ilvc和ilvD和ilvE,L-缬氨酸产量提高到43.4 g/L[24]。BARTEK等[30]利用pJC4质粒在C.glutamicum过表达基因簇ilvBNCDE,该基因簇的过表达有效转化丙酮酸使其质量浓度降为0.09 g/L;同时,减少了细胞外其他副产物的合成,最终通过补料分批发酵L-缬氨酸产量达到24.6 g/L。在C.glutamicum ATCC 13032中增加ilvBNXV基因拷贝数为2个时,L-缬氨酸产量达到了18.58 g/L;当在基因组中增加该基因拷贝数为3个时,L-缬氨酸产量提高到20.49 g/L[19]。与此策略类似,在C.glutamicum中表达双拷贝突变操纵子ilvB*N*C*使L-缬氨酸产量提高了34.2%,达到38.1 g/L,最后将Ptuf-ilvB*N*C*的第3个拷贝整合到菌株中,使产量提高到43.5 g/L[20]。
除此之外,替换重要基因的启动子也被广泛用于代谢改造中。强启动子Ptac、Psod和Ptuf等启动子已被用于提高C.glutamicum生产氨基酸关键酶的表达水平[15]。WEI等[29]发现C.glutamicum CP中一个新的强启动子PCP_2454,它能够以较高的转录水平稳定地表达,L-缬氨酸的产量提高了58.5%。
2.3 平衡优化辅因子
微生物细胞体内的许多生化反应都需要辅因子的参与,其中,NADPH的循环再生对细胞生长和代谢至关重要。在C.glutamicum中,每合成1分子L-缬氨酸需要消耗2分子NADPH;其中1分子NADPH驱动AHAIR酶促还原,另1分子NADPH参与谷氨酸脱氢酶反应,为最终的转氨化反应提供氨基[27]。BARTEK等[30]敲除编码葡萄糖-6-磷酸异构酶的基因pgi,使更多的碳流流向磷酸戊糖途径中,细胞内NADPH浓度显著升高,L-缬氨酸产率从0.49 g/g提高到0.67 g/g,产量提高了82.3%。敲除ATP合酶操纵子基因 cg1360导致菌株在指数生长阶段葡萄糖消耗速率比对照提高了28%,发酵72 h后,细胞内NADH和NADPH水平分别增加了40%和42%,L-缬氨酸产量达到9.2 g/L[31]。另一项研究表明,过表达大肠杆菌的吡啶核苷酸转氢酶(pyridine nucleotide transhydrogenase, STH)编码基因pntAB,可以有效地提高C.glutamicum中NADPH的利用率,该酶可催化NADH向NADPH的可逆转化,当pntAB与NAD+激酶编码基因ppnK共同过表达时导致NADPH浓度显著升高[32]。
在L-缬氨酸合成过程中,存在磷酸戊糖途径产生的NADPH供应不足,且在有氧条件下糖酵解产生的NADH很难被转化为NADPH的现象。针对这一问题,科研工作者通过对相关酶进行异源替换或对其定点突变的方式从而改变辅因子的偏好。HAO等[33]通过引入异源 Entner-Doudoroff 途径平衡辅因子,使L-缬氨酸产量提高了22.13%,达到21.25 g/L。赵阔等[21]将Ilvc氨基酸残基进行定点突变以及引入球形赖氨酸芽孢杆菌中的 NADH依赖型亮氨酸脱氢酶替换C.glutamicum的IlvE,转换了AHAIR和TA的辅因子偏好性,提高了糖耗速率,最终在5L发酵罐中发酵48 h后,L-缬氨酸的产量和产率分别达到了110 g/L和0.51 g/g。由此可见,辅因子水平的失衡限制了L-缬氨酸的高效合成,改善辅因子的供给可以显著提升葡萄糖从头合成L-缬氨酸的生产能力。
2.4 削减竞争支路
在生物合成过程中,副产物的积累会降低目标产物的产量。如L-异亮氨酸、L-亮氨酸和D-泛酸(图1),它们会消耗用于L-缬氨酸生产所需的辅因子、前体物质和酶,导致无法有效提高L-缬氨酸的产量。另外,科研工作者要考虑在积累目标产物的过程中,除了要抑制竞争代谢途径以最大限度地减少副产物的形成,还要保持菌株在可能形成缺乏营养的培养基上生长的能力。
由ilvA编码的苏氨酸脱水酶(threonine dehydratase,TD)催化苏氨酸生成L-异亮氨酸的前体物质2酮丁酸[34],而AHAS对2酮丁酸的亲和力大于合成L-缬氨酸的前体物质丙酮酸,这导致在2酮丁酸存在时反应倾向于合成L异亮氨酸[35],因此减少L-异亮氨酸形成的最直接方法就是降低细胞中2-酮丁酸的浓度。在C.glutamicum ATCC 13869中同时敲除aceE、alaT和ilvA导致L-缬氨酸产量增加44倍[28];但与此同时会产生L-异亮氨酸的营养缺陷株。对此,RADMACHER等[36]在敲除ilvA基因的菌株培养基中额外添加1.1 mmol/L的L-异亮氨酸使菌株正常生长,这增加了生产成本。上述研究发现直接阻断竞争产物的代谢途径会产生营养缺陷型菌株或影响细胞正常生长,因此,多数研究者们并不完全让ilvA基因的活性丧失,而是弱化其启动子,使基因表达量减少,降低L-异亮氨酸合成的同时尽量维持细胞的生理活性不受干扰,进一步增加L-缬氨酸的产量。HOU等[37]在C.glutamicum ATCC 13032中串联表达定点突变的ilvEBNrC 基因后,敲除alaT并用比原生启动子活性低13倍的突变型启动子MpilvA(P-ilvAM1CG)弱化ilvA,L-缬氨酸产量达到了31.5 g/L。
此外,L-亮氨酸的合成会竞争L-缬氨酸的前体物质α-酮基异戊酸,而2-异丙基苹果酸合成酶(2-isopropyl malate synthase,IPMS)是合成其的关键酶[38]。因此,敲除或者削弱leuA基因编码的IPMS,可以有效地减少L-亮氨酸的积累,如替换原始启动子为弱突变型启动子以减弱基因leuA和ilvA的活性,使L-缬氨酸产量提高了40%左右[39]。
同样,panB和 panC基因编码的酮泛解酸羟甲基转移酶(ketopantoate hydroxymethyltransferase,KHT)是D-泛酸合成关键酶基因。单独敲除panB或者共同敲除这两个基因可以阻断D-泛酸的合成,有利于提高L-缬氨酸的产量[40]。在C.glutamicum ATCC 13032ΔilvA中敲除panBC能进一步提高L-缬氨酸产量,ATCC 13032ΔilvAΔpanBC pJC1ilvBNCD在摇瓶发酵48 h后能积累11 g/L的L-缬氨酸[36]。此外,在菌株ilvNM13中敲除基因panB和基因ilvA并过表达ilvBNC,筛选出的无质粒菌株经过48 h发酵可产15.2 g/L的L-缬氨酸[41]。使用无质粒的菌株可以减少质粒给细胞代谢带来额外的负担,同时避免加入抗生素后对环境的影响。
2.5 强化输出途径
目标产物的最终产量不仅取决于它在细胞内的合成,还取决于转运系统的效率。当目标产物在细胞内积累到一定程度时,会抑制相关酶的活性,进而对其生产造成不利影响,因此提高目标产物的胞外转运能力有利于积累终产物。
在C.glutamicum中,负责将L-缬氨酸分泌到胞外的蛋白由brnF和brnE分别编码的两个亚基组装为膜转运酶BrnFE, BrnFE也是L-亮氨酸、L-异亮氨酸和 L-甲硫氨酸的转运蛋白,且BrnFE的表达受全局调控因子Lrp的调控[42]。Lrp能够结合到lrp与brnF之间的基因间隔区域,激活brnFE操纵子的转录以增强其表达[36]。CHEN等[28]分别过表达brnFE和lrp时,L-缬氨酸产量提高2.7倍和16倍,但过表达lrp抑制菌体生长;而来源VWB-1的突变体LrpArg39Trp被证明不仅可以促进L-缬氨酸的积累,使L-缬氨酸产量提高17.5倍,还能减弱对菌体生长的抑制作用。侯英婕[43]对经过多轮诱变的L-缬氨酸生产菌株VHL-1进行测序后发现 Lrp1存在S124 N突变,将Lrp1与brnFE共同过表达后摇瓶发酵可积累36.7 g/L 的L-缬氨酸,相较于出发菌株提高了25.2%,这些结果进一步阐明lrp和brnFE对L-缬氨酸产量影响显著。
MUSTAFI等[44]建立了对L-缬氨酸具有高亲和力的Lrp生物传感器,可以在线监测细胞中L-缬氨酸的产量。Lrp生物传感器也成功地应用于高通量筛选中,为随机诱变产L-缬氨酸高产菌株提供了手段[45]。例如在含有质粒编码的Lrp生物传感器的菌株C.glutamicum ATCC 13032ΔaceE 进行实验室进化,经过几轮迭代,进化菌株的生长速度显著提高,且L-缬氨酸产量增加25%,副产物生成减少3~4倍;同时发现,基因组内共积累了7个SNPs(single nucleotide polymorphism),这能够迅速识别有希望的候选基因进行下一步分析;基因组测序结果显示,在编码脲酶辅助蛋白的基因ureD中发现了一个功能缺失突变(ureD-e188*),该突变可使L-缬氨酸的产量增加高达100%[46]。Lrp生物传感器驱动菌株适应性进化还可以结合常压室温等离子体诱变,诱变菌株采用荧光激活细胞分选筛选得到的突变株产量为3.2 g/L,比原菌株提高了21.47%[47]。
迄今为止,由Lrp生物传感器驱动的定向进化已经提高了L-缬氨酸产生菌株的性能。MA等[19]利用Lrp生物传感器诱导tetR的表达从而动态调控TCA循环中柠檬酸合酶的表达,利用这种自我调节的系统在无需添加诱导剂的条件下平衡菌体生长与L-缬氨酸的生产,最终在5L发酵罐中有氧发酵38 h L-缬氨酸的产量达到了103 g/L,且没有L-丙氨酸、乳酸、醋酸、琥珀酸以及1,3-二羟基丙酮和甘油等副产物的积累。这些结果表明生物传感器驱动的进化是提高微生物生产菌株生长和生产力的直接方法之一。
3 优化发酵工艺
除了通过代谢工程改造L-缬氨酸生产菌株外,优化发酵工艺对于提高L-缬氨酸的产量也具有重要意义。在发酵过程中,可以通过控制培养基的组成和发酵条件来实现对菌株代谢的调控。例如,优化C.glutamicum WCC003 (ΔilvAΔaceE) L-异亮氨酸和乙酸的添加量,使L-缬氨酸产量达到了51.2 g/L[28]。KONIEKOVA-RADOEHOVA等[48]发现以葡萄糖为碳源时,豆粕水解液是最佳的氮源,副产物生酸较少。侯英婕[43]先使用单因素试验对培养基中葡萄糖、硫酸铵、玉米浆粉、蛋白胨、K2HPO4 以及维生素 B1进行优化,在此基础上采用两水平的Plackett-Burman(PB)实验设计(N=12)评估各因素对产量的影响。随后,选取对产量具有显著影响的因素进行Box-Behnken(BB)响应面分析,确定最佳发酵培养基后进行5 L发酵罐补料分批培养,最终L-缬氨酸产量为(86.2±2.2) g/L,生产强度为1.2 g/(L·h),糖酸转化率为 0.3 g/g。
CHEN等[28]采用二级种子接种进一步促进菌体生长,使摇瓶发酵96 h后的菌体量和L-缬氨酸产量分别提高了63.5%和10.9%。由于生物素和氯化胆碱对于细胞膜的合成有重要的作用,徐达[49]对培养基中生物素的含量,以及氯化胆碱的添加方式和添加量进行优化,当添加50 μg/L的生物素并随着添加葡萄糖使氯化胆碱维持在1 g/L时,L-缬氨酸的产量提升到86.2 g/L,与原始培养基相比提高了34.7%,且糖酸转化率达到了36.5%。另外,采用膜偶联在线透析和葡萄糖限量供应发酵工艺有效减少了副产物L-丙氨酸的积累,且创新了一种在发酵过程中补料的同时还能放出相同体积发酵液的发酵工艺,达到了延长产酸高峰期从而提高产量的目的。石拓等[50]敲除参与C.glutamicum细胞壁肽聚糖合成途径2个关键基因murA(cgl0352)和 murB( cgl0353)构建出一株对温度敏感的易于产酸的菌株,在发酵过程中维持33 ℃发酵产量仅为19.8 g/L,而利用分段控温在5L发酵罐中33 ℃发酵15 h,然后将温度提高6 ℃进行后续发酵,产量达到了35.5 g/L。
控制发酵过程中的氧气含量可以进一步提高L-缬氨酸的产量,赵阔等[21]在前期进行有氧发酵,9 h后转为微溶氧发酵,菌株生产能力强于全程有氧发酵,L-缬氨酸产量和得率达到83.33 g/L 和 0.42 g/g,这种两阶段发酵方式显著降低通风和搅拌的能源成本,使生产过程更具经济效益。除此之外,为了延迟菌体的发酵时间,满足其生长需要,维持较高的生产速率,赵丽丽[51]在5 L发酵罐实验中确认了最佳的补糖方式后又比较了最佳的补氨方式,即遵循少量多次的原则用氨水替代NaOH溶液调节pH值以持续供给氮源,发酵60 h后L-缬氨酸产量为50.71 g/L。比摇瓶发酵和5 L罐补料分批发酵提高了20.16%和12.43%。以上结果表明,发酵条件的优化有利于获得更高产量的终产物。
4 总结与展望
L-缬氨酸广泛应用于食品、医药和化妆品等行业。随着L-缬氨酸市场需求量不断增加,采用更加绿色、经济、高效的方法生产L-缬氨酸至关重要。近年来,随着生物技术的不断发展,微生物发酵生产L-缬氨酸已成为主流方法,主要的手段包括解除关键酶反馈抑制、下调竞争途径减少副产物生成、平衡优化辅因子和能量需求、改造转运途径等多种策略,经过改造的部分菌株已具备了工业化生产的能力,表1列出了采用谷氨酸棒杆菌生产L-缬氨酸的主要进展。
表1 L-缬氨酸代谢途径改造策略部分汇总
Table 1 A partial summary of L-valine metabolic pathway modification strategies
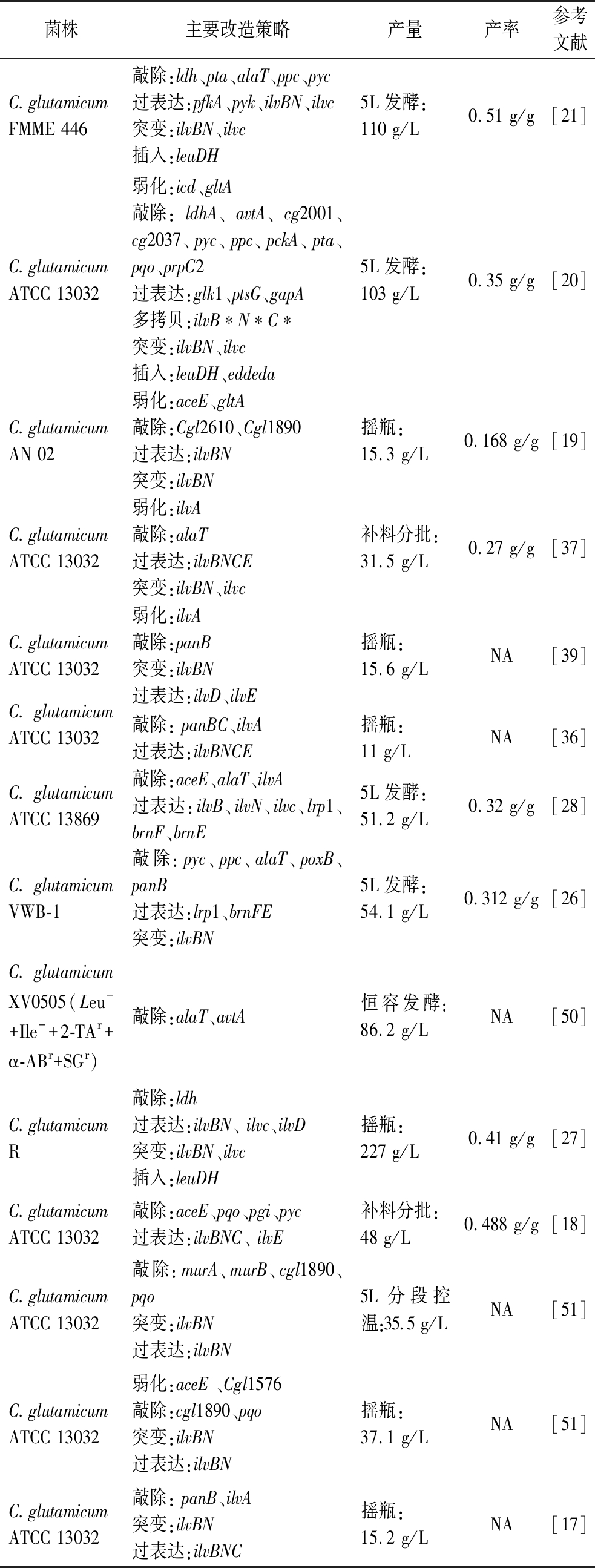
菌株主要改造策略产量产率参考文献C.glutamicumFMME 446敲除:ldh、pta、alaT、ppc、pyc过表达:pfkA、pyk、ilvBN、ilvc突变:ilvBN、ilvc插入:leuDH5L发酵:110 g/L0.51 g/g[21]C.glutamicum ATCC 13032弱化:icd、gltA敲除:ldhA、avtA、cg2001、cg2037、pyc、ppc、pckA、pta、pqo、prpC2过表达:glk1、ptsG、gapA多拷贝:ilvB∗N∗C∗突变:ilvBN、ilvc插入:leuDH、eddeda5L发酵:103 g/L0.35 g/g[20]C.glutamicumAN 02弱化:aceE、gltA敲除:Cgl2610、Cgl1890过表达:ilvBN突变:ilvBN摇瓶:15.3 g/L0.168 g/g[19]C.glutamicum ATCC 13032弱化:ilvA敲除:alaT过表达:ilvBNCE突变:ilvBN、ilvc补料分批:31.5 g/L0.27 g/g[37]C.glutamicum ATCC 13032弱化:ilvA敲除:panB突变:ilvBN过表达:ilvD、ilvE摇瓶:15.6 g/LNA[39]C.glutamicum ATCC 13032敲除: panBC、ilvA过表达:ilvBNCE摇瓶:11 g/LNA[36]C.glutamicum ATCC 13869敲除:aceE、alaT、ilvA过表达:ilvB、ilvN、ilvc、lrp1、brnF、brnE5L发酵:51.2 g/L0.32 g/g[28]C.glutamicum VWB-1敲除:pyc、ppc、alaT、poxB、panB过表达:lrp1、brnFE突变:ilvBN5L发酵:54.1 g/L0.312 g/g[26]C.glutamicum XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr)敲除:alaT、avtA恒容发酵:86.2 g/LNA[50]C.glutamicumR敲除:ldh过表达:ilvBN、 ilvc、ilvD突变:ilvBN、ilvc插入:leuDH摇瓶:227 g/L0.41 g/g[27]C.glutamicum ATCC 13032敲除:aceE、pqo、pgi、pyc过表达:ilvBNC、 ilvE补料分批:48 g/L0.488 g/g[18]C.glutamicum ATCC 13032敲除:murA、murB、cgl1890、pqo突变:ilvBN过表达:ilvBN5L分段控温:35.5 g/LNA[51]C.glutamicum ATCC 13032弱化:aceE 、Cgl1576敲除:cgl1890、pqo突变:ilvBN过表达:ilvBN摇瓶:37.1 g/LNA[51]C.glutamicum ATCC 13032敲除: panB、ilvA突变:ilvBN过表达:ilvBNC摇瓶:15.2 g/LNA[17]
注:NA表示文献中未提及。
由于微生物体内各种代谢途径相互交织、相互影响,导致对一些单个基因进行改造优化时,产生一些代谢负荷和生长阻碍,微生物细胞工厂高效合成L-缬氨酸仍存在一定挑战。因此,后续的研究可以着重于以下几个方面:a)利用动态调控策略,如使用温敏型启动子、氧气感应元件或开发基于核糖开关、前导肽、蛋白质翻译元件及酶偶联等类型的生物传感器,感应外界环境因素或代谢物浓度,实现基因表达的动态调控,平衡菌株生长与产物高产率合成的关系;b)在同一体系内人为构建两种或多种菌株的共培养环境,通过模块化设计实现菌株的分工与合作,以此降低各菌株的代谢负荷,为不同的代谢模块选择最适合的菌株来表达需要的酶,提高生产效率;c)为了促进经济社会可持续发展和环境保护,选用廉价丰富的可再生碳源,例如将木质纤维素、乙酸、甘油、甲醇等单一或者混合利用作为生物原料,推进以此进行高效生物转化的工业化进程;d)随着生物信息学的发展,未来还可以结合基因信息、人工智能、大数据分析等方法对关键酶进行挖掘和修饰,促进L-缬氨酸产量的提升;还可以利用蛋白质的结构信息和蛋白质定向进化等方法对L-缬氨酸转运蛋白设计改造,使L-缬氨酸更高效的分泌到胞外,避免胞内的积累并简化后续的分离纯化过程,以期满足不断增长的市场需求,创造更大的经济效益。
[1] NEINAST M, MURASHIGE D, ARANY Z.Branched chain amino acids[J].Annu Rev Physiol, 2019, 81:139-164.
[2] KARAU A, GRAYSON I.Amino acids in human and animal nutrition[J].Advances in Biochemical Engineering/Biotechnology, 2014, 143:189-228.
[3] ZHANG S H, ZENG X F, REN M, et al.Novel metabolic and physiological functions of branched chain amino acids:A review[J].Journal of Animal Science and Biotechnology, 2017, 8:10.
[4] 夏春秋, 万发春, 刘磊, 等.缬氨酸的生物学功能及其在畜禽日粮中的应用[J].畜牧兽医学报, 2023, 54(11):4502-4513.
XIA C Q, WAN F C, LIU L, et al.Valine:Biological function and application in livestock and poultry diets[J].Acta Veterinaria et Zootechnica Sinica, 2023, 54(11):4502-4513.
[5] WU G Y.Amino acids:Metabolism, functions, and nutrition[J].Amino Acids, 2009, 37(1):1-17.
[6] KAWAGUCHI T, IZUMI N, CHARLTON M R, et al.Branched-chain amino acids as pharmacological nutrients in chronic liver disease[J].Hepatology, 2011, 54(3):1063-1070.
[7] BISHOP C A, SCHULZE M B, KLAUS S, et al.The branched-chain amino acids valine and leucine have differential effects on hepatic lipid metabolism[J].FASEB Journal, 2020, 34(7):9727-9739.
[8] CHEN X H, LIU S R, PENG B, et al.Exogenous L-valine promotes phagocytosis to kill multidrug-resistant bacterial pathogens[J].Frontiers in Immunology, 2017, 8:207.
[9] PARK J G, TAK W Y, PARK S Y, et al.Effects of branched-chain amino acids (BCAAs) on the progression of advanced liver disease:A Korean nationwide, multicenter, retrospective, observational, cohort study[J].Medicine, 2017, 96(24):e6580.
[10] SUZUKI M, SATO T, KUROSE A, et al.New low-molecular weight gelators based on L-valine and L-isoleucine with various terminal groups[J].Tetrahedron Letters, 2005, 46(16):2741-2745.
[11] 潘毅, 张雪洪.L-缬氨酸生产工艺研究进展[J].广东化工, 2013, 40(3):79-80.
PAN Y, ZHANG X H.L-valine production technology research progress[J].Guangdong Chemical Industry, 2013, 40(3):79-80.
[12] PARK J H, LEE S Y.Fermentative production of branched chain amino acids:A focus on metabolic engineering[J].Applied Microbiology and Biotechnology, 2010, 85(3):491-506.
[13] WENDISCH V F.Metabolic engineering advances and prospects for amino acid production[J].Metabolic Engineering, 2020, 58:17-34.
[14] WANG Y Y, SHI K, CHEN P D, et al.Rational modification of the carbon metabolism of Corynebacterium glutamicum to enhance L-leucine production[J].Journal of Industrial Microbiology &Biotechnology, 2020, 47(6-7):485-495.
[15] OLDIGES M, EIKMANNS B J, BLOMBACH B.Application of metabolic engineering for the biotechnological production of L-valine[J].Applied Microbiology and Biotechnology, 2014, 98(13):5859-5870.
[16] WANG X Y, ZHANG H L, QUINN P J.Production of L-valine from metabolically engineered Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology, 2018, 102(10):4319-4330.
[17] EIKMANNS B J, BLOMBACH B.The pyruvate dehydrogenase complex of Corynebacterium glutamicum:An attractive target for metabolic engineering[J].Journal of Biotechnology, 2014, 192:339-345.
[18] BLOMBACH B, SCHREINER M E, BARTEK T, et al.Corynebacterium glutamicum tailored for high-yield L-valine production[J].Applied Microbiology and Biotechnology, 2008, 79(3):471-479.
[19] MA Y C, CHEN Q X, CUI Y, et al.Comparative genomic and genetic functional analysis of industrial L-leucine- and L-valine-producing Corynebacterium glutamicum strains[J].Journal of Microbiology and Biotechnology, 2018, 28(11):1916-1927.
[20] WANG F A, CAI N Y, LENG Y L, et al.Metabolic engineering of Corynebacterium glutamicum for the high-level production of L-valine under aerobic conditions[J].ACS Synthetic Biology, 2024, 13(9):2861-2872.
[21] 赵阔, 程金宇, 郭亮, 等.谷氨酸棒杆菌代谢工程高效生产L-缬氨酸[J].生物工程学报, 2023, 39(8):3253-3272.
ZHAO K, CHENG J Y, GUO L, et al.Highly efficient production of L-valine by multiplex metabolic engineering of Corynebacterium glutamicum[J].Chinese Journal of Biotechnology, 2023, 39(8):3253-3272.
[22] PARK J, SHIN H, LEE S M, et al.RNA-guided single/double gene repressions in Corynebacterium glutamicum using an efficient CRISPR interference and its application to industrial strain[J].Microbial Cell Factories, 2018, 17(1):4.
[23] 杜丽红, 熊海波, 徐达, 等.利用谷氨酸棒杆菌CRISPRi系统构建L-缬氨酸高产菌株[J].食品与发酵工业, 2020, 46(17):1-8.
DU L H, XIONG H B, XU D, et al.Construction of L-valine production strain by CRISPRi system of Corynebacterium glutamicum[J].Food and Fermentation Industries, 2020, 46(17):1-8.
[24] 张海灵. 系统代谢工程改造谷氨酸棒状杆菌生产L-缬氨酸[D].无锡:江南大学, 2018.
ZHANG H L.Production of L-valine by Corynebacterium glutamicum modified by systematic metabolic engineering[D].Wuxi:Jiangnan University, 2018.
[25] WADA M, HIJIKATA N, AOKI R, et al.Enhanced valine production in Corynebacterium glutamicum with defective H+-ATPase and C-terminal truncated acetohydroxyacid synthase[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(11):2959-2965.
[26] GUO Y F, HAN M, YAN W L, et al.Generation of branched-chain amino acids resistant Corynebacterium glutamicum acetohydroxy acid synthase by site-directed mutagenesis[J].Biotechnology and Bioprocess Engineering, 2014, 19(3):456-467.
[27] HASEGAWA S, UEMATSU K, NATSUMA Y, et al.Improvement of the redox balance increases L-valine production by Corynebacterium glutamicum under oxygen deprivation conditions[J].Applied and Environmental Microbiology, 2012, 78(3):865-875.
[28] CHEN C, LI Y Y, HU J Y, et al.Metabolic engineering of Corynebacterium glutamicum ATCC13869 for L-valine production[J].Metabolic Engineering, 2015, 29:66-75.
[29] WEI H B, MA Y C, CHEN Q X, et al.Identification and application of a novel strong constitutive promoter in Corynebacterium glutamicum[J].Annals of Microbiology, 2018, 68(6):375-382.
[30] BARTEK T, ZÖNNCHEN E, KLEIN B, et al.Analysing overexpression of L-valine biosynthesis genes in pyruvate-dehydrogenase-deficient Corynebacterium glutamicum[J].Journal of Industrial Microbiology &Biotechnology, 2010, 37(3):263-270.
[31] WANG X C, YANG H Y, ZHOU W, et al.Deletion of cg1360 affects ATP synthase function and enhances production of L-valine in Corynebacterium glutamicum[J].Journal of Microbiology and Biotechnology, 2019, 29(8):1288-1298.
[32] ZHAN M L, KAN B J, DONG J J, et al.Metabolic engineering of Corynebacterium glutamicum for improved L-arginine synthesis by enhancing NADPH supply[J].Journal of Industrial Microbiology &Biotechnology, 2019, 46(1):45-54.
[33] HAO Y N, MA Q, LIU X Q, et al.High-yield production of L-valine in engineered Escherichia coli by a novel two-stage fermentation[J].Metabolic Engineering, 2020, 62:198-206.
[34] LIANG C W, HUO Y L, QI G F, et al.Enhancement of L-valine production in Bacillus licheniformis by blocking three branched pathways[J].Biotechnology Letters, 2015, 37(6):1243-1248.
[35] CORDES C, MÖCKEL B, EGGELING L, et al.Cloning, organization and functional analysis of IlvA, IlvB and Ilvc genes from Corynebacterium glutamicum[J].Gene, 1992, 112(1):113-116.
[36] RADMACHER E, VAITSIKOVA A, BURGER U, et al.Linking central metabolism with increased pathway flux:L-valine accumulation by Corynebacterium glutamicum[J].Applied and Environmental Microbiology, 2002, 68(5):2246-2250.
[37] HOU X H, CHEN X D, ZHANG Y, et al.(L)-Valine production with minimization of by-products’ synthesis in Corynebacterium glutamicum and Brevibacterium flavum[J].Amino Acids, 2012, 43(6):2301-2311.
[38] 张伟国, 程功.微生物发酵法生产L-亮氨酸的研究进展[J].食品与生物技术学报, 2015, 34(2):113-120.
ZHANG W G, CHENG G.Progress on microbial fermentation production of L-leucine[J].Journal of Food Science and Biotechnology, 2015, 34(2):113-120.
[39] HOL TKO J, ELI
TKO J, ELI
 KOV
KOV V, PROUZA M, et al.Metabolic engineering of the L-valine biosynthesis pathway in Corynebacterium glutamicum using promoter activity modulation[J].Journal of Biotechnology, 2009, 139(3):203-210.
V, PROUZA M, et al.Metabolic engineering of the L-valine biosynthesis pathway in Corynebacterium glutamicum using promoter activity modulation[J].Journal of Biotechnology, 2009, 139(3):203-210.
[40] MARIENHAGEN J, EGGELING L.Metabolic function of Corynebacterium glutamicum aminotransferases AlaT and AvtA and impact on L-valine production[J].Applied and Environmental Microbiology, 2008, 74(24):7457-7462.
[41] ELIS KOV
KOV V, P
V, P TEK M, HOL
TEK M, HOL TKO J, et al.Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glutamicum[J].Applied and Environmental Microbiology, 2005, 71(1):207-213.
TKO J, et al.Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glutamicum[J].Applied and Environmental Microbiology, 2005, 71(1):207-213.
[42] YIN L, SHI F, HU X, et al.Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulator Lrp and two-component export system BrnFE[J].Journal of Applied Microbiology, 2013, 114(5):1369-1377.
[43] 侯英婕. 代谢工程改造谷氨酸棒杆菌生产L-缬氨酸[D].无锡:江南大学, 2023.
HOU Y J.Metabolic engineering modified Corynebacterium glutamicum to produce L-valine[D].Wuxi:Jiangnan University, 2023.
[44] MUSTAFI N, GRÜNBERGER A, KOHLHEYER D, et al.The development and application of a single-cell biosensor for the detection of L-methionine and branched-chain amino acids[J].Metabolic Engineering, 2012, 14(4):449-457.
[45] MUSTAFI N, GRÜNBERGER A, MAHR R, et al.Application of a genetically encoded biosensor for live cell imaging of L-valine production in pyruvate dehydrogenase complex-deficient Corynebacterium glutamicum strains[J].PLoS One, 2014, 9(1):e85731.
[46] MAHR R, G TGENS C, G
TGENS C, G TGENS J, et al.Biosensor-driven adaptive laboratory evolution of L-valine production in Corynebacterium glutamicum[J].Metabolic Engineering, 2015, 32:184-194.
TGENS J, et al.Biosensor-driven adaptive laboratory evolution of L-valine production in Corynebacterium glutamicum[J].Metabolic Engineering, 2015, 32:184-194.
[47] HAN G Q, XU N, SUN X P, et al.Improvement of L-valine production by atmospheric and room temperature plasma mutagenesis and high-throughput screening in Corynebacterium glutamicum[J].ACS Omega, 2020, 5(10):4751-4758.
[48] KONIEKOVA-RADOEHOVA M, SMEAKAL F.PreParation of Bervibaeetrium sP.M27 mutantstrain Produeing Valine strain improved by ehemieal mutagenesis(confeernceabsatret)[J].Folia Mieorbiol, 1990, 35(6):496.
[49] 徐达. L-缬氨酸生产菌定向改造及其发酵过程精准控制研究[D].天津:天津科技大学, 2020.
XU D.Research on directional modification of L-valine producing bacteria and precise control of fermentation process[D].Tianjin:Tianjin University of Science and Technology, 2020.
[50] 石拓, 刘晓倩, 范晓光, 等.缬氨酸生产菌株的定向改造及发酵优化[J].食品与发酵工业, 2019, 45(5):19-24.
SHI T, LIU X Q, FAN X G, et al.Direct construction and fermentation optimization of valine producing strain[J].Food and Fermentation Industries, 2019, 45(5):19-24.
[51] 赵丽丽. L-缬氨酸高产菌的选育及其发酵条件研究[D].天津:天津科技大学, 2004.
ZHAO L L.Study on breeding and fermentation conditions of L-valine high yielding bacteria[D].Tianjin:Tianjin University of Science and Technology, 2004.