研究表明,我国成年居民肥胖率已超50%,城乡各年龄组居民肥胖率持续上升,增幅明显高于发达国家[1]。越来越多的证据表明,脂质代谢与肥胖之间有着密切的关系。因此,稳定的脂质代谢对维持人体健康起着关键的作用。胆汁酸(bile acid,BA)是一种含有24个碳原子胆烷酸衍生物,在肝脏中由胆固醇分解合成后进入肠道,主要在肠道中进行重吸收、代谢与排泄[2]。BA作为人体重要的代谢信号因子,在脂质代谢中起重要作用。近年来,BA在脂质代谢中的作用研究日益增多,BA含量变化与脂质代谢的异常密切相关,过多的BA在肠道内能加速脂肪乳化形成乳糜微粒,加快肠道吸收脂肪的速率,从而导致肥胖[3]。膳食纤维(dietary fiber,DF)是植物性食品中普遍存在的不易被人体消化酶消化及小肠吸收的物质,具有多种生物学活性。研究表明,DF可以通过多种机制调节肠道菌群和BA代谢,故通过摄入DF以调控肥胖等疾病受到人们的广泛关注[4]。然而DF与BA的相互作用很复杂,文章主要综述了DF在小肠中与BA的相互作用,与DF在大肠中通过调节肠道菌群结构和组成以调节信号传导和相关酶,进而影响BA代谢的机理和机制,以期为DF与BA相互作用的机制研究提供思路,为预防肥胖奠定理论基础。
1 BA的合成与代谢
1.1 BA的合成
BA根据结构可以划分为游离型和结合型;根据其是否进行菌群代谢转化可分为初级BA和二级BA。如表1所示,初级BA的合成包括经典途径和替代途径[1]。首先,7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)催化胆固醇几乎等量地生成2种游离型初级BA:胆酸(cholic acid,CA)和鹅去氧胆酸(chenodeoxycholic acid,CDCA),两者约占通过胆固醇转化产生的总BA的90%[5]。CYP7A1催化胆固醇生成7α-羟基胆固醇,经甾醇12α-羟化酶(sterol 12α-hydroxylase,CYP8B1)催化生成CA,如果没有CYP8B1,将生成CDCA。替代途径由27α-羟化酶(27α-hydroxylase,CYP27A1)和羟甾醇7α-羟化酶(hydroxysterol 7α-hydroxylase,CYP7B1)介导催化生成CDCA[6]。
表1 BA合成的基本途径
Table 1 The basic pathway of bile acid synthesis

分类反应类型原料相关酶合成的BA初级/游离BA经典途径胆固醇替代途径胆固醇CYP7A1CDCACYP7A1、CYP8B1CACYP27A1、CYP7B1CDCA次级BA解偶联、7α-脱羟基化初级BABSH、7α-脱羟化酶DCA、LCA解偶联、7β-差向异构化初级BABSH、7β-差向异构酶UDCA结合BA酰基偶联化初级BA-TCA、GCA
在肠道微生物的作用下,初级BA转化为二级BA。胆盐水解酶(bile salt hydrolase,BSH)是一种常见于小肠和结肠细菌中的酶,可水解BA与其氨基酸偶联物连接起来的酰胺键[7]。水解后,若发生7α-脱羟基化,则生成去氧胆酸(deoxycholic acid,DCA)和石胆酸(lithocholic acid,LCA)等二级BA;若进行7β-差向异构化,则生成熊去氧胆酸(ursodeoxycholic acid,UDCA)[5]。因此,肠道菌群在肠肝循环和调节BA代谢中起着重要作用。
结合BA由游离型BA在肝脏中生成。大部分与牛磺酸或甘氨酸的酰基偶联,形成结合型BA牛磺胆酸(taurocholic acid,TCA)和甘氨胆酸(glycocholic acid,GCA),以便在胆汁中分泌[8]。结合态BA具有强亲水性、高极性的特点,易与Na+、K+等离子结合,生成胆酸钠和胆酸盐。
1.2 BA的代谢
BA储存在胆汁中,当食物从胃部进入十二指肠时,胆囊受到胃液刺激收缩并分泌胆汁,BA随胆汁分泌进入肠道后,通过门静脉循环转运返回肝脏,然后重新分泌到肝脏中,该过程称为肠肝循环[9]。在肠肝循环各周期中,95%以上的BA经门静脉循环再进入肝脏,约5%的BA经解耦联、去羟基等代谢途径被代谢为二级BA,是微生物代谢的主要底物。排入肠道内的游离BA(LCA除外)主要在小肠部位通过扩散作用被动重吸收,而结合BA经小肠刷状缘的顶端钠依赖性BA转运蛋白(apical sodium-dependent bile acid transporter,ASBT),在回肠中以主动重吸收的方式进入小肠黏膜细胞,并结合回肠BA结合蛋白,再通过肝脏毛细胆管膜的胆盐输出泵(bile salt export pump,BSEP)和多药耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)运输到胆汁中[10]。再经BESP的作用BA被分泌入胆小管,以完成一次肠肝循环。正常人体内的BA储备总量约3~5 g,而人体每天对BA的需求总量远高于储备总量,每日新合成的BA远低于需求总量,故人体每天会进行多次的肠肝循环,不断从肠道中重吸收BA,以满足人体对BA的需求。肠肝循环对维持BA平衡和人体健康起着极其重要的作用。
1.3 BA受体的代谢调控作用
BA可激活法尼醇X受体(farnesoid X receptor,FXR)进行信号传导,参与BA合成的基因受到肝脏和/或肠道FXR的调控,其在调节BA合成与肠肝循环以维持BA稳态方面起核心作用。
据报道,FXR可活化小分子异源二聚体伴侣(small heterodimer partner,SHP)的转录,从而抑制CYP7A1、CYP8B1的表达[11],使BA维持在较低的水平以防止肝损伤和胆汁淤积;此外,FXR介导CYP27A1的抑制。FXR诱导相关转录因子表达并与CYP8B1、CYP27A1和CYP7B1的基因启动子结合,导致其表达显著降低。
除了在肝脏中调节BA合成具有重要作用外,FXR还被远端回肠中的BA激活[12],以调节各种BA转运蛋白的表达,进而调节BA的肠肝循环。FXR诱导BSEP将BA从肝细胞转运到胆管中,胆管将BA排入胆囊,最终进入十二指肠。BA分泌到肠道后,主要在回肠被ASBT接收到达肠上皮细胞,与回肠BA结合蛋白结合,并经肠道内的α/β异源二聚体运输至门静脉血,然后经钠-牛磺酸共转运多肽和有机阴离子转运体将BA从血液中摄取到肝细胞中,从而抑制肝脏对BA的摄取,这是FXR对BA重吸收的负调控,因此,FXR还充当传感器控制BA的重吸收和分泌,以防止BA在肠细胞中积聚,完成BA的肠肝循环。
2 DF在小肠中与BA的作用
小肠中存在的DF已被证明可以防止一些BA被重新吸收到肠肝循环中,这导致BA池大小发生变化,进而影响BA在回肠末端被重吸收。
2.1 DF对BA的吸附作用
DF的大分子结构赋予它特殊的理化性质,如高保水、吸附性等。研究表明,大豆纤维可以在肠道直接结合BA,通过吸附BA阻止其回到肝肠循环中[13]。洋车前子壳纤维由于其网络结构,可以吸附BA[14]。先前的报道显示,燕麦β-葡聚糖降胆固醇的机制可能是燕麦β-葡聚糖通过吸附胆汁酸促进胆汁酸的排泄,促使肝脏中的胆固醇转化为胆汁酸,从而降低胆固醇含量[15]。KERN等[16]在体外研究了BA与含DF食物残渣的结合。结果表明,含DF食物残渣能够吸附胆汁酸,并且其吸附的二羟基BA多于三羟基BA。分子对接可以从分子水平上反应DF与BA之间的关系。SINGH等[17]利用分子模拟技术,将BA与果胶、纤维素进行对接,发现两者可以通过化学键或物理方式结合,实现对BA的吸附。NAUMANN等[18]研究表明DF的吸附与BA的疏水性呈正相关,这表明两者之间的潜在机制是基于疏水相互作用。此外,WANG等[19]采用分子对接探讨大豆种皮多糖对BA的吸附作用,对接位主要为氧原子和氢原子,结果表明二者之间的相互作用力为氢键和疏水作用,其中,氢键是大豆种皮多糖和BA吸附的主要动力。DF的主要疏水部分是木质素,主要存在于植物的结构性成分中,木质素可能是BA吸附的主要成分。因此,通过消耗胆固醇及增加BA的合成来维持BA池的平衡,其作用机制可能是氢键和疏水相互作用导致BA被吸附在DF形成的网络上。
2.2 DF形成物理屏障对BA作用
最近的研究还表明,除了直接作用外,DF还能降低肠黏液的通透性[20]。有研究表明,羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)通过增加肠黏度使血浆胆固醇降低,并且血浆胆固醇的降低与羟甲基纤维素黏度对数之间呈线性关系。不同黏度等级的HPMC与在小肠内不滞留的纤维素相比,HPMC会导致小肠管壁黏度增加,并且REPPAS等[21]证实并扩展了这些发现,表明HPMC可以降低血浆胆固醇。其作用机制被解释为:非发酵型DF与肠道刷状缘多糖-蛋白复合体在肠道内形成一层流动缓慢、稳定的静止水层,这种静水屏障随肠道黏度升高而逐渐消失。静止水层的厚度成比例增大,通过阻挡BA再吸收作用以阻断肠道和肝脏中的BA循环[22]。综上所述,DF在小肠中对BA的作用机制为抑制BA的重吸收,通过DF的黏度和吸附直接作用于BA,或可溶性DF在小肠管腔中形成黏性静止水层,从而防止BA渗透,阻断BA的肠肝循环。
其他研究发现,BA与不溶性DF之间存在直接的分子关联[23]。BA与米糠、燕麦麸皮和富含β-葡聚糖大麦的结合与其可溶性DF含量不成比例,反而与不可溶性DF含量有关。具有高阳离子交换能力的不溶性DF会阻碍胶束的扩散或吸收,进而破坏胶束的稳定性,DF通过形成复杂的网络结构与BA进行结合[24]。因此,选择可溶性DF更有助于研究其与BA作用机制,不溶性DF与BA的作用机制也有待进一步研究。
3 DF在大肠中与BA的作用
3.1 DF增加BA的排泄
一些体内研究探讨了水溶性DF对BA排泄的影响。IACCARINO等[25]向高胆固醇血症大鼠饮食中添加分子质量不同的β-葡聚糖补充剂,分别为市售β-葡聚糖(100 kDa)、低分子质量β-葡聚糖(150 kDa)和中等分子质量β-葡聚糖(530 kDa)。结果发现与对照组相比,所有添加了β-葡聚糖饮食组均增加了高胆固醇血症大鼠粪便中次级BA的排泄,包括脱氧胆酸、猪去氧胆酸和石胆酸。其中,中等分子质量β-葡聚糖组显示粪便中的次级BA水平升高最为显著。作者将其归因于β-葡聚糖的高分子量和/或嵌段结构可调节次级BA的排泄,其能引起的黏度也最高,进而增强了BA与DF之间的结合能力,导致粪便中BA排泄量增加。据报道,燕麦中的β-葡聚糖和苹果中的果胶等纤维以及原花青素、儿茶素或单宁等多酚具有BA螯合活性,这可能导致BA在未被吸收的情况下进入结肠,进而被排泄或再次被结肠细菌转化为次级BA[26]。此外,可溶性DF通过网状结构包裹BA以抑制其活性,并随粪便排出体外。
3.2 肠道菌群调节BA代谢
肠道菌群是调控BA代谢的关键因素,表2中总结了参与BA代谢的主要菌群。肠道菌群调控BA代谢可分为4条路径:早期解离、去羟基化、脱氢和脱硫[27-29]。(a)BSH将宿主细胞产生的初级BA分解,使甘氨酸和牛磺氨酸基团从结合的BA中脱离,转变为游离型BA。BSH主要存在于乳酸菌、梭状芽胞杆菌、双歧杆菌、肠球菌、李斯特菌属、梭菌属中。(b)未被ASBT重吸收的初级BA进入结肠,通过梭状芽胞杆菌参与BA7α-去羟基化去除C7位上的羟基,初级BA代谢成次级BA,即来自CDCA的LCA和来自CA的DCA。(c)由肠道微生物产生的3α-羟类固醇脱氢酶、7α-羟类固醇脱氢酶和12α-羟类固醇脱氢酶,参与BA羟基氧化和特定的差向异构化,将脂溶性的有毒BA转化为无毒的水溶性BA。3α-羟类固醇脱氢酶广泛存在于产气荚膜梭菌、消化链球菌、和迟缓埃格特菌以及假单胞菌等中,7α-羟类固醇脱氢酶主要在拟杆菌、梭菌、大肠杆菌和瘤胃球菌中发现,12α-羟类固醇脱氢酶存在于梭状芽胞杆菌属中。(d)某些肠道微生物(如梭状芽孢杆菌S2)可通过分泌硫酸盐酶提高BA的脱硫率和促进BA的再吸收。肠道菌群的解离和脱羟基分别影响未结合BA和次级BA的形成,在调节BA池中起重要作用。
表2 参与BA代谢的主要菌群
Table 2 Major microbiota involved in bile acid metabolism

BA代谢肠道菌群BA去结合拟杆菌属、梭状芽胞杆菌属、乳酸菌、双歧杆菌属、李斯特菌属C7位脱羟基梭状芽胞杆菌属C3、C7和C12羟基异构化拟杆菌属、梭状芽胞杆菌属、埃希氏杆菌属、迟缓埃格特菌属、消化链球菌属、瘤胃球菌属脱硫作用梭状芽胞杆菌属、梭菌属、消化链球菌属、假单胞菌属
研究表明,燕麦β-葡聚糖阻止BA在回肠中的重吸收,从而导致其在盲肠和结肠向次级BA转化[18],次级BA谱的变化表明肠道菌群的有利变化。微生物转化作用增强了熊去氧胆酸的形成并降低了LCA的形成,LCA和熊脱氧胆酸均有明显的抗肿瘤活性,其中疏水性是影响胆酸盐细胞毒性的一个关键因素[30]。通过DF吸附BA改变其在大肠中细胞毒性和可用性,有助于了解DF调节BA代谢以及对人类健康的影响。DF通过改变肠道菌群的结构和组成以及增加BA的疏水性,促进BA的排泄,表3中总结了不同来源DF对肠道菌群和BA代谢的调控作用。
表3 不同DF对肠道菌群和BA代谢的调控作用
Table 3 Regulation of gut microbiota and BA metabolism by different DFs
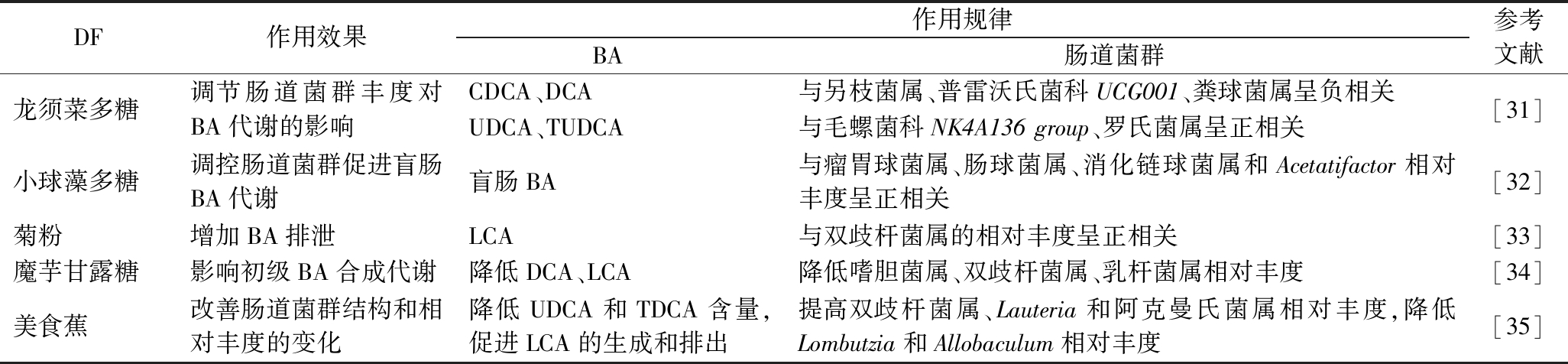
DF作用效果作用规律BA肠道菌群参考文献龙须菜多糖调节肠道菌群丰度对BA代谢的影响CDCA、DCA与另枝菌属、普雷沃氏菌科UCG001、粪球菌属呈负相关UDCA、TUDCA与毛螺菌科NK4A136 group、罗氏菌属呈正相关[31]小球藻多糖调控肠道菌群促进盲肠BA代谢盲肠BA与瘤胃球菌属、肠球菌属、消化链球菌属和Acetatifactor相对丰度呈正相关[32]菊粉增加BA排泄LCA与双歧杆菌属的相对丰度呈正相关[33]魔芋甘露糖影响初级BA合成代谢降低DCA、LCA降低嗜胆菌属、双歧杆菌属、乳杆菌属相对丰度[34]美食蕉改善肠道菌群结构和相对丰度的变化降低UDCA和TDCA含量,促进LCA的生成和排出提高双歧杆菌属、Lauteria和阿克曼氏菌属相对丰度,降低Lombutzia和Allobaculum相对丰度[35]
3.3 BA相关代谢信号因子的调控作用
BA是FXR的天然配体,它们可以激活FXR信号通路,在调控BA合成与代谢中起着至关重要的作用。表4中总结了几种BA相关代谢信号因子对BA代谢的调控作用,通过考虑其对关键肠肝过程和信号通路的影响,可能开发用于治疗肠肝轴中的部分疾病[39]。ZHANG等[36]研究表明,小鼠UDCA的口服给药对BA池的大小、组成、分布和排泄产生了独特的影响。在UDCA补充组中,分布在盲肠和结肠中的总BA的比例和数量显著增加,同时,粪便排泄的总BA量急剧升高。这可归因于偶联UDCAs是体内和体外肠道FXR的拮抗剂。UDCA给药显著抑制了肠道FXR mRNA和FXR蛋白的表达,同时,SHP和FGF15蛋白水平的下游伴侣降低。FXR则进一步调控相关的肝脏中BA合成酶的表达和回肠中BA转运蛋白的表达,以增强回肠对BA的重吸收。UDCA给药抑制了FXR信号传导和降低FGF15/19的水平,进而影响了相关的代谢信号因子,调控了体内BA的代谢,加速了BA肠肝循环频率。
表4 BA相关代谢信号因子的调控作用
Table 4 Regulation of bile acid-related metabolic signaling factors

代谢信号因子作用效果作用规律BA参考文献UDCA抑制肠道FXR信号转导和降低FGF15/19的水平进而上调CYP27A1和CYP7B1,诱导BA转运蛋白ASBT以及BSEP和MRP2的表达产生具有高丰度TUDCA和GUDCA的独特BA曲线[36]TUDCA激活FXR上调BSEP的表达,增加BA依赖性胆汁流量-[37]CDCACDCA与EE竞争激活FXR,上调BSEP的表达肝脏CYP7A1的抑制与肝脏FXR-SHP-CYP8B1通路的激活以及CYP27A1基因的上调回肠中,CA和DCA浓度显著降低,UDCA浓度显著升高[38]
CYP7A1和CYP8B1的基因表达主要由肝脏FXR-SHP-CYP7A1/CYP8B1通路和回肠FXR-FGF15-CYP7A1/CYP8B1通路决定,它们是协同构建回肠-肝脏FXR信号转导轴的最重要组成部分。在肝脏FXR-SHP-CYP7A1/CYP8B1通路中,BAs激活的肝脏FXR诱导SHP的mRNA表达,在转录水平上对CYP7A1和CYP8B1的基因表达具有抑制作用。此外,BAs的肝脏从头合成也受到回肠中FXR-FGF15-CYP7A1/CYP8B1通路的严格调控。在该途径中,通过回肠FXR起作用的BA诱导激素FGF15的表达,随后导致肝脏CYP7A1和CYP8B1的基因转录抑制[40]。
综上所述,FXR可受到其天然配体BA的调控,通过调节相关的BA合成酶和回肠中BA转运蛋白等信号因子的表达,进而调控BA的代谢,通过调节BA进而调控相关代谢性疾病受到广泛的关注。
3.4 DF通过调节肠道菌群调控BA受体
DF与肠道菌群和BA是相互关联的,众多体内体外研究表明,摄入DF能够改变肠道菌群的结构及其相对丰度,以影响信号传导和相关酶,进而影响BA代谢,表5中总结了不同DF通过调节肠道菌群对BA受体的调控作用。许多在人类肝脏和结肠细胞系中FXR的体外实验中发现,BA对FXR的活化程度依次为:CDCA>DCA>LCA>CA,游离BA比结合BA更能激活FXR[46-47]。LIU等[48]研究表明,岩藻多糖干预能有效地恢复结肠炎诱导的BA代谢障碍,这主要归因于肠道微生物群的改善。岩藻多糖通过增加毛螺菌科的相对丰度,例如苏黎世杆菌属、Muribaculum、副萨特氏菌属和Colidextribacter以调节BA代谢,从而导致FXR和TGR5的激活并进一步增强肠道屏障并抑制结肠炎症。肠道菌群可调节CYP7A1、CYP7B1和CYP27A1酶的表达。CHEN等[49]研究发现,添加低聚半乳糖和岩藻多糖组与高脂饮食组相比,其总BA含量显著降低,这可归因于褐藻多糖和低聚半乳糖提高了肝脏中CYP7A1的表达和小肠内容物BSH活性。低聚半乳糖显著增加疣微菌门、拟杆菌属、经黏液真杆菌属和阿克曼氏菌属相对丰度,但降低厚壁菌门相对丰度,褐藻多糖显著减少气球菌属和放线菌门相对丰度。这与先前的报道结果一致,与高脂饮食组相比,喂食复合阿拉伯木聚糖和木葡聚糖的小鼠不仅吸附BA,还激活了BA代谢途径中的关键受体FXR和TGR5,CYP7A1和CYP27A1被抑制并增加了拟杆菌属和阿克曼氏菌属的丰度以减少BA[41]。GUO等[50]研究表明,灰树花多糖可通过调控肠道微生态,影响BA合酶CYP7A1及胆盐输出泵的表达,从而调节BA代谢。结果显示,在小鼠的肠道中,罗氏菌属、Lachnoclostridium、Lachnospiraceae_NK4AB6_group、Rikenella、拟杆菌属和另枝菌属等均与CYP7A1和BSEP的表达存在显著的正相关,而链球菌、葡萄球菌、肠球菌和气球菌属则与BSEP的表达存在显著的负相关。
表5 不同DF通过调节肠道菌群对BA受体的调控作用
Table 5 Regulation of different DFs on BA receptors by modulating gut microbiota

DF作用效果肠道菌群BA受体参考文献阿拉伯糖复合木葡聚糖提高拟杆菌属和阿克曼氏菌属相对丰度激活FXR和TGR,抑制CYP7A1以减少BA[41]木葡聚糖复合菊粉增加双歧杆菌属的相对丰度激活FXR和TGR5[42]木葡聚糖增加双歧杆菌属的相对丰度影响FXR-SHP途径[43]菊粉增加拟杆菌门和厚壁菌门的相对丰度调节初级BA,影响FXR信号通路[44]龙须菜多糖提高粪球菌属、另枝菌属、Prevotellaceae_UCG-001和罗氏菌属的相对丰度上调LXRα和CYP7A1的表达[45]
综上所述,肠道菌群修饰BA以产生次级BA,DF通过改变肠道菌群的结构和组成,有利于BA的排泄。这种相互作用与BA受体和相关酶密切相关。
4 DF与BA相互作用的影响因素
4.1 DF的结构
不同来源的DF种类和含量不同,导致其与BA的结合能力不同。表6中总结了7种不同来源的DF与各BA的结合效果。ZHANG等[58]发现苹果皮纤维对胆酸钠的结合能力高于麦麸和大豆籽壳纤维。这可归因于DF的水溶性,不溶性DF会破坏胶束的稳定性,并阻碍胶束的扩散或吸收,进而阻碍其与BA的结合。同样,基于大豆、豇豆、鹰嘴豆和青豆的总DF的BA结合力分别为10%、21%、68%和19%,各种DF的BA结合能力不同可能与植物化学物质(类黄酮、单宁含量)、阴离子、阳离子、物理和化学结构、组成和代谢物或它们与活性结合位点的相互作用有关[59]。因此,需要进一步对DF特性进行剖析来解释其与BA结合率的差异性。
表6 不同来源DF与BA的结合能力
Table 6 Binding ability of dietary fiber from different sources to bile acids
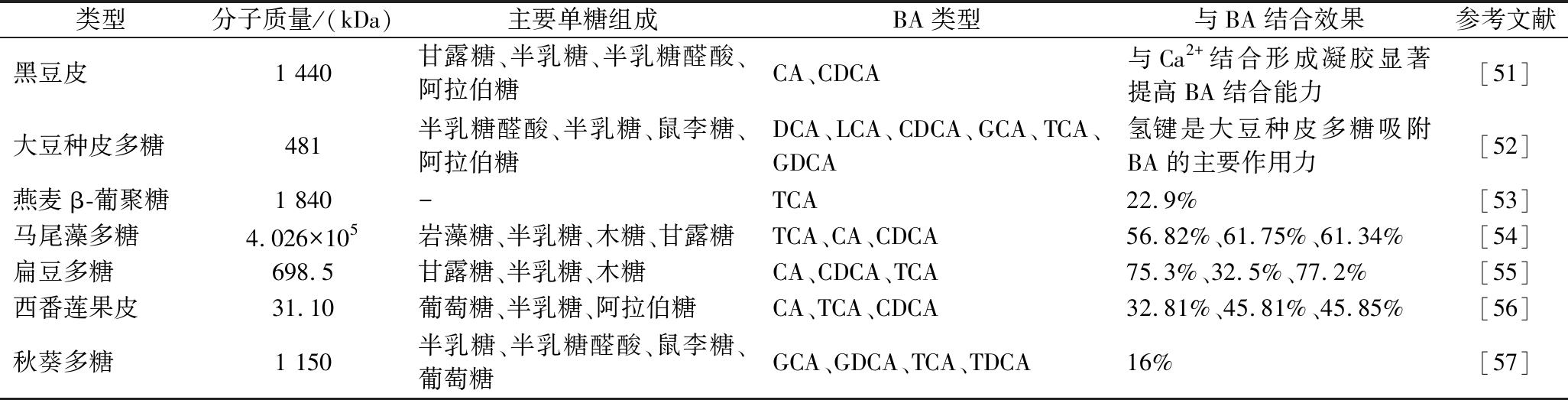
类型分子质量/(kDa)主要单糖组成BA类型与BA结合效果参考文献黑豆皮1 440甘露糖、半乳糖、半乳糖醛酸、阿拉伯糖CA、CDCA与Ca2+结合形成凝胶显著提高BA结合能力[51]大豆种皮多糖481半乳糖醛酸、半乳糖、鼠李糖、阿拉伯糖DCA、LCA、CDCA、GCA、TCA、GDCA氢键是大豆种皮多糖吸附BA的主要作用力[52]燕麦β-葡聚糖1 840-TCA22.9%[53]马尾藻多糖4.026×105岩藻糖、半乳糖、木糖、甘露糖TCA、CA、CDCA56.82%、61.75%、61.34%[54]扁豆多糖698.5甘露糖、半乳糖、木糖CA、CDCA、TCA75.3%、32.5%、77.2%[55]西番莲果皮31.10葡萄糖、半乳糖、阿拉伯糖CA、TCA、CDCA32.81%、45.81%、45.85%[56]秋葵多糖1 150半乳糖、半乳糖醛酸、鼠李糖、葡萄糖GCA、GDCA、TCA、TDCA16%[57]
DF的结构被证明与BA水平密切相关,这表明通过特定的膳食成分来调节BA代谢,能促进机体健康。DF与BA的结合能力与其黏度和疏水作用力有关。张馨月等[60]发现,在胡萝卜、米糠和柚子DF中,柚子不溶性DF黏度最高,从而使其显示出最强的胆酸钠结合能力。BA与DF在分子水平上结合,BA的黏度增加导致其胶束流动性降低[61],疏水相互作用被认为有助于BA滞留在小肠。因此,黏性纤维基质中的延迟扩散与BA的胶束性质有关。
而DF的黏度与其分子质量具有相关性。研究表明,分子质量越大的食物纤维溶液,其黏度越高,并且高分子质量的DF溶液即使在浓度较低时也具有一定的黏度[62]。窦祖满[63]的研究发现,随着多糖分子质量的降低,黑莓多糖对BA的结合能力降低,其原因可能是分子质量较高的多糖具有更高的黏度,从而表现出对BA结合的流体动力学限制,使多糖与BA之间的结合能力更强。此外,DF的提取方式也会影响其与BA的结合能力。例如从酸碱溶剂中提取的多糖由于碱溶液或高温将会引起多糖的糖苷键降解,从而使其分子质量降低,进而导致其与BA的结合能力受到相应的影响[55]。
基于上述结论,选择一种具有氢键和疏水相互作用,高分子质量,高浓度,具有较高的总糖、糖醛酸和硫酸盐含量和高度分支结构的DF测定其与BA结合能力,更有助于研究其相关机制。同时,仍然需要探究DF与人体BA相互作用的深层次机制。这不仅涉及到结构表征方面的细节问题,还包括了它们在体内如何协同工作以降低胆固醇水平的精确分子机制。
4.2 BA的结构
除了DF的因素外,BA的种类在DF与BA的结合中也发挥着重要作用。BA羟基化的程度强烈影响与富含DF的食品成分的吸附相互作用。NAUMANN等[64]的研究发现,羽扇豆子叶纤维能吸附CDCA,但对CA的吸附没有显著差异,表明随着BA羟基化程度的增加,吸附能力下降,氢键对吸附没有帮助,相反,CDCA的吸附能力高于CA,表明羽扇豆纤维组分与DF之间存在疏水作用。二羟基BA(CDCA和DCA)的吸附程度高于三羟基BA(CA),其中DCA表现出最高的吸附性。这些发现主要与BA的胶束特性有关,这是由疏水效应和氢键驱动的。一般来说,扩散速率随着温度的降低和黏度和/或颗粒半径的增加而降低,消化过程中的温度和黏度对所有BA的影响相同,扩散速率仅取决于扩散BA的半径。该半径与BA的临界胶束浓度(critical micelle concentration,CMC)和聚集数有关。其中,CMC是指聚合物链被表面活性剂分子完全饱和后,表面活性剂胶束开始形成时的浓度,不同BA的CMC不同。表7中总结了人体BA池中主要结合BA的这些参数。
表7 BA池中主要结合BA的聚集数和疏水性变化情况
Table 7 Aggregation number and hydrophobicity changes of the main bound bile acids in the bile acid pool
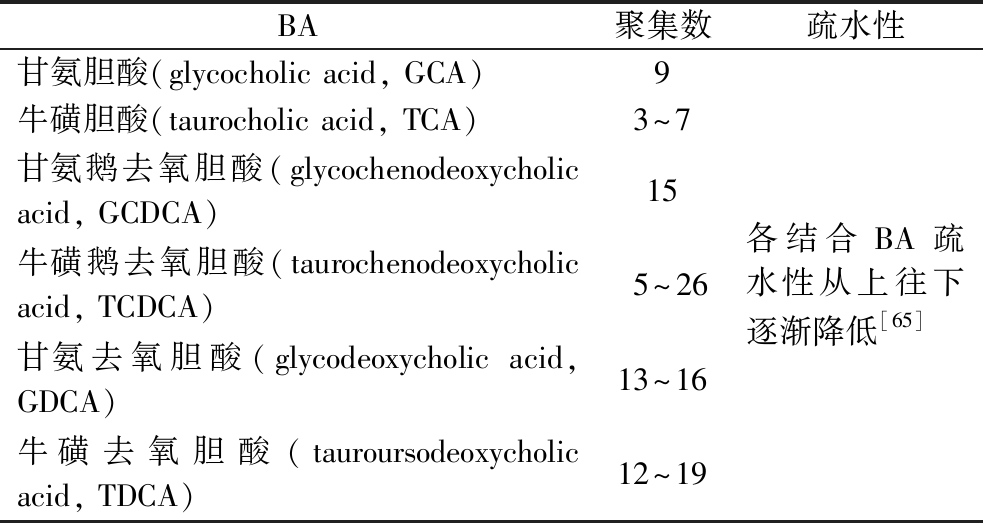
BA聚集数疏水性甘氨胆酸(glycocholic acid, GCA)9牛磺胆酸(taurocholic acid, TCA)3~7甘氨鹅去氧胆酸(glycochenodeoxycholic acid, GCDCA)15牛磺鹅去氧胆酸(taurochenodeoxycholic acid, TCDCA)5~26甘氨去氧胆酸(glycodeoxycholic acid, GDCA)13~16牛磺去氧胆酸(tauroursodeoxycholic acid, TDCA)12~19各结合BA疏水性从上往下逐渐降低[65]
BEHERA等[66]研究发现随着去氧胆酸钠浓度的增加,越来越多的DF结合去氧胆酸钠,直到聚合物被去氧胆酸钠饱和并位于去氧胆酸钠周围,继续增加去氧胆酸钠浓度,结果发现逐渐形成游离去氧胆酸钠胶束,并且游离去氧胆酸钠胶束与DF结合的去氧胆酸钠配合物共存。由于疏水相互作用是DF和去氧胆酸钠结合的主要驱动力,故胶束形成对BA释放的影响进一步说明了许多使用低于CMC的研究的局限性[67]。因此需要将纤维来源影响的黏度和吸附与人类胆汁中丰富的BA的结构特性联系起来。
一般来说,根据斯托克斯-爱因斯坦方程[31]的定义,扩散率会随着温度的降低、黏度和/或颗粒半径的增加而降低。由于消化过程中的温度和黏度对所有胆汁酸的影响相同,因此扩散速率完全取决于扩散胆汁酸的半径。该半径受CMC和聚集数控制,聚集数定义了胶束内单体的数量。
4.3 其他影响因素
DF中纤维三糖的数量会影响其与BA之间的结合,青稞β-葡聚糖单链上纤维三糖数量相比燕麦β-葡聚糖更高,纤维三糖的存在将有助于形成物理网络进而形成聚集和凝胶,从而有利于两者的结合[68]。这表明,高浓度的β-葡聚糖分子链之间的相互作用会更加强烈,从而进一步影响胆酸盐的扩散。此外,近年来的研究还表明,DF的含量和胆酸盐的结合能力成正相关性,而这些因子又会对BA的流动性产生明显的影响[69]。根据M KEL
KEL 等[70]的研究结果,黏度和凝胶结构的形成能够对BA结合产生显著影响,但若样品中的β-葡聚糖浓度太低时,将会导致其无法形成足够的黏度或凝胶结构,此时其他因素可能会占主导地位。因此,浓度是影响DF引起的黏度增加的关键因素,并且通过凝胶特性阻碍BA的重吸收。
等[70]的研究结果,黏度和凝胶结构的形成能够对BA结合产生显著影响,但若样品中的β-葡聚糖浓度太低时,将会导致其无法形成足够的黏度或凝胶结构,此时其他因素可能会占主导地位。因此,浓度是影响DF引起的黏度增加的关键因素,并且通过凝胶特性阻碍BA的重吸收。
pH值的变化可调控胆酸盐分子链间的聚集状态和胆酸盐的聚集尺寸,从而实现两者在一定的空间匹配,从而影响DF和胆酸盐的结合性能。相对于三羟基胆酸,β-葡聚糖在pH 6.4时对二羟胆酸具有更强的束缚作用,而pH值对二羟胆酸的抑制作用极为明显,这提示两者可能仅在特定的肠道内才能结合[71]。
此外,DF的成分也会影响其束缚BA的能力,例如多酚,不同的DF具有不同含量的多酚。据报道,多酚能形成吸附BA的疏水空间,由于这种相互作用,BA的胶束溶解度降低,从而减少吸收并增加粪便排泄[65]。
5 结论和展望
DF对BA代谢的作用可以分为2种方式。一种是DF通过吸附作用影响BA在肠腔的扩散,疏水相互作用和氢键是关键作用力,或是DF形成静止水层,也会影响BA在小肠中的重吸收;另一种是DF通过各级BA影响肠道菌群组成和结构,FXR受到其天然配体BA的调控,进而通过调节相关的BA合成酶和回肠中BA转运蛋白等信号因子的表达,进而调控BA的代谢,使肠道菌群的组成发生变化,有利于增加BA排泄量,维持BA池的稳态。
虽然大量研究人员对DF与BA的相互作用进行了研究,但各种相互作用之间存在的复杂影响因素仍待阐明,新种类的多糖可能会与BA产生新的效应,如DF结构差异(分子质量、单糖组成、糖苷键等)使其与BA之间的结合分子机制不够清晰,可以利用分子模拟解析DF与BA的结合位点,更加深入地探究二者的作用机制,并通过物理、化学或生物酶法对DF进行分子构象的修饰与转化,以验证BA与DF之间的作用机制,为DF在体内对BA代谢的精确调控提供参考,从而更好地发挥DF的功能作用。此外,宿主-肠道菌群-BA轴的动态变化错综复杂,不同化学结构和理化性质的DF表现出不同的生理作用,故DF对BA的调节机制、肠道菌群代谢产物和菌群结构的影响有待进一步研究。这将为基于肠道微生态学修饰的饮食指南提供重要信息,同时,可以根据不同人群的生理特点,合理开发功能性DF食品,以此调节慢性疾病,对提高人类生活质量和健康水平具有深远的意义。
[1] CHIANG J Y L, FERRELL J M.Bile acids as metabolic regulators and nutrient sensors[J].Annual Review of Nutrition, 2019, 39:175-200.
[2] 杜雪儿, 王菁, 姚军虎, 等.胆汁酸肠肝循环转运蛋白及FXR对其的调控机制[J].畜牧兽医学报, 2021, 52(10):2721-2739.
DU X E, WANG J, YAO J H, et al.Bile acid enterohepatic circulation transporter and its regulatory mechanism by FXR[J].Acta Veterinaria et Zootechnica Sinica, 2021, 52(10):2721-2739.
[3] LIU J X, LI Y, SUN C, et al.Geniposide reduces cholesterol accumulation and increases its excretion by regulating the FXR-mediated liver-gut crosstalk of bile acids[J].Pharmacological Research, 2020, 152:104631.
[4] TIAN S H, CHU Q, MA S T, et al.Dietary fiber and its potential role in obesity:A focus on modulating the gut microbiota[J].Journal of Agricultural and Food Chemistry, 2023, 71(41):14853-14869.
[5] FIORUCCI S, URBANI G, BIAGIOLI M, et al.Bile acids and bile acid activated receptors in the treatment of Covid-19[J].Biochemical Pharmacology, 2024, 228:115983.
[6] FUNABASHI M, GROVE T L, WANG M, et al.A metabolic pathway for bile acid dehydroxylation by the gut microbiome[J].Nature, 2020, 582(7813):566-570.
[7] RIMAL B, COLLINS S L, TANES C E, et al.Bile salt hydrolase catalyses formation of amine-conjugated bile acids[J].Nature, 2024, 626(8000):859-863.
[8] NEUGEBAUER K A, OKROS M, GUZIOR D V, et al.B aat gene knockout alters post-natal development, the gut microbiome, and reveals unusual bile acids in mice[J].Journal of Lipid Research, 2022, 63(12):100297.
[9] 李淑玲, 李闻.胆汁酸与肠道微生态的研究进展[J].胃肠病学和肝病学杂志, 2018, 27(4):466-470.
LI S L, LI W.The relationship between bile acid and intestinal microecology[J].Chinese Journal of Gastroenterology and Hepatology, 2018, 27(4):466-470.
[10] FUCHS C D, TRAUNER M. Role of bile acids and their receptors in gastrointestinal and hepatic pathophysiology[J]. Nature Reviews Gastroenterology &Hepatology, 2022, 19(7): 432-450.
[11] CHIANG J Y L, FERRELL J M.Bile acid receptors FXR and TGR5 signaling in fatty liver diseases and therapy[J].American Journal of Physiology.Gastrointestinal and Liver Physiology, 2020, 318(3):554-573.
[12] 宋波, 文国琴, 王蔺.胆汁酸代谢与肠道微生物[J].微生物学杂志, 2021, 41(3):107-112.
SONG B, WEN G Q, WANG L.Intestinal microorganisms and bile acid metabolism[J].Journal of Microbiology, 2021, 41(3):107-112.
[13] 袁尔东, 郑建仙, 陈智毅.多功能大豆纤维的降脂作用及其机理探讨[J].粮食与饲料工业, 2000(7):45-47.
YUAN E D, ZHENG J X, CHEN Z Y.Effect and mechanism of decreasing serum cholesterol of multifunctional soybean fiber[J].Cereal &Feed Industry, 2000(7):45-47.
[14] NIU Y G, XIA Q, JUNG W, et al.Polysaccharides-protein interaction of Psyllium and whey protein with their texture and bile acid binding activity[J].International Journal of Biological Macromolecules, 2019, 126:215-220.
[15] DRZIKOVA B, DONGOWSKI G, GEBHARDT E, et al.The composition of dietary fibre-rich extrudates from oat affects bile acid binding and fermentation in vitro[J].Food Chemistry, 2005, 90(1-2):181-192.
[16] KERN F, BIRKNER H J, OSTROWER V S.Binding of bile acids by dietary fiber 1 2[J].The American Journal of Clinical Nutrition, 1978, 31(10):S175-S179.
[17] SINGH J, METRANI R, SHIVANAGOUDRA S R, et al.Review on bile acids:Effects of the gut microbiome, interactions with dietary fiber, and alterations in the bioaccessibility of bioactive compounds[J].Journal of Agricultural and Food Chemistry, 2019, 67(33):9124-9138.
[18] NAUMANN S, SCHWEIGGERT-WEISZ U, EGLMEIER J, et al.In vitro interactions of dietary fibre enriched food ingredients with primary and secondary bile acids[J].Nutrients, 2019, 11(6):1424.
[19] WANG Z Y, YANG L N, XUE S, et al.Molecular docking and dynamic insights on the adsorption effects of soy hull polysaccharides on bile acids[J].International Journal of Food Science &Technology, 2022, 57(6):3702-3712.
[20] GRUNDY M M L, FARDET A, TOSH S M, et al.Processing of oat:The impact on oat’s cholesterol lowering effect[J].Food &Function, 2018, 9(3):1328-1343.
[21] REPPAS C, SWIDAN S Z, TOBEY S W, et al.Hydroxypropylmethylcellulose significantly lowers blood cholesterol in mildly hypercholesterolemic human subjects[J].European Journal of Clinical Nutrition, 2009, 63(1):71-77.
[22] EUSSEN S, KLUNGEL O, GARSSEN J, et al.Support of drug therapy using functional foods and dietary supplements:Focus on statin therapy[J].British Journal of Nutrition, 2010, 103(9):1260-1277.
[23] GUNNESS P, FLANAGAN B M, GIDLEY M J.Molecular interactions between cereal soluble dietary fibre polymers and a model bile salt deduced from13C NMR titration[J].Journal of Cereal Science, 2010, 52(3):444-449.
[24] NAUMANN S, SCHWEIGGERT-WEISZ U, BADER-MITTERMAIER S, et al.Differentiation of adsorptive and viscous effects of dietary fibres on bile acid release by means of in vitro digestion and dialysis[J].International Journal of Molecular Sciences, 2018, 19(8):2193.
[25] IACCARINO N, KHAKIMOV B, MIKKELSEN M S, et al.Structurally different mixed linkage β-glucan supplements differentially increase secondary bile acid excretion in hypercholesterolaemic rat faeces[J].Food &Function, 2020, 11(1):514-523.
[26] PUSHPASS R A G, ALZOUFAIRI S, JACKSON K G, et al.Circulating bile acids as a link between the gut microbiota and cardiovascular health:Impact of prebiotics, probiotics and polyphenol-rich foods[J].Nutrition Research Reviews, 2022, 35(2):161-180.
[27] SONG X Y, SUN X M, OH S F, et al.Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis[J].Nature, 2020, 577(7790):410-415.
[28] WANG C H, ZHU C P, SHAO L M, et al.Role of bile acids in dysbiosis and treatment of nonalcoholic fatty liver disease[J].Mediators of Inflammation, 2019, 2019:7659509.
[29] WINSTON J A, THERIOT C M.Diversification of host bile acids by members of the gut microbiota[J].Gut Microbes, 2020, 11(2):158-171.
[30] ZENG H W, UMAR S, RUST B, et al.Secondary bile acids and short chain fatty acids in the colon:A focus on colonic microbiome, cell proliferation, inflammation, and cancer[J].International Journal of Molecular Sciences, 2019, 20(5):1214.
[31] HUANG S M, PANG D R, LI X, et al.A sulfated polysaccharide from Gracilaria Lemaneiformis regulates cholesterol and bile acid metabolism in high-fat diet mice[J].Food &Function, 2019, 10(6):3224-3236.
[32] CHEN Y X, LIU X Y, WU L X, et al.Physicochemical characterization of polysaccharides from Chlorella pyrenoidosa and its anti-ageing effects in Drosophila melanogaster[J].Carbohydrate Polymers, 2018, 185:120-126.
[33] LANCASTER S M, LEE-MCMULLEN B, ABBOTT C W, et al.Global, distinctive, and personal changes in molecular and microbial profiles by specific fibers in humans[J].Cell Host &Microbe, 2022, 30(6):848-862.
[34] 邹晓莹, 邓婕, 钟静, 等.魔芋葡甘露聚糖通过肠道菌群-胆汁酸途径发挥降脂作用[J].食品科学, 2022, 43(23):113-124.
ZOU X Y, DENG J, ZHONG J, et al.Konjac glucomannan ameliorates hyperlipidemia via gut microbiota-bile acid pathway[J].Food Science, 2022, 43(23):113-124.
[35] 傅金凤. 美食蕉(Plantain)的降血糖功能及其作用机理研究[D].广州:华南理工大学, 2021.
FU J F.The anti-hyperglycemic effects of plantain and its mechanism[D].Guangzhou:South China University of Technology, 2021.
[36] ZHANG Y J, JIANG R Q, ZHENG X J, et al.Ursodeoxycholic acid accelerates bile acid enterohepatic circulation[J].British Journal of Pharmacology, 2019, 176(16):2848-2863.
[37] ZHAO J, SONG G C, WENG F Y, et al.The choleretic role of tauroursodeoxycholic acid exacerbates alpha-naphthylisothiocyanate induced cholestatic liver injury through the FXR/BSEP pathway[J].Journal of Applied Toxicology, 2023, 43(7):1095-1103.
[38] ZHANG F, XI L L, DUAN Y T, et al.The ileum-liver Farnesoid X Receptor signaling axis mediates the compensatory mechanism of 17α-ethynylestradiol-induced cholestasis via increasing hepatic biosynthesis of chenodeoxycholic acids in rats[J].European Journal of Pharmaceutical Sciences, 2018, 123:404-415.
[39] LIN H R.Natural products as farnesoid X receptor (FXR) agonists:Their interactions with FXR ligand binding region[J].Mini-Reviews in Organic Chemistry, 2016, 13(2):97-108.
[40] CHOW M D, LEE Y H, GUO G L.The role of bile acids in nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J].Molecular Aspects of Medicine, 2017, 56:34-44.
[41] CHEN H, CHENG J H, ZHOU S S, et al.Arabinoxylan combined with different glucans improve lipid metabolism disorder by regulating bile acid and gut microbiota in mice fed with high-fat diet[J].International Journal of Biological Macromolecules, 2021, 168:279-288.
[42] CHEN H, ZHOU S S, LI J W, et al.Xyloglucan compounded inulin or Arabinoxylan against glycometabolism disorder via different metabolic pathways:Gut microbiota and bile acid receptor effects[J].Journal of Functional Foods, 2020, 74:104162.
[43] CHENG J H, JIANG X J, LI J W, et al.Xyloglucan affects gut-liver circulating bile acid metabolism to improve liver damage in mice fed with high-fat diet[J].Journal of Functional Foods, 2020, 64:103651.
[44] 方城杰, 吴漫漫, 于海宁.膳食纤维对肠道菌群紊乱及脂代谢异常的修复作用[J].中国食品学报, 2021, 21(12):127-134.
FANG C J, WU M M, YU H N.Reparative action of dietary fiber on intestinal flora disorder and lipid metabolish[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):127-134.
[45] 黄诗铭. 龙须菜多糖调节脂质代谢及肠道菌群功效研究[D].广州:华南理工大学, 2019.
HUANG S M.Effect of Gracilaria lemaneiformis polysaccharide on regulating lipid metabolism and intestinal flora[D].Guangzhou:South China University of Technology, 2019.
[46] VAQUERO J, MONTE M J, DOMINGUEZ M, et al.Differential activation of the human farnesoid X receptor depends on the pattern of expressed isoforms and the bile acid pool composition[J].Biochemical Pharmacology, 2013, 86(7):926-939.
[47] SAYIN S I, WAHLSTRÖM A, FELIN J, et al.Gut microbiota regulates bile acid metabolism by reducing the levels of tauro-beta-muricholic acid, a naturally occurring FXR antagonist[J].Cell Metabolism, 2013, 17(2):225-235.
[48] LIU X X, ZHANG Y H, LI W H, et al.Fucoidan ameliorated dextran sulfate sodium-induced ulcerative colitis by modulating gut microbiota and bile acid metabolism[J].Journal of Agricultural and Food Chemistry, 2022, 70(47):14864-14876.
[49] CHEN Q C, LIU M, ZHANG P Y, et al.Fucoidan and galactooligosaccharides ameliorate high-fat diet-induced dyslipidemia in rats by modulating the gut microbiota and bile acid metabolism[J].Nutrition, 2019, 65:50-59.
[50] GUO W L, DENG J C, PAN Y Y, et al.Hypoglycemic and hypolipidemic activities of Grifola frondosa polysaccharides and their relationships with the modulation of intestinal microflora in diabetic mice induced by high-fat diet and streptozotocin[J].International Journal of Biological Macromolecules, 2020, 153:1231-1240.
[51] FENG Z Q, DOU W, ALAXI S, et al.Modified soluble dietary fiber from black bean coats with its rheological and bile acid binding properties[J].Food Hydrocolloids, 2017, 62:94-101.
[52] YANG L N, ZHANG H Y, ZHAO Y F, et al.Chemical structure, chain conformation and rheological properties of pectic polysaccharides from soy hulls[J].International Journal of Biological Macromolecules, 2020, 148:41-48.
[53] M KEL
KEL N, ROSA-SIBAKOV N, WANG Y J, et al.Role of β-glucan content, molecular weight and phytate in the bile acid binding of oat β-glucan[J].Food Chemistry, 2021, 358:129917.
N, ROSA-SIBAKOV N, WANG Y J, et al.Role of β-glucan content, molecular weight and phytate in the bile acid binding of oat β-glucan[J].Food Chemistry, 2021, 358:129917.
[54] LIN P C, CHEN S H, ZHONG S Y.Nutritional and chemical composition of Sargassum zhangii and the physical and chemical characterization, binding bile acid, and cholesterol-lowering activity in HepG2 cells of its fucoidans[J].Foods, 2022, 11(12):1771.
[55] DOU Z M, CHEN C, HUANG Q, et al.Comparative study on the effect of extraction solvent on the physicochemical properties and bioactivity of blackberry fruit polysaccharides[J].International Journal of Biological Macromolecules, 2021, 183:1548-1559.
[56] 孙永进. 西番莲果皮多糖的纯化、结构表征及体外降脂活性研究[D].桂林:桂林理工大学, 2023.
SUN Y J.In vitro lipid-lowering activity,purification, structuralcharacterization of polysaccharidesfractionated from passiflora edulis peel[D].Guilin:Guilin University of Technology, 2023.
[57] WU D T, HE Y, YUAN Q, et al.Effects of molecular weight and degree of branching on microbial fermentation characteristics of okra pectic-polysaccharide and its selective impact on gut microbial composition[J].Food Hydrocolloids, 2022, 132:107897.
[58] ZHANG N, HUANG C H, OU S Y.In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J].Journal of Hazardous Materials, 2011, 186(1):236-239.
[59] KAHLON T S, SHAO Q.In vitro binding of bile acids by soy bean (Glycine max), black eye bean (Vigna unguiculata), garbanzo (Cicer arietinum) and Lima bean (Phaseolus lunatus)[J].Food Chemistry, 2004, 86(3):435-440.
[60] 张馨月, 张民, 邓梅, 等.三种食物来源膳食纤维的理化性质与功能特性比较[J].现代食品科技, 2024, 40(1):102-111.
ZHANG X Y, ZHANG M, DENG M, et al.Comparison of the physicochemical properties and functional properties of insoluble dietary fiber from three food sources[J].Modern Food Science and Technology, 2024, 40(1):102-111.
[61] NAUMANN S, HALLER D, EISNER P, et al.Mechanisms of interactions between bile acids and plant compounds-a review[J].International Journal of Molecular Sciences, 2020, 21(18):6495.
[62] 蔡松铃, 刘琳, 战倩, 等.膳食纤维的黏度特性及其生理功能研究进展[J].食品科学, 2020, 41(3):224-231.
CAI S L, LIU L, ZHAN Q, et al.Viscosity characteristics and physiological functions of dietary fiber:A review[J].Food Science, 2020, 41(3):224-231.
[63] 窦祖满. 不同分子量黑莓多糖的制备、结构解析及其体外消化、酵解特性研究[D].广州:华南理工大学, 2022.
DOU Z M.Preparation, structure analysis, in vitro digestion and fermentation of blackberry polysaccharides with different molecular weights[D].Guangzhou:South China University of Technology, 2022.
[64] NAUMANN S, SCHWEIGGERT-WEISZ U, EISNER P.Characterisation of the molecular interactions between primary bile acids and fractionated lupin cotyledons (Lupinus angustifolius L.)[J].Food Chemistry, 2020, 323:126780.
[65] NAUMANN S, HALLER D, EISNER P, et al.Mechanisms of interactions between bile acids and plant compounds-a review[J].International Journal of Molecular Sciences, 2020, 21(18):6495.
[66] BEHERA S K, MISHRA S, MOHAPATRA M.Physicochemical study of dietary fiber methylcellulose and human intestinal bile salt micellar aggregates[J].Colloid and Interface Science Communications, 2021, 44:100493.
[67] GUNNESS P, GIDLEY M J.Mechanisms underlying the cholesterol-lowering properties of soluble dietary fibre polysaccharides[J].Food &Function, 2010, 1(2):149-155.
[68] AJITHKUMAR A, ANDERSSON R, SIIKA-AHO M, et al.Isolation of cellotriosyl blocks from barley β-glucan with endo-1, 4-β-glucanase from Trichoderma reesei[J].Carbohydrate Polymers, 2006, 64(2):233-238.
[69] GUNNESS P, FLANAGAN B M, SHELAT K, et al.Kinetic analysis of bile salt passage across a dialysis membrane in the presence of cereal soluble dietary fibre polymers[J].Food Chemistry, 2012, 134(4):2007-2013.
[70] M KEL
KEL N, ROSA-SIBAKOV N, WANG Y J, et al.Role of β-glucan content, molecular weight and phytate in the bile acid binding of oat β-glucan[J].Food Chemistry, 2021, 358:129917.
N, ROSA-SIBAKOV N, WANG Y J, et al.Role of β-glucan content, molecular weight and phytate in the bile acid binding of oat β-glucan[J].Food Chemistry, 2021, 358:129917.
[71] IBRÜGGER S, KRISTENSEN M, POULSEN M W, et al.Extracted oat and barley β-glucans do not affect cholesterol metabolism in young healthy adults[J].The Journal of Nutrition, 2013, 143(10):1579-1585.