多酚又名植物单宁,广泛存在于植物性食物中,富含类黄酮和单宁酸,自然界目前发现的多酚有8 000多种,主要存在于蔬菜、坚果、茶、可可之中。近年,多酚因具有调节氧化和炎症应激、改变宏量营养素消化、调节肠道菌群等作用成为食品和医学领域的研究热点[1-2]。研究发现多酚对高脂饮食(high fat diet,HFD)诱导人体代谢紊乱进而诱发的肥胖,二型糖尿病(diabetes mellitus type 2,T2DM),非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)等疾病具有改善和预防作用。
长期摄入HFD会影响脂类在小肠、血液、肝脏等组织的消化吸收,导致脂类及其代谢产物质和量的异常,此过程即为人体的脂代谢紊乱。全球成年人中的肥胖患者超过6亿成年人,预计还将继续增长,HFD被认为是全球肥胖流行的一个重要促成因素,伴随着饮食结构的变化和体育活动减少等生活方式的改变,HFD与肥胖、炎症和糖尿病等代谢性疾病发病率的上升密不可分[3]。HFD的过量摄入,特别是饱和脂肪酸的大量摄入,易导致肝损伤,引发肝脏炎症、NAFLD等疾病。总脂肪和饱和脂肪的消耗也会间接促进二型糖尿病的发展,并且导致严重的并发症,如视网膜病变和失明[4]。近期,对近200人为期25年的研究进一步证实,HFD与代谢疾病、癌症和神经系统疾病有关[5]。
基于此,有关HFD诱导代谢疾病的研究越来越多,在查阅大量关于多酚对HFD动物的实验研究后发现,植物多酚对小鼠的脂质代谢的调控、非酒精性脂肪肝的预防与治疗、胰高血糖素的生成、肠道菌群等多个方面起到积极作用。本综述具体阐述多酚影响脂质代谢的机制,探究其预防和治疗T2DM、NAFLD等疾病的机理,以期为未来膳食多酚应用到食品加工、保健食品的制备等方面提供参考和方向。
1 多酚
1.1 多酚的结构
酚类化合物是植物中分布最广的次生代谢产物之一[6],是植物来源食物如(水果、蔬菜、谷物、咖啡和茶饮料[7])的主要成分。目前已经在高等植物中鉴定出数千种多酚化合物,其中食用植物中发现了数百种[8]。尽管酚类化合物种类众多,但在其结构中具有一定的相似性,其次级结构中必须含有1个以上的苯环,并且在其最基本的结构中不含任何氮基官能团。如图1所示,根据多酚的结构特征,膳食多酚可分为单个苯环为官能团的酚酸类衍生物(如羟基苯甲酸和羟基苯肉桂酸)、双苯环3个碳原子相连的黄酮类衍生物和非黄酮类化合物(如木脂素、香豆素、丹宁酸和二苯乙烯)。这些官能团使得多酚具有较强的抗氧化、抗炎、抑菌、防癌等作用,近年来研究也发现多酚可以参与调节脂质代谢,进而调节由高脂饮食诱导的脂代谢紊乱及相关疾病[9]。
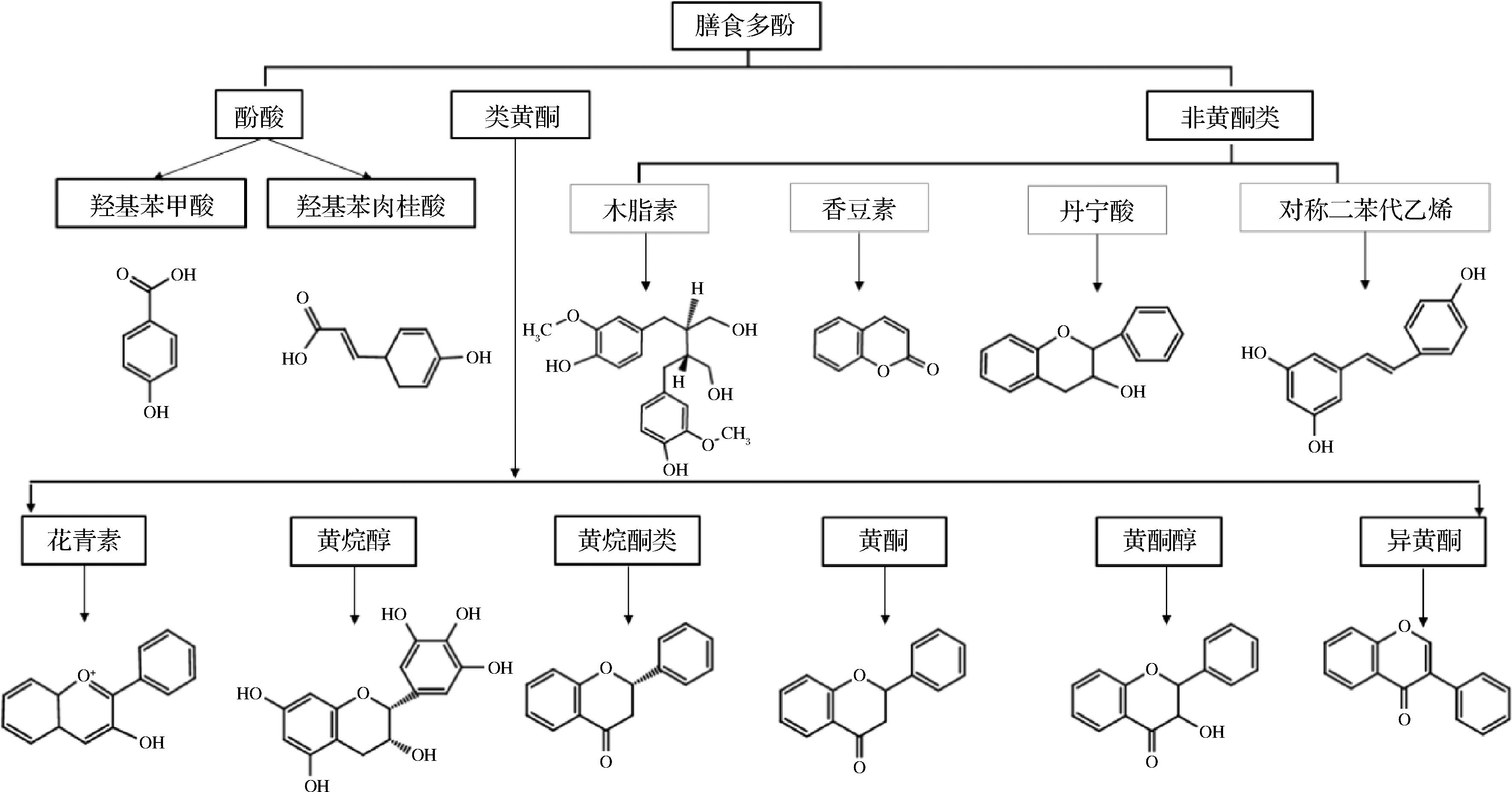
图1 膳食多酚结构分类图
Fig.1 Classification diagram of polyphenol structure
1.2 多酚在人体中的生理活性功能
1.2.1 酚的抗氧化作用
多酚是一种效果强大的抗氧化剂,可以通过提供电子或氢原子来中和自由基,其抗氧化作用机制包括直接清除活性自由基,螯合参与自由基形成的微量金属离子(图2上)[10]。图2下介绍了两种主要的抗氧化机制。第1种是苯酚官能团向自由基提供氢原子,例如脂质自氧化过程,多酚在此过程作为断裂抗氧化剂提供氢原子,而其本身由(ArOH)转变为自由基。第2种机制是从ArOH到自由基R+的单电子转移,形成稳定的自由基阳离子ArOH+[11]。此外多酚可以直接抑制参与自由基产生氧化酶如脂氧合酶、环氧化酶、髓过氧化物酶和黄嘌呤氧化酶,避免体内产生大量活性氧(reactive oxygen species,ROS)和有机氢过氧化物[12]。另外,多酚会诱导具有抗氧化活性的抗氧化酶的生成,如酶胱甘肽过氧化物(glutathione peroxidase,GSH-Px)、过氧化氢酶和超氧化物歧化酶(superoxide dismutase,SOD),分别分解H2O2和超氧化物阴离子,并抑制黄嘌呤氧化酶等酶的表达[13]。
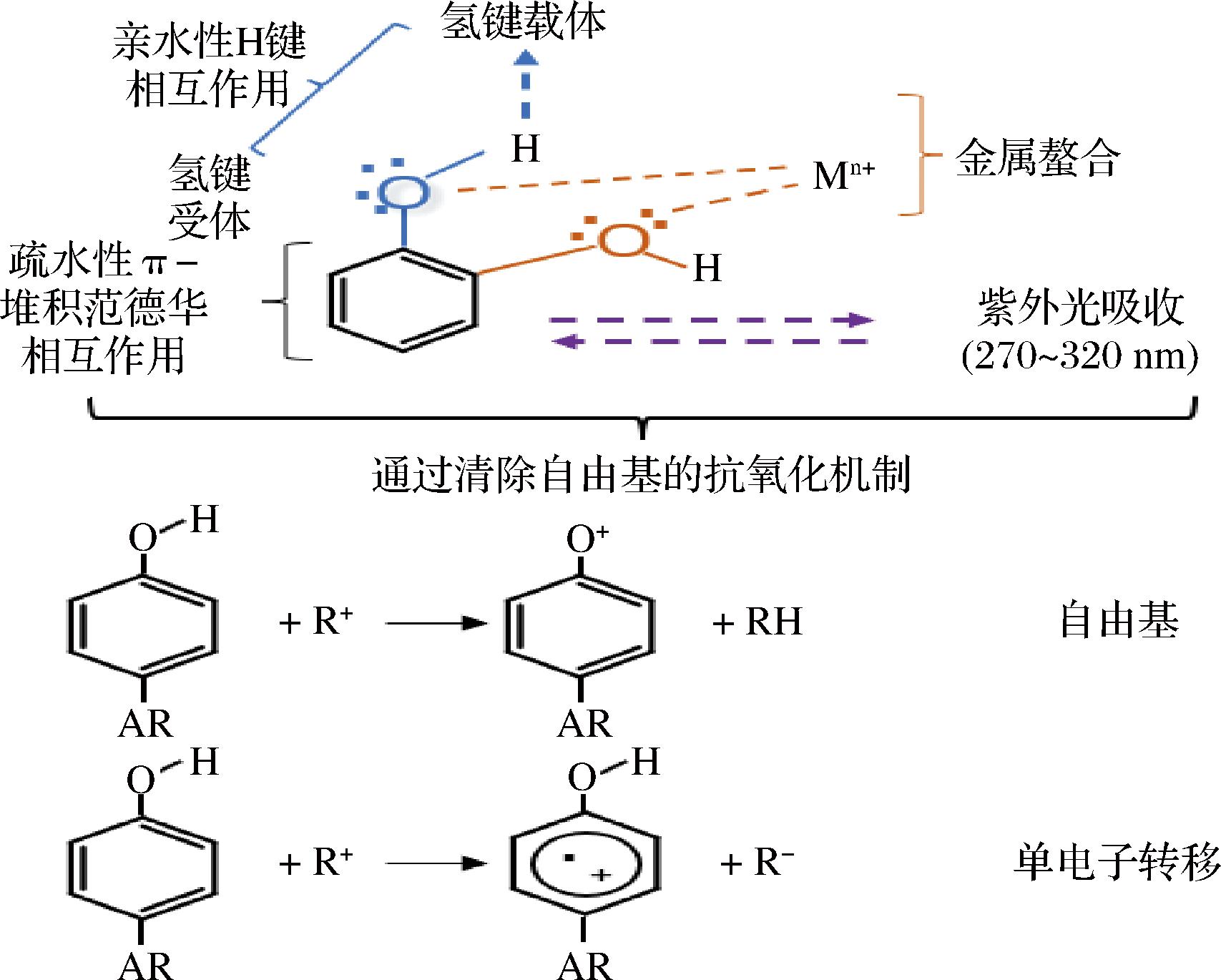
图2 多酚抗氧化作用机制图
Fig.2 Mechanism diagram of polyphenol antioxidant effect
1.2.2 酚的抗氧化作用
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性疾病,其确切病因尚不完全清楚。主要表现是炎症反应、氧化应激或肠道菌群失调以及与之相关的肠上皮细胞破坏[14]。IBD的特征是肠道上皮细胞受损,伴随上皮完整性的破坏,炎症细胞(主要是B细胞、T细胞、巨噬细胞和中性粒细胞)浸润固有层,以及促炎细胞因子如TNF-α、白细胞介素或干扰素γ (interferon-γ,IFN-γ)的产生增强[15]。相关研究发现多酚类化合物具有抗炎作用,可降低体外巨噬细胞中促炎因子的表达,特别是IL-1β、IL-6、TNF-α和环氧合酶-2 (cyclooxygenase-2,COX-2)的表达[16-18],从而起到治疗肠道炎症的作用。
研究发现多酚能够通过调节下丘脑炎症和氧化应激,促进并增强在该大脑区域内作用的几种神经激素的功能[19]。多酚具有穿越血脑屏障和促进大脑健康的潜力,它们能够保护神经元免受氧化应激诱导的损伤,抑制神经炎症[20]。还有研究学者提出多酚在治疗以炎症状态增加为特征的阿尔茨海默病和帕金森病等疾病的治疗和预防方面具有巨大的益处[21-22]。关于多酚抗炎机理的研究并不多,但其体现在动物实验上的抗炎作用已被证实,待挖掘潜力巨大。
1.2.3 酚的抗氧化作用
植物中的多酚提取物是一种天然的抑菌剂,对食品腐败微生物和食源性病原体都有抑制作用[23-24]。图3总结了多酚发挥其抗菌作用的方式,主要为以下4个方面:a)破坏微生物细胞形态;b)影响细胞膜电位;c)影响 ATP 的形成和消耗;d)抑制蛋白质等生物大分子合成[25]。食物中的多酚提取物对食源性致病菌都有一定的抑制作用,左龙亚等[26]研究了柠檬果皮提取物的多酚组成和抑菌性,发现柠檬果皮中含有4种酚酸和12种黄酮类化合物,其中大部分的多酚提取物都具有良好的抑菌性。QUAN等[27]用超声辅助提取法提取纯化荨麻中的黄酮和三萜类化合物并研究其抑菌性,发现荨麻具有良好的抑菌活性。DENG等[28]探究黑果腺肋花楸中花青素对大肠杆菌的抗菌作用及机制发现,花青素可通过诱导大肠杆菌的细胞壁和膜损伤发挥抑菌作用。CHEN等[29]探究甜菜糖蜜多酚对食源性致病菌的抗菌机制,发现甜菜糖蜜多酚对金黄色葡萄球菌、单核细胞增生李斯特菌、大肠杆菌和沙门氏菌的生长具有抑菌活性。多酚抑菌机理一直是研究的热点,由于多酚的成分和受试菌株不同,很难从某一方面阐明植物多酚的抑菌机理。其抑菌作用通常受多个因素的影响,还需深入探究。
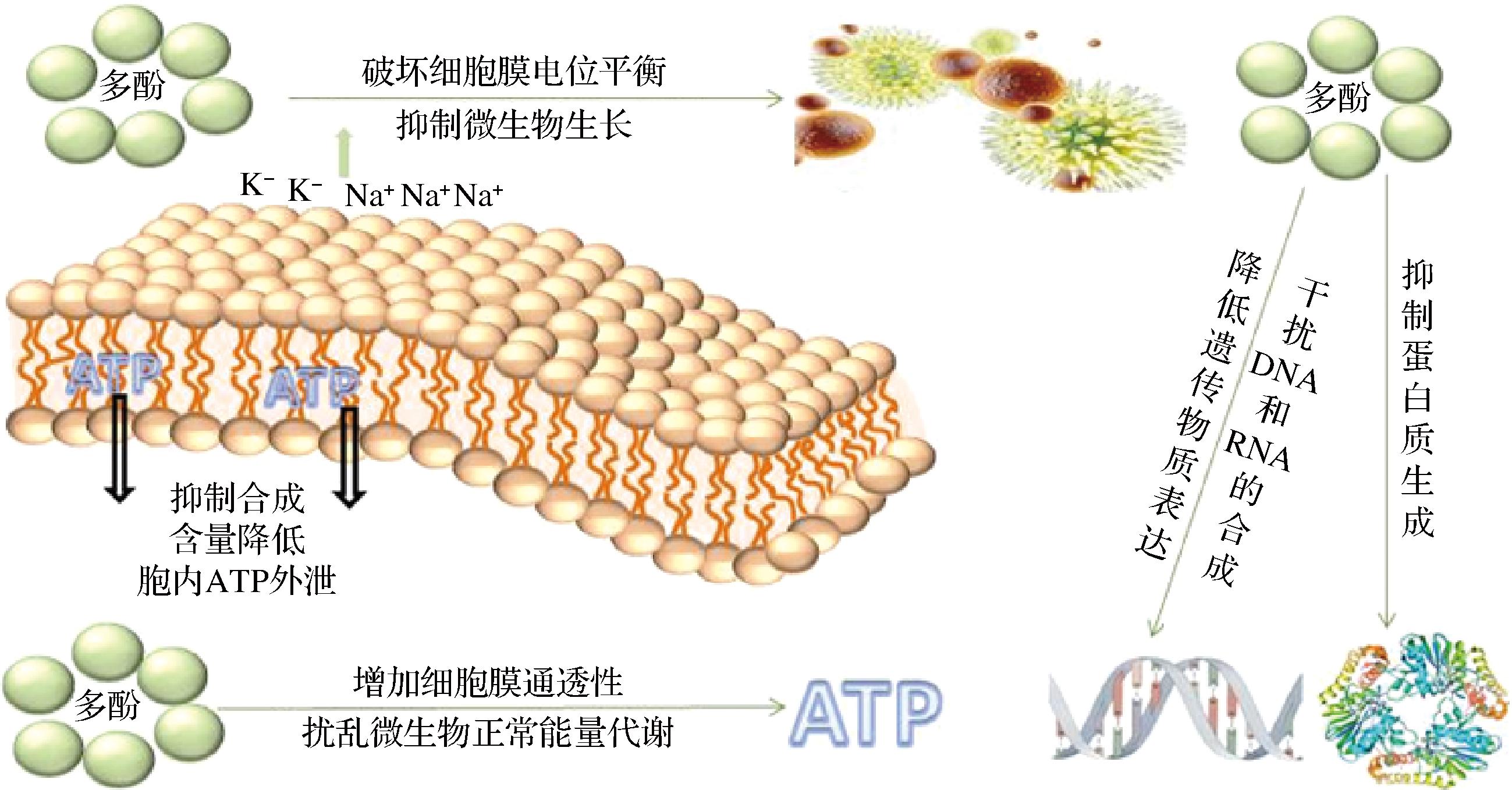
图3 多酚抑菌作用机制图
Fig.3 Mechanism diagram of polyphenol antibacterial effect
1.2.4 其他生理活性
多酚还具有抗癌、调节血糖、调节血脂、抗肥胖等功能[30]。据报道,目前已有 1 000 种植物被鉴定具有抗癌特性,其中萜类、生物碱、皂苷、多糖和多酚,已被证明是有效的抗癌化合物[31]。YANG等[32]研究了姜黄提取物中的酚类物质组成及抗氧化活性、抗增殖活性,发现姜黄多酚物质的酚类成分对癌细胞系(MCF7、MDA-MB-231、HCT116、HT29、HepG2、HeLa)具有抗增殖作用。随着人们对健康饮食的不断追求和科学手段的不断发展,更多先进的研究手段如基因代谢组学技术应用于动物实验研究中,用于深入探究多酚调控血糖干预肥胖的机制。ARSHAD等[33]采用超声波辅助提取苏铁叶片中的多酚类物质,并研究其体外抗氧化及抗糖尿病特性,结果发现60%乙醇提取物其提取率及 DPPH 自由基清除活性最高,500 mg/kg 体重剂量的植物提取物能显著降低糖尿病小鼠的血糖水平,并对其血脂有改善效果。此外,膳食多酚还可以通过调节脂质代谢;影响脂肪细胞的增殖、分化和凋亡;加速机体的能量消耗,刺激代谢产热来干预肥胖[34]。近年来,有关多酚通过调节炎症通路和肠道菌群发挥其生理活性的功能的研究越来越多,相关机制的探讨有望成为下一个研究热点。
除以上之外,多酚还具有抗过敏、抗病毒、抗微生物、抗增殖、抗突变、调节细胞周期阻滞、凋亡等作用[35]。近年来的研究也发现多酚对高脂饮食诱导脂代谢异常相关疾病具有积极的调节作用。
2 高脂饮食诱导脂代谢异常相关疾病的发生途径及机制
据2020年《中国居民营养与慢性病状况报告》所述,我国成年居民超重肥胖超过50%,6~7岁的儿童青少年接近20%,6岁以下的儿童达到10%,这与日常生活高脂饮食的摄入密不可分。高脂饮食的长期摄入,不仅导致肥胖,积累的脂肪还会附着在内脏上,易产生高血脂、心脏病、脂肪肝等多种健康问题。如损伤心血管、肝脏、肠胃、干扰代谢,诱发肠道炎症等[26]。
2.1 高脂饮食诱导的脂代谢紊乱概述
脂类是身体储能和功能的重要物质也是生物膜的重要结构成分,脂质的代谢包括脂类在小肠内消化、吸收,由淋巴系统进入血循环(通过脂蛋白转运),经肝脏转化,储存于脂肪组织,需要时被组织利用。脂类代谢受遗传、神经体液、激素、酶以及肝脏等组织器官的调节。当这些因素有异常时,可造成脂代谢紊乱和有关器官的病理生理变化,如高脂蛋白血症、脂质贮积病及其造成的临床综合征、肥胖症、酮症酸中毒、脂肪肝和新生儿硬肿症等。而高脂饮食的摄入恰恰会导致人体脂类代谢发生异常。
如图4,长期的高脂饮食摄入使得脂质代谢产物发生异常导致机体发生脂代谢紊乱,对血液、肝脏和肠道均产生危害进而诱发相关疾病。
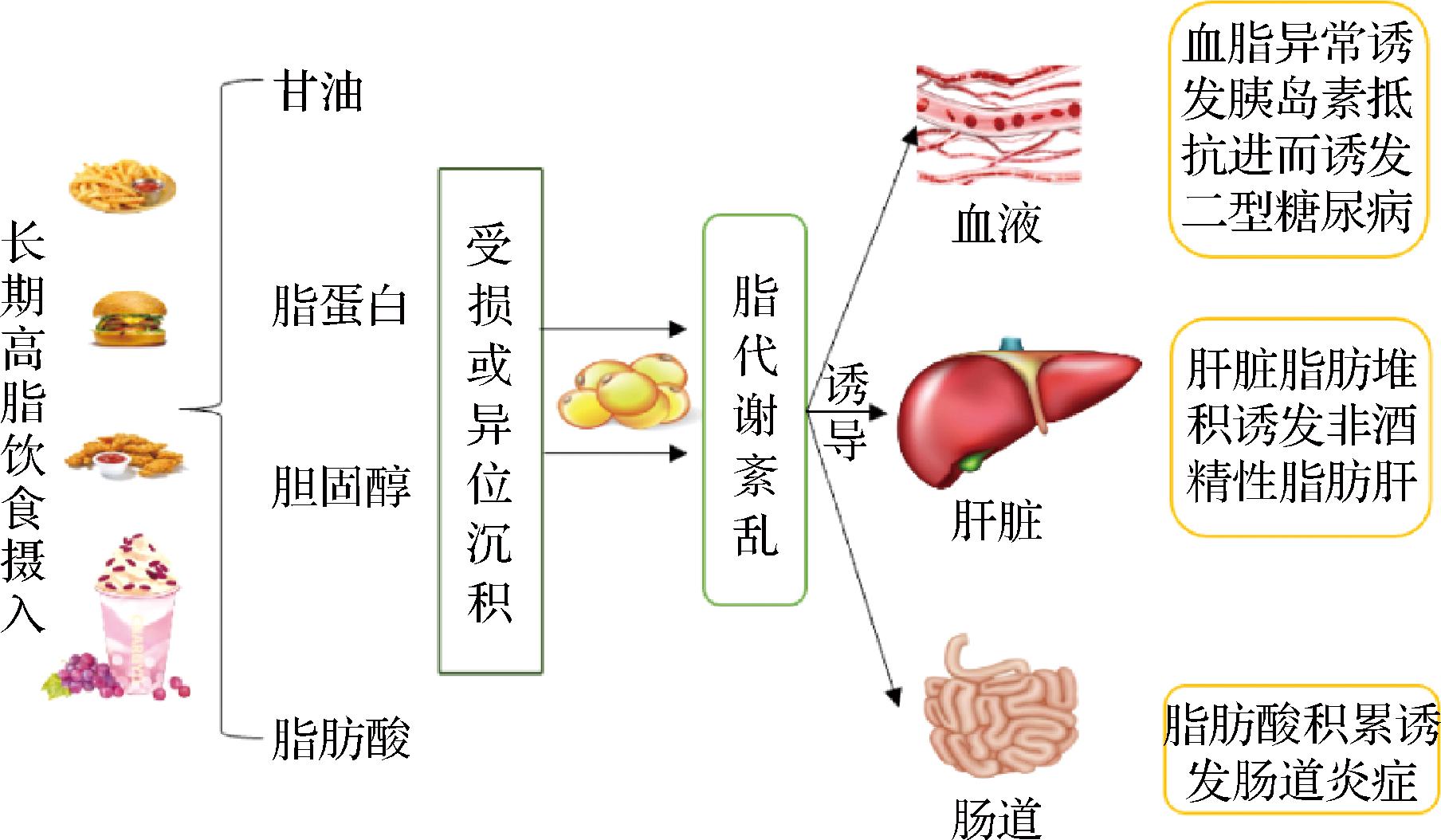
图4 高脂饮食诱导脂代谢紊乱相关疾病机制
Fig.4 Mechanism diagram of lipid metabolism disorders related diseases induced by high-fat diet
2.2 高脂饮食诱导脂代谢异常的相关疾病
长期的高脂饮食摄入对人体最直观的健康影响是导致机体肥胖,其次是引发T2DM、NAFLD及炎症疾病等。其中高脂饮食摄入导致脂代谢紊乱诱发NAFLD是全球面临待解决的一大难题。
根据NAFLD病理特征,其在机体内的发展可分为3个阶段,即NAFLD、非酒精性脂肪性肝炎,最终发展为肝硬化[36]。其主要特征表现为肝脏脂肪堆积过多,虽然NAFLD的发病机制尚不清楚,但是学术界普遍认为高脂饮食会诱导NAFLD的发生,高能量食物尤其是富含蔗糖、高果糖玉米糖浆和饱和脂肪等摄入增加,会导致NAFLD和骨骼肌异位脂质沉积增加。肌细胞内脂质含量的增加(通常发生在NAFLD发病之前)致使肌肉胰岛素抵抗,从而抑制胰岛素信号传导,减少胰岛素刺激的葡萄糖转运和肌糖原合成[37]。目前在全世界范围内尚无有效治疗NAFLD的临床用药。由于摄入的葡萄糖不能作为肌糖原正确储存,因而重新回到肝脏与肌肉胰岛素抵抗导致的代偿性门静脉高胰岛素血症相结合,刺激固醇调节元件结合蛋白,进而促进调节脂肪生成的关键肝酶的表达增加,导致极低密度脂蛋白(very low density lipoprotein, VLDL)产生增加、高甘油三酯血症和NAFLD,此外单糖还可以通过招募其他转录因子(包括转录因子碳水化合物反应元件结合蛋白(carbohydrate response element binding protein,ChREBP)、PPARg辅激活因子1-b)来激活肝脏脂肪生成,从而促进NAFLD的发展[38]。由此可见NAFLD与T2DM之间还可能存在相关联系。
另一方面,调查研究发现高脂饮食能够诱导T2DM的发生。T2DM是由多年的胰岛素抵抗和β细胞功能的进行性下降所引发的[39],虽然有研究发现遗传和环境因素对T2DM的发展也存在一定的作用[40],但是代谢因素是决定T2DM发生至关重要的因素,特别是高脂摄入是触发异位脂肪储存和脂质代谢紊乱的主要因素[41]。因此高脂饮食将会诱导T2DM疾病的发生。长时间的高脂饮食摄入,将通过激活脂质新生(de novo lipogenesis,DNL)途径将糖原储存的能量转移到脂肪组织中。当皮下脂肪储存容量达到最大值或脂肪细胞内的脂肪储存受损时,血浆甘油三酯水平将上升并转移到肝脏。来自甘油三酯和脂肪酸代谢的T氧脂中间体会引起肝脏胰岛素抵抗,从而导致空腹胰岛素水平升高以补偿胰岛素抵抗[42]。高胰岛素水平将增强DNL和肝脏循环。肝脏内过量脂肪堆积导致肝脏VLDL-TG(极低密度脂蛋白甘油三酯)输出到其他组织的升高。这将增加胰腺暴露在高甘油三酯浓度下的风险,增加胰腺组织中脂肪酸的吸收和储存,启动胰腺循环。长期接触脂肪酸和相关的有毒代谢物,会导致β细胞功能的损害。β细胞会在糖尿病发病早期通过分泌更多的胰岛素来克服这种压力。但当β细胞功能失能达到50%~60%时,β细胞无法维持正常血糖,就会出现T2DM。与高空腹胰岛素血症相关的高血糖血症将驱动更多的DNL,导致恶性循环[43]。
此外,高脂饮食导致的脂代谢异常会影响小肠上皮的微生物菌群数量和结构诱导肠道炎症,极易破坏肠道健康。目前可以确定的是HFD是诱发肠道炎症、炎症性肠病IBD、溃疡性结肠炎(ulcerative colitis, UC)和几种肠道肿瘤的真正危险因素[44],其通过促进ROS的氧化应激,多种途径损害肠道并促进炎症。
3 多酚对高脂饮食诱导脂代谢异常相关疾病的调节机制及研究进展
关于多酚的研究在过去的20年中逐渐增长,膳食多酚在预防氧化应激相关慢性疾病中的有益作用受到了广泛关注[45]。图5介绍了多酚对代谢及炎症相关因子的调节作用,多酚对慢性疾病的调节归根结底是对脂代谢、糖代谢和炎症相关因子的调节,进而起到对肝脏、胰岛、血液、小肠等脏器的调控作用。
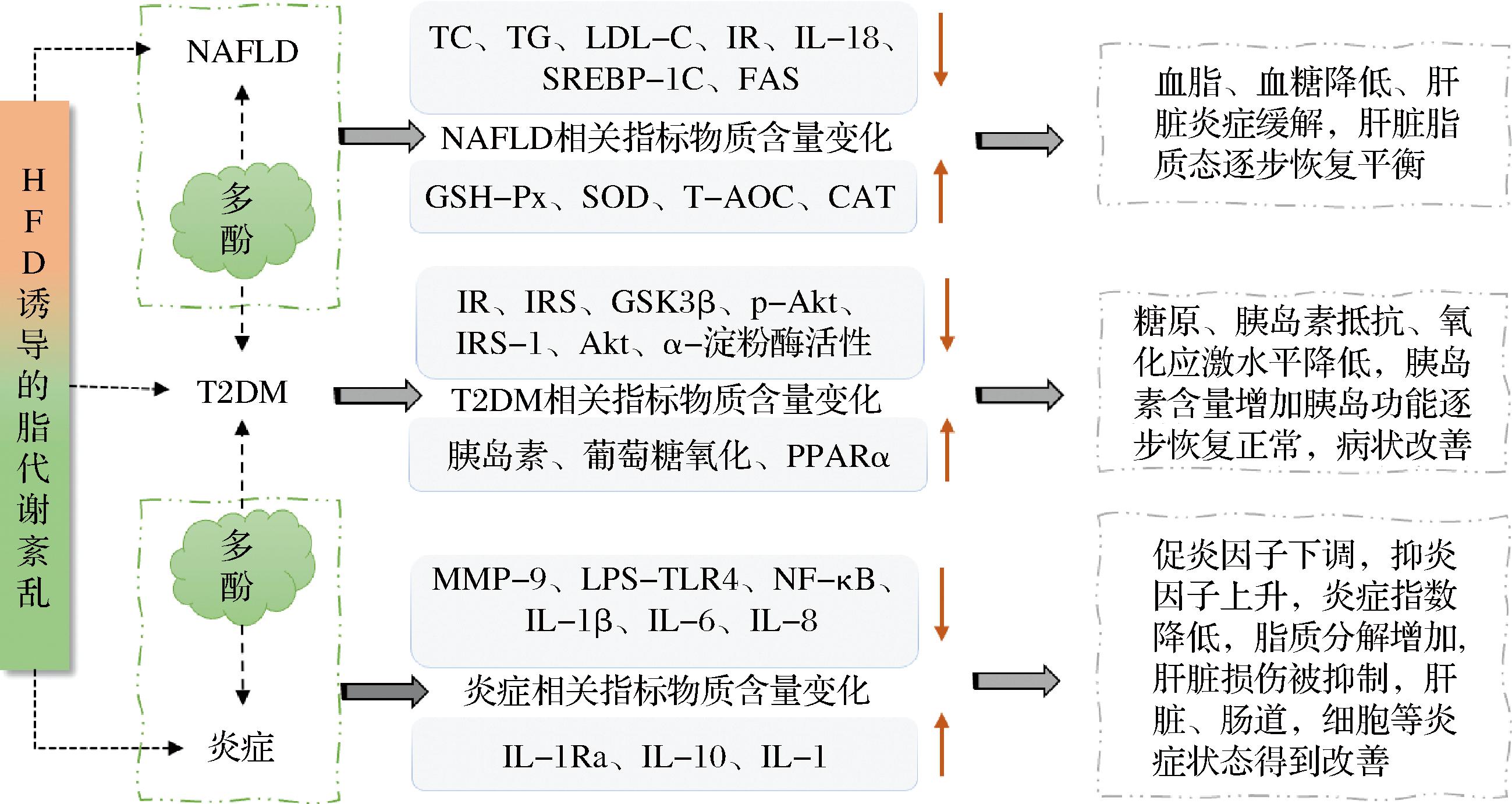
图5 多酚改善HFD诱导脂代谢紊乱相关疾病机制分析
Fig.5 Mechanism analysis of polyphenols improving HFD induced lipid metabolism disorder related diseases
3.1 多酚干预治疗NAFLD
NAFLD影响着全球25%~30%的普通人群,其发病率的高低与饮食方式密切相关。其主要的表现是胰岛素抵抗、氧化应激和血脂异常,目前有关治疗NAFLD的药理学方法尚无定论。根据文献以及报道可以得出结论,食用富含抗氧化剂的食物,特别是以富含多酚类物质为特征的传统地中海饮食是治疗NAFLD一种潜在的新方法[46]。通过对不同种类多酚在动物实验的研究已经证实多酚具有降血脂、调节脂肪酸代谢、调节胰岛素抵抗、抗氧化应激等多方面的作用。膳食多酚或富含多酚的食物可从调节脂质与脂肪酸的合成、调节胰岛素抵抗、调节氧化应激反应、调节肝脏促炎因子合成等4个方面改善NAFLD,具有潜在治疗NAFLD的作用。
多酚干预NAFLD主要是通过降低血清中总胆固醇(total cholesterol,TC)、甘油三脂(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)、游离脂肪酸(free fatty acid,FFA)、空腹血糖(fasting blood glucose,FBG)实现的,如夏洪淼[47]经过离脂高糖乳剂灌胃大鼠4周构建出NAFLD模型,在经过茶多酚干预后,相比对照组,实验组小鼠体内血清、TC、TG、LDL、FFA、FBG均显著降低,同时高密度脂蛋白(high-density lipoprotein, HDL)水平升高。进一步的研究也发现多酚看通过调节胰岛素抵抗改善由HFD诱导的NAFLD大鼠糖脂代谢紊乱。例如,GAN等[48]对小鼠进行24周的HFD喂养的实验发现茶多酚能降低血清胰岛素和血清脂联素水平、改善胰岛素抵抗指数(insulin resistance index,IRI)和胰岛素敏感指数(insulin sensitivity index,ISI)所评价的胰岛素抵抗,夏洪淼等[47]也得到了相似的实验结果。此外多酚对NAFLD的干预作用呈剂量依赖性,胰岛素降解酶(insulin-degrading enzyme,IDE)可能是NAFLD治疗的潜在药物靶点。例如对小鼠注射表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),EGCG剂量依赖性地改善了NAFLD小鼠的肝脏形态和功能,增强肝脏中胰岛素清除率,减轻体重,缓解高血脂、高血糖、高胰岛素血症和胰岛素抵抗。EGCG剂量依赖性地增强了NAFLD,上调了IDE蛋白表达和酶活性。
另一方面多酚可以通过调节NAFLD小鼠体内抗氧化物活性、抑制肝脏炎性细胞因子的生成,增强肝脏抗氧化能力。杨秘[49]发现石榴皮多酚可以减少高脂诱导大鼠丙二醛 (malondialdehyde,MDA)水平,增强GSH-Px、SOD、总抗氧化能力和过氧化氢酶的活力水平,显著减少大鼠血液和肝脏IL-1β和IL-18炎性细胞因子的生成和mRNA表达,对NAFLD可能起到缓解作用。另外,石榴皮多酚可抑制脂质代谢通路胆固醇调节元件结合蛋白-1C (sterol-regulatory element binding protein-lC, SREBP-1C)与脂肪酸合成酶(fatty acid synthetase,FAS)mRNA和蛋白的表达,改善大鼠肝脏的脂质堆积从而减缓NAFLD的发展。WANG等[50]发现核桃壳多酚提取物能够防止HFD大鼠体内产生的氧化应激反应,避免肝脏炎症的产生,并且维持了肠道菌群的平衡,降低了血清和肝脏中的TC、TG和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)的含量,进一步验证了多酚的抗氧化应激能力。HFD会导致线粒体产生大量ROS,而生成的ROS进一步攻击脂肪酸的不饱和键,触发脂质过氧化产生MDA,而核桃壳多酚提取物可以抑制大鼠肝脏MDA的升高,表明ROS的生成减少,对NAFLD的形成和发展起到显著的预防作用。CUI等[51]近期的一项研究发现,苹果多酚可以通过调节肝脏脂质和胆汁酸的代谢,而潜在治疗NAFLD,进一步证实多酚对NAFLD的调控作用。
3.2 多酚干预治疗T2DM
多酚的抗糖尿病活性研究是近年来研究的热点,大量研究表明多酚对高脂高糖饮食诱导的T2DM起到积极作用[52],多酚可通过改善胰岛素抵抗、保护胰岛β细胞和促进胰岛素释放、保护细胞避免高血糖引起的氧化应激、增强葡萄糖代谢等作用显著调节改善T2DM[53]。多酚类化合物还可以预防糖尿病的长期并发症发展,如心血管疾病、精神病变、肾病和视网膜病变等[54]。
多酚对T2DM的改善作用最直观体现就是抑制胰岛素抵抗的产生,陈丽莉等[55]将黑树莓多酚添加到饲料中,对HFD诱导、化学诱导、高脂饮食结合化学诱导T2DM小鼠进行喂养发现,小鼠血糖水平显著下降,与胰岛素信号通路的相关蛋白胰岛素抵抗(insulin resistance,IR)、胰岛素受体底物(insulin receptor substrate,IRS)、糖原合酶激酶(glycogen synthase kinase 3β,GSK3β)、磷酸化蛋白激酶B抗体(phosphorylated protein kinase B,p-Akt)等均出现上调,进而促进了葡萄糖的代谢,抑制了胰岛素抵抗的产生。这与JANG等[56]的研究结果具有部分相似之处,JANG等[56]发现 EGCG治疗恢复了HFD诱导糖尿病大鼠原代牛主动脉内皮细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、胰岛素受体底物和p-Akt的胰岛素刺激磷酸化,其通过促进脂质代谢间接有助于预防内皮功能障碍和胰岛素抵抗,即便在饱和脂肪酸的存在下,EGCG也能很好的保存胰岛素信号。证实了食多酚与植物多酚可以调节与胰岛素抵抗相关蛋白,促进葡萄糖和脂质的代谢,起到改善T2DM的作用。
此外,多酚干预治疗T2DM的改善作用还可能是通过抑制α-淀粉酶活性、改善免疫调节特性和氧化应激实现的。例如研究者发现花生壳中的多酚提取物中槲皮素和木犀草素已被证明具有抗糖尿病作用[57]。SUN等[58]对花生壳多酚提取物进行了大鼠实验,发现花生壳多酚提取物可能通过抑制α-淀粉酶活性、改善免疫调节特性和氧化应激起到抗糖尿病作用,进而使得HFD诱导T2DM大鼠体重、食物和水摄入量、血糖水平、胰岛素水平恢复正常。
此外,多酚还可通过调节脂质和脂蛋白代谢,改善血脂异常进而改善T2DM相关症状。这一作用首先体现在多酚类化合物能够减少膳食脂质的消化和吸收。如苹果中含有的低聚原花青素对胰脂肪酶和甘油三脂的吸收具有抑制作用,苹果原花青素还通过降低载脂蛋白B的合成和分泌、抑制胆固醇雌化和肠脂蛋白的产生,诱导降血脂作用[59]。其次多酚(如儿茶素和原花青素[60])还可以通过抑制脂质生物合成途径中的关键酶,减少肠道脂质吸收。如儿茶素还与肠细胞刷序中涉及胆固醇易位的蛋白质相互作用改变其功能并有效降低胆固醇吸收,通过增强肝脏过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptor α,PPARα)和一些靶基因。再如富含花青素的酸樱桃作为药用食品服用,可降低高脂血症、高胰岛素血症、脂肪肝和肝脏脂肪变性[61-62]。由此可见,T2DM的产生与肝脏脂代谢紊乱关系密切,多酚可以通过调节HFD诱导肝脏脂代谢紊乱进而调节T2DM。
3.3 多酚改善高脂饮食诱导的肠道炎症
多酚可以从限制免疫细胞浸润和增殖、下调炎性细胞因子和酶、增强抗氧化防御、调节肠道微生物群平衡、恢复上皮屏障和调节细胞信号通路等多个方面改善高脂饮食诱导的肠道炎症。
CHANG等[63]研究发现富含多酚的荔枝花水提取物增加了HFD仓鼠的肝脏抗氧化能力,降低了肝脏损伤和炎症指数、C-反应蛋白(C-reactive protein,CRP)水平和基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)活性,这与肝脏组织学检查中轻度的肝脏损伤相对应。李欣[64]研究发现,菝葜多酚提高了HFD诱导小鼠的肠道微生物菌群的丰富度,抑制了脂多糖-样受体4(lipopolysaccharide Toll-like receptor 4 Toll,LPS-TLR4)和核转录因子-κB(nuclear factor-κappa B,NF-κB)信号通路并增加肠道中具有抗炎作用细菌的相对丰度以及降低能引起炎症反应的有害细菌,减轻了高脂饮食诱导的炎症。陈宇欢[65]研究发现菜豆豆奶和酸奶中具有抗氧化、抗炎症活性的物质为小分子的寡肽和多酚,建立了HFD小鼠模型,在饲料中添加上述物质发现小鼠体重、肝脏、白色脂肪组织和棕色脂肪组织总重,血浆甘油三酯、胆固醇和低密度脂蛋白的增长都得到了抑制,并且出现轻微胰岛素抵抗趋势,猜测与小肽和多酚成分的抗炎功能有关。研究发现,槲皮素、山奈酚等黄酮类物质能够通过激活脂肪细胞内的过氧化物酶体增殖激活受体γ (peroxisome proliferator-activated receptor γ,PPAR-γ),调节脂肪分解和葡萄糖代谢,以改善炎症和胰岛素抵抗症状[66-67]。HAN等[68]在小鼠饮食中添加2.5%或5.0%冻干草莓37 d后发现,小鼠疾病活动指数、结肠缩短和脾脏增大、促炎性免疫细胞显著降低,原因可能是由于草莓中富含的多酚类物质。
表1总结了近年来有关多酚对高脂饮食诱导脂代谢相关疾病的调节作用,多酚及多酚提取物能够显著改善高脂饮食小鼠的脂代谢紊乱预防慢性病的发生。
表1 不同种类多酚对高脂诱导的脂质代谢及相关疾病的影响
Table 1 Effects of different type of polyphenols on lipid metabolism and related diseases induced by hyperlipidemia

作用成分多酚种类动物实验模型参与脂代谢及其他生理活动调节作用参考文献黄烷醇EGCGHFD小鼠体重增加、肠系膜脂肪质量、空腹血糖水平、胰岛素抵抗、血清胆固醇和ALT水平、肝脏脂质含量和肝脏脂肪变性的严重程度显著降低;游离脂肪酸种类的血清水平降低;Cyp7a1和Cyp27a1的肝脏mRNA水平显著增加[69]绿茶多酚HFD雄性犬体重增加降低;TNF-α、IL-6和IL-1β的mRNA水平显著降低;细菌丰富度和多样性增加,肠道免疫力提升,慢性炎症的发展得到抑制[70]绿茶多酚HFD小鼠体重增加得到改善;肠道微生物群组成改变;部分计量的茶多酚可使短链脂肪酸增加;拟杆菌减少,厚壁菌增加,小鼠的F(厚壁菌门Firmicutes)/B(拟杆菌门Bacteroidetes)比率增加;血清TC、TG、LDL-C、GLU和INS水平显著降低;葡萄糖耐量得到改善[71]金合欢多酚HFD小鼠升高的血糖和胰岛素水平得到抑制;增加了PPARα和PPARδ(核受体)的mRNA表达,降低了TNF-α mRNA的表达;显著增加(约5倍)PPARγ mRNA、脂联素mRNA和骨骼肌中GLUT4的mRNA表达;抑制高脂肪饮食引起的肥胖、糖尿病、脂肪肝[72]乌龙茶多酚HFD小鼠血清 TC、TG、LDL-C 水平明显降低,高密度脂蛋白胆固醇水平明显升高;增加了 HFD 诱导的肥胖小鼠肠道内微生物菌群的多样性,促进了总 SCFAs 的产生,改善了脂质代谢紊乱[73]类黄酮、酚酸葡萄多酚HFD小鼠体重增加、TG、TC、LDL-c水平降低,增加了降血脂的肠道菌的相对丰度,高血脂得到抑制[74]蜂蜜多酚HFD大鼠结肠炎性细胞因子IL-6、TNF-α, TGF-β1, IL-1β下调;显著减少了拟杆菌、棒状杆菌和变形杆菌的种群;调节肠道微生物群改善肠道炎症和抗氧化应激能力[75]类黄酮猕猴桃籽多酚HFD小鼠小鼠的体重增长和脂肪堆积得到缓解;葡萄糖耐受度和胰岛素敏感性提升;改善肝脏组织的脂肪空泡、炎症浸润和脂肪组织损伤情况;血清、肝脏和结肠中炎症因子相关指标(IL-6、IL-10、IL-1β和 TNF-α)水平降低,有效抑制了体内炎症因子的释放;脂质代谢相关指标(LDL-C、HDL-C、TC、TG、AST 和 ALT)水平降低;高短链脂肪酸的含量及厚壁菌门/拟杆菌门比值增加,改变肠道菌群的物种组成和丰度,改善了高脂饮食诱导的肥胖[76]黄酮醇樱桃李果实多酚HFD小鼠小鼠血清中甘油三酯和总胆固醇的含量显著降低;肝脏脂肪的形成和积累降低;下调小鼠肝脏 IL-6、TNF-α 基因的表达,显著抑制高脂饮食所导致的肝脏炎症[77]乙烯对称二甲苯代白藜芦醇HFD大鼠体重、腹膜后脂肪量、收缩压、血浆瘦素和脂联素水平得到改善;增加了拟杆菌门(Bacte-roidetes)和蓝藻门(Cyanobacteria)的比例;降低了软壁菌门(Tenericutes)和嗜黏蛋白阿克曼菌(Akkermansia)的比例,恢复了由产前和产后高脂饮食暴露造成的肠道相关生态失调[78]白藜芦醇HFD大鼠胰岛素抵抗降低并改善胰岛素敏感性;大鼠的糖化血红蛋白、血脂异常、氧化应激和炎症生物标志物的生成得到抑制[79]单宁酸嘉宝果多酚HFD小鼠脂质代谢、高瘦素血症和高胰岛素血症得到改善;降低胰岛素血浆水平,提高胰岛素敏感性;增加UCP1、PPAR-γ和PGC1-α基因表达水平,恢复棕色脂肪组织功能,促进了皮下脂肪组织的褐变[80]
续表1

作用成分多酚种类动物实验模型参与脂代谢及其他生理活动调节作用参考文献黄烷醇、香豆素猕猴挑多酚HFD小鼠抑制了HFD引起的肠漏,调节微生物,下调TLR-2/TLR-4、TNF-α和IL-1β表达,降低了肠道炎症状态;刺激拟杆菌、乳杆菌和双歧杆菌的表达,下调炎症介质的表达,改善紧密连接蛋白的表达,减轻肠道损伤[81]酚酸、花青素苹果多酚HFD石斑鱼脂质含量降低,总胆固醇和血清低密度脂蛋白胆固醇含量减少;脂肪酸合成增加、氧化降低;蛋白质含量增加;脂解基因pparα、pparβ、hsl、atgl和cpt1基因表达上升,脂质击沉降低[82]苹果多酚HFD小鼠体重、肝脏质量和脂肪积累的增加得到抑制,肝脏脂肪变性和血清胰岛素水平得到改善[51]多酚提取物富含多酚的桃皮提取物HFD小鼠调节脂质代谢相关基因的表达,改善氧化应激;调节肠道微生物群落的多样性和丰富度以及SCFAs的含量,缓解脂质代谢异常[83]初榨橄榄油多酚提取物HFD大鼠肝脏中AKT和GLUT2的磷酸化表达提高,葡萄糖稳态改善;血清中瘦素和脂联素的水平得到调节;降低了蛋白质的亚硝基化作用,减少了ROS的产生,降低了MDA水平;血糖和胰高血糖素指数降低,胰岛素敏感性恢复;血清甘油三酯和ALT以及所有肝脏总脂质降低[84]小米多酚HFD大鼠抗氧化酶的表达和活性、自由基清除能力、还原力和抗脂质过氧化能力增强;氧化应激得到抑制,下调Tnf-α、I l-1β、App、PS1和tau基因的表达,具有抗炎和神经保护作用[85]猕猴桃皮多酚HFD大鼠大鼠血清TG、TC、LDL-C、FFA水平显著降低,显著提高血清HDL-C水平,肝脂质蓄积现象、细胞肿胀的程度、脂肪空泡的数量得到明显的改善;脂肪合成和脂肪氧化分解相关的基因得到调控;显著下调高脂大鼠肝脏脂肪合成相关基因(ACC、FAS)的表达,显著上调脂肪分解相关基因(PPAR-α、CPT-1)的表达,脂代谢紊乱得到正向调控[86]黑豆种皮多酚HFD小鼠减少下丘脑激活的小胶质细胞的积累和HFD摄入诱导的胶质细胞增生;降低下丘脑促炎细胞因子基因表达;降低HFD诱导的NF-κB通路的活化,改善了肥胖[87]
4 结语与展望
多酚的抗氧化性、抗炎作用及对高脂饮食引起的相关代谢疾病的预防与治疗作用是近年来研究的热点。研究表明,多酚可以调节HFD模型小鼠的脂质代谢,降低胰高血糖素水平,调节肝脏和血液中脂蛋白水平从而起到对非酒精性脂肪肝、二型糖尿病、肠道炎症、肝脏炎症、肥胖等高脂饮食诱导疾病的预防和治疗作用。但是多酚种类繁多,在人体内的代谢机制复杂,对脂代谢紊乱和相关疾病的调控机理并不明确。其次,多酚与蛋白相结合可以提升多酚在人体内的消化利性,将多酚与蛋白质结合能否进一步提升多酚的功能性犹未可知,且目前有关多酚与蛋白形成复合物的研究较少,涉及的范围窄,还有很大的研究空间。
在食品行业上,将多酚与食品相结合做成功能性食品或保健食品具有很大的商业价值和意义,但是涉及的研究匮乏,本综述目的在阐述多酚的种类,化学结构,作用机理,以及在动物实验上面的取得研究进展,为多酚类功能性产品的开发和医学研究提供参考。
[1] BERTELLI A, BIAGI M, CORSINI M, et al.Polyphenols:From theory to practice[J].Foods, 2021, 10(11):2595.
[2] 贺珍, 秦昉, 陈洁, 等.食品多酚对2型糖尿病及其代谢综合症的干预研究进展[J].食品与机械, 2019, 35(2):202-206.
HE Z, QIN F, CHEN J, et al.Advances on intervention of food polyphenols on type 2 diabetes and metabolic syndrome[J].Food &Machinery, 2019, 35(2):202-206.
[3] 金璨, 邓颖, 曹楠, 等.茶多酚对高脂饮食诱导的非酒精性脂肪性肝病预防作用的研究进展[J].食品科学, 2023, 44(7):295-302.
JIN C, DENG Y, CAO N, et al.Progress in research on the preventive effect of tea polyphenols on non-alcoholic fatty liver disease induced by high-fat diet[J].Food Science, 2023, 44(7):295-302.
[4] CLARKSON-TOWNSEND D A, DOUGLASS A J, SINGH A, et al.Impacts of high fat diet on ocular outcomes in rodent models of visual disease[J].Experimental Eye Research, 2021, 204:108440.
[5] OBESITY COLLABORATORS G B D, AFSHIN A, FOROUZANFAR M H, et al.Health effects of overweight and obesity in 195 countries over 25 years[J].New England Journal of Medicine, 2017, 377(1):13-27.
[6] SCALBERT A, WILLIAMSON G.Dietary intake and bioavailability of polyphenols[J].The Journal of Nutrition, 2000, 130(8):2073S-2085S.
[7] 唐瑶, 陈洋, 曹婉鑫.多酚类化合物的分类、来源及功能研究进展[J].中国食物与营养, 2016, 22(3):32-34.
TANG Y, CHEN Y, CAO W X.Research progress in classification, origin and function of polyphenols[J].Food and Nutrition in China, 2016, 22(3):32-34.
[8] CHOJNACKA K, SKRZYPCZAK D, IZYDORCZYK G, et al.Antiviral properties of polyphenols from plants[J].Foods, 2021, 10(10):2277.
[9] HUANG H R, CHEN J J, AO T X, et al.Exploration of the role of bound polyphenols on tea residues dietary fiber improving diabetic hepatorenal injury and metabolic disorders[J].Food Research International, 2022, 162:112062.
[10] BEL
 AK-CVITANOVI
AK-CVITANOVI A, DURGO K, HU
A, DURGO K, HU EK A, et al.Overview of Polyphenols and Their Properties[M].Polyphenols:Properties, Recovery, and Applications.Amsterdam:Elsevier, 2018:3-44.
EK A, et al.Overview of Polyphenols and Their Properties[M].Polyphenols:Properties, Recovery, and Applications.Amsterdam:Elsevier, 2018:3-44.
[11] CHENG C, LI Z Z, ZHAO X, et al.Natural alkaloid and polyphenol compounds targeting lipid metabolism:Treatment implications in metabolic diseases[J].European Journal of Pharmacology, 2020, 870:172922.
[12] NIJVELDT R J, VAN NOOD E, VAN HOORN D E, et al.Flavonoids:A review of probable mechanisms of action and potential applications[J].The American Journal of Clinical Nutrition, 2001, 74(4):418-425.
[13] DE GROOT H, RAUEN U.Tissue injury by reactive oxygen species and the protective effects of flavonoids[J].Fundamental &Clinical Pharmacology, 1998, 12(3):249-255.
[14] CABAN M, LEWANDOWSKA U.Polyphenols and the potential mechanisms of their therapeutic benefits against inflammatory bowel diseases[J].Journal of Functional Foods, 2022, 95:105181.
[15] GUAN Q D.A comprehensive review and update on the pathogenesis of inflammatory bowel disease[J].Journal of Immunology Research, 2019, 2019:7247238.
[16] CABAN M, CHOJNACKA K, OWCZAREK K, et al.Spent hops (Humulus Lupulus L.) extract as modulator of the inflammatory response in lipopolysaccharide stimulated RAW 264.7 macrophages[J].Journal of Physiology and Pharmacology, 2020, 70(1).DOI:10.26402/jpp.2020.1.05.
[17] CABAN M, LEWANDOWSKA U.Polyphenols and posterior segment eye diseases:Effects on angiogenesis, invasion, migration and epithelial-mesenchymal transition[J].Food Reviews International, 2023, 39(6):3415-3443.
[18] MI OSZ C, KATARZYNA O, KATARZYNA C, et al.Overview of polyphenols and polyphenol-rich extracts as modulators of inflammatory response in dry eye syndrome[J].Food Reviews International, 2022, 38(S1):501-528.
OSZ C, KATARZYNA O, KATARZYNA C, et al.Overview of polyphenols and polyphenol-rich extracts as modulators of inflammatory response in dry eye syndrome[J].Food Reviews International, 2022, 38(S1):501-528.
[19] SARUBBO F, MORANTA D, PANI G.Dietary polyphenols and neurogenesis:Molecular interactions and implication for brain ageing and cognition[J].Neuroscience and Biobehavioral Reviews, 2018, 90:456-470.
[20] PANICKAR K S.Effects of dietary polyphenols on neuroregulatory factors and pathways that mediate food intake and energy regulation in obesity[J].Molecular Nutrition &Food Research, 2013, 57(1):34-47.
[21] HENEKA M T, CARSON M J, EL KHOURY J, et al.Neuroinflammation in Alzheimer’s disease[J].The Lancet Neurology, 2015, 14(4):388-405.
[22] ROCHA N P, DE MIRANDA A S, TEIXEIRA A L.Insights into neuroinflammation in Parkinson’s disease:From biomarkers to anti-inflammatory based therapies[J].BioMed Research International, 2015, 2015:628192.
[23] MILEO A M, NISTIC P, MICCADEI S.Polyphenols:Immunomodulatory and therapeutic implication in colorectal cancer[J].Frontiers in Immunology, 2019, 10:729.
P, MICCADEI S.Polyphenols:Immunomodulatory and therapeutic implication in colorectal cancer[J].Frontiers in Immunology, 2019, 10:729.
[24] QABAHA K, ABBADI J, YAGHMOUR R, et al.Unveiling the antibacterial and antioxidant potential of Hedera helix leaf extracts:Recent findings[J].Canadian Journal of Physiology and Pharmacology, 2024, 102(1):26-32.
[25] 费鹏, 赵胜娟, 陈曦, 等.植物多酚抑菌活性、作用机理及应用研究进展[J].食品与机械, 2019, 35(7):226-230.
FEI P, ZHAO S J, CHEN X, et al.The research progress on antimicrobial activity, mechanism and application of plant polyphenols[J].Food &Machinery, 2019, 35(7):226-230.
[26] 左龙亚, 滕左, 王孝仕, 等.不同溶剂柠檬果皮提取物抗氧化、抑菌活性比较及其与多酚组成的关系[J].园艺学报, 2017, 44(4):743-754.
ZUO L Y, TENG Z, WANG X S, et al.Comparsion of antioxidant and antifungal activities of various solvent extracts of lemon peel and analysis the relationship with polyphenol composition[J].Acta Horticulturae Sinica, 2017, 44(4):743-754.
[27] QUAN H X, SUN N, LIU S L, et al.The analysis of flavonoids and triterpenes extracted from Urtica by LC-MS and the antimicrobial activity of the extracts[J].Journal of Food Processing and Preservation, 2021, 45(9):e15706.
[28] DENG H T, ZHU J Y, TONG Y Q, et al.Antibacterial characteristics and mechanisms of action of Aronia melanocarpa anthocyanins against Escherichia coli[J].LWT, 2021, 150:112018.
[29] CHEN M S, ZHAO Z G, MENG H C, et al.The antibiotic activity and mechanisms of sugar beet (Beta vulgaris) molasses polyphenols against selected food-borne pathogens[J].LWT, 2017, 82:354-360.
[30] MA M J, GU M F, ZHANG S Z, et al.Effect of tea polyphenols on chitosan packaging for food preservation:Physicochemical properties, bioactivity, and nutrition[J].International Journal of Biological Macromolecules, 2024, 259:129267.
[31] ZEB F, NAQEEB H, OSAILI T, et al.Molecular crosstalk between polyphenols and gut microbiota in cancer prevention[J].Nutrition Research, 2024, 124:21-42.
[32] YANG Q Q, CHENG L Z, ZHANG T Z, et al.Phenolic profiles, antioxidant, and antiproliferative activities of turmeric (Curcuma longa)[J].Industrial Crops and Products, 2020, 152:112561.
[33] ARSHAD M, CHAUDHARY A R, MUMTAZ M W, et al.Polyphenol fingerprinting and hypoglycemic attributes of optimized Cycas circinalis leaf extracts[J].Journal of the Science of Food and Agriculture, 2021, 101(4):1530-1537.
[34] 宋海昭, 汪芳, 沈新春.植物多酚干预肥胖发生作用机制的研究进展[J].食品安全质量检测学报, 2020, 11(21):7721-7728.
SONG H Z, WANG F, SHEN X C.Research progress on the anti-obestiy effect and mechanism of plant polyphenols[J].Journal of Food Safety &Quality, 2020, 11(21):7721-7728.
[35] 《中国居民营养与慢性病状况报告(2020年)》发布成年居民超重肥胖超50%[J].初中生世界, 2021(14):61.
The Nutrition and Chronic Disease Status Report of Chinese Residents (2020) was released, and over 50% of adult residents were overweight and obese[J].Junior High School Students World, 2021(14):61.
[36] BASHIR A, DUSEJA A, DE A, et al.Non-alcoholic fatty liver disease development:A multifactorial pathogenic phenomena[J].Liver Research, 2022, 6(2):72-83.
[37] KAHN S E, COOPER M E, DEL PRATO S.Pathophysiology and treatment of type 2 diabetes:Perspectives on the past, present, and future[J].Lancet, 2014, 383(9922):1068-1083.
[38] LOOMBA R, FRIEDMAN S L, SHULMAN G I.Mechanisms and disease consequences of nonalcoholic fatty liver disease[J].Cell, 2021, 184(10):2537-2564.
[39] MUREA M, MA L J, FREEDMAN B I.Genetic and environmental factors associated with type 2 diabetes and diabetic vascular complications[J].The Review of Diabetic Studies, 2012, 9(1):6-22.
[40] AL-MRABEH A.Pathogenesis and remission of type 2 diabetes:What has the twin cycle hypothesis taught us?[J].Cardiovascular Endocrinology &Metabolism, 2020, 9(4):132-142.
[41] BENNETT K, ADITYA B S.An overview of diabetic nephropathy:epidemiology, pathophysiology and treatment[J].Journal of Diabetes Nursing, 2015, 19(2):61-67.
[42] 王紫轩, 薛琼雯, 罗亦轩, 等.中药通过肠道菌群改善肥胖症及其相关代谢性疾病的作用机制研究进展[J].上海中医药杂志, 2023, 57(2):1-7.
WANG Z X, XUE Q W, LUO Y X, et al.Research progress on mechanisms of traditional Chinese medicine in improving obesity and its related metabolic diseases through gut microbiota[J].Shanghai Journal of Traditional Chinese Medicine, 2023, 57(2):1-7.
[43] SHADMAN Z, KHOSHNIAT M, POORSOLTAN N, et al.Association of high carbohydrate versus high fat diet with glycated hemoglobin in high calorie consuming type 2 diabetics[J].Journal of Diabetes and Metabolic Disorders, 2013, 12:27.
[44] FAN-JIANG P Y, LEE P S, NAGABHUSHANAM K, et al.Pterostilbene attenuates high-fat diet and dextran sulfate sodium-induced colitis via suppressing inflammation and intestinal fibrosis in mice[J].Journal of Agricultural and Food Chemistry, 2021, 69(25):7093-7103.
[45] 马雯, 刘玉环, 阮榕生, 等.膳食多酚类化合物的研究进展[J].中国酿造, 2012, 31(4):11-14.
MA W, LIU Y H, RUAN R S, et al.Development of dietary polyphenols[J].China Brewing, 2012, 31(4):11-14.
[46] MOOSAVIAN S P, ARAB A, PAKNAHAD Z.The effect of a Mediterranean diet on metabolic parameters in patients with non-alcoholic fatty liver disease:A systematic review of randomized controlled trials[J].Clinical Nutrition ESPEN, 2020, 35:40-46.
[47] 夏洪淼. 茶多酚对非酒精性脂肪肝大鼠胰岛素抵抗的作用及其机制的研究[D].武汉:武汉大学, 2017.
XIA H M.Effect of tea polyphenols on insulin resistance in rats with nonalcoholic fatty liver disease and its mechanism[D].Wuhan:Wuhan University, 2017.
[48] GAN L, MENG Z J, XIONG R B, et al.Green tea polyphenol epigallocatechin-3-gallate ameliorates insulin resistance in non-alcoholic fatty liver disease mice[J].Acta Pharmacologica Sinica, 2015, 36(5):597-605.
[49] 杨秘. 石榴皮多酚对高脂诱导的NAFLD大鼠肝损伤的保护作用及其机制研究[D].西安:陕西师范大学, 2019.
YANG M.Protective effect of pomegranate peel polyphenols on liver injury induced by high fat in rats with NAFLD and its mechanism[D].Xi’an:Shaanxi normal university, 2019.
[50] WANG G L, HAN Q Q, YAN X P, et al.Polyphenols-rich extracts from walnut green husk prevent non-alcoholic fatty liver disease, vascular endothelial dysfunction and colon tissue damage in rats induced by high-fat diet[J].Journal of Functional Foods, 2021, 87:104853.
[51] CUI Y, YIN Y, LI S L, et al.Apple polyphenol extract targets circadian rhythms to improve liver biological clock and lipid homeostasis in C57BL/6 male mice with mistimed high-fat diet feeding[J].Journal of Functional Foods, 2022, 92:105051.
[52] PAQUETTE M, MEDINA LARQUÉ A S, WEISNAGEL S J, et al.Strawberry and cranberry polyphenols improve insulin sensitivity in insulin-resistant, non-diabetic adults:A parallel, double-blind, controlled and randomised clinical trial[J].British Journal of Nutrition, 2017, 117(4):519-531.
[53] 侯滕, 张民, 刘锐, 等.膳食多酚抗糖尿病活性、作用机制研究进展[J].现代食品, 2021, 27(19):64-68.
HOU T, ZHANG M, LIU R, et al.Research progress on anti-diabetic activity and mechanism of dietary polyphenols[J].Modern Food, 2021, 27(19):64-68.
[54] VISVANATHAN R, WILLIAMSON G.Effect of Citrus fruit and juice consumption on risk of developing type 2 diabetes:Evidence on polyphenols from epidemiological and intervention studies[J].Trends in Food Science &Technology, 2021, 115:133-146.
[55] 陈丽莉, 刘月, 牛晓琪, 等.黑树莓多酚对糖尿病小鼠血糖代谢的调控作用及机制研究[J].中草药, 2021, 52(17):5258-5266.
CHEN L L, LIU Y, NIU X Q, et al.Regulation and mechanism of polyphenol from Rubus occidentalis on blood sugar metabolism in diabetic mice[J].Chinese Traditional and Herbal Drugs, 2021, 52(17):5258-5266.
[56] JANG H J, RIDGEWAY S D, KIM J A.Effects of the green tea polyphenol epigallocatechin-3-gallate on high-fat diet-induced insulin resistance and endothelial dysfunction[J].American Journal of Physiology.Endocrinology and Metabolism, 2013, 305(12):E1444-E1451.
[57] TORRES-PIEDRA M, ORTIZ-ANDRADE R, VILLALOBOS-MOLINA R, et al.A comparative study of flavonoid analogues on streptozotocin-nicotinamide induced diabetic rats:Quercetin as a potential antidiabetic agent acting via 11β-hydroxysteroid dehydrogenase type 1 inhibition[J].European Journal of Medicinal Chemistry, 2010, 45(6):2606-2612.
[58] SUN X M, YE H Q, LIU J B, et al.Assessment of anti-diabetic activity of peanut shell polyphenol extracts[J].Journal of Zhejiang University.Science.B, 2018, 19(10):764-775.
[59] LYU J M, ISMAIL B B, YE X Q, et al.Ultrasonic-assisted nanoencapsulation of kiwi leaves proanthocyanidins in liposome delivery system for enhanced biostability and bioavailability[J].Food Chemistry, 2023, 416:135794.
[60] NIE Y, STÜRZENBAUM S R.Proanthocyanidins of natural origin:Molecular mechanisms and implications for lipid disorder and aging-associated diseases[J].Advances in Nutrition, 2019, 10(3):464-478.
[61] HARLAN L, MENA L T, RAMALINGAM L, et al.Mechanisms mediating anti-inflammatory effects of delta-tocotrienol and tart cherry anthocyanins in 3T3-L1 adipocytes[J].Nutrients, 2020, 12(11):3356.
[62] SANTOS H O, GENARIO R, GOMES G K, et al.Cherry intake as a dietary strategy in sport and diseases:A review of clinical applicability and mechanisms of action[J].Critical Reviews in Food Science and Nutrition, 2021, 61(3):417-430.
[63] CHANG Y Y, YANG D J, CHIU C H, et al.Antioxidative and anti-inflammatory effects of polyphenol-rich litchi (Litchi chinensis Sonn.)-flower-water-extract on livers of high-fat-diet fed hamsters[J].Journal of Functional Foods, 2013, 5(1):44-52.
[64] 李欣. 菝葜多酚对高脂高糖饮食诱导肥胖小鼠肠道菌群与脂类代谢和炎症相关性的研究[D].南昌:江西农业大学, 2021.
LI X.Study on the correlation between intestinal flora and lipid metabolism and inflammation in obese mice induced by high-fat and high-sugar diet[D].Nanchang:Jiangxi agricultural university, 2021.
[65] 陈宇欢. 普通菜豆豆奶和酸奶中小肽及多酚对炎症的改善作用及其机制[D].南昌:南昌大学, 2019.
CHEN Y H.Effects of small peptides and polyphenols in common bean milk and yogurt on inflammation and their mechanisms[D].Nanchang:Nanchang university, 2019.
[66] CHUANG C C, MARTINEZ K, XIE G X, et al.Quercetin is equally or more effective than resveratrol in attenuating tumor necrosis factor-α-mediated inflammation and insulin resistance in primary human adipocytes 1 2 3[J].The American Journal of Clinical Nutrition, 2010, 92(6):1511-1521.
[67] FANG X K, GAO J, ZHU D N.Kaempferol and quercetin isolated from Euonymus alatus improve glucose uptake of 3T3-L1 cells without adipogenesis activity[J].Life Sciences, 2008, 82(11-12):615-622.
[68] HAN Y H, SONG M Y, GU M, et al.Dietary intake of whole strawberry inhibited colonic inflammation in dextran-sulfate-sodium-treated mice via restoring immune homeostasis and alleviating gut microbiota dysbiosis[J].Journal of Agricultural and Food Chemistry, 2019, 67(33):9168-9177.
[69] HUANG J B, FENG S M, LIU A N, et al.Green tea polyphenol EGCG alleviates metabolic abnormality and fatty liver by decreasing bile acid and lipid absorption in mice[J].Molecular Nutrition &Food Research, 2018, 62(4):10.1002/mnfr.201700696.
[70] LI Y, RAHMAN S U, HUANG Y Y, et al.Green tea polyphenols decrease weight gain, ameliorate alteration of gut microbiota, and mitigate intestinal inflammation in canines with high-fat-diet-induced obesity[J].The Journal of Nutritional Biochemistry, 2020, 78:108324.
[71] WANG L, ZENG B H, LIU Z W, et al.Green tea polyphenols modulate colonic microbiota diversity and lipid metabolism in high-fat diet treated HFA mice[J].Journal of Food Science, 2018, 83(3):864-873.
[72] IKARASHI N, TODA T, OKANIWA T, et al.Anti-obesity and anti-diabetic effects of Acacia polyphenol in obese diabetic KKAy mice fed high-fat diet[J].Evidence-Based Complementary and Alternative Medicine, 2011, 2011:952031.
[73] 郭彤彤, 宋丹, 张鑫.乌龙茶多酚对高脂饮食诱导肥胖小鼠模型肠道菌群的调节作用[J].中国野生植物资源, 2019, 38(4):24-29.
GUO T T, SONG D, ZHANG X.The modulatory effect of oolong tea polyphenols on intestinal flora of high fat diet-induced obesity mice model[J].Chinese Wild Plant Resources, 2019, 38(4):24-29.
[74] 卢烽, 刘凤娇, 胡小松, 等.葡萄多酚改善高脂饮食诱导的小鼠高血脂及对肠道菌群的调节作用[J].中国食品学报, 2021, 21(7):97-106.
LU F, LIU F J, HU X S, et al.Grape polyphenol attenuated hyperlipidemia and modulated gut microbiota in high-fat diet-fed mice[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):97-106.
[75] ZHAO H A, CHENG N, ZHOU W Q, et al.Honey polyphenols ameliorate DSS-induced ulcerative colitis via modulating gut microbiota in rats[J].Molecular Nutrition &Food Research, 2019, 63(23):e1900638.
[76] 张齐. 猕猴桃籽多酚对高脂饮食诱导小鼠肥胖的预防作用及其机制[D].西安:西北大学, 2020.
ZHANG Q.Preventive effect of kiwifruit seed polyphenols on obesity induced by high fat diet and its mechanism[D].Xi’an:Northwestern university, 2020.
[77] 吐克孜·吾守尔.樱桃李果实多酚对高脂饮食肥胖小鼠脂代谢的影响研究[D].乌鲁木齐:新疆师范大学, 2021.
TUKZ HOSHUR.Cherry vivianlulu real polyphenols to study the effects of a high-fat diet fat lipid metabolism of mice[D].Urumqi:Xinjiang normal university, 2021.
[78] HUANG Y C, HUANG L T, SHEEN J M, et al.Resveratrol treatment improves the altered metabolism and related dysbiosis of gut programed by prenatal high-fat diet and postnatal high-fat diet exposure[J].The Journal of Nutritional Biochemistry, 2020, 75:108260.
[79] EBRAHIM H A, ALZAMIL N M, AL-ANI B, et al.Suppression of knee joint osteoarthritis induced secondary to type 2 diabetes mellitus in rats by resveratrol:Role of glycated haemoglobin and hyperlipidaemia and biomarkers of inflammation and oxidative stress[J].Archives of Physiology and Biochemistry, 2022, 128(5):1375-1382.
[80] TRINDADE P L, MARTINS F F, DOS RAMOS SOARES E, et al.Polyphenol-rich jaboticaba (Myrciaria jaboticaba) peel and seed powder induces browning of subcutaneous white adipose tissue and improves metabolic status in high-fat-fed mice[J].Journal of Functional Foods, 2022, 97:105238.
[81] YUAN M L, CHEN X, SU T X, et al.Supplementation of kiwifruit polyphenol extract attenuates high fat diet induced intestinal barrier damage and inflammation via reshaping gut microbiome[J].Frontiers in Nutrition, 2021, 8:702157.
[82] PAN S M, YAN X B, LI T, et al.Tea polyphenols improve lipid metabolism in hybrid grouper (♀ Epinephelus fuscoguttatus × ♂ E.lanceolatu) fed high-lipid diets[J].Aquaculture Reports, 2022, 25:101217.
[83] KAN J, CHEN C C, HUO T B, et al.Polyphenolic-enriched peach peels extract regulates lipid metabolism and improves the gut microbiota composition in high fat diet-fed mice[J].Journal of Functional Foods, 2020, 72:104082.
[84] LAMA A, PIROZZI C, MOLLICA M P, et al.Polyphenol-rich virgin olive oil reduces insulin resistance and liver inflammation and improves mitochondrial dysfunction in high-fat diet fed rats[J].Molecular Nutrition &Food Research, 2017, 61(3).DOI:10.1002/mnfr.201600418.
[85] LI S, XIAN F R, GUAN X, et al.Neural protective effects of millet and millet polyphenols on high-fat diet-induced oxidative stress in the brain[J].Plant Foods for Human Nutrition, 2020, 75(2):208-214.
[86] 苏天霞, 袁敏兰, 周艳, 等.猕猴桃皮多酚对高脂膳食大鼠脂代谢紊乱的调节作用[J].食品科学, 2020, 41(17):196-201.
SU T X, YUAN M L, ZHOU Y, et al.Kiwifruit peel polyphenols regulate lipid metabolism disorders induced by a high fat diet in rats[J].Food Science, 2020, 41(17):196-201.
[87] HIRONAO K Y, ASHIDA H, YAMASHITA Y.Black soybean seed coat polyphenol ameliorates the abnormal feeding pattern induced by high-fat diet consumption[J].Frontiers in Nutrition, 2022, 9:1006132.