硒(selenium)是一种人体和其他哺乳动物必需的微量元素,除了具有抗氧化作用、免疫调节、抗炎、防癌抗癌及抗肝损伤作用外,其在降血糖、抗糖尿病视网膜病变、降血压、抗动脉硬化、抗高胆固醇血症及抗心肌缺血再灌注损伤等方面也起到了重要作用[1]。由于人体无法自行合成硒,因此只能从食物中摄取[2],自然界存在有无机态和有机态2种硒形态,其中无机硒毒性较大,而有机硒以及单质硒则具有更高的安全性和生物利用率[3-4]。近年来,随着公众健康意识的不断提高,硒的营养价值和生理功能引起了广泛关注,特别是在食品科学领域,如何通过科学、高效的食品摄入方式补充有机硒以满足人体健康需求,已成为研究的新热点。
我国是硒缺乏国家,硒的分布极不均衡,约2/3土地存在硒缺乏情况[5]。直接人工合成有机硒存在技术难度高和成本高的问题。相比之下,微生物具有繁殖快、易操作及转化能力强等特点,因此许多研究者将目光聚焦于微生物富集硒的方法研究[6]。乳酸菌作为常用于食品工业的益生菌,应用于无机硒的转化可确保富硒食品的安全性[7]。同时,在生理特性方面,乳酸菌的生长和代谢活动条件(生长温度和pH值等)更接近于人体环境,单位体积内的益生菌菌群数量也可达到理想的高密度,从而保证其在人体消化道恶劣环境中的高存活率。肠道定植能力是益生菌菌株的重要特征,因为益生菌需要能够在肠道中存活和发挥作用才能发挥其健康益处。与酵母菌相比,乳酸菌在肠道内定植能力更为显著,这是因为能够产生胞外多糖(exopolysaccharides, EPS)和胆盐水解酶的基因在许多乳酸菌中普遍存在,这些特征有助于乳酸菌抵抗胃肠道环境的压力,并且乳酸菌在维持肠道菌群和稳态方面也发挥着重要作用[8]。富硒乳酸菌产品不仅有助于提高食品中有机硒含量,还能通过乳酸菌的益生作用促进人体对硒的吸收和利用[9]。因此,富硒乳酸菌在功能性食品和医药领域具有广阔的应用前景。
通过对富硒乳酸菌硒化产物分布的深入研究,有助于进一步探索硒在乳酸菌中的转化机制和生物可利用率。此外,分析硒对乳酸菌菌株生长的影响,有助于筛选和优化富硒乳酸菌菌株。本文旨在综述富硒乳酸菌的相关研究进展,包括硒在乳酸菌中的生物转化、硒化产物分布、硒对乳酸菌菌株的影响以及富硒乳酸菌在食品工业和人体健康中的应用前景。通过对现有文献的分析,期望为富硒乳酸菌的深入研究和应用提供有价值的参考。
1 乳酸菌富硒机制
在自然界中,硒主要以无机形态形式存在,包括硒化物(Se2-)、单质硒(Se0)、亚硒酸盐(SeO32-)和硒酸盐(SeO42-)。其中硒化物(Se2-)、亚硒酸盐(SeO32-)和硒酸盐(SeO42-)是毒性较大的硒形式,其毒性与水溶性等有关,同等条件下水溶性越强毒性越强。乳酸菌能积累并生物转化无机硒,但其富集机制尚存争议,特别是转运过程、硒酸盐和亚硒酸盐的还原机制以及硒纳米粒子(selenium nanoparticles, SeNPs)的组装机制。大量研究表明,不同细菌通过复杂的生物化学途径将硒酸盐和亚硒酸盐进行转化(图1),此过程主要包括3个主要阶段:首先,硒酸盐和亚硒酸盐经细胞膜转运进入细胞内;其次,它们在细胞内被还原;最后,Se0组装形成SeNPs。
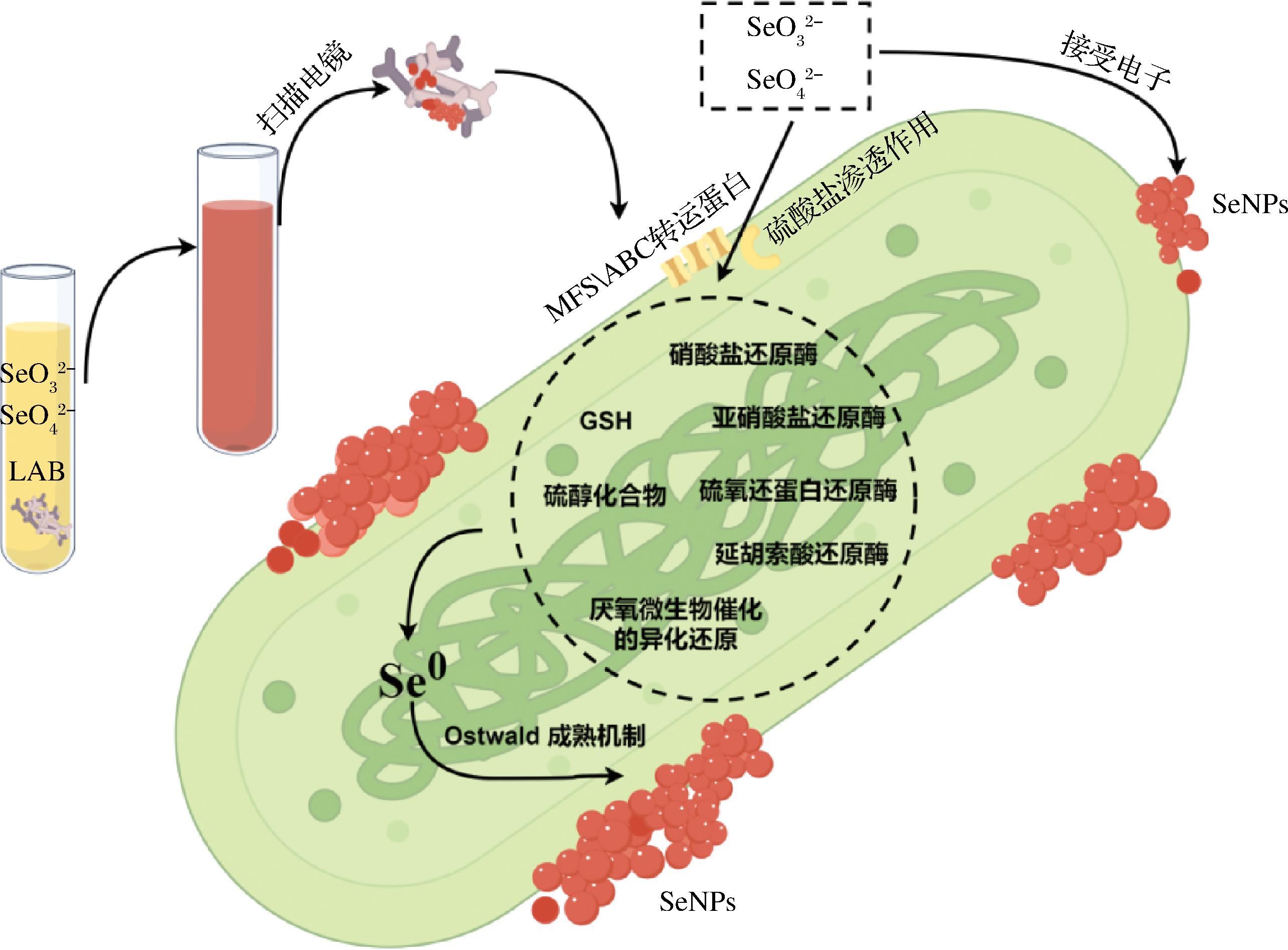
图1 乳酸菌富硒机制
Fig.1 Mechanism of selenium enrichment in lactic acid bacteria
注:本图由Figdraw绘制。
1.1 硒酸盐和亚硒酸盐在细胞膜转运
乳酸菌能够通过细胞膜摄取环境中的硒酸盐,然而,目前并未发现这些耐硒菌株拥有专门的硒酸盐转运系统。现有研究表明,乳酸菌细胞内的硒转运通道主要包括2种机制:一是由于硫和硒的结构相似,推测硒酸盐或亚硒酸盐被运输到细菌细胞中可能是通过硫酸盐渗透物[10]被运输至细菌细胞内;二是依赖相关转运蛋白的跨膜转运机制,硒酸盐或亚硒酸盐可能借助特定转运蛋白跨膜转运进入细胞内部。YANG等[11]发现,亚硒酸盐进入短乳杆菌JLD715细胞与主要促进剂超家族(major facilitator superfamily, MFS)转运蛋白(该超家族中已知的最大的次级转运蛋白家族,可在无机阴离子和阳离子的运输中发挥作用)和ATP结合盒(ATP-binding cassette, ABC)转运蛋白(大多数ABC蛋白负责跨膜转运各种化合物)密切相关。林官根[12]在短乳杆菌CGMCC 6683中也得出了相似结论,研究还发现了几个与膜转运蛋白合成相关的显著差异表达基因:涉及编码MFS转运蛋白(LVIS_1917、LVIS_0613)和编码ABC转运蛋白(LVIS_0178、LVIS_0472)的基因,它们均参与无机盐离子转运,但具体功能、结构及如何将亚硒酸盐运送至乳酸菌细胞内还有待进一步实验证明。
1.2 硒酸盐和亚硒酸盐在细胞内被还原
在细胞内部,硒酸盐或亚硒酸盐通常被还原为有机硒或零价硒。然而,关于硒酸盐或亚硒酸盐在细菌细胞中的还原机制一直存在诸多争议。其中一种还原机制是通过厌氧微生物催化硒酸盐和亚硒酸盐的异硒还原(呼吸还原)反应,将其还原为零价硒(Se0)[13]。OREMLAND等[13]发现,巴氏硫螺旋菌(Sulfurospirillum barnesi)、硒化还原芽孢杆菌(Bacillus selenitireducens)和硒化厌氧菌(Selenihalanaerobacter shriftii)均能够将硒酸盐或亚硒酸盐通过异化作用转化为胞外稳定且均匀的球形Se0颗粒。
第二种还原机制涉及由细胞内硫醇化合物和谷胱甘肽(glutathione, GSH)参与的合成过程[14-16],GSH是细菌和真核生物中含量最丰富的低分子质量硫醇。KESSI等[17]发现在还原过程中硫基表现出高活性,亚硒酸盐可与多种硫醇反应生成三硫化硒衍生物,而亚硒酸盐与GSH反应则生成硒二谷胱甘肽,这些衍生物是无机硒向生物活性硒化合物转化的中间体。在该反应中,GSH被氧化为硒二谷胱甘肽,随后被谷胱甘肽还原酶(glutathione reductase, GR)还原为GSH并分解产生Se0[18],或用作合成硒磷酸合成酶的底物。GR是一种黄蛋白二核氧化还原酶,能催化NADPH依赖的谷胱甘肽还原,维持细胞内高GSH/GSSG(谷胱甘肽二硫)水平,从而参与细胞抗氧化应激[19]。此外,硒化半胱氨酸裂解酶(selenocysteine lyase, SCL)能将硒半胱氨酸(selenocysteine, SeCys)分解为Se0和丙氨酸,同时其还能将Se0调入SeCys以合成硒磷酸盐,用以合成生产SeCys tRNA,而SeCys tRNA是SeCys和硒蛋白的前体物质[20]。
一般而言,亚硒酸盐可通过细菌的硝酸盐/亚硝酸盐还原酶和多肽或蛋白质的巯基被还原成Se0。高通量转录组测序结果表明,在5 mmol/L Na2SeO3的MRS培养基中生长24 h的短乳杆菌菌体内,差异表达基因主要富集在丙酮酸盐代谢通路、脂肪酸生物合成通路及NOD样受体信号通路和硒化物代谢通路,与编码菌体内巯基还原相关酶以及短乳杆菌电子传递链相关蛋白合成的基因显著上调表达,推断亚硒酸盐进入菌体内被含有巯基基团的物质(如Met)还原为低价肽硒化物,这些硒化物作为前体物质被合成含硒氨基酸,进而掺入到含硒蛋白质的合成[12]。此外,也有研究发现,通过硫氧还蛋白还原酶和延胡索酸还原酶等的作用,亚硒酸盐亦可被还原为纳米硒单质[21]。
总之,硒酸盐和亚硒酸盐还原过程可能涉及多种机制以及多种中间产物,且不同的乳酸菌硒酸盐和亚硒酸盐还原机制可能存在差异,需进一步研究。
1.3 Se0组装形成SeNPs
目前尚未完全阐明SeNPs的组装机理,其与Se0的合成位置(细胞内、周质或细胞外)有关。已有研究发现,部分细胞内Se0通过细胞膜转运至细胞外,并在此进一步转化SeNPs,该过程仅在亚硒酸盐在细胞内被还原为Se0且存在细胞外组装的情况下发生。DEBIEUX等[14]发现,细胞内组装的SeNPs可能与一种分子质量约为95 kDa的分泌蛋白Se factor a(SefA)相关,SefA并没有硒酸盐还原酶活性,但它可以促进SeNPs的形成。王金泽等[21]的观察结果表明,富硒乳酸菌在添加NaSeO4 24 h后,纳米单质硒同时存在于胞外和胞内,且多呈球形,因此推测SeNPs的合成部分发生在胞内,随后被分泌至胞外。尽管如此,SeNPs的精确组装机制仍不完全清楚。还有研究发现,胞外的亚硒酸钠接受来自短乳杆菌电子传递链的电子,逐步被还原为单质硒,这些单质硒在菌体表面聚集形成纳米颗粒[12]。此外,细菌转化和组装SeNPs的过程还可能涉及Ostwald成熟机制[22-23],这些初始尺寸较小的SeNPs可能会聚集形成更大尺寸的SeNPs。
总体而言,细菌对硒的富集主要涉及以下4个步骤:首先,亚硒酸盐通过某些非特异性转运蛋白(如硫酸盐渗透酶、MFS转运蛋白或ABS转运蛋白)进入细胞内;其次,在某些特定物质(亚硝酸盐还原酶、硝酸盐还原酶、GSH等)的作用下,亚硒酸盐被逐步还原为多种中间体(GS-Se-SG、GS-Se-等),最终生成Se0或有机硒形式;随后,这些Se0被运出细胞;最后,这些Se0在细胞外被组装成纳米硒。其中,步骤二和步骤四始终存在,而步骤一和步骤三的发生取决于步骤二和步骤四是在细胞内、周质还是细胞外进行[24]。只有当SeO32-、SeO42-在细菌胞内还原为Se0,且Se0在胞外完成组装时,第三步骤才会发生。
2 富硒乳酸菌的硒化产物及特性
近年来,以微生物为载体将无机硒(硒酸盐或亚硒酸盐)转化为有机硒或纳米硒的研究受到广泛关注。乳酸菌可将无机硒生物转化为诸如硒蛋白(包括硒代甲硫氨酸[25]、硒代半胱氨酸[26]及甲基硒代半胱氨酸[27]等)、硒多糖[28]及硒纳米粒子[29]等多种有机形态。然而,关于这些有机硒在细菌细胞各组分中的分布及特性,目前的研究相对较少,成为当前研究的热点领域。
2.1 有机硒
韦梦婷等[6]通过对实验菌株的自由基清除力、还原力及胆盐耐受性实验证明了乳酸菌具有将无机硒转化为有机硒的能力。相比于无机硒,有机硒在激发免疫作用更为显著且人体吸收率更高。SUN等[30]通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)对富硒乳酸菌进行了分析,发现副干酪乳杆菌所吸收的Se可与其细胞内的蛋白质、多糖和核酸结合,从而影响相应化学键的状态。此外,研究还发现,在细胞内,有机硒主要分布于蛋白质中,其次为多糖或核酸,但同时硒还可能与脂质结合或合成为其他小分子硒化合物[30-31]。
2.1.1 硒蛋白
硒蛋白是富硒乳酸菌中分布最多的有机硒,是硒在机体发挥生理功能的主要形式。MORENO-REYES等[32]研究发现,硒循环中硒蛋白占约90%以上,小分子硒代谢产物仅占约5%,其认为硒的生理作用主要通过硒蛋白和硒代谢物共同作用,并且硒蛋白在维持人体健康和预防疾病方面发挥着重要作用[33]。乳酸菌对无机硒进行生物转化时,硒倾向于结合至蛋白质成分中,硒蛋白是其有机硒的主要形式。CHEN等[31]通过分析硒化后的副干酪乳杆菌蛋白质提取物中的Se含量发现,水溶性、盐溶性及碱溶性蛋白质提取物中,硒含量分别占有机硒的24.7%、11.1%及49.4%,而其他未提取蛋白中有机硒含量占14.9%,但未获得醇溶性蛋白,这与PIENIZ等[34]研究者的结果一致。因此,碱溶性蛋白是乳酸菌富硒后的主要结合蛋白。凝胶电泳技术分离结果表明,富硒副干酪乳杆菌中的硒可能更倾向于与分子质量较小的蛋白质结合。
在乳酸菌中,有机硒氨基酸最常以硒代甲硫氨酸(selenomethionine, SeMet)和硒代半胱氨酸(selenocysteine, SeCys)的形式存在。其中,SeCys是生物可利用性最强的硒形式。在动物和细菌中,SeCys被整合入蛋白的过程由UGA密码子指导,而SeMet则是以非特异性的方式取代Met后与蛋白质结合。因此,SeMet较SeCys的后续代谢性差[35]。此外,不同富硒乳酸菌菌株中SeCys和SeMet的含量也存在差异。PESCUMA等[36]在嗜酸乳杆菌CRL636和罗伊氏乳杆菌CRL1101培养基中添加无机硒后,发现2株菌株细胞中均会产生SeCys和SeMet,其中CRL1101的含量显著高于CRL636。MART NEZ等[37]对96株果源性和花源性菌株富硒发现,细胞中仅含有SeCys。CHEN等[31]发现对P.acidilactici MRS-7富硒后,其中谷氨酸(Glu)、色氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、甲硫氨酸(Met)、苯丙氨酸(Phe)、赖氨酸(Lys)和精氨酸(Arg)的浓度均提高,而缬氨酸(Val)、亮氨酸(Leu)、脯氨酸(Pro)、丙氨酸(Ala)、酪氨酸(Tyr)及异亮氨酸(Ile)的浓度均降低。总体而言,富硒处理增加了P.acidilactici MRS-7中氨基酸的总浓度,这是因为Se不仅可与蛋白质结合,还可整合到其他生物大分子中,诸如seleno-tRNA-s (13),从而影响蛋白质的生物合成,并导致氨基酸总量增加[38]。其中Met的含量增加尤为明显,这可能是由于硫和硒的化学性质相似,硒取代了Met中的硫形成SeMet,促进了蛋白质与硒的结合,从而使含硫氨基酸的含量增加[39]。
NEZ等[37]对96株果源性和花源性菌株富硒发现,细胞中仅含有SeCys。CHEN等[31]发现对P.acidilactici MRS-7富硒后,其中谷氨酸(Glu)、色氨酸(Ser)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、甲硫氨酸(Met)、苯丙氨酸(Phe)、赖氨酸(Lys)和精氨酸(Arg)的浓度均提高,而缬氨酸(Val)、亮氨酸(Leu)、脯氨酸(Pro)、丙氨酸(Ala)、酪氨酸(Tyr)及异亮氨酸(Ile)的浓度均降低。总体而言,富硒处理增加了P.acidilactici MRS-7中氨基酸的总浓度,这是因为Se不仅可与蛋白质结合,还可整合到其他生物大分子中,诸如seleno-tRNA-s (13),从而影响蛋白质的生物合成,并导致氨基酸总量增加[38]。其中Met的含量增加尤为明显,这可能是由于硫和硒的化学性质相似,硒取代了Met中的硫形成SeMet,促进了蛋白质与硒的结合,从而使含硫氨基酸的含量增加[39]。
2.1.2 硒多糖
经过硒化修饰后,乳酸菌所产生的多糖类物质可与硒结合,形成硒多糖。硒多糖不仅具有降血压的功效,同时其免疫激活作用和抗肿瘤活性也优于未经硒化的胞外多糖[40-42]。硒多糖的连接方式以1-3糖苷键为主,构型多为β-构型。目前,现有的研究主要集中于提取乳酸菌胞外多糖后,对其进行硒化修饰,而对于富硒乳酸菌直接生成硒多糖的研究则较少。富硒乳酸菌的硒多糖产量易受菌种和富硒条件等因素影响,同时不同乳酸菌株采取不同富硒方式或提取方法所获得的多糖结构也存在差异。白芳芳等[43]对6株乳酸菌富硒后发现,鼠李糖乳杆菌是产多糖较多的耐硒菌株,在培养时间24 h、接菌量5%、亚硒酸钠质量浓度12.5 μg/mL、培养温度37 ℃的条件下,鼠李糖乳杆菌的富硒率为79.21%,胞外多糖含量为51.47 μg/mL。景晨茜[44]发现鼠李糖乳杆菌胞外多糖(Kb-EPS)和其硒化胞外多糖(Se-EPS)的表观形态以及单糖组成存在显著不同,由图2可见,硒化后EPS表面更加分散和碎片化,出现了椭球状颗粒,多糖之间的糖苷键断裂,改变了多糖的分子结构。同时发现,在多糖质量浓度为0~8 mg/mL时,Se-EPS抑制α-葡萄糖苷酶和α-淀粉酶的能力显著强于Kb-EPS(P<0.05),且Se-EPS在质量浓度为4 mg/mL时,对这2种酶的抑制率分别达到56.61%和46.70%,其抗氧化性也相应提高。
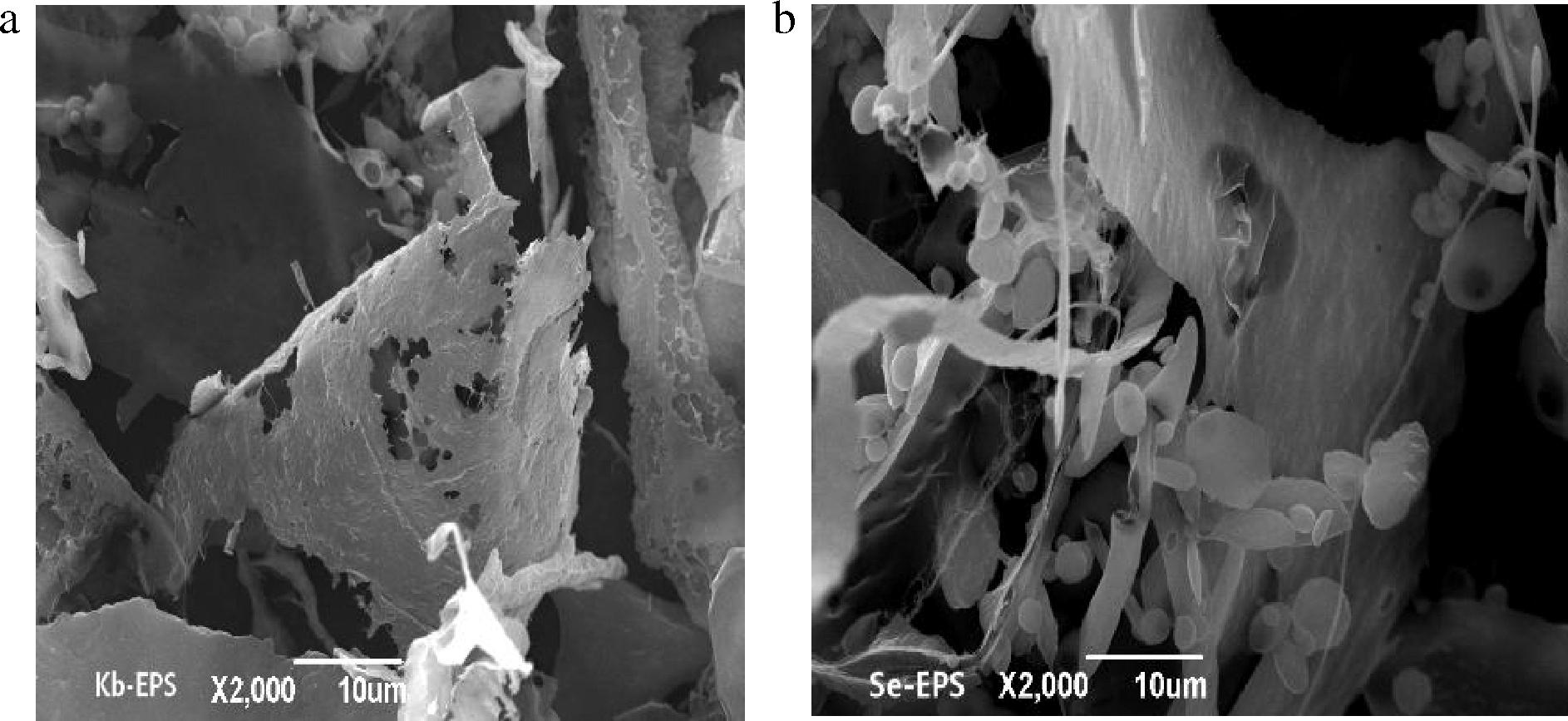
a-鼠李糖乳杆菌胞外多糖;b-鼠李糖乳杆菌硒化胞外多糖
图2 鼠李糖乳杆菌胞外多糖和硒化胞外多糖扫描电镜图[44]
Fig.2 Scanning electron microscopy images of Lactobacillus rhamnosus Kb-EPS and Se-EPS
2.2 硒纳米粒子
硒纳米粒子(SeNPs)是富硒益生菌最显著的特征之一。其在扫描电子显微镜下,可见富硒乳酸菌细胞表面存在许多纳米形态的球体(图3),而富硒乳酸菌在肉眼观察下则呈现红色或浅红色。当乳酸菌在富硒环境中生长时,菌落会表现出由白色至红色的时间依赖性颜色变化[6]。这种特有的红色是由于单斜Se粒子的表面等离子体振动的激发所引起[45],因此通常用红色的深浅表征单质硒的多少。SUN等[30]通过扫描电镜观察到富硒副干酪乳杆菌表面存在球形颗粒,进而通过能量色散谱仪(energy dispersive spectroscopy, EDS)分析发现在1.335 keV附近有硒特征能量峰,表明这些颗粒物处于硒的零价态[46],这些球形颗粒是在微生物细胞中所观察到的最常见硒形态[47]。当然,不同乳酸菌菌株产生的纳米颗粒也存在差异,MART NEZ等[37]通过观察8株乳酸菌形成SeNPs的透射电子显微镜(transmission electron microscopy, TEM)发现,SeNPs可单独存在,也可与多糖和蛋白质结合形成Se0聚集体,呈现微晶形态。王金泽等[21]通过FTIR分析发现,富硒乳酸乳球菌产生的纳米硒颗粒表面存在着蛋白质、脂类及碳水化合物等有机物成分,即纳米硒粒子外层被细菌蛋白质组分和多糖等所包裹。该乳酸菌的细菌蛋白质不仅参与了亚硒酸钠的还原,还参与了纳米硒粒子的组装与稳定。同样,XU等[48]得出了类似的结论,并发现富硒干酪乳杆菌L.casei 393菌株所产生的球形SeNPs包含碳、氧、氮、硫、磷及硒等元素。通过TEM分析,他们还发现细胞在接触SeNPs 12 h后细胞内出现大量SeNPs颗粒,证明了SeNPs可以通过内吞作用进入细胞质。在SeNPs的稳定性方面,生物源的SeNPs较化学方法和物理制备方法制备的SeNPs具有较高稳定性,因为生物源SeNPs存在生物大分子的自然包覆作用,因此稳定性更高且不会随时间推移而发生聚集[49]。生物源SeNPs的粒径通常在40~500 nm,具体取决于所使用的菌株[50-53]。由于颗粒尺寸缩小时比表面积增加,因此较小的硒纳米颗粒会展现出更高的生物活性,主要包括其抗羟基自由基功能和保护DNA免受氧化作用[23]。另一方面,小于100 nm的SeNPs在胃肠道中的吸收率较大颗粒的SeNPs高15至250倍[54]。
NEZ等[37]通过观察8株乳酸菌形成SeNPs的透射电子显微镜(transmission electron microscopy, TEM)发现,SeNPs可单独存在,也可与多糖和蛋白质结合形成Se0聚集体,呈现微晶形态。王金泽等[21]通过FTIR分析发现,富硒乳酸乳球菌产生的纳米硒颗粒表面存在着蛋白质、脂类及碳水化合物等有机物成分,即纳米硒粒子外层被细菌蛋白质组分和多糖等所包裹。该乳酸菌的细菌蛋白质不仅参与了亚硒酸钠的还原,还参与了纳米硒粒子的组装与稳定。同样,XU等[48]得出了类似的结论,并发现富硒干酪乳杆菌L.casei 393菌株所产生的球形SeNPs包含碳、氧、氮、硫、磷及硒等元素。通过TEM分析,他们还发现细胞在接触SeNPs 12 h后细胞内出现大量SeNPs颗粒,证明了SeNPs可以通过内吞作用进入细胞质。在SeNPs的稳定性方面,生物源的SeNPs较化学方法和物理制备方法制备的SeNPs具有较高稳定性,因为生物源SeNPs存在生物大分子的自然包覆作用,因此稳定性更高且不会随时间推移而发生聚集[49]。生物源SeNPs的粒径通常在40~500 nm,具体取决于所使用的菌株[50-53]。由于颗粒尺寸缩小时比表面积增加,因此较小的硒纳米颗粒会展现出更高的生物活性,主要包括其抗羟基自由基功能和保护DNA免受氧化作用[23]。另一方面,小于100 nm的SeNPs在胃肠道中的吸收率较大颗粒的SeNPs高15至250倍[54]。

图3 富硒乳酸菌扫描电镜图[30]
Fig.3 Scanning electron microscopy images of selenium-enriched lactic acid bacteria
3 富硒对菌株生长和营养价值的影响
乳酸菌在不同的无机硒浓度下对有机硒的转化能力和菌体生长影响存在显著差异。MART NEZ等[37]发现,添加亚硒酸盐浓度在8%~100%时,微生物菌株在培养基中的转化能力呈现先升后降的趋势,且不同菌株间存在显著差异。研究人员将亚硒酸钠添加量与富硒率的变化及乳酸菌的生物量变化关联分析,认为这可能是由于亚硒酸钠质量浓度的增加,硒对乳酸菌产生了毒害作用[55],即菌体自身代谢遭到破坏。在高浓度硒环境中,乳酸菌还会出现细胞膜破损、ATP浓度下降、膜电位“去极化”及菌体内pH下降等现象,并且pH下降趋势与杀菌物质浓度成反比关系[12]。此外,微生物在富硒环境中也可能发生适应性遗传变异,但这仅发生在无机硒浓度较高的情况下。ZAN等[56]研究证明,富硒后植物乳杆菌L. plantarum 6076的基因未发生显著变化,表明其硒富集能力是通过现有的代谢途径和基因组特征实现,而非新的基因突变或基因重组。
NEZ等[37]发现,添加亚硒酸盐浓度在8%~100%时,微生物菌株在培养基中的转化能力呈现先升后降的趋势,且不同菌株间存在显著差异。研究人员将亚硒酸钠添加量与富硒率的变化及乳酸菌的生物量变化关联分析,认为这可能是由于亚硒酸钠质量浓度的增加,硒对乳酸菌产生了毒害作用[55],即菌体自身代谢遭到破坏。在高浓度硒环境中,乳酸菌还会出现细胞膜破损、ATP浓度下降、膜电位“去极化”及菌体内pH下降等现象,并且pH下降趋势与杀菌物质浓度成反比关系[12]。此外,微生物在富硒环境中也可能发生适应性遗传变异,但这仅发生在无机硒浓度较高的情况下。ZAN等[56]研究证明,富硒后植物乳杆菌L. plantarum 6076的基因未发生显著变化,表明其硒富集能力是通过现有的代谢途径和基因组特征实现,而非新的基因突变或基因重组。
在硒富集过程中,乳酸菌自身性质会产生一些特性变化,使富硒乳酸菌较普通乳酸菌具有更多的功能特性,其不仅可以作为硒补充剂,同时在功能食品、保健品及医药领域也有更广泛的应用前景。在理想的硒浓度条件下,对乳酸菌进行硒富集不仅不会对其益生潜力及菌株生长造成不利影响,反而可以观察到益生特性的显著增强,如精确控制硒浓度后,植物乳杆菌L.plantarum 6076在模拟胃酸和肠道环境中的耐受能力、对pH变化的适应性、对胆汁盐的抵抗力以及细胞表面的疏水性能均展现出相较于未富硒状态时的明显提升[56]。这些益生特性的增强,为进一步探索乳酸菌在促进宿主健康和增强食品安全性方面的应用潜力提供了科学依据。CHEN等[31]的研究也得出了类似结论,硒化不会影响乳酸菌P.acidilactici MRS-7在胃肠道系统中的生存,富硒后的乳酸菌仍具有益生菌潜力且不会影响细胞形状。研究还发现,Se可通过协同、拮抗或其他复杂的调控机制影响植物或微生物对微量元素的吸收。例如Zn和Cu是催化超氧化物歧化酶的重要组分,已有研究报道Se浓度与Fe、Zn及Cu的浓度呈正相关[57]。此外,有研究者采用电感耦合等离子体发射光谱仪评价了Se对P.acidilactici MRS-7中微量元素组成的影响,结果表明除K和S外,在Se处理后,所有检测到的元素浓度均有所升高[31]。
乳酸菌本身具有多重生物学功能,如促进肠道健康、提高免疫力等。硒的抗癌、抗氧化、提高免疫力、抗肝损伤等功能与乳酸菌的生物学功能相结合,使得富硒乳酸菌在预防疾病、促进健康等方面更具优势,并改善了发酵食品的营养价值。富硒乳酸菌具有一定的解毒功效,其能够对黄曲霉菌的生长和产毒产生明显抑制作用[58],还有研究者发现富硒乳酸菌能够缓解黄曲霉毒素B1诱导的上皮细胞凋亡[59]。在促进疾病康复方面也发挥了积极的作用,仲雨晴[60]发现富硒乳酸菌能够有效缓解小鼠结肠炎,其效果优于富硒酵母菌和无机硒。并且对小鼠慢性酒精性肝损伤也能起到良好的缓解作用,低剂量的乳酸菌硒就可以达到较好的效果。富硒乳酸菌比其他硒补充剂更有效提高硒酶活力的原因可能是其主要含有的硒形态SeCys比SeMet、SeO32-更容易被机体吸收利用[60]。除此之外,在蛋鸡日粮中添加富硒乳酸菌可以提高蛋鸡的生产性能、免疫力以及鸡蛋的蛋白质含量[61]。富硒乳酸菌在发酵食品中也被广泛地应用,左映平等[62]发现采用富硒植物乳杆菌发酵复合果蔬汁相较于接种普通乳酸菌和自然发酵不仅会增加酚类物质的合成,同时也会降低酚类物质的氧化,从而增加多酚类生物活性物质的含量,并且复合果蔬汁的体外抗氧化能力也出现了显著的提升。章金梅等[63]在榨菜的腌制过程中等比例的添加乳酸菌和亚硒酸钠, 最后得到风味更好, 亚硝酸盐含量更低的富硒榨菜。由于富硒乳酸菌发酵食品具有较高的抗氧化能力、较低的后酸化[36],可以延长商品货架期、更有利于贮藏过程中基本品质的保持。总之,富硒乳酸菌具有更多的健康益处,可用于开发具有增强功能的新型益生菌产品。
4 结论
富硒益生菌的发展为解决地方性硒缺乏这一营养问题提供了可行性方案。乳酸菌凭借其特有优势被认为是最适合无机硒生物转化的载体之一。乳酸菌能将无机硒转化为更安全、更利于人体吸收利用以及营养价值更高的有机硒和纳米硒粒子。目前,富硒乳酸菌在食品和保健品领域已取得了显著成就。然而,富硒乳酸菌的硒转化机制较为复杂,并且不同菌株产生的硒化产物在特性和组成上或存在差异。尽管已有相关研究,但具体的转化机制、最终产物及其特性仍不甚清晰。在适宜浓度下,富硒乳酸菌的生长通常不受不利影响,同时营养价值和益生特性也得到提高,但高硒浓度仍会对细胞产生毒害作用。研究富硒乳酸菌不仅有助于揭示硒在乳酸菌中的代谢途径和生物有效性,还为筛选具有优越硒富集能力的乳酸菌菌株和优化其硒转化过程提供了科学支持。
尽管围绕富硒乳酸菌的研究已经取得了丰硕成果,但仍有若干问题有待解决:a)目前对乳酸菌富硒后的产物研究主要集中在硒蛋白及纳米硒,而对其他产物,如硒多糖等的研究较为缺乏,需进一步深入探究;b)需对富硒乳酸菌生成的主要产物硒蛋白进行深入研究,以生产更多满足需求且营养价值更高的硒蛋白,同时各种硒蛋白的生物学功能有待进一步验证;c)富硒乳酸菌的安全性研究仍不充分,需要进一步深入探讨其对人体及环境的影响,包括其对人体的毒性和过敏性等方面的研究。同时,富硒乳酸菌的药用活性应逐步从临床前的探索性研究转向临床,以验证其真正的功效;d)未来,基因工程和分子生物学技术将成为构建和优化对无机硒具有显著转化能力的耐硒乳酸菌株的新趋势。利用精准的基因编辑和克隆技术,可以有效改造乳酸菌基因组,增强其内在的硒转化能力。主要措施包括:提高亚硒酸盐还原酶的活性,调控相关代谢通路,提高乳酸菌对无机硒的生物转化效率。同时,运用CRISPR-Cas9等技术手段,可以实现特定基因的精确敲除或插入,进一步优化乳酸菌的耐硒性能和硒的生物利用度;e)鉴于已有研究提出的可能机制,尚缺乏富硒乳酸菌硒富集过程的完整科学解释。亟需深入探究细胞内部的关键环节,如亚硒酸盐和硒酸盐的转运、还原代谢机制以及纳米硒颗粒的生成等,以期全面阐明该过程的闭环机制。
乳酸菌生物转化硒的机理研究是一个重要的研究方向,通过基因组学、蛋白质组学和代谢组学等先进技术手段,可以阐明乳酸菌转化硒的具体过程和机制。这些研究成果将为开发富含高附加值硒化合物的乳酸菌产品提供科学依据,助力于食品和医药工业的应用开发。总之,深入探索富硒乳酸菌的功能特性和应用潜力,对该领域的学术研究和产业发展具有重要意义。
[1] 贺栋, 祁珊珊, 郑红星, 等.硒的生理功能及富硒产品研究进展[J].食品研究与开发, 2023, 44(1):191-196.
HE D, QI S S, ZHENG H X, et al.Physiological functions of selenium and selenium-enriched products:A review[J].Food Research and Development, 2023, 44(1):191-196.
[2] 杨善岩, 李海龙, 狄志鸿.硒元素生理功能及微生物富硒发酵研究现状[J].食品工业, 2013, 34(6):167-170.
YANG S Y, LI H L, DI Z H.Research status of the physiological functions of selenium and concentrating selenium of microbe[J].The Food Industry, 2013, 34(6):167-170.
[3] ZHANG J S, WANG H L, YAN X X, et al.Comparison of short-term toxicity between Nano-Se and selenite in mice[J].Life Sciences, 2005, 76(10):1099-1109.
[4] NUTTALL K L.Evaluating selenium poisoning[J].Annals of Clinical and Laboratory Science, 2006, 36(4):409-420.
[5] 潘芸芸, 姜竹茂, 艾春梅, 等.富硒乳制品的生产研发进展及前景分析[J].中国乳业, 2020(8):89-92.
PAN Y Y, JIANG Z M, AI C M, et al.Development and prospect analysis of selenium-enriched dairy products[J].China Dairy, 2020(8):89-92.
[6] 韦梦婷, 王英, 单成俊, 等.富硒乳酸菌的筛选和体外活性的研究[J].食品工业科技, 2021, 42(8):102-108.
WEI M T, WANG Y, SHAN C J, et al.Screening of selenium-enriched lactic acid bacteria and evaluation of their bioactivities in vitro[J].Science and Technology of Food Industry, 2021, 42(8):102-108.
[7] 汪波, 林晓波, 张静, 等.3种乳酸菌鉴定、筛选、富硒比较研究[J].中国农学通报, 2018, 34(23):141-144.
WANG B, LIN X B, ZHANG J, et al.Identification, screening and selenium-enrichment comparison of three kinds of Lactobacillus[J].Chinese Agricultural Science Bulletin, 2018, 34(23):141-144.
[8] DE FILIPPIS F, PASOLLI E, ERCOLINI D.The food-gut axis:Lactic acid bacteria and their link to food, the gut microbiome and human health[J].FEMS Microbiology Reviews, 2020, 44(4):454-489.
[9] GALANO E, MANGIAPANE E, BIANGA J, et al.Privileged incorporation of selenium as selenocysteine in Lactobacillus reuteri proteins demonstrated by selenium-specific imaging and proteomics[J].Molecular &Cellular Proteomics, 2018, 17(5):835.
[10] AVOSCAN L, CARRI RE M, PROUX O, et al.Enhanced selenate accumulation in Cupriavidus metallidurans CH34 does not trigger a detoxification pathway[J].Applied and Environmental Microbiology, 2009, 75(7):2250-2252.
RE M, PROUX O, et al.Enhanced selenate accumulation in Cupriavidus metallidurans CH34 does not trigger a detoxification pathway[J].Applied and Environmental Microbiology, 2009, 75(7):2250-2252.
[11] YANG X Y, DAI X F, JIN H N, et al.Physicochemical and transcriptomic responses of Lactobacillus brevis JLD715 to sodium selenite[J].Journal of the Science of Food and Agriculture, 2021, 101(10):4332-4341.
[12] 林官根. 基于转录组水平对短乳杆菌代谢亚硒酸钠的机制的研究[D].哈尔滨:东北农业大学, 2018.
LIN G G.Study on the mechanism of metabolism of Na2SeO3 by Lactobacillus brevis based on transcriptomics[D].Harbin:Northeast Agricultural University, 2018.
[13] OREMLAND R S, HERBEL M J, BLUM J S, et al.Structural and spectral features of selenium nanospheres produced by Se-respiring bacteria[J].Applied and Environmental Microbiology, 2004, 70(1):52-60.
[14] DEBIEUX C M, DRIDGE E J, MUELLER C M, et al.A bacterial process for selenium nanosphere assembly[J].Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(33):13480-13485.
[15] RIDLEY H, WATTS C A, RICHARDSON D J, et al.Resolution of distinct membrane-bound enzymes from Enterobacter cloacae SLD1a-1 that are responsible for selective reduction of nitrate and selenate oxyanions[J].Applied and Environmental Microbiology, 2006, 72(8):5173-5180.
[16] TURNER R J, WEINER J H, TAYLOR D E.Selenium metabolism in Escherichia coli[J].Biometals, 1998, 11(3):223-227.
[17] KESSI J, HANSELMANN K W.Similarities between the abiotic reduction of selenite with glutathione and the dissimilatory reaction mediated by Rhodospirillum rubrum and Escherichia coli[J].Journal of Biological Chemistry, 2004, 279(49):50662-50669.
[18] OGASAWARA Y, LACOURCIERE G M, ISHII K, et al.Characterization of potential selenium-binding proteins in the selenophosphate synthetase system[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(4):1012-1016.
[19] J NSCH A, KORAKLI M, VOGEL R F, et al.Glutathione reductase from Lactobacillus sanfranciscensis DSM20451T:Contribution to oxygen tolerance and thiol exchange reactions in wheat sourdoughs[J].Applied and Environmental Microbiology, 2007, 73(14):4469-4476.
NSCH A, KORAKLI M, VOGEL R F, et al.Glutathione reductase from Lactobacillus sanfranciscensis DSM20451T:Contribution to oxygen tolerance and thiol exchange reactions in wheat sourdoughs[J].Applied and Environmental Microbiology, 2007, 73(14):4469-4476.
[20] LAMBERTI C, MANGIAPANE E, PESSIONE A, et al.Proteomic characterization of a selenium-metabolizing probiotic Lactobacillus reuteri Lb2 BM for nutraceutical applications[J].Proteomics, 2018, 18(13):e1870116.
[21] 王金泽, 李静, 郭耀东, 等.富硒乳酸菌亚硒酸盐还原特性及产硒机理研究[J].粮食与油脂, 2022, 35(4):139-144.
WANG J Z, LI J, GUO Y D, et al.Selenite reduction characteristics and selenium production mechanism of selenium-enriched lactic acid bacteria[J].Cereals &Oils, 2022, 35(4):139-144.
[22] LAMPIS S, ZONARO E, BERTOLINI C, et al.Delayed formation of zero-valent selenium nanoparticles by Bacillus mycoides SeITE01 as a consequence of selenite reduction under aerobic conditions[J].Microbial Cell Factories, 2014, 13(1):35.
[23] ZHANG W J, CHEN Z J, LIU H, et al.Biosynthesis and structural characteristics of selenium nanoparticles by Pseudomonas alcaliphila[J].Colloids and Surfaces B:Biointerfaces, 2011, 88(1):196-201.
[24] YANG J P, YANG H.Recent development in Se-enriched yeast, lactic acid bacteria and bifidobacteria[J].Critical Reviews in Food Science and Nutrition, 2023, 63(3):411-425.
[25] JIN W H, YOON C, JOHNSTON T V, et al.Production of selenomethionine-enriched Bifidobacterium bifidum BGN4 via sodium selenite biocatalysis[J].Molecules, 2018, 23(11):2860.
[26] LEE M R F, FLEMING H R, COGAN T, et al.Assessing the ability of silage lactic acid bacteria to incorporate and transform inorganic selenium within laboratory scale silos[J].Animal Feed Science and Technology, 2019, 253:125-134.
[27] KUREK E, RUSZCZY SKA A, WOJCIECHOWSKI M, et al.Bio-transformation of selenium in Se-enriched bacterial strains of Lactobacillus casei[J].Roczniki Panstwowego Zakladu Higieny, 2016, 67(3):253-262.
SKA A, WOJCIECHOWSKI M, et al.Bio-transformation of selenium in Se-enriched bacterial strains of Lactobacillus casei[J].Roczniki Panstwowego Zakladu Higieny, 2016, 67(3):253-262.
[28] 颜炳祥, 潘道东, 曾小群.乳酸菌胞外多糖硒化修饰及其抗氧化活性研究[J].中国食品学报, 2012, 12(2):15-23.
YAN B X, PAN D D, ZENG X Q.Study on selenium modification and antioxidant activity of lactic acid bacteria exopolysaccharides[J].Journal of Chinese Institute of Food Science and Technology, 2012, 12(2):15-23.
[29] YANG J P, LI Y, ZHANG L, et al.Response surface design for accumulation of selenium by different lactic acid bacteria[J].3 Biotech, 2017, 7(1):52.
[30] SUN Y H, WANG H Z, ZHOU L, et al.Distribution characteristics of organic selenium in Se-enriched Lactobacillus (Lactobacillus paracasei)[J].LWT, 2022, 165:113699.
[31] CHEN H, WANG X Y, YUE Y, et al.Enrichment and distribution of selenium in Pediococcus acidilactici MRS-7:Impact on its biochemical composition, microstructure, and gastrointestinal survival[J].Journal of Agricultural and Food Chemistry, 2022, 70(47):14877-14885.
[32] MORENO-REYES R, SUETENS C, MATHIEU F, et al.Kashin-Beck osteoarthropathy in rural Tibet in relation to selenium and iodine status[J].New England Journal of Medicine, 1998, 339(16):1112-1120.
[33] RAYMAN M P.Selenoproteins and human health:Insights from epidemiological data[J].Biochimica et Biophysica Acta (BBA)-General Subjects, 2009, 1790(11):1533-1540.
[34] PIENIZ S, ANDREAZZA R, MANN M B, et al.Bioaccumulation and distribution of selenium in Enterococcus durans[J].Journal of Trace Elements in Medicine and Biology, 2017, 40:37-45.
[35] ALZATE A, FERN NDEZ-FERN
NDEZ-FERN NDEZ A, PÉREZ-CONDE M C, et al.Comparison of biotransformation of inorganic selenium by Lactobacillus and Saccharomyces in lactic fermentation process of yogurt and kefir[J].Journal of Agricultural and Food Chemistry, 2008, 56(18):8728-8736.
NDEZ A, PÉREZ-CONDE M C, et al.Comparison of biotransformation of inorganic selenium by Lactobacillus and Saccharomyces in lactic fermentation process of yogurt and kefir[J].Journal of Agricultural and Food Chemistry, 2008, 56(18):8728-8736.
[36] PESCUMA M, GOMEZ-GOMEZ B, PEREZ-CORONA T, et al.Food prospects of selenium enriched-Lactobacillus acidophilus CRL 636 and Lactobacillus reuteri CRL 1101[J].Journal of Functional Foods, 2017, 35:466-473.
[37] MART NEZ F G, MORENO-MARTIN G, PESCUMA M, et al.Biotransformation of selenium by lactic acid bacteria:Formation of seleno-nanoparticles and seleno-amino acids[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:506.
NEZ F G, MORENO-MARTIN G, PESCUMA M, et al.Biotransformation of selenium by lactic acid bacteria:Formation of seleno-nanoparticles and seleno-amino acids[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:506.
[38] SUHAJDA  , HEG
, HEG CZKI J, JANZS
CZKI J, JANZS B, et al.Preparation of selenium yeasts I.Preparation of selenium-enriched Saccharomyces cerevisiae[J].Journal of Trace Elements in Medicine and Biology, 2000, 14(1):43-47.
B, et al.Preparation of selenium yeasts I.Preparation of selenium-enriched Saccharomyces cerevisiae[J].Journal of Trace Elements in Medicine and Biology, 2000, 14(1):43-47.
[39] 胡惠影. 乳杆菌 (Lactobacillus sp.) JZ07富集转化硒的特性研究[D].郑州:河南工业大学, 2018.
HU H Y.Characteristics of selenium accumulation and transformation by Lactobacillus sp.JZ07[D].Zhengzhou:Henan University of Technology, 2018.
[40] 刘鹭. 硒化乳酸菌胞外多糖免疫功能机制研究[D].宁波:宁波大学, 2014.
LIU L.Immunomodulatory activities of selenium exopolysaccharide produced by Lactococcus lactis subsp.lactis[D].Ningbo:Ningbo University, 2014.
[41] 刘文丽, 刘洪霞, 邢少华, 等.泡菜中乳酸菌的分离及功能性菌株的筛选与鉴定[J].中国调味品, 2016, 41(9):73-79.
LIU W L, LIU H X, XING S H, et al.Screening and identification of functional lactic acid bacteria isolated from pickles[J].China Condiment, 2016, 41(9):73-79.
[42] KHERADMAND E, RAFII F, YAZDI M H, et al.The antimicrobial effects of selenium nanoparticle-enriched probiotics and their fermented broth against Candida albicans[J].Daru, 2014, 22(1):48.
[43] 白芳芳, 张荣荣, 原倩倩, 等.乳酸菌富硒及产胞外多糖条件的研究[J].中国调味品, 2022, 47(3):65-71.
BAI F F, ZHANG R R, YUAN Q Q, et al.Study on selenium enrichment and extracellular polysaccharide production conditions of lactic acid bacteria[J].China Condiment, 2022, 47(3):65-71.
[44] 景晨茜. 硒化乳酸菌胞外多糖结构及抗氧化性研究[D].山西:山西农业大学, 2021.
QING C X.Study on the structure and antioxidant activity of extracellular polysaccharide of selenium lactic acid bacteria[D].Shanxi:Shanxi Agricultural University, 2021.
[45] LIN Z H, CHRIS WANG C R.Evidence on the size-dependent absorption spectral evolution of selenium nanoparticles[J].Materials Chemistry and Physics, 2005, 92(2-3):591-594.
[46] DENG Y, MAN C X, FAN Y, et al.Preparation of elemental selenium-enriched fermented milk by newly isolated Lactobacillus brevis from kefir grains[J].International Dairy Journal, 2015, 44:31-36.
[47] TUGAROVA A V, KAMNEV A A.Proteins in microbial synthesis of selenium nanoparticles[J].Talanta, 2017, 174:539-547.
[48] XU C L, QIAO L, GUO Y, et al.Preparation, characteristics and antioxidant activity of polysaccharides and proteins-capped selenium nanoparticles synthesized by Lactobacillus casei ATCC 393[J].Carbohydrate Polymers, 2018, 195:576-585.
[49] WADHWANI S A, SHEDBALKAR U U, SINGH R, et al.Biogenic selenium nanoparticles:Current status and future prospects[J].Applied Microbiology and Biotechnology, 2016, 100(6):2555-2566.
[50] ESZENYI P, SZTRIK A, BABKA B, et al.Elemental, nano-sized (100-500 nm) selenium production by probiotic lactic acid bacteria[J].International Journal of Bioscience, Biochemistry and Bioinformatics, 2011:148-152.
[51] SASIDHARAN S, BALAKRISHNARAJA R.Comparison studies on the synthesis of selenium nanoparticles by various microorganisms[J].International Journal of Pure &Applied Bioscience, 2014, 2:112-117.
[52] VISHA P, NANJAPPAN K, et al.Biosynthesis and structural characteristics of selenium nanoparticles using Lactobacillus acidophilus bacteria by wet sterilization process[J].International Journal of Advanced Veterinary Science and Technology, 2015, 4(1):178-183.
[53] MORENO-MARTIN G, PESCUMA M, PÉREZ-CORONA T, et al.Determination of size and mass-and number-based concentration of biogenic SeNPs synthesized by lactic acid bacteria by using a multimethod approach[J].Analytica Chimica Acta, 2017, 992:34-41.
[54] HOSNEDLOVA B, KEPINSKA M, SKALICKOVA S, et al.Nano-selenium and its nanomedicine applications:A critical review[J].International Journal of Nanomedicine, 2018, 13:2107-2128.
[55] 黄秀锦. 富硒乳酸菌发酵条件的研究[J].中国调味品, 2009, 34(12):54-60.
HUANG X J.Study on fermentation condition of Se-enriched Lactobacillus[J].China Condiment, 2009, 34(12):54-60.
[56] ZAN L X, ZHANG W Y, SHANG S F, et al.Alleviating effect of selenium-enriched Lactobacillus plantarum 6076 on dextran sulfate sodium-induced colitis and liver inflammation in mice[J].Food &Function, 2023, 14(22):10151-10162.
[57] FEROCI G, BADIELLO R, FINI A.Interactions between different selenium compounds and zinc, cadmium and mercury[J].Journal of Trace Elements in Medicine and Biology, 2005, 18(3):227-234.
[58] 姚婉, 赵方红, 刘丽娜, 等.不同浓度硒含量的富硒乳酸菌抑制黄曲霉菌生长以及产毒效果的研究[J].中国饲料, 2016(12):19-21;26.
YAO W, ZHAO F H, LIU L N, et al.Study on Se-enriched Lactobacillus with different selenium concentration inhibiting the growth and toxin-producing effects of Aspergillus flavus[J].China Feed, 2016(12):19-21;26.
[59] 李元辉, 傅春妮, 李鹏程, 等.富硒乳酸菌对黄曲霉毒素B1诱导鸡小肠上皮细胞凋亡的影响[J].中国畜牧兽医, 2021, 48(12):4702-4709.
LI Y H, FU C N, LI P C, et al.Effect of selenium-enriched lactic acid bacteria on apoptosis of chicken small intestinal epithelial cells induced by aflatoxin B1[J].China Animal Husbandry &Veterinary Medicine, 2021, 48(12):4702-4709.
[60] 仲雨晴. 乳酸菌硒的生物学功能评价及富硒工艺研究[D].无锡:江南大学, 2023.
ZHONG Y Q.Biological function evaluation and selenium enrichment technology of lactic acid bacteria selenium[D].Wuxi:Jiangnan University, 2023.
[61] 李乐. 富硒乳酸菌培养物对蛋鸡生长性能及相关指标的影响[D].延吉:延边大学, 2018.
LI L.Effect of selenium-enriched Lactobacillus on production performance and correlative index in laying hens[D].Yanji:Yanbian University, 2023.
[62] 左映平, 孙国勇, 张玲.富硒乳酸菌对复合果蔬汁品质的影响[J].食品研究与开发, 2021, 42(14):36-42.
ZUO Y P, SUN G Y, ZHANG L.Quality of compound fruit and vegetable juice fermented by selenium-enriched lactic acid bacteria[J].Food Research and Development, 2021, 42(14):36-42.
[63] 章金梅, 王芳, 赵继英.富硒榨菜腌制工艺探究[J].食品研究与开发, 2017, 38(10):106-109.
ZHANG J M, WANG F, ZHAO J Y.Study on the curing process of Se-rich pickle[J].Food Research and Development, 2017, 38(10):106-109.