高血压是一种常见的心血管慢性疾病,长期患病会使人患上心脏[1]、肾脏[2]、脑部[3-4]等疾病的几率大大增加,是世界各地人民过早死亡的一个重要原因。目前预防和治疗高血压已经成为一项艰巨而必要的任务,以卡托普利[5]为代表的血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI),是一线抗高血压药物,其主要原理是抑制血管紧张素转换酶(angiotensin converting enzyme,ACE)及缓激肽降解酶(同ACE),减少血管紧张素Ⅰ转变为血管紧张素Ⅱ,并减慢有扩血管作用的缓激肽的降解,促进有扩血管作用的前列腺素释放,最终导致血管扩张,降低血压。此类人工合成的ACE抑制剂易出现咳嗽、味觉障碍、皮疹、血管神经性水肿等不良反应,且长期使用还会出现醛固酮逃逸[6-7]。而生物活性肽由于分子质量小、易于消化吸收、安全性高,而且具有抗氧化、促进免疫、激素调节、抗菌、抗病毒、降血压、降血脂等生理功能[8]。因此对天然的ACE抑制肽进行研究,是发现新降血压药物的新思路。
单环刺螠(Urechis unicinctus),俗称“海肠子”,隶属于螠虫动物门(Echiurioidea),螠纲(Echiurida),无管螠目(Xenopneusta),刺螠科(Xenopneusta)[9]。目前关于单环刺螠的药用价值开发主要集中在具有生物活性的肽类物质,现已有文献证明从单环刺螠开发出的多肽具有抗氧化、抗肿瘤、抑菌、免疫调节等多种活性[10-11]。本课题组前期研究中已经从单环刺螠酶解肽中筛选到系列ACE抑制肽,但其活性相较于一线药物尚有差距,基于此,本课题以天然酶解的单环刺螠ACE抑制肽为基础,以ACE抑制肽构效关系的研究进展为参考,总结出ACE抑制肽的氨基酸序列优化规则,通过对天然单环刺螠ACE抑制肽氨基酸序列进行重新排列,筛选到5条ACE抑制活性显著提高的重排肽。本实验从化学水平、计算机分子模拟对接两个层面对重排肽的ACE抑制活性以及分子对接能进行评价,为ACE抑制肽的构效关系研究以及人为设计优化提供新的思路及实验依据。
1 材料与方法
1.1 实验材料
多肽由上海楚肽生物科技有限公司合成,纯度95%以上。F2-1:Ile-His-Val-Lys-Phe;F3-1:Tyr-His-Pro-Lys-Phe;F4-1:Gly-Ala-Trp-Lys-Pro;F5-1:Gly-Thr-Leu-Lys-Pro;F7-1:Ile-Ile-Val-Arg-Met。
1.2 主要试剂和仪器
4-(2-羟乙基)哌嗪-1-乙磺酸钠盐[4(2-hydroxyethyl)piperazine-1-ethanesulfonic acid sodium salt, HEPES-Na],北京索莱宝科技有限公司;ACE,默克有限公司;N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(N-[3-(2-furyl)acryloyl]-Phe-Gle-Gle, FAPGG),上海麦克林生化科技有限公司。
MSA225S电子精密天平,赛多利斯科学仪器有限公司;Multiskan FC酶标仪,赛默飞世尔科技(中国)有限公司。
1.3 实验方法
1.3.1 ACE抑制肽重排设计
根据已有的ACE抑制肽研究,总结得到以下4条多肽优化规则:(a)C末端氨基酸为芳香族氨基酸(Trp、Tyr、Phe)、脂肪族氨基酸(Ile、Ala、Leu,Pro等)可以提高活性,但是酸性氨基酸Glu会很大程度降低活性[12]。(b)C端第3个氨基酸为疏水性氨基酸(如Pro、Val)或芳香族氨基酸(Trp、Tyr、Phe)可以提高活性[13]。(c)C端第2个氨基酸为是脂肪族氨基酸(如Val、Ile、Ala等)、碱性或芳香族氨基酸(如Tyr、Phe)、Pro会很大程度降低活性[14]。(d)N端区域可以是Trp、Tyr、分支脂肪族氨基酸(Gly、Val、Leu和Ile)或疏水性氨基酸残基。根据以上规律,对已有的单环刺螠天然肽进行氨基酸序列设计重排。
1.3.2 重排肽ACE抑制活性测定
参照HOLMQUIST等[15]方法,用80 mmol/L HEPES缓冲液(pH 8.2,300 mmol/L Cl-)配制不同浓度的多肽液以及ACE溶液。将重排肽以及各反应试剂按照ACE(0.05 U/mL)样品和空白各加10 μL,FAPGG(1 mmol/L)样品孔和空白孔各加50 μL,多肽液样品孔加40 μL,空白孔不加;缓冲液空白孔加40 μL,样品孔不加;加入到96孔板中。使用酶标仪分别测定空白组以及样品组在340 nm处的初始吸光度(A1、B1),在37 ℃的恒温培养条件下反应20 min,再次测定其吸光度(A2、B2)。ACE抑制活性按公式(1)计算:
ACE抑制率![]()
(1)
1.3.3 重排肽抑制模式分析
使用Lineweaver-Burk表征重组多肽对于ACE的抑制动力学。将FAPGG溶解在HEPES-Na缓冲液中,按照实验需求依次配制FAPGG溶液,使其终浓度为2、1、0.5、0.25和0.125 mmol/L。将多肽溶于去离子水中,使其终浓度为与IC50相近的2种不同浓度。不同浓度的多肽溶液与不同浓度的FAPGG溶液反应。用1/[S]和1/V描绘Lineweaver-Burk图,并通过比较所获得的回归方程评估多肽的ACEI动力学。
1.3.4 分子模拟对接
使用SeeSAR 11.2.0软件将5条重排肽与ACE分别进行分子对接模拟,进一步从分子水平上探究其与ACE的结合方式。分别从RCSB PDB文件库中下载ACE与卡托普利结合的晶体复合结构(PDB代码:1UZF),PubChem下载卡托普利的对接格式文件C[C@H](CS)C(=O)N1CCC[C@H]1C(=O)O使用Novopro的在线工具将5条重排肽的序列转化为SMILES以及PDB格式的对接文件。
去除1UZF复合结构中非ACE的部分,得到暴露出活性位点空腔的对接模型文件1UZF cleaned。打开SeeSAR软件,选择打开1UZF cleaned文件,切换到Binding Site模式检测空腔,选择所有空腔后切换到Docking模式,点击Load Molecules导入卡托普利以及重排肽的SMILES或PDB格式文件。点击标准对接按钮进行对接。对接完成后导出SDF格式文件,并使用proteins.plus在线工具得到2D对接模式示意图。
2 结果与分析
2.1 ACE抑制肽重排设计结果及ACE抑制活性分析
依据2.1节总结的经验规则对天然的单环刺螠酶解肽F2、F3、F4、F5、F7进行氨基酸序列重排,共设计20条重排肽(见表1),经ACE活性评价,与天然肽相比,多数重排后的肽其ACE抑制活性的IC50值明显降低,证明其活性显著提高。为更好的探讨构效关系,从每条天然肽下选择1条活性最好的重排肽,即F2-1、F3-1、F4-1、F5-1、F7-1进行后续研究。由图1可以看出,5条重排肽均表现出良好的ACE抑制活性,随给药浓度的增加,ACE抑制率也随之增加,呈现一定的量效依赖性。其中F2-1、F3-1、F7-1的活性较好,10~40 μg/mL的ACE抑制率分别为F2-1:(63.65±0.91)%、(73.42±0.62)%、(82.24±0.24)%,F3-1:(81.80±0.22)%、(90.64±0.31)%、(95.88±0.15)%,F7-1:(44.12±0.34)%、(52.24±0.83)%、(61.02±0.73)%。在GraphPad Prism 9.0软件上使用最小二乘法对以上结果进行IC50拟合计算,F2-1、F3-1、F4-1、F5-1、F7-1重排肽的IC50分别为(10.15±0.36)、(6.38±0.22)、(35.05±0.38)、(44.14±0.71)、(25.73±0.24) μmol/L。而本课题组前期研究中从单环刺螠得到的天然酶解肽F2、F3、F4、F5、F7的IC50分别为(75.47±0.61)、(110.45±0.37)、(46.32±0.42)、(56.35±0.53)、(60.23±0.48) μmol/L。对比可见,天然肽符合优化规则数明显较少,重排肽的IC50与天然酶解肽相比显著降低,即具有更好的ACE抑制活性,ACE抑制活性分别提升了6.44、16.31、0.32、0.28、1.34倍,其中F3-1的优化效率最高,其他重排肽的IC50值见表1。
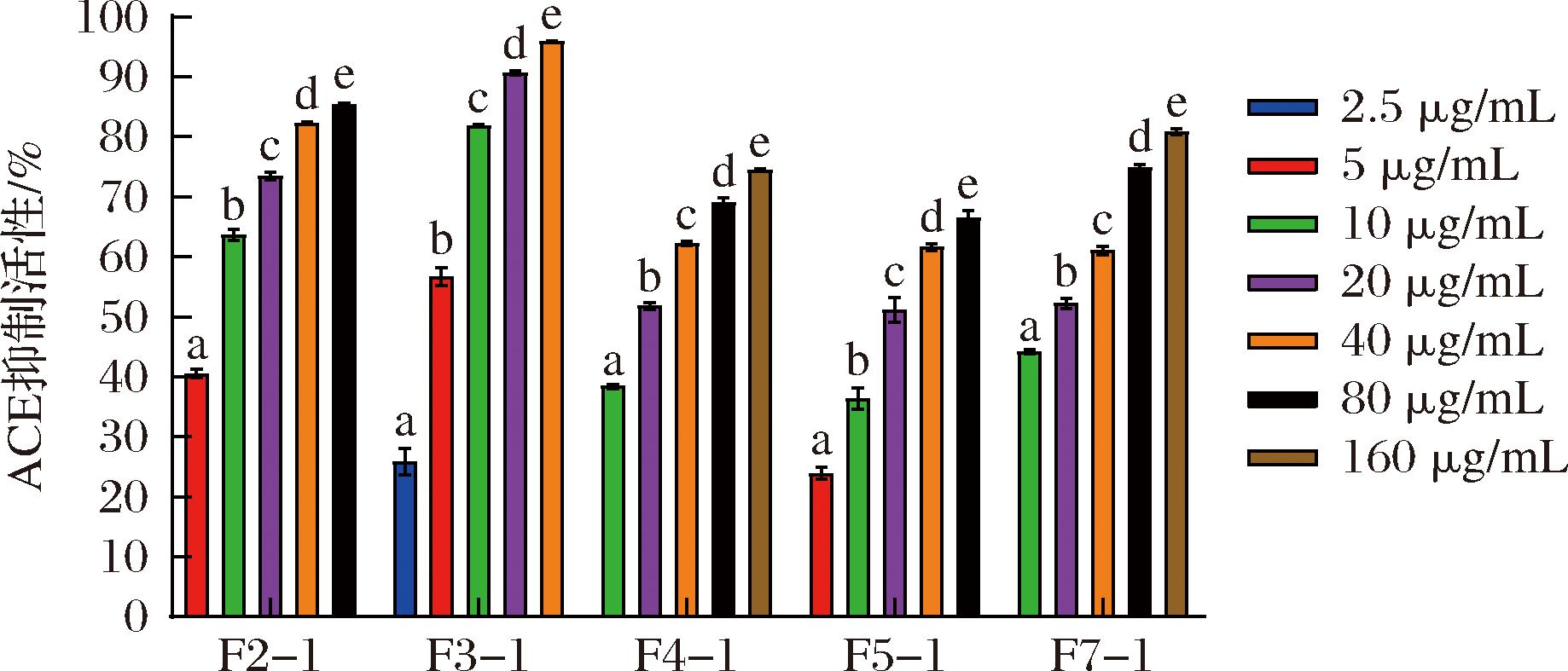
图1 重排肽的ACE抑制活性
Fig.1 ACE inhibitory activity of rearranged peptides
注:不同小写字母表示差异显著(P<0.05)(下同)。
表1 ACE抑制肽重排设计结果、优化依据及ACE抑制活性结果
Table 1 Results of the redesigned ACE inhibitory peptides, basis for optimization, and ACE inhibitory activities

编号氨基酸序列符合优化规则ACE抑制活性(IC50)/(μmol/L)F2(天然)Ile-Val-Lys-His-Phe(a)、(d)75.47±0.61bF2-1Ile-His-Val-Lys-Phe(a)、(b)、(d)10.15±0.36eF2-2Val-His-Phe-Lys-Ile(a)、(b)、(d)18.24±0.47dF2-3Val-His-Phe-Ile-Lys(b)、(c)、(d)83.17±0.52aF2-4Val-His-Phe-Ile-Lys(b)、(c)、(d)38.09±0.32cF3(天然)Phe-Pro-Tyr-Lys-His(b)110.45±0.37aF3-1Tyr-His-Pro-Lys-Phe(a)、(b)、(d)6.38±0.22eF3-2Tyr-His-Phe-Lys-Pro(a)、(b)、(d)17.25±0.35dF3-3His-Tyr-Phe-Lys-Pro(a)、(b)53.12±0.54cF3-4His-Tyr-Pro-Lys-Phe(a)、(b)60.48±0.48bF4(天然)Trp-Pro-Gly-Lys-Ala(a)46.32±0.42dF4-1Gly-Ala-Trp-Lys-Pro(a)、(b)、(d)35.05±0.38eF4-2Ala-Gly-Trp-Lys-Pro(a)、(b)57.46±0.27bF4-3Ala-Gly-Pro-Lys-Trp(a)、(b)48.33±0.43cF4-4Lys-Gly-Trp-Ala-Pro(a)、(b)、(c)64.37±0.52aF5(天然)Gly-Leu-Thr-Lys-Pro(a)、(d)56.35±0.53cF5-1Gly-Thr-Leu-Lys-Pro(a)、(d)44.14±0.71eF5-2Gly-Thr-Pro-Lys-Leu(a)、(b)、(d)58.19±0.46bF5-3Gly-Thr-Leu-Lys-Pro(a)、(d)61.23±0.62aF5-4Leu-Gly-Thr-Lys-Pro(a)、(d)55.67±0.58dF7(天然)Ile-Val-Met-Arg-Ile(a)、(d)60.23±0.48bF7-1Ile-Ile-Val-Arg-Met(b)、(d)25.73±0.24eF7-2Ile-Arg-Val-Met- Ile(a)、(c)、(d)38.43±0.37dF7-3Ile-Ile-Val-Arg-Met(b)、(d)78.68±0.53aF7-4Val-Ile-Met-Ile-Arg(c)、(d)52.46±0.55c
注:a-e表示有显著性差异(P<0.05)(下同)。
2.2 重排肽的ACE抑制动力学测定
ACEI肽的酶动力学参数通常使用Lineweaver-Burk图,抑制性参数用Y轴和X轴截距表示[16]。回归线与Y轴的交点表示最大反应速率(Vmax)的倒数,斜率表示米氏常数(Km)与Vmax的比值。当3条线相较于X轴上时,表明抑制剂是非竞争性抑制剂,其抑制程度与抑制剂的浓度有关,而与底物浓度和Km无关,即Km保持不变,而Vmax值随着抑制剂浓度的增大而降低。当3条线相交于Y轴上的一点时,说明抑制剂是竞争性抑制剂,抑制程度与多肽的浓度成正比,与底物的浓度成反比,即Vmax不变,Km值随着多肽浓度的增大而变大。而当3条线相较于第二、第三象限时,是混合型抑制模式,当3条线相互平行时,则是反竞争性抑制。
图2-a~图2-e中分别表示重排肽F2-1、F3-1、F4-1、F5-1、F7-1与ACE产生抑制作用的Lineweaver-Burk图。图中可见该5条肽对ACE的抑制作用均符合米氏方程的动力学特性,随着重排肽浓度的增加,3条线均在Y轴上相交于同一点,说明Vmax不变,且Km值随着多肽浓度的增大而变大,表明此5条重排多肽与ACE之间均为竞争性抑制模式[17]。而在之前的研究中,F3为非竞争性抑制剂,经氨基酸序列重排后转变为竞争性抑制剂,竞争性抑制剂与酶的底物在结构上通常有相似性,能与底物竞相争夺酶分子上的结合位点,从而产生酶活性的可逆的抑制作用,影响底物与酶的结合能力,而非竞争性抑制剂则影响反应产物的生成。虽无法直接判断两者哪种抑制剂的抑制能力更强,但这或许是其抑制活性大幅提升16.31倍的原因。此外,LI等[18]从藜麦麸谷蛋白-2中鉴定出的AVPKPS(IC50:123.13 μmol/L)为一种竞争性抑制剂,HUANG等[19]从酵母水解产物衍生的一种新型竞争性ACE抑制肽VIPVPFF(IC50:10.27 μmol/L),CHEN等[20]从桑叶蛋白水解物中获得并最终筛选出的4条活性最好的ACE抑制肽ERFNVE(IC50:2.65 mg/mL)、TELVLK(IC50:0.98 mg/mL)、MELVLK(IC50:1.90 mg/mL)和FDDKLD(IC50:0.70 mg/mL)均表现为竞争性抑制模式,以上说明短肽ACE抑制肽通常为竞争性抑制肽。

a-F2-1;b-F3-1;c-F4-1;d-F5-1;e-F7-1
图2 5条重排肽对ACE抑制作用Lineweaver-Burk图
Fig.2 Lineweaver-Burk plot of ACE inhibition by 5 rearranged peptides
2.3 重排肽与ACE之间的结合
通过查阅文献[21-22]可知,ACE分子中有3个主要的活性位点口袋,分别为S1(Ala354、Glu384和Tyr523),S2(Gln281、His353、Lys511、His513和Tyr520)和S3(Glu162残基)。另外,通过分析ACE与卡托普利的晶体复合结构发现,其口袋外活性位点还有His383、His387以及Phe457这3个残基。
活性物质一般与ACE产生作用的方式是氢键和疏水键,而抑制剂与ACE的竞争性位点的结合会更容易产生抑制作用,因为竞争性位点直接与ACE的催化活性相关,而非竞争性位点可能对催化活性的影响较小。然而,也有一些非竞争性位点的结合会对ACE的结构变化、蛋白质稳定性等方面产生影响,从而对催化活性产生明显的抑制作用。因此,竞争性位点和非竞争性位点都是影响ACE抑制剂活性的关键结合位点,两者的贡献需要综合考虑。关于以上模拟对接结果如下,见图3:

a~e-F2-1、F3-1、F4-1、F5-1和F7-1与ACE的3D对接图;a′~e′-5条肽与ACE结合模式的2D示意图
图3 5条重排肽与ACE模拟对接的3D和2D示意图
Fig.3 Schematic of 3D and 2D simulation docking of 5 rearranged peptides with ACE
注:绿色实线表示疏水作用力,黑色虚线表示氢键,绿色虚线表示π-π堆积力。
F2-1与ACE活性位点之间有8个氢键(N端第2位His残基与口袋外活性位点His383A、His387A、第3位Val残基分别与S1口袋的Ala354A以及S2口袋的His353A、第4位Lys残基与S2口袋的Gln281A、Tyr520A、Lys511A、C末端的Phe残基与S2口袋的Lys511A)和1个疏水键(第4位Lys残基与口袋外活性位点Phe457A)的相互作用,这些相互作用表明F2-1与ACE的活性位点紧密结合,具有一定的竞争性抑制作用。此外,F2-1还与ACE的非竞争性位点有少量相互作用(如:N端的Ile残基与ACE链上的非竞争性位点Glu411A、Ala356A;第4位Lys残基与非竞争性位点Asp415A),但根据酶动力学测定结果,这种作用的效果不明显。总的来说,F2-1与ACE之间通过氢键和疏水键的相互作用,与活性口袋紧密结合,竞争性抑制底物与酶的结合,发挥竞争性抑制作用,相比竞争性抑制,非竞争性抑制的作用略显不足。
F3-1与ACE的结合非常密切,它们之间形成了7个氢键和1个疏水键。F3-1的N端第2位His残基与S1口袋的Glu384A;第3位Pro残基与S1口袋的Tyr523A;第4位Lys残基与S2口袋His353A、His513A;C末端Phe残基与S2口袋Gln281A、Lys511A、Tyr520A通过氢键链接。F3-1的N端Tyr残基与ACE链上Pro407A;C末端Phe残基与口袋外活性位点His383A以及非竞争性位点Val380A产生疏水键作用力。这些相互作用使得F3-1与ACE的活性位点紧密结合,从而抑制ACE的酶活性。此外,与非竞争性位点产生的疏水键以及π-π堆积力对ACE活性的影响较小。
F4-1与ACE的竞争性位点之间存在6个氢键和3个疏水键。第4位Lys残基与S1口袋的Tyr523A以及S2口袋的His353A、His513A;C末端的Pro残基与S2口袋的Tyr520A、Gln281A以及Lys511A产生氢键。第4位Lys残基与S1口袋的Ala354A以及Tyr523A、C末端的Pro残基与S1口袋Tyr523A产生疏水键。此外,F4-1的N端Gly残基、Ala残基、Trp残基还分别与非竞争性位点Pro407A、Glu411A、Glu411A、Ala356A、Glu411A之间存在5个氢键;Trp残基与非竞争性位点Ser355A之间存在1个疏水作用力。总体呈现出与ACE紧密结合的竞争性抑制作用,而C末端的2个残基则产生了6个氢键以及3个疏水键,进一步印证了C末端3个氨基酸对ACE抑制效果影响最大的结论。
F5-1产生氢键的有N端Gly残基与S1口袋的Glu384A、Ala354A、Tyr523A以及S2口袋的His353A、His513A;第2位Thr残基与S2口袋的Tyr520A、Lys511A、Gln281A;第四位的Lys残基与S1口袋的Ala354A、S3口袋的Glu162A之间共存在10个氢键。第4位的Lys残基还与非竞争位点Cys370A之间存在氢键。产生疏水键的位点在F5-1的N端第3位Leu残基与非竞争位点Val380A、第4位的Lys残基与非竞争位点Val380A之间。其中N末端的2个残基与ACE的活性中心共产生了8个氢键,而C端序列中,只有C端第2位的Lys残基产生了2个竞争性的氢键。与F4-1相比,F5-1的N端残基与ACE的活性中心产生的氢键更多,而C端序列中仅有第2位的Lys残基与ACE产生竞争性氢键。这一结果确认了N端序列对ACE抑制的影响,尤其是N端的Gly和Thr残基对F5-1的ACE抑制作用起主要作用。尽管F5-1(Gly-Thr-Leu-Lys-Pro)在一级结构上与F4-1(Gly-Ala-Trp-Lys-Pro)非常相似,但它们与ACE的相互作用表现出明显的差异。这可能是由于N端第2、3位残基组合和性质不同导致的,从而影响了整个肽链的空间构象。根据F5-1的结果可以推测,当肽链N端第2位是亲水性氨基酸时,可能更有利于它与ACE的结合。
产生氢键的有F7-1的第2位Ile残基与S1口袋Tyr523A、第3位Val残基与S1口袋的Ala354A、S2口袋的His513A、第4位Arg残基与S2口袋的Tyr520A、Lys511A、Gln281A、C末端Met残基与S2口袋His353A之间共存在7个氢键;Ile残基、Arg残基还与非竞争性位点Glu411、Arg522A、Asp453A之间存在3个氢键;C末端Met残基与Val380A之间存在疏水键。除了N端Ile残基外,其余4个氨基酸残基与ACE的活性中心位点总计产生了7个氢键,相比之下,其与活性中心外的位点仅产生了3个氢键和1个疏水键。结合酶动力学实验结果,F7-1与ACE活性中心的多个氢键结合进一步证明了其竞争性抑制的作用模式。
氢键和疏水键是分子间相互作用力的重要形式,在药物与受体之间的相互作用中起着关键作用。氢键是通过氢原子与电负性较大的原子(如O、N等)形成的,具有一定的方向性和选择性。在ACE抑制肽与ACE的结合过程中,氢键可以增强两者之间的结合力,使得抑制肽能更紧密地与ACE结合在一起。疏水键则是非极性分子或基团之间的相互作用力,通常发生在水性环境中。ACE抑制肽中的疏水基团可以与ACE的疏水残基相互作用,进一步增强抑制肽与酶的结合力。通过氢键和疏水键的作用,ACE抑制肽可以更有效地与ACE结合,并在其活性口袋内形成稳定的结合,从而竞争性地阻止底物与ACE的结合,抑制了ACE的活性。氢键是药物与ACE活性位点之间的主要相互作用力,其次是疏水键。根据上述对接结果可以看出,5种重排肽都能够通过与ACE的活性口袋形成多个氢键和疏水键等交互作用,表明它们与ACE的活性中心结合紧密,从而产生了竞争性的抑制作用。虽然与非竞争性位点也能形成氢键或疏水键等相互作用,但根据酶动力学的实验结果,竞争性抑制是5种重排肽的主要抑制模式。对于短肽而言,其非竞争性抑制活性可能比其竞争性抑制活性要弱得多,当重排肽同时与两种位点发生作用并且与竞争性位点产生的结合较多时,竞争性抑制作用可能占据主导,或者完全表现为竞争性抑制模式。
LI等[18]从藜麦谷蛋白-2水解物中鉴定出来的AVPKPS可以分别通过短氢键和疏水相互作用与活性残基Glu384和Ala354(均属于ACE的S1中心口袋)结合。DONG等[23]从罗非鱼皮中提取的VGLFPSRSF通过氢键和疏水相互作用与ACE受体蛋白相互作用。SUO等[22]从蓝贻贝蛋白水解产物中分离出的IK、YEGDP、WF和SWISS通过氢键、静电力和疏水相互作用与ACE活性位点有效相互作用,表现出更好的抑制活性。以上结果均证明ACE抑制肽与ACE活性口袋通过氢键、疏水键等相互作用力相结合,发挥竞争性抑制作用。
3 讨论与结论
ACE抑制肽通常由2~10个氨基酸残基组成,具有特定的序列和空间构型,通过与ACE酶的活性部位结合,阻碍血管紧张素I向血管紧张素Ⅱ的转化,从而降低血管紧张素Ⅱ水平,扩张血管,降低血压。研究ACE抑制肽的结构规律可以帮助揭示其与ACE酶的相互作用机制,从而为设计更有效的ACE抑制剂提供理论基础。
酶的竞争性抑制剂的内在机制主要涉及到抑制剂与底物在酶活性中心上的竞争结合。竞争性抑制剂与被抑制的酶的底物在结构上有相似性,因此能够与被抑制的底物竞相争夺酶分子上的结合位点。当竞争性抑制剂与酶结合时,它们会占据酶的活性中心,从而阻止底物与酶的结合,进而抑制酶与底物形成中间产物,最终导致酶的活性降低。这种抑制作用是可逆的,即当抑制剂从酶上解离后,酶又能重新与底物结合,恢复其催化活性。因此,竞争性抑制剂与活性中心结合能力的强弱直接影响酶的催化活性和有效时间,结合能力越强,越不易与酶解离,酶的催化作用被抑制的越充分,抑制有效时间越长。
本研究依据总结的经验规则对天然的单环刺螠天然酶解肽F2、F3、F4、F5、F7进行氨基酸序列重排,总共设计了20条肽链,其中5条重排肽F2-1、F3-1、F4-1、F5-1、F7-1比天然肽ACE抑制活性更强,IC50值分别为(10.15±0.36)、(6.38±0.22)、(35.05±0.38)、(44.14±0.71)和(25.73±0.24) μmol/L,IC50值均显著低于天然肽,证明重排后ACE抑制活性显著提高,其中F3-1与F3相比活性提高了16.31倍,并由原来的非竞争性抑制剂转变为竞争性抑制剂。Lineweaver-Burk图和分子模拟对接显示5条重排肽均为ACE竞争性抑制模式。由此可见,本文总结的ACE抑制肽的氨基酸序列与活性规律是相符的,ACE抑制肽的氨基酸序列及肽链N、C两端的疏水性对其ACE抑制活性有重要影响,是天然ACE抑制肽进行序列调控或修饰优化并获得高效ACE抑制活性肽的有效方法。除降血压外,ACE抑制肽还具有抗氧化和抗炎等多种生物活性,具有进一步深入研究的价值。
[1] DI PALO K E, BARONE N J.Hypertension and heart failure:Prevention, targets, and treatment[J].Heart Failure Clinics, 2020, 16(1):99-106.
[2] BENSON L N, GUO Y P, DECK K, et al.The link between immunity and hypertension in the kidney and heart[J].Frontiers in Cardiovascular Medicine, 2023, 10:1129384.
[3] NEWBY D, WINCHESTER L, SPROVIERO W, et al.The relationship between isolated hypertension with brain volumes in UK Biobank[J].Brain and Behavior, 2022, 12(5):e2525.
[4] RANTANEN A T, KORKEILA J J A, LÖYTTYNIEMI E S, et al.Awareness of hypertension and depressive symptoms:A cross-sectional study in a primary care population[J].Scandinavian Journal of Primary Health Care, 2018, 36(3):323-328.
[5] ROSENDORFF C.Captopril-An overview[J].South African Medical Journal, 1982, 62(17):593-599.
[6] GOYAL A, CUSICK A S, THIELEMIER B.ACE Inhibitors[M].StatPearls Publishing, 2022.
[7] NOBAKHT N, KAMGAR M, RASTOGI A, et al.Limitations of angiotensin inhibition[J].Nature Reviews.Nephrology, 2011, 7(6):356-359.
[8] JIA L T, WANG L, LIU C, et al.Bioactive peptides from foods:Production, function, and application[J].Food &Function, 2021, 12(16):7108-7125.
[9] 李诺, 宋淑莲, 唐永政.单环刺螠[J].生物学通报, 1998(8):13-15.
LI N, SONG S L, TANG Y Z.Urechis unicinctus VonDrasche[J].Bulletin of Biology, 1998(8):13-15.
[10] 程泽宇, 赵佳锐, 肖翰, 等.单环刺螠的活性成分及其在调味品开发中的应用研究进展[J].食品科技, 2020, 45(4):253-258.
CHENG Z Y, ZHAO J R, XIAO H, et al.Study on the bioactive components of Urechis unicinctus and the development of condiments[J].Food Science and Technology, 2020, 45(4):253-258.
[11] LI J J, LU J J, ASAKIYA C, et al.Extraction and identification of three new Urechis unicinctus visceral peptides and their antioxidant activity[J].Marine Drugs, 2022, 20(5):293.
[12] ZHANG S S, HAN L W, SHI Y P, et al.Two novel multi-functional peptides from meat and visceral mass of marine snail Neptunea Arthritica cumingii and their activities in vitro and in vivo[J].Marine Drugs, 2018, 16(12):473.
[13] YEA C S, EBRAHIMPOUR A, HAMID A A, et al.Winged bean[Psophorcarpus tetragonolobus (L.) DC]seeds as an underutilised plant source of bifunctional proteolysate and biopeptides[J].Food &Function, 2014, 5(5):1007-1016.
[14] CUSHMAN D W, PLUSCEC J, WILLIAMS N J, et al.Inhibition of angiotensin-coverting enzyme by analogs of peptides from Bothrops jararaca venom[J].Experientia, 1973, 29(8):1032-1035.
[15] HOLMQUIST B, BÜNNING P, RIORDAN J F.A continuous spectrophotometric assay for angiotensin converting enzyme[J].Analytical Biochemistry, 1979, 95(2):540-548.
[16] ZHAO T R, LIU B T, YUAN L, et al.ACE inhibitory activity in vitro and antihypertensive effect in vivo of LSGYGP and its transepithelial transport by Caco-2 cell monolayer[J].Journal of Functional Foods, 2019, 61:103488.
[17] RAO S Q, SUN J, LIU Y T, et al.ACE inhibitory peptides and antioxidant peptides derived from in vitro digestion hydrolysate of hen egg white lysozyme[J].Food Chemistry, 2012, 135(3):1245-1252.
[18] LI J R, HUO X Y, ZHENG Y J, et al.ACE-inhibitory peptides identified from quinoa bran glutelin-2 hydrolysates:In silico screening and characterization, inhibition mechanisms of ACE, coordination with zinc ions, and stability[J].Plant Foods for Human Nutrition, 2023, 78(2):419-425.
[19] HUANG Y B, JIA F, ZHAO J S, et al.Novel ACE inhibitory peptides derived from yeast hydrolysates:Screening, inhibition mechanisms and effects on HUVECs[J].Journal of Agricultural and Food Chemistry, 2021, 69(8):2412-2421.
[20] CHEN Y, ZHANG Y, QI Q H, et al.Preparation and activity evaluation of angiotensin-I converting enzyme inhibitory peptides from protein hydrolysate of mulberry leaf[J].Frontiers in Nutrition, 2023, 9:1064526.
[21] MIRZAEI M, MIRDAMADI S, EHSANI M R, et al.Production of antioxidant and ACE-inhibitory peptides from Kluyveromyces marxianus protein hydrolysates:Purification and molecular docking[J].Journal of Food and Drug Analysis, 2018, 26(2):696-705.
[22] SUO S K, ZHAO Y Q, WANG Y M, et al.Seventeen novel angiotensin converting enzyme (ACE) inhibitory peptides from the protein hydrolysate of Mytilus edulis:Isolation, identification, molecular docking study, and protective function on HUVECs[J].Food &Function, 2022, 13(14):7831-7846.
[23] DONG Y, YAN W, ZHANG Y Q, et al.A novel angiotensin-converting enzyme (ACE) inhibitory peptide from Tilapia skin:Preparation, identification and its potential antihypertensive mechanism[J].Food Chemistry, 2024, 430:137074.