L-亮氨酸是人体8种必需氨基酸之一,具有修复肌肉、调节人体蛋白质代谢、调节免疫功能和脂质代谢等多种生理功能[1-2]。L-亮氨酸被广泛运用在医药、食品、饲料及化妆品等多行业中,其市场需求不断增加[3-6]。目前,L-亮氨酸的生产方法主要包括蛋白水解法、化学合成法、酶催化法和微生物发酵法。蛋白水解法可从废弃生物质中提取L-亮氨酸,但其要求目的氨基酸在粗制品中占比较高,且副产物过多,难以分离[7]。化学合成法和酶催化法由于成本昂贵同样限制了大规模制备的可能性[8-9]。随着合成生物学的发展,微生物发酵法利用葡萄糖、玉米浆和豆粕粉等廉价生物质作为原料颇受研究者青睐。
目前,谷氨酸棒状杆菌(Corynebacterium glutamicum)作为模式菌株常被用于L-亮氨酸的生产[10],然而现存的工业菌株还存在转化率较低、副产物积累过多、结晶后产率急剧下降等问题。WANG等[11]在谷氨酸棒杆菌中过表达了leuA(编码2-异丙基苹果酸合酶)来加强亮氨酸合成通路,同时引入大肠杆菌的乙酰辅酶A合酶(由acs编码)加强乙酰辅酶A供应,最终亮氨酸产量达40.11 g/L。此外,还有研究通过敲除pyc(编码丙酮酸羧化酶)、avtA(编码缬氨酸-丙酮酸转氨酶)来减弱支路代谢以此富集前体丙酮酸,使亮氨酸产量提升了43.2%[12]。最近,CHEN等[13]通过启动子工程减弱基因zwf(编码葡萄糖-6-磷酸-1-脱氢酶)的表达,同时引入丙酮丁醇梭菌源NADP+依赖性3-磷酸甘油醛脱氢酶(由gapX编码,CagapX)从而提高NADPH的供应,将L-亮氨酸产量提高了14.3%。尽管过去进行过很多利用谷氨酸棒状杆菌生产L-亮氨酸的研究,但并未存在对菌株整体代谢通路进行系统性改造的研究。
本研究在前期构建的亮氨酸生产菌株C.glutamicum CP基础上,通过富集前体物、敲除支路途径、加强主代谢流、维持胞内氧化还原平衡及优化转运系统等一系列系统性的代谢工程改造后(图1)获得的菌株CP06-1在5 L生物反应器中发酵50 h时的L-亮氨酸产量达65.1 g/L,糖酸转化率达25.1%。此外,本研究通过半连续发酵避免了亮氨酸结晶导致的产率下降的问题,最终5 L生物反应器中发酵50 h后总产酸228.8 g,转化率27.9%,较补料分批发酵提升11.2%。本研究通过系统代谢工程改造得到了一株可高效生产L-亮氨酸的菌株,同时开发了一种最优的半连续发酵方法以提高糖酸转化率,为L-亮氨酸生产菌株改造及工业化生产提供了理论依据。
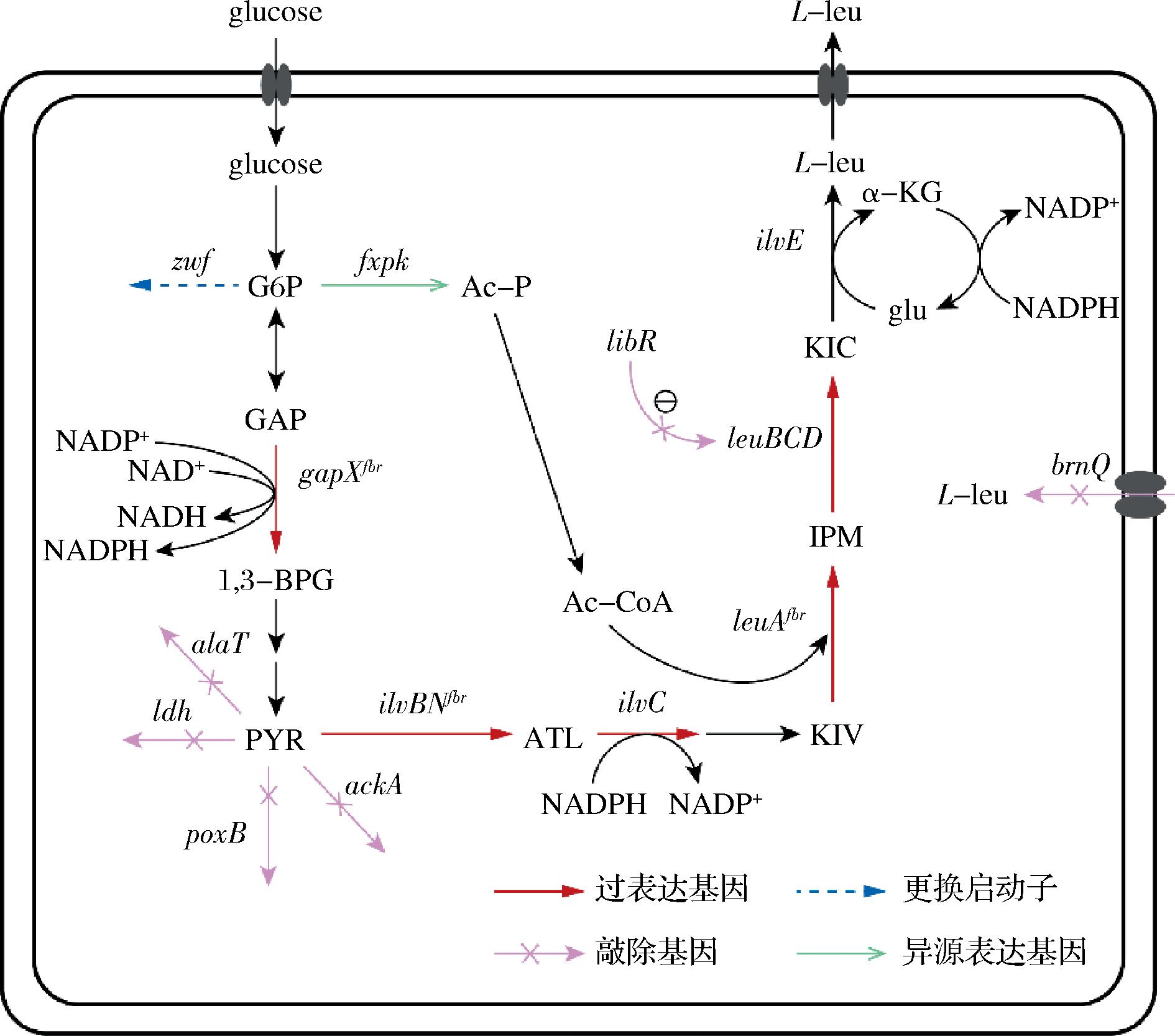
图1 菌株CP06-1代谢途径改造
Fig.1 Metabolic pathway modification of strain CP06-1
注:glucose,葡萄糖;G6P,6-磷酸葡萄糖;GAP,4-磷酸甘油醛;1,3-BPG,1,3-二磷酸甘油酸;PYR,丙酮酸;ATL,α-乙酰乳酸;KIV,α-酮异戊酸;IPM,α-异丙基苹果酸;KIC,α-酮异己酸;leu,亮氨酸;Ac-P,乙酰磷酸;glu,谷氨酸;α-KG,α-酮戊二酸;Ac-CoA,乙酰辅酶A;NADP+,烟酰胺腺嘌呤二核苷磷酸;NAD+,烟酰胺腺嘌呤二核苷酸;zwf,编码6-磷酸葡萄糖脱氢酶;Bafxpk,编码青春双歧杆菌源磷酸酮醇酶;gapXfbr,编码突变的3-磷酸甘油醛脱氢酶;alaT,编码丙氨酸转氨酶;ldh,编码乳酸脱氢酶;poxB,编码丙酮酸脱氢酶;ackA,编码乙酸激酶;ilvBNfbr,编码突变的乙酰乳酸合酶;ilvC,编码酮醇酸还原异构酶;leuAfbr,编码突变的2-异丙基苹果酸合酶;leuBCD,编码3-异丙基苹果酸脱氢酶和3-异丙基苹果酸异构酶;ltbR,编码亮氨酸转录调节因子;brnQ,编码支链氨基酸转运蛋白;ilvE,编码支链氨基酸转氨酶。
1 材料与方法
1.1 菌株与质粒
本研究所用菌株及质粒如表1所示。
表1 菌株和质粒
Table 1 Strains and plasmids

菌株/质粒基因型来源E.coli DH5αF-, Δ(lacZYA-argF)U169 recA1 endA1 hsdR17invitrogenC.glutamicum CPL-leucine-producing strain[14]CP01-1C.glutamicum CP, Δldh, ΔpoxB, ΔackA本研究CP01-2CP01-1, ΔalatT本研究CP01-3CP01-1, ΔavtA本研究CP01-4CP01-1, ΔalatT, ΔavtA本研究CP02-1CP01-2, ΔltbR::PdapN-Bafxpk本研究CP02-2CP01-2, ΔltbR::Psod-Bafxpk本研究CP02-3CP01-2, ΔltbR::Ptuf-Bafxpk本研究CP02-4CP01-2, ΔltbR::Ptac-Bafxpk本研究CP03-1CP02-2, Ptuf-leuAfbr本研究CP03-2CP02-2, Ptuf-leuB本研究CP03-3CP02-2, Ptuf-leuCD本研究CP03-4CP03-1, Ptuf-leuB本研究CP03-5CP03-1, Ptuf-leuB, Ptuf-leuCD本研究CP04-1CP03-5, Ptuf-ilvBNfbr本研究CP04-2CP04-1, Ptuf-ilvC本研究CP04-3CP04-2, Ptuf-ilvD本研究CP05-1CP04-2, ΔPzwf::Pmpha本研究CP05-2CP04-2, Δzwf本研究CP05-3CP05-1, Ptuf-gapXfbr本研究CP05-4CP05-3, Ptuf-gapXfbr本研究CP05-5CP05-4, Ptuf-gapXfbr本研究CP06-1CP05-4, ΔbrnQ本研究CP06-2CP05-4, Ptuf-lrp本研究CP06-3CP05-4, Ptuf-brnFE本研究pK18 mobasacBKanR, sacB, vector for allelic exchange in C.glutamicum[15]
1.2 试剂与培养基
葡萄糖为食品级,新疆阜丰生物科技有限公司;蛋白胨、酵母浸粉,英国Oxoid公司;玉米浆、豆饼水解液,宁夏伊品生物科技股份有限公司;(NH4)2SO4、K2HPO4·3H2O、MgSO4·7H2O、柠檬酸、维生素H、维生素B1、FeSO4·7H2O、L-甲硫氨酸、L-异亮氨酸等均为分析纯,国药集团化学试剂有限公司。
Luria-Bertani培养基(g/L):蛋白胨10,酵母粉 5,NaCl 10。
脑心浸液肉汤培养基:38.5 g/L脑心浸液肉汤。
斜面培养基(g/L):葡萄糖 2,蛋白胨 8,酵母粉 5,NaCl 5,KH2PO4·3H2O 1.0,MgSO4·7H2O 0.3,琼脂 20。
种子培养基(g/L):葡萄糖20,酵母浸粉3,蛋白胨2,玉米浆干粉10,豆饼水解液10 mL/L,(NH4)2SO4 2,K2HPO4·3H2O 3,MgSO4·7H2O 2,柠檬酸1.5,维生素H 0.5 mg/L,维生素B1 0.5 mg/L,FeSO4·7H2O 10 mg/L,L-甲硫氨酸 1,L-异亮氨酸1。
发酵培养基(g/L):葡萄糖25,酵母3,蛋白胨2,玉米浆干粉10,豆饼水解液10 mL/L,(NH4)2SO4 2.5,K2HPO4·3H2O 4,MgSO4·7H2O 2,柠檬酸2.5,维生素H 0.2 mg/L,维生素B1 0.2 mg/L,FeSO4·7H2O 30 mg/L,L-甲硫氨酸 1,L-异亮氨酸1。
1.3 主要仪器设备
5 L自动控制发酵罐,上海保兴生物设备工程有限公司;LC-20A高效液相色谱仪,岛津仪器(苏州)有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;TU1810紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.4 基因改造方法
对谷氨酸棒状杆菌进行基因删除和基因整合,通过pK18 mobsacB质粒采用两步同源重组的方式进行,具体操作方法参考文献[15]。
1.5 酶的纯化及酶活力测定
FXPK纯化方法:具体操作方法参照文献[16]。通过镍柱中的氯化镍与携带his标签的蛋白结合。蛋白上样后,带有his标签的蛋白特异性结合到柱子里,其他的杂蛋白随流穿液流出。Ni柱中的氯化镍也可以与咪唑结合。带有his标签的目的蛋白挂柱后,再用不同浓度梯度的咪唑洗脱,咪唑竞争性结合到氯化镍柱上,目的蛋白就被洗脱下来,这时候收集浸出液,浸出液里就是目的蛋白,将蛋白经超滤置换为不含咪唑的缓冲液即可获得纯化后的目的蛋白。
FXPK酶活力测定方法:具体操作方法参照文献[16]。FXPK的酶活力定义为在37 ℃,pH=7的每分钟催化果糖-6-磷酸生成1 μmol乙酰磷酸所需的酶为1个酶单位。比酶活为单位毫克蛋白所含有的酶活力。
1.6 发酵培养方法
摇瓶发酵:使用500 mL挡板三角瓶,装液量30 mL,接种量1 mL,苯酚红作为酸碱指示剂,25%(体积分数)氨水用于发酵过程中调节pH,32 ℃,220 r/min。
谷氨酸棒杆菌补料分批发酵参考文献[16]。
1.7 分析与检测方法
1.7.1 生物量、葡萄糖浓度检测
使用分光光度计测定600 nm的光吸收(OD600)数值,以测定谷氨酸棒杆菌的菌体浓度。采用SBA-40C生物传感仪测定发酵过程中的葡萄糖含量。
1.7.2 亮氨酸及副产物杂酸浓度检测
色谱柱为Agilent ZORBAX Eclipse AA column (4.6 mm×150 mm, 5 μm),2,4-二硝基氟苯柱前衍生测定,具体衍生方法参考文献[16]。紫外检测器的检测波长为360 nm,流动相为50%乙腈(体积分数)和50 mmol/L乙酸钠溶液,流速1 mL/min,柱温30 ℃,进样量 20 μL。
1.7.3 糖酸转化率计算
糖酸转化率计算方法如公式(1)所示:
糖酸转化率![]()
(1)
式中:m1,发酵总产酸量,g;m2,发酵总耗糖量,g。
2 结果与分析
2.1 前体物富集提高亮氨酸产量
2.1.1 优化支路途径加强丙酮酸积累
L-亮氨酸合成的关键前体α-乙酰乳酸是由2个丙酮酸缩合而来,丙酮酸供应水平被认为是L-亮氨酸合成的限速瓶颈[17]。同时,丙酮酸还参与了多条代谢途径,如乙酸、乳酸、甲酸和丙氨酸的代谢途径。本研究在前期实验中对出发菌株C.glutamicum CP进行摇瓶发酵,24 h时的L-亮氨酸产量为5.2 g/L(图2-a),糖酸转化率为13%。但其还合成了大量的丙氨酸、乙酸、乳酸和甲酸等副产物(如表2所示),表明丙酮酸在该代谢节点有所溢出。同时,乙酸等副产物积累会对菌体造成毒害作用加速菌体老化并影响亮氨酸正常合成。截断这些竞争途径可减弱副产物的生成以此将更多的丙酮酸用于合成亮氨酸。因此,在菌株C.glutamicum CP的基础上敲除了基因ldh(编码乳酸脱氢酶)、poxB(编码丙酮酸脱氢酶)、ackA(编码乙酸激酶),得到菌株CP01-1。24 h摇瓶发酵结果显示,L-亮氨酸产量未见明显差异(5.4 g/L),但糖酸转化率提高到14.1%,且在发酵液上清液中仅检查到极低含量的副产物乙酸、乳酸和甲酸(如表2),菌株最终生物量较原菌株CP差异不大(如图2-a),表明这些基因的敲除不会影响菌株正常生长。
表2 菌株CP及CP01-1副酸积累对比 单位:g/L
Table 2 Comparison of paraacid accumulation between strains CP and CP01-1
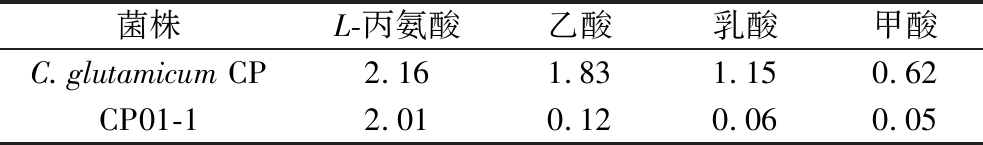
菌株L-丙氨酸乙酸乳酸甲酸C.glutamicum CP2.161.831.150.62CP01-12.010.120.060.05

a-菌株CP、CP01-1、CP01-2、CP01-3和CP01-4摇瓶发酵结果;b-3种不同来源FXPK的比酶活力;c-不同启动子调节Bafxpk启动;d-菌株CP02-1、CP02-2、CP02-3、CP02-4和CP02-5摇瓶发酵结果;e-不同丙酮酸添加量对菌株CP02-4的影响;f-1.5 g/L丙酮酸添加对CP02-1、CP02-2、CP02-3、CP02-4和CP02-5的影响
图2 丙酮酸和乙酰辅酶A富集对菌株L-亮氨酸产量的影响
Fig.2 Effects of pyruvate and acetyl CoA enrichment on the production of L-leucine in bacterial strains
注:**表示具有极显著性差异(P<0.01)(下同)。
此外,为了验证丙氨酸途径的敲除对亮氨酸产量和生物量是否有影响,在CP01-1的基础上分别敲除基因alaT(编码丙氨酸转氨酶)、avtA得到菌株CP01-2、CP01-3,同时敲除基因alaT和avtA得到了菌株CP01-4。24 h摇瓶发酵结果如图2-a所示,相对于出发菌株,菌株CP01-2、CP01-3和CP01-4的生物量均有所下降,分别为27.3、26.5、18.2。其中CP01-4的生物量大幅下降,较CP降低了41.7%。菌株CP01-2和CP01-3的亮氨酸产量有所上升,分别为5.9和5.6 g/L,较出发菌株CP提高了13.4%和7.6%,并且丙氨酸质量浓度均有所下降,分别为0.8和1.3 g/L。菌株CP01-4只积累了0.1 g/L的丙氨酸,但L-亮氨酸产量也下降至3.5 g/L。同时,三者糖酸转化率均有所上升,分别为14.8%、14.3%和16.2%。说明敲除部分丙氨酸合成途径对菌株生长影响较小,并可促进L-亮氨酸积累,而完全敲除丙氨酸合成途径会使菌株无法正常生长,降低菌株代谢速率,导致亮氨酸产量下降。综合考虑,CP01-2具有最佳的L-亮氨酸生产性能,被用于下一步改造。
2.1.2 引入磷酸醇酮酶富集乙酰辅酶A池
亮氨酸合成的另一关键前体为乙酰辅酶A,1分子葡萄糖经糖酵解反应后生成2分子丙酮酸,其中1分子丙酮酸脱羧后释放1分子CO2生成乙酰辅酶A,这一过程降低了糖酸转化率。有研究报道,主要存在于双歧杆菌中的非氧化糖酵解(non-oxidative-glycolysis,NOG)途径的关键酶磷酸酮醇酶(由fxpk编码)可利用6-磷酸果糖或5-磷酸木酮糖生成乙酰辅酶A的前体乙酰磷酸[17]。引入这一途径可将1分子葡萄糖无碳损耗完全转化为3分子乙酰辅酶A,乙酰辅酶A的理论碳转化率从66%提升到100%。以乙酰辅酶A为前体的产品通过此途径可显著提高糖酸转化率。DING等[18]在大肠杆菌中引入fxpk将亮氨酸产量提高了60.3%。GONG等[19]筛选了不同来源的FXPK酶,最终选择青春双歧杆菌的fxpk用于富集乙酰辅酶A池将反式-L-羟脯氨酸的产量提升了37.1%。本研究对3种已报道的fxpk进行对比,分别来源于青春双歧杆菌(Bafxpk,GenBank:CP007443.1)、丙酮丁醇梭菌(Cafxpk,GenBank:KHD36088.1)和长双歧杆菌(Blfxpk,GenBank:AP010888.1)。将3种磷酸醇酶在谷氨酸棒状杆菌ATCC 13032中进行异源表达,纯化后测定其对6-磷酸果糖的催化活性,结果如图2-b所示,青春双歧杆菌中的FXPK对6-磷酸果糖具有最高的催化活性,比酶活力达到63.5 U/mg。此外,有研究称转录调节因子LtbR会抑制leuCD和leuB的表达[20],由leuB和leuCD编码的3-异丙基苹果酸脱氢酶和3-异丙基苹果酸异构酶也是L-亮氨酸合成途径中的关键酶。所以本研究在菌株CP01-4的ltbR位点分别选用启动子PdapN、Psod、Ptuf、Ptac对Bafxpk进行过表达得到菌株CP02-1、CP02-2、CP02-3、CP02-4(如图2-c)。同时,敲除菌株CP01-4的ltbR得到菌株CP02-5作为对照。
5株菌株经24 h摇瓶发酵后,数据如图2-d所示。5组菌的L-亮氨酸产量分别为6.3、6.9、6.0、5.6和6.1 g/L,菌株CP02-2的产量较CP01-4提高了16.9%。糖酸转化率分别为15.8%、16.4%、15.5%、15.7%和14.9%,较菌株CP01-4均有明显上升。由此表明敲除ltbR可促进L-亮氨酸积累,而谷氨酸棒状杆菌可正常表达Bafxpk转化葡萄糖,具有较好的生物活性。此外,Bafxpk的表达使得菌株摄入的葡萄糖经丙酮酸生成乙酰辅酶A代谢通量下降,而由6-磷酸葡萄糖生成Ac-磷酸产生乙酰辅酶A。同时,更多的丙酮酸和乙酰辅酶A的供应将代谢流“推”向L-亮氨酸的合成,因此表现出L-亮氨酸产量显著增多。并且,表达强度过高的Bafxpk反而对L-亮氨酸产量产生负向效果,可能原因是糖酵解途径被分流至NOG途径导致丙酮酸供应减少,前体丙酮酸与乙酰辅酶A之间分配不平衡从而影响了菌株的生长和L-亮氨酸的产量。当在菌株CP02-4的摇瓶发酵培养基中分别添加0.5、1、1.5和2 g/L丙酮酸时(如图2-e),L-亮氨酸产量均有显著上升(P<0.05),分别达到6.1、6.3、6.7和6.8 g/L。这可能是表达过强的Bafxpk将更多的6-磷酸葡萄糖用于乙酰辅酶A的生成,糖酵解途径减弱导致丙酮酸供应与乙酰辅酶A供应不平衡,从而表现出L-亮氨酸产量下降。为进一步验证该猜想,将5株菌株在添加1.5 g/L丙酮酸的摇瓶培养基中24 h发酵,结果如图2-f所示。添加1.5 g/L丙酮酸培养基中菌株CP02-3和CP02-4的L-亮氨酸产量都有所提高,分别达到6.8和6.7 g/L。而菌株CP02-1、CP02-2和CP02-3的L-亮氨酸产量未有提升。表明菌株CP02-3和CP02-4中,丙酮酸与乙酰辅酶A之间供应不平衡,导致L-亮氨酸产量下降。而菌株CP02-1、CP02-2和CP02-5中,丙酮酸的积累与乙酰辅酶A供应相对平衡,外加丙酮酸无法提高L-亮氨酸的产量。此外,5株菌株的生物量都有上升,分别达到29.3、28.5、24.3、23.1和29.4,这表明丙酮酸的添加可促进菌株的生长。其中,菌株CP02-1、CP02-2和CP02-5的生物量提高相较菌株CP02-3和CP02-4提升明显更多,也从侧面证明了这3株菌株体内用于供应L-亮氨酸合成的丙酮酸充足,胞外的丙酮酸添加仅被用于菌体生长导致生物量上升。综合考虑,启动子Psod介导的Bafxpk表达可使丙酮酸与乙酰辅酶A的碳供应更为平衡, L-亮氨酸产量最高,选择菌株CP02-2进行下一步改造。
2.2 调控亮氨酸合成途径
在上一步的改造中,强化了L-亮氨酸主要前体丙酮酸和乙酰辅酶A的供应,但L-亮氨酸产量的提升并未达到预期,推测亮氨酸合成途径中关键限速酶2-异丙基苹果酸合酶LeuA的表达量不足限制了L-亮氨酸的合成。此外,由leuB和leuCD编码的3-异丙基苹果酸脱氢酶和3-异丙基苹果酸异构酶也是L-亮氨酸合成途径中的关键酶。因此,在菌株CP02-2的基因组上,分别整合了以Ptuf启动的leuAfbr、leuB和leuCD,得到菌株CP03-1、CP03-2、CP03-3,其中leuAfbr来源于菌株C.glutamicum CP,具有G127D、I197V、R529H和 G561D突变[21],有研究称该酶突变后可使亮氨酸的耐受浓度提高100倍以上[18]。摇瓶发酵结果如图3-a所示,各菌株的生物量基本一致,但菌株CP03-1的L-亮氨酸产量显著上升,达8.6 g/L,较菌株CP02-2提升了24.6%,糖酸转化率为17.2%,提升了4.9%。菌株CP03-2的L-亮氨酸产量也上升了10.1%,为7.6 g/L,糖酸转化率为16.8%。而菌株CP03-3的亮氨酸产量和糖酸转化率反而有所下降,为6.7 g/L和15.9%。可能原因为leuCD是一个双向异构酶,表达过强反而加强了逆反应的强度,从而造成L-亮氨酸的产量下降。
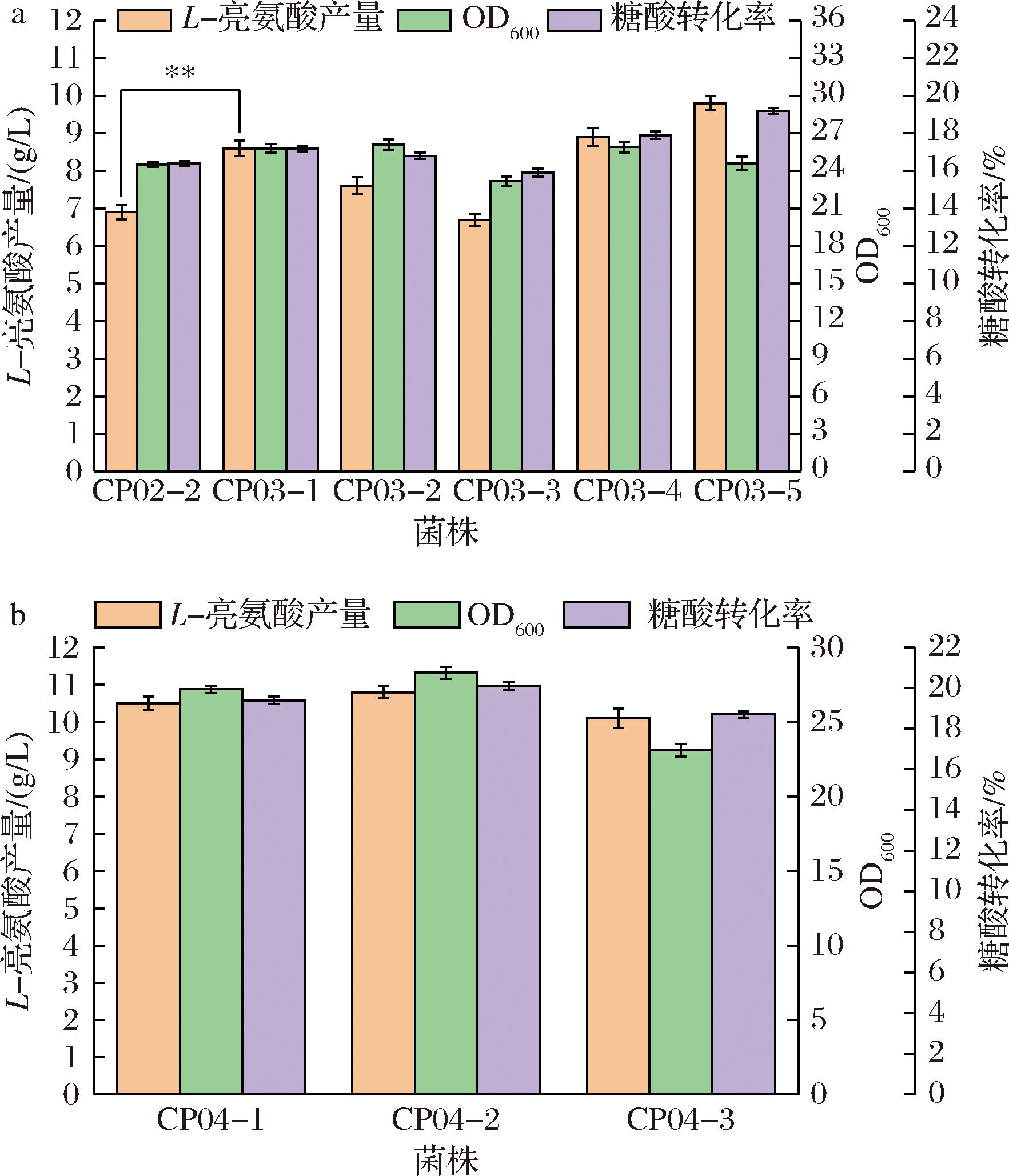
a-CP03-1、CP03-2、CP03-3和CP03-4摇瓶发酵结果;b-CP04-1、CP04-2和CP04-3摇瓶发酵结果
图3 主代谢流加强对L-亮氨酸产量的影响
Fig.3 Effects of enhanced main metabolic flow on L-leucine production
为进一步将代谢流“拉”向L-亮氨酸的合成,在菌株CP03-1的基因组上依次整合了由Ptuf启动的leuB和leuCD,得到菌株CP03-4和CP03-5。结果如图3-a所示,菌株CP03-5的L-亮氨酸产量和糖酸转化率分别为9.8 g/L和19.2%,较菌株CP03-1提高了13.9%和11.6%,表明同时强化leuACP、leuB和leuCD可有效促进L-亮氨酸的合成。可能是leuCD在与leuA、leuB组合过表达后,后者为前者提供了更多的β-异丙基苹果酸以此促进亮氨酸直接前体物α-酮异戊酸的合成,从而L-亮氨酸浓度也有所提高。反之,单独过表达leuCD既造成了不必要的能量浪费,同时还加强了逆反应造成L-亮氨酸产量下降。此外,同时强化leuACP和leuB的组合(CP03-4)也可小幅度提高亮氨酸的产量与糖酸转化率,为8.9 g/L和17.9%。
2.3 支链氨基酸途径的改造与优化
α-酮异戊酸作为亮氨酸的重要前体,其合成的关键酶乙酰乳酸合酶(由ilvBN编码)受支链氨基酸反馈抑制[22]。之前已有研究报道,突变体ilvBNK30Q-G128S-A226S-G235S-Y252H-T362S(后续称ilvBNfbr)可解除亮氨酸对其的反馈抑制[21]。此外,ilvC和ilvD连续催化α-乙酰乳酸合成α-酮异戊酸,中间消耗一个NADPH。为了进一步加强L-亮氨酸合成途径中α-酮异戊酸的供应,在CP03-5的基础上过表达ilvBNfbr、ilvC和ilvD后依次得到了菌株CP04-1、CP04-2和CP04-3。摇瓶发酵结果见图3-b,可以看出CP04-1和CP04-2有较好的效果,L-亮氨酸产量分别为10.5和10.8 g/L,较CP03-5提升了7.1%和10.2%。糖酸转化率也上升至19.4%和20.1%。然而,菌株CP04-3较CP04-2的L-亮氨酸产量有所下降,为10.1 g/L。表明ilvBNfbr和ilvC的过表达促进了α-酮异戊酸的供应,且二者的组合表达效果更佳。而ilvD的表达强度已经足够,继续过表达反而影响了菌体内的代谢平衡从而造成了L-亮氨酸产量下降。并且,CP04-3在摇瓶发酵中出现了大量绵密的泡沫,也验证了过量表达ilvD似乎扰乱了菌株的正常代谢,导致较多的可溶性蛋白生成,这既降低了L-亮氨酸的产量和转化率,还提高了发酵控制难度,而菌株CP04-3较低的生物量和糖酸转化率同样证明了上述猜想。
2.4 维持氧化还原平衡提高糖酸转化率
在生物合成途径中,NADPH是代谢网络中的一种关键辅酶,在氨基酸合成等方面扮演着重要角色。在谷氨酸棒杆菌中,每合成1 mol亮氨酸需要消耗2 mol的NADPH。其中,由ilvC基因编码的乙酰羟酸异构还原酶反应需要消耗1 mol的NADPH,由 ilvE基因编码的支链氨基酸转移酶反应需要消耗谷氨酸并产生α-酮戊二酸,此过程不消耗能量,但是,当α-酮戊二酸重新转化成为谷氨酸时会消耗1 mol的NADPH。DING等[18]通过改善大肠杆菌中的氧化还原通量,亮氨酸的产量提升11.1%。杨汉昆等[23]全部阻断谷氨酸棒杆菌中辅因子NADPH的合成途径,亮氨酸的产量减低了79.22%。因此,适量的NADPH可对L-亮氨酸的合成起促进作用。通常情况下,NADPH主要由磷酸戊糖途径生成,分别在葡萄糖-6-磷酸脱氢酶(由zwf编码)与6-磷酸葡萄糖酸脱氢酶(由gnd编码)催化的反应中产生,但是此过程中还会释放出1分子的CO2,降低了碳源的利用率以及产物的转化率。因此,如何在保持胞内氧化还原平衡的同时提高糖酸转化率是提高L-亮氨酸产量需解决的重要难题。
由zwf所编码的葡萄糖-6-磷酸脱氢酶是磷酸戊糖途径中的关键酶,本研究尝试更换zwf的启动子使其弱化或者敲除zwf,从而减少碳流失。将菌株CP04-2上zwf自身的启动子更换为更弱的mpha启动子或直接敲除zwf基因,得到菌株CP05-1和CP05-2。结果如图4所示,菌株CP05-1和菌株CP05-2的生物量为21.6和19.1,较CP04-2分别下降了22.8%和31.7%,亮氨酸的产量为7.8和7.0 g/L,较CP04-2分别降低了27.7%和35.1%,表明完全敲除zwf基因会对菌体生长产生较大的影响,且还原力NADPH合成的减少,不能满足酶催化的条件,影响了亮氨酸的合成效率。然而,在更换弱启动子的菌株CP05-1中,尽管L-亮氨酸产量同样下降,但其糖酸转化率显著上升至24.1%,相比菌株CP04-2提高了19.9%。不难看出,适当削弱磷酸戊糖途径可使代谢通量更多的流向亮氨酸合成途径,有利于转化率的提升。但是完全阻断磷酸戊糖途径会严重影响菌株生长,因此菌株CP05-1被用于下一步改造。
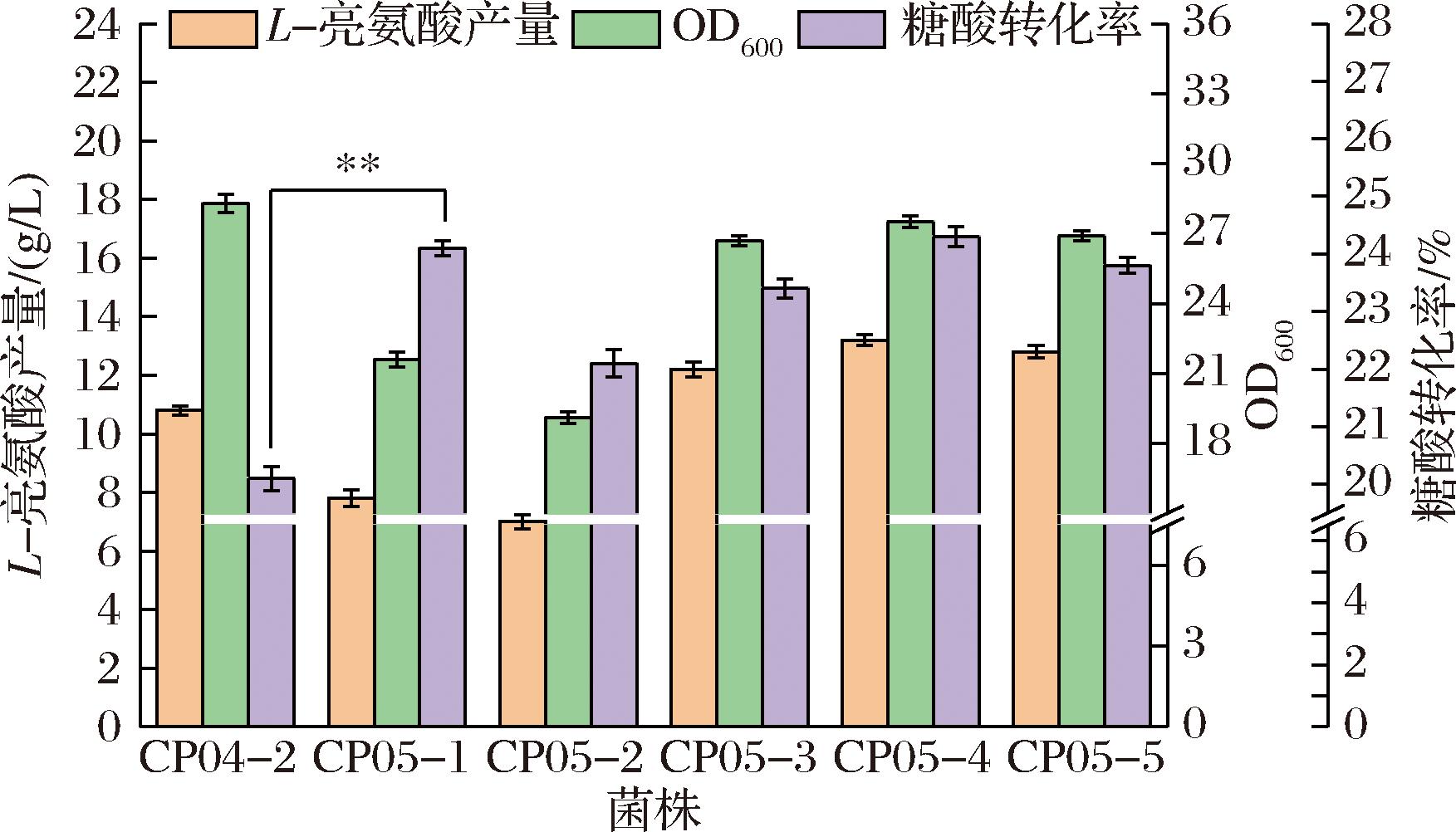
图4 CP05-1、CP05-2、CP05-3、CP05-4和CP05-5摇瓶发酵结果
Fig.4 Shake flask fermentation results of strains CP05-1、CP05-2、CP05-3、CP05-4 and CP05-5
葡萄糖-6-磷酸脱氢酶编码基因zwf的弱化降低了胞内NADPH的可用性,对于L-亮氨酸的产量造成一定影响。然而,由gapX编码的3-磷酸甘油醛脱氢酶在糖酵解过程中负责催化3-磷酸甘油醛生成3-磷酸甘油酸,在此过程中可将NAD+还原为NADH,为菌体提供还原力。有研究表明甘油醛-3-磷酸脱氢酶GapX经过L36S/T37K/P192S突变以后可同时生成NADH与NADPH,可为菌株提供充足还原力的同时加强呼吸链为菌体供能[24]。因此,在菌株CP05-1上整合了由Ptuf控制的gapXfbr基因得到菌株CP05-3,可以看到生物量提升至26.7(如图4),亮氨酸的产量提升至12.2 g/L,糖酸转化率为23.4%,以上结果表明NADPH的供给不足会影响菌株的产酸效率,本研究对还原力再生途径进行优化后使亮氨酸的合成途径更加通畅。为进一步加强菌株的还原力,在菌株CP05-3上面整合双拷贝gapXfbr基因和3拷贝gapXfbr,得到菌株CP05-4 和CP05-5,结果表明两菌株生物量与菌株CP05-3相比持平(如图4),亮氨酸产量相比CP05-3分别上涨8.2%(13.2 g/L)和5.2%(12.8 g/L),而菌株CP05-4的糖酸转化率更高,其产量提升效果更加明显,已经满足菌株合成亮氨酸的还原力需求,过多的还原力反而导致糖酸转化率下降。
2.5 改造转运系统提高亮氨酸滴度
许多研究表明,对菌株进行转运工程改造可有效提高氨基酸的产量[18]。在谷氨酸棒状杆菌中,BrnQ负责支链氨基酸的内转运,而BrnFE则将支链氨基酸转运至胞外[25]。同时,Lrp作为调控因子会响应胞内支链氨基酸浓度来调控BrnFE的表达,当胞内L-亮氨酸浓度上升时,Lrp会上调BrnFE的表达[25]。研究表明初始菌株经诱变后Lrp及BrnFE已经含有额外拷贝[14],因此本研究在菌株CP05-4的基础上敲除brnQ和继续过表达lrp及brnFE来促进支链氨基酸的转运(分别对应图5中菌株CP06-1、CP06-2、CP06-3)。
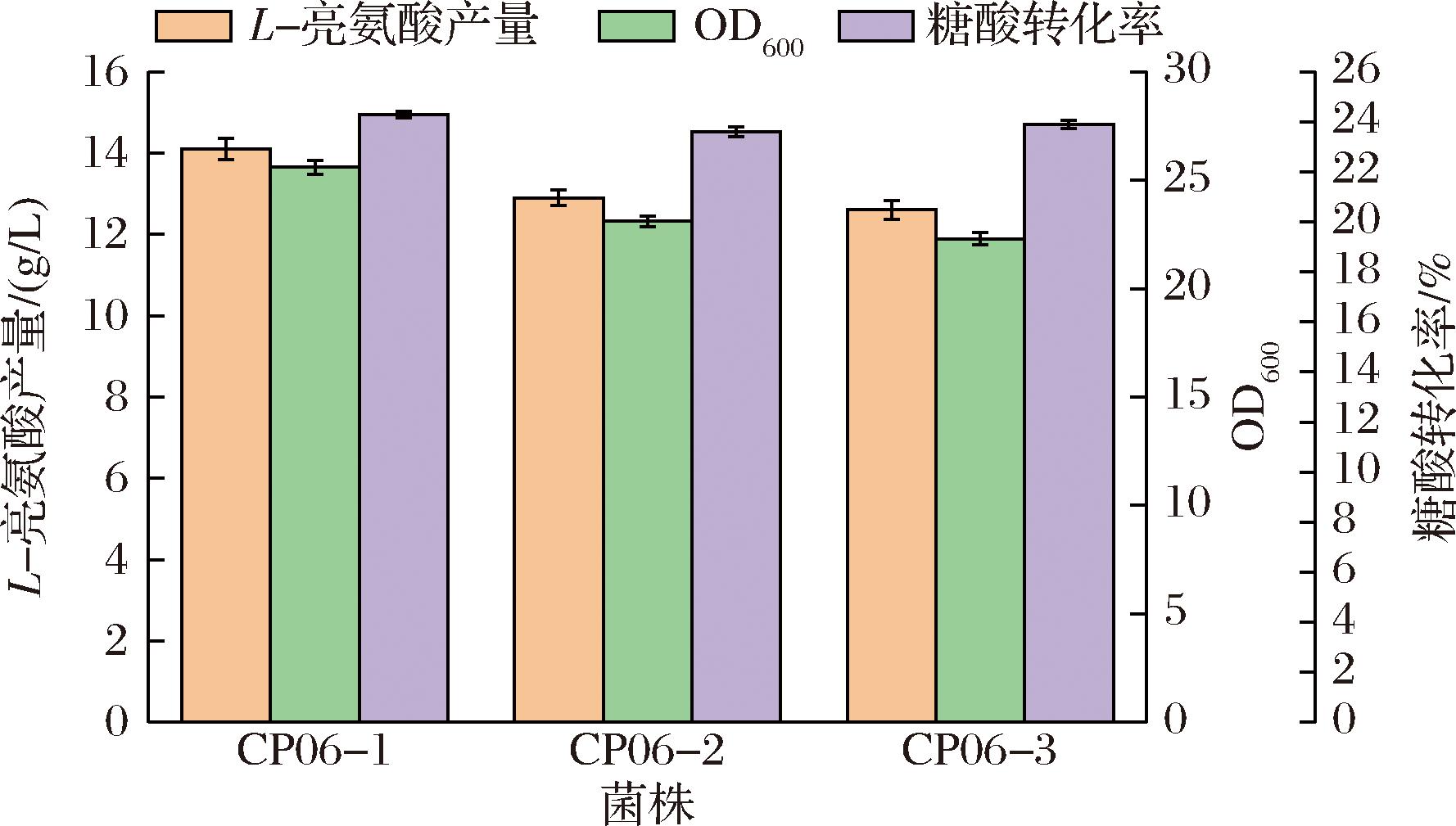
图5 CP06-1、CP06-2和CP06-3摇瓶发酵结果
Fig.5 Shake flask fermentation results of strains CP06-1、CP06-2 and CP06-3
24 h摇瓶发酵结果如图5所示,可见敲除brnQ有益于对亮氨酸积累,菌株CP06-1的L-亮氨酸产量和糖酸转化率为14.1 g/L和24.3%,这与之前的研究一致[13]。而lrp、brnFE过表达后的菌株CP06-2和CP06-3亮氨酸产量几乎没有提升,为12.9和12.6 g/L,且二者生物量有所下降。这表明菌株CP05-4中lrp及brnFE的表达强度已经足够,继续加强膜蛋白反而影响了菌株的正常生长从而导致L-亮氨酸产量下降。
2.6 5 L生物反应器分批发酵验证亮氨酸发酵水平
为了进一步评估本研究采取的策略对L-亮氨酸生产的影响,本研究在5 L生物反应器中对菌株CP(出发菌株)、CP02-2(富集丙酮酸和乙酰CoA)、CP04-2(主代谢流加强)和CP06-1(最终菌株,维持氧化还原平衡和转运系统改造)进行分批补料实验。50 h发酵结果如图6所示,4种菌株表现出了不同的亮氨酸生产性能。菌株CP与其他三者相比,生物量显著偏高(P<0.05),而L-亮氨酸产量(32.4 g/L)和转化率(14.5%)显著偏低(P<0.05)。这些结果表明本研究对菌株的改造具有提高L-亮氨酸产量和糖酸转化率的正向效果。与CP相比,CP02-2的生物量有所降低,但L-亮氨酸产量(43.5 g/L)和转化率(18.2%)有明显提升,分别提高了34.3%和25.5%。这些结果进一步表明引入Bafxpk来增加乙酰CoA并减少碳损失有效提高了L-亮氨酸的产量和糖酸转化率。菌株CP04-2的L-亮氨酸产量达到55.2 g/L,较摇瓶结果显著上升,比CP02-2产量提升了26.9%,糖酸转化率为21.3%,同比上升17%。而最终得到的菌株CP06-1在5-L生物反应器中发酵50 h时L-亮氨酸产量达65.1 g/L,糖酸转化率为25.1%,较改造前的菌株CP分别提高了100.9%和73.1%,具有较大的工业生产价值。
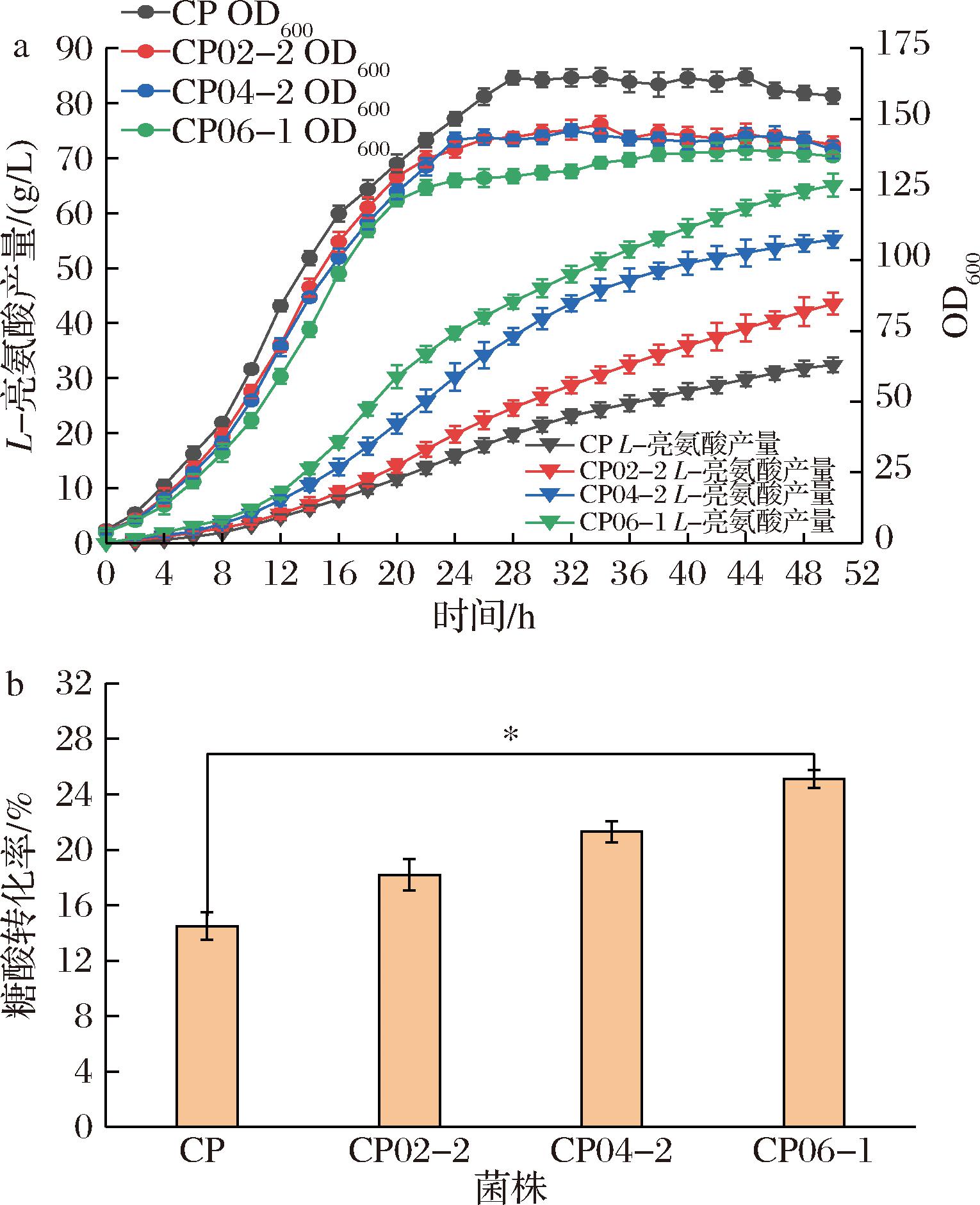
a-50 h发酵曲线图;b-糖酸转化率
图6 菌株CP、CP02-2、CP04-2、CP06-1在5 L发酵罐50 h发酵结果
Fig.6 Fermentation results of strains CP, CP02-2, CP04-2, and CP06-1 in a 5 L bioreactor for 50 hours
值得注意的是,当发酵24 h之后, L-亮氨酸(溶解度约34 g/L)晶体在复杂的发酵液中伴随着高速搅拌与高通风形成了大量泡沫。由于L-亮氨酸晶体和泡沫导致菌体对发酵液中的营养物质和溶解氧吸收减慢,细菌新陈代谢速度下降从而导致L-亮氨酸的产率陡然下降。通常情况下,消泡剂被用于抑制泡沫的产生。一方面,这增加了原料成本;另一方面,过量的消泡剂对菌体存在毒副作用。因此,如何安全有效的抑制L-亮氨酸发酵过程中的泡沫问题具有实际意义。本研究选择在菌株CP06-1在发酵22 h时(L-亮氨酸结晶前)放出一定发酵液,同时补充等量新鲜培养基进行半连续发酵。为避免放液量过多造成的营养物质浪费,本研究在5 L生物反应器中进行了放液-补液量的优化,结果如图7和表3所示。
表3 不同补料方式参数结果对比
Table 3 Comparison of parameter results for different replenishment methods
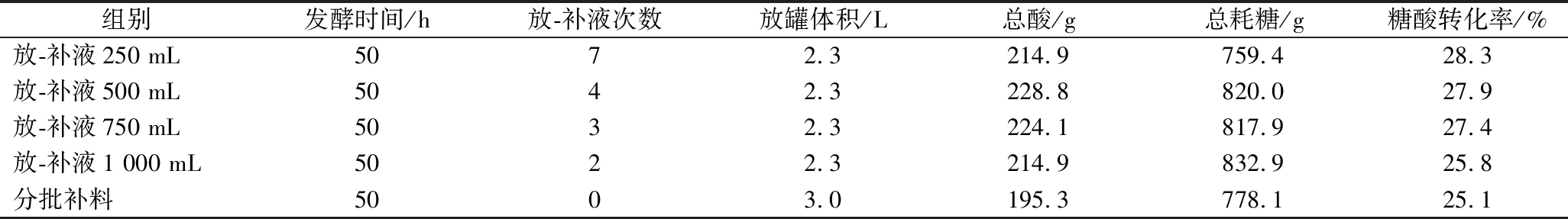
组别发酵时间/h放-补液次数放罐体积/L总酸/g总耗糖/g糖酸转化率/%放-补液250 mL5072.3214.9759.428.3放-补液500 mL5042.3228.8820.027.9放-补液750 mL5032.3224.1817.927.4放-补液1 000 mL5022.3214.9832.925.8分批补料5003.0195.3778.125.1

a-放-补液量250 mL;b-放-补液量500 mL;c-放-补液量750 mL;d-放-补液量1 000 mL
图7 5 L发酵罐中菌株CP06-1半连续发酵不同补料量发酵结果
Fig.7 Semi-continuous fermentation results of strain CP06-1 in a 5 L fermentor with different feeding rates
由图7可见,半连续发酵对菌株的最终生物量和L-亮氨酸产量影响较小,但产酸速率均有显著上升(P<0.05)。此外,随着放液-补液的次数增加,菌株的产酸能力和生长速率逐渐下降,可能原因是菌株在不断传代的过程中逐渐退化。因此,放液-补液次数也限制了菌株的产酸性能。由表3可知,当单次放液-补液量为500 mL 时,菌株CP06-1发酵过程中共放液-补液4次,此时菌株活性较强,最终5 L生物反应器中50 h共产生L-亮氨酸228.8 g,糖酸转化率为27.9%,较分批补料分别提高了17.2%和11.2%,产酸性能极佳。此外,放液-补液量更高时,罐内菌体生物量和L-亮氨酸浓度被大幅稀释,罐内环境大幅改变,原本生长与生产之间平衡状态被打破,生长速率上升而产酸速率有所下降,导致L-亮氨酸产率和糖酸转化率下降。反之,放液-补液量较低,罐内环境变化较小,菌株的L-亮氨酸产率和糖酸转化率更高。考虑到低放液-补液量情况下发酵操纵困难与较高的设备要求,因此本研究认为500 mL的放液-补液即为最适放液-补液量。
3 结论
本研究通过系统代谢工程对L-亮氨酸生产菌株C.glutamicum CP进行模块化改造包括:a)前体丙酮酸及乙酰辅酶A的富集;b)主代谢流(支链氨基酸途径和亮氨酸合成途径)的加强;c)维持氧化还原平衡;d)转运系统改造,最终获得了一株可高效生产L-亮氨酸的谷氨酸棒状杆菌CP06-1。经5 L发酵罐发酵50 h后,L-亮氨酸产量为65.1 g/L,糖酸转化率为25.1%,较改造前分别提高了100.9%和73.1%,是一株具有良好工业价值的L-亮氨酸生产菌株。此外,本研究还发现发酵过程中随着L-亮氨酸的结晶,发酵液中出现大量泡沫,影响了菌体对营养物质和溶解氧的吸收,从而导致产酸速率急速下降。为解决此问题,本研究使用半连续发酵,在发酵过程中通过放液-补液来维持菌体的高活性和高产酸速率。经过优化,发酵过程中500 mL的放液-补液量对菌体的性能具有最大的提升,最终菌株CP06-1在5 L生物反应器中经50 h发酵后共产生L-亮氨酸228.8 g,糖酸转化率27.9%,较普通分批补料发酵提高了17.2%和11.2%,处于国内的先进水平。本研究对L-亮氨酸生产菌C.glutamicum CP进行了系统性的代谢工程改造,并对其发酵条件进行优化,对L-亮氨酸生产菌株开发和利用提供了一定的指导价值。
[1] VAN LOON L J C.Leucine as a pharmaconutrient in health and disease[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2012, 15(1):71-77.
[2] LIU T, ZUO B, WANG W, et al.Dietary supplementation of leucine in premating diet improves the within-litter birth weight uniformity, antioxidative capability, and immune function of primiparous SD rats[J].BioMed Research International, 2018, 2018:1523147.
[3] YANG Y, WU Z L, MEININGER C J, et al.L-leucine and NO-mediated cardiovascular function[J].Amino Acids, 2015, 47(3):435-447.
[4] ZHANG S H, ZENG X F, REN M, et al.Novel metabolic and physiological functions of branched chain amino acids:A review[J].Journal of Animal Science and Biotechnology, 2017, 8:10.
[5] WU G Y.Amino acids:Metabolism, functions, and nutrition[J].Amino Acids, 2009, 37(1):1-17.
[6] WANG Y Y, XU J Z, ZHANG W G.Metabolic engineering of L-leucine production in Escherichia coli and Corynebacterium glutamicum:A review[J].Critical Reviews in Biotechnology, 2019, 39(5):633-647.
[7] CHENG H B, ZHU X, ZHU C, et al.Hydrolysis technology of biomass waste to produce amino acids in sub-critical water[J].Bioresource Technology, 2008, 99(9):3337-3341.
[8] IVANOV K, STOIMENOVA A, OBRESHKOVA D, et al.Biotechnology in the production of pharmaceutical industry ingredients:Amino acids[J].Biotechnology &Biotechnological Equipment, 2013, 27(2):3620-3626.
[9] MARTIN J, EISOLDT L, SKERRA A.Fixation of gaseous CO2 by reversing a decarboxylase for the biocatalytic synthesis of the essential amino acid l-methionine[J].Nature Catalysis, 2018, 1:555-561.
[10] WANG Y Y, ZHANG F, XU J Z, et al.Improvement of L-leucine production in Corynebacterium glutamicum by altering the redox flux[J].International Journal of Molecular Sciences, 2019, 20(8):2020.
[11] WANG Y Y, XU J Z, JIN Z Y, et al.Improvement of acetyl-CoA supply and glucose utilization increases L-leucine production in Corynebacterium glutamicum[J].Biotechnology Journal, 2022, 17(8):e2100349.
[12] WANG Y Y, SHI K, CHEN P D, et al.Rational modification of the carbon metabolism of Corynebacterium glutamicum to enhance L-leucine production[J].Journal of Industrial Microbiology &Biotechnology, 2020, 47(6-7):485-495.
[13] CHEN S L, LIU T S, ZHANG W G, et al.An NADPH-auxotrophic Corynebacterium glutamicum recombinant strain and used it to construct L-leucine high-yielding strain[J].International Microbiology, 2023, 26(1):11-24.
[14] GUI Y L, MA Y C, XU Q Y, et al.Complete genome sequence of Corynebacterium glutamicum CP, a Chinese L-leucine producing strain[J].Journal of Biotechnology, 2016, 220:64-65.
[15] 王颖妤. 代谢工程改造谷氨酸棒杆菌发酵生产L-亮氨酸[D].无锡:江南大学, 2020.
WANG Y Y.Metabolic engineering of Corynebacterium glutamicum for L-leucine fermentation[D].Wuxi:Jiangnan University, 2020.
[16] 张玉富. L-亮氨酸生产菌的代谢工程改造及发酵工艺优化[D].天津:天津科技大学, 2021.
ZHANG Y F.Metabolic engineering and fermentation process optimization of L-leucine producing strain[D].Tianjin:Tianjin University of Science of Technology, 2021.
[17] BOGORAD I W, LIN T S, LIAO J C.Synthetic non-oxidative glycolysis enables complete carbon conservation[J].Nature, 2013, 502(7473):693-697.
[18] DING X H, YANG W J, DU X B, et al.High-level and-yield production of L-leucine in engineered Escherichia coli by multistep metabolic engineering[J].Metabolic Engineering, 2023, 78:128-136.
[19] GONG Y, WANG R Q, MA L, et al.Optimization of trans-4-hydroxyproline synthesis pathway by rearrangement center carbon metabolism in Escherichia coli[J].Microbial Cell Factories, 2023, 22(1):240.
[20] BRUNE I, JOCHMANN N, BRINKROLF K, et al.The IclR-type transcriptional repressor LtbR regulates the expression of leucine and tryptophan biosynthesis genes in the amino acid producer Corynebacterium glutamicum[J].Journal of Bacteriology, 2007, 189(7):2720-2733.
[21] MA Y C, CHEN Q X, CUI Y, et al.Comparative genomic and genetic functional analysis of industrial L-leucine- and L-valine-producing Corynebacterium glutamicum strains[J].Journal of Microbiology and Biotechnology, 2018, 28(11):1916-1927.
[22] YIN L H, HU X Q, XU D Q, et al.Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum[J].Metabolic Engineering, 2012, 14(5):542-550.
[23] 杨汉昆, 徐建中, 张伟国.阻断辅因子NADPH合成对谷氨酸棒杆菌生长及产物合成的影响[J].食品与发酵工业, 2019, 45(10):1-9.
YANG H K, XU J Z, ZHANG W G.Blocking NADPH biosynthesis affected growth and metabolites formation of Corynebacterium glutamicum[J].Food and Fermentation Industries, 2019, 45(10):1-9.
[24] SON H F, PARK W, KIM S, et al.Structure-based functional analysis of a novel NADPH-producing glyceraldehyde-3-phosphate dehydrogenase from Corynebacterium glutamicum[J].International Journal of Biological Macromolecules, 2024, 255:128103.
[25] LANGE C, MUSTAFI N, FRUNZKE J, et al.Lrp of Corynebacterium glutamicum controls expression of the brnFE operon encoding the export system for L-methionine and branched-chain amino acids[J].Journal of Biotechnology, 2012, 158(4):231-241.