甜茶苷(rubusoside, 13-O-β-glucosyl-19-O-β-D-glucosy-steviol, Ru)作为一种罕见的天然甜味剂,存在于我国广西西南山区的蔷薇科悬钩子属植物甜茶中[1],其甜度是蔗糖的114倍、热量约为蔗糖的1%,并且具有与蔗糖接近的清爽甜味。除甜味以外还具有降血糖、降血压、降血脂、抗肿瘤、抗龋齿等生理功能[2-4],提高难溶性药物溶解度,是一种天然增溶剂[5],因此甜茶苷在健康饮料、食品、医药等领域的应用中具有巨大潜力,有效弥补了蔗糖、阿斯巴甜等对生理健康造成的危害[6]。但因其原料甜茶的产量受地域和当地气候影响产量低、价格高,甜茶植物已被列入《世界自然保护联盟濒危物种红色名录》中,所以从甜茶中直接提取和纯化是低效、昂贵、不现实的。
斯替夫苷(stevioside, 13-O-β-sophorosyl-19-O-β-D-glucosyl-steviol, St)是甜叶菊中甜菊糖苷的主要成分之一,与甜茶苷在化学结构上具有相同的内-贝壳杉烯酸分子骨架,区别在于斯替夫苷在C-13的β-1, 2键上有1个额外的葡萄糖。因此,可将斯替夫苷作为生产甜茶苷的底物,利用酶法水解选择性断裂斯替夫苷C-13的β-1, 2糖苷键即可制得甜茶苷。
目前为止,甜茶苷的生产并没有获得明显技术突破,主要来源依旧是从植物中提取,如从甜茶中获得提取液,通过SA-3树脂柱吸附,经体积分数为70%乙醇洗脱收集得到甜茶苷粗品,再利用聚酰胺柱层析后得到甜茶苷精品,进一步的使用溶剂萃取法、重结晶法得到纯度为92%甜茶苷[7],过程复杂、原料受地域气候及种植限制。目前,尚无化学全合成方法制备甜茶苷,可采用酶法定向转化甜菊糖苷制备甜茶苷来解决甜茶苷产量的问题。与化学催化剂相比,酶作为生物催化剂具有加工成本低、对环境影响小、副产物少、产率高等优点,是制备甜茶苷更有效的新途径。先前研究表明[8],对30多种商业酶进行筛选,但仅有来自嗜热链球菌(Thermus thermophiles)的β-半乳糖苷酶可以将斯替夫苷转化为甜茶苷作为主要产物,产率为86%。LAN等[9]发现了一种来自细菌鞘氨醇单胞菌(Sphingomonas elodea ATCC 31461)对甜菊糖苷具有高活性的β-葡萄糖苷酶,几乎可以完全将甜菊糖苷转化为甜茶苷,产率为99%。周卓愉等[10]从黑曲霉(Aspergillus niger)筛选出来一种β-葡萄糖苷酶,可催化水解斯替夫苷生成甜茶苷,同时证明了甜茶苷无细胞毒性并在高浓度作用下具有抑制癌细胞生长的潜力。目前发现的用于酶促水解斯替夫苷制备甜茶苷的酶类只有少数的β-葡萄糖苷酶与β-半乳糖酶[11-13],由于斯替夫苷在C13和C19位点具有3个葡萄糖基,这些葡萄糖基可以完全或者部分被水解,因此其中许多酶对斯替夫苷表现出了非特异性水解从而生成各种副产物,如甜菊醇、异甜菊醇、甜菊醇单糖酯、甜菊醇单糖苷等以及甜茶苷被进一步水解,导致产率降低。迄今为止未曾发现可将糖苷键断裂使斯替夫苷转化为甜茶苷的脂肪酶的报道。
本研究首次发现了一种具有底物特异性和高催化性能的催化水解斯替夫苷制备甜茶苷的脂肪酶Lip A(来自Aspergillus niger),探讨了脂肪酶Lip A对斯替夫苷水解的最佳反应条件,通过控制反应条件可做到特异性生成甜茶苷,并采用液质联用、红外、核磁共振技术对水解产物进行定性分析,阐明产物生成路径。为甜茶苷的高效工业化生产提供了巨大潜力。
1 材料与方法
1.1 材料与试剂
斯替夫苷、莱鲍迪苷A、莱鲍迪苷C、脂肪酶Lip A(来自黑曲霉Aspergillus niger, ≥120 000 U/g)、脂肪酶(来自米曲霉Aspergillus oryzae)、脂肪酶G(来自卡门柏青霉Penicillium camemberti)、脂肪酶(来自假丝酵母菌Candida sp.)、果胶酶(来自棘孢曲霉Aspergillus aculeatus)、果胶酶(来自黑曲霉Aspergillus niger),阿拉丁;果胶酶,国药集团化学试剂有限公司;果胶酶,北京博奥森生物技术有限公司;木瓜蛋白酶,国药集团化学试剂有限公司;酸性纤维素酶和乳糖酶,南宁庞博生物工程有限公司;β-葡萄糖苷酶(来自黑曲霉Aspergillus niger)、β-半乳糖苷酶(来自乳酸克鲁维酵母Kluyveromyces lactis),诺维信公司;β-半乳糖苷酶(来自乳酸克鲁维酵母Kluyveromyces lactis),帝斯曼;乙腈(HPLC),ACS;无水甲醇、乙酸、乙酸钠、Na2HPO4、NaH2PO4,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪、Agilent 6230飞行时间液质联用,安捷伦科技有限公司;IS50傅里叶变换红外,美国赛默飞世尔科技公司;AVANCE Ⅲ 400M数字化核磁共振谱仪,德国布鲁克公司;AUW120D分析天平,日本岛津有限公司;101-3Y恒温干燥箱,杭州天蓝化验仪器厂;JS031SD超声波清洗机,深圳市超洁科技实业有限公司;TG16G离心机,盐城凯特实验仪器有限公司;LC-10N冷冻干燥机,上海力辰邦西仪器科技有限公司;RE-6000旋转蒸发仪,上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 酶筛选
在10 g/L的斯替夫苷水溶液中加入质量浓度均为10 mg/mL的不同商业水解酶,在50 ℃下振荡(135 r/min)反应一定时间,加入5倍体积无水甲醇溶液终止反应,得到斯替夫苷水解液,HPLC分析水解液。HPLC检测条件如下:Kromasil 100-5-C18色谱柱(4.6 mm×250 mm);检测波长210 nm;梯度洗脱程序:流动相为V(水)∶V(乙腈)=70∶30(0 min),56∶44(10 min),26∶74(12 min),26∶74(18 min),70∶30(25 min),70∶30(27 min);柱温:40 ℃;流速:0.8 mL/min;进样量:20 μL。
1.3.2 脂肪酶Lip A水解条件优化
采用单因素法探究温度、pH、底物浓度、加酶量、金属离子、反应时间对脂肪酶Lip A水解斯替夫苷的影响。以斯替夫苷转化率与甜茶苷生成率为考察指标。
1.3.3 脂肪酶Lip A水解斯替夫苷
将10 g/L斯替夫苷溶液在55 ℃气浴振荡预热10 min,然后加入脂肪酶Lip A,135 r/min下振荡反应24 h。定时取样,无水甲醇灭活终止反应,HPLC分析水解液。斯替夫苷转化率[A(St)]和甜茶苷产率[B(Ru)]计算方法如公式(1)、公式(2)所示:
(1)
(2)
式中:A0,St的初始峰面积;At,t时刻St的峰面积;Bt,t时刻Ru的峰面积,得斯替夫苷转化率与甜茶苷产率。
1.3.4 水解产物分离表征
利用LC-MS对1.3.2节、1.3.3节中水解液各组分的相对分子质量进行鉴定。检测条件:流动相为V(水)∶V(甲醇)=25∶75(36 min);柱温45 ℃;流速为0.3 mL/min;进样质量浓度为1 mg/mL;进样量为1 μL;负离子检测模式;相对分子质量范围为100~2 000。
利用甲醇重结晶技术纯化产物,将得到的水解液浓缩后冷冻干燥,加入一定体积的体积分数为95%甲醇,70 ℃油浴中加热搅拌至全部溶解,于4 ℃析出白色晶体。纯化后的产物采用KBr压片法,在波数4 000~400 cm-1范围内进行检测;将纯化后产物溶于重水中,得产物1H-NMR和13C-NMR,氢谱中所有化学位移以重水的1H(4.80 ppm) 为基准。
2 结果与分析
2.1 酶筛选
不同来源的酶其结构、活性、功能等具有很大差异。14种商业水解酶催化斯替夫苷的活性如图1所示。HPLC结果显示来自Aspergillus niger的脂肪酶Lip A与来自Aspergillus niger的β-葡萄糖苷酶能够水解斯替夫苷,反应过程伴随有副产物的生成。本实验均以来自Aspergillus niger的脂肪酶Lip A为研究对象,如图2所示,使用不同的底物测定脂肪酶Lip A的底物特异性,结果表明只在斯替夫苷中表现明显,在莱鲍迪苷A和莱鲍迪苷C中没有发生物质转换。
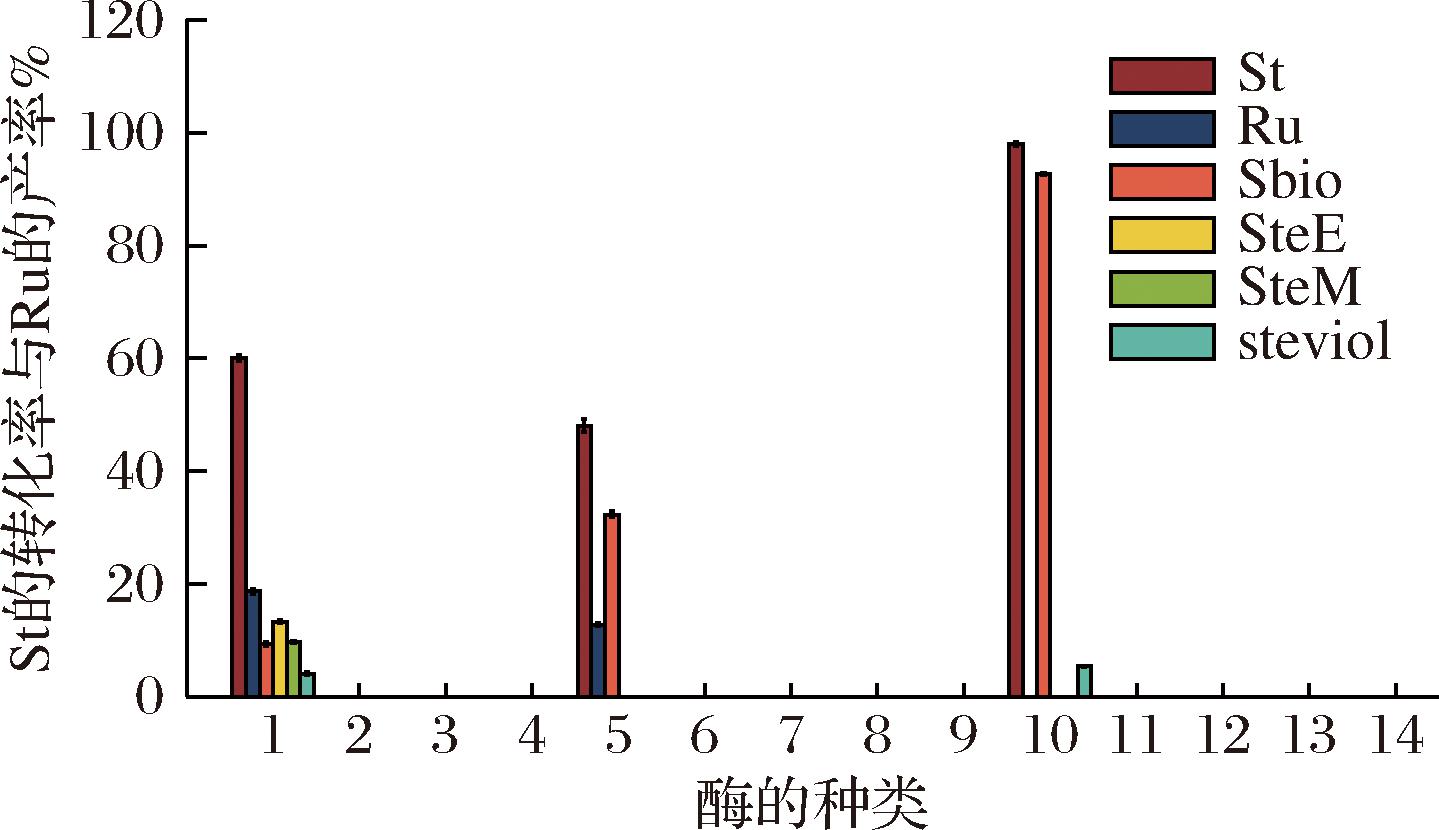
图1 酶促水解斯替夫苷
Fig.1 Enzymatic hydrolysis of stevioside
注:10 g/L St, 50 ℃, 蒸馏水。1.脂肪酶Lip A(来自Aspergillus niger, 阿拉丁);2.脂肪酶(来自Aspergillus oryzae, 阿拉丁);3.脂肪酶G(来自Penicillium camemberti, 阿拉丁);4.脂肪酶(来自Candida sp., 阿拉丁);5.β-葡萄糖苷酶(来自Aspergillus niger, 诺维信);6.果胶酶(来自Aspergillus aculeatus, 阿拉丁);7.果胶酶(来自Aspergillus niger, 阿拉丁);8.果胶酶(夏盛)9.果胶酶(Bioss);10.β-半乳糖苷酶(来自Kluyveromyces lactis, 帝斯曼);11.β-半乳糖苷酶(来自Kluyveromyces lactis, 诺维信)12.木瓜蛋白酶(国药);13.酸性纤维素酶(豫万邦);14.乳糖酶(豫万邦);甜茶苷(rubusoside, Ru);甜菊醇双糖苷(steviolbioside, Sbio);甜菊醇单糖酯(steviol-19-O-β-D- glucoside, SteE);甜菊醇单糖苷(steviolmonoside, SteM);甜菊醇(steviol)
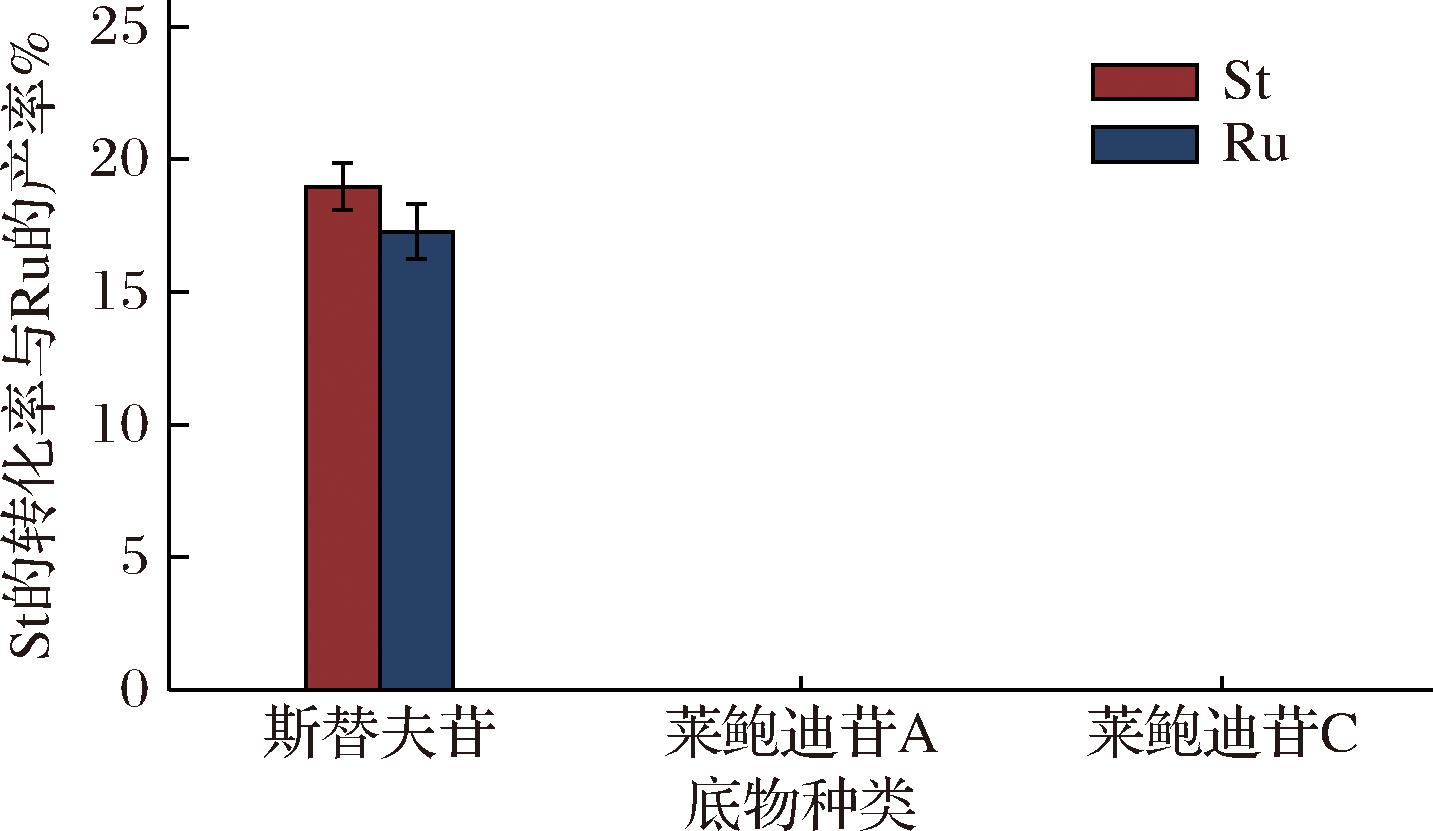
图2 底物特异性
Fig.2 Substrate specificity
注:1%St, 50 ℃, 3 h,蒸馏水。
2.2 产物的表征
2.2.1 IR及LC-MS分析
利用甲醇重结晶技术,得到HPLC纯度大于99%的水解产物,其具有与天然Ru相同的保留时间。采用KBr压片法对产物进行红外表征,由图3可知3 385 cm-1处吸收谱带宽而强为O—H的伸缩振动峰、2 926 cm-1处为—CH3、—CH2—的特征吸收峰、1 740 cm-1处为C![]() O的伸缩振动峰、1 619 cm-1为C
O的伸缩振动峰、1 619 cm-1为C![]() C特征峰,与甜茶苷特征结构一致。通过LC-MS对水解产物进行进一步的分析与鉴定,如图4所示,ESI-模式下准分子离子的质荷比为m/z 641[M-H]-,其二级质谱得到m/z 479[M-Glc-H]-,结合精确相对分子质量,初步鉴定其为甜茶苷。
C特征峰,与甜茶苷特征结构一致。通过LC-MS对水解产物进行进一步的分析与鉴定,如图4所示,ESI-模式下准分子离子的质荷比为m/z 641[M-H]-,其二级质谱得到m/z 479[M-Glc-H]-,结合精确相对分子质量,初步鉴定其为甜茶苷。
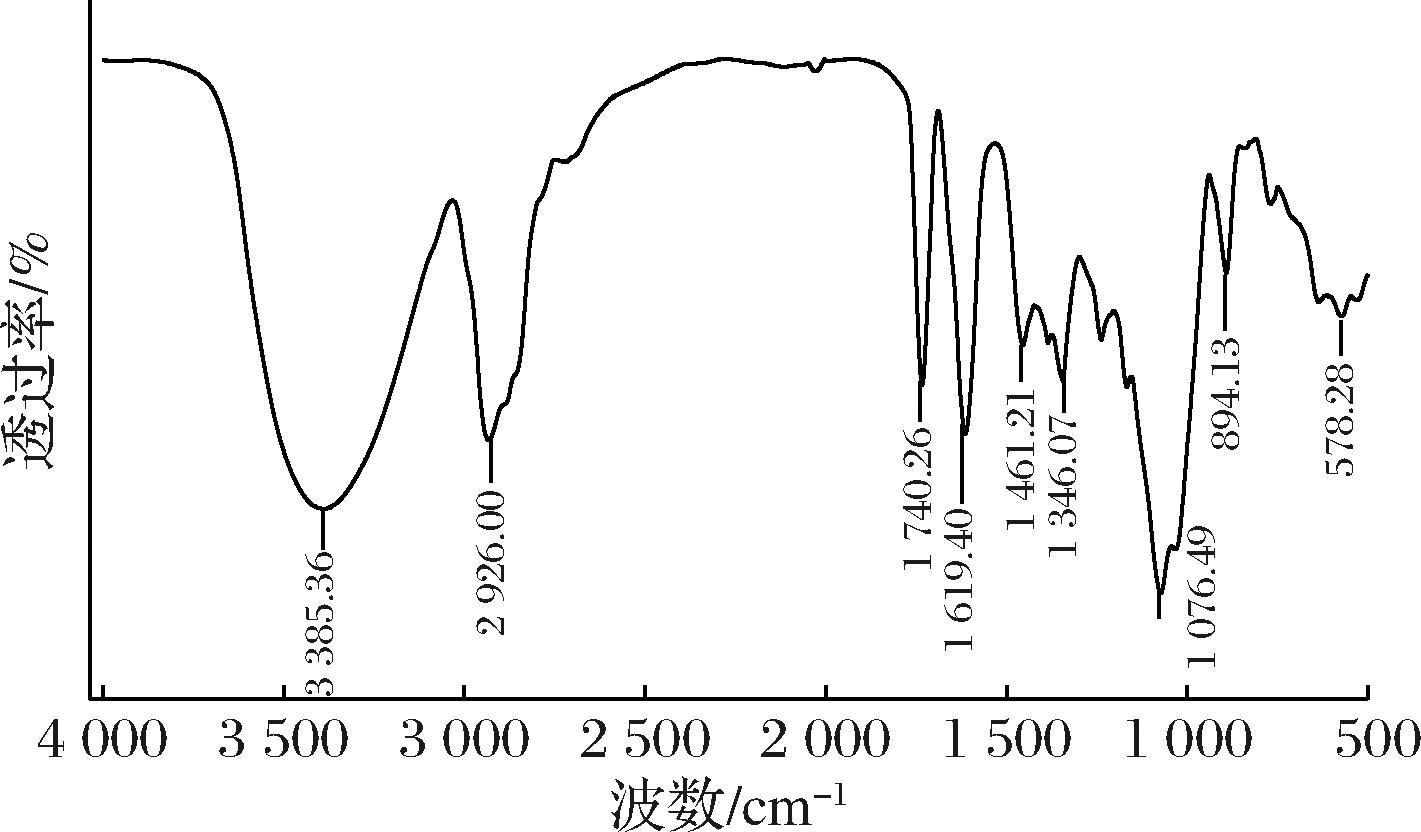
图3 斯替夫苷水解产物红外图
Fig.3 IR of the product from hydrolysis of stevioside
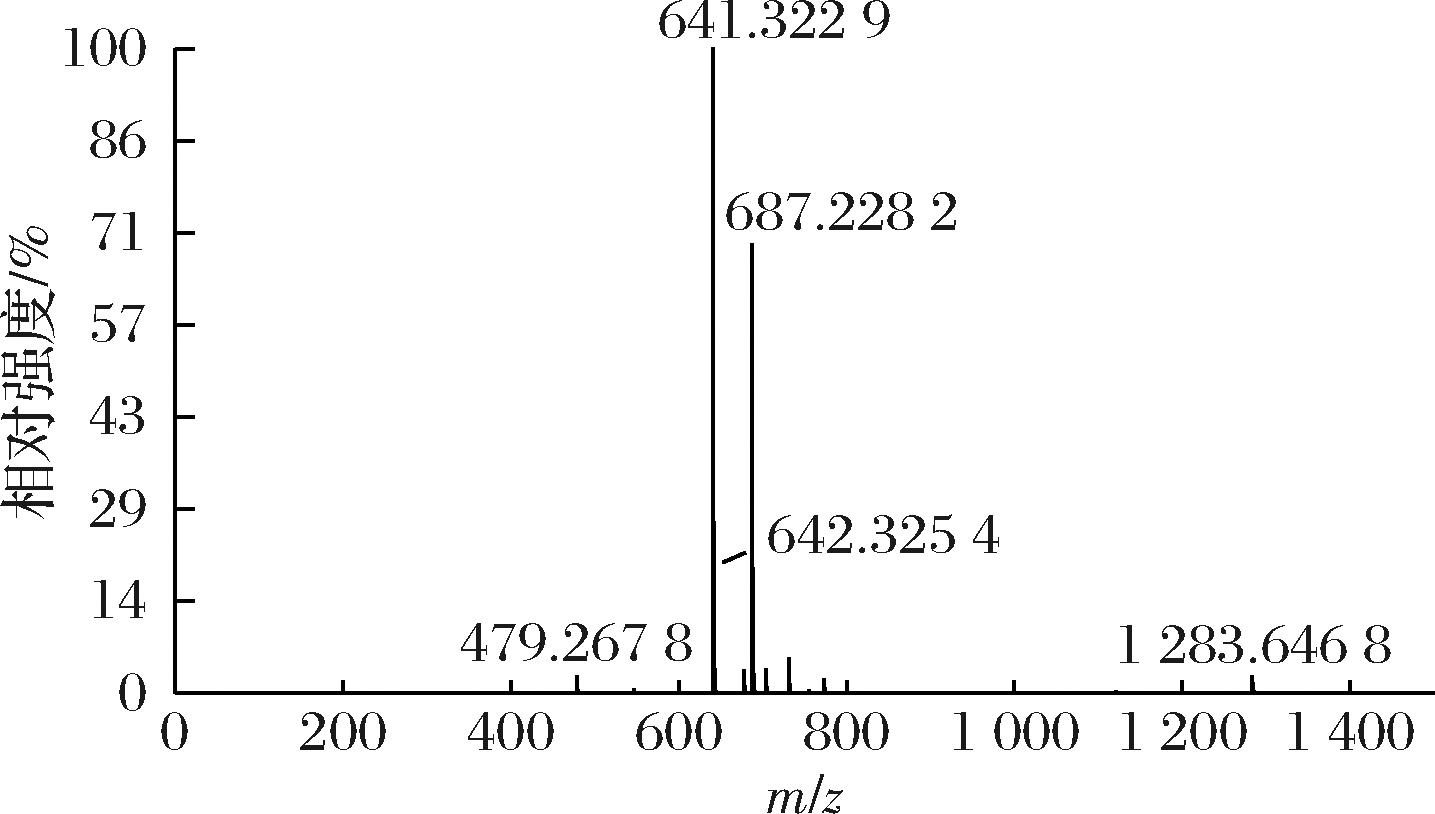
图4 斯替夫苷水解产物质谱图
Fig.4 MS of the product from hydrolysis of stevioside
2.2.2 1H与13C NMR分析
产物的一维核磁共振谱如图5所示,1H谱中,异头区存在4个峰值,包括δ 5.27 ppm (d, J=7.2, 1H), δ 5.00 ppm (s, 1H), δ 4.80 ppm (s, 1H), δ 4.49 ppm (d, J=8.0, 1H)。其中,δ 5.27 ppm (d, J=7.2, 1H) 和δ 4.49 ppm (d, J=8.0, 1H) 的高J耦合距离表明它们的葡萄糖残基为β-构型,δ 5.00 ppm (s, 1H) 与δ 4.80 ppm (s, 1H) 为单峰表明其为与苷元的烯烃(C-17)相连的质子信号。在13C谱中,因为羧基(C19)和C![]() C双键(C16和C17)的存在,可以在低场中观察到3个峰(C-19,178.19 ppm;C-16,152.61 ppm;C-17,105.15 ppm)。核磁共振谱的特征峰与文献报道的甜茶苷特征峰一致[10-11],结合上述的HPLC与LC-MS分析结果,可以确定该产物为甜茶苷。
C双键(C16和C17)的存在,可以在低场中观察到3个峰(C-19,178.19 ppm;C-16,152.61 ppm;C-17,105.15 ppm)。核磁共振谱的特征峰与文献报道的甜茶苷特征峰一致[10-11],结合上述的HPLC与LC-MS分析结果,可以确定该产物为甜茶苷。
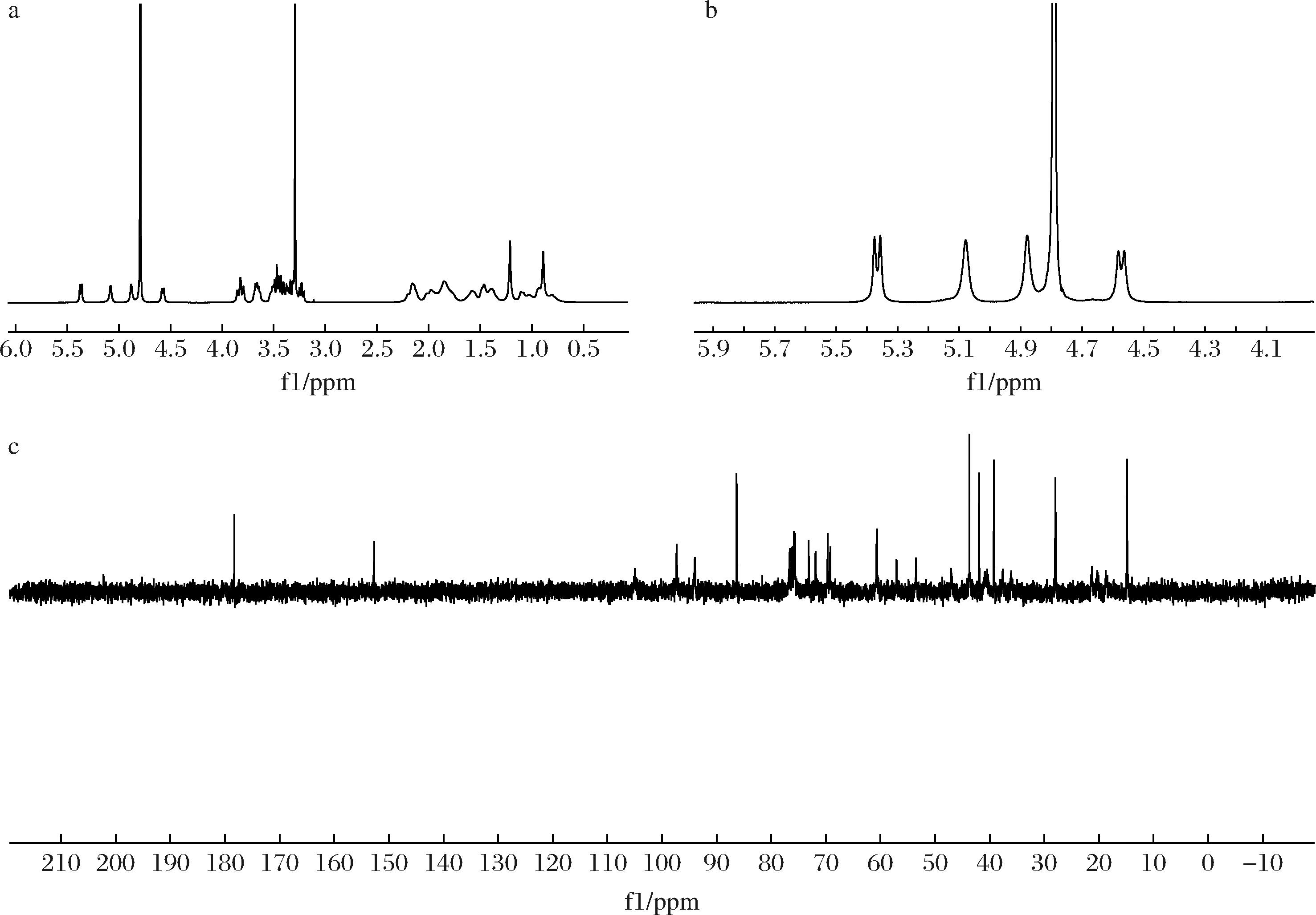
a-完整的1H-NMR谱;b-放大葡萄糖基的异头区的质子;c-完整的13C-NMR谱
图5 水解产物的1H-NMR谱和13C-NMR谱
Fig.5 1H-NMR and 13C-NMR profiles of the hydrolysis product
2.3 反应条件优化
酶促反应受底物的浓度、温度、pH值、加酶量等因素的影响,不仅影响酶促反应速率,还可能影响反应产物。
温度在35~55 ℃范围内,酶解温度升高,酶活性增加,Ru转化率呈增长趋势,当酶解温度达到55 ℃之后随着温度升高Ru转化率不再增加,将呈下降趋势,这是因为温度超过最适温度,破坏了酶的非共价键结构,使得酶的结构改变而失活。温度在35~50 ℃范围内St水解率高、Ru的转化率低的原因是将St更多的转化为了各种副产物(图6-a);pH不仅影响底物的解离行为,还影响酶中活性基团的空间结构和解离状态,通过pH的改变,抑制了副产物的生成,提高了目标产物Ru的生成。在pH 2.5~5.5酸性环境下具有较好的St水解率与Ru转化率,最适pH为4.5(图6-b);酶解反应为可逆反应,当体系随底物质量浓度增加而导致产物达到一定质量浓度时,不仅抑制酶对底物的酶解能力,还会促使反应逆向进行,导致转化率降低(图6-c);当加酶量达到1 200 U/g时,反应5 h后St的转化率已经达到90%,Ru的产率为88%(图6-d);金属离子可以通过与酶的特定位点结合来影响酶的构象和催化活性。Ca2+、Mn2+、Zn2+、Cu2+、Fe2+、Fe3+、Mg2+为7种工业常见的金属离子,与未添加金属离子的空白对照组比较,结果发现Zn2+、Fe2+对斯替夫苷的水解反应起促进作用,其中Fe2+促进作用最为显著。Ca2+、Mg2+对水解反应有轻度抑制作用,Cu2+对脂肪酶Lip A具有明显抑制作用(图6-e),可能是由于酶与金属离子形成了配位键,影响了酶的活性,因此在今后工业生产中可以避免此类金属离子的混入。当反应达到9 h时,基本反应完成,产率可达90%(图6-f)。
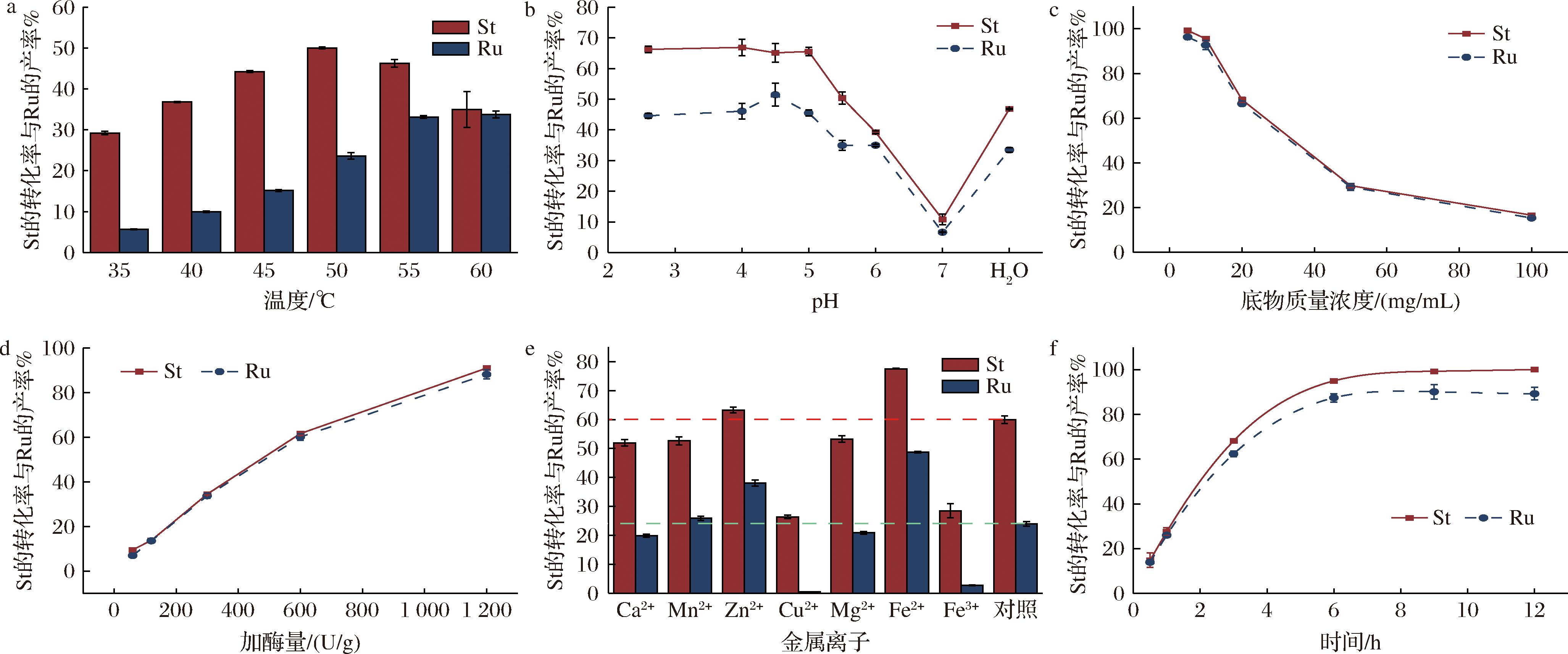
a-温度影响1%St, H2O, 600 U/g脂肪酶Lip A;b-pH影响1%St, 600 U/g脂肪酶Lip A, 55 ℃;c-底物浓度影响1 200 U/g脂肪酶Lip A, 55 ℃, pH 4.5;d-加酶量影响1%St, 55 ℃, pH 4.5;e-金属离子影响1%St, 600 U/g脂肪酶Lip A, H2O, 55 ℃;f-反应进程1%St, 1 200 U/g脂肪酶Lip A, 55 ℃, pH 4.5
图6 黑曲霉脂肪酶Lip A催化水解斯替夫苷反应条件优化
Fig.6 Single-factor test on production of rubusoside from stevioside with the lipase from Aspergillus niger
2.4 产物反应路径初步分析
在单因素实验探究中,HPLC结果显示脂肪酶Lip A催化水解斯替夫苷的反应体系中伴随温度的改变除目标主产物甜茶苷外,由于酶催化反应下葡萄糖基可能发生的连续水解产生了甜菊醇双糖苷、甜菊醇单糖苷、甜菊醇单糖酯、甜菊醇4种副产物。通过LC-MS按实验方法1.3.4节鉴定反应液中副产物。峰3离子峰为641,为甜菊醇双糖苷;峰4、5离子峰为480,为甜菊醇单糖苷和甜菊醇单糖酯;峰6离子峰为318,为甜菊醇。HPLC结果显示(图7-e),在确保脂肪酶Lip A的催化活性和稳定性下,改变pH使环境呈酸性以及提高反应温度,反应副产物峰消失,有效抑制了副产物的生成,使斯替夫苷专一性的转化为甜茶苷,提高了目标产物产率,这可能与酶分子活性部位上有关基团的解离有关。

图7 产物路径初步分析图
Fig.7 Preliminary analysis of product path
注:a.斯替夫苷(St);b.H2O, 45 ℃下St水解HPLC图;c.甜茶苷(Ru);d.副产物(甜菊醇双糖苷Sbio、甜菊醇单糖苷SteM、甜菊醇单糖酯SteE、甜菊醇Steviol);e.条件优化(左图为1%St, 600 U/g脂肪酶Lip A, H2O。A.35 ℃;B.40 ℃;C.45 ℃;D.50 ℃;E.55 ℃;F.60 ℃;右图为1%St, 600 U/g脂肪酶Lip A, 55 ℃。A.pH 2.6;B.pH 4;C.pH 4.5;D.pH 5;E.pH 5.5;F.pH 6;G.pH 7;H.H2O);f.pH 4.6, 50 ℃下St水解HPLC图。
3 结论
本实验利用液质联用、傅里叶变换红外、核磁共振技术,首次确定了来自Aspergillus niger的脂肪酶Lip A可以特异性水解斯替夫苷C-13的β-1, 2糖苷键生成甜茶苷。当加酶量为1 200 U/g, 在55 ℃和pH 4.5环境下,反应9 h斯替夫苷转化率可达99%,产率为90%。同时,初步探讨了关于反应过程中产物生成的影响因素及初步反应路径,改变pH使环境呈酸性以及提高反应温度,能有效抑制副产物的生成,使斯替夫苷专一性的转化为甜茶苷。本研究扩充了甜茶苷的制备方法,丰富了甜菊糖的应用,未来将进一步进行工业化放大研究,实现甜茶苷的高通量制备。
[1] OHTANI K, AIKAWA Y, KASAI R, et al.Minor diterpene glycosides from sweet leaves of Rubus suavissimus[J].Phytochemistry, 1992, 31(5):1553-1559.
[2] ORELLANA-PAUCAR A M.Steviol glycosides from Stevia rebaudiana:An updated overview of their sweetening activity, pharmacological properties, and safety aspects[J].Molecules, 2023, 28(3):1258.
[3] MENG T Y, ZHANG Y F, HUANG J, et al.Rubusoside mitigates neuroinflammation and cellular apoptosis in Parkinson’s disease, and alters gut microbiota and metabolite composition[J].Phytomedicine, 2024, 124:155309.
[4] MARKUS V, SHARE O, TERAL K, et al.Anti-quorum sensing activity of Stevia extract, stevioside, rebaudioside A and their aglycon steviol[J].Molecules, 2020, 25(22):5480.
K, et al.Anti-quorum sensing activity of Stevia extract, stevioside, rebaudioside A and their aglycon steviol[J].Molecules, 2020, 25(22):5480.
[5] CHEN J Z, KHISTE S K, FU X M, et al.Rubusoside-assisted solubilization of poorly soluble C6-Ceramide for a pilot pharmacokinetic study[J].Prostaglandins &Other Lipid Mediators, 2020, 146:106402.
[6] RIBOLI E, BELAND F A, LACHENMEIER D W, et al.Carcinogenicity of aspartame, methyleugenol, and isoeugenol[J].Lancet.Oncology, 2023, 24(8):848-850..
[7] 鲍晨阳. 甜茶中主要活性成分提取、纯化工艺的研究[D].贵阳:贵州师范大学, 2016.
BAO C Y.Study on extraction and purification of main active components in sweet tea[D].Guiyang:Guizhou Normal University, 2016.
[8] NGUYEN T T H, JUNG S J, KANG H K, et al.Production of rubusoside from stevioside by using a thermostable lactase from Thermus thermophilus and solubility enhancement of liquiritin and teniposide[J].Enzyme and Microbial Technology, 2014, 64:38-43.
[9] LAN Q, TANG T T, YIN Y, et al.Highly specific sophorose β-glucosidase from Sphingomonas elodea ATCC 31461 for the efficient conversion of stevioside to rubusoside[J].Food Chemistry, 2019, 295:563-568.
[10] 周卓愉, 隋晓辰, 夏咏梅.甜茶苷的酶法制备及其对肝肠胃细胞的抑制作用[J].应用化学, 2020, 37(7):785-792.
ZHOU Z Y, SUI X C, XIA Y M.Enzymatic synthesis of rubusoside and its inhibition on liver and gastrointestinal cells[J].Chinese Journal of Applied Chemistry, 2020, 37(7):785-792.
[11] YAN Z X, CAO X T, YANG X, et al.A novel β-glucosidase from Chryseobacterium scophthalmum 1433 for efficient rubusoside production from stevioside[J].Frontiers in Microbiology, 2021, 12:744914.
[12] KO J A, KIM Y M, RYU Y B, et al.Mass production of rubusoside using a novel stevioside-specific β-glucosidase from Aspergillus aculeatus[J].Journal of Agricultural and Food Chemistry, 2012, 60(24):6210-6216.
[13] WANG Z L, WANG J P, JIANG M H, et al.Selective production of rubusoside from stevioside by using the sophorose activity of β-glucosidase from Streptomyces sp.GXT6[J].Applied Microbiology and Biotechnology, 2015, 99(22):9663-9674.