藏羊(Tibetan sheep)属于牛科羊亚科羊属藏系绵羊种,主要分布于青海、西藏、甘肃等地。羊血是藏羊屠宰后的主要副产物,目前大多作为废物排放,造成了资源浪费和环境污染。开发和利用藏羊血液资源,变废为宝,可提高藏羊产业附加值、减少环境污染。
研究表明,机体衰老与其产生活性氧密不可分。抗氧化剂的摄入可清除体内过量的自由基,在减轻机体的氧化损伤方面起着重要的作用[1]。近年来,由于食源性生物活性肽具有安全易吸收的特点,且包含多种生物活性,如抗氧化[2]、降血压及降血糖[3]等作用,故源于动植物抗氧化肽被广泛的研究,如植物源的辣椒籽蛋白[4]、玉米蛋白[5]、小米蛋白[6]和动物源的鸭血浆蛋白[7]、鸡血蛋白[8]等己用于制备生物活性肽。而羊血中含有丰富的蛋白质资源,粗蛋白含量达到84.7%,以血细胞中的血红蛋白为主[9]。目前,我国在羊血资源的开发利用方面,主要开展了血红素提取[10]、血肽制备和超氧化物歧化酶分离[11]等方面的研究,研究表明,羊血具有抗氧化、补血等功效,开发潜力较大,但对于高原特种藏羊血液的研究还较少,且关键技术和活性尚不清楚,还需进一步探索。
传统多肽的制备方法,通常是使用特定的酶对蛋白进行酶解,然后对其分离、鉴定,并通过体内外活性实验对活性进行确定[12]。随着蛋白质数据库、多肽数据库、生物活性预测工具和分子对接软件等生物信息学工具的出现,蛋白质酶解以及活性预测筛选可以进行计算机模拟实验,此方法可减少试验的盲目性,节约试验经费、研究时间,提高活性多肽的发现效率[13]。
本研究采用计算机模拟酶解和虚拟筛选的方法获得酶解藏羊血红蛋白的最佳抗氧化肽段,并通过固相合成法[14]合成相应多肽,使用DPPH自由基和ABTS阳离子自由基清除实验验证其抗氧化活性。为合理利用藏羊屠宰加工过程中的副产品提供新思路。
1 材料与方法
1.1 材料与仪器
UniProt数据库(https://www.uniprot.org/);BIOPEP在线工具(http://www.uwm.edu.pl/biochemia/index);Prot Param在线工具(https://web.expasy.org/protparam/);ExPASy Peptide Cutter在线工具(http://web.expas.org/peptidecutter/);Peptide Ranker在线工具;Innovagen在线工具;ToxinPred在线工具;AdmetSAR在线系统(http://lmmd.ecust.edu.cn/admetsar 1/predict/);iBitter-SCM在线工具;PDB 数据库(https://www.rcsb.org/);Pymol;AutoDock;Discovery Studio;DPPH、ABTS、过硫酸钾,Sigma公司;赖氨酸-精氨酸-甲硫氨酸(Lys-Arg-Met,KRM)、苯丙氨酸-脯氨酸-亮氨酸(Phe-Pro-Leu,FPL)、苯丙氨酸-亮氨酸(Phe-Leu,FL)(纯度≥95%),兰州大学合成。
电子分析天平,奥豪斯国际贸易(上海)有限公司;酶标仪,瑞士帝肯公司;冷冻干燥机、超声波清洗机,宁波新芝生物科技股份有限公司。
1.2 藏羊血红蛋白潜在活性片段评价
使用UniProt数据库查找经过验证藏羊血红蛋白的氨基酸序列。筛选出5条蛋白链(表1)。将5条蛋白链作为生物活性肽前体的图谱,在BIOPEP[15]使用“潜在生物活性图谱”工具,查找蛋白质序列中生物活性片段的类型和位置。同时,以具有给定活性的多肽在蛋白质中出现的频率作为评价参数(A)[16],根据公式(1)计算:
(1)
表1 藏羊血红蛋白链
Table 1 Hemoglobin chains of Tibetan sheep

Uniprot ID蛋白名称氨基酸数分子质量/DaP02075血红蛋白β链14516 073P68056血红蛋白β-C链14215 750P68240血红蛋白α-1/2链14215 164P02083血红蛋白γ链14515 931P33709促红细胞生成素19421 335
式中:a,蛋白质序列中具有给定活性的多肽数;N,蛋白质中的氨基酸残基数。
1.3 藏羊血红蛋白虚拟酶解
分析藏羊血红蛋白的氨基酸组成及占比,利用Prot Param在线工具[17],对5种不同藏羊血红蛋白的氨基酸序列进行分析,以确定它们抗氧化的潜力。在此基础上使用ExPASy Peptide Cutter程序[18]对筛选出的藏羊血红蛋白进行虚拟酶解,酶解的蛋白酶包括蛋白酶K4.21.62、胰蛋白酶EC 3.4.21.4、胃蛋白酶(pH 1.3,pH>2,EC 3.4.23.1)、低特异性糜蛋白酶(C端指[FYWML],不在P之前,EC 3.4.21.1)以及高特异性糜蛋白酶(C端指[FYW],不在P之前,EC 3.4.21.1)模拟酶解,计算理论水解度(theoretical degree of hydrolysis,TDH),计算方法如公式(2)所示:
(2)
式中:D,蛋白质中肽键总数;d,被裂解的肽键数。
1.4 藏羊血红蛋白抗氧化肽虚拟筛选
将虚拟酶解所得多肽与BIOPEP-UWM中己知的抗氧化肽进行比较,选取未知的多肽通过在线软件Peptide Ranker[19]进行生物活性的预测,筛选活性评分>0.5的多肽。利用在线工具Innovagen对筛选的多肽进行溶解性预测,通过ToxinPred在线软件预测其毒性,使用iBitter-SCM在线软件预测其是否为苦味肽,使用A11erTOP[20]在线软件预测其致敏性。AdmetSAR[21]在线系统,通过研究藏羊血红蛋白肽的人体肠道吸收(human intestinal absorption,HIA)、血脑屏障(blood-brain barrier,BBB)、细胞色素P450超家族(cytochrome P450 proteins, CYP)代谢和急性口服毒性对活性肽进行筛选。
1.5 分子对接
使用Chemdraw2D软件画出多肽结构,Chemdraw3D构建3D结构作为小分子配体,并对其进行能量优化,从PDB蛋白质数据库获取Keap1蛋白的天然晶体结构(PDB ID:2flu)的3D结构,通过Pymol软件删除水分子、氢原子及原有受体所携带的配体,使用Autodock vina软件进行分子对接,基于dock评分值总共定义了100种构象,选择表现出最小结合能(结合自由能=最终分子间能量+最终总内能+扭转自由能-未结合系统能量)的构象用于模型开发。通过Discovery studio(DS)V2020软件进行可视化处理,以确定藏羊血红蛋白肽的抗氧化作用和结合模式。
1.6 活性验证
1.6.1 抗氧化能力测定
采用体外抗氧化模型对模拟酶解的肽段进行抗氧化能力测定。以维生素C和L-还原型谷胱甘肽(glutathione,L-GSH)为阳性对照,分别配制不同浓度的多肽样品和维生素C溶液,研究多肽对DPPH自由基和ABTS阳离子自由基的清除能力。
1.6.1.1 DPPH自由基清除能力测定
参考文献方法[22],略有修改。配制浓度为2 mmol/L 的DPPH乙醇溶液,避光存储。取不同浓度的多肽溶液、维生素C溶液或L-GSH溶液100 μL至96孔板中,加入DPPH储备液100 μL混合室温条件下避光反应30 min,在517 nm处检测吸光度。DPPH自由基的清除能力如公式(3)所示:
DPPH自由基清除能力![]()
(3)
式中:A1,待测样品或阳性对照的吸光度;A2,空白吸光度,待测样品或阳性对照与无水乙醇混合反应;A3,对照吸光度,去离子水与DPPH溶液混合反应。
1.6.1.2 ABTS阳离子自由基清除能力测定
将5 mmol/L的ABTS阳离子自由基溶液与7 mmol/L 的K2S2O8溶液混合振荡,在室温下避光放置12 h以稳定自由基,用去离子水稀释至吸光度为0.7±0.02,制备自由基试剂。取不同浓度的多肽溶液、维生素C溶液或L-GSH溶液50 μL于96孔板中,分别加入ABTS阳离子自由基储备液200 μL,混合,避光反应6 min,测量734 nm处的吸光度。ABTS阳离子自由基的清除能力计算如公式(4)所示:
ABTS阳离子自由基清除能力![]()
(4)
式中:A1,待测样品或阳性对照的吸光度;A0,空白吸光度,待测样品或阳性对照与ABTS溶液混合反应。
1.7 数据统计与分析
所有多肽生物活性检测均进行3个重复,其数据以“平均值±标准差”表示。采用SPSS 16.0版本进行统计学分析、Chemdraw、Discovery studio、Graph Pad.Prism 9.0.0.12 1软件进行作图。
2 结果
2.1 藏羊血红蛋白潜在生物活性
根据目前BIOPEP数据库中的信息(截至2024年1月27日,在BIOPEP中收集了4 791个具有生物活性的肽段),在藏羊血红蛋白中发现了25种已知生物活性的片段(图1),其中抗氧化活性、血管紧张素转换酶(angiotensin converting enzyme,ACE)活性、二肽基肽酶Ⅳ(dipeptidyl peptidase-Ⅳ,DPPⅣ)活性的预测肽段占比最高。在生物活性肽的总发生频率方面,5条蛋白链生物活性肽频率均在1.60~1.75。

a-生物活性的片段;b-生物活性频率
图1 藏羊血红蛋白中具有活性的多肽的出现频率
Fig.1 Frequency of occurrence of active peptides in hemoglobin of Tibetan sheep
注:1,ACE抑制剂;2,免疫调节剂;3,阿片类;4,stimulating;5,神经肽;6,调节肽;7,抗癌肽;8,抗氧化肽;9,细菌渗透酶配体;10,抗炎肽;11,降压肽;12,激活泛素介导的蛋白水解;13,二肽基肽酶IV抑制剂;14,葡萄糖苷酶抑制剂;15,二肽基肽酶Ⅲ抑制剂;16,CaMPDE抑制剂;17,肾素抑制剂;18,降血脂肽;19,antiamnestic;20,抗菌肽;21,抗血栓肽;22,PAM 抑制剂;23,亮氨酸转移酶抑制剂;24,xaa-pro 抑制剂;25,乳头蛋白抑制剂。
2.2 藏羊血红蛋白虚拟酶解
使用NCBI数据库查询,得到藏羊血红蛋白链如表2所示。通过对藏羊血红蛋白结构的分析,发现藏羊血红蛋白中含有20种氨基酸(表3),8种必须氨基酸(Leu、Val、Lys、Phe、Ile、Thr、Trp、Met)和婴幼儿必须氨基酸(His)占总氨基酸的比例为44.17%;9种疏水性氨基酸(Gly、Ala、Val、Leu、Ile、Met、Phe、Pro、Trp)占总氨基酸的比例为52.61%;酸性氨基酸(Asp、Glu)占总氨基酸的比例为10.63%,碱性氨基酸(Lys、His、Arg)占总氨基酸的比例为15.09%。这些氨基酸是功能性多肽的重要组成,是抗氧化肽提取的理想原料[23]。
表2 藏羊血红蛋白链
Table 2 Hemoglobin chains of Tibetan sheep

蛋白名称基因名称氨基酸数量氨基酸序列血红蛋白β链HBB145MLTAEEKAAVTGFWGKVKVDEVGAEALGRLLVVYPWTQRFFEHFGDLSNADAVMNNPKVKAHGKKVLDSFSNGMKHLDDLKGTFAQLSELHCDKLHVDPENFRLLGNVLVVVLARHHGNEFTPVLQADFQKVVAGVANALAHKYH血红蛋白β-C链HBBC142MPNKALITGFWSKVKVDEVGAEALGRLLVVYPWTQRFFEHFGDLSTADAVLGNAKVKAHGKKVLDSFSNGVQHLDDLKGTFAQLSELHCDKLHVDPENFRLLGNVLVVVLARHFGKEFTPELQAEFQKVVAGVASALAHRYH
续表2

蛋白名称基因名称氨基酸数量氨基酸序列血红蛋白α-1/2链142MVLSAADKSNVKAAWGKVGGNAGAYGAEALERMFLSFPTTKTYFPHFDLSHGSAQVKGHGEKVAAALTKAVGHLDDLPGTLSDLSDLHAHKLRVDPVNFKLLSHSLLVTLACHLPNDFTPAVHASLDKFLANVSTVLTSKYR血红蛋白γ链145MLTAEEKASVISLFAKVNVEEVGGEAL-GRLLVVYPWTQRFFEHFGDLSSADAILGNPKVKGHGKKVLNSFSEGLKQLDDLKGAFASLSELHCDKLHVDPENFRLLGNVLVVVLARRFGGEFTPELQANFQKVVTGVANALAHRYH促红细胞生成素EPO194MGARDCTPLLLLLLSFLLFPLGLPVLGAP-PRLICDSRVLERYILEAREAENATMGCAEGCSFSENITVPDTKVNFYAWKRMEVQQQALEVWQGLALLSEAIFRGQALLANASQP-CEALRLHVDKAVSGLRSLTSLLRALGAQKEAIPLPDATPSAAPLRIFTVDALSKLFRIYSNFLRGKLTLYTGEACRRGDR
表3 藏羊血红蛋白氨基酸组成 单位:%
Table 3 Amino acid composition of hemoglobin of Tibetan sheep
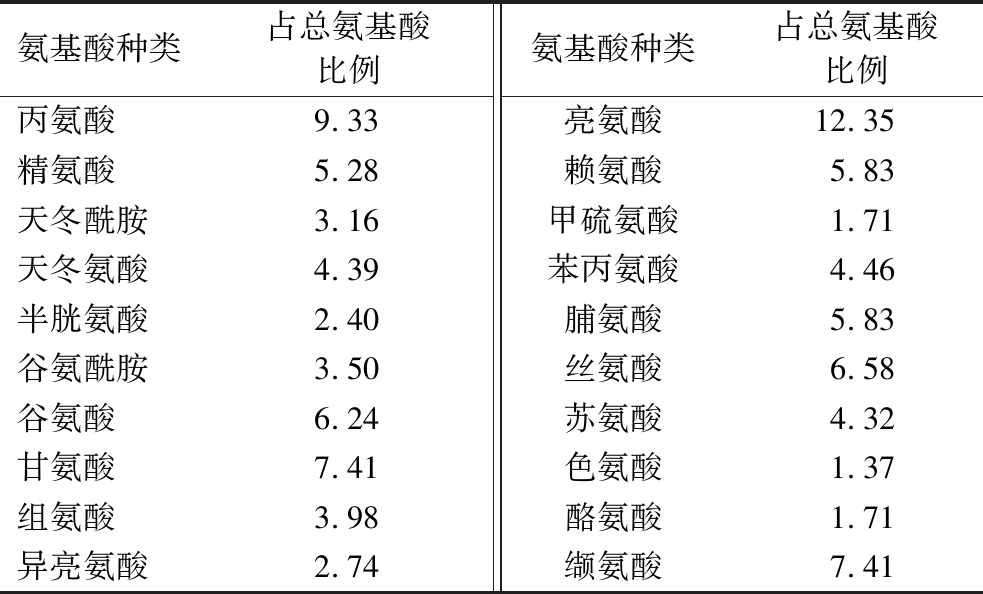
氨基酸种类占总氨基酸比例氨基酸种类占总氨基酸比例丙氨酸9.33亮氨酸12.35精氨酸5.28赖氨酸5.83天冬酰胺3.16甲硫氨酸1.71天冬氨酸4.39苯丙氨酸4.46半胱氨酸2.40脯氨酸5.83谷氨酰胺3.50丝氨酸6.58谷氨酸6.24苏氨酸4.32甘氨酸7.41色氨酸1.37组氨酸3.98酪氨酸1.71异亮氨酸2.74缬氨酸7.41
采用胰蛋白酶、蛋白酶K、胃蛋白酶(pH 1.3,pH>2)、低特异性糜蛋白酶以及高特异性糜蛋白酶,分别对5条藏羊血红蛋白链进行模拟酶解,共得到258种多肽(485条),见表4,经蛋白酶K、胃蛋白酶和低特异性糜蛋白酶酶解,大多数水解物是多肽(2≤肽长度≤5),经计算理论水解度如图2所示,其中蛋白酶K的水解能力最强,达到53.99%,高特异性糜蛋白酶最弱,TDH值为8.18%。
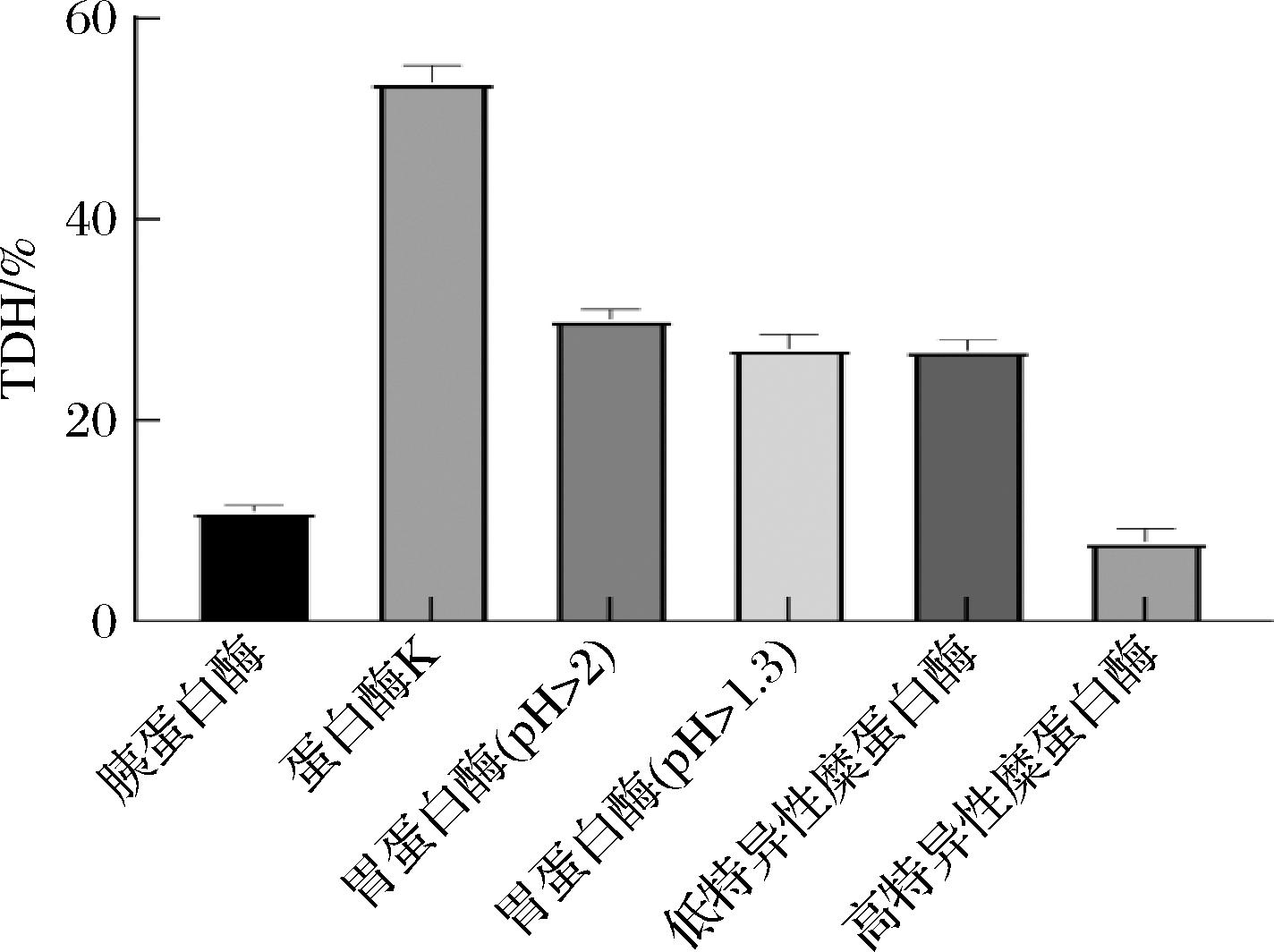
图2 藏羊血红蛋白肽理论水解度
Fig.2 Theoretical hydrolysis degree of hemoglobin peptides in Tibetan sheep
表4 计算机模拟酶解多肽数量
Table 4 The number of enzymatically cleaved peptides by computer simulation
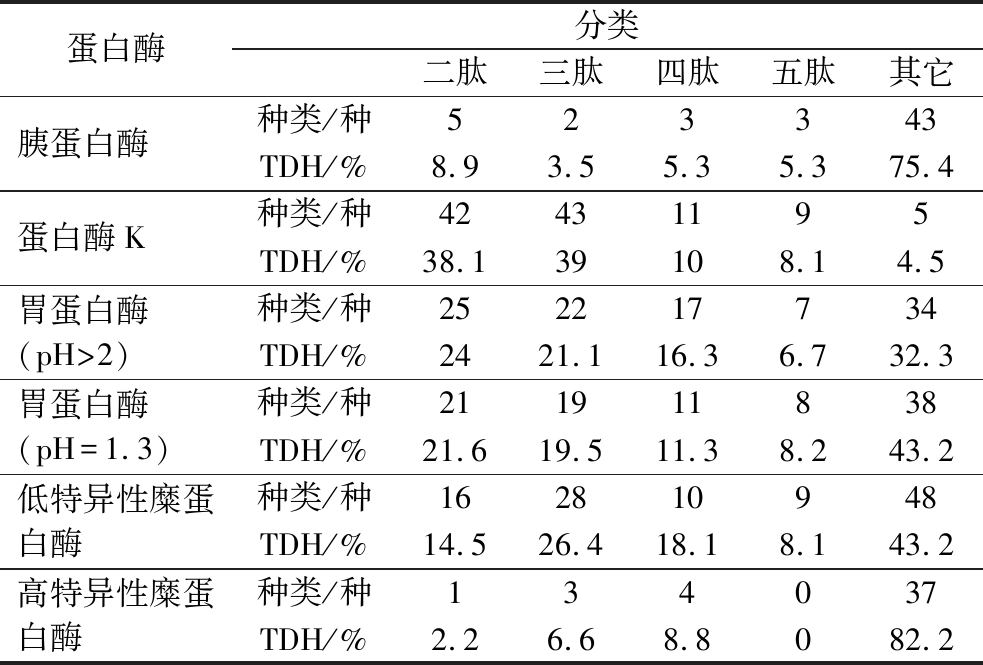
蛋白酶分类二肽三肽四肽五肽其它胰蛋白酶种类/种523343TDH/%8.93.55.35.375.4蛋白酶K种类/种42431195TDH/%38.139108.14.5胃蛋白酶(pH>2)种类/种252217734TDH/%2421.116.36.732.3胃蛋白酶(pH=1.3)种类/种211911838TDH/%21.619.511.38.243.2低特异性糜蛋白酶种类/种162810948TDH/%14.526.418.18.143.2高特异性糜蛋白酶种类/种134037TDH/%2.26.68.8082.2
2.3 藏羊血红蛋白抗氧化肽筛选
2.3.1 活性多肽筛选
将虚拟酶解所得多肽与BIOPEP-UWM中己知的抗氧化肽进行比较后,选取未知的多肽通过在线软件Peptide Ranker进行生物活性的预测,筛选出有潜在生物活性的二肽至八肽,即评分>0.5的肽段,共110种(194条),如表5所示。
表5 具有潜在活性的模拟酶解肽段
Table 5 Simulated enzymatic peptides with potential activity

肽序列酶名称活性评分肽序列酶名称活性评分肽序列酶名称活性评分肽序列酶名称活性评分LFR胰蛋白酶0.939 527KGTF胃蛋白酶(pH>2)0.620 703MGAR胰蛋白酶0.630 475LL胃蛋白酶(pH>2)0.618 551AAWGK胰蛋白酶0.661 786PGT胃蛋白酶(pH>2)0.517 522HFGK胰蛋白酶0.637 746FTPEL胃蛋白酶(pH>2)0.504 811LR胰蛋白酶0.569 984LF胃蛋白酶(pH=1.3)0.986 934YR胰蛋白酶0.525 242GAPPRL胃蛋白酶(pH=1.3)0.879 823GCSF蛋白酶K0.940 312GL胃蛋白酶(pH=1.3)0.808 777PPRL蛋白酶K0.897 469LL胃蛋白酶(pH=1.3)0.618 551MGCA蛋白酶K0.833 642FL胃蛋白酶(pH=1.3)0.989 567PL蛋白酶K0.811 148SF胃蛋白酶(pH=1.3)0.948 796SNF蛋白酶K0.784 613PHF胃蛋白酶(pH=1.3)0.938 016MGA蛋白酶K0.718 967GRL胃蛋白酶(pH=1.3)0.775 024SGL蛋白酶K0.557 028KGAF胃蛋白酶(pH=1.3)0.746 432RY蛋白酶K0.543 741RL胃蛋白酶(pH>2)0.626 352QGL蛋白酶K0.533 495ACHL胃蛋白酶(pH=1.3)0.643 75GF蛋白酶K0.994 712FTPVL胃蛋白酶(pH=1.3)0.643 683PW蛋白酶K0.992 911RL胃蛋白酶(pH=1.3)0.626 352RMF蛋白酶K0.980 292KGTF胃蛋白酶(pH=1.3)0.620 703HF蛋白酶K0.950 971PGT胃蛋白酶(pH=1.3)0.517 522SF蛋白酶K0.948 796FTPEL胃蛋白酶(pH=1.3)0.504 811DF蛋白酶K0.942 412FPL低特异性糜蛋白酶0.979 006NF蛋白酶K0.941 145AW低特异性糜蛋白酶0.966 9RRF蛋白酶K0.939 558SF低特异性糜蛋白酶0.948 796QRF蛋白酶K0.898 112RIF低特异性糜蛋白酶0.881 531ML蛋白酶K0.894 564GAPPRL低特异性糜蛋白酶0.879 823RHF蛋白酶K0.876 772SNF低特异性糜蛋白酶0.784 613PHFDL蛋白酶K0.839 721KRM低特异性糜蛋白酶0.554 33PNDF蛋白酶K0.835 987GLPVL低特异性糜蛋白酶0.545 46GL蛋白酶K0.808 777QGL低特异性糜蛋白酶0.533 495GRL蛋白酶K0.775 024FPH低特异性糜蛋白酶0.940 088YP蛋白酶K0.739 381ARRF低特异性糜蛋白酶0.877 805DSF蛋白酶K0.725 605LPNDF低特异性糜蛋白酶0.782 948NSF蛋白酶K0.686 594GRL低特异性糜蛋白酶0.775 024CHL蛋白酶K0.670 392GGEF低特异性糜蛋白酶0.769 472DKF蛋白酶K0.660 518KGAF低特异性糜蛋白酶0.746 432RL蛋白酶K0.626 352DSF低特异性糜蛋白酶0.725 605GHL蛋白酶K0.588 729NSF低特异性糜蛋白酶0.686 594SNGMKHL蛋白酶K0.567 183ITGF低特异性糜蛋白酶0.667 395GDL蛋白酶K0.546 664DKF低特异性糜蛋白酶0.660 518PA蛋白酶K0.534 47QADF低特异性糜蛋白酶0.638 734GA蛋白酶K0.522 353SNGM低特异性糜蛋白酶0.635 702PGT蛋白酶K0.517 522QANF低特异性糜蛋白酶0.634 832LF胃蛋白酶(pH>2)0.986 934RL低特异性糜蛋白酶0.626 352FRI胃蛋白酶(pH>2)0.897 758KGTF低特异性糜蛋白酶0.620 703GAPPRL胃蛋白酶(pH>2)0.879 823VVYPW低特异性糜蛋白酶0.617 33LGL胃蛋白酶(pH>2)0.652 338TQRF低特异性糜蛋白酶0.582 937FL胃蛋白酶(pH>2)0.989 567ACH低特异性糜蛋白酶0.553 429YF胃蛋白酶(pH>2)0.981 812GDL低特异性糜蛋白酶0.546 664SF胃蛋白酶(pH>2)0.948 796RY低特异性糜蛋白酶0.543 741PHF胃蛋白酶(pH>2)0.938 016GNEF低特异性糜蛋白酶0.521 517WTQRF胃蛋白酶(pH>2)0.863 223AW高特异性糜蛋白酶0.966 9GRL胃蛋白酶(pH>2)0.775 024SNF高特异性糜蛋白酶0.784 613KGAF胃蛋白酶(pH>2)0.746 432FPHF高特异性糜蛋白酶0.987 258ACHL胃蛋白酶(pH>2)0.643 75GGEF高特异性糜蛋白酶0.769 472FTPVL胃蛋白酶(pH>2)0.643 683TQRF高特异性糜蛋白酶0.582 937
2.3.2 水溶性、毒性、苦味和过敏原的预测
利用在线工具Innovagen对筛选的藏羊血红蛋白肽进行溶解性预测。通过ToxinPred在线软件预测其毒性,发现均无毒性。使用iBitter-SCM在线软件预测苦味,发现无苦味肽。通过A11erTOP在线软件预测其致敏性,发现无致敏性。预测结果显示(表6)共有18条溶解性好无毒无苦味且非过敏原的多肽。
表6 虚拟筛选藏羊血红蛋白多肽
Table 6 Virtual screening of hemoglobin peptides from Tibetan sheep
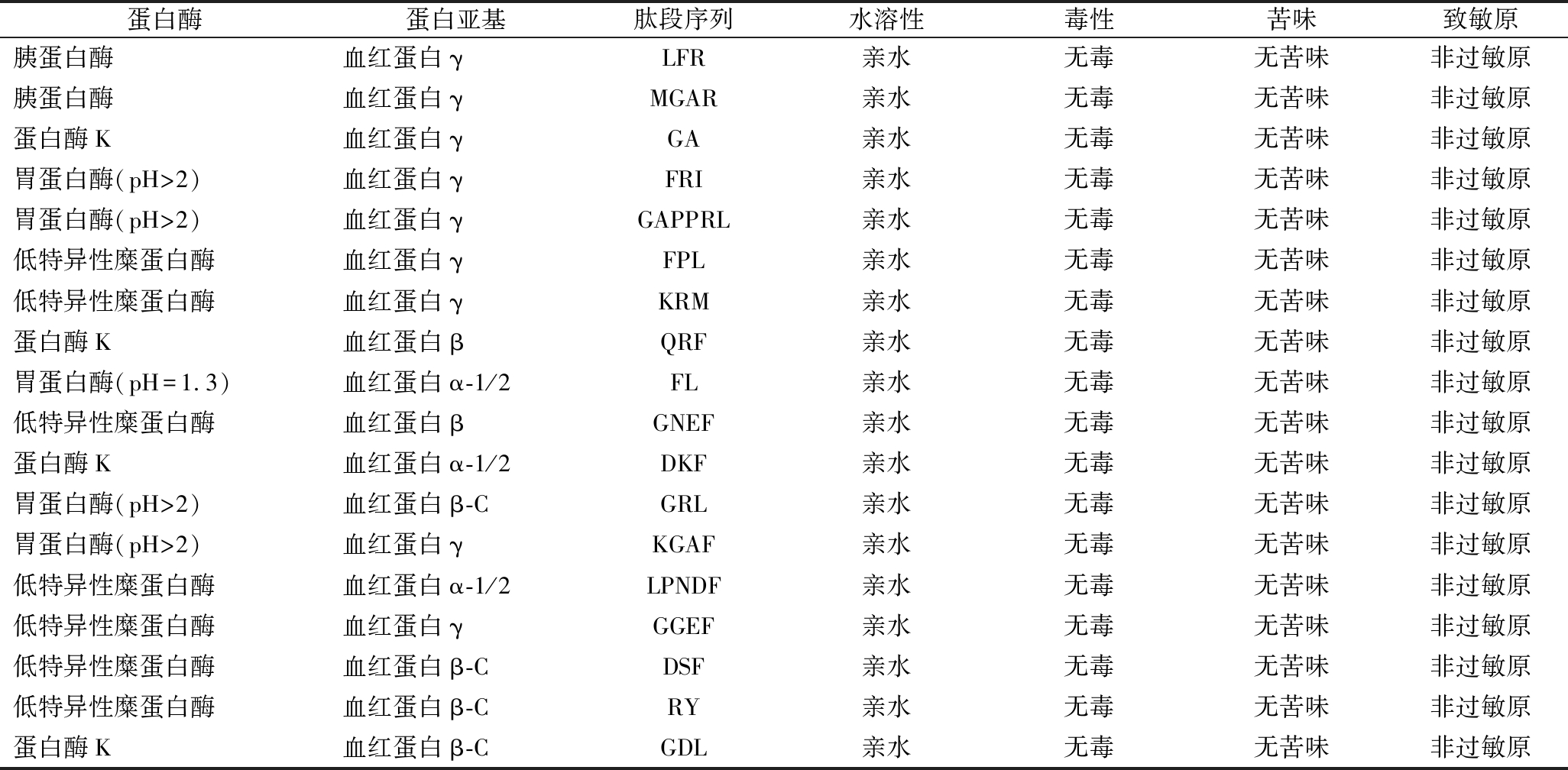
蛋白酶蛋白亚基肽段序列水溶性毒性苦味致敏原胰蛋白酶血红蛋白γLFR亲水无毒无苦味非过敏原胰蛋白酶血红蛋白γMGAR亲水无毒无苦味非过敏原蛋白酶K血红蛋白γGA亲水无毒无苦味非过敏原胃蛋白酶(pH>2)血红蛋白γFRI亲水无毒无苦味非过敏原胃蛋白酶(pH>2)血红蛋白γGAPPRL亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白γFPL亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白γKRM亲水无毒无苦味非过敏原蛋白酶K血红蛋白βQRF亲水无毒无苦味非过敏原胃蛋白酶(pH=1.3)血红蛋白α-1/2FL亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白βGNEF亲水无毒无苦味非过敏原蛋白酶K血红蛋白α-1/2DKF亲水无毒无苦味非过敏原胃蛋白酶(pH>2)血红蛋白β-CGRL亲水无毒无苦味非过敏原胃蛋白酶(pH>2)血红蛋白γKGAF亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白α-1/2LPNDF亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白γGGEF亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白β-CDSF亲水无毒无苦味非过敏原低特异性糜蛋白酶血红蛋白β-CRY亲水无毒无苦味非过敏原蛋白酶K血红蛋白β-CGDL亲水无毒无苦味非过敏原
2.3.3 安全性评价及代谢
将上述18条肽段通过ChemSketch程序获得其简化分子线性SMILES格式(表7),使用AdmetSAR在线系统,分析其HIA、BBB、CYP代谢和急性口服毒性,其中HIA分为肠道吸收好(HIA+)与肠道吸收差(HIA-)之分。我们选择肠道吸收能力相对较好,急性口服毒性低的10种(表8)多肽进行下一步实验。
表7 SMILES格式表
Table 7 Table of SMILES format

多肽SMILESLFR[H]N[C@@H](CC(C)C)C(N[C@H](C(N[C@@H](CCCNC(N)=N)C(O)=O)=O)CC1=CC=CC=C1)=OMGAR[H]N[C@H](C(NCC(N[C@H](C(N[C@@H](CCCNC(N)=N)C(O)=O)=O)C)=O)=O)CCSCGA[H]NCC(N[C@H](C(O)=O)C)=OFRI[H]N[C@H](C(N[C@@H](CCCNC(N)=N)C(N[C@]([C@@H](C)CC)([H])C(O)=O)=O)=O)CC1=CC=CC=C1GAPPRL[H]NCC(N[C@H](C(N1CCC[C@H]1C(N2CCC[C@H]2C(N[C@@H](CCCNC(N)=N)C(N[C@@H](CC(C)C)C(O)=O)=O)=O)=O)=O)C)=OFPL[H]N[C@H](C(N1CCC[C@H]1C(N[C@@H](CC(C)C)C(O)=O)=O)=O)CC2=CC=CC=C2KRM[H]N[C@@H](CCCCN)C(N[C@@H](CCCNC(N)=N)C(N[C@H](C(O)=O)CCSC)=O)=OQRF[H]N[C@@H](CCC(N)=O)C(N[C@@H](CCCNC(N)=N)C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)=OFL[H]N[C@H](C(N[C@@H](CC(C)C)C(O)=O)=O)CC1=CC=CC=C1GNEF[H]NCC(N[C@@H](CC(N)=O)C(N[C@@H](CCC(O)=O)C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)=O)=ODKF[H]N[C@H](C(N[C@@H](CCCCN)C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)=O)CC(O)=OGRL[H]NCC(N[C@@H](CCCNC(N)=N)C(N[C@@H](CC(C)C)C(O)=O)=O)=OKGAF[H]N[C@@H](CCCCN)C(NCC(N[C@H](C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)C)=O)=OLPNDF[H]N[C@@H](CC(C)C)C(N1CCC[C@H]1C(N[C@@H](CC(N)=O)C(N[C@H](C(N[C@H](C(O)=O)CC2=CC=CC=C2)=O)CC(O)=O)=O)=O)=OGGEF[H]NCC(NCC(N[C@@H](CCC(O)=O)C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)=O)=ODSF[H]N[C@H](C(N[C@@H](CO)C(N[C@H](C(O)=O)CC1=CC=CC=C1)=O)=O)CC(O)=ORY[H]N[C@@H](CCCNC(N)=N)C(N[C@H](C(O)=O)CC(C=C1)=CC=C1O)=OGDL[H]NCC(N[C@H](C(N[C@@H](CC(C)C)C(O)=O)=O)CC(O)=O)=O
表8 多肽的ADMET
Table 8 ADMET of peptides

多肽BBBHIACYP4502C9CYP4502D6CYP4503A4口服毒性LFR0.625 6-0.777 9+0.776 50.764 80.644 3(Ⅲ)0.577 5MGAR0.580 8+0.519 3-0.828 40.778 40.637 3(Ⅲ)0.648 5GA0.893 2+0.759 2+0.856 50.832 90.757 5(Ⅲ)0.523 5FRI0.549 7-0.866 7+0.804 80.766 50.702 5(Ⅲ)0.577 5GAPPRL0.961 0-0.535 1-0.859 20.758 90.518 1(Ⅲ)0.635 5
续表8

多肽BBBHIACYP4502C9CYP4502D6CYP4503A4口服毒性FPL0.935 5-0.837 7+0.865 90.791 20.507 7(Ⅲ)0.668 9KRM0.549 3+0.657 4+0.766 40.767 10.714 4(Ⅲ)0.629 2QRF0.765 8+0.533 3-0.808 50.774 30.739 8(Ⅲ)0.573 3FL0.623 8+0.943 8+0.856 90.808 20.710 4(Ⅲ)0.565 4GNEF0.618 6-0.609 8-0.845 50.813 50.732 7(Ⅲ)0.567 1DKF0.544 0+0.707 7-0.845 20.812 60.746 6(Ⅲ)0.582 7GRL0.602 8-0.541 4-0.826 10.781 80.648 7(Ⅲ)0.665 0KGAF0.573 2-0.500 0-0.852 20.829 90.719 2(Ⅲ)0.635 7LPNDF0.990 7-0.688 0+0.839 90.785 70.542 4(Ⅲ)0.625 7GGEF0.529 2+0.547 1-0.885 10.841 30.772 0(Ⅲ)0.647 7DSF0.579 1+0.507 9+0.872 50.854 40.796 6(Ⅲ)0.560 5RY0.612 1+0.616 3+0.793 20.764 90.686 5(Ⅲ)0.620 5GDL0.646 8-0.630 5+0.877 20.798 70.667 1(Ⅲ)0.577 5
注:根据美国EPA的标准,第3类(Ⅲ)包括LD50值>500 mg/kg但<5 000 mg/kg的化合物。
2.4 分子对接评分
目前,越来越多的研究人员正在通过分子对接技术探索天然产物与其生物靶标之间的相互作用。为了进一步筛选藏羊血红蛋白源抗氧化肽,并解释抗氧化肽的在Keap1-Nrf2抗氧化通路的分子机制[24],对肠道吸收较好的10条藏羊血红蛋白肽进行抗氧化活性分子对接分析,以探究天然产物与生物靶标之间的相互作用。其中肽段KRM、FPL、FL与Keap1蛋白受体的最小结合能分别为-6.88、-6.58和-5.91 kcal/mol,相较于其它肽段具有较好的抗氧化活性。通过Discovery Studio 2020 Client进一步分析化合物与Keap1蛋白受体的相互作用模式,显示出了KRM、FPL、FL 3条肽段相互作用的二维和三维结构(图3)。对接结果显示,在Keap1蛋白的结合口袋中,KRM序列与Keap1分子的氨基酸残基Leu557、Leu365、Lie559、Lie416、val606、Val418形成常规氢键,FPL序列与Keap1分子的氨基酸残基Val465、Val467、Val512形成常规氢键,氨基酸残基Val606、Ala607、Ala366形成烷基力、π-烷基力,FL序列与Keap1分子的氨基酸残基Val512、Val465、Val467、Val418形成常规氢键,Ala466形成碳氢化合物键,Val606、Ala366、Val561、Cys513烷基力、π-烷基力,以上14个氨基酸残基是影响Keap1-Nrf2相互作用的关键残基,说明KRM、FPL和FL 3个序列具有在体内发挥抗氧化性的潜力。

图3 KRM、FPL、FL与Keap1活性位点相互作用的3D和2D模式图
Fig.3 3D and 2D patterns of KRM, FPL, and FL interaction with Keap1 active site
2.5 藏羊血红蛋白肽抗氧化能力测定
藏羊血红蛋白肽KRM、FPL、FL在0.039 0~10 mg/mL范围内,藏羊血红蛋白肽对DPPH自由基和ABTS阳离子自由基清除能力与阳性对照维生素C和L-GSH趋势一致,均随浓度升高而增大,其中KRM清除率从60.79%升高到98.78%,FPL清除率从51.66%升高到96.37%,FL清除率从23.18%升高到86.43%(图4-a、图4-b),肽段质量浓度为5 mg/mL时,KRM对DPPH自由基和ABTS阳离子自由基清除能力超过了阳性对照,IC50分别为(0.125 0±0.012 3) mg/mL(图4-c)和(0.339 1±0.031 4) mg/mL(图4-f),FPL对DPPH自由基和ABTS阳离子自由基清除能力也超过了阳性对照,IC50分别为(0.256 5±0.014 1) mg/mL(图4-d)和(0.374 6±0.047 1) mg/mL(图4-g),进一步加大FL浓度,对DPPH自由基和ABTS阳离子自由基清除能力未超过阳性对照,清除能力分别达到了阳性对照的88.90%和94.40%,IC50分别为(1.106 1±0.279 0) mg/mL(图4-e)和(1.601±0.296 0) mg/mL(图4-h)。综上所述,多肽KRM、FPL和FL与分子对接预测结果相一致,具有较强的抗氧化能力。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-KRM DPPH自由基IC50;d-FPL DPPH自由基IC50;e-FL DPPH自由基IC50;f-KRM ABTS阳离子自由基IC50;g-FPL ABTS阳离子自由基IC50;h-FL ABTS阳离子自由基IC50
图4 KRM、FPL、FL抗氧化活性
Fig.4 Antioxidant activity of KRM, FPL, FL
注:C表示肽段KRM、FPL、FL、维生素C和L-GSH的质量浓度。
3 结论
本研究通过虚拟酶解藏羊血红蛋白,通过活性预测软件对多肽进行筛选,并与Keap1受体进行分子对接,通过分子对接评分和作用机理分析预测筛选多肽的抗氧化活性潜力,通过DPPH自由基和ABTS阳离子自由基清除实验对筛选多肽进行功能验证,实验结果表明,5条藏羊血红蛋白链中共含有20种氨基酸,其中蛋白酶K的理论水解度达到了53.99%,6种酶对5条蛋白链进行酶解,共得到258种多肽(485条),通过生物活性评分系统得到110种评分>0.5的多肽(194条),进一步预测活性,得到18种溶解性好、无毒、无苦味且非过敏原的多肽,筛选肠道吸收较好的10条多肽进行分子对接,将分子对接评分前3位的多肽KRM、FPL、FL进行实验验证,体外抗氧化活性实验结果显示,KRM对DPPH自由基和ABTS阳离子自由基清除能力超过了阳性对照,IC50分别为(0.125 0±0.012 3)和(0.339 1±0.031 4) mg/mL,FPL对DPPH自由基和ABTS阳离子自由基清除能力也超过了阳性对照,IC50分别为(0.256 5±0.014 1)和(0.374 6±0.047 1) mg/mL,FL对DPPH自由基和ABTS阳离子自由基清除能力分别达到了阳性对照的88.90%和94.40%,IC50分别为(1.106 1±0.279 0)和(1.601±0.296) mg/mL,均表现出较强的抗氧化活性。本文运用生物信息学工具阐述了如何从藏羊血红蛋白中筛选出抗氧化肽,使试验过程目的性更强、更经济且更高效,且试验验证结果与预测相一致。本文为后续筛选食源性抗氧化肽提供了一定的参考。
[1] 张强, 李伟华.抗氧化肽的研究现状[J].食品与发酵工业, 2021, 47(2):298-304.
ZHANG Q, LI W H.Research progress of antioxidant peptides[J].Food and Fermentation Industries, 2021, 47(2):298-304.
[2] BENEDÉ S, MOLINA E.Chicken egg proteins and derived peptides with antioxidant properties[J].Foods, 2020, 9(6):735.
[3] RIZZELLO C G, TAGLIAZUCCHI D, BABINI E, et al.Bioactive peptides from vegetable food matrices:Research trends and novel biotechnologies for synthesis and recovery[J].Journal of Functional Foods, 2016, 27:549-569.
[4] 刘聪, 尹乐斌, 罗鑫阳, 等.响应面法优化辣椒籽抗氧化肽的酶解制备工艺[J].粮食与油脂, 2024, 37(2):111-115.
LIU C, YIN L B, LUO X Y, et al.Optimization of enzymatic hydrolysis of antioxidant peptides from Capsicum annuum seeds by response surface method[J].Cereals &Oils, 2024, 37(2):111-115.
[5] ZHU B Y, HE H, HOU T.A comprehensive review of corn protein-derived bioactive peptides:Production, characterization, bioactivities, and transport pathways[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(1):329-345.
[6] 陈昶宇, 陈博睿, 赵卿宇, 等.小米多肽酶解工艺及其抗氧化和ACE抑制活性[J].中国食品学报, 2023, 23(12):125-133.
CHEN C Y, CHEN B R, ZHAO Q Y, et al.Enzymatic hydrolysis process of millet polypeptides and its antioxidant and ACE inhibitory activities[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(12):125-133.
[7] YANG J, HUANG J C, ZHU Z S, et al.Investigation of optimal conditions for production of antioxidant peptides from duck blood plasma:Response surface methodology[J].Poultry Science, 2020, 99(12):7159-7168.
[8] ZHENG Z J, SI D Y, AHMAD B, et al.A novel antioxidative peptide derived from chicken blood corpuscle hydrolysate[J].Food Research International, 2018, 106:410-419.
[9] 周成伟, 李芮洋, 李景敏, 等.羊血的开发和利用[J].科技视界, 2019(13):81-82.
ZHOU C W, LI R Y, LI J M, et al.Development and utilization of sheep blood[J].Science &Technology Vision, 2019(13):81-82.
[10] 韩晴, 王维婷, 王守经, 等.羊血亚铁血红素的酶法制备及抗氧化活性研究[J].食品科技, 2023, 48(3):147-154.
HAN Q, WANG W T, WANG S J, et al.Enzymatic preparation and antioxidant activity of ferroheme from sheep blood[J].Food Science and Technology, 2023, 48(3):147-154.
[11] SOUSA R S, MINERVINO A H H, OLIVEIRA F L C, et al.Impact of blood storage duration on hematologic, blood gas, biochemical, and oxidative stress variables in sheep undergoing allogeneic blood transfusions[J].Veterinary Clinical Pathology, 2020, 49(4):545-556.
[12] LE N MADRAZO A, SEGURA CAMPOS M R.In silico prediction of peptide variants from Chia (S.hispanica L.) with antimicrobial, antibiofilm, and antioxidant potential[J].Computational Biology and Chemistry, 2022, 98:107695.
N MADRAZO A, SEGURA CAMPOS M R.In silico prediction of peptide variants from Chia (S.hispanica L.) with antimicrobial, antibiofilm, and antioxidant potential[J].Computational Biology and Chemistry, 2022, 98:107695.
[13] OLSEN T H, YESILTAS B, MARIN F I, et al.AnOxPePred:Using deep learning for the prediction of antioxidative properties of peptides[J].Scientific Reports, 2020, 10(1):21471.
[14] MINNEE H, RACK J G M, VAN DER MAREL G A, et al.Solid-phase synthesis and biological evaluation of peptides ADP-ribosylated at histidine[J].Angewandte Chemie (International Ed), 2024, 63(4):e202313317.
[15] MINKIEWICZ P, IWANIAK A, DAREWICZ M.BIOPEP-UWM database of bioactive peptides:Current opportunities[J].International Journal of Molecular Sciences, 2019, 20(23):5978.
[16] CHEN M D, PAN D D, ZHOU T Q, et al.Novel umami peptide IPIPATKT with dual dipeptidyl peptidase-IV and angiotensin I-converting enzyme inhibitory activities[J].Journal of Agricultural and Food Chemistry, 2021, 69(19):5463-5470.
[17] HU J, ZHOU X Y, CAO Y K, et al.Bioinformatics-based analyses and B/Th cell epitope prediction of mugwort pollen allergen art v 1 protein[J].Journal of Visualized Experiments, 2023:202.
[18] PURCELL D, PACKER M A, HAYES M.Identification of bioactive peptides from a Laminaria digitata protein hydrolysate using in silico and in vitro methods to identify angiotensin-1-converting enzyme (ACE-1) inhibitory peptides[J].Marine Drugs, 2023, 21(2):90.
[19] MARCET I, DELGADO J, D AZ N, et al.Peptides recovery from egg yolk lipovitellins by ultrafiltration and their in silico bioactivity analysis[J].Food Chemistry, 2022, 379:132145.
AZ N, et al.Peptides recovery from egg yolk lipovitellins by ultrafiltration and their in silico bioactivity analysis[J].Food Chemistry, 2022, 379:132145.
[20] NINGRUM A, WARDANI D W, VANIDIA N, et al.In silico approach of glycinin and conglycinin chains of soybean by-product (okara) using papain and bromelain[J].Molecules, 2022, 27(20):6855.
[21] DESALE V J, MALI S N, THORAT B R, et al.Synthesis, admetSAR predictions, DPPH radical scavenging activity, and potent anti-mycobacterial studies of hydrazones of substituted 4-(anilino methyl) benzohydrazides (Part 2)[J].Current Computer-Aided Drug Design, 2021, 17(4):493-503.
[22] PARK Y R, PARK C I, SOH Y.Antioxidant and anti-inflammatory effects of NCW peptide from clam worm (Marphysa sanguinea)[J].Journal of Microbiology and Biotechnology, 2020, 30(9):1387-1394.
[23] ZAKY A A, ABD EL-ATY A M, MA A J, et al.An overview on antioxidant peptides from rice bran proteins:Extraction, identification, and applications[J].Critical Reviews in Food Science and Nutrition, 2022, 62(5):1350-1362.
[24] ZHU L J, MA M H, AHN D U, et al.Hatched eggshell membrane can be a novel source of antioxidant hydrolysates to protect against H2O2-induced oxidative stress in human chondrocytes[J].Antioxidants, 2022, 11(12):2428.