溃疡性结肠炎(ulcerative colitis,UC)是炎症性肠病的一种[1],在不同程度上影响直肠和结肠,UC的临床表现为慢性和复发性腹泻、便血、体重减轻、肠道黏膜屏障损伤等[2-3]。溃疡性结肠炎的患病率与发病率不断增加,已成为一种全球健康负担,并且具有年轻化趋势[4]。研究发现UC患者肠道癌变的风险远高于正常人[5-6]。导致UC的因素除环境、遗传外,还与肠道菌群失衡密切相关[7]。肠道菌群是寄居在人体肠道内的微生物群落,它们在促进消化系统、调节代谢反应以及维护免疫功能等方面发挥着重要的作用。肠道菌群失衡会破坏黏膜屏障,诱导肠道免疫异常,进而造成肠道黏膜损伤[8]。当前治疗UC的药物有5-氨基水杨酸类、免疫抑制剂和局部治疗药物等[9]。这些药物可引起感染、肝功能异常和肾脏毒性等副作用。因此,寻找低毒性又能有效恢复肠道微生物群稳态的天然生物活性成分已成为治疗UC的新途径[10-11]。
刺糖酸性多糖源于药用和食用骆驼刺(Alhagi sparsifolia)中提取分离纯化得到的天然酸性多糖,具有免疫调节、抗氧化、抗炎、抗肿瘤等多种生物活性[12]。最近有研究表明多糖作为益生元在改善小鼠肠道黏膜免疫和调节肠道微生物群方面的潜在作用[13],但是目前关于刺糖酸性多糖在调节肠道微生物方面研究较少,因此,本研究建立3%(质量分数)DSS诱导UC模型,以16S rRNA高通量测序技术分析刺糖酸性多糖对UC小鼠肠道菌群的影响,为探讨刺糖酸性多糖治疗UC的作用机制提供参考。
1 材料与方法
1.1 材料与试剂
葡聚糖硫酸钠(dextran sulphate sodium,DSS),美国MP Biomedicals公司;刺糖药材,新疆麦迪森药业有限公司;美沙拉嗪肠溶片,黑龙江天宏药业股份有限公司;IL-1β、IL-6、IL-10和TNF-α ELISA试剂盒,上海江莱生物科技有限公司;便隐血检测试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
MiSeq PE300型高通量测序仪,美国Illumina公司;NanoDrop2000型超微量分光光度计、Infinite F50 酶标仪,美国赛默飞世尔科技公司;ABI GeneAmp® 9700型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪,美国ABI公司;5424R型高速台式冷冻离心机,德国Eppendorf公司;TE2000-S显微镜,日本NIKON公司。
1.3 实验动物
C57BL/6J雄性小鼠40只,SPF级,体重18.0~22.0 g,新疆医科大学动物实验中心。实验动物生产许可证编号:SCXK(新)2018-0002;实验动物使用许可证编号:SCXK(新)2018-0003。将所有小鼠置于特定的无病原体设施中,环境条件为(23±2) ℃,相对湿度为65%~70%,光照和黑暗周期分别为12 h,自由饮水和基本饮食。所有程序严格遵守中华人民共和国法律和伦理标准,并经新疆医科大学实验动物伦理委员会批准,批准号:IACUC-20210507-3。
1.4 实验方法
1.4.1 刺糖酸性多糖的制备
使用石油醚和95%(体积分数)乙醇回流法去除刺糖中脂溶性化合物和小分子醇溶性物质,剩余的提取物用蒸馏水回流。将得到的提取物浓缩并与95%乙醇溶液混合,达到最终乙醇体积分数为80%。48 h后,将沉淀物过滤收集,冷冻干燥后采用XDA-1型大孔吸附树脂进行脱色和脱蛋白,得到刺糖粗多糖(alhagi-honey polysaccharide,AHP)。然后用DEAE-650M阴离子交换柱(50 mm×50 cm)将AHP溶解于蒸馏水中,洗脱液为0.2 mol/L NaCl溶液,洗脱速度为1 mL/min,每10 mL收集1管。采用苯酚硫酸法在490 nm处追踪检测,浓缩透析,冷冻干燥后得到刺糖酸性多糖(alhagi-honey polysaccharide acid,AHPA)。进一步通过Sephadex G-100凝胶柱(25 mm×100 cm)对AHPA反复洗脱纯化,洗脱液为蒸馏水,洗脱速度为0.5 mL/min,每8 mL收集1管,收集同一洗脱峰的洗脱液,于-80 ℃预冻后冷冻干燥得到精制刺糖酸性多糖粉末。将精制刺糖酸性多糖粉末加水溶解,以苯酚硫酸法测定得到多糖含量为90.66%。
1.4.2 动物分组、造模及给药
将小鼠随机分为对照组、模型组、美沙拉嗪组、刺糖酸性多糖低、高剂量组(L-AHPA、H-AHPA),每组8只。适应性喂养7 d后,对照组小鼠给予去离子水自由饮用,其他组小鼠均给予3% DSS溶液自由饮用,连续7 d诱导UC模型。给药期间,对照组和模型组均灌胃给予去离子水0.2 mL,L-AHPA组、H-AHPA组和美沙拉嗪组分别灌胃给予刺糖酸性多糖(100、400 mg/kg)和美沙拉嗪(100 mg/kg)0.2 mL[14]。
1.4.3 样本采集
实验结束前小鼠禁食过夜,在第8天麻醉后,眼球取血。将血样室温下静置30 min,3 000 r/min离心15 min,得血清,置于-80 ℃冰箱中保存。取血后,通过颈椎脱臼的方式处死小鼠,取结直肠,测量从肛门至回盲瓣的距离,并取结肠中间干净部位于4%(体积分数)多聚甲醛中进行固定,剩余部位置于液氮中保存。收集结肠内容物,培养分析肠道菌群的变化。
1.4.4 疾病活动指数(disease activity index,DAI)评分与体重变化率测定
全面评估刺糖酸性多糖对UC的影响,实验鼠经正式干预后,每日通过对小鼠体质量、粪便黏稠度、便血程度三方面考察小鼠结肠炎症状程度进行评分[15],DAI评分标准如表1所示。
表1 DAI评分标准
Table 1 DAI daiscoring standard
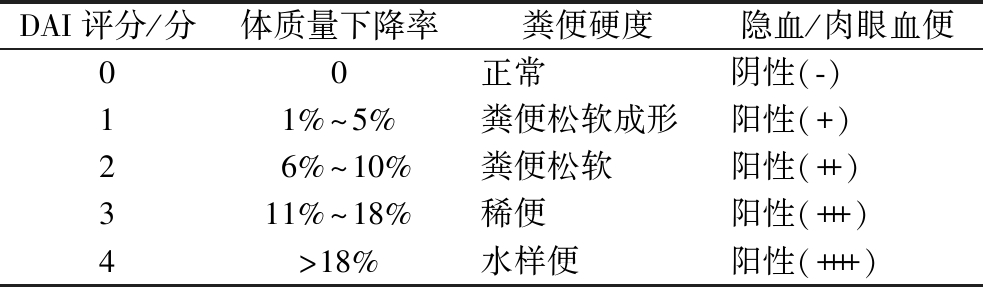
DAI评分/分体质量下降率粪便硬度隐血/肉眼血便00正常阴性(-)11%~5%粪便松软成形阳性(+)26%~10%粪便松软阳性(++)311%~18%稀便阳性(+++)4>18%水样便阳性(++++)
1.4.5 结肠长度测定与结肠组织病理学形态观察
将麻醉处死后的小鼠分离出结肠组织,用预冷的磷酸盐缓冲液进行冲洗,然后用滤纸吸干,测定其结肠长度;取各组小鼠结肠组织0.2 cm的切片,用4%多聚甲醛固定,梯度乙醇溶液进行脱水处理,然后石蜡包埋,将蜡块切成4 μm厚的切片,将结肠组织切片分别用苏木精-伊红染液(hematoxylin-eosin,HE)和阿利新蓝染液(periodic acid schiff and alcian blue,AB-PAS)染色15 min,纯化水洗。之后封固进行保存,最后使用倒置显微镜进行组织病理学观察分析。
1.4.6 小鼠血清炎性因子水平测定
取小鼠血清,按照1∶10(mL∶mL)的比例加入高效裂解液(radio immunoprecipitation assay,RIPA),4 ℃ 条件下孵育1 h。然后用超声匀浆机低温匀浆20 min后,接着4 ℃下以13 000 r/min(离心半径7 cm)离心30 min,取上清液。根据ELISA试剂盒的操作指南,严格按照按照步骤检测小鼠上清液中的IL-1β、IL-6、TNF-α、IL-10含量。
1.4.7 RNA肠道菌群测序分析
按照十六烷基三甲基溴化铵法标准化操作流程将对照组、模型组、H-APHA组(400 mg/kg)小鼠粪便中微生物DNA进行提取,随后使用1%(质量分数)琼脂糖凝胶电泳技术对微生物DNA进行纯度和浓度大小的检测,根据浓度,用无菌水将 DNA 稀释至1 ng/μL,将粪便 DNA 保存于离心管中并置于-80 ℃备用。PCR反应温度程序设定条件为:首先98 ℃的初始变性1 min,然后98 ℃的变性反应10 s,随后50 ℃退火反应持续30 s,最后是72 ℃的延伸反应持续30 s。最终72 ℃终延伸反应5 min。PCR完成后,根据PCR产物的浓度等量混合各样本,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,文库质量合格后,在 Illumina NovaSeq6000 平台上对文库进行测序,按细菌16S rDNA的V3~V4可变测序区域,得到250 bp的末端配对reads。引物序列信息:ACTCCTACGGGAGGCAGCA;GGACTACHVGGGTWTCTAAT。
1.4.8 生物信息学分析
将测序所得的原始数据采用Uparse软件对质控、去噪、拼接、去嵌合体后的数据进行分析,通过将菌群分类单元代表序列与Greengenes数据库比较,得到各样本物种信息。在门(Phylum)、属(Genus)水平上进行不同物种相对丰度分析;通过检查α和β多样性来进行物种丰富度与多样性分析;通过LEfSe线性判别分析(linear discriminant analysis,LDA)得到不同组间具有统计学差异的菌群。
1.4.9 统计学方法
采用SPSS 17.0进行统计分析数据,使用GraphPad Prism 9.0进行绘图,结果以![]() 表示。多组间比较采用单因素方差分析(one-way ANOVA),P<0.05认为差异具有统计学意义。16S rRNA测序数据均使用QIIME2软件、R软件等进行物种组成性分析、α和β多样性分析和LefSe线性判别分析。使用诺米代谢云平台(https://www.biodeep.cn)分析数据。
表示。多组间比较采用单因素方差分析(one-way ANOVA),P<0.05认为差异具有统计学意义。16S rRNA测序数据均使用QIIME2软件、R软件等进行物种组成性分析、α和β多样性分析和LefSe线性判别分析。使用诺米代谢云平台(https://www.biodeep.cn)分析数据。
2 结果与分析
2.1 刺糖酸性多糖对UC小鼠的DAI评分与体质量变化的影响
DSS可以诱导小鼠结肠炎,并导致小鼠体重降低、便血和粪便性状改变[16]。DAI评分可以直接反映DSS诱导的小鼠结肠炎临床症状的严重程度,数值越高则表明症状越严重。如图1所示,与对照组相比,模型组小鼠的DAI评分显著升高,在第5天时体重明显减少,并伴有严重腹泻、便血等症状,差异具有统计学意义(P<0.05)。相反,L-AHPA和H-AHPA组小鼠DAI评分与体重减轻程度均明显低于模型组(P<0.01),部分小鼠有轻度腹泻症状。H-AHPA组与美沙拉嗪组有相似的治疗作用,表明刺糖酸性多糖高剂量可以有效减轻DSS小鼠的结肠炎症状。
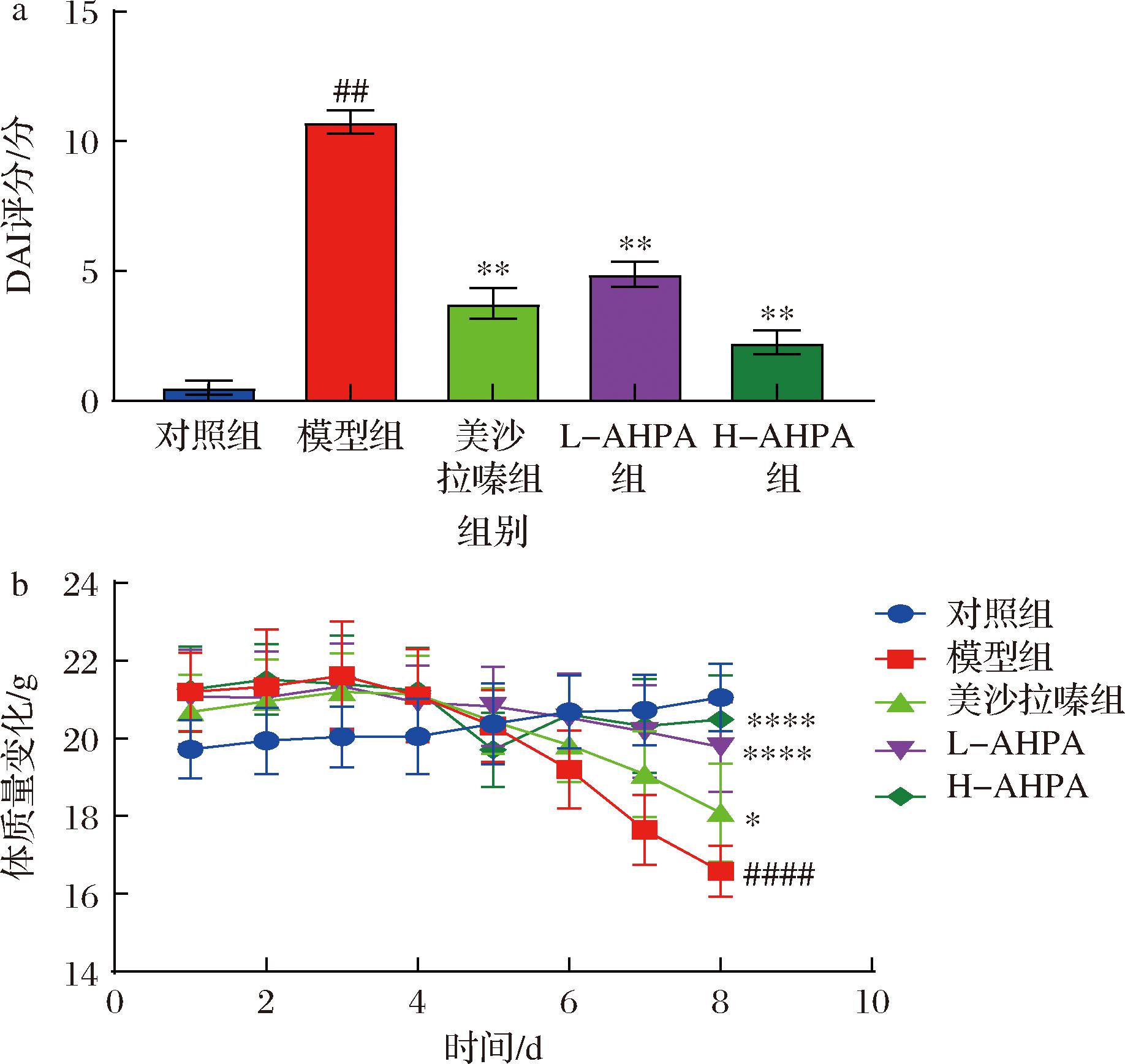
a-DAI评分;b-体质量变化
图1 刺糖酸性多糖对UC小鼠DAI评分和体质量
变化的影响(n=8)
Fig.1 Effects of Alhagi-honey acid polysaccharide on DAI score and body mass in UC mice(n=8)
注:与对照组相比:##P<0.01,####P<0.000 1;与模型组相比:
*P<0.05,**P<0.01,****P<0.000 1(下同)。
2.2 刺糖酸性多糖对UC小鼠的结肠长度与组织病理学的影响
结肠长度的变化可作为评估肠道炎症程度及组织损伤程度的一个指标。在结肠炎模型中,由于炎症反应的发生,结肠黏膜会出现不同程度的缩短或者变形,进而造成结肠整体长度的减少。如图2所示,对照组小鼠结肠平均长度为(8.35±0.54) cm,与对照组相比,模型组小鼠结肠平均长度显著缩短为(4.00±0.48) cm(P<0.001),而给予L-AHPA和H-AHPA治疗后的小鼠,结肠平均长度恢复至(6.54±0.69)、(6.79±0.45) cm,与模型组相比差异具有统计学意义(P<0.01)。以上数据表明刺糖酸性多糖能够在一定程度上改善UC小鼠的疾病状况。
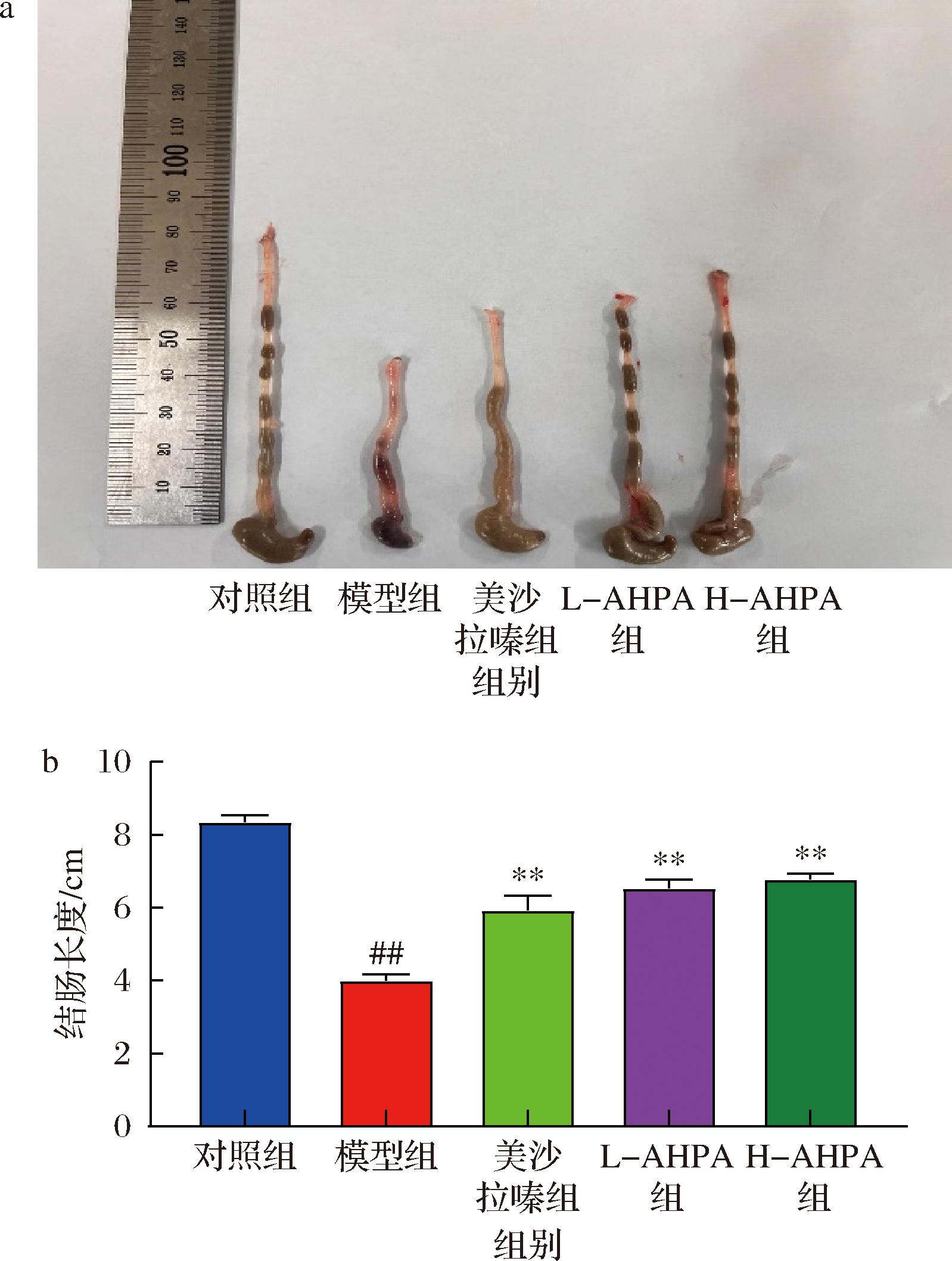
图2 刺糖酸性多糖对UC小鼠结肠长度变化的影响(n=8)
Fig.2 Effects of Alhagi-honey acid polysaccharide on the change of colon length in mice(n=8)
炎性细胞浸润,杯状细胞数量减少均是结肠炎的典型特征之一[17]。如图3-a所示,HE染色对小鼠结肠组织切片分析结果,与对照组相比,模型组小鼠结肠组织损伤严重,表现为黏膜糜烂、隐窝消失、大量炎性细胞浸润;与模型组比较,L-AHPA和H-AHPA组小鼠结肠炎性浸润均明显减少、黏液分泌增加、部分隐窝结构较模型组有所恢复。如图3-b所示,AB-PAS染色结果,与对照组相比,模型组杯状细胞减少,呈现不同形状的萎缩,形成结节状;与模型组相比,L-AHPA和H-AHPA组小鼠结肠组织中杯状细胞的数量均趋于正常,萎缩有所逆转,表明刺糖酸性多糖可以改善UC小鼠的结肠病理组织损,发挥肠道黏膜保护作用。
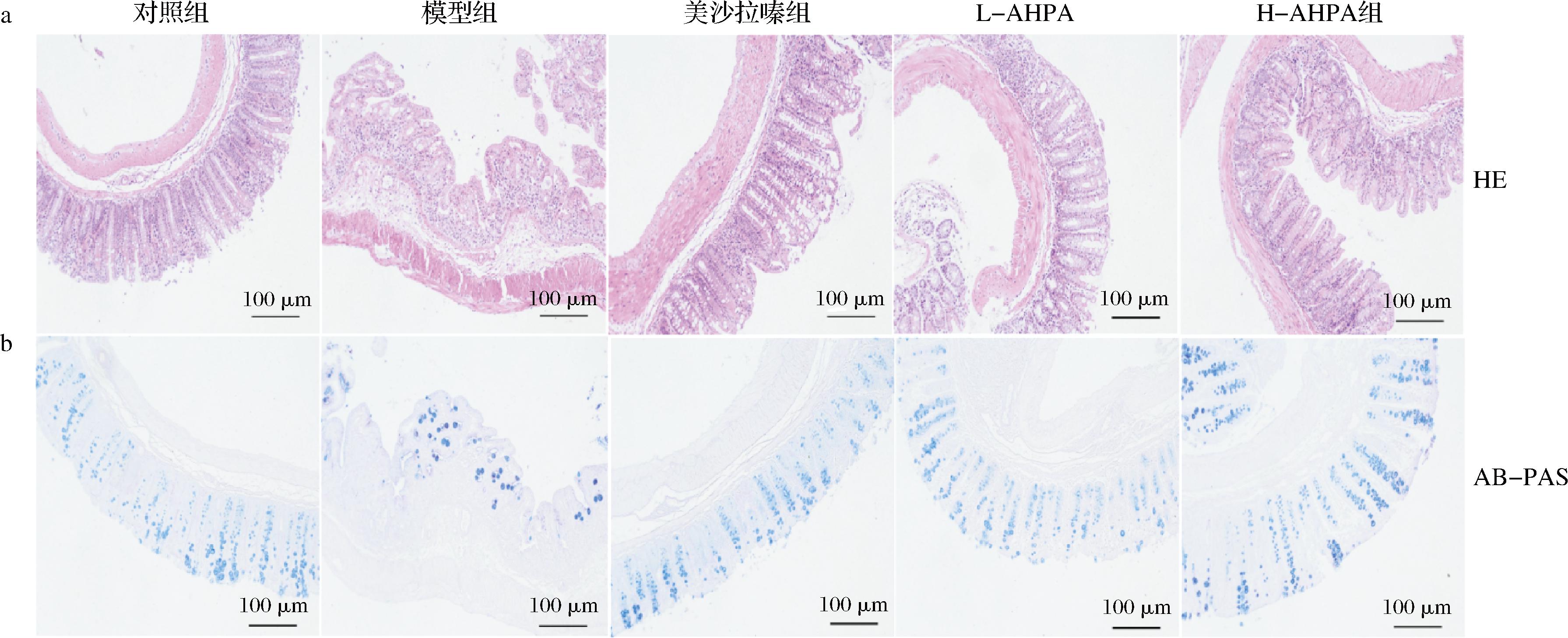
a-HE染色;b-AB-PAS染色(200X)
图3 刺糖酸性多糖对UC小鼠组织病理损伤的影响
Fig.3 Effects of Alhagi-honey acid polysaccharide on histopathological injury of UC mice
2.3 刺糖酸性多糖对UC小鼠血清炎性因子水平的影响
在UC疾病过程中,促炎因子IL-1β、IL-6、TNF-α的升高和抑炎因子IL-10的降低是导致肠黏膜损害及微循环障碍的重要因素[18]。因此,进一步对小鼠结肠内炎症因子IL-1β、IL-6、TNF-α和IL-10的水平进行检测。如图4所示,与对照比较,模型组小鼠结肠内的促炎因子IL-1β、IL-6、TNF-α 水平均有显著提升,而抑炎因子IL-10水平则显著下降(P<0.01);与模型组比较,L-AHPA和H-AHPA组小鼠结肠中IL-1β、IL-6、TNF-α水平均显著降低,同时IL-10水平则显著上升(P<0.05),且H-AHPA组的抑炎水平明显高于L-AHPA组,综上所述,刺糖酸性多糖可以明显降低肠道促炎细胞因子水平以及明显升高抑炎细胞因子水平,从而改善产生炎症反应。
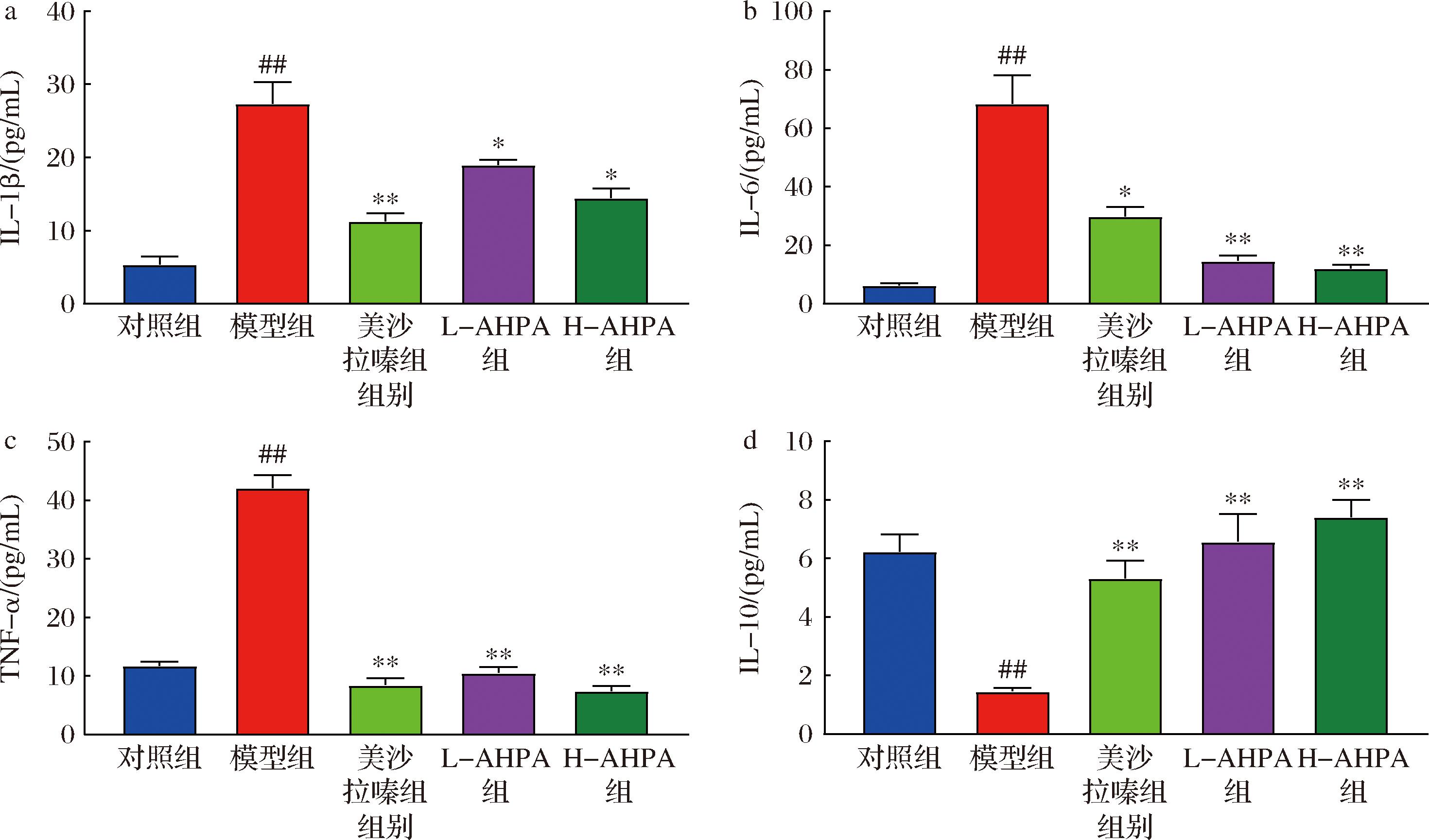
a-IL-1β;b-IL-6;c-TNF-α;d-IL-10
图4 刺糖酸性多糖对UC小鼠血清中IL-1β、IL-6、TNF-α及IL-10的影响(n=8)
Fig.4 Effects of Alhagi-honey acid polysaccharide on IL-1β, IL-6, TNF-α, and IL-10 in serum of UC mice(n=8)
a-α多样性;b-β多样性
图5 刺糖酸性多糖对UC小鼠结肠肠道菌群多样性的影响(n=6)
Fig.5 Effects of Alhagi-honey acid polysaccharide on colon intestinal flora diversity in UC mice(n=6)
2.4 刺糖酸性多糖对UC小鼠肠道菌群的影响
2.4.1 刺糖酸性多糖对UC小鼠肠道菌群多样性的影响
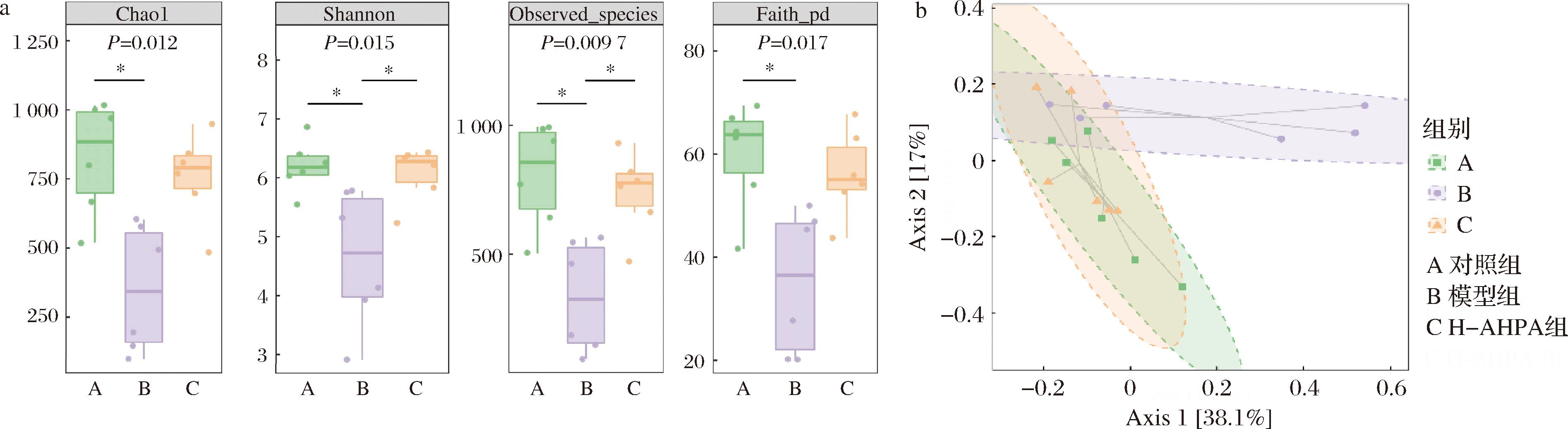
α-多样性是衡量某一特定区域或生态系统内部物种丰富度与多样性的指标,本研究采用Chao1、Shannon、Observed、Faith指数对小鼠肠道菌群Alpha多样性进行分析。如图5-a所示,与对照组比较,模型组小鼠Chao、Shannon、Observed、Faith均显著降低(P<0.05),与模型组比较,H-AHPA组小鼠Observed指数明显升高(P<0.01)。以上结果说明,DSS破坏了小鼠肠道结构,降低了小鼠肠道内微生物菌群的多样性,但刺糖酸性多糖高剂量组有助于恢复小鼠肠道的菌群多样性。
β-多样性主要用于评估并比较不同样本间微生物群落在构成上的差异,进而揭示各样本之间微生物群落的组成特点和变化规律,通常采用主坐标分析(principal coordinates analysis,PCoA)。如图5-b所示,对照组和模型组相互分开,H-AHPA组呈现向对照组聚集的趋势。表明不同组之间微生物群落结构有明显差异,刺糖酸性多糖高剂量组干预使DSS诱导的小鼠肠道菌群结构趋于正常水平。
2.4.2 刺糖酸性多糖对UC小鼠菌群物种组成的影响
门水平上,小鼠肠道菌群主要由以下4个门类构成:拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)以及疣微菌门(Verrucomicrobia),它们合计总占比超过85%。如图6-a所示,与对照组相比,模型组中变形菌门的丰度明显上升,而拟杆菌门和厚壁菌门的丰度则有所下降,与模型组比较,H-AHPA组拟杆菌门和疣微菌门丰度明显增加,变形菌门丰度显著减少。
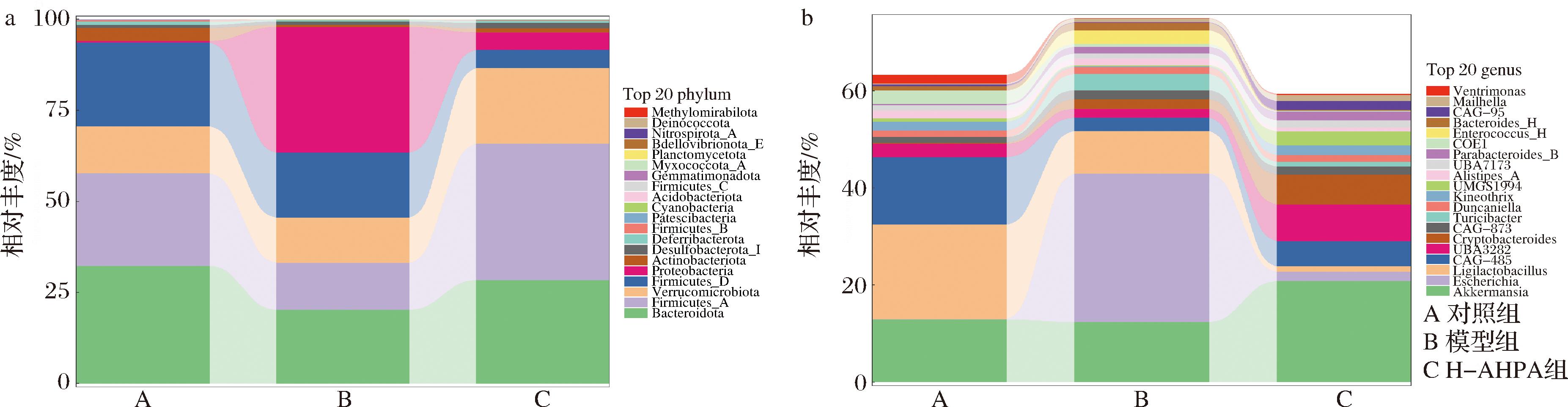
a-门水平;b-属水平
图6 刺糖酸性多糖对UC小鼠结肠肠道菌群结构的影响(n=6)
Fig.6 Effects of Alhagi-honey acid polysaccharide on colon microflora structure in UC mice(n=6)

a-进化分支图;b-LDA值分布柱状图
图7 LefSe线性判别分析图(n=6)
Fig.7 Linear discriminant analysis graphics of LefSe(n=6)
属水平上,小鼠肠道菌群主要由阿克曼菌属(Akkermansia)、埃希氏杆菌属(Escherichia)组成。如图6-b所示,与对照组相比,模型组的埃希氏杆菌属相对丰度增加,阿克曼菌属丰度减少,与模型组比较,H-AHPA组阿克曼菌属明显增加,埃希氏杆菌属显著减少。以上结果表示刺糖酸性多糖高剂量能通过增加有益菌丰度,减少有害菌丰度实现对肠道菌群的调节作用,改善DSS诱导的结肠炎。
2.4.3 刺糖酸性多糖对UC小鼠肠道菌群物种差异的影响
LEfSe线性判别分析能够在不同组间寻找具有统计学差异的生物标志物,从而找到组间具有优势的菌群。如图7所示,对照组、模型组、H-AHPA组分别有37、17、21种关键微生物类群。其中,对照组小鼠肠道菌群差异物种主要属于拟杆菌门(Coriobacteriia、Eggerthellaceae),模型组小鼠肠道菌群差异物种主要属于变形菌门(Enterococcaceae)、厚壁菌门(Firmicutes),H-AHPA组小鼠肠道菌群差异物种主要属于拟杆菌门(Cryptobacteroides), 厚壁菌门(UBA3282、UBA932、Faecalibaculum)。结果表明刺糖酸性多糖高剂量对结肠炎小鼠的肠道菌群构成具有一定的调节作用。
3 结果与讨论
刺糖酸性多糖在功能性食品与医药领域中展现出多样化的生物活性特征[19]。有研究表明,天然多糖可以改善DSS诱导的溃疡性结肠炎相关症状,这些症状包括体重减轻、腹泻、结肠缩短、炎症反应、肠道损伤和肠道微生态改变等[20],因此,本研究首先通过3% DSS诱导建立UC模型,探讨刺糖酸性多糖对UC的治疗作用。结果表明模型组小鼠出现了体质量减轻、结肠长度明显缩短、DAI评分升高、大量炎症细胞浸润、肠黏膜坏死等情况。给予刺糖酸性多糖后,UC小鼠的上述症状均明显好转,表明刺糖酸性多糖在治疗DSS诱导的结肠炎方面具有治疗潜力。促炎因子(IL-1β、IL-6、TNF-α)和抑炎因子(IL-10)在结肠炎的发生发展中起关键作用[21],并直接影响UC的发病机制[22]。基于此,本文采用ELISA法进一步评估小鼠血清中这些细胞因子的水平。结果表明,刺糖酸性多糖高剂量组和美沙拉嗪组均可显著减少IL-1β、IL-6、TNF-α的水平,同时增加了抗炎因子IL-10的水平,从而抑制结肠炎症。
越来越多证据表明,肠道菌群紊乱在UC的发生发展中,发挥着重要的作用[23]。目前已发现各种通过干预肠道菌群来治疗UC的方法,如益生元疗法、粪便移植等[24]。本研究发现,模型组小鼠Chao1、Shannon、Observed、Faith指数均下降,并且PCoA分析结果也显示,模型组样本直线距离较远,表明微生物群落组成存在很大的差异,说明UC小鼠肠道菌群结构紊乱、肠道微生物多样性下降。刺糖酸性多糖高剂量干预后,以上结果均明显逆转。说明刺糖酸性多糖能够改善小鼠的肠道菌群结构,提高肠道菌群的多样性。在门水平上,Bacteroidetes参与人体肠道中的多种代谢活动并且能够在肠道中与Treg细胞结合,促进抗炎因子的分泌[25];Proteobacteria均为革兰氏阴性菌,其中大部分为条件致病菌,如幽门螺旋杆菌等,与肠道炎症密切相关[26]。实验结果表明,模型组小鼠Bacteroidetes相对丰度减少,Proteobacteria相对丰度增加,刺糖酸性多糖高剂量可以逆转这种变化趋势,促进有益菌的生长,抑制幽门螺旋杆菌等有害菌的产生。在属水平上,Akkermansia是一种肠道有益菌,能够补充外膜蛋白Amuc_1100从而减少肠道中的炎症水平,预防肠癌的发生[27]。Escherichia可引起肠道感染及肠道外感染,使肠屏障功能减弱,导致严重的腹泻和肠道炎症[28]。通过差异性分析可知,与模型组比较,刺糖酸性多糖高剂量组的Akkermansia/Escherichia比例显著上升,表明刺糖酸性多糖能够通过增加有益菌丰度,有效调节肠道生态失衡,改善肠道屏障。
综上所述,刺糖酸性多糖可以有效减轻结肠炎小鼠的症状,降低促炎因子和升高抑炎因子的水平。同时,通过提高肠道微生物的多样性、相对丰度,以及Bacteroidetes、Akkermansia等肠道优势菌群的比例,促进有益菌的生长,减少有害菌的丰度,进而减轻UC小鼠肠道菌群紊乱,降低肠道黏膜炎症,增加肠屏障与肠道免疫功能。本研究为刺糖酸性多糖在食品保健的开发与UC临床有效治疗的研究中提供了借鉴意义。
[1] SINHA A, LI Y, MIRZAEI M K, et al.Transplantation of bacteriophages from ulcerative colitis patients shifts the gut bacteriome and exacerbates the severity of DSS colitis[J].Microbiome, 2022, 10(1):105.
[2] ZHU Y F, YANG S H, ZHAO N, et al.CXCL8 chemokine in ulcerative colitis[J].Biomedicine &Pharmacotherapy, 2021, 138:111427.
[3] QUAGLIO A E V, GRILLO T G, DE OLIVEIRA E C S, et al.Gut microbiota, inflammatory bowel disease and colorectal cancer[J].World Journal of Gastroenterology, 2022, 28(30):4053-4060.
[4] LE BERRE C, HONAP S, PEYRIN-BIROULET L.Ulcerative colitis[J].The Lancet, 2023, 402(10401):571-584.
[5] FEUERSTEIN J D, CHEIFETZ A S.Ulcerative colitis epidemiology, diagnosis, and management[J].Mayo Clinic Proceedings, 2014, 89(11):1553-1563.
[6] SEGAL J P, LEBLANC J F, HART A L.Ulcerative colitis:An update[J]. Clinical Medicine, 2021, 21(2):135-139.
[7] WU Y, RAN L, YANG Y, et al.Deferasirox alleviates DSS-induced ulcerative colitis in mice by inhibiting ferroptosis and improving intestinal microbiota[J].Life Sciences, 2023, 314:121312.
[8] 吴军城, 赵立国, 张立文.灯盏花乙素调节AMPK/SIRT1/PGC-1ɑ信号通路对溃疡性结肠炎大鼠肠道菌群的影响[J].中国病原生物学杂志, 2024, 19(1):36-41.
WU J C, ZHAO L G, ZHANG L W.Regulatory effect of Scutellarin B on the gut microbiota of ulcerative colitis rats by regulating AMPK/SIRT1/PGC-1ɑ signaling pathway[J].Journal of Pathogen Biology, 2024, 19(1):36-41.
[9] LIU E, ASLAM N, NIGAM G, et al.Tofacitinib and newer JAK inhibitors in inflammatory bowel disease-where we are and where we are going[J].Drugs in Context, 2022, 11:2021-2011-4.
[10] 徐锋,朱磊,李亚楠,等.基于肠道菌群及代谢组学探讨白芷多糖对溃疡性结肠炎小鼠的治疗及其作用机制[J].中国中药杂志,2025,50(4):896-907.
XU F, ZHU L, LI Y N, et al.Study on the therapeutic effect of Angelica polysaccharide on ulcerative colitis mice based on intestinal flora and metabolomics[J].Chinese Journal of Traditional Chinese Medicine,2025,50(4):896-907.
[11] 李蓉, 杨萍, 李明鉴, 等.发酵枸杞多糖通过调节肠道微生态缓解葡聚糖硫酸钠诱导的溃疡性结肠炎[J].中国药科大学学报, 2024, 55(2):236-245.
LI R, YANG P, LI M J, et al.Amelioration of dextran sulfate sodium-induced ulcerative colitis by fermented Lycium barbarum polysaccharides through modulation of intestinal microecology[J].Journal of China Pharmaceutical University, 2024, 55(2):236-245.
[12] 赵津, 李改茹, 郑杰, 等.维药刺糖抗氧化活性多糖筛选研究[J].新疆医科大学学报, 2015, 38(12):1479-1481.
ZHAO J, LI G R, ZHENG J, et al.Screening of antioxidant activities polysaccharides from Saccharum Alhagi[J].Journal of Xinjiang Medical University, 2015, 38(12):1479-1481.
[13] CAI G F, WUSIMAN A, GU P F, et al.Supplementation of Alhagi honey polysaccharides contributes to the improvement of the intestinal immunity regulating the structure of intestinal flora in mice[J].Food &Function, 2021, 12(20):9693-9707.
[14] 文雨薇, 李科, 吕弯弯, 等.黄芪多糖APS-Ⅰ、APS-Ⅱ制备及其对溃疡性结肠炎小鼠抗炎活性[J].中草药, 2024, 55(14):4759-4770.
WEN Y W, LI K, LYU W W, et al.Preparation of Astragalus polysaccharides APS-Ⅰ and APS-Ⅱ and their anti-inflammatory activity in mice with ulcerative colitis[J].Chinese Traditional and Herbal Drugs, 2024, 55(14):4759-4770.
[15] OH S Y, CHO K A, KANG J L, et al.Comparison of experimental mouse models of inflammatory bowel disease[J].International Journal of Molecular Medicine, 2014, 33(2):333-340.
[16] CHEN Y R, ZHANG P, CHEN W R, et al.Ferroptosis mediated DSS-induced ulcerative colitis associated with Nrf2/HO-1 signaling pathway[J].Immunology Letters, 2020, 225:9-15.
[17] CHASSAING B, AITKEN J D, MALLESHAPPA M, et al.Dextran sulfate sodium (DSS)-induced colitis in mice[J].Current Protocols in Immunology, 2014, 104:15.25.1-15.2515.25.14.
[18]  TOFILOV
TOFILOV J, LANGERHOLC T, BOTTA C, et al.Cytokine production in vitro and in rat model of colitis in response to Lactobacillus plantarum LS/07[J].Biomedicine &Pharmacotherapy=Biomedecine &Pharmacotherapie, 2017, 94:1176-1185.
J, LANGERHOLC T, BOTTA C, et al.Cytokine production in vitro and in rat model of colitis in response to Lactobacillus plantarum LS/07[J].Biomedicine &Pharmacotherapy=Biomedecine &Pharmacotherapie, 2017, 94:1176-1185.
[19] SONG J Z, CHEN Y Y, LYU Z Y, et al.Structural characterization of a polysaccharide from Alhagi honey and its protective effect against inflammatory bowel disease by modulating gut microbiota dysbiosis[J].International Journal of Biological Macromolecules, 2024, 259(Pt 1):128937.
[20] NIU W, CHEN X Q, XU R L, et al.Polysaccharides from natural resources exhibit great potential in the treatment of ulcerative colitis:A review[J].Carbohydrate Polymers, 2021, 254:117189.
[21] LIANG J, CHEN S X, CHEN J H, et al.Therapeutic roles of polysaccharides from Dendrobium officinale on colitis and its underlying mechanisms[J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides, 2018, 185:159-168.
[22] DU B, ZHU F M, XU B J.An insight into the anti-inflammatory properties of edible and medicinal mushrooms[J].Journal of Functional Foods, 2018,47:334-342.
[23] 胡付豪,刘玉晖,梁新丽,等.基于肠道菌群和炎症因子探讨牛至油对溃疡性结肠炎小鼠的作用[J].中成药,2023,45(4):1294-1300.
HU F H, LIU Y H, LIANG X L, et al.Effect of oregano oil on ulcerative colitis mice based on intestinal flora and inflammatory factors[J].Chinese Traditional Patent Medicine, 2023,45(4):1294-1300.
[24] SHIN W, KIM H J.Intestinal barrier dysfunction orchestrates the onset of inflammatory host-microbiome cross-talk in a human gut inflammation-on-a-chip[J].Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(45):E10539-E10547.
[25] 王晨. 肠道拟杆菌种结构组成对溃疡性结肠炎发展的影响[D].无锡:江南大学, 2021.
WANG C.Effect of intestinal Bacteroides species composition on the development of ulcerative colitis[D].Wuxi: Jiang Nan University, 2021.
[26] SIMPSON C A, DIAZ-ARTECHE C, ELIBY D, et al.The gut microbiota in anxiety and depression-A systematic review[J].Clinical Psychology Review, 2021, 83:101943.
[27] WANG L J, TANG L, FENG Y M, et al.A purified membrane protein from Akkermansia muciniphila or the pasteurised bacterium blunts colitis associated tumourigenesis by modulation of CD8+ T cells in mice[J].Gut, 2020, 69(11):1988-1997.
[28] ZHANG Y C, TAN P, ZHAO Y, et al.Enterotoxigenic Escherichia coli:Intestinal pathogenesis mechanisms and colonization resistance by gut microbiota[J].Gut Microbes, 2022, 14(1):2055943.