龋病是一种发生在牙齿硬组织上的细菌感染性疾病。世界卫生组织报道全球龋齿患病率占疾病总数的1/3[1-2]。龋病是由口腔微生物、宿主、食物和时间相互作用产生,口腔菌群对龋病的发生发展起着重要作用[3-4]。1924年,CLARKE[5]从口腔的龋损组织发现了一种产酸细菌,命名为变异链球菌(Streptococcus mutans)。研究发现,S.mutans是龋齿发生的关键性细菌,能够利用碳水化合物产生大量酸性物质,从而破坏牙釉质[6];同时水解蔗糖产生胞外多糖基质,会促进致龋菌在牙齿表面的黏附和聚集,进一步形成牙菌斑生物被膜,导致龋齿的发病[7]。已有研究证明,降低口腔微环境中S.mutans的数量或生物被膜生成可以减缓龋齿的发展[8]。传统的龋齿治疗方法主要为抗菌剂(如洗必泰、氟化物等)疗法,旨在杀灭口腔中的致龋菌,然而抗菌剂的过度使用造成了口腔微生态紊乱,和一些有益细菌群落的退化[9]。因此,探寻一种有效、安全的龋病治疗策略显得尤为重要。
乳酸菌(lactic acid bacteria, LAB)具有维持宿主微生态平衡、提高免疫和抑制病原菌等生理功能,在肠道内发挥着至关重要的作用。多项研究表明乳酸菌对龋病有积极的防治效果,其防治龋病的机制大致包括抑制致病菌生长、减少生物被膜形成、抑制致病菌定植等,涉及到的种属有唾液联合杆菌、鼠李糖乳酪杆菌、植物乳植杆菌、干酪乳酪杆菌、发酵粘液乳杆菌等[10-11]。其中,鼠李糖乳酪杆菌GG(Lacticaseibacillus rhamnosus GG, LGG)可以定植于口腔粘膜,降低S.mutans数量并抑制其生物被膜形成,减少S.mutans在牙齿表面的吸附[12-13]。同时,临床实验证实LGG能减少儿童龋齿的发病率,降低唾液中S.mutans的检出率[14]。尽管龋病益生菌疗法已成为研究热点,但国内的预防龋齿功能乳酸菌仍相对较少。还需要大量挖掘优秀的本土微生物资源,开发自主知识产权的预防龋齿益生菌。
本研究利用体外抑菌能力评价,筛选得到一株优良抑制S.mutans生长和生物被膜形成的乳酸菌,分析了该菌株的菌体特性。并建立大鼠龋齿模型,进一步验证菌株体内抗龋齿功效,为开发具有预防龋齿功能性产品提供理论依据。
1 材料与方法
1.1 材料与试剂
168株乳酸菌、鼠李糖乳酪杆菌GG(LGG),杭州娃哈哈集团菌种保藏中心,菌株详细信息见增强出版附表1(http://doi.org/10.13995/j.cnki.11-1802/ts.038901);变异链球菌ATCC 25175,中国普通微生物菌种保藏管理中心。SPF级雌性SD大鼠(3周龄,50~60 g),上海斯莱克实验动物有限公司。高糖饲料Diet 2000,南通特洛菲饲料科技有限公司。发酵粘液乳杆菌WHH2483,广东省微生物菌种保藏中心(保藏编号为GDMCC No.63221)。
表1 菌株的自聚集能力、共聚集能力 单位:%
Table 1 Auto-aggregation and co-aggregation ability of LAB strains

菌株自聚率共聚率WHH248339.19±1.65∗∗77.08±1.08∗∗LGG27.56±2.1550.31±1.39
注:与对照组相比,*表示P<0.05;**表示P<0.01,(下同)。
MRS培养基、脑心浸出肉汤(brain heart infusion,BHI)培养基,英国Oxoid生物试剂有限公司;甘露醇氯化钠琼脂培养基(mannitol salt agar,MSA),青岛海博生物科技有限公司;细菌/细胞总DNA提取试剂盒,北京天根生化科技有限公司;亚碲酸钾溶液(10 g/L)、醋酸氯己定溶液(洗必泰,0.2 g/L)、羟磷灰石、结晶紫、EDTA,中国医药集团有限公司;二甲基亚砜(dimethylsulfoxide,DMSO)、氨苄青霉素、链霉素,赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
高压蒸汽灭菌锅,日本SANYO株式会社;Mastercycler® nexus GX2 PCR扩增仪、Eppendorf 5810 R离心机,德国Eppendorf公司;Baker Type B2 SterilGARD III生物安全柜,美国BAKER公司;DNP-111电热恒温培养箱,上海海向仪器的设备厂;DU 800紫外分光光度计,美国Beckman公司;JA2003N电子天平、SevenMulti pH仪,瑞士METTLER TOLEDO公司;OLYMPUS BX61光学显微镜,日本Olympus株式会社。
1.3 实验方法
1.3.1 预防龋齿乳酸菌的体外筛选
1.3.1.1 菌株的活化和菌悬液制备
乳酸菌和S.mutans ATCC 25175分别在MRS和BHI液体培养基中连续活化3代,培养温度37 ℃。取乳酸菌和S.mutans对数生长末期菌液,8 000 r/min离心5 min,收集菌泥,重悬于无菌PBS中(活菌数108 CFU/mL),备用。
1.3.1.2 菌株对S.mutans生长的影响
在SCHWENDICKE等[15]的测定方法上稍作调整。取2 uL乳酸菌悬液(约108 CFU/mL)接种在MRS固体培养基表面,37 ℃培养16 h。取1 mL培养24 h 的S.mutans悬液与100 mL含琼脂(0.07 g/L)的BHI肉汤混合(最终活菌数约为5×107 CFU/mL),倾注于已接种乳酸菌的固体平板上,并将平板在37 ℃下培养48 h,随后用游标卡尺测定抑菌圈直径。空白对照组以PBS代替乳酸菌悬液。阳性对照组为菌株LGG。筛选标准为:R表示抑菌直径;R=0 mm,无抑菌效果;0 mm<R≤6 mm,抑菌效果较弱;6 mm<R≤12 mm,抑菌效果一般;12 mm<R≤17 mm,抑菌效果较好;R>17 mm,抑菌效果强。
1.3.1.3 菌株对S.mutans生物被膜形成量的影响
在黄银等[16]的测定方法上稍作修改。用含蔗糖(20 g/L)的BHI液体培养基调整S.mutans活菌数约为105 CFU/mL,取100 μL/孔加到96孔板中,同时加入10 μL乳酸菌悬液(106 CFU/mL),于37 ℃静置培养24 h。之后用移液枪将上清液吸出,沿孔板壁缓缓加入200 μL PBS洗涤,洗涤3次,自然干燥后,加入50 μL结晶紫溶液(0.5 g/L),室温孵育20 min。弃去结晶紫,用PBS洗涤2次,每孔加入200 μL的DMSO溶液,振荡混匀后于600 nm处测定吸光值。空白对照组以PBS代替乳酸菌悬液。阳性对照组为菌株LGG。每组设置3个平行组,实验3次重复。菌株对S.mutans生物被膜形成量抑制率的计算如公式(1)所示:
生物被膜抑制率![]()
(1)
式中:A1,空白对照组的吸光值;A2,实验组的吸光值。
1.3.2 发酵粘液乳杆菌WHH2483特性研究
1.3.2.1 菌株自聚集和共聚能力的测定
本研究测定乳酸菌的自聚率和共聚率,以评估其在口腔中的定植能力。测定方法参考ZHANG等[17]。
1.3.2.2 菌株对唾液包被的羟基磷灰石黏附能力的分析
唾液包被羟基磷灰石的制备按照张妍等[18]的方法。取2 mL菌株WHH2483过夜培养物离心,将菌体重悬于等体积的无菌PBS中,测量其在600 nm下的吸光度,记为A1。后将5 mg唾液包被的羟基磷灰石加入上述制备的菌悬液中,在37 ℃振荡1 h。振荡结束后在室温静置10 min,取1 mL上清菌液,加入0.1 mL 0.1 mol/L EDTA溶液,混匀后在室温静置1 h。随后在600 nm下测定吸光度,记为A2。以S.mutans作为阳性对照。其计算如公式(2)所示:
黏附率![]()
(2)
式中,A1,样品初始的吸光值;A2,样品处理后的吸光值。
1.3.3 发酵粘液乳杆菌WHH2483对大鼠龋病的预防作用
本动物实验所有程序均按照中国浙江省《浙江省实验动物管理办法》的要求进行。该研究方案由杭州娃哈哈集团有限公司动物管理和伦理委员会讨论通过并批准(批准文号WHH2022062701)。
选择3周龄的雌性SD大鼠(50~60 g)32只。保持环境温度为(21±2) ℃,湿度为30%~70%,12 h光照交替,自由摄食饮水。适应3 d后,随机分为4组,每组8只,为空白对照组、模型组、药物组和WHH2483组。实验期共计56 d,0~3 d为抗生素干扰期,模型组、药物组和WHH2483组大鼠饲喂含抗生素(5 μg/mL氨苄青霉素、200 μg/mL链霉素)的饮用水。4~8 d为S.mutans接种期,模型组、药物组和WHH2483组大鼠的臼齿,用无菌棉签蘸取200 μL S.mutans菌悬液(5×108 CFU/mL)擦拭,统一作用时间。9~56 d为干预期,模型组、药物组和WHH2483组的大鼠用无菌棉签分别对牙齿均匀涂抹200 μL的无菌水、0.02%洗必泰、发酵粘液乳杆菌WHH2483菌悬液(浓度为109 CFU/mL)。涂抹后禁食、禁水0.5 h。实验期间,除空白对照组喂食正常饲料和饮用水外,其他组均饲以致龋饲料Diet 2000和蔗糖浓度50 g/L的饮用水。每周记录大鼠体重和摄食量。在第9、30、56天给大鼠口腔牙齿分别进行第1、2和3次取样,用MSA培养基对大鼠口腔中的变异链球菌计数。
实验结束,麻醉处死大鼠,剔除所有软组织,获取颌骨标本。下颌骨标本用活体Micro-CT影像系统进行X射线扫描成像;以固定阈值将牙釉质与下颌骨分离并计算牙釉质的表面积和体积;采用不同密度羟基磷灰石样品进行校准,计算牙釉质的矿物密度。同时,将下颌骨标本放进装有紫脲酸胺溶液(4 g/L)的容器中避光染色12 h。染色结束取出冲洗晾干,用低速金刚石切割机沿颌骨磨牙牙合面近远中向矢状半切,清洗干燥后在体视显微镜下观察。依据Keyes评分系统对大鼠磨牙的龋坏程度进行记录和评分[19]。
1.3.4 数据处理及分析
数据分析用SPSS 18.0软件,作图用GraphPad Prism软件,两组间的显著性差异采用t检验方法分析,多组数据采用单因素方差分析(One Way ANOVA)中的Tukey检验,测定指标均表示为“平均值±标准差”。实验数据处理过程中将显著性水平定为0.05。
2 结果与分析
2.1 乳酸菌对S.mutans生长的抑制
168株乳酸菌的抑菌结果见增强出版附表1(http://doi.org/10.13995/j.cnki.11-1802/ts.038901),抑菌效果强(对S.mutans抑菌圈直径>17 mm)的菌株结果如图1-a所示。发酵粘液乳杆菌WHH2483的抑菌圈直径为(21.20±1.42) mm,显著高于LGG[(16.70±0.78) mm,图1-b,P<0.05]。干酪乳酪杆菌WHH2162和植物乳植杆菌WHH2499的抑菌圈直径分别为(18.61±1.86) mm、(17.09±0.58) mm,与LGG抑菌效果相当(P>0.05)。因此,选取这3株的乳酸菌用于后续研究。

a-抑菌圈直径;b-菌株WHH2483的抑菌图
图1 乳酸菌对变异链球菌生长的抑制作用
Fig.1 The inhibitory effect of LAB strains on the growth of S.mutans
注:不同小写字母代表各组间具有显著性差异(P<0.05)(下同)。
2.2 乳酸菌对S.mutans生物被膜形成的抑制
结果如图2所示,4株菌对S.mutans生物被膜的形成有不同程度的抑制作用。生物被膜抑制率最高的菌株为发酵粘液乳杆菌WHH2483,达(95.05±3.25)%,显著高于对照LGG(62.44±3.21)%,(P<0.05)和其他2株乳酸菌。
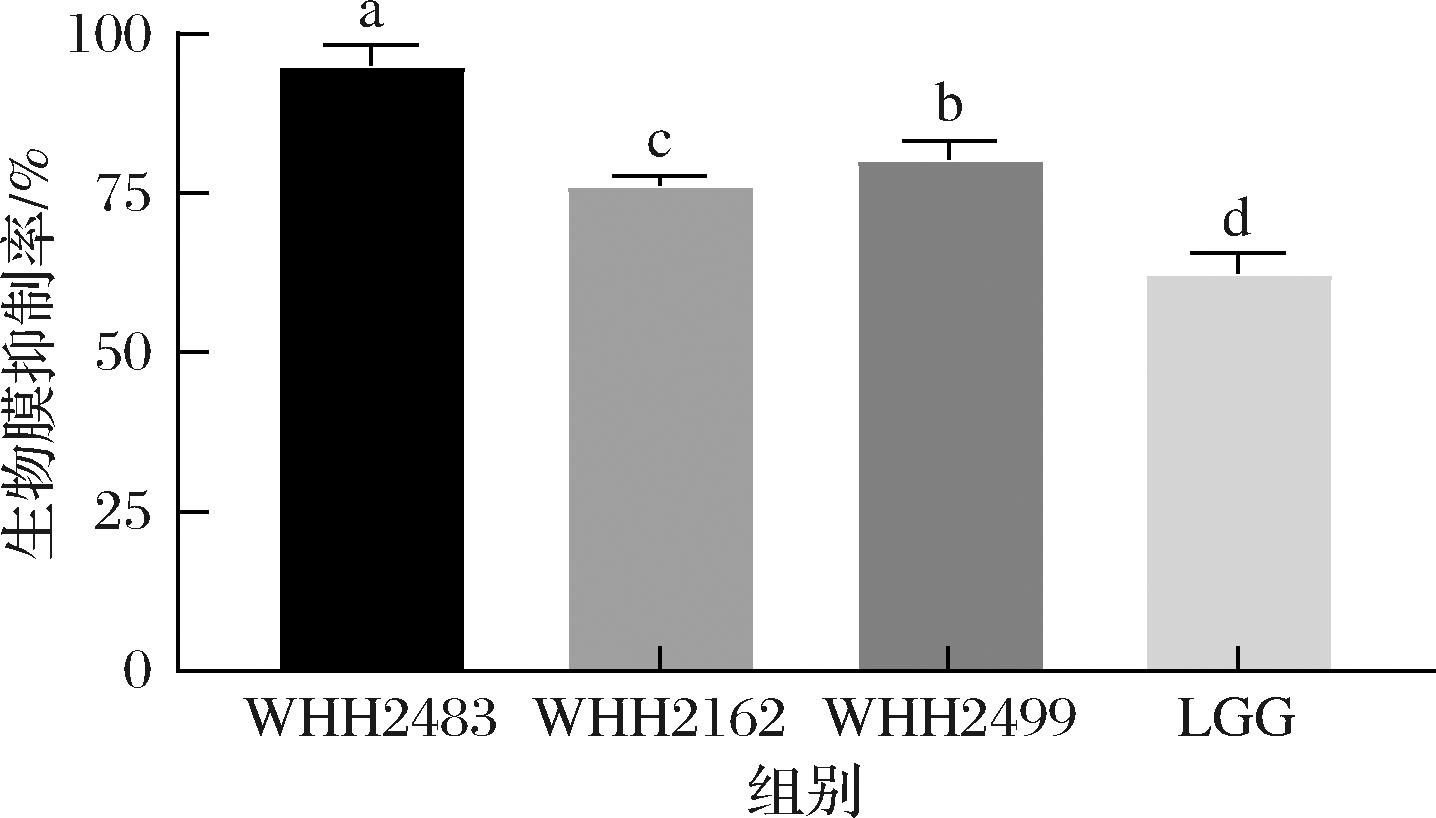
图2 乳酸菌对变异链球菌生物被膜形成的抑制率
Fig.2 Inhibition rate of LAB strains on biofilm formation of S.mutans
2.3 发酵粘液乳杆菌WHH2483基础特性
2.3.1 自聚集和共聚集能力
结果如表1所示,菌株WHH2483的自聚率(39.19±1.65)%和共聚率(77.08±1.08)%,显著高于对照LGG(P<0.01)。表明WHH2483具有优良的自聚集和共聚集能力,在口腔环境中可能定植,并与S.mutans发生相互凝聚,减少口腔中致病菌的数量。
2.3.2 黏附能力
本研究采用唾液包被的羟基磷灰石模拟人体牙齿,考察菌株WHH2483对牙表面的黏附能力。结果如表2所示,菌株WHH2483对羟基磷灰石的黏附率为(20.72±1.20)%,显著低于S.mutans的黏附率(P<0.01)。这说明WHH2483对牙面的黏附性较低,对牙齿酸蚀威胁的可能性较小。
表2 菌株WHH2483对唾液包被的羟基磷灰石的黏附能力
Table 2 Adhesion capacity of strain WHH2483 to saliva-coated hydroxyapatite
菌株WHH2483S.mutans黏附率/%20.72±1.20∗∗69.35±1.56
注:与S. mutans相比,*表示P<0.05;**表示P<0.01。
2.4 发酵粘液乳杆菌WHH2483的预防龋齿功能
2.4.1 大鼠口腔中S.mutans的变化情况
在实验期间,对龋变过程的S.mutans计数,结果如表3所示。
表3 不同时期大鼠口腔取样S.mutans的数量 单位:lg CFU/mL
Table 3 The count of S.mutans in rat dental samples at different periods
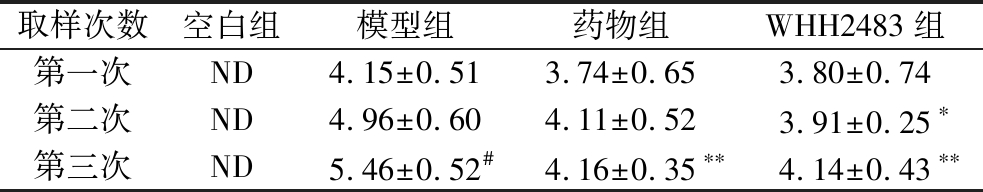
取样次数空白组模型组药物组WHH2483组第一次ND4.15±0.513.74±0.653.80±0.74第二次ND4.96±0.604.11±0.523.91±0.25∗第三次ND5.46±0.52#4.16±0.35∗∗4.14±0.43∗∗
注:与模型组相比,*表示P<0.05;**表示P<0.01,(下同)。各组内与第一次取样相比,#表示P<0.05。ND表示未检出。活菌数检出限为30 CFU/mL。
空白组在全部实验过程中S.mutans未检出,模型组、药物组和WHH2483组大鼠第一次采样的S.mutans数量在3~5 lg CFU/mL,表明S.mutans在各组大鼠口腔成功定植。龋齿模型组大鼠的S.mutans数量随着时间的增加而升高,且第三次采样S.mutans数量显著高于第一次(P<0.05)。药物组大鼠第三次采样的S.mutans数量显著低于模型组(P<0.01)。WHH2483组大鼠第二次和第三次采样的S.mutans数量均显著低于模型组(P<0.05),且3次采样结果之间无显著差异(P>0.05)。表明菌株WHH2483对大鼠龋齿发展过程中S.mutans的增殖具有明显的抑制作用,效果与药物0.02%洗必泰相当。
2.4.2 Micro-CT分析
Micro-CT定量分析了大鼠牙釉质表面积、体积和矿物质密度。釉质表面积、体积和矿物质密度越小,说明釉质流失越多,龋损越严重。与空白对照组相比,龋齿模型组的牙釉质表面积(图3-a)、釉质体积(图3-b)和釉质密度(图3-c)显著降低(P<0.05),说明大鼠龋病模型成功建立。与模型组相比,WHH2483组和药物组的釉质表面积和釉质体积显著增加(P<0.01、P<0.05),药物组的釉质密度无显著差异(P>0.05)。Micro-CT扫描的三维重建图像(图3-d)可见,模型组牙齿破坏严重,牙沟和邻近区域(绿色荧光区域)存在明显的连续性中断及裂纹。而WHH2483组牙釉质连续且规则,未发现明显的釉质裂纹。表明菌株WHH2483能有效减少大鼠牙齿的龋坏程度,阻止龋齿的发展。

a-牙釉质表面积;b-牙釉质体积;c-牙釉质矿物质密度;d-下颌磨牙的三维重建视图
图3 Micro-CT分析结果
Fig.3 Micro-CT analysis results
注:与空白组相比,#表示P<0.05;##表示P<0.01。红色箭头代表龋齿病变部位。
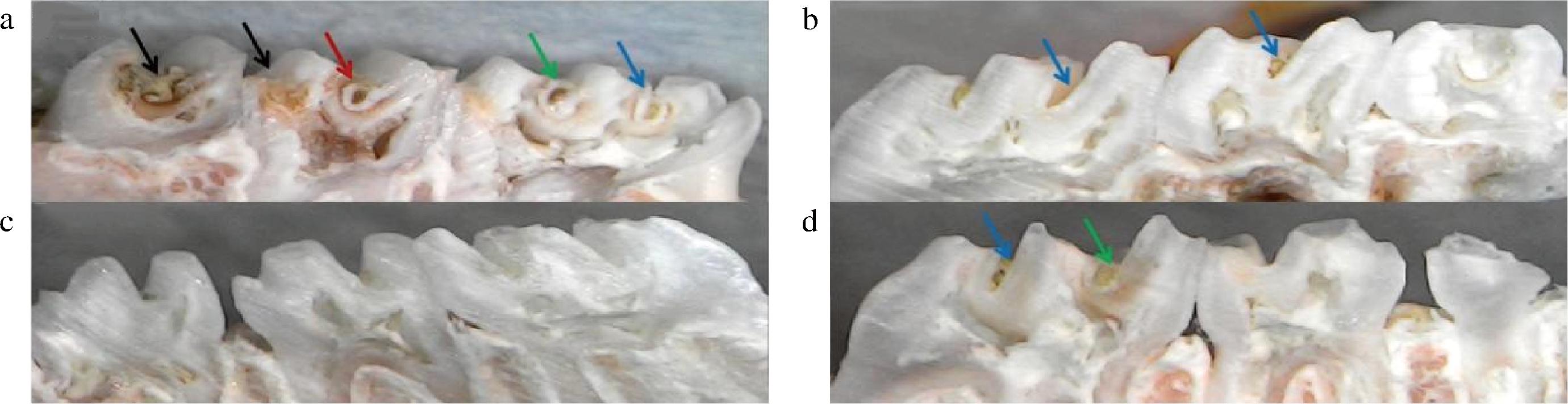
a-模型组;b-WHH2483;c-空白组;d-药物组
图4 体视显微镜下大鼠磨牙矢状切面观察图
Fig.4 Sagittal section observation of rat molars under stereomicroscope
注:蓝色箭头表示E级、绿色箭头表示Ds级、红色箭头表示Dm级、黑色箭头表示Dx级。
2.4.3 大鼠磨牙牙合面龋齿得分
大鼠磨牙牙合面龋损表征见图4,箭头指向为不同程度的龋齿Keyes评分,箭头颜色代表不同龋损程度。可见,空白组无龋损、釉质完整,龋病模型组出现釉质不连续、牙本质损坏等龋损表征,然而在WHH2483组和药物组中存在少量牙釉质损坏的表征。上述结果通过Keyes评分进行统计,结果如表4所示。与模型组相比,WHH2483组的磨牙釉质龋(E级)、牙本质浅龋(Ds级)、牙本质中龋(Dm级)及牙本质深龋(Dx级)显著降低(P<0.05),与药物组无显著差异(P>0.05)。表明菌株WHH2483对大鼠各级龋齿的发生均有较好的抑制作用,效果与药物0.02%洗必泰相当。
表4 大鼠牙齿的Keyes评分
Table 4 Keyes scores of rat teeth
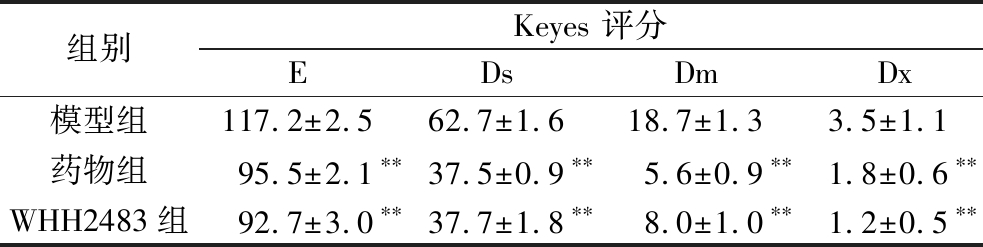
组别Keyes 评分EDsDmDx模型组117.2±2.562.7±1.618.7±1.33.5±1.1药物组95.5±2.1∗∗37.5±0.9∗∗5.6±0.9∗∗1.8±0.6∗∗WHH2483组92.7±3.0∗∗37.7±1.8∗∗8.0±1.0∗∗1.2±0.5∗∗
3 讨论
近年,乳酸菌对人类口腔健康的促进作用受到广泛关注,已成为一种新型的龋齿干预方式。变异链球菌是龋齿的关键性致病菌,牙菌斑生物被膜是龋齿发展的关键因素。因此,口腔益生菌必须具备抑制S.mutans生长及生物被膜形成的能力。本研究选择Lacticaseibacillus rhamnosus GG为阳性对照,从168株乳酸菌中筛选到一株发酵粘液乳杆菌WHH2483,具有显著抑制S.mutans的生长和生物被膜形成能力。类似研究报道,6株乳杆菌对S.mutans的抑菌直径在8.80~14.70 mm[17]。张秋香等[20]发现不同乳酸菌对S.mutans生物被膜的抑制率在13.80%~60.33%。与这些研究结果相比,发酵粘液乳杆菌WHH2483表现出较高的抑菌效果和抑制生物被膜形成能力,显示其具有预防龋齿的巨大潜力。益生菌对S.mutans生长抑制和生物被膜的拮抗作用与其代谢产生的抗菌活性物质密切相关。发酵粘液乳杆菌代谢产生的细菌素对革兰阳性菌具有广谱的抗菌活性,这是其抑制S.mutans的主要抗菌物质[21]。同时,发酵粘液乳杆菌在生长稳定期可以生成生物表面活性剂,已被证明具有降低S.mutans黏附和生物被膜形成的作用[22]。此外,发酵粘液乳杆菌b44可以通过调节S.mutans生物被膜形成中的关键基因表达,发挥抑制生物被膜活性[23]。在本研究中发酵粘液乳杆菌WHH2483表现出优异的抑制S.mutans生长和生物被膜形成的能力。这可能与大量研究所报道的发酵粘液乳杆菌的代谢产物抑菌活性有关,但还需进一步研究菌株抑菌机制。
乳酸菌必须能够在口腔中存活,才能发挥其益生功效。良好的自聚集能力有助于乳酸菌在口腔环境中快速的繁殖与生存。同时,菌株与S.mutans共聚集能力越强,越利于浮游的S.mutans从口腔中去除,从而增加乳酸菌在口腔的定植[24]。本研究的发酵粘液乳杆菌WHH2483的自聚率为(39.19±1.65)%,共聚率为(77.08±1.08)%,表明菌株WHH2483具有良好的口腔定植能力。这与LUAN等[25]所报道的Pediococcus pentosaceus AC1-2研究结果类似。此外,乳酸菌应该对牙面具有较低的黏附能力,这样才能防止菌体自身产酸腐蚀牙齿[26]。本研究的WHH2483的黏附率为(20.72±1.20)%,显著低于S.mutans的黏附率。说明WHH2483菌株酸蚀牙齿的危害性较小,应用于口腔的安全性高。
本研究使用S.mutans感染大鼠口腔,致龋食谱造模,成功建立了发展中的大鼠龋齿模型,利用药物0.02%洗必泰作为阳性对照,验证菌株WHH2483对龋齿的预防效果。在监测大鼠致龋菌数量的过程中,和体外实验结果一致,WHH2483能够明显抑制大鼠口腔中的S.mutans的增殖,将S.mutans数目控制在较低水平。这与CULP等[27]所报道的Streptococcus sanguinis BCC23研究结果类似。对于龋坏程度的判断,先采用无需破坏牙齿整体结构的Micro-CT进行定性和定量分析,发现WHH2483在很大程度上减少龋齿发生造成的牙釉质表面积和体积的缺失,不会影响牙釉质矿物质密度,然而药物0.02%洗必泰的使用明显造成了牙齿矿物质的流失。并且,牙齿扫描三维图像更直观的呈现出,WHH2483能减少牙釉质的损坏,保持牙齿结构的完整性。进一步的,用Keyes评分法评估龋损情况,与Micro-CT结果一致,WHH2483能显著降低大鼠浅表、中部及深层龋齿评分,阻止龋损向更严重的程度发展,效果与药物0.02%洗必泰相当。与本研究结果一致,奚彧等[28]构建大鼠龋齿模型,结果显示益生菌组合物能够有效缓解龋齿的发病率和严重程度。因此,发酵粘液乳杆菌WHH2483在体内表现出优异的预防龋齿效果。
4 结论
本研究从新疆酸奶样品中分离得到一株具有预防龋齿作用的发酵粘液乳杆菌,命名为WHH2483。该菌株的菌体特性优良,具有良好口腔定植能力,且安全性高,产酸腐蚀牙齿的危害性低。同时,该菌株能够有效抑制变异链球菌生长及其生物被膜形成,具有较好的抗龋齿效果。经动物实验验证,该菌株能够抑制大鼠口腔中的变异链球菌的增殖,降低变异链球菌诱导的龋齿发生和加深,有利于口腔牙齿健康,在食品与医药领域具有较高的开发潜力。
[1] PITTS N, DUCKWORTH R M, MARSH P, et al.Post-brushing rinsing for the control of dental caries:Exploration of the available evidence to establish what advice we should give our patients[J].British Dental Journal, 2012, 212(7):315-320.
[2] SIM N-SORO A, MIRA A.Solving the etiology of dental caries[J].Trends in Microbiology, 2015, 23(2):76-82.
N-SORO A, MIRA A.Solving the etiology of dental caries[J].Trends in Microbiology, 2015, 23(2):76-82.
[3] SONG C H, LIU R, KONG B, et al.Functional hydrogels for treatment of dental caries[J].Biomedical Technology, 2024, 5:73-81.
[4] PITTS N B, TWETMAN S, FISHER J, et al.Understanding dental caries as a non-communicable disease[J].British Dental Journal, 2021, 231(12):749-753.
[5] CLARKE J K.On the bacterial factor in the etiology of dental caries[J].British Journal of Haematology, 1924, 5(3):141-147.
[6] COLOMBO A P V, TANNER A C R.The role of bacterial biofilms in dental caries and periodontal and peri-implant diseases:A historical perspective[J].Journal of Dental Research, 2019, 98(4):373-385.
[7] KIM H, HAN C Y, EUN S H, et al.Inhibitory effects of Bacillus velezensis ID-A01 supernatant against Streptococcus mutans[J].BMC Microbiology, 2023, 23(1):362.
[8] ALAM M K, ZHENG L, LIU R R, et al.Synthetic antigen-binding fragments (Fabs) against S.mutans and S.sobrinus inhibit caries formation[J].Scientific Reports, 2018, 8(1):10173.
[9] ANDERSON A C, AL-AHMAD A, SCHLUETER N, et al.Influence of the long-term use of oral hygiene products containing stannous ions on the salivary microbiome-a randomized controlled trial[J].Scientific Reports, 2020, 10(1):9546.
[10] AGARWAL E, BAJAJ P, GURUPRASAD C N, et al.Probiotics:A novel step towards oral health[J].Archives of Oral Sciences and Research, 2011, 1(2):108-115.
[11] YANINE N, ARAYA I, BRIGNARDELLO-PETERSEN R, et al.Effects of probiotics in periodontal diseases:A systematic review[J].Clinical Oral Investigations, 2013, 17(7):1627-1634.
[12] YLI-KNUUTTILA H, SN LL J, KARI K, et al.Colonization of Lactobacillus rhamnosus GG in the oral cavity[J].Oral Microbiology and Immunology, 2006, 21(2):129-131.
LL J, KARI K, et al.Colonization of Lactobacillus rhamnosus GG in the oral cavity[J].Oral Microbiology and Immunology, 2006, 21(2):129-131.
[13] SÖDERLING E M, MARTTINEN A M, HAUKIOJA A L.Probiotic lactobacilli interfere with Streptococcus mutans biofilm formation in vitro[J].Current Microbiology, 2011, 62(2):618-622.
[14] N SE L, HATAKKA K, SAVILAHTI E, et al.Effect of long-term consumption of a probiotic bacterium, Lactobacillus rhamnosus GG, in milk on dental caries and caries risk in children[J].Caries Research, 2001, 35(6):412-420.
SE L, HATAKKA K, SAVILAHTI E, et al.Effect of long-term consumption of a probiotic bacterium, Lactobacillus rhamnosus GG, in milk on dental caries and caries risk in children[J].Caries Research, 2001, 35(6):412-420.
[15] SCHWENDICKE F, KORTE F, DÖRFER C E, et al.Inhibition of Streptococcus mutans growth and biofilm formation by probiotics in vitro[J].Caries Research, 2017, 51(2):87-95.
[16] 黄银. 植物乳杆菌FB-T9对龋病的防治作用研究[D].无锡:江南大学, 2017.
HUANG Y.The prevention and treatment effect of Lactobacillus plantarum FB-T9 on dental caries[D].Wuxi:Jiangnan University, 2017.
[17] ZHANG G J, LU M, LIU R M, et al.Inhibition of Streptococcus mutans biofilm formation and virulence by Lactobacillus plantarum K41 isolated from traditional Sichuan pickles[J].Frontiers in Microbiology, 2020, 11:774.
[18] 张妍. 抗龋齿益生菌性质及其作用机制的研究[D].哈尔滨:东北农业大学, 2019.
ZHANG Y.A study on the properties and mechanism action of anti-caries probiotics[D].Harbin:Northeast Agricultural University, 2019.
[19] KEYES P H, JORDAN H V.Periodontal lesions in the Syrian hamster—Ⅲ findings related to an infectious and transmissible component[J].Archives of Oral Biology, 1964, 9(4):377-IN6.
[20] 张秋香, 黄银, 姚沛琳, 等.植物乳杆菌FB-T9抑制变异链球菌及其生物膜形成的研究[J].食品与生物技术学报, 2019, 38(9):17-26.
ZHANG Q X, HUANG Y, YAO P L, et al.Inhibition of Streptococcus mutans and its biofilm formation by Lactobacillus plantarum FB-T9[J].Journal of Food Science and Biotechnology, 2019, 38(9):17-26.
[21] DE SOUZA RODRIGUES J Z, PASSOS M R, SILVA DE MAC DO NERES N, et al.Antimicrobial activity of Lactobacillus fermentum TcUESC01 against Streptococcus mutans UA159[J].Microbial Pathogenesis, 2020, 142:104063.
DO NERES N, et al.Antimicrobial activity of Lactobacillus fermentum TcUESC01 against Streptococcus mutans UA159[J].Microbial Pathogenesis, 2020, 142:104063.
[22] TAHMOURESPOUR A, SALEHI R, KERMANSHAHI R K, et al.The anti-biofouling effect of Lactobacillus fermentum-derived biosurfactant against Streptococcus mutans[J].Biofouling, 2011, 27(4):385-392.
[23] 余意. 发酵乳杆菌B44抑制变异链球菌生物膜形成机制的初步研究[D].上海:上海海洋大学, 2021.
YU Y.Mechanism of Limosilactobacillus fermentum B44 inhibiting the formation of Streptococcus mutans biofilm[D].Shanghai:Shanghai Ocean University, 2021.
[24] 杨娟, 堵国成, 陈坚, 等.口腔乳酸杆菌的分离及其益生特性[J].微生物学报, 2013, 53(4):403-408.
YANG J, DU G C, CHEN J, et al.Characterization of a probiotic Lactobacillus strain isolated from oral cavity[J].Acta Microbiologica Sinica, 2013, 53(4):403-408.
[25] LUAN C, JIANG N, ZHOU X L, et al.Antibacterial and anti-biofilm activities of probiotic Lactobacillus curvatus BSF206 and Pediococcus pentosaceus AC1-2 against Streptococcus mutans[J].Microbial Pathogenesis, 2022, 164:105446.
[26] LAWS G L, HALE J D F, KEMP R A.Human systemic immune response to ingestion of the oral probiotic Streptococcus salivarius BLIS K12[J].Probiotics and Antimicrobial Proteins, 2021, 13(6):1521-1529.
[27] CULP D J, HULL W, SCHULTZ A C, et al.Testing of candidate probiotics to prevent dental caries induced by Streptococcus mutans in a mouse model[J].Journal of Applied Microbiology, 2022, 132(5):3853-3869.
[28] 奚彧, 董权锋, 张秋香, 等.益生菌组合物对大鼠龋齿的预防作用[J].中国微生态学杂志, 2022, 34(11):1306-1313;1319.
XI Y, DONG Q F, ZHANG Q X, et al.Preventory effect of probiotics combination on rat dental caries[J].Chinese Journal of Microecology, 2022, 34(11):1306-1313;1319.