糖是衡量水果及其发酵制品品质的重要指标。不同水果中可发酵糖的种类和含量存在差异,以葡萄糖、果糖和蔗糖为主[1]。葡萄糖、果糖属于还原糖,低聚糖和多糖可经过酸水解转化为还原糖,葡萄酒等果酒生产和科研中需要实时准确掌握发酵进程,测定还原糖是监控发酵进程的主要手段之一[2]。还原糖测定方法有高效液相色谱法[3]、直接滴定法[4]、间接碘量法[5]、电位滴定法[6]及DNS比色法[7]等。DNS法因操作步骤简单、反应快速、灵敏度高和成本低等优点,常用于监测发酵过程中大批量样品的还原糖或含量。深色果酒酿造中高浓度花色苷干扰DNS比色法还原糖测定的准确性。杨泉女等[8]研究比较DNS法和酶法对甜玉米中还原糖的检测,发现DNS法测定值显著高于酶法,这可能与甜玉米黄色素对水杨酸法的显色干扰有关。活性炭脱色法[9]和交换纤维脱色法[10]已被研究用于排除酒中色素的干扰,但脱色处理会延长检测时间,并可能造成样品风味损失。王欢等[11]测定食醋中还原糖含量时表明DNS法比直接滴定法更为准确可靠,采用活性炭脱色消除色素干扰后发现活性炭同时吸附花色苷、糖等。因此,减少发酵液或酒样中高浓度花色苷的干扰,对应用DNS法快速精准监测深色果酒发酵过程具有重要意义。本研究拟采用PVP脱色、空白对照和样品稀释3种方式改进DNS比色法,以降低花色苷等色素对还原糖检测准确性的干扰。
酿酒酵母还原糖代谢涉及复杂的能量和物质代谢反应,多种酶参与调控。己糖激酶(由HXK基因编码)和葡萄糖激酶(由GLK基因编码)可催化细胞内葡萄糖代谢的第一个不可逆步骤[12]。PFK基因编码的磷酸果糖激酶,将6-磷酸果糖催化为1,6-二磷酸果糖,是糖酵解途径的限速酶[13](图1)。酿酒酵母还原糖代谢相关基因的功能研究相对成熟[14],但发酵过程中还原糖相关基因表达水平的动态变化监测及其与还原糖含量的关联报道较少。本研究以酿酒酵母还原糖代谢起始反应的两个关键酶(己糖激酶和磷酸果糖激酶)的编码基因GLK1、HXK1、HXK2、PFK1、PFK2为对象,利用反转录定量PCR法(quantitative reverse transcription PCR,RT-qPCR)监测5个基因在蓝莓酒发酵过程中的表达水平变化,探索发酵中基因表达量与还原糖含量变化的关联,以期对监测方法的改进和产品质量提升提供理论指导。
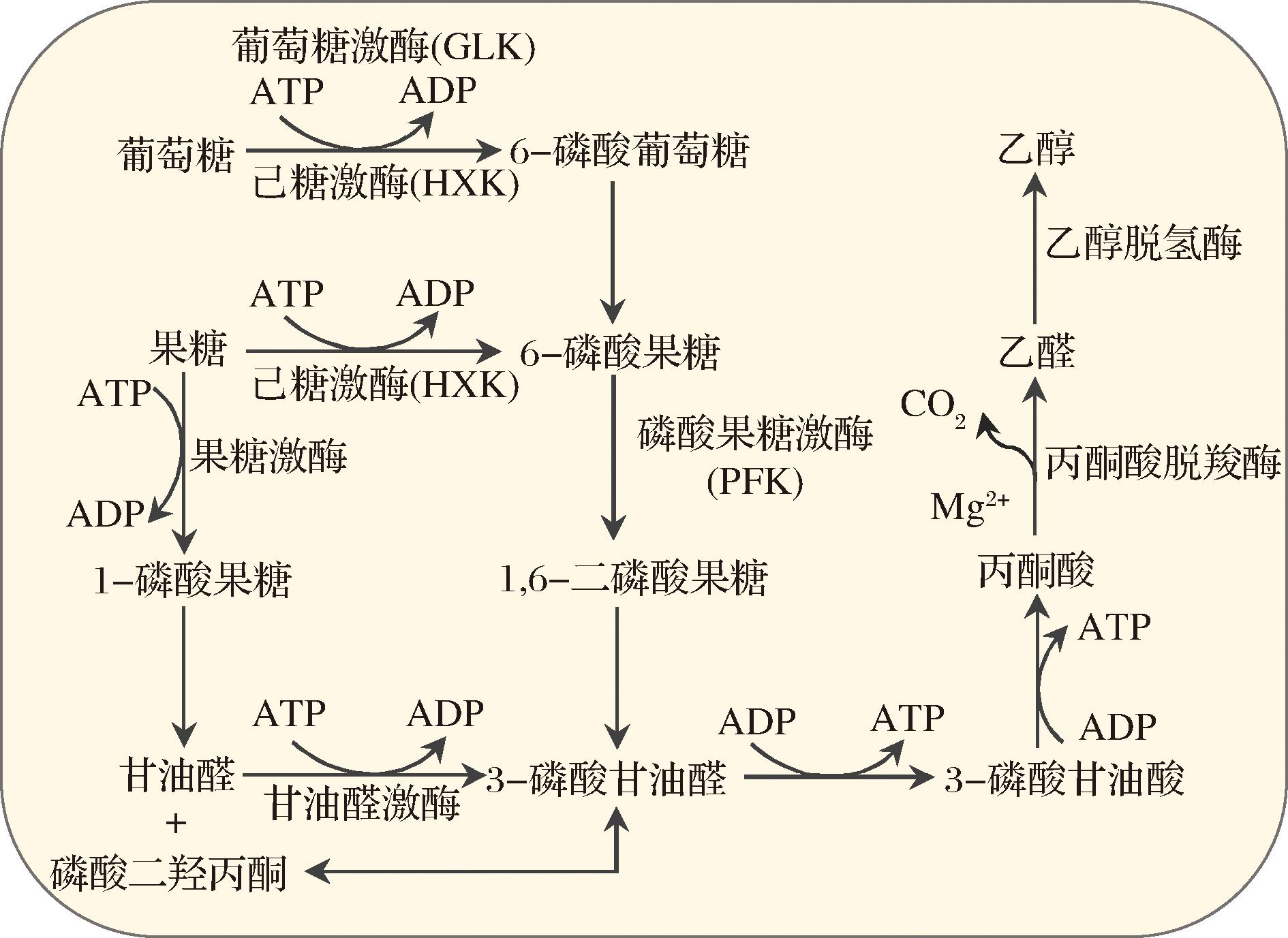
图1 酿酒酵母酒精发酵代谢途径
Fig.1 Metabolism pathway of alcohol fermentation in Saccharomyces cerevisiae
1 材料与方法
1.1 材料与试剂
成品酒1(悠蜜蓝莓精酿):还原糖含量18.25 g/L,酒精度13%vol;成品酒2(长和翡翠马瑟兰干红葡萄酒):还原糖含量3.00 g/L,酒精度14.5%vol。
蓝莓:采集自贵州省丹寨县某蓝莓种植示范基地。
菌种:商业酿酒酵母CECA,购自安琪公司。
RNA iso Plus试剂盒、cDNA合成试剂盒PrimeScriptTM Ⅱ 1 st Strand cDNA Synthesis Kit,北京宝日医生物有限公司。qPCR分析相关试剂,Bio-Rad公司。
DNS、苯酚、NaOH、丙三醇、次甲基蓝、四水合酒石酸钾钠、CuSO4、葡萄糖、果糖等生化试剂均为国产分析纯。
DNS试剂:3.25 g DNS,2 mol/L NaOH 162.5 mL,22.5 g丙三醇,用蒸馏水定容至500 mL,棕色瓶4 ℃恒温放置[2]。
1.2 仪器与设备
Allegra X-30R冷冻离心机,美国Beckman Coulter公司;Multifuge X3R冷冻离心机、Varioskan Flash超微量全波长读数酶标仪,美国Thermo Fisher Scientific公司;CFX Connect Real-time System,美国Bio-Rad公司;AL204电子天平,上海梅特勒-托利多仪器有限公司;SPX-250B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;DK-98-IIA恒温水浴锅,天津泰斯特仪器有限公司。
1.3 方法
1.3.1 无花色苷干扰的DNS比色法
1.3.1.1 还原糖水溶液标准曲线建立
分别准确吸取0、20、40、60、80、100、120、140、160、180和200 μL 的1 mg/mL葡萄糖(果糖或葡萄糖∶果糖=1∶1混合的还原糖)标准溶液置于1.5 mL离心管中,用蒸馏水补足至200 μL,加入150 μL的DNS试剂后混匀,沸水浴中保持5 min,流水冷却至室温,加400 μL蒸馏水,混匀,静置20 min后测量吸光度,检测波长540 nm,建立3种还原糖标准曲线。
1.3.1.2 样品测定方法
准确吸取200 μL待测样品于1.5 mL离心管中,加150 μL DNS,混匀,沸水浴中保持5 min。流水冲冷却至室温,加入蒸馏水400 μL,混匀,静置20 min后测量吸光度,检测波长540 nm。
1.3.2 花色苷对检测的干扰研究
在不同花色苷含量的干红葡萄酒样中添加6种不同浓度葡萄糖标准溶液的稀释液,研究花色苷对DNS法检测的干扰。具体方法是以蒸馏水、干红葡萄酒原样、10倍、100倍和1 000倍干红葡萄酒稀释酒样(稀释酒样记作0.1酒样、0.01酒样和0.001酒样)模拟不同花色苷含量酒样。用蒸馏水分别配制200、150、100、50、10、5 g/L葡萄糖标准溶液以模拟发酵过程中变化的还原糖浓度。将6种糖标准溶液稀释至0.5~1 g/L的标准曲线可检测范围,在10 μL的酒样中添加稀释后的糖标准液90 μL,充分混匀后蒸馏水补足至200 μL,作为待测样品。采用DNS比色法测定还原糖,每个样品设置4个平行。计算加标回收率,通过测量值和加标回收率分析花色苷对还原糖测定的影响。
1.3.3 三种降低花色苷干扰方法的研究
1.3.3.1 PVP脱色法降低花色苷干扰研究
PVP-K30是聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)产品的一种,是性能优良的多酚类物质吸附剂[15]。高花色苷酒样中加入PVP-K30可吸附花色苷等多酚化合物,降低颜色干扰。本研究向蓝莓酒中分别加入20和60 g/L PVP-K30剧烈震荡5 min,采用0.22 μm水相滤膜过滤,使用酶标仪测定滤液OD540nm,通过比对吸光度值评价脱色效果。
1.3.3.2 空白对照法降低花色苷干扰研究
以干红葡萄酒和蓝莓酒作为样品,根据DNS法的显色原理,按表1改变DNS法反应体系中酒样体积、蒸馏水体积、DNS试剂的添加以及沸水浴等因素,从而设置7种不同空白对照,测定OD540nm。通过标准曲线计算同一样品不同空白对照下的还原糖,对比选取最佳空白对照组。
表1 有色酒样还原糖检测的空白对照设计
Table 1 Blank control design for reducing sugar detection in colored wine samples
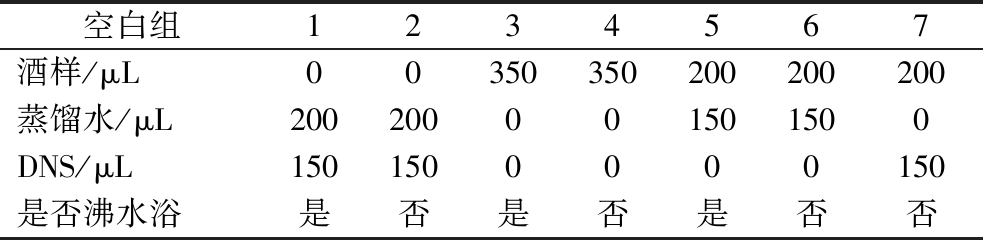
空白组1234567酒样/μL00350350200200200蒸馏水/μL200200001501500DNS/μL1501500000150是否沸水浴是否是否是否否
1.3.3.3 稀释法对还原糖测定准确性的影响研究
准确配制200、150、100、50、10和5 g/L葡萄糖标准溶液和果糖标准溶液,经500倍、400倍、250倍、200倍、100倍、50倍、20倍、10倍、5倍稀释后作为待测样品。采用DNS比色法检测还原糖,每个稀释倍数设置4个平行。比较不同稀释倍数下的测量值,通过理论值与测定值的偏差率分析稀释倍数对还原糖检测准确性的影响。
1.3.4 相关基因表达量分析
1.3.4.1 蓝莓酒发酵
蓝莓破碎成汁,使用葡萄糖调配成还原糖含量为200 g/L待发酵蓝莓汁,分装150 mL于250 mL三角瓶中,以106 cells/mL接种酿酒酵母CECA,无菌纱布加封口膜密封,28 ℃静置发酵,设置4个发酵平行。发酵过程记录CO2生成量,具体方法为:每隔12 h称重发酵瓶,称重前摇匀发酵液使气体逸出。以未接种酿酒酵母但装有同体积蓝莓汁三角瓶作为空白对照,以避免自然挥发带来的失重误差。当24 h净生成量不超过0.2 g时,视为发酵结束。在发酵0(发酵起点)、2、4和8 d(发酵结束)时,取样用于还原糖测定和RNA提取,样品分别命名为LM0、LM1、LM2、LM3。
1.3.4.2 RT-qPCR
按照RNA iso Plus试剂盒所述方法,提取LM0、LM1、LM2、LM3蓝莓发酵酒样中的菌体RNA,对总RNA进行浓度、电泳检测和完整性质量检验,调整浓度一致后使用cDNA合成试剂PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit反转录合成cDNA。本研究采用Primer Premier 5.0设计GLK1、HXK1、HXK2、PFK1、PFK2五个目的基因引物(表2),并通过溶解曲线分析确认引物特异性。目的基因定量分析采用SYBR green 法,通过荧光定量仪Bio-Rad CFX Connect进行,选取PDA1基因为内参基因[16]。反应体系为13 μL,反应流程为:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,循环40次;95 ℃ 10 s,溶解曲线(55~95 ℃,0.5 ℃上升)。5个目的基因表达结果采用2-ΔCt法计算各基因相对于内参基因表达量,采用2-ΔΔCt法计算相对于LM0的基因相对表达倍数变化[16]。
表2 RT-qPCR所用引物序列
Table 2 Primer sequences of RT-qPCR

引物名称引物序列(5′-3′)PDA1-FAATTAGCTGATGCTGCTCCPDA1-RTCCCTAGAGGCAAAACCTTGGLK1-FGTCGGAAAGGATGTCGTGGLK1-RTCCTGTGGCAACTTCGTGHXK1-FAAAGGTTTGACAAAGAAGGGAGHXK1-RTTGGTGCTTAGTGGTTCTCATGHXK2-FTCCGTTTACAACAGATACCCHXK2-RATAACAGCGGCACCAGCAPFK1-FAGCAAGCAAGGGTAAGTTPFK1-RTAGCGTCAGTGTTTGGAGAAPFK2-FAGCCATTCAAGCTAAGGAPFK2-RCGAGTAGACGGCAGAGTT
1.3.5 数据处理与分析
还原糖测量值采用“平均数±标准差”表示,结果准确性比较使用测定值与其理论值之间偏差率(%)及加样回收率(%)表示。
偏差率按公式(1)计算:
偏差率![]()
(1)
回收率按公式(2)计算:
回收率/%=
(2)
式中:加标试样指酒样中加入葡萄糖标准溶液,样品指未加入葡萄糖标液的酒样。
使用统计软件SPSS 23进行显著性差异分析,采用Tukey’s HSD test法进行事后比较,P<0.05视为差异显著。采用Excel 2022、Graphpad Pism 9.5和Origin 2022软件绘制折线图与柱状图,采用MedCalc软件对3条标准曲线进行最小二乘方回归分析及统计检验,采用Spearman等级相关系数方法进行相关性分析,应用ChiPlot网站绘制相关性热图。
2 结果与分析
2.1 还原糖水溶液标准曲线
葡萄糖、果糖和混合还原糖3种标准曲线的吸光度值范围均在0.1~0.7,线性拟合程度良好(图2)。在标准曲线的范围内,同一糖浓度下,3种标曲吸光度值的差异均在5%的置信区间内,表明3种标曲的差异较小。在成熟的葡萄、蓝莓等水果中,可溶性糖的主要成分是葡萄糖和果糖,二者比例接近1∶1(数值在0.81~1.05)[17-19]。酿酒酵母在酒精发酵进程中优先利用葡萄糖,从而使果酒中葡萄糖与果糖的比例发生变化[20]。在标准曲线检测的糖浓度范围内,3种工作标曲的吸光度值差异较小,因此可以忽略代谢导致的变化。本研究最终选择以1∶1混合糖标准曲线作为后续还原糖分析的依据。
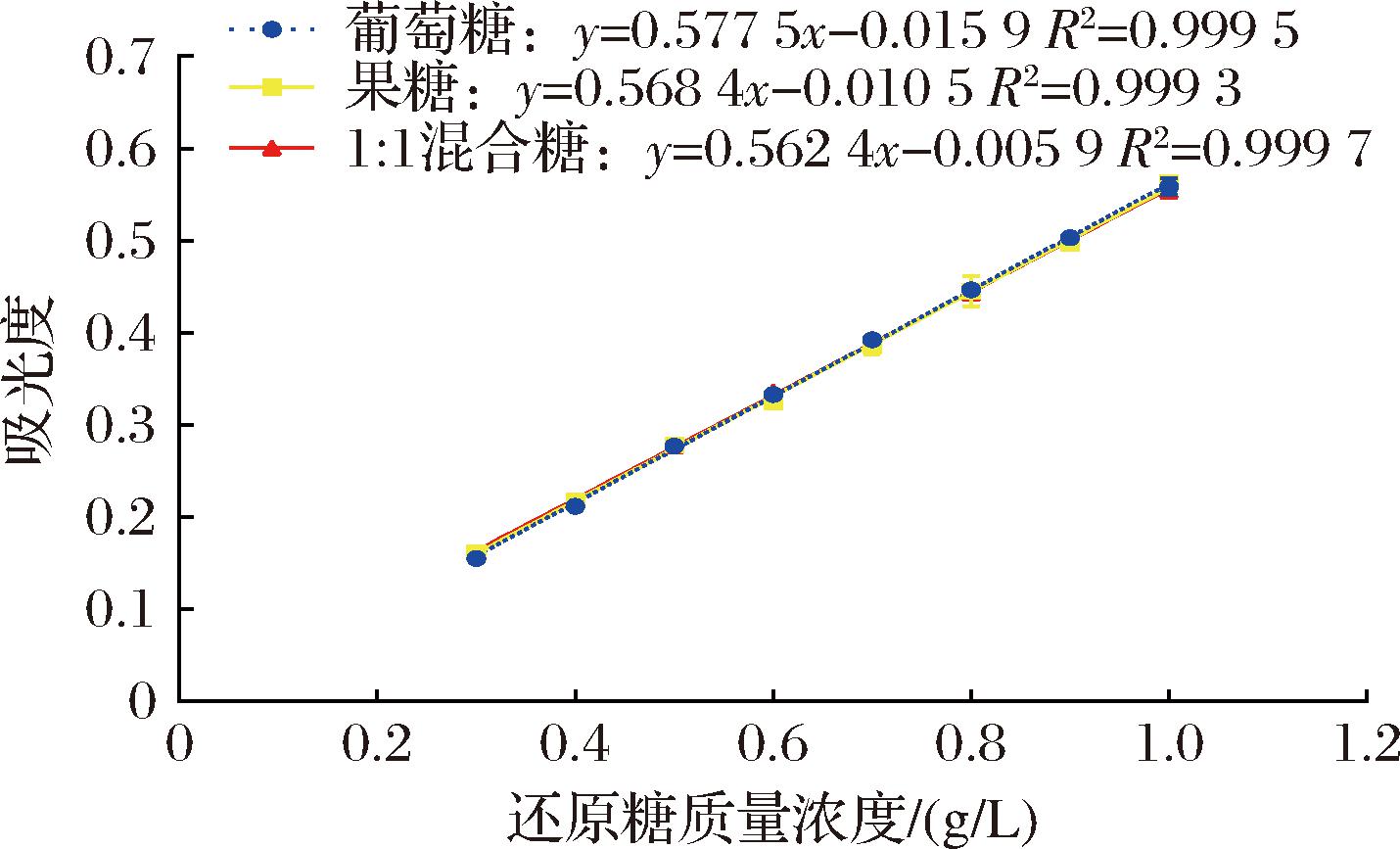
图2 三种DNS法还原糖的标准曲线
Fig.2 Three standard curves of reducing sugar analysis by DNS method
2.2 花色苷对还原糖检测的干扰分析
加标回收率用于评估分析方法的准确性和可靠性。根据GB/T 27404—2008《实验室质量控制规范 食品理化检测》技术要求,被测组分含量>100 mg/kg时,回收率范围95%~105%。6种糖标准液在酒样中的加标回收率变化趋势保持一致(图3)。除5 g/L糖标准溶液以外,蒸馏水空白加标回收率均在95.5%~99.42%,干红葡萄酒原样的加标回收率最大,均超过150%;0.1酒样、0.01酒样、0.001酒样加标回收率趋于平稳,基本在99%~105%。回收率变化表明,酒样中花色苷含量影响还原糖检测准确性,回收率随着酒样中花色苷的稀释减少稳定在95%~105%,此时检测准确性良好。从排除干扰角度,可通过增大深色酒样的稀释倍数来降低花色苷干扰。
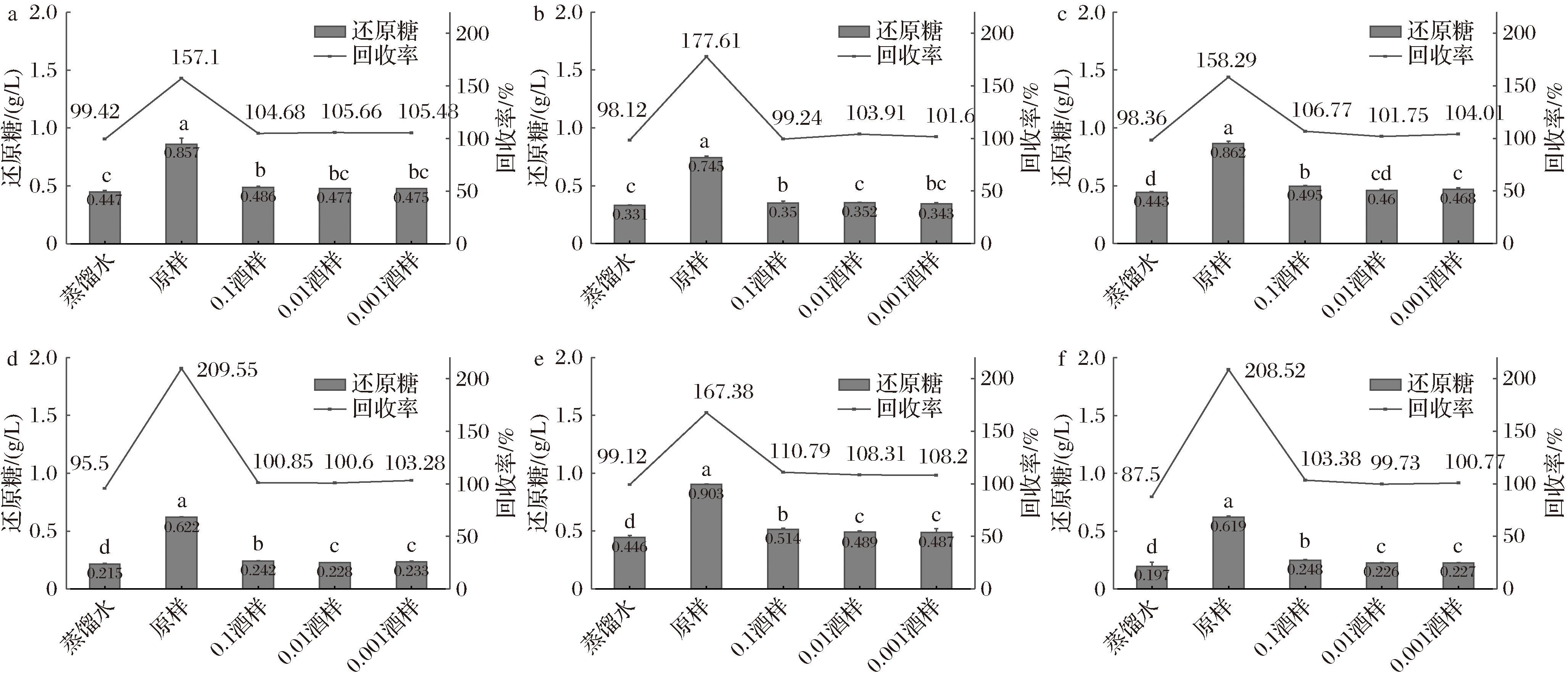
a-200 g/L;b-150 g/L;c-100 g/L;d-50 g/L;e-10 g/L;f-5 g/L
图3 添加6种浓度葡萄糖标准液后试样的加标回收率与还原糖率变化
Fig.3 Spiked recovery rate and reducing sugar rate after adding 6 initial concentrations of glucose standard solutions
注:不同小写字母表示差异显著(P<0.05)(下同)。
对于同一样品,添加6种糖标准溶液的回收率各有不同。如0.1干红葡萄酒样中,添加200、150、50和5 g/L糖标液稀释液的回收率为99%~105%,检测准确性较好;添加100、10 g/L糖标液稀释液的回收率则超过105%。表明除花色苷外,稀释倍数可能影响检测准确性。
2.3 三种降低花色苷干扰方法的分析
2.3.1 PVP脱色效果分析
PVP-K30可与特定多酚化合物(如单宁、花色苷)形成络合物,起到澄清作用[21]。本研究结果表明,PVP-K30具有一定吸附花色苷的作用,未加PVP-K30时OD540nm为0.620 6,加入不同浓度PVP-K30处理后吸光度明显下降,OD540nm下降至0.603 8(20 g/L)和0.574 1(60 g/L)(图4)。因此,本研究发现采用PVP-K30可一定程度减少深色果酒对DNS法检测干扰,但无法完全排除颜色干扰。

图4 PVP-K30处理后蓝莓酒样颜色和吸光度对比
Fig.4 Comparison of color and absorbance value of blueberry wine after PVP-K30 treatment
2.3.2 最佳空白对照分析
比色法定量依据是朗博-比尔定律,测定时要扣除比色皿及非待测物的背景吸光度。试剂空白用于扣除测试试剂本身可能引入的微小误差,常用去离子水代替样品来测量。样品空白用于消除测试过程中由于样品本身特性(如颜色、浊度)引入的误差,常用已知浓度的样品代替待测样品进行测试[22]。本研究结果表明,不同空白组下的还原糖测定值间存在显著差异,两种深色果酒(蓝莓酒和葡萄酒)在不同空白组下的还原糖测定值差异变化趋势相对一致(图5)。空白组1和2以DNS试剂作为空白,所得测定值偏离实际值最大。空白组3和4以酒样代替样品和DNS试剂作为空白,测定值明显下降,表明酒样存在较大背景吸光度,是主要颜色干扰。空白组5和6以酒样作为空白,蒸馏水代替DNS试剂,测定值高于空白组3和4,表明蒸馏水的添加稀释了酒样,但降低颜色干扰的效果不好。空白组7以酒样作为空白,添加DNS试剂,不经过沸水浴,有色样品检测的测定值最接近实际值。由于DNS比色法需沸水浴(1.3.1.2节),为衡量沸水浴对DNS试剂和样品的影响,空白组设计时每个处理对比了有无沸水浴对检测的影响,结果表明样品和DNS不同时添加时,如1组和2组、3组和4组、5组和6组,沸水浴带来的差异不显著。因此空白对照法可选定最佳空白组为:200 μL待测酒样,添加150 μL DNS试剂,不经过沸水浴处理。值得注意的是,样品检测则需经过沸水浴处理。

a-蓝莓酒;b-干红葡萄酒
图5 不同空白组下的还原糖测定值
Fig.5 Measurement values of reducing sugars under different blank groups
2.3.3 稀释倍数对还原糖检测准确性的影响分析
为进一步探究稀释倍数对检测准确性的影响,基于2.2节研究结果,本研究设定了适于不同含糖量水平的稀释倍数,进一步筛选适合的稀释倍数。采用DNS法测定葡萄糖和果糖标准溶液经稀释后的还原糖含量,比较不同稀释倍数的测定值间是否存在显著差异。由表3可知,200、150、100、50、10和5 g/L葡萄糖标准溶液和果糖标准溶液,不同稀释倍数的测量值间均无显著差异(P>0.05),表明所选定稀释倍数对还原糖测定值无影响。
表3 糖标准溶液经不同稀释后的测定结果
Table 3 Detection value of sugar standard solution after different dilutions
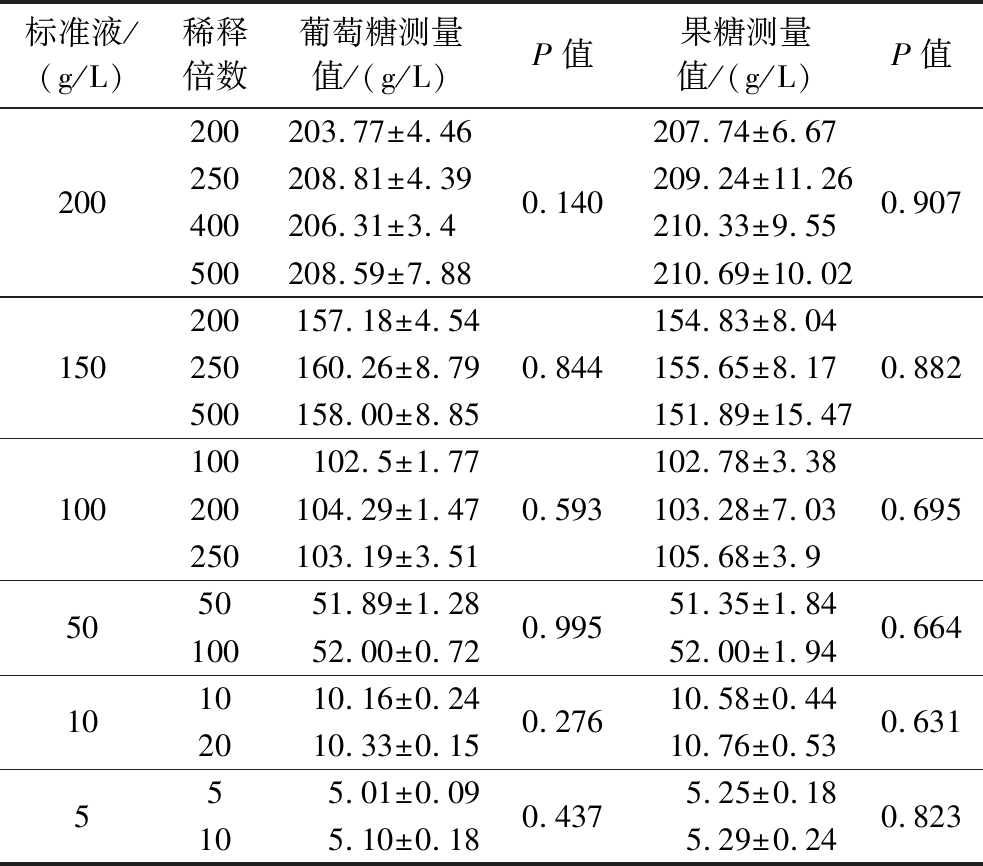
标准液/(g/L)稀释倍数葡萄糖测量值/(g/L)P值果糖测量值/(g/L)P值200200203.77±4.46250208.81±4.39400206.31±3.4500208.59±7.880.140207.74±6.67209.24±11.26210.33±9.55210.69±10.020.907150200157.18±4.54250160.26±8.79500158.00±8.850.844154.83±8.04155.65±8.17151.89±15.470.882100100102.5±1.77200104.29±1.47250103.19±3.510.593102.78±3.38103.28±7.03105.68±3.90.695505051.89±1.2810052.00±0.720.99551.35±1.8452.00±1.940.664101010.16±0.242010.33±0.150.27610.58±0.4410.76±0.530.631555.01±0.09105.10±0.180.437 5.25±0.185.29±0.240.823
偏差率可用于分析已知浓度样品检测值的准确性。表3中的葡萄糖、果糖标准液经不同倍数稀释后,测定值与理论值的偏差率分布如图6。200 g/L葡萄糖标准液稀释200倍时偏差率最低且集中,超过200倍后偏差率分散程度增大。150 g/L样品稀释200倍时偏差率集中在0%~5%,准确性良好;稀释250、500倍时,偏差率大于5%,甚至接近±10%,准确性变差。50和100 g/L样品经50、100倍稀释后测量值偏差率则在-5%~5%,超过100倍稀释后偏差率增大。5和10 g/L样品在5倍、10倍稀释后的偏差率集中分布在-5%~5%,继续增大稀释倍数后偏差率上升。图6-b可知,200 g/L果糖标准溶液稀释200倍测定准确性最好;150 g/L果糖标准溶液稀释200倍偏差率较低;100 g/L果糖标准溶液稀释100倍偏差率分布较低且集中;50 g/L果糖标准溶液稀释50~100倍时偏差率在5%左右,准确性较好;10 g/L果糖标准溶液稀释10倍准确性优于稀释20倍;5 g/L果糖标准溶液稀释5倍准确性优于稀释10倍。
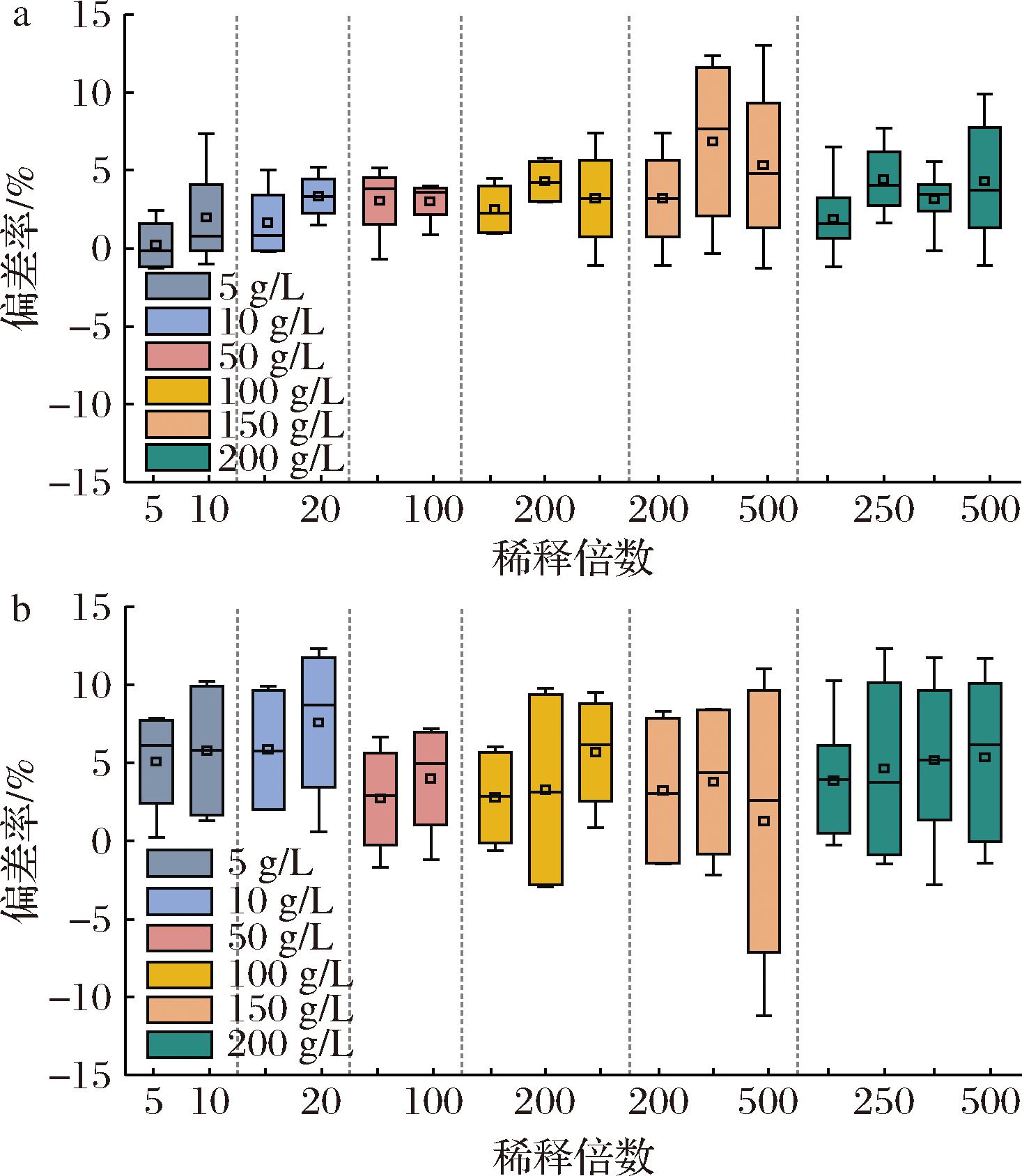
a-葡萄糖标准液;b-果糖标准溶液
图6 不同浓度的糖标准液稀释后偏差率分布箱型图
Fig.6 Box plots of deviation rates of sugar standard solutions at different dilutions
结果表明,无色素干扰时,合适稀释倍数对测定值影响较小,过大稀释倍数使检测值的准确度与精密度变差,存在最佳稀释倍数范围。100~200 g/L还原糖样品,稀释200倍最佳,50~100 g/L还原糖样品,稀释100倍以内时最佳,还原糖10~50 g/L样品,50倍以内稀释准确性较好。
3种降低花色苷干扰方法研究结果表明:PVP-K30具有一定吸附花色苷的作用,但无法完全排除颜色干扰。选定空白对照为200 μL待测酒样+添加150 μL DNS试剂+不经过沸水浴处理时,测定的样品测定值最接近实际值。稀释可降低花色苷对检测的干扰,从排除色素干扰角度,稀释倍数越大花色苷干扰越小。然而,过大稀释倍数使检测值的准确度与精密度变差,合适稀释倍数对测定值影响较小。因此,稀释倍数需兼顾降低花色苷干扰和测定样品的初始还原糖浓度,存在最佳稀释倍数范围。当样品有色素干扰时,可在最佳稀释倍数范围内进行较大稀释。因此,深色果酒的还原糖检测建议结合空白对照法和稀释法。
2.4 基因表达量分析
蓝莓酒发酵8 d结束,4个取样点分别为LM0(0 d)、LM1(2 d)、LM2(4 d)、LM3(8 d),对应的CO2累积生成量和还原糖含量平均值分别为0.00 g(204.39 g/L)、3.34 g(173.81 g/L)、7.38 g(105.15 g/L)、11.25 g(47.11 g/L)。以内参基因PDA1为参照,酿酒酵母CECA还原糖代谢关键酶(己糖激酶和磷酸果糖激酶)的相关基因在不同发酵阶段的相对表达水平差异显著(图7-a)。发酵前期(LM0)和发酵中期(LM1)5个相关基因均出现表达,LM0期GLK1和HXK1表达水平较高,HXK1在LM0期表达水平最高。LM1和LM2期HXK2、PFK1和PFK2表达水平提高,HXK2在LM1和发酵中后期(LM2)表达水平最高。发酵后期(LM3),GLK1、PFK1和PFK1未检测到Ct值,表明其表达水平较低。HXK1和HXK2在后期仍存在表达。
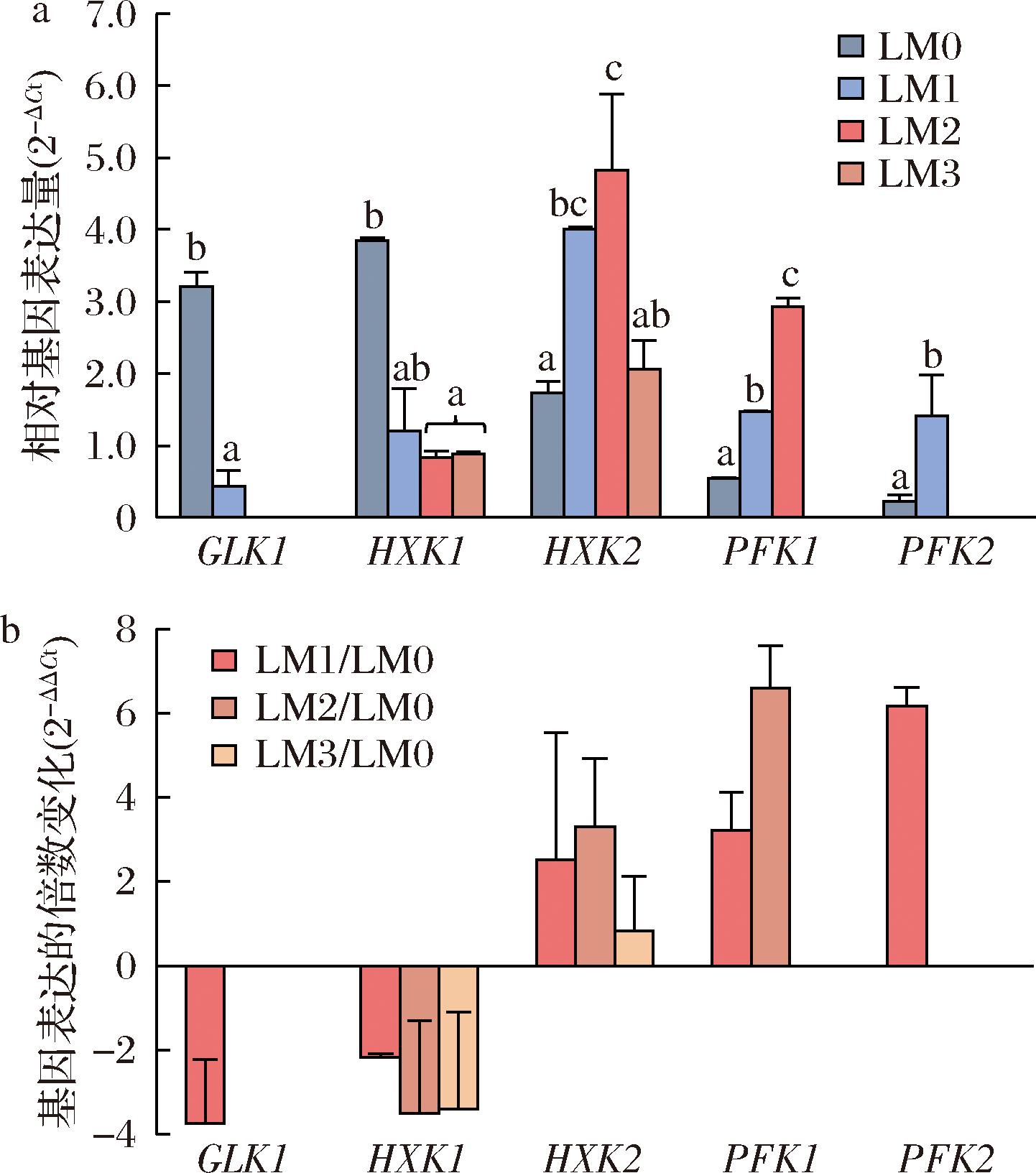
a-基因相对表达量;b-基因表达的倍数变化
图7 酵母菌CECA的5个还原糖代谢相关基因的基因表达水平分析
Fig.7 The relative expression levels of five reducing sugar metabolism genes in yeast CECA
以LM0期为参照,评估各基因在LM1、LM2和LM3期相对于LM0期的基因表达水平的倍数变化(图7-b)。相对表达量在0~1视为负表达,1以上视为正表达。GLK1和HXK1在发酵开始时相对表达量高,其余时期相对LM0期均呈现负表达,表明GLK1和HXK1被首先激活,在发酵前期发挥主要调控作用;随着发酵进行,HXK2表达量水平上调,在LM2时期的表达量是LM0的3倍以上;PFK1在LM1和LM2时均呈正表达,相对表达量为LM0时期的4倍以上,最高达6倍,表明发酵中期和中后期HXK2和PFK1起主要调控作用;PFK2仅在LM1时呈正表达,表达量为LM0的6倍左右,可见PFK2主要在发酵中期集中表达。
2.5 还原糖与基因表达量相关性分析
酿酒酵母CECA发酵过程中的还原糖含量与还原糖代谢相关基因的相关性分析表明:还原糖含量与GLK1、HXK1基因表达量呈高度正相关,与PFK2显著正相关(图8),同时GLK1与HXK1基因表达量高度正相关。因此,在基因水平上监测还原糖代谢时,可将GLK1、HXK1作为主要监测对象。此外,PFK1与HXK2基因表达量高度正相关。根据相关性分析结果,推测GLK1与HXK1存在协同表达,在发酵前期激活还原糖代谢,而中期、中后期PFK1与HXK2基因表达量协同上调以维持还原糖的代谢。酿酒酵母还原糖代谢受到多种酶基因的协同调控。GLK1和HXK1分别编码葡萄糖激酶1(Glk1p)和己糖激酶(Hxk1p),首先激活糖代谢通路,还原糖含量下降。随着发酵的进行,GLK1、HXK1表达水平下调,而HXK2、PFK1和PFK2表达上调,继续维持酵母还原糖代谢。发酵结束时,GLK1、HXK1、HXK2、PFK1、PFK2均降低,还原糖含量达到最低。

图8 发酵过程基因表达量与还原糖含量相关性热图
Fig.8 Heatmap of the correlation between gene expression and reducing sugar content
注:|R|<0.3,为微弱相关,0.3<|R|<0.5为低度相关;0.5<|R|<0.8为显著相关,0.8<|R|<1为高度相关。
3 结论与讨论
颜色是发酵果酒品质的重要评价指标之一,花色苷类化合物赋予葡萄酒、蓝莓酒等果酒独特的视觉和抗氧化功效[23-24],但其颜色也对基于比色法的定量检测带来挑战。本研究采用PVP脱色、空白对照和样品稀释方法来降低花色苷色素对DNS法检测的干扰。结果表明,PVP-K30的吸附脱色作用有限。以200 μL待测样+添加150 μL DNS试剂+不经过沸水浴处理作为深色样品空白对照时,DNS法检测值最接近真实值。稀释是有效降低酒液中花色苷对检测值干扰的方式。统计分析表明,适当稀释可在降低干扰同时保持还原糖测定准确性。不同发酵时期样品应采用不同的稀释倍数。高色素、高还原糖样品,如发酵初期葡萄醪液、蓝莓汁等100~200 g/L高浓度样品,稀释200倍可有效降低色素干扰同时保证检测准确性。随着发酵的进行,还原糖被代谢消耗,高倍稀释能有效降低色素干扰,但稀释倍数的增大会降低检测值的准确性。因而,50~100 g/L还原糖样品,稀释倍数在100倍内时最佳,还原糖10~50 g/L样品,50倍以内稀释最佳。在发酵后期,还原糖浓度不足10 g/L,无法进行高倍稀释,此时色素对还原糖检测干扰较大。建议结合样品空白、不经过沸水浴的空白对照,以抵消样品因色素产生的背景吸光度值。
本研究尝试探究发酵过程中酿酒酵母还原糖代谢关键基因相对表达量与还原糖含量之间的联系,为还原糖监测方法的改进提供了坚实的理论依据和有效的辅助支持。5个还原糖代谢相关基因的监测中,GLK1和HXK1在发酵前期表达水平较高,HXK2、PFK1和PFK2在中期、中后期均呈高表达水平,后期5个基因表达水平均较低。还原糖含量与GLK1、HXK1基因表达量高度正相关。发酵前期,GLK1、HXK1基因前期表达的激活还原糖的代谢,起主导作用,发酵中期、中后期PFK1基因表达的量的上调有利于还原糖的代谢。酿酒酵母的酒精发酵代谢机制极为复杂,影响还原糖代谢的酶并非仅文中所研究的3种。后续研究中可进一步探究乙醇脱氢酶等酒精发酵代谢通路中相关酶编码基因的表达水平,并分析其与还原糖之间的关联,为从分子水平监控酒精发酵提供更充分的依据。
本研究以降低花色苷检测干扰为目标,研究结果为快速精准监测发酵进程还原糖含量提供方法参考,并探究发酵中还原糖浓度与关键基因表达量关系,为从基因表达水平预测并监控蓝莓酒发酵进程提供理论依据,对产品质量提升具有重要意义。
[1] 许子刚, 刘深勇.糖分对葡萄酒发酵的影响[J].食品安全导刊, 2017(30):133.
XU Z G, LIU S Y.Effect of sugar on wine fermentation[J].China Food Safety Magazine, 2017(30):133.
[2] 王春晓, 江璐, 刘延琳.DNS法监控葡萄酒发酵进程的应用研究[J].中国酿造, 2012, 31(9):24-27.
WANG C X, JIANG L, LIU Y L.Application study on monitoring wine fermentation process by DNS method[J].China Brewing, 2012, 31(9):24-27.
[3] 吴国辉, 王柳玲, 邓伟恒.高效液相色谱法测定酒类中总糖含量[J].食品安全导刊, 2018(16):59-61.
WU G H, WANG L L, DENG W H.Determination of total sugar in alcohol by high performance liquid chromatography[J].China Food Safety Magazine, 2018(16):59-61.
[4] 张敏, 刘冰, 王凡, 等.葡萄酒等果酒中总糖含量检测方法的优化研究[J].酿酒科技, 2023(7):111-115.
ZHANG M, LIU B, WANG F, et al.Optimization of detection method for total sugar content in fruit wines[J].Liquor-Making Science &Technology, 2023(7):111-115.
[5] 武平, 赵文婧, 徐晓娇, 等.测定葡萄酒中总糖方法的探讨[J].中国酿造, 2011, 30(1):163-165.
WU P, ZHAO W J, XU X J, et al.Methods for determination of total sugar content in wine[J].China Brewing, 2011, 30(1):163-165.
[6] 偰德翱. 电位滴定法测定葡萄酒中还原糖含量的研究[J].食品工程, 2007(3):61-63.
XIE D A.Determination of reducing sugar content in wine by potentiometric titration[J].Food Engineering, 2007(3):61-63.
[7] 赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008(8):534-536.
ZHAO K, XU P J, GU G Y.Colorimetric determination of reducing sugars by 3,5-dinitrosalicylic acid[J].Food Science, 2008(8):534-536.
[8] 杨泉女, 周权驹, 吴松健, 等.3, 5-二硝基水杨酸法与酶法测定甜玉米还原糖和蔗糖含量的比较[J].中国农业科技导报, 2017, 19(11):125-131.
YANG Q N, ZHOU Q J, WU S J, et al.Comparison of 3, 5-dinitrosalicylic acid method and enzymatic method in the determination of sugar and sucrose content in sweet corn[J].Journal of Agricultural Science and Technology, 2017, 19(11):125-131.
[9] 江龙发. 干红葡萄酒中总糖快速测定技术研究[D].南昌:南昌大学, 2016.
JIANG L F.Research on the rapid determination technique of total sugar in dry red wine[D].Nanchang:Nanchang University, 2016.
[10] 李凤. 脱色对红葡萄酒中还原糖测定的影响[J].安徽农业科学, 2007,35(10):2835-2836.
LI F.Effect of decolorization on the determination of reducing sugars in red wines[J].Anhui Agricultural Science, 2007,35(10):2835-2836.
[11] 王欢, 卢红梅, 张义明, 等.固态发酵食醋中还原糖、总糖含量测定[J].中国酿造, 2011, 30(9):172-175.
WANG H, LU H M, ZHANG Y M, et al.Determination of the contents of reducing sugar and total sugar in solid-state fermented vinegar[J].China Brewing, 2011, 30(9):172-175.
[12] RODR GUEZ A, CERA T D L, HERRERO P, et al.The hexokinase 2 protein regulates the expression of the GLK1 HXK1 and HXK2 genes of Saccharomyces cerevisiae[J].Biochemical Journal, 2001, 355(Pt 3):625-631.
GUEZ A, CERA T D L, HERRERO P, et al.The hexokinase 2 protein regulates the expression of the GLK1 HXK1 and HXK2 genes of Saccharomyces cerevisiae[J].Biochemical Journal, 2001, 355(Pt 3):625-631.
[13] DAVIES S E, BRINDLE K M.Effects of overexpression of phosphofructokinase on glycolysis in the yeast Saccharomyces cerevisiae[J].Biochemistry, 1992, 31(19):4729-4735.
[14] YAMADA R, WAKITA K, OGINO H.Global metabolic engineering of glycolytic pathway via multicopy integration in Saccharomyces cerevisiae[J].ACS Synthetic Biology, 2017, 6(4):659-666.
[15] 朱银龙, 周学义, 张蕾蕾, 等.PVPP对枸杞果酒多酚物质及品质的影响[J].酿酒科技, 2021(1):42-44;49.
ZHU Y L, ZHOU X Y, ZHANG L L, et al.Effect of PVPP on polyphenols and quality of Lycium barbarum wine[J].Liquor-Making Science &Technology, 2021(1):42-44;49.
[16] WANG C X, LIU M L, LI Y, et al.Hydrogen sulfide synthesis in native Saccharomyces cerevisiae strains during alcoholic fermentations[J].Food Microbiology, 2018, 70:206-213.
[17] 张素敏, 杨巍, 魏鑫, 等.蓝莓果实外观与糖、酸、酚组成特征[J].食品研究与开发, 2023, 44(10):53-61.
ZHANG S M, YANG W, WEI X, et al.Appearance and sugar, acid and phenol composition of blueberry fruit[J].Food Research and Development, 2023, 44(10):53-61.
[18] 张晓利, 刘崇怀, 刘强, 等.不同葡萄种质果实可溶性糖组分特征分析[J].中国果树, 2023(4):56-62.
ZHANG X L, LIU C H, LIU Q, et al.Characterization of soluble sugar fractions of different grape germplasm[J].China Fruits, 2023(4):56-62.
[19] 李佳秀, 张春岭, 刘慧, 等.葡萄汁中糖酸组成分析及在掺假鉴别中的应用[J].果树学报, 2019, 36(11):1566-1577.
LI J X, ZHANG C L, LIU H, et al.Profiles of soluble sugars and organic acids in grape juice and their application for authentication[J].Journal of Fruit Science, 2019, 36(11):1566-1577.
[20] D’AMORE T, RUSSELL I, STEWART G G.Sugar utilization by yeast during fermentation[J].Journal of Industrial Microbiology, 1989, 4(4):315-323.
[21] 黎新明, 崔英德, 廖列文. PVPP对啤酒中多酚类物质和蛋白质的吸附作用比较[J]. 食品科学, 2002(8): 74-76.
LI X M, CUI Y D, LIAO L W. Comparison of adsorption effects of PVPP on polyphenols and proteins in beer[J]. Food Science, 2002(8): 74-76.
[22] 辛伍红. 朗伯-比尔定律的适用条件与限制[J].化工时刊, 2020, 34(7):49-51.
XIN W H.Conditions and limitations of Lambert-Beer law[J].Journal of Chemical Engineering, 2020, 34(7):49-51.
[23] LI X S, ZHANG L, PENG Z Y, et al.The impact of ultrasonic treatment on blueberry wine anthocyanin color and its in-vitro anti-oxidant capacity[J].Food Chemistry, 2020, 333:127455.
[24] ENARU B, DRE\U021BCANU G, POP T D, et al.Anthocyanins:Factors affecting their stability and degradation[J].Antioxidants, 2021, 10(12):1967.