胶原蛋白广泛存在于廉价且来源十分丰富的肉类副产品中,如牛、猪和鸡的皮肤和骨骼[1-2],是工业化生产胶原蛋白肽(collagen peptide)的主要前体来源。胶原蛋白肽具有高保湿[3]、抗皱的特性,对抑制紫外线引起的光损伤具有良好的修复效果。临床试验显示,涂抹和口服胶原蛋白肽可以通过不同的机制缓解衰老,具有不同程度的抗氧化活性[4],并有助于防治骨质疏松。在海洋生物中,包括鱼皮、鱼骨、鱼鳞等组织结构中的胶原蛋白因其良好的生物相容性、优异的生物活性和低抗原性,在近年来也备受关注[5]。
目前,获取胶原蛋白肽的方法主要包括物理降解法、化学降解法和微生物酶解法[6]。物理降解法涵盖高温和高压降解,但由于高能耗和高温对胶原蛋白活性的影响,这些方法存在一定局限性。化学降解法则使用强酸强碱等,但其对胶原蛋白短肽中的氨基酸活性结构的破坏以及对环境的污染限制了其应用[7-8]。相比之下,酶法降解胶原蛋白具有温和的反应条件、产物分子质量单一且对环境友好的优势。通过利用生物酶法降解动物副产品,如皮肤和软骨组织,获得的胶原蛋白肽具有广泛的市场前景[9-10],因此,研发一种高活性、易制备的胶原蛋白水解酶显得尤为重要。
胶原蛋白水解酶分为动物来源和微生物来源。与动物来源的胶原蛋白水解酶相比,细菌胶原蛋白水解酶既可以降解水溶性变性胶原蛋白,也可以作用于水不溶性胶原蛋白。目前商品化的胶原酶是从溶组织梭状芽孢杆菌提取,存在制备成本高和菌株的致病性的问题。在本研究中,通过在大肠杆菌中实现蜡样芽孢杆菌来源的胶原蛋白水解酶ColVD021的活性表达,优化其表达过程,从而提高酶活性至(8.96±0.21) U/mL。通过截短信号肽,并在诱导时添加Ca2+和Zn2+能够明显提高ColVD021-Δ30的酶活性,成功将酶活性提升至(16.24±0.21) U/mL,为异源高效表达奠定了基础。随后,我们优化了ColVD021-Δ30的水解条件,确定了最适pH为7.5,最适反应温度为37 ℃。通过对不同胶原蛋白的酶学特性测试,证明了ColVD021-Δ30对各类胶原蛋白的强水解能力,并鉴定了主要产物的分子质量分布。为了验证其工业应用潜力,将ColVD021-Δ30应用于降解农副产品中的鸡胸软骨,经过粉碎和酶降解处理后,鸡胸软骨的胶原蛋白降解为小分子胶原蛋白肽,含量高达98.01%。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
本研究所使用的菌株、质粒见表1。
表1 本文所使用的菌株和质粒
Table 1 The strains and plasmids used in this study
菌株与质粒特点来源菌株Escherichia coli BL21(DE3)表达宿主本实验室E.coli ColVD021表达宿主,表达ColVD021本研究E.coli ColVD021-Δ30表达宿主,表达ColVD021-Δ30本研究E.coli ColVD021-Δ93表达宿主,表达ColVD021-Δ93本研究质粒pET28a (+)表达载体,KanaR本实验室pET28a-ColVD021含有ColVD021的表达载体,KanaR本研究pET28a-ColVD021-Δ30含有ColVD021-Δ30的表达载体,KanaR本研究pET28a-ColVD021-Δ93含有ColVD021-Δ93的表达载体,KanaR本研究
1.1.2 实验试剂
胶原蛋白水解酶ColVD021编码基因、PCR引物,天霖生物科技(无锡)有限公司合成;Prime STAR Max DNA聚合酶、Prime STAR DNA聚合酶、DNA marker、限制性核酸内切酶Dpn I、一步克隆试剂盒、磷酸化连接试剂盒,TaKaRa公司;Taq PCR Master Mix,杭州宝赛生物科技有限公司;DNA纯化回收试剂盒、质粒提取试剂盒,南京诺唯赞生物科技股份有限公司;改良型BCA蛋白浓度测定试剂盒、硫酸卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、茚三酮,上海生工生物有限公司;10×Fast Digest Green buffer、酵母粉、蛋白胨,赛默飞世尔科技公司;乙二醇甲醚和其他常用的国产分析纯试剂,上海国药试剂公司;二水还原茚三酮、鱼鳞来源胶原蛋白、鸡源Ⅱ胶原蛋白、牛跟腱来源的I胶原蛋白,上海源叶生物科技有限公司。
1.1.3 培养基
LB培养基(g/L):蛋白胨10,酵母提取物5,NaCl 10;TB培养基(g/L):蛋白胨12,酵母提取物24,K2HPO4 12.54,KH2PO4 2.31,甘油4。
1.2 方法
1.2.1 胶原蛋白水解酶表达载体的构建
胶原蛋白水解酶ColVD021(GenBank:EOO74759.1或Uniprot ID:R8HPH3)的编码基因由天霖生物科技有限公司在进行密码子优化后合成,通过设计引物pET28a-F:5′-CGCGGA TCCGAAGAGAA-GG TTCCATATAATGTTTTGCAC-3′ 和引物pET28a-R:5′-TTTCACACTCAAAGCATAAGCACCATC-3′扩增得到基因片段,并与载体pET28a相连,得到质粒pET28a-ColVD021,质粒转化Escherichia coli BL21(DE3),得到菌株E.coli ColVD021。
1.2.2 质粒pET28a-ColVD021-Δ30和pET28a-ColVD021-Δ93的构建
以质粒pET28a-ColVD021为模板,设计引物ColVD021-Δ30:5′-GACTAACGTTTCCGCAGAAG AG-AAGGTTCCATATAATGTTTTGCAC-3′ 和ColVD021-Δ93:5′-CAAGCAAGCCAAAGAAAGCTACTCG ATGGCCGA-TCTTAACAAAATG-3′,分别构建截短信号肽的胶原蛋白水解酶质粒pET28a-ColVD021-Δ30和截短信号肽及前肽的胶原蛋白水解酶质粒pET28a-ColVD021-Δ93,质粒分别转化E.coli BL21 (DE3),得到菌株E.coli ColVD021-Δ30和菌株E.coli ColVD021-Δ93,后续对其酶活性进行测定。
1.2.3 重组胶原水解酶蛋白的表达
将重组菌株E.coli ColVD021、E.coli ColVD021-Δ30和E.coli ColVD021-Δ93在LB平板上划线活化,37 ℃培养12 h,挑取单菌落于含有30 mL LB培养基的250 mL摇瓶中,使用恒温振荡培养箱37 ℃培养12 h左右,然后按照10%的接种量将种子转接含有50 mL TB培养基的250 mL摇瓶中,37 ℃培养至OD600为0.6~0.8时,加入IPTG进行诱导,使用恒温振荡培养箱25 ℃培养10 h。
1.2.4 重组胶原水解酶蛋白的纯化
诱导结束后8 000 r/min离心30 min后用100 mmol/L Tris-HCl,pH=7.5的缓冲液重悬细胞沉淀,在冰水浴中超声波破碎,10 000 r/min离心30 min后取上清液,用100 mmol/L的Tris-HCl重悬裂解细胞后8 000 r/min,离心10 min,取上清液,上清液使用0.45 μm的微孔滤膜过滤,得到粗酶液,使用AKTA蛋白纯化仪进行蛋白纯化,首先使用缓冲液A平衡预装纯化柱HisTrap HP column(GE healthcare),使用缓冲液A冲洗柱子,然后用0、50、100、200 mmol/L咪唑进行梯度洗脱和纯化。重组胶原水解酶十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)检测:将得到的胶原酶液分别采用SDS-PAGE。电泳结束后,含有目标胶原酶的凝胶经过复性、考马斯亮蓝染色、脱色,目标胶原酶呈现负染条带。
1.2.5 胶原蛋白水解酶酶活性测定和酶活性定义
采用茚三酮显色的方法表征胶原蛋白水解酶活性,参考李陈[11]等,胶原蛋白水解酶特异性水解胶原蛋白中Gly-X-Y中的肽键,形成的Gly与茚三酮反应并在590 nm下有特定吸光值。
酶活力单位定义:在37 ℃和pH 7.5的条件下,每分钟水解胶原蛋白产生1 μmol甘氨酸所需的酶量为1个酶活力。蛋白浓度采用改良型BCA蛋白浓度测定试剂盒测定,原理为碱性环境下,蛋白质能够与Cu2+结合并将其还原为Cu+。Cu+与BCA试剂形成稳定的紫蓝色复合物,其最大吸收波长为562 nm。该吸光度与蛋白质的浓度呈线性关系,因此可以利用这一特性来测定蛋白质的浓度。以牛血清白蛋白为标准品。
1.2.6 胶原蛋白降解产物分子质量测定
使用凝胶排阻色谱检测胶原蛋白的降解以及测定胶原蛋白肽的分子质量。测定分子质量时,使用50 mmol/L Tris-HCl,5 mmol/L CaCl2,pH 7.5缓冲液溶解胶原蛋白,底物质量浓度为20 mg/mL,加入不同酶量的胶原蛋白水解酶,50 ℃反应,反应过程中定时取样,12 000 r/min离心10 min,取上清液使用0.22 μm水系滤膜去除杂质后测定样品分子质量。高效液相色谱条件:色谱柱为TSK-GEL® G2000SWxl(孔径130 Å、粒径5 μm、尺寸7.8 mm×300 mm),柱温25 ℃,以浓度0.1 mol/L的NaNO3溶液为流动相,设定流速0.8 mL/min,进样量20 μL,使用示差检测器检测。以不同分子质量的胶原蛋白肽作为标准样品,制作不同标样洗脱时间与分子质量之间的标准曲线。
2 结果与分析
2.1 胶原蛋白水解酶ColVD021的表达及截短优化
从NCBI查阅到来源于蜡样芽孢杆菌的胶原蛋白水解酶的氨基酸序列GenBank:EOO74759.1,反向翻译得到其编码核苷酸序列,通过在线密码子优化(https://www.vectorbuilder.cn/tool/codon-optimization.html)并合成后,连接到载体pET28a上,转入到E.coli BL21(DE3)中,将重组菌E.coli ColVD021培养至OD600为0.6~0.8,用0.5 mmol/L IPTG诱导,破壁后通过测定酶活性确定ColVD021的活性表达,酶活性显示为(4.50±0.34) U/mL,如图1-a所示。
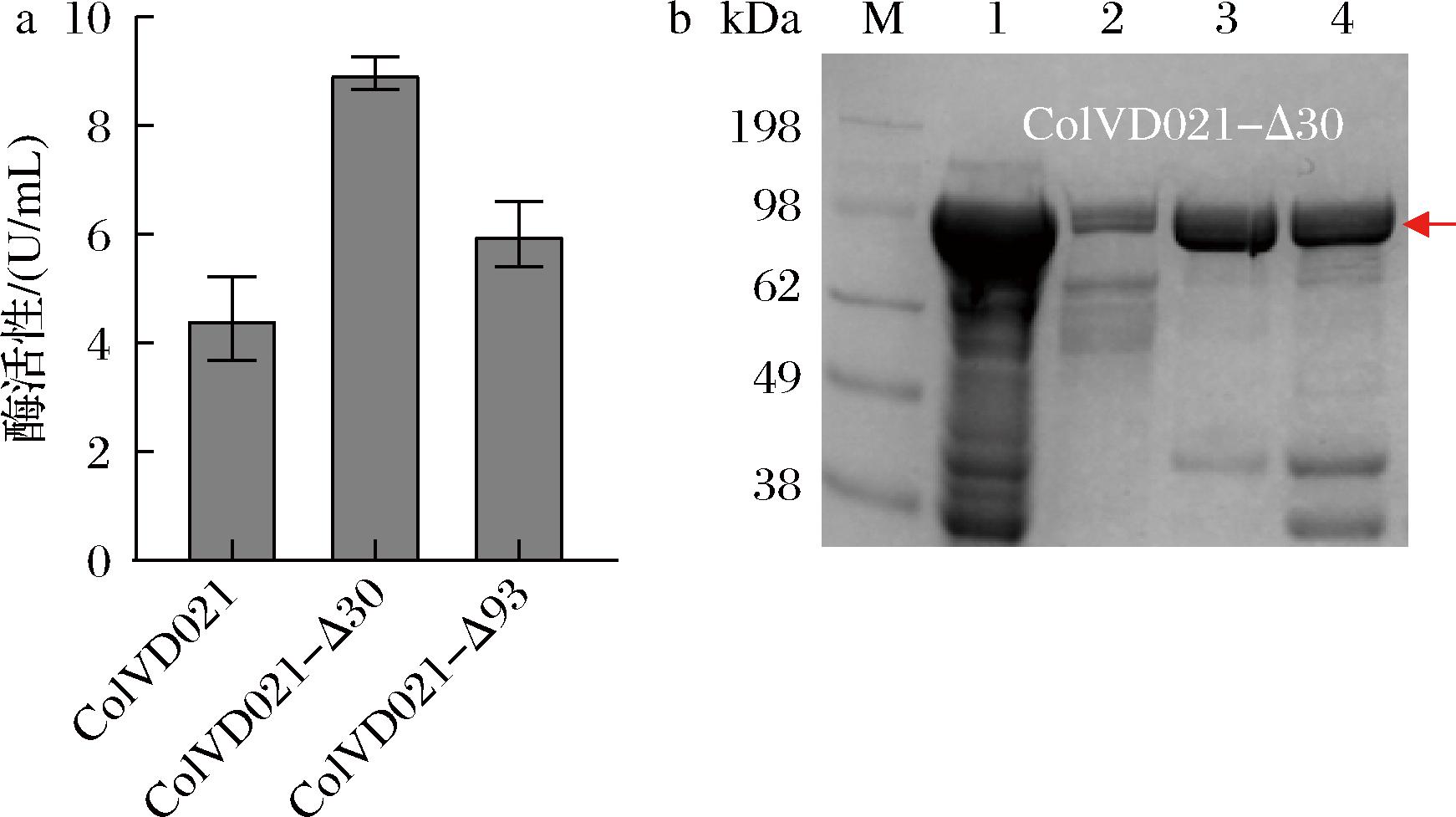
a-截短不同长度的ColVD021酶活性测定;b-ColVD021-Δ30表达及纯化分析
图1 胶原蛋白水解酶ColVD021的表达及截短优化
Fig.1 Expression and truncation optimization of collagenase ColVD021
注:M-蛋白质标准品;1-破壁上清液;2-50 mmol/L咪唑洗脱液;3-100 mmol/L咪唑洗脱液;4-200 mmol/L咪唑洗脱液。
对ColVD021的序列分析预测,发现其可能存在一个信号肽(1~30 aa)和前导肽(31~93 aa)序列。通过删除ColVD021中的信号肽和前导肽,获得重组质粒pET28a-ColVD021-Δ30和pET28a-ColVD021-Δ93。质粒分别转化E.coli BL21(DE3),得到菌株E.coli ColVD021-Δ30和菌株E.coli ColVD021-Δ93,培养表达后对其酶活性进行测定,发现截短信号肽后,ColVD021-Δ30的酶活性为(8.96±0.21) U/mL,酶活性较未截短的提高了99%。当删除前导肽后,ColVD021-Δ93的酶活性并没有继续增加,为(6.00±0.32) U/mL,较原始菌株提高了33%。实验结果表明,在E.coli BL21(DE3)中表达时,截短ColVD021序列的前30个氨基酸,更加有利于胶原蛋白水解酶在大肠杆菌中的表达[12]。
为了测定ColVD021-Δ30的比酶活,将菌株ColVD021-Δ30在TB培养基中进行培养,加入诱导剂后,在25 ℃培养10 h,OD600达到4.5。利用NI-NTA镍柱亲和层析法纯化蛋白,蛋白挂柱后用100、200 mmol/L咪唑洗脱出目的蛋白,利用SDS-PAGE分析纯化情况,如图1-b所示。并测定了脱盐后的蛋白含量及酶活,纯化后蛋白质量浓度为1 mg/mL,比酶活为4 U/mg。
2.2 优化培养条件添加金属离子提高重组胶原蛋白水解酶ColVD021-Δ30的酶活性
根据报道,其他蜡样芽孢杆菌来源的胶原蛋白水解酶ColG和ColH的活性依赖于Zn2+[13],并且可以与Ca2+稳定结合从而提高酶活性[14],因此尝试在培养基添加金属离子,提高ColVD021-Δ30的酶活性。
在菌株E.coli ColVD021-Δ30诱导时,向培养基中添加不同浓度的CaCl2和ZnCl2,测定胶原蛋白水解酶的活性,ColVD021-Δ30活力在添加不同浓度CaCl2和ZnCl2有不同程度的提高。当单独添加10 mmol/L CaCl2时,酶活性最高,为(12.03±0.75) U/mL,如图2-a所示。当在培养基中单独添加0.2 mmol/L ZnCl2时,酶活性最高,为(10.15±1.91) U/mL,如图2-b所示。将10 mmol/L CaCl2和0.2 mmol/L ZnCl2组合添加到培养基中,胶原蛋白水解酶活性进一步提升到(16.24±0.21) U/mL。这些结果证实了培养基中添加Ca2+和Zn2+有助于提高胶原蛋白水解酶的活性[14-15],这可能归因于在胶原蛋白水解酶蛋白翻译折叠过程中,需要金属离子(Ca2+和Zn2+)参与蛋白的形成,通过向培养基中添加金属离子可以辅助ColVD021-Δ30更好的折叠。
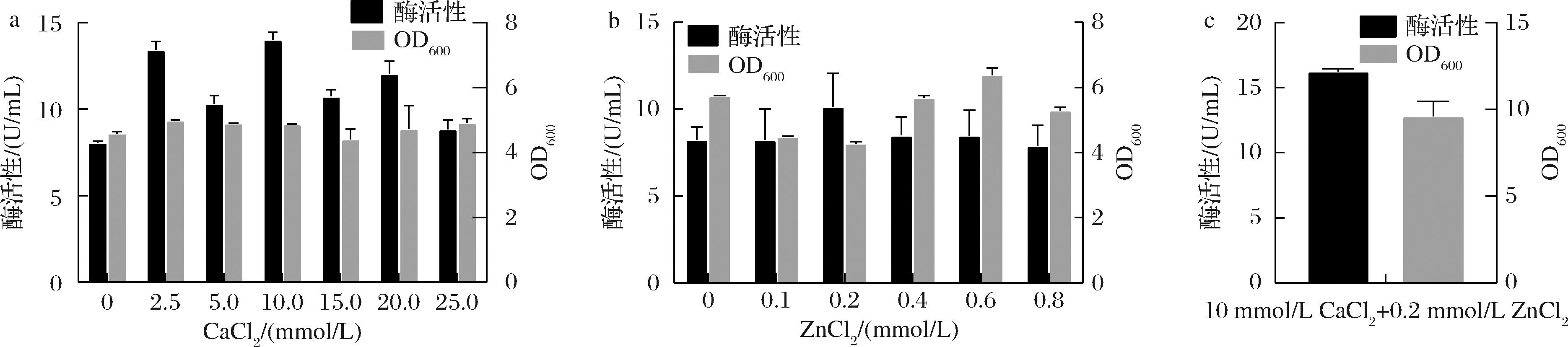
a-不同浓度Ca2+优化;b-不同浓度Zn2+优化;c-组合添加Ca2+和Zn2+
图2 优化金属离子添加提高重组胶原蛋白水解酶ColVD021-Δ30的酶活性
Fig.2 Optimization of metal ion supplementation enhances the activity of recombinant collagenase ColVD021-Δ30
2.3 胶原蛋白水解酶ColVD021-Δ30的反应体系优化及酶学性质测定
在添加金属离子优化培养基的基础上,为进一步考察不同金属离子在催化反应过程中对胶原蛋白水解酶ColVD021-Δ30活性的影响,通过在反应体系中分别添加5 mmol/L Ca2+、Zn2+、Mg2+、K+、Co2+、Fe3+、Fe2+、Ni2+和Cu2+,测定它们对酶活性的影响。结果表明Mg2+、K+、Co2+、Ca2+对胶原蛋白水解酶酶活有不同程度的提升,分别提高了44.82%、30.78%、23.94%、6.78%,而添加Fe3+、Fe2+、Ni2+、Cu2+、Zn2+则对胶原蛋白水解酶有抑制作用,胶原蛋白水解酶活性降低到原来的37.71%、28.87%、36.41%、58.82%、15.76%,如表2所示。该实验结果表明,适当添加对应的金属离子,能够有效地提高ColVD021-Δ30的活性;而添加某些金属离子(如Zn2+)抑制了活性,说明此种金属离子只能通过蛋白折叠过程中提高酶的活性,过量添加时不能辅助蛋白催化,反而会影响底物的结合和释放,进而影响酶活性。
表2 金属离子对胶原蛋白水解酶活性影响
Table 2 Effect of metal ions on the activity of collagen hydrolase

金属离子对照Ca2+Zn2+Mg2+K+Co2+Fe2+Ni2+Fe3+Cu2+添加浓度/(mmol/L)0555555555相对酶活性/%100106.7815.76144.82137.78123.9428.8736.4137.7158.82
为了提高胶原蛋白水解酶ColVD021-Δ30的应用潜力,对ColVD021-Δ30反应条件中的pH和温度进行优化。如图3-a所示,对纯化后的胶原蛋白水解酶ColVD021-Δ30进行最适温度的测定,纯化后的样品被分别置于20、30、37、45、50、60 ℃进行反应。随温度升高,胶原蛋白水解酶活性上升,并在50 ℃时酶活性达到最大,此时继续提高温度,胶原蛋白水解酶ColVD021-Δ30迅速失活。
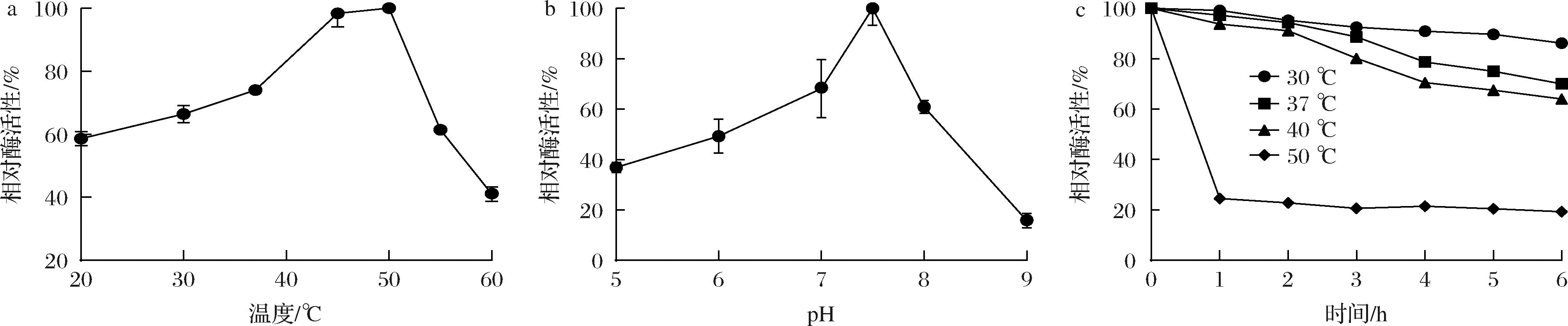
a-温度;b-pH;c-ColVD021-Δ30的稳定性测试
图3 胶原蛋白水解酶ColVD021-Δ30的反应条件优化
Fig.3 Optimization of reaction conditions for collagenase ColVD021-Δ30
将纯化后胶原蛋白水解酶ColVD021-Δ30分成6组,将pH调成5、6、7、7.5、8和9,并在最适温度下进行酶活性测定,胶原蛋白水解酶在pH 7.5时酶活性达到最大,如图3-b所示,pH继续升高时,酶活性降低,随着pH升高到9,胶原蛋白水解酶接近失去活性。接着,我们测试了胶原蛋白水解酶ColVD021-Δ30的稳定性,如图3-c所示,胶原蛋白水解酶ColVD021-Δ30在30、37 ℃下较为稳定。在30 ℃下保温6 h后酶活性剩余87%,在37 ℃下保温6 h后酶活性剩余78%,在40 ℃下保温6 h后酶活性剩余64%,但在最适温度50 ℃下保温6 h后相对酶活性仅为20%,胶原蛋白水解酶ColVD021-Δ30在最适温度50 ℃下不稳定,保温1 h后胶原蛋白水解酶失活,在孵育第2 h后酶活性已经降到一个非常低的水平。因此在同样的半衰期下,酶活性继续衰减的幅度也变小。另一方面,前期大量失活的酶可能是由于蛋白质的结构已经发生了变化,结构变化的ColVD021-Δ30仍具有少量酶活性,因此后续孵育,蛋白质结构不再发生变化或变化不明显,导致酶活性下降缓慢。该结果表明,胶原蛋白水解酶能够在37 ℃保持稳定酶活性,适合于大多数工业生产场景。
接着比较了对不同来源的胶原蛋白的水解活力,如明胶、鱼鳞来源胶原蛋白、牛源I型胶原蛋白、鸡源Ⅱ型胶原蛋白,测定了相关动力学参数,如图4所示。利用明胶做底物时,测定其最大反应速度Vmax为(13.53±1.10) μmol/(mg·min),Km为(6.93±0.91) mg/mL。用相同的测定方法测定牛源I型胶原蛋白、鸡源Ⅱ型胶原蛋白、鱼鳞来源胶原蛋白,测定Vmax分别为(2.63±0.56)、(2.00±0.02)、(5.34±0.96) μmol/(mg·min),Km分别为(8.86±0.08)、(5.94±0.16)、(1.84±0.62) mg/mL,证明胶原蛋白水解酶ColVD021-Δ30对不同来源的胶原蛋白均有较高的酶活性。
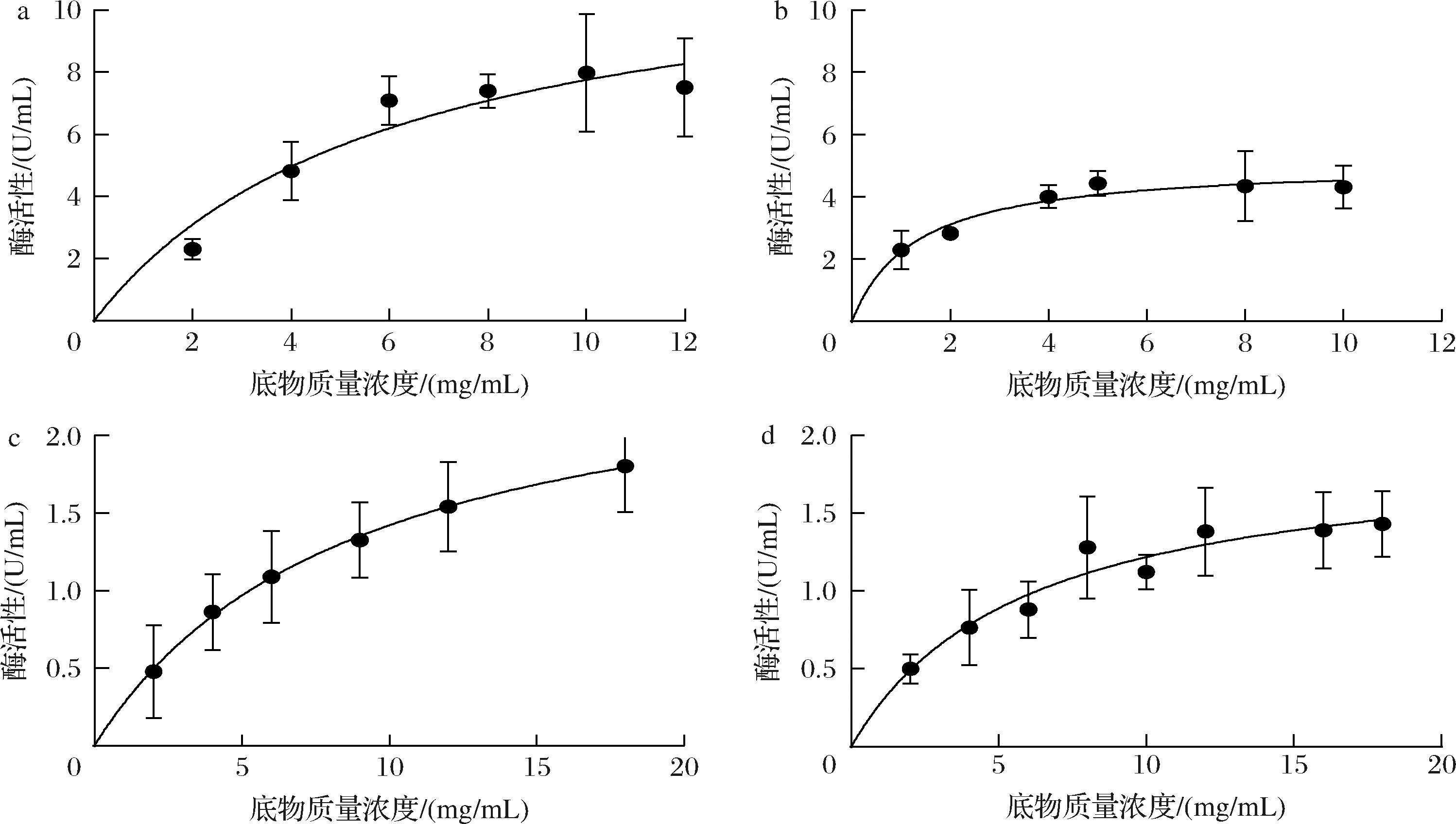
a-明胶;b-鱼鳞来源胶原蛋白;c-牛源I型胶原蛋白;d-鸡源Ⅱ型胶原蛋白
图4 胶原蛋白水解酶ColVD021-Δ30降解不同底物的酶学性质分析
Fig.4 Enzymatic properties analysis of collagenase ColVD021-Δ30 in degrading various substrates
2.4 应用胶原蛋白水解酶ColVD021-Δ30水解不同来源的胶原蛋白
以上结果确定了胶原蛋白水解酶ColVD021-Δ30能够水解不同来源的胶原蛋白。为了探究工业化实际应用情况,优化了不同酶活性对高浓度底物的降解情况。如图5所示,随着加入的胶原蛋白水解酶酶活性增加,不同来源的胶原蛋白中小分子胶原蛋白肽比例越高,大分子(分子质量>5 kDa)比例越低。在10 mL的催化体系中,降解20 g/L鸡源Ⅱ型胶原蛋白,添加酶活性为70、50、10 U时,大分子比例分别从0.36%降至0%、0.2%、0.4%,小分子(分子质量<1 kDa)比例分别从84.38%升至95.26%、94.4%、92.22%。在10 mL的催化体系中,降解20 g/L牛源I型胶原蛋白,添加酶活性为100、45、15 U时,大分子比例分别从4.11%降至0.28%、0.25%、0.49%,小分子比例分别从57.67%升高到85.05%、87.35%、84.62%。在10 mL的催化体系中,降解20 g/L鱼鳞胶原蛋白添加酶活性为100、50、20 U时,大分子比例分别从3.66%降至0.22%、0.27%、0.33%,小分子比例分别从58.1%升至91.07%、90.06%、87.30%。通过延长水解时间,如图6-a~图6-c所示,降解鸡源Ⅱ型胶原蛋白、鱼鳞胶原蛋白、牛源I型胶原蛋白大分子分布逐步减小,小分子分布比例逐步增加。以上结果实验证明,通过调节胶原蛋白水解酶ColVD021-Δ30的添加量和水解时间,能够很好的降解不同来源的胶原蛋白,获得不同比例的小分子胶原蛋白肽。
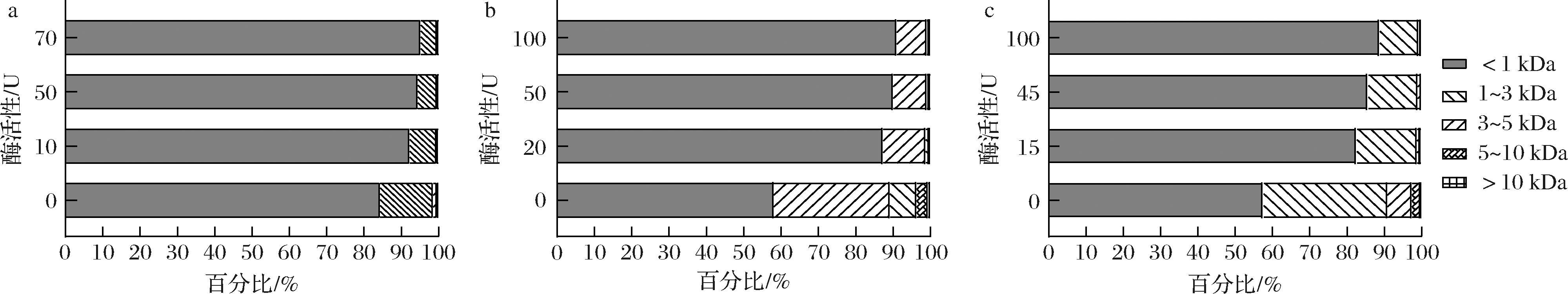
a-鸡源Ⅱ型胶原蛋白;b-鱼鳞来源胶原蛋白;c-牛源I型胶原蛋白
图5 优化ColVD021-Δ30的添加水解不同来源的胶原蛋白
Fig.5 Optimization of ColVD021-Δ30 for hydrolyzing collagen from different sources
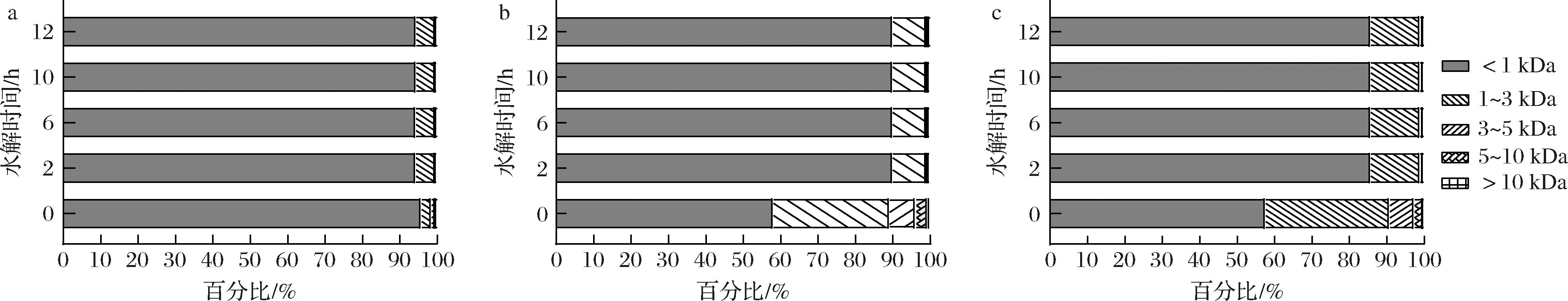
a-鸡源Ⅱ型胶原蛋白;b-鱼鳞来源胶原蛋白;c-牛源I型胶原蛋白
图6 优化ColVD021-Δ30的水解时间降解不同来源的胶原蛋白
Fig.6 Optimization of hydrolysis time for ColVD021-Δ30 in degrading collagen from different sources
为了考察上述制备的胶原蛋白水解酶在实际工业上复杂底物下的应用,向30 mL体系中加入4 g粉碎的鸡软骨中和120 U胶原蛋白水解酶,在降解过程中定时取样分析反应体系中胶原蛋白分子质量分布的变化情况。根据反应流程,如图7-a所示,在反应的初期,胶原蛋白水解的底物的分子质量迅速降低,之后逐渐趋于不变。大分子(分子质量>5 kDa)分布比例分别从3.02%降至0.5%,小分子(分子质量<1 kDa)比例分别从81.64%升高至98.01%,如图7-b所示。由此可见,胶原蛋白水解酶ColVD021-Δ30能将原始的农副产品鸡胸软骨中的胶原蛋白降解成低分子质量的胶原蛋白肽,且降解效果随着反应时间的延长产生小分子比例胶原蛋白比例越大。24 h后检测到小分子质量胶原蛋白含量为98.01%,具有巨大的工业生产前景。
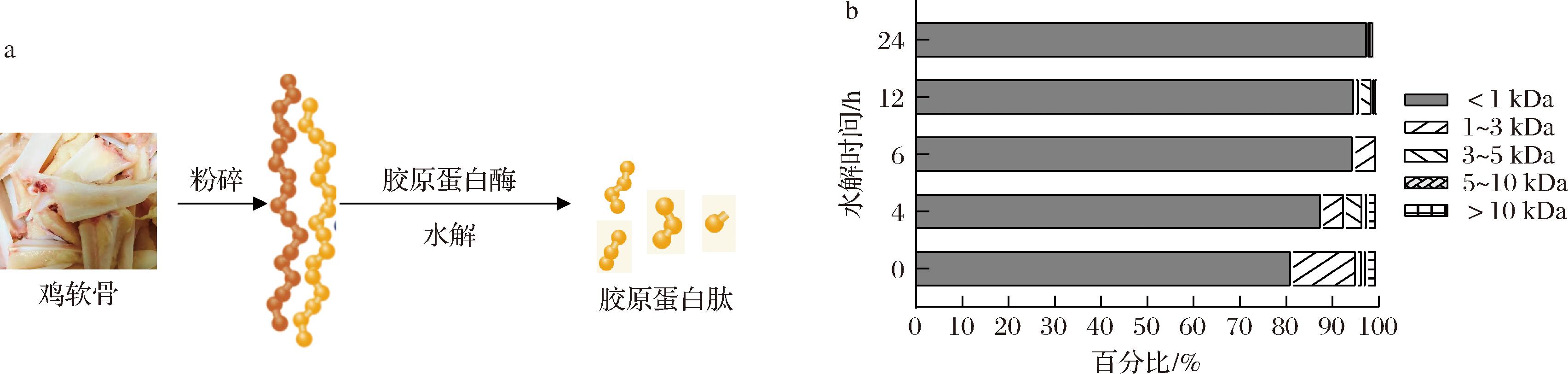
a-降解鸡软骨流程;b-降解鸡软骨的分子质量分布
图7 胶原蛋白水解酶ColVD021-Δ30降解鸡软骨及分子质量分布
Fig.7 Molecular weight analysis of collagenase ColVD021-Δ30 in hydrolyzing chicken cartilage
3 讨论和结论
与哺乳动物胶原蛋白水解酶相比,细菌胶原蛋白水酶具有广泛的特异性。动物来源的胶原蛋白水酶通常从鱼的内脏和其他动物中提取和纯化。尽管从鱼类加工废物中提取酶可以实现副产物的综合利用,但考虑成本因素时并不理想[16]。使用微生物来源的细菌胶原蛋白水解酶能够解决这一问题,因为其生产成本更低。然而,病原菌产生的胶原蛋白水解酶使用可能引起一些担忧,目前的市售微生物胶原蛋白水解酶来源于溶组织梭状芽孢杆菌,菌株的致病性限制了胶原酶在工业上的应用[17],尤其是在食品行业中,因此越来越多的其他微生物被探索作为胶原酶的替代来源。
本研究成功实现了蜡样芽孢杆菌来源的胶原蛋白水解酶ColVD021在大肠杆菌中的高效表达,并通过截短信号肽、诱导条件的优化以及添加Zn2+和Ca2+的组合,将酶活性显著提升。此外,通过对不同来源胶原蛋白水解条件的优化,确定了最适的反应pH和温度,进一步提高了酶的适用性。通过广泛的酶学特性测试,验证了ColVD021-Δ30对多种胶原蛋白的强水解能力,并明确了主要产物的分子质量分布。在工业应用方面,本研究将ColVD021-Δ30成功应用于降解农副产品中的鸡胸软骨,取得了显著的降解效果。经过粉碎和酶降解处理后,鸡胸软骨中的胶原蛋白降解为小分子胶原蛋白肽,含量高达98.01%。这一成果不仅为农副产品加工中胶原蛋白的高效利用提供了可行的技术途径,也为生产高品质胶原蛋白肽奠定了基础。总体而言,本研究的成功突破了胶原蛋白水解酶的高效表达和工业应用方面的难题,为胶原蛋白肽的生产提供了新的解决方案。这不仅有望促进农副产品加工业的可持续发展,同时也为胶原蛋白在医药、保健品等领域的广泛应用提供了有力支持。未来,基于本研究成果的技术或将在工业生产中迎来更为广泛的应用,推动相关领域的进一步研究和发展。
[1] DUARTE A S, CORREIA A, ESTEVES A C.Bacterial collagenases-A review[J].Critical Reviews in Microbiology, 2016, 42(1):106-126.
[2] GORDON M K, HAHN R A.Collagens[J].Cell and Tissue Research, 2010, 339(1):247-257.
[3] KARNA E, MILTYK W, WO CZY
CZY SKI S, et al.The potential mechanism for glutamine-induced collagen biosynthesis in cultured human skin fibroblasts[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2001, 130(1):23-32.
SKI S, et al.The potential mechanism for glutamine-induced collagen biosynthesis in cultured human skin fibroblasts[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2001, 130(1):23-32.
[4] 李诚, 肖岚, 付刚, 等.猪皮胶原蛋白抗氧化肽的分离纯化及体外抗氧化活性研究[J].食品工业科技, 2014, 35(15):95-100;106.
LI C, XIAO L, FU G, et al.Study on separation and purification of antioxidant peptide from pigskin collagen protein and antioxidant activity in vitro[J].Science and Technology of Food Industry, 2014, 35(15):95-100;106.
[5] SUPHATHARAPRATEEP W, CHEIRSILP B, JONGJAREONRAK A.Production and properties of two collagenases from bacteria and their application for collagen extraction[J].New Biotechnology, 2011, 28(6):649-655.
[6] 李东霞, 张庆, 殷翔, 等.胶原蛋白降解工艺及其应用研究概况[J].大连大学学报, 2008, 29(3):86-88;123.
LI D X, ZHANG Q, YIN X, et al.Research on method of waste hydrogenation catalyst cleaning oil treatment[J].Journal of Dalian University, 2008, 29(3):86-88;123.
[7] AZMIR J, ZAIDUL I S M, RAHMAN M M, et al.Techniques for extraction of bioactive compounds from plant materials:A review[J].Journal of Food Engineering, 2013, 117(4):426-436.
[8] TYREE B, SELTZER J L, HALME J, et al.The stoichiometric activation of human skin fibroblast pro-collagenase by factors present in human skin and rat uterus[J].Archives of Biochemistry and Biophysics, 1981, 208(2):440-443.
[9] NAZER D W, AL-SA’ED R M, SIEBEL M A.Reducing the environmental impact of the unhairing-liming process in the leather tanning industry[J].Journal of Cleaner Production, 2006, 14(1):65-74.
[10] GOHAR M, ØKSTAD O A, GILOIS N, et al.Two-dimensional electrophoresis analysis of the extracellular proteome of Bacillus cereus reveals the importance of the PlcR regulon[J].Proteomics, 2002, 2(6):784-791.
[11] 李陈, 吴琦, 陈惠.胶原蛋白酶活性的测定方法[J].中国皮革, 2008, 37(11):24-25;30.
LI C, WU Q, CHEN H.Determination methods of collagenase activity[J].China Leather, 2008, 37(11):24-25;30.
[12] ECKHARD U, SCHÖNAUER E, DUCKA P, et al.Biochemical characterization of the catalytic domains of three different Clostridial collagenases[J].Biological Chemistry, 2009, 390(1):11-18.
[13] ECKHARD U, SCHÖNAUER E, NÜSS D, et al.Structure of collagenase G reveals a chew-and-digest mechanism of bacterial collagenolysis[J].Nature Structural &Molecular Biology, 2011, 18(10):1109-1114.
[14] OHBAYASHI N, YAMAGATA N, GOTO M, et al.Enhancement of the structural stability of full-length Clostridial collagenase by calcium ions[J].Applied and Environmental Microbiology, 2012, 78(16):5839-5844.
[15] IKURA M.Calcium binding and conformational response in EF-hand proteins[J].Trends in Biochemical Sciences, 1996, 21(1):14-17.
[16] BIELAJEW B J, HU J C, ATHANASIOU K A.Collagen:Quantification, biomechanics, and role of minor subtypes in cartilage[J].Nature Reviews.Materials, 2020, 5(10):730-747.
[17] 肖寒, 刘秀妨, 郑淋, 等.溶组织梭状芽孢杆菌胶原蛋白酶的研究进展[J].食品科学, 2022, 43(17):316-325.
XIAO H, LIU X F, ZHENG L, et al.Recent advances in collagenase from Clostridium histolyticum[J].Food Science, 2022, 43(17):316-325.