幽门螺旋杆菌(Helicobacter pylori,Hp)是微需氧杆菌,长2~4 μm,宽0.5~1 μm,呈螺旋形,革兰氏阴性,定植于人体胃黏膜,经 WARREN 和 MARSHAL 分离鉴定得到[1]。据报道,全世界约有 50% 的人感染幽门螺旋杆菌[2],发展中国家的感染率更高,其中非洲的感染率最高,南非患病率为 87%,尼日利亚为 91%[3]。据相关统计,我国感染的人群高达 53.66%[4]。近年来,抗生素治疗导致幽门螺旋杆菌耐药菌株不断涌现,耐药细菌数量逐渐增加,导致抗生素治疗效果降低。世界卫生组织将耐药细菌和耐药基因的传播视为 21 世纪最严重的公共卫生威胁之一[5]。
沙棘(Hippophae rhamnoides L.)是胡颓子科沙棘属的一种落叶灌木或乔木[6],又被称醋柳、酸刺柳和黑刺柳,生长在亚洲、欧洲和北美洲的高海拔地区[7]。沙棘在中国的种植面积超过 200万hm2,广泛分布在青海、西藏、甘肃、宁夏、内蒙古、新疆、四川、云南、贵州、辽宁、吉林以及黑龙江等地。其中,西藏和青海是主要分布区。沙棘果实富含多种营养和活性成分,如多酚、类黄酮、多糖、维生素、类胡萝卜素等[8],这些活性成分在各种慢性疾病中具有潜在疗效,包括心血管疾病、癌症和炎症[9]。
多酚是沙棘果实中最丰富的活性物质之一,已被证明具有抗衰老[10]、抗氧化[11]以及抗肿瘤[12-13]等作用。COJOCARI[14]发现,沙棘果、玫瑰果、黑樱桃、葡萄和山楂对引起食物变质的病原微生物有抗菌作用,沙棘醇提物对单核增生李斯特菌的抑制作用最显著。WU等[15]的试验结果表明, 75%乙醇提取物的总酚含量最高,抗氧化活性最强,而 75%甘油提取物中芦丁、表没食子儿茶素和原儿茶酸含量最高。本课题组研究发现,沙棘提取物及活性物质对幽门螺旋杆菌有明显的抑制作用[16-17]。本试验对沙棘多酚进行提取纯化,并对其抑制幽门螺杆菌的效果及机理进行研究。
1 材料与方法
1.1 材料与试剂
沙棘(中国沙棘亚种,Hippophae rhamnoides L.),采摘于青海省海东市,海拔高度 3 000~3 300 m(36.37°N,102.27°E)。幽门螺旋杆菌 ATCC43504,购自商城北纳创联生物科技有限公司(菌种编号 BNCC339501)。
幽门螺旋杆菌培养基(固体),青岛海博生物技术有限公司;二甲基亚砜,天津富宇精细化工有限公司;脱纤维绵羊血,青岛海博生物技术有限公司;没食子酸标准品、(+)-儿茶素(catechin,C)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),纯度≥98%,购于北京索莱宝科技有限公司;AB-8大孔树脂,购于西陇科学股份有限公司。
1.2 仪器与设备
UV-1780紫外可见分光光度计,岛津仪器(苏州)有限公司;SPX-250F生化培养箱,宁波普朗特仪器有限公司;DGL-75B立式蒸汽灭菌锅,江苏登冠医疗器械有限公司;UltiMate3000傅里叶变换超高分辨液质联用仪、Varioskan LUX多功能酶标仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 沙棘前处理
沙棘经挑选,去除沙棘叶、沙棘树枝等杂质后,50 ℃干燥,粉碎过筛。称取适量沙棘果粉,按照料液比1∶10(g∶mL)用石油醚静置脱脂24 h,抽滤,待石油醚完全挥发后,置于50 ℃的烘箱进行干燥,得到沙棘脱脂粉末。
1.3.2 多酚含量的测定
称取20.0 mg没食子酸标准品,用蒸馏水配制成 1.0 mg/mL的标准溶液,依次配制成0、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.20 mg/mL的溶液,使用765 nm波长测定吸光度并绘制标准曲线[18]。
没食子酸标准曲线回归方程为:Y=3.684 2X+0.037 2 (R2=0.996 5),在0~0.20 mg/mL线性良好。
1.3.3 沙棘多酚提取
使用超声辅助乙醇法提取沙棘多酚,根据前期试验,提取工艺条件为:乙醇体积分数58.2%,超声时间28.8 min,超声温度60 ℃。提取后旋蒸冻干冷藏备用。
1.3.4 沙棘多酚粗提物纯化
沙棘多酚的纯化参考文献[19-20]的方法稍作修改,使用AB-8大孔吸附树脂静态吸附纯化,经多次试验选用较好的纯化参数为吸附时间3 h,解吸时间1 h,上样液pH=4,上样质量浓度为2 mg/mL,树脂与样品固液比1∶10(g∶mL),洗脱液乙醇体积分数为70%。
1.3.5 沙棘多酚组分分析
待测样液的制备:大孔树脂纯化后的样品溶液旋转蒸发至无液体残留,使用色谱级甲醇复溶,用0.22 μm滤膜过滤,得到样品溶液。
标准曲线的绘制:配制20 mg/mL标准品溶液,将5种标准品溶液梯度稀释为2 000、1 000、500、200、100、50、25 μg/mL 的混标溶液,用0.22 μm滤膜过滤。用傅里叶变换超高分辨液质联用仪进行分析。液相色谱条件:HypersilGOLDTMC18色谱柱(100 mm×2.1 mm,1.9 μm);流动相A:0.9%乙酸水,流动相B:甲醇;总流速:0.2 mL/min;梯度条件:0~9 min,20%~100% B;9~10 min,100% B;10~11 min,100%~20% B;11~14 min,20% B。柱温:35 ℃;进样量:5 μL。质谱条件:ESI离子源,对样品进行正、负离子切换扫描,采集一级和二级质谱数据。使用3.0kV喷雾电压(正负模式);辅助气体流量为10 L/min;鞘气流量为35 L/min;毛细管温度为320 ℃;扫描范围为200~600 m/z。
1.3.6 沙棘儿茶素类物质对幽门螺杆菌的体外抑菌效果
幽门螺杆菌的固体培养:按照幽门螺旋杆菌培养基(固体)说明配制固体培养基。使用2.5 L密闭培养盒和微需氧产气袋于恒温培养箱中37 ℃倒置培养 48~72 h。
幽门螺杆菌的液体培养:参照刘欣等[17]的方法稍作修改,将幽门螺杆菌菌种接种至含有6%(体积分数,下同)胎牛血清和少量抗生素的布氏肉汤培养基中,使用微需氧产气袋和 2.5 L密闭培养盒在37 ℃培养2~3 d。
抑菌圈试验:采用滤纸片法测定儿茶素类物质的抑菌效果[21]。取100 μL菌悬液均匀涂布于幽门螺旋杆菌固体培养基表面,室温静置20 min至培养基表面微干。用镊子将直径为6 mm的空白药敏纸片浸入样品溶液中,各样品质量浓度为20 mg/mL。将滤纸片等距离地置于平板上,倒置于密闭培养箱内,37 ℃恒温培养48 h,观察是否有抑菌圈,并用游标卡尺十字交叉法测量抑菌圈以表示抑菌敏感性。
最小抑菌浓度(minimal inhibit concentration,MIC)的测定:采用肉汤微量稀释法测定儿茶素类物质的MIC[22]。在 96 孔板中用布氏肉汤培养基将20 mg/mL的儿茶素母液分别稀释至10、5、2.5、1.25、0.625、0.312 5、0.156 3、0.078 mg/mL,取50 μL菌悬液加入到96孔板的各孔中,使每孔的最终体积为150 μL,以不添加儿茶素标准品溶液的菌悬液作为空白对照。混匀后置于密闭培养箱内,37 ℃静置培养48 h后观察,将96孔板中无浑浊现象的第一个孔浓度视为MIC。
细菌抑制率的测定:将含有抑菌效果最好的EGC和EGCG(0、1/4 MIC、1/2 MIC、1 MIC、2 MIC和4 MIC)的培养基与幽门螺旋杆菌在96孔板中混合,置于37 ℃恒温密闭培养箱中培养,48 h后于600 nm处测定吸光度,由公式(1)计算细菌抑制率:
细菌抑制率![]()
(1)
式中:A0为空白组吸光度;A1为试验组吸光度。
1.3.7 沙棘儿茶素类物质对幽门螺杆菌体外抑菌机理
将抑菌效果最好的EGC和EGCG用于抑菌机制的研究。
细胞膜通透性的测定:以N-苯基-1-萘胺(N-phenyl-1-naphthylamine,NPN)作为荧光指示剂测定儿茶素类物质对幽门螺旋杆菌细胞外膜的影响。在菌悬液中加入儿茶素类物质至终浓度分别为0、1/4 MIC、1/2 MIC、1 MIC、2 MIC和4 MIC,加入20 μL NPN 荧光剂于37 ℃培养 1 h后,在酶标仪中检测其荧光强度。激发波长为 350 nm,发射波长为 430 nm。
细胞内容物泄露的测定:向含有幽门螺旋杆菌的培养基中加入儿茶素类物质,使其终浓度分别为0、1/4 MIC、1/2 MIC、MIC、2 MIC和4 MIC,置于37 ℃的恒温培养箱中培养 12 h。分别取不同处理组的菌液,离心取上清液于酶标仪中,分别测定260 nm和280 nm处的吸光度,确定幽门螺旋杆菌细胞核酸和蛋白质泄漏情况[23]。
细胞膜蛋白的测定:将幽门螺旋杆菌培养48 h,5 000 r/min离心10 min,用PBS洗涤 3 次,制成菌悬液。将菌液与不同浓度的KI溶液(0、0.5、1.0、1.5、2.0、2.5 mol/L)和儿茶素类物质(0、1/4 MIC、1/2 MIC、1 MIC、2 MIC和4 MIC)混合,置于37 ℃的恒温培养箱中孵育1 h,在280 nm和296 nm处测定细菌的荧光发光值[16]。
脲酶活力的测定:将幽门螺旋杆菌培养48 h,用PBS制成菌悬液。将菌液与不同浓度的儿茶素类物质(0、1/4 MIC、1/2 MIC、1 MIC、2 MIC和4 MIC)混合,37 ℃培养2 h后加入1.5 %尿素、0.1% EDTA与0.02%甲酚红混合溶液,37 ℃孵育20 min,在590 nm处测定吸光度。
1.4 数据处理
采用SPSS 27.0进行统计学分析,采用Origin 2022作图,采用Design-Expert 13进行响应面分析。所有试验重复3次,数据均以“平均值±标准差”形式表示。
2 结果与分析
2.1 沙棘提取物多酚物质组分分析
通过对比样品中儿茶素类化合物与标准品的保留时间,定性确定化合物种类,根据标准品和样品峰面积,计算含量,结果见表1。由表1可知,经大孔树脂纯化后,4 种儿茶素类物质的含量分别为97.97、291.10、19.31、32.50 μg/mL,除ECG含量略有下降外,其他3种儿茶素含量均有不同程度的增加,C增加了 63.91 %,EGC增加了71.63 %,EGCG是纯化前的10.45倍,ECG含量有所下降,仅为纯化前的0.86倍。马贺等[16]研究结果显示,沙棘乙酸乙酯提取物中不含有儿茶素,吕恒慧[24]在沙棘醇提成分中鉴定到儿茶素类物质,说明提取方法对沙棘提取物中的多酚类儿茶素物质含量有较大影响。
表1 沙棘多酚提取液中儿茶素类物质的含量
Table 1 The content of catechins in seabuckthorn polyphenol extract

物质分子式分子量/(g/mol)保留时间/min标准曲线纯化前/(μg/mL)纯化后/(μg/mL)CC15H14O6290.271.59Y=47 829X+1 000 000(R2=0.996 7)59.7797.97EGCC15H14O7306.271.45Y=17 498X-366 438(R2=0.996 8)169.61291.10ECGC22H18O10442.377.41Y=15 181X+232 596(R2=0.999 8)22.4219.31EGCGC22H18O11458.3810.93Y=9 124.1X(R2=0.999 8)3.1132.50
2.2 沙棘儿茶素类物质体外抑菌活性的测定结果
2.2.1 抑菌圈的测定结果
抑菌试验结果见表2。
表2 抑菌圈直径的测定
Table 2 Determination of inhibition zone diameter
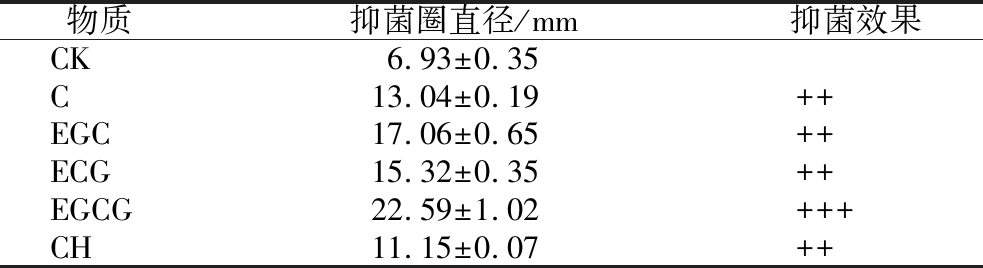
注:CK为空白对照,CH为沙棘多酚提取物样品;抑菌圈<10 mm为轻度抑菌,记录为“+”;抑菌圈直径 10~20 mm 为中度抑菌,记录为“++”;抑菌圈直径>20 mm为高度抑菌,记录为“+++”。
物质抑菌圈直径/mm抑菌效果CK6.93±0.35C13.04±0.19++EGC17.06±0.65++ECG15.32±0.35++EGCG22.59±1.02+++CH11.15±0.07++
由表2可知,除空白对照组外,各种儿茶素类物质处理组均有抑菌圈出现,与CH组相比,4种儿茶素类物质的抑菌圈更大,该结果表明儿茶素类物质有良好的抑菌活性。与其他 4 种物质相比,添加EGCG处理的幽门螺旋杆菌平板抑菌圈最大,为22.59 mm,表现出最强的抑菌活性。龙蕥倩[25]研究发现,橘皮提取物可通过影响金黄色葡萄球菌的细胞壁、细胞膜的完整性和通透性,进而影响细菌的正常生命周期;周浓等[26]的研究表明,番石榴多酚对大肠杆菌、枯草芽孢杆菌等具有较好的抑菌活性;陈小敏等[27]的研究表明,EGCG对金黄色葡萄球菌和沙门氏菌具有体外抑菌效果。
2.2.2 最小抑菌浓度测定结果
最小抑菌浓度的测定结果见表3。
表3 最小抑菌浓度的确定
Table 3 Determination of minimum inhibitory concentration
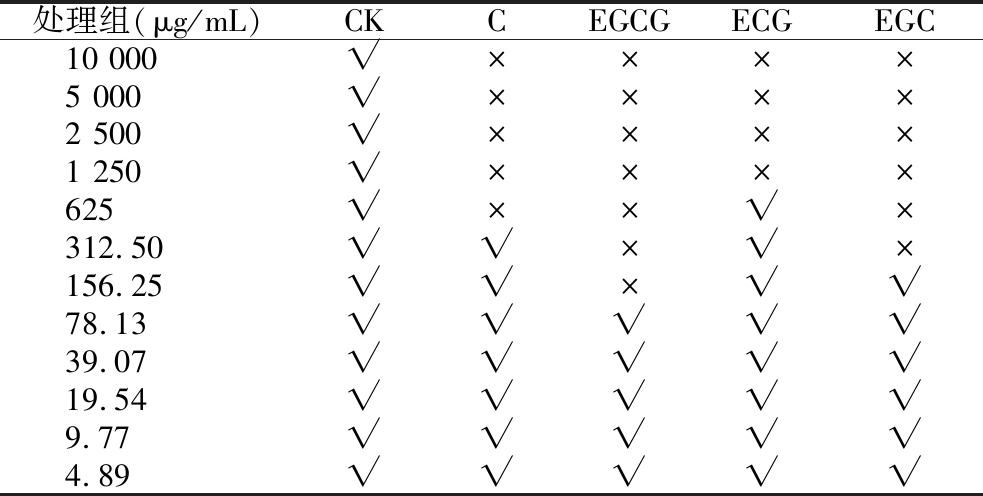
注:“√”表示呈肉眼可见的浑浊;“×”表示无明显浑浊。
处理组(μg/mL)CKCEGCGECGEGC10 000√××××5 000√××××2 500√××××1 250√××××625√××√×312.50√√×√×156.25√√×√√78.13√√√√√39.07√√√√√19.54√√√√√9.77√√√√√4.89√√√√√
由表3可知,C、EGC、ECG、EGCG的最小抑菌浓度分别为0.625、0.625、0.156 25、1.25、0.312 5 mg/mL。5种儿茶素类物质对幽门螺旋杆菌抑菌活性大小依次为:EGCG>EGC>C>ECG。MIC试验结果表明,EGC和EGCG的抑菌活性最高,与抑菌圈试验的结果基本一致。NOORI等[28]的研究也表明儿茶素类物质与幽门螺杆菌的相关靶点有较强的结合活性。因此,选用EGC和EGCG进行后续研究。
2.2.3 细菌抑制率的测定结果
将沙棘儿茶素类物质ECG和EGCG用于细菌抑制率的测定,结果如图1所示。
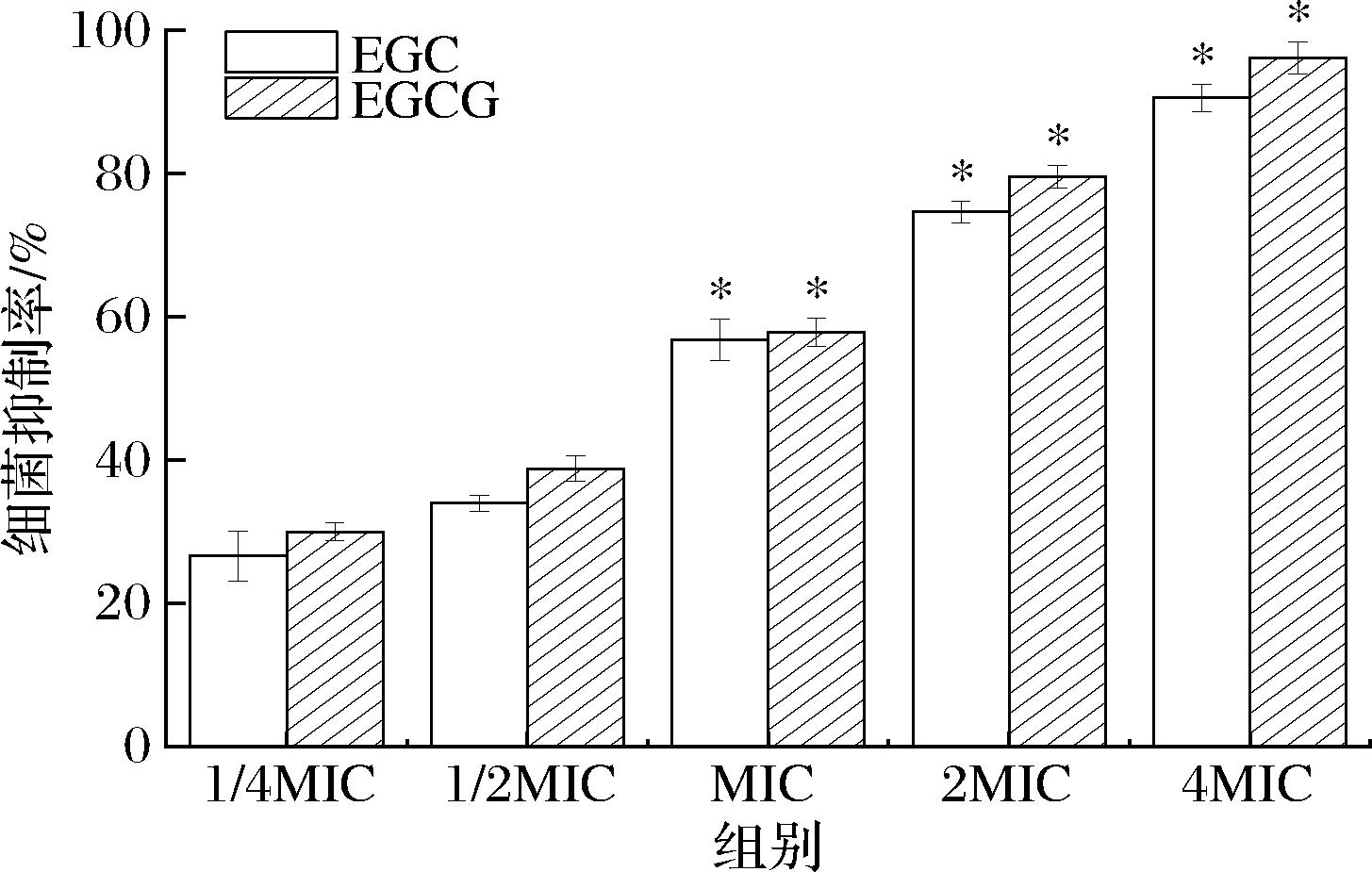
图1 细菌抑制率的测定
Fig.1 Determination of bacterial inhibition rate
注:*表示差异显著(P<0.05)(下同)。
由图1可知,EGC和EGCG对幽门螺旋杆菌的抑制率随着浓度的增大而增大。与1/4 MIC处理组相比,MIC、2 MIC、4 MIC处理组对幽门螺旋杆菌的抑制率明显增加(P<0.05),且抑菌率均在50%以上。
2.3 沙棘儿茶素类物质体外抑菌机理研究结果
2.3.1 对细胞膜通透性的影响
沙棘儿茶素类物质EGC和EGCG对细胞膜通透性的影响如图2 所示。
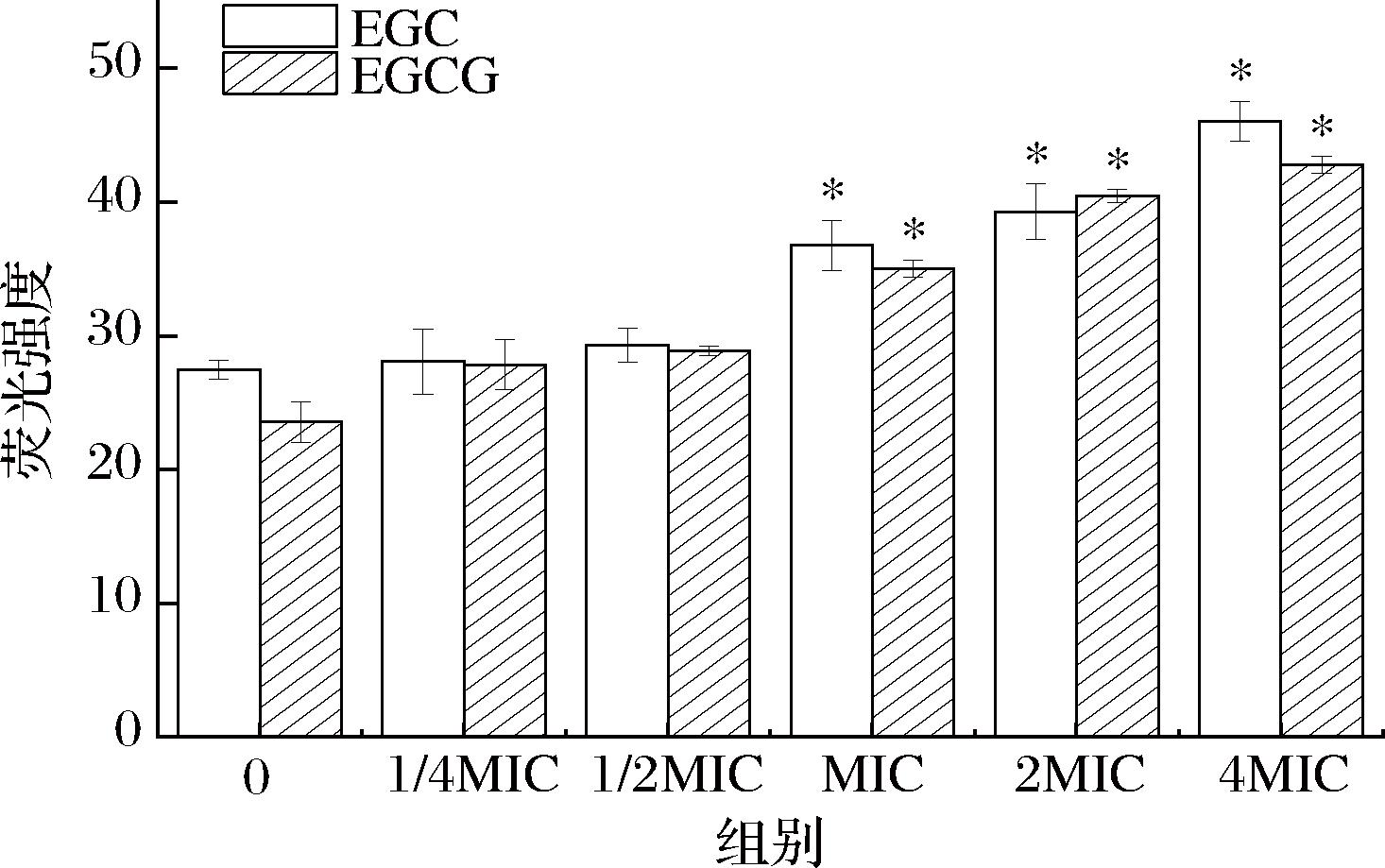
图2 细胞外膜渗透率的测定
Fig.2 Determination of cell outer membrane permeability
由图2可知,细胞外膜荧光强度随浓度增大逐渐增强,呈剂量依赖性。与空白处理组相比,MIC、2 MIC、4 MIC处理组幽门螺旋杆菌细胞外膜荧光强度明显增强(P<0.05)。ESCAND N等[29]研究表明,儿茶素发挥抗菌作用的一种可能机制是通过靶向磷脂来扰乱细胞膜。王瑞飞[30]研究发现EGCG可以与细菌细胞膜蛋白特异性结合,通过其分子的疏水性干扰细胞膜磷脂双分子层的流动性损伤细胞膜。据此推测EGC、EGCG处理可通过破坏细胞外膜,使其通透性增加,从而达到抑菌效果。
N等[29]研究表明,儿茶素发挥抗菌作用的一种可能机制是通过靶向磷脂来扰乱细胞膜。王瑞飞[30]研究发现EGCG可以与细菌细胞膜蛋白特异性结合,通过其分子的疏水性干扰细胞膜磷脂双分子层的流动性损伤细胞膜。据此推测EGC、EGCG处理可通过破坏细胞外膜,使其通透性增加,从而达到抑菌效果。
2.3.2 对细胞内容物泄露的影响
沙棘儿茶素类物质EGC和EGCG对细胞内容物泄露的影响如图3所示。
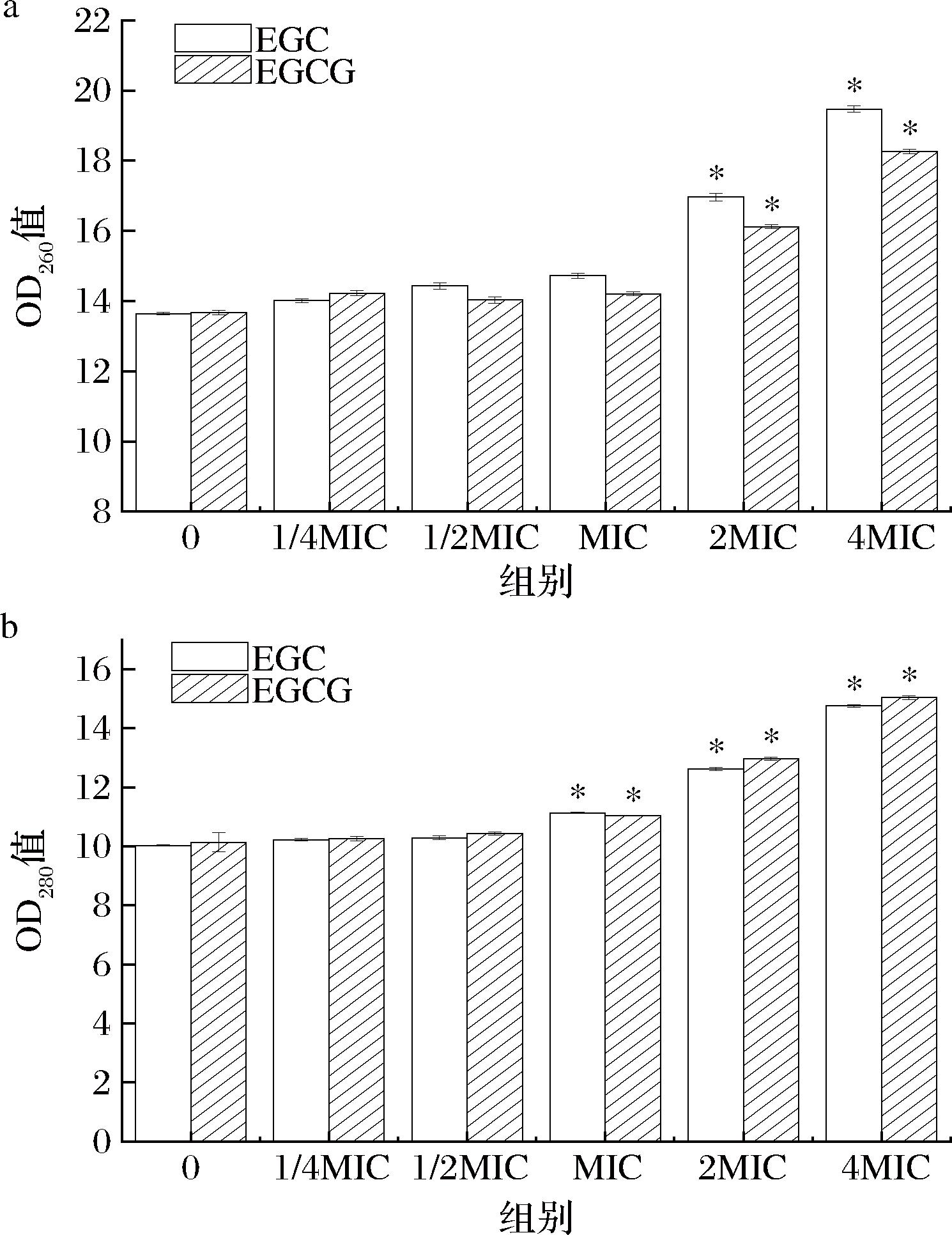
a-核酸泄漏情况;b-蛋白质泄漏情况
图3 细胞内容物泄漏的测定
Fig.3 Determination of cell contents leakage
由图3可知,核酸(图3-a)和蛋白质(图3-b)的浓度随着处理组浓度的增大逐渐增大。与空白处理组相比,2 MIC和4 MIC处理组核酸和蛋白质泄漏量明显增加(P<0.05)。杨蕊嘉[31]研究发现苹果黄酮中的山奈酚可能通过改变细胞膜通透性,使细胞内的大分子小分子溢出,发挥抑制幽门螺杆菌活性的作用。推测经EGC和EGCG处理后,幽门螺旋杆菌菌体细胞壁和细胞膜等结构受到破坏,细胞内的核酸和蛋白质等大分子流出[32]。
2.3.3 对细胞膜蛋白的影响
沙棘儿茶素类物质EGC和EGCG对细胞膜蛋白的影响如图4所示。
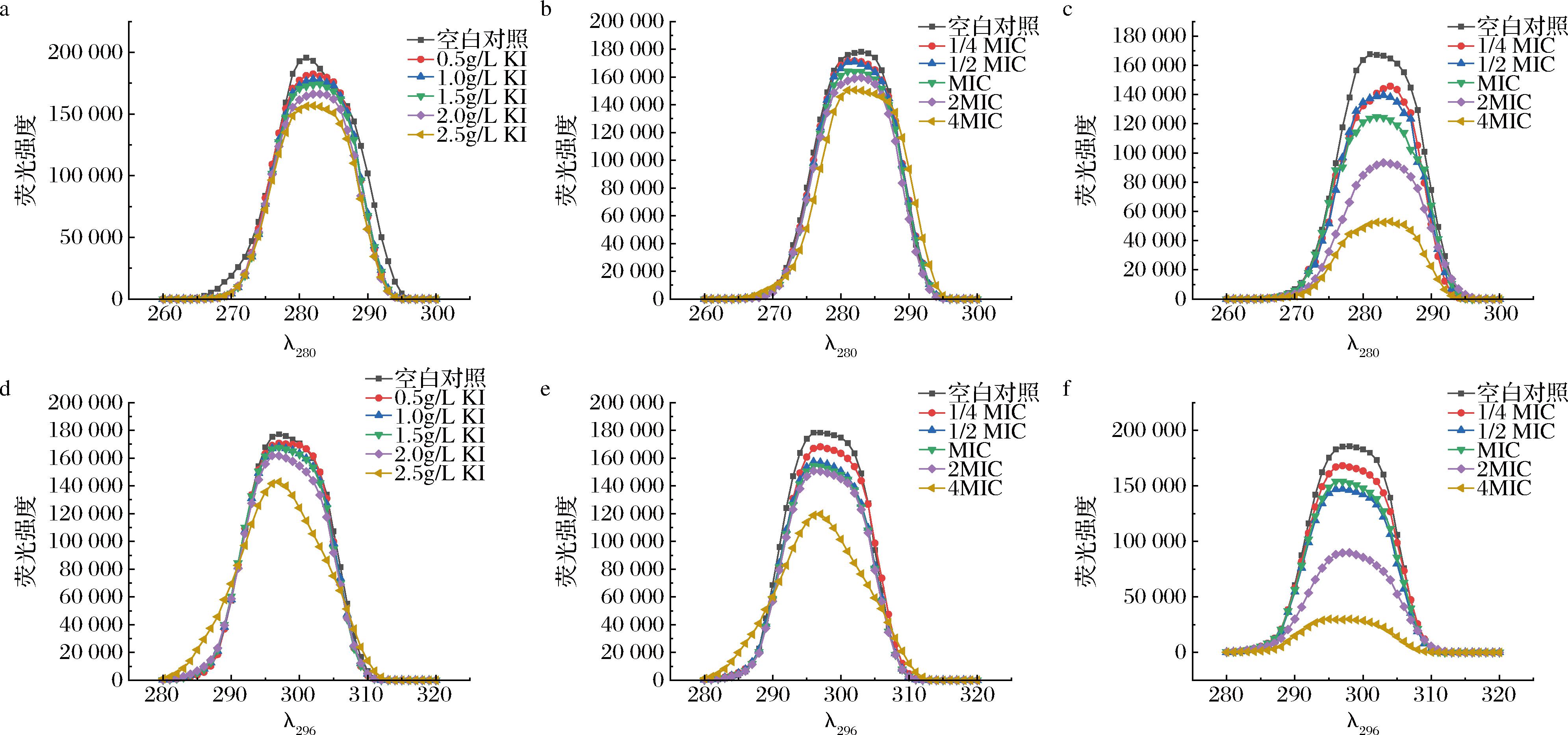
a~c-KI、EGC、EGCG对280 nm处色氨酸残基荧光光谱的影响;d~f-KI、EGC、EGCG对296 nm处酪氨酸残基荧光光谱的影响
图4 细胞膜蛋白荧光光谱
Fig.4 Fluorescence spectra of cell membrane proteins
色氨酸(Trp)和酪氨酸(Tyr)等氨基酸残基是膜蛋白中主要的荧光载体,KI可淬灭膜蛋白表面残基荧光[15]。如图4-a和图4-d所示,KI 含量的增加对Trp和Tyr残基没有明显的猝灭作用,表明Trp和Tyr残基主要位于膜内。EGC和EGCG对固定激发波长分别为 280 nm和 296 nm 的Trp和Tyr残基荧光发射光谱的影响分别如图4-b、4-e、4-c、4-f 所示,EGC和EGCG可以猝灭氨基酸残基的荧光强度,随着浓度的增加,色氨酸和酪氨酸残基的荧光逐渐降低。推测EGC和EGCG与幽门螺旋杆菌细胞膜或细胞壁上的蛋白相互作用,改变膜蛋白的构象,氨基酸残基的位置从细胞膜内改变到细胞膜外,从而使更多的儿茶素类物质与色氨酸和酪氨酸接触,猝灭了色氨酸和酪氨酸残基的荧光强度。
2.3.4 对细胞脲酶活性的影响
沙棘儿茶素类物质EGC和EGCG对细胞脲酶活力的影响如图5所示。
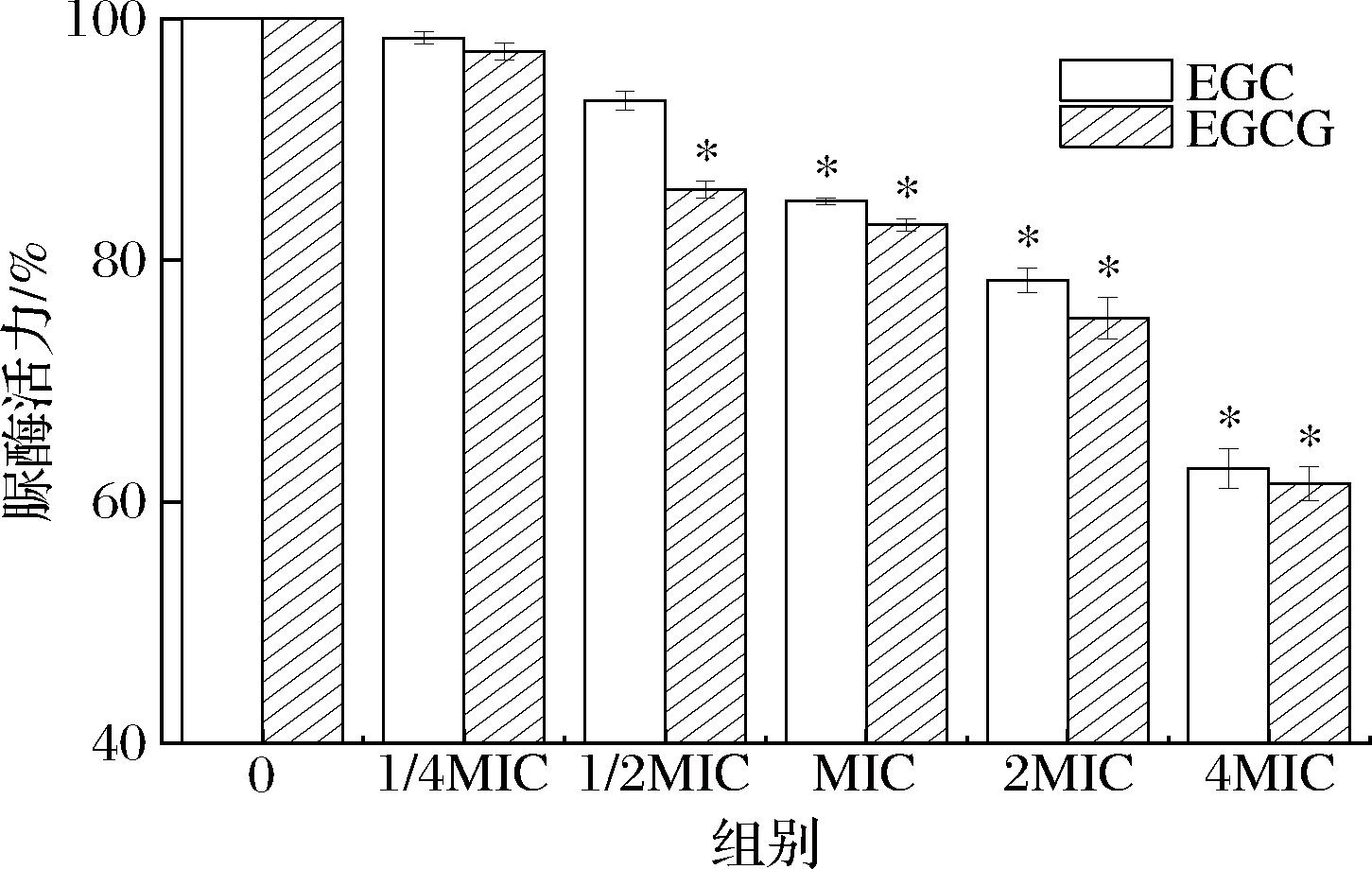
图5 脲酶活力的测定
Fig.5 Determination of urease activity
幽门螺旋杆菌较强的脲酶活力使其能够通过产生氨类物质抵御胃部酸性环境,并对胃黏膜造成损伤[33]。醇、酚和酮基团,可与各种氨基酸形成氢键和离子键,这些相互作用可以有效地与蛋白质的结合位点结合,导致其3D形状被破坏,从而导致活性抑制[34]。NOORI等[28]通过计算机模拟发现儿茶素可能通过靶向抑制莽草酸途径中的DAH 7 PS酶抑制蛋白质的产生,并抑制幽门螺杆菌生长和毒力。由图5可知,幽门螺旋杆菌的脲酶活力随着处理浓度的增大呈现下降趋势。与空白处理组相比,MIC、2 MIC、4 MIC处理组幽门螺旋杆菌的脲酶活力明显下降(P<0.05)。其中,4 MIC处理组的脲酶活力仅为空白对照组的 0.6 倍。这表明EGC和EGCG可能通过破坏蛋白质构象抑制脲酶活力来抑制幽门螺杆菌。
3 结论
本研究表明以儿茶素类物质为主的沙棘多酚化合物对幽门螺旋杆菌具有较强的抑菌活性,沙棘多酚类化合物可以增加该菌细胞外膜通透性、破坏细胞膜造成大分子泄露、改变膜蛋白构象、抑制脲酶活力,从而抑制幽门螺旋杆菌的生长,对幽门螺杆菌产生抑制效果,该研究结果为沙棘抑制幽门螺旋杆菌产品的开发提供了数据,为沙棘活性物质开发开辟了新的研究途径。
[1] MLADENOVA I. Gastric Cancer and Helicobacter pylori[M]//Gastrointestinal Cancers: An Interdisciplinary Approach. Cham: Springer Nature Switzerland, 2022:133-149.
[2] ZAVROS Y, MERCHANT J L.The immune microenvironment in gastric adenocarcinoma[J].Nature Reviews Gastroenterology &Hepatology, 2022, 19(7):451-467.
[3] VALENZUELA-HORMAZABAL P, ![]() R V, ALEGR
R V, ALEGR A-ARCOS M, et al. Unveiling novel urease inhibitors for Helicobacter pylori: A multi-methodological approach from virtual screening and ADME to molecular dynamics simulations[J]. International Journal of Molecular Sciences, 2024, 25(4):1968.
A-ARCOS M, et al. Unveiling novel urease inhibitors for Helicobacter pylori: A multi-methodological approach from virtual screening and ADME to molecular dynamics simulations[J]. International Journal of Molecular Sciences, 2024, 25(4):1968.
[4] 许艺飞, 江伟雯, 邝兆进, 等. 胃疡宁丸体内外抗幽门螺杆菌的实验研究[J]. 中药新药与临床药理, 2014, 25(5):572-576.XU Y F, JIANG W W, KUANG Z J, et al. Antimicrobial activities of weiyangning pills against Helicobacter pylori in vivo and in vitro[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2014, 25(5):572-576.
[5] LAN M J, WENG M F, LIN Z Y, et al.Metabolomic analysis of antimicrobial mechanism of polysaccharides from Sparassis crispa based on HPLC-Q-TOF/MS[J].Carbohydrate Research, 2021, 503:108299-108299.
[6] 王玉净, 都治香, 张霞, 等.沙棘黄酮通过调控 TLR4/NF-κB 信号通路改善大鼠多囊卵巢综合征的作用[J].食品工业科技, 2024, 45(16):340-347.WANG Y J, DU Z X, ZHANG X, et al.Effect of Hippophae rhamnoides flavone on improving polycystic ovarian syndrome in rats by regulating TLR4/NF-κB[J].Science and Technology of Food Industry, 2024, 45(16):340-347.
[7] WANG R Q, WANG X J, LIU Z H, et al.Comparative chloroplast genome analysis of four Hippophae rhamnoides subspecies and its phylogenetic analysis[J].Genetic Resources and Crop Evolution, 2024, 71(6):2557-2571
[8] MEI D, MA X J, FU F F, et al.Research status and development prospects of sea buckthorn(Hippophae rhamnoides L.) resources in China[J].Forests, 2023, 14(12):2461-2462.
[9] CHAUHAN U, CHAUHAN E S.Review on nutritional composition, bioactive compounds and therapeutic properties of Hippophae rhamnoides L.(Sea Buckthorn)[J].International Journal of Health Sciences, 2022, 6(S3):11620-11632.
[10] LIU L M, GUO P S, WANG P X, et al.The review of anti-aging mechanism of polyphenols on Caenorhabditis elegans[J].Frontiers in Bioengineering and Biotechnology, 2021, 9(1):635768.
[11] ORSAVOV J, JURIKOV
J, JURIKOV T,
T, ![]() R, et al.Total phenolic and total flavonoid content, individual phenolic compounds and antioxidant activity in sweet rowanberry cultivars[J].Antioxidants, 2023, 12(4):913-914.
R, et al.Total phenolic and total flavonoid content, individual phenolic compounds and antioxidant activity in sweet rowanberry cultivars[J].Antioxidants, 2023, 12(4):913-914.
[12] ZHANG Y S, GU J R, WANG Y, et al.The anti-tumor activity and critical active compounds of polyphenols from Chinese dwarf cherry (Cerasus humilis)[J].Journal of Berry Research, 2023, 13(3):211-225.
[13] 崔米米. 沙棘果结合态多酚抗结肠癌效应的活性成分及分子机制[D].太原:山西大学, 2020.CUI M M.The anti-colon cancer active components and molecular mechanism of bound polyphenols from seabuckthorn berries[D].Taiyuan:Shanxi University, 2020.
[14] COJOCARI D.In vitro antibacterial effect of various berries on Listeria monocytogenes as food borne patogen[J].Agrobiodiversity for improving nutrition, health and life quality, 2022, 6(1):67-74.
[15] WU D, YANG Z H, LI J, et al.Optimizing the solvent selection of the ultrasound-assisted extraction of sea buckthorn (Hippophae rhamnoides L.) pomace:Phenolic profiles and antioxidant activity[J].Foods (Basel, Switzerland), 2024, 13(3):482-483.
[16] 马贺, 雷梅英, 王家娟, 等.沙棘乙酸乙酯萃取物化学成分分析及体外抑制幽门螺杆菌机理研究[J].食品与发酵工业, 2024, 50(5):59-66.MA H, LEI M Y, WANG J J, et al.Mechanism of Chemical components and anti-Helicobacter pylori sea buckthorn berries extract in vitro[J].Food and Fermentation Industries, 2024, 50(5):59-66.
[17] 刘欣, 常应九, 王树林, 等.沙棘提取物对幽门螺杆菌脲酶活性的抑制[J].食品与发酵工业, 2022, 48(3):85-91.LIU X, CHANG Y J, WANG S L, et al.Inhibition of Hippophae rhamnoides extracts on urease activity of Helicobacter pylori[J].Food and Fermentation Industries, 2022, 48(3):85-91.
[18] 吕佳玮, 王颉, 刘亚琼, 等.沙棘多酚提取纯化工艺研究[J].食品工业科技, 2021, 42(3):108-114.LU J W, WANG J, LIU Y Q, et al.Study on extraction and purification process of sea buckthorn polyphenols[J].Science and Technology of Food Industry, 2021, 42(3):108-114.
[19] 许欢欢, 苗春霖, 宋颖, 等.大孔树脂纯化核桃分心木多酚及其组分鉴定[J].食品研究与开发, 2023, 44(24):144-150.XU H H, MIAO C L, SONG Y, et al.Macroporous resin purification of Diaphragma juglandis Fructus polyphenols and components analysis[J].Food Research and Development, 2023, 44(24):144-150.
[20] 王娜, 郑玉茹, 徐超, 等.花生红衣原花青素纯化工艺及其对乳糜泻细胞模型的影响[J].中国食品学报, 2023, 23(12):167-178.WANG N, ZHENG Y R, XU C, et al.Purification technology of peanut red procyanidins and its effect on celiac disease cell model[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(12):167-178.
[21] 陈长毅. 合欢荚果提取物的抑菌作用研究[J].现代食品科技, 2013, 29(2):274-276;310.CHEN C Y.Study on the bacteriostasis of the extracts from legume of Albizzia julibrissn durazz[J].Modern Food Science and Technology, 2013, 29(2):274-276;310.
[22] 廖思晨. 原儿茶醛对藤黄微球菌和单核细胞增生李斯特氏菌抗菌机理及其应用的研究[D].西安:陕西科技大学, 2023.LIAO S C.Study on the antibacterial mechanism and the application of protocatechualdehyde against Micrococcus and Listeria monocytogenes[D].Xi’an:Shaanxi University of Science &Technology, 2023.
[23] 吴文慧,田雨纯,牛吉祥, 等.牡丹皮乙醇提取物对黄瓜枯萎病菌的活性抑制及作用机制[J].现代农药,2023,22(6):78-82.WU W H, TIAN W C, NIU J X, et al.Inhibitory activity and mechanism of ethanol extract of moutan bark on Fusarium oxysporum f.sp.cucumerinum causing fusarium wilt of cucumber[J].Modern Agrochemicals, 2023, 22(6):78-82.
[24] 吕恒慧. 沙棘果中活性物质的提取及其对心脏保护作用的研究[D].济南:山东师范大学,2016.LYU H H.Study of bioactive components extracted from sea buckthorn and cardiac protective effect on hearts[D].Jinan:Shandong Normal University, 2016.
[25] 龙蕥倩,邓雨荷,刘瑞秀,等. 不同橘皮提取物对S.aureus和E.coli的抑菌活性对比研究及其抗菌机制初探[J].应用化工, 2024, 53(12), 1-6.LONG Y Q, PENG Y H, LIU R X,et al.Comparative study on the antibacterial activity of different orange peel extract against Staphylococcus aureus and Escherichia coli and preliminary exploration of their antibacterial mechanisms[J].Applied Chemical Industry, 2024, 53(12):2822-2825.
[26] 周浓, 莫日坚, 黄秋艳, 等.番石榴多酚的提取纯化及其抑菌活性研究[J].食品与发酵工业, 2020, 46(14):182-188.ZHOU N, MO R J,HUANG Q Y, et al.Study on extraction and purification of guava polyphenols and its antibacterial activity[J].Food and Fermentation Industries, 2020, 46(14):182-188.
[27] 陈小敏, 黄泽璇,谭礼浩,等.表没食子儿茶素没食子酸酯对食源性致病菌抑菌机理及应用研究[J].食品与机械, 2024, 40(8):127-134.CHEN X M, HUANG Z X, TAN L H, et al.Study on the inhibitory mechanism of epigallocatechin gallate against foodborne pathogens and its application[J].Food &Machinery, 2024, 40(8):127-134.
[28] NOORI GOODARZI N, KHAZANI ASFOROSHANI M, SHAHBAZI B, et al.Identification of novel drug targets for Helicobacter pylori:Structure-based virtual screening of potential inhibitors against DAH7PS protein involved in the shikimate pathway[J].Frontiers in Bioinformatics, 2024, 18(4):1482338-1482338.
[29] ESCAND N R A, DEL CAMPOM, L
N R A, DEL CAMPOM, L PEZ-SOLIS R, et al.Antibacterial effect of kaempferol and (-)-epicatechin on Helicobacter pylori[J].European Food Research and Technology, 2016, 242(9):1495-1502.
PEZ-SOLIS R, et al.Antibacterial effect of kaempferol and (-)-epicatechin on Helicobacter pylori[J].European Food Research and Technology, 2016, 242(9):1495-1502.
[30] 王睿飞. 曲酸和茶多酚的协同抑菌机理及其在冷鲜水产品中的应用[D].广州:华南理工大学, 2021.WANG R F.Synergistic antibacterial mechanism of kojic acid and tea polyphenols in combination and their application on chilled aquatic products[D].Guangzhou:South China University of Technology, 2021.
[31] 杨蕊嘉. 苹果类黄酮抑制胃幽门螺旋杆菌的活性研究[D].杨凌:西北农林科技大学, 2021.YANG R J.Inhibition activity of Malus flavonoids to Helicobacter Pylori[D].Yangling:Northwest A&F University, 2021.
[32] 吴科惠, 吕曼婷, 刘锋, 等.白术、酸枣仁提取物对金黄色葡萄球菌的抑菌效果研究[J].饲料工业, 2024:45(7):93-99.WU K H, LU M T LIU F, et al.Study on antibacterial activity of extracts from Rhizoma atractylodis macrocephalae and Semen ziziphi spinosae against Staphylococcus aureus[J].Feed Industry, 2024, 45(7):93-99.
[33] 常应九. 沙棘提取物对胃肠微生物影响的研究[D].西宁:青海大学, 2020.CHANG Y J.Study on the effect of Hippophae rhamnoides Linn.extract on gastrointestinal microorganism[D].Xining:Qinghai University, 2020.
[34] AYOUB I M, ABDEL-AZIZ M M, ELHADY S S, et al.Valorization of Pimenta racemosa essential oils and extracts:GC-MS and LC-MS phytochemical profiling and evaluation of Helicobacter pylori inhibitory activity[J].Molecules, 2022, 27(22):7695-7695.