黄曲霉(Aspergillus flavus)是污染香辛料、坚果和谷物作物等农产品的重要物种之一[1],其分泌的黄曲霉毒素具有强烈的致癌性、致突变性、致畸性和免疫抑制等危害[2]。黄曲霉毒素B1(aflatoxin B1, AFB1)作为毒性最强的黄曲霉毒素类型,已被国际癌症研究机构(International Agency for Research on Cancer, IARC)列为人类Ⅰ类致癌物[3]。因此,全球有100多个国家制定了食品中黄曲霉毒素的最大限量标准[3]。尽管黄曲霉毒素相关研究已有60年历史,然而,全球每年仍有约25%粮食遭受黄曲霉和黄曲霉毒素污染[4],并且约有20亿人毫无防备摄入远高于欧洲标准(4 ppb)的黄曲霉毒素[5]。因此,关于农产品中黄曲霉和黄曲霉毒素污染防控研究仍在继续。
目前对食品中黄曲霉及黄曲霉毒素进行防控的方法主要有三类:化学方法、生物方法和物理方法,联合防控方法是使用2种或3种方法。常规化学杀菌剂或熏蒸剂使用,可能存在化学物质残留、环境污染以及耐药性问题[6]。以芽孢杆菌[7]、乳酸菌[8]和酵母菌[9]为主的生物防治方法,防治效果容易受到环境条件的影响,因此在应用上受到限制。物理方法,例如伽马辐射、低温等离子体以及最近兴起LED可见光处理技术,因其无污染、低成本、安全(低辐射)等优点受到越来越多的关注。与其他LED光源相比,蓝光显示出了较强的抗菌活性。据报道,蓝光除了可以抑制细菌的生长和存活[10],还影响真菌(念珠菌)的菌丝发育[11]。此外,LED蓝光被证实可以用于防控苹果中扩展青霉引起的腐败[12]。然而,目前关于蓝光对黄曲霉抑制作用及其机制研究却十分有限。中国和匈牙利作为最大的干红辣椒生产和消费国之一,干红辣椒中的黄曲霉毒素污染问题也逐渐受到关注[13]。
本文旨在探讨LED蓝光是否可以作为防控干辣椒中黄曲霉及其毒素污染的潜在工具。具体研究包括:蓝光对黄曲霉孢子萌发、菌丝生长、黄曲霉毒素产生的抑制作用;蓝光对黄曲霉微观结构、细胞膜损伤、细胞渗透、氧化损伤、氧化应激的影响;蓝光在干红辣椒黄曲霉污染上的应用研究。
1 材料与方法
1.1 试剂和菌株
碘化丙啶(propidium iodide, PI)染料、2,7-二氯二氢荧光素(2,7-dichlorodihydrofluorescein diacetate, DCFH-DA)荧光染料、DPPH、ABTS,上海麦克林生化科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)活力检测试剂盒、过氧化氢酶(catalase, CAT)活力检测试剂盒、还原型谷胱甘肽(glutathione, GSH)检测试剂盒,上海索莱宝科技有限公司;总酚含量(total phenols content, TPC)试剂盒,苏州格锐思生物科技有限公司;黄曲霉毒素B1(aflatoxin B1, AFB1)标准对照品,中国食品药品检定研究院;黄曲霉毒素总量免疫亲和柱,青岛普瑞邦生物工程有限公司。
黄曲霉(Aspergillus flavus)CICC 2219,中国工业微生物菌种保藏管理中心提供。
1.2 仪器与设备
LED蓝光灯(460±5) nm,深圳市绿恒照明科技有限公司;Agilent 1290高效液相色谱仪,美国Agient公司;Phenom Pro扫描电子显微镜,荷兰飞纳制造公司;BX53荧光正置显微镜,日本OLYMPUS公司;DDSJ-308F电导率仪,上海仪电科学仪器股份有限公司;SYNERGY H1酶标仪,美国Biotek公司;WR-18精密色差仪,福光电科技有限公司。
1.3 实验方法
1.3.1 蓝光光源条件设置
采用LED蓝光照明处理,光照强度设置为0、25、50、75、100 μmol/(m2·s)。不同强度的蓝光光源距离实验样品的距离(cm)见表1。
表1 不同强度的LED蓝光光源距离实验样品的距离
Table 1 Distance between LED blue light and the experimental samples

蓝光强度/[μmol/(m2·s)]距离/cm2518.55010.5757.01004.5
1.3.2 黄曲霉孢子萌发率评价
将107 CFU/mL的黄曲霉孢子悬浮液100 μL接种在装有200 μL PDB的96孔板中,置于不同强度LED蓝光33 ℃培养6 h后,通过普通光学显微镜计数视野范围内100~200个孢子中萌发的孢子的比例来评估孢子萌发率。根据谢一嘉等[14]将孢子萌发定义为芽管的长度≥孢子的半径。
1.3.3 抑制菌丝体生长
在PDA中心点接10 μL孢子悬浮液。在LED蓝光处理下培养5 d后拍照,并测量黄曲霉菌落直径(mm)。
1.3.4 扫描电子显微镜(scanning electron microscope, SEM)检查菌丝体表面形态
为了评价LED蓝光对真菌形态的影响,将黄曲霉接种于PDA平板上,并置于LED蓝光下连续培养7 d。SEM样本处理方法:用2.5%(体积分数)戊二醛固定,4 ℃放置24 h,PBS洗涤3次,经过一系列梯度浓度的乙醇逐级脱水20 min,再进行干燥,经过喷金处理后用SEM观察菌丝的微观形态[12]。
1.3.5 细胞渗漏
参考HU等[15]的方法,并稍作修改。将黄曲霉的孢子悬浮液接种到PDB培养基中,孢子终浓度为1×105 CFU/mL,然后在33 ℃下摇床振荡(180 r/min)培养3 d,经过滤收获菌丝体并用无菌蒸馏水洗涤3次。将菌丝体重悬于无菌蒸馏水中,分成20 mL菌丝体悬浮液,质量浓度为0.1 g/mL。采用LED蓝光处理,光照强度设置为0、25、50、100 μmol/(m2·s)。经过双层无菌粗棉布过滤后,用电导率仪测量0、4、8、16、20、24 h处理后的样本。
1.3.6 菌丝细胞膜完整性
采用LI等[16]先前描述的方法,将孢子悬液接种于PDA平板上,培养5 d,然后在不同光照强度下处理24 h。收集菌丝体,经过PI(质量浓度为5 μg/mL)染色后,再用荧光显微镜进行观察。
1.3.7 活性氧(reactive oxygen species, ROS)检测
根据ZHU等[12]的方法,采用DCFH-DA荧光法测定其内源ROS的形成。将孢子液接种于PDA上,33 ℃培养5 d,然后在不同强度LED蓝光下处理24 h,收集菌丝,并用10 μmol/L DCFH-DA荧光探针溶液进行染色,在37 ℃下染色30 min后,PBS洗涤3次,使用荧光显微镜对样品进行检测。
1.3.8 脂质过氧化检测
根据GANH O等[17]的方法采用硫代巴比妥酸(thiobarbituric acid, TBA)法测定丙二醛(malondialdehyde, MDA)含量。将孢子悬浮液接种于PDA板上于33 ℃培养5 d,然后在不同强度LED蓝光下处理24 h,收集菌丝0.5 g,用2 mL 100 g/L的三氯乙酸进行匀浆处理。将三氯乙酸再次加入匀浆中,固定体积为3 mL,10 000 r/min离心10 min,取上清液2 mL与0.6% TBA 2 mL混合,沸水浴15 min,立即冷却,再次离心。用酶标仪在450、532、600 nm处测定上清液的吸光度。
O等[17]的方法采用硫代巴比妥酸(thiobarbituric acid, TBA)法测定丙二醛(malondialdehyde, MDA)含量。将孢子悬浮液接种于PDA板上于33 ℃培养5 d,然后在不同强度LED蓝光下处理24 h,收集菌丝0.5 g,用2 mL 100 g/L的三氯乙酸进行匀浆处理。将三氯乙酸再次加入匀浆中,固定体积为3 mL,10 000 r/min离心10 min,取上清液2 mL与0.6% TBA 2 mL混合,沸水浴15 min,立即冷却,再次离心。用酶标仪在450、532、600 nm处测定上清液的吸光度。
1.3.9 超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、还原型谷胱甘肽(glutathione, GSH)含量的检测
将孢子液接种于PDA上,于33 ℃培养5 d,然后在不同LED蓝光强度下处理24 h,收集菌丝。分别用SOD活力检测试剂盒WST-1法和CAT活力检测试剂盒进行检测。用GSH检测试剂盒检测GSH含量。
1.3.10 蓝光对黄曲霉毒素生物合成的影响
为了研究LED蓝光对黄曲霉毒素分泌的影响,将孢子悬浮液加入到PDB中使孢子终浓度为1×105CFU/mL,于33 ℃的蓝光下连续培养5 d。检测其AFB1含量。具体方法为:取1 mL培养滤液,加入2 mL二氯甲烷,涡旋30 s,再摇床振荡30 min,取1 mL有机层,用氮吹仪在50 ℃下进行干燥。加入200 μL的正己烷和100 μL的三氟乙酸,将混合物涡旋30 s后置于40 ℃下反应15 min,再用氮吹仪干燥。最后加入初始流动相溶解并用0.22 μm有机滤膜进行过滤,以待HPLC检测分析。
1.3.11 AFB1的检测
用高效液相色谱结合荧光检测器(fluorescence detector, FLD)分析毒素。检测条件为:C18柱(150 mm×4.6 mm×5.0 μm),流动相为55%水、45%有机物(乙腈与甲醇体积比为1∶1),流速为1.0 mL/min,柱温为40 ℃,进样体积为50 μL,荧光检测器的激发波长和发射波长分别为360 nm和440 nm。
1.3.12 对干红辣椒中黄曲霉生长和黄曲霉毒素产生的抑制作用
称取2.0 g经过辐射灭菌(8 kGy)的红辣椒粉于均匀铺平在60 mm培养皿中,在中央接种10 μL黄曲霉孢子悬浮液(1×107 CFU/mL)。然后在不同蓝光强度下于33 ℃培养5 d。测量菌落直径(mm)并检测AFB1含量。辣椒中AFB1含量的检测:准确称取样品于50 mL离心管中,加入20 mL甲醇-水(70∶30,体积比)涡旋1 min,再在摇床中振荡30 min,6 000 r/min离心10 min。所得上清液通过槽纹滤纸过滤,将4 mL滤液用23 mL超纯水稀释并充分混合。然后用Whatman玻璃微纤维滤纸将稀释的样品过滤到干净的试管中,将15 mL滤液通过PriboFast®黄曲霉毒素总量免疫亲和柱,用10 mL超纯水洗涤2次,然后用2.0 mL甲醇洗脱。同1.3.10节所述方法,样品再经干燥、衍生化、重新溶解和过滤处理,再进行HPLC分析。色谱检测条件同1.3.11节所述。
1.3.13 蓝光照射对干红辣椒品质的影响
1.3.13.1 颜色的测定
使用精密色差仪测量不同强度蓝光照射3 d的辣椒粉表面颜色以及辣椒粉重新混合后的颜色,以评估蓝光对辣椒粉表面和整体的颜色影响。在读取亮度(L*)、红度(a*)和黄度(b*)之前,使用白板校正色差仪。总颜色变化(ΔE)的计算如公式(1)所示:
(1)
1.3.13.2 总酚的测定
采用ALMUSALLAM等[18]描述的方法并作适当修改。称取2.0 g蓝光处理过的辣椒粉,用20 mL 80%(体积分数)甲醇水溶液对总酚进行提取,1 000 r/min离心10 min,获得上清液,使用总酚试剂盒测定总酚含量。
1.3.13.3 抗氧化活性的测定
a)DPPH自由基清除率
使用1.3.13.2节相同方法制备辣椒粉提取物,根据LI等[19]的方法评估辣椒粉提取物的DPPH自由基清除能力。将0.5 mL辣椒粉提取物与1 mL DPPH甲醇溶液(250 μmol/L)充分混合。然后,将反应混合物在室温下在黑暗中静置10 min,然后测量在517 nm处的吸光度。以去离子水代替样品作为空白对照。DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A0、A1分别为空白和样品的吸光度。
b)ABTS阳离子自由基清除率
根据WANG等[20]的方法评估提取物的ABTS阳离子自由基清除能力。分别取0.2 mL辣椒粉提取物和3.9 mL的ABTS溶液,混匀后暗处放置15 min。在734 nm测定吸光度。以去离子水代替样品作为空白对照。ABTS阳离子自由基清除率的计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
式中:A0、A1分别为空白和样品的吸光度。
c)羟自由基清除率
根据LI等[19]的方法评估辣椒粉提取物的羟自由基清除能力。取10 mmol/L水杨酸-乙醇溶液(现配现用)、10 mmol/L硫酸亚铁溶液、辣椒粉提取物各1 mL,再加入0.03%过氧化氢溶液1 mL启动反应,混匀后置于37 ℃水浴锅中反应30 min,最后将反应溶液于510 nm处测定吸光度。以去离子水代替样品作为空白对照。羟自由基清除率的计算如公式(4)所示:
羟自由基清除率![]()
(4)
式中:A0、A1分别为空白和样品的吸光度。
1.4 统计分析
数据表示为“平均值±标准偏差”(如图中的误差条所示)。使用SPSS 18.0统计软件对数据进行统计分析,并采用Duncan多范围检验来评估各处理组之间的统计学显著性差异(P<0.05),使用Origin 2021作图。
2 结果与分析
2.1 蓝光在体外对黄曲霉的抗真菌作用
2.1.1 蓝光抑制孢子萌发和菌丝生长
在不同蓝光照射强度下[25、50、75、100 μmol/(m2·s)],蓝光显著抑制了黄曲霉的孢子萌发(图1-a),且抑制效果与光强呈正相关(图1-b),抑制率分别为11.06%、18.11%、71.06%和89.40%。此外,在PDA平板上,蓝光表现出强烈的抑制黄曲霉生长能力(图1-c、图1-d)。尤其是高光强度下[100 μmol/(m2·s)],蓝光几乎完全抑制了黄曲霉生长。
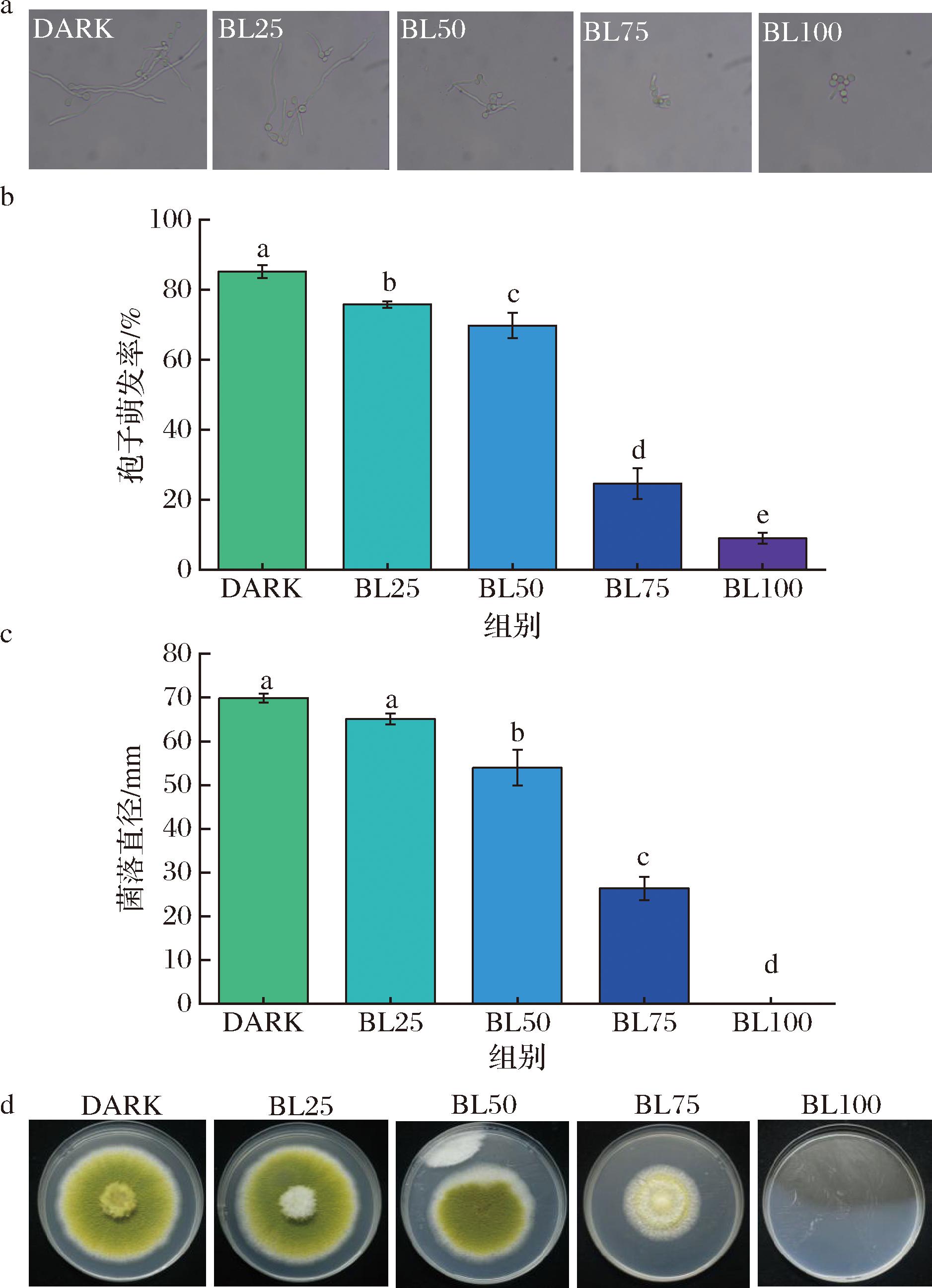
a-光学显微镜下孢子萌发的情况;b-黄曲霉孢子萌发率;c-黄曲霉菌落直径;d-黄曲霉在PDA平板生长情况
图1 不同强度蓝光处理对黄曲霉孢子萌发和菌丝生长的影响
Fig.1 Effect of different LED blue light intensities treatments on spore germination and mycelium growth of A.flavus
注:“DARK”“BL25”“BL50”“BL75”“BL100”分别表示黑暗处理对照组,蓝光照射强度为25、50、75、100 μmol/(m2·s)处理组,不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 蓝光减少黄曲霉的毒素合成
黄曲霉生长与产毒并不一定呈现正相关[21],在一些不利于生长的因素胁迫下,黄曲霉产毒能力可能更高[22]。因此,探究了蓝光对黄曲霉产毒的影响。结果显示,随着光强增加,黄曲霉在PDB液体培养基中产毒量也下降(图2)。在低中等光照强度下[25 μmol/(m2·s)和50 μmol/(m2·s)],黄曲霉生长抑制率分别是6.83%和22.76%,产毒抑制率分别是46.41%和70.75%。这说明中低强度蓝光并不会诱导黄曲霉产毒,黄曲霉毒素产量与黄曲霉生物量存在正相关。紫外光对黄曲霉毒素具有降解作用,但是蓝光对黄曲霉毒素的降解作用尚不知。本研究中蓝光主要是通过对黄曲霉生长的抑制从而实现减毒。
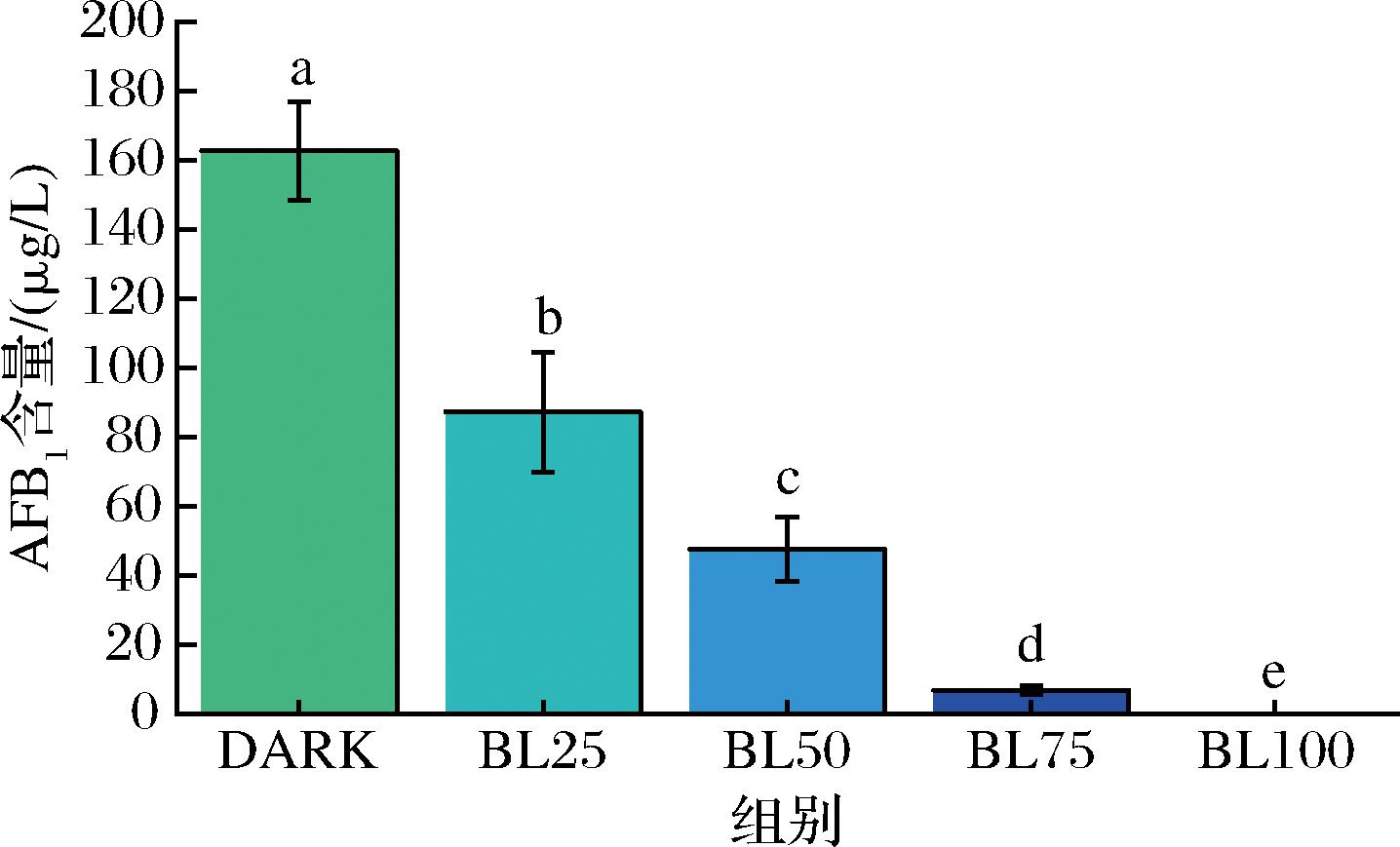
图2 不同强度蓝光处理对黄曲霉产AFB1的影响
Fig.2 Effect of different LED blue light intensities treatments on AFB1production of A.flavus
2.2 蓝光损伤黄曲霉的机制
2.2.1 蓝光对黄曲霉形态结构的影响
采用SEM观察蓝光对黄曲霉形态结构的影响,结果发现在不同光照强度的LED蓝光处理下,黄曲霉孢子及菌丝体形态表现出较大差异(图3)。在黑暗对照组中,菌丝形态完整(图3-a),并且分生孢子呈规则的圆形状(图3-b)。然而,在中等蓝光强度下[50 μmol/(m2·s)],大部分菌丝体形态呈现扁平、褶皱(图3-c),而分生孢子也出现皱缩、破裂情况(图3-d)。尤其是暴露于高强度蓝光下[100 μmol/(m2·s)],菌丝体完全干瘪,表面不规则,还在某些部分盘绕和缠结(图3-e),而分生孢子皱缩严重,并且大部分破裂(图3-f)。这些结果表明,蓝光处理会破坏黄曲霉菌丝和孢子的形态结构的完整性,从而导致黄曲霉菌生长受到抑制。
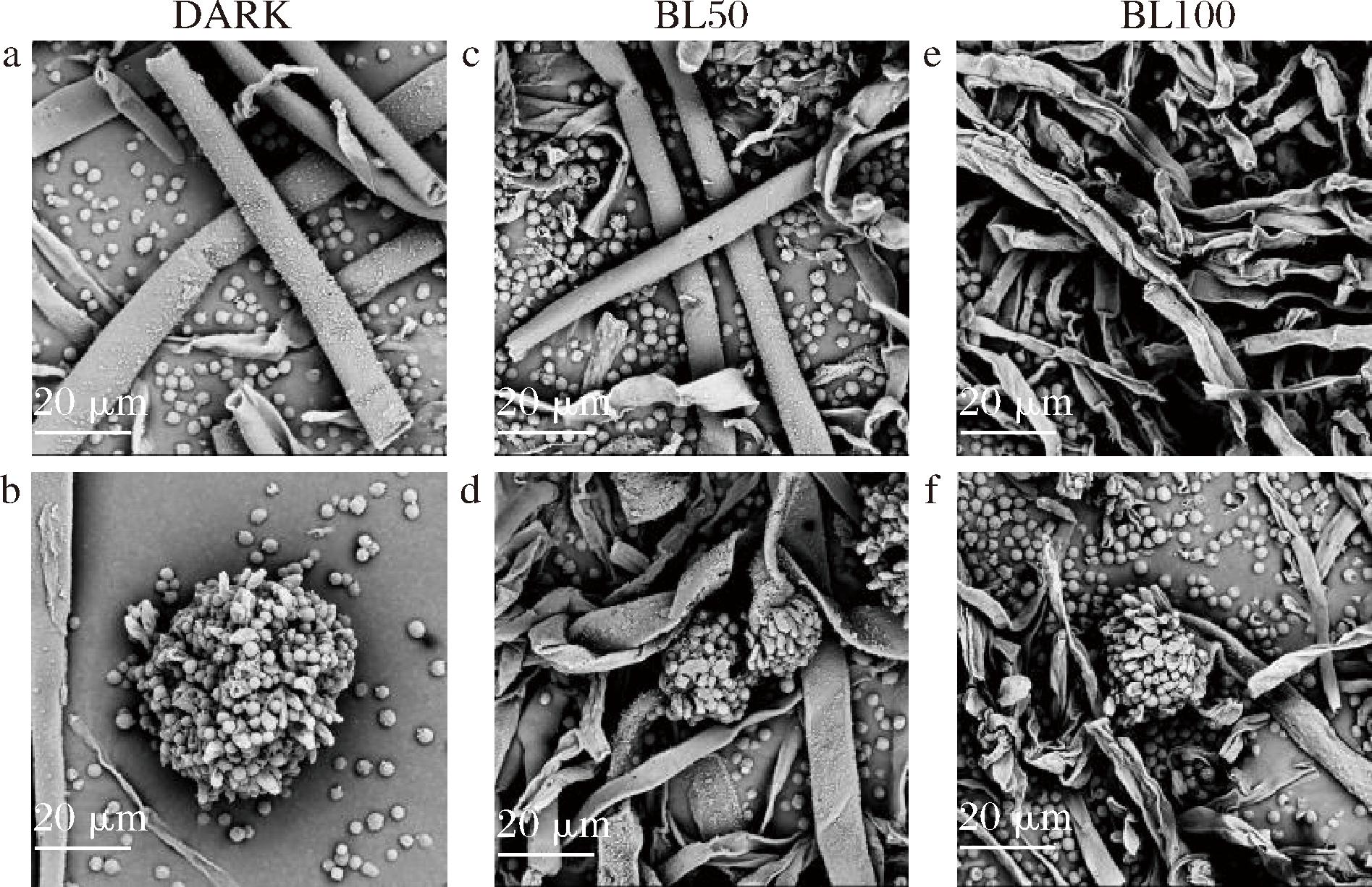
图3 不同强度蓝光处理对黄曲霉孢子及菌丝体形态的SEM观察(放大倍数3 000×)
Fig.3 SEM observation of the morphology of A.flavus spores and mycelia treated with different LED blue light intensities(magnification 3 000×)
2.2.2 蓝光对黄曲霉细胞膜通透性的影响
PI荧光染料不能穿过完整的细胞膜,但可以穿过受损的细胞膜,与细胞内的DNA结合,产生红色荧光。因此,它可以显示细胞膜损伤情况[23]。PI染色结果,如图4-a所示。在黑暗中生长的菌丝体无法观察到红色荧光,表明细胞膜相对完整。但是在高强度蓝光下[100 μmol/(m2·s)]下,菌丝体红色荧光强度更高。与此同时,检测了黄曲霉菌体在液体中的电导率(图4-b),随着蓝光照射时间的延长或光照强度的增加,电导率也变大。这可能是因为菌体完整性被破坏,进而导致金属阳离子外泄[24]。相似研究报道称,蓝光处理对扩展青霉、单核增生李斯特菌和荧光假单胞菌的细胞膜产生了破坏[12,25]。
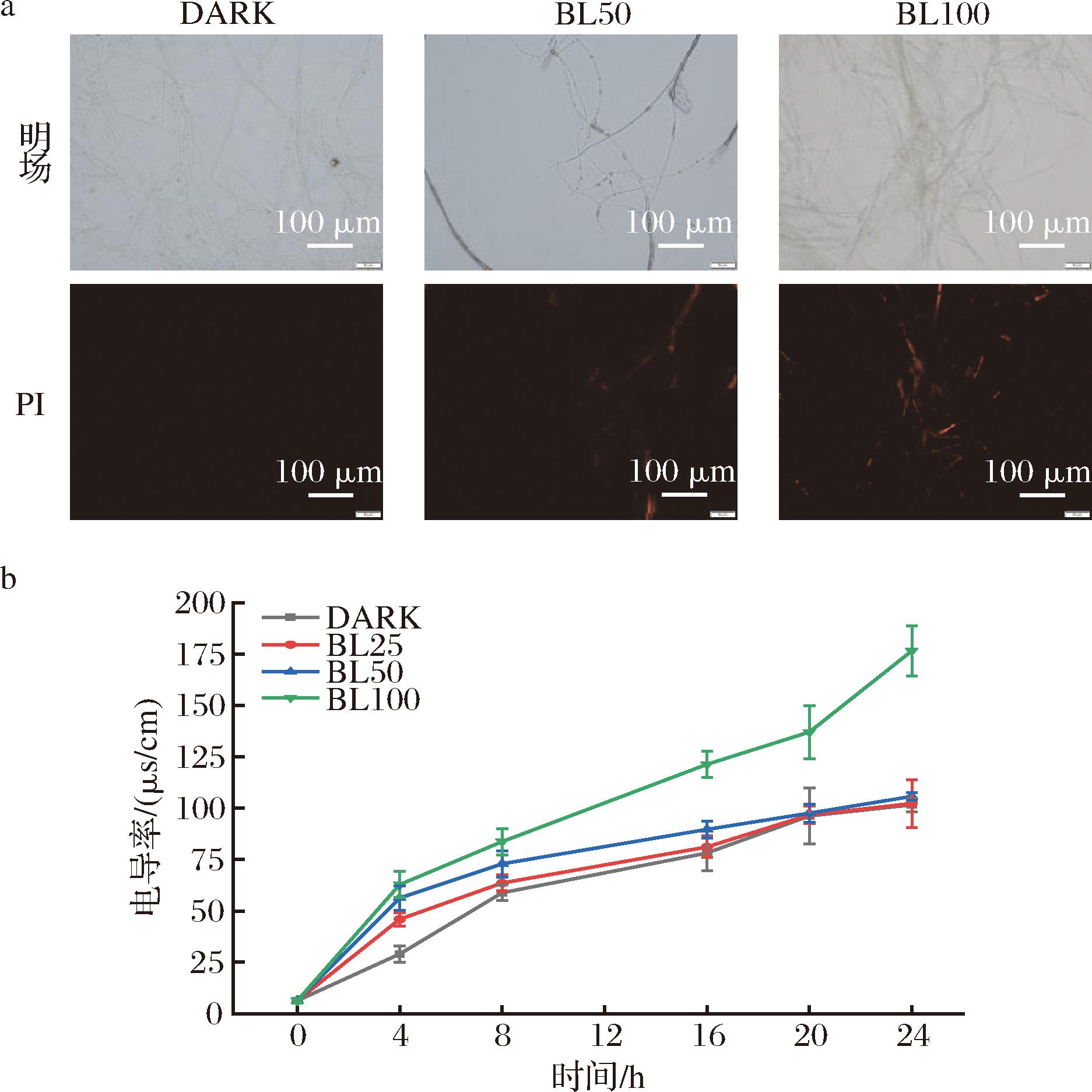
a-PI染色结果;b-菌丝胞外电导率
图4 不同强度蓝光处理对黄曲霉菌体细胞膜通透性的影响
Fig.4 Effect of different LED blue light intensity treatments on the membrane permeability of A.flavus
2.2.3 蓝光对黄曲霉菌丝体氧化损伤的影响
随着光强的增强,菌丝的MDA含量也随之增加(图5-a),特别是在100 μmol/(m2·s)的LED蓝光下进行培养,黄曲霉菌丝的MDA含量比对照组高6.8倍,说明LED蓝光加剧了脂质过氧化。图5-b为不同光强下菌丝体ROS积累情况。100 μmol/(m2·s)的LED蓝光处理的实验组中,绿色荧光强度明显强于黑暗对照组,表明较高强度的蓝光能够诱导黄曲霉菌丝体内大量ROS积累,从而导致菌丝损伤。本文结果表明,随着光强的增加,MDA含量和ROS水平升高(图5),表明膜脂过氧化水平和氧化应激增加。另有报道,蓝光能够导致食源性病原体阪崎克罗诺杆菌的MDA含量增加以及膜损坏[26]。此外,蓝光会剧烈诱导大肠杆菌O157:H7产生ROS,导致其ROS水平提高10%~30%[27]。这些研究都进一步证实了本研究结果。
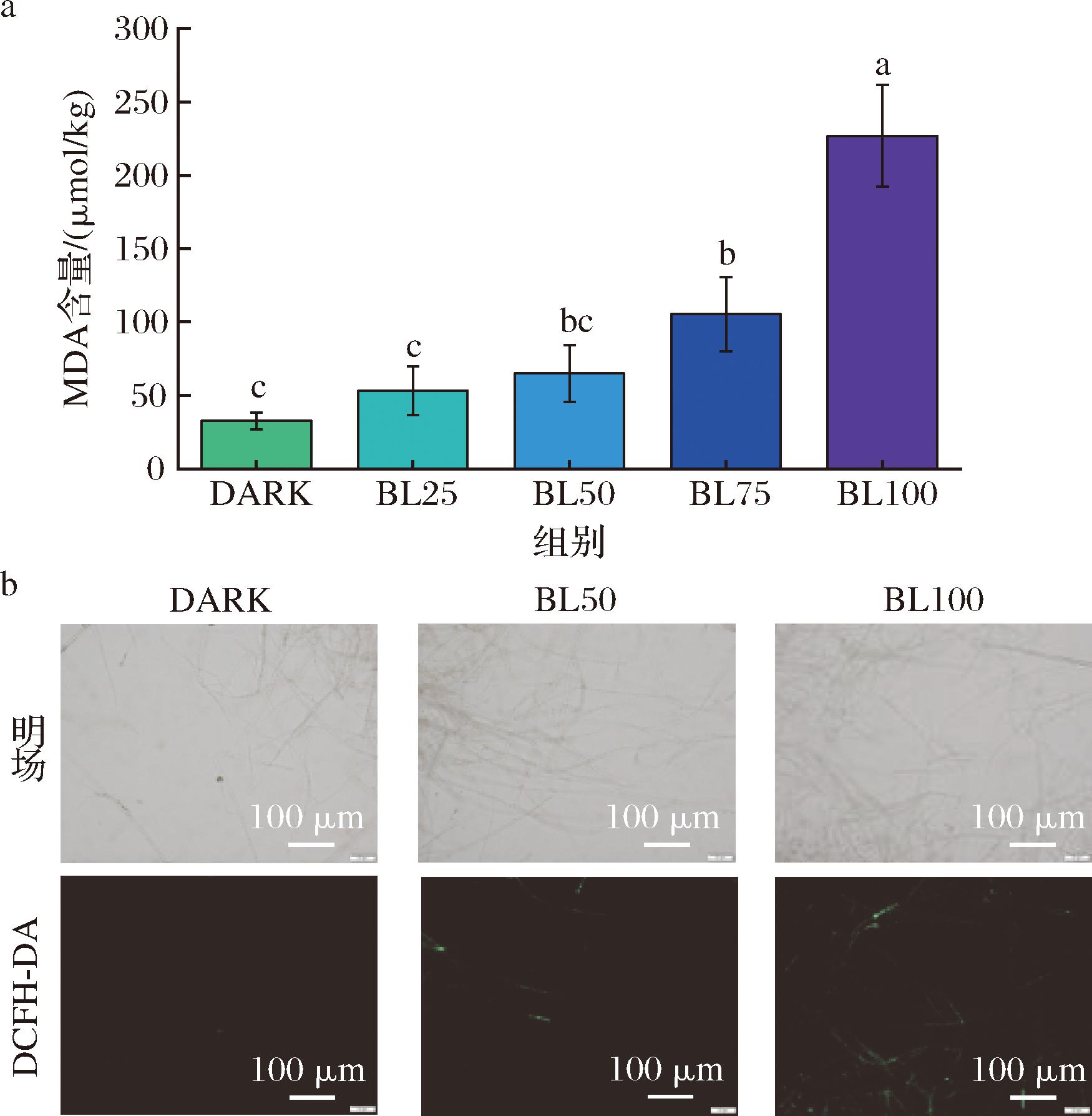
a-对菌丝体脂质过氧化的影响;b-菌丝体ROS积累情况
图5 不同强度蓝光处理对黄曲霉菌体氧化损伤的影响
Fig.5 Effect of different LED blue light intensity treatments on oxidative damage of A.flavus
2.2.4 蓝光对黄曲霉菌丝体抗氧化防御系统的影响
抗氧化防御系统,包括抗氧化酶(如SOD和CAT)和抗氧化剂(如GSH)2部分,是细胞抵御ROS诱导的氧化应激损伤的第一道保护屏障[28]。随着蓝光光照强度的增强,SOD活力逐渐降低(图6-a),CAT活性也逐渐降低(图6-b)。同时,随着光照强度的增强,经过100 μmol/(m2·s) LED蓝光处理的黄曲霉菌丝体GSH含量与黑暗对照组相比降低59.15%(图6-c,P<0.05)。这些结果表明,蓝光一方面可以增加细胞内的氧化应激水平,另一方面可以破坏黄曲霉菌丝体细胞内抗氧化防御系统,阻止细胞自身修复,从而造成黄曲霉细胞内生理活性的不可修复的氧化损伤。
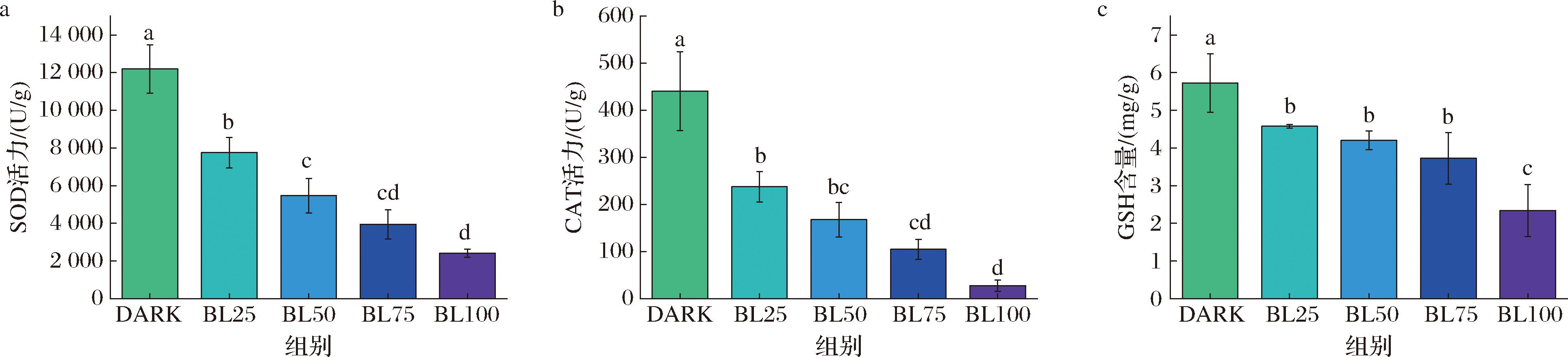
a-SOD活力;b-CAT活力;c-GSH含量
图6 不同强度蓝光对黄曲霉抗氧化系统的影响
Fig.6 Effect of different LED blue light intensity treatments on antioxidant system of A.flavus
2.3 蓝光在干红辣椒上(体内)对黄曲霉生长及产毒的抑制
如图7-a所示,在100 μmol/(m2·s) LED蓝光下,黄曲霉在辣椒上定殖较困难,表现为辣椒上基本无黄曲霉孢子生长,而75 μmol/(m2·s) LED蓝光下,辣椒表面上的孢子数量较少。与黑暗组相比,所有蓝光处理组下黄曲霉在辣椒上的生长均受到了抑制(图7-b)(P<0.05),同时较高强度蓝光处理抑制了黄曲霉在辣椒上产生黄曲霉毒素,与对照组相比,25、50、75、100 μmol/(m2·s)处理组的毒素产生量逐渐下降,与光强呈现负相关,毒素抑制率最高达到77.87%。这说明了蓝光可以在干红辣椒上抑制黄曲霉生长和产毒。然而,LED蓝光是否可以作为有效工具应用,还需要进一步评估蓝光对干红辣椒品质的影响。
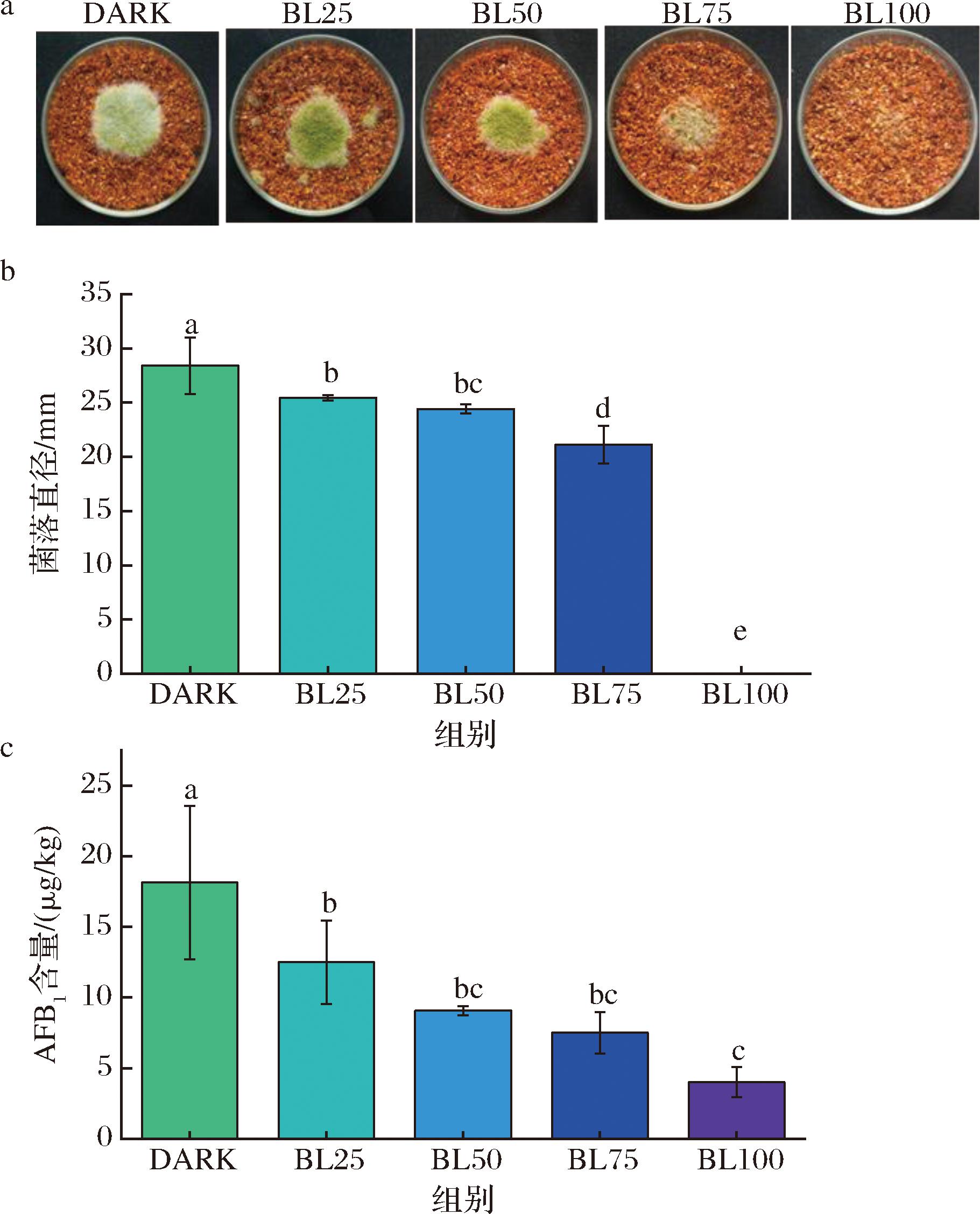
a-黄曲霉在辣椒上生长5 d后的情况;b-菌落直径;c-AFB1含量
图7 蓝光对黄曲霉在辣椒基质生长、产毒素的影响
Fig.7 Effect of different LED blue light intensity treatments on the mycelial growth and AFB1 accumulation of A.flavus in dried red chilies
2.4 蓝光对辣椒品质的影响
2.4.1 蓝光对辣椒颜色的影响
颜色作为辣椒粉最重要的感官属性之一,很大程度上影响着消费者的可接受度。本研究中对蓝光处理后辣椒粉的颜色属性进行了评估,结果如表2和表3所示。表2是辣椒粉照射后直接测量表面颜色,表3是辣椒粉照射后经过再次混匀后测量表面颜色。由表2可以看出,高强度蓝光照射对辣椒粉表面的颜色影响较大,L*值、a*值和b*值都显著降低了(P<0.05)。处理后辣椒粉L*值的增加可能是由于类胡萝卜素和其他色素通过非酶和酶氧化过程导致轻微变色[29],蓝光处理后辣椒粉a*值的降低可归因于类胡萝卜素的降解,因为它们对温度和光照以及这些处理的持续时间具有高敏感性。如表3所示,与对照组(33.10±1.94)相比,100 μmol/(m2·s)蓝光LED光显著(P<0.05)增加了L*值,b*值差异不显著(P>0.05)。总体上看,经过混匀后各组之间总色差无显著差异,说明蓝光对辣椒粉的颜色总体是没有显著影响的,颜色差异只存在于与蓝光直接照射的表面。
表2 蓝光对辣椒粉颜色的影响(混匀前)
Table 2 Effect of LED blue light treatments on the color of dried red chili powder (before mixed)
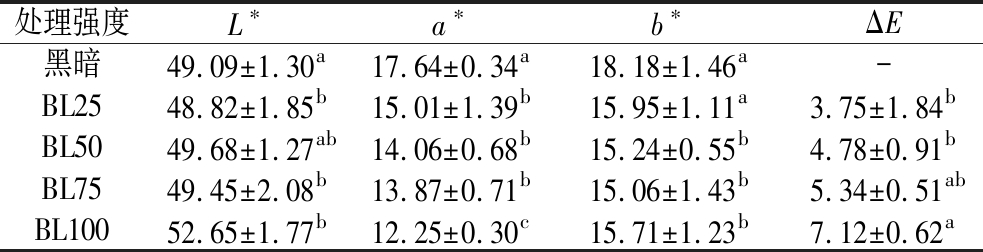
注:同列不同小写字母表示差异显著(P<0.05)(下同)。
处理强度L∗a∗b∗ΔE黑暗49.09±1.30a17.64±0.34a18.18±1.46a-BL2548.82±1.85b15.01±1.39b15.95±1.11a3.75±1.84bBL5049.68±1.27ab14.06±0.68b15.24±0.55b4.78±0.91bBL7549.45±2.08b13.87±0.71b15.06±1.43b5.34±0.51abBL10052.65±1.77b12.25±0.30c15.71±1.23b7.12±0.62a
表3 蓝光对辣椒粉颜色的影响(混匀后)
Table 3 Effect of LED blue light treatments on the color of dried red chili powder (after mixed)

处理强度L∗a∗b∗ΔE黑暗33.10±1.94b30.54±1.36a52.12±2.69a-BL2534.34±1.41ab30.02±1.36a50.21±5.10a4.88±1.42aBL5033.91±1.93ab29.11±1.66ab50.24±3.19a5.26±2.98aBL7534.77±1.63ab27.61±1.92ab51.96±4.78a4.25±1.35aBL10036.92±1.52a26.72±1.68b50.16±3.85a4.47±2.80a
2.4.2 蓝光对辣椒总酚含量及抗氧化活性的影响
蓝光照射对辣椒粉TPC和DPPH自由基、ABTS阳离子自由基以及羟自由基清除能力的影响,结果如图8所示。结果表明蓝光处理对辣椒粉TPC(图8-a)和DPPH自由基活性(图8-b)没有显著影响(P>0.05)。与对照相比,蓝光强度≥50 μmol/(m2·s)会降低辣椒粉的ABTS阳离子自由基清除能力(图8-c),蓝光强度≥75 μmol/(m2·s)会降低辣椒粉的羟自由基清除能力(图8-d)。对比其他加工方法对辣椒粉的理化品质的影响差异发现,UV-C处理会降低辣椒粉的TPC、提高辣椒粉DPPH自由基能力[30],与中高强度蓝光降低辣椒粉的TPC、提高辣椒粉DPPH自由基结果一致。总体而言,加工方法对食品生物活性特性的影响,可能与加工材料的类型、状态和基质以及加工条件(如温度、持续时间、强度、功率等)有关。因此,找到适当的辐照强度和贮存温度条件以尽量减少每种食品的质量变化很重要。
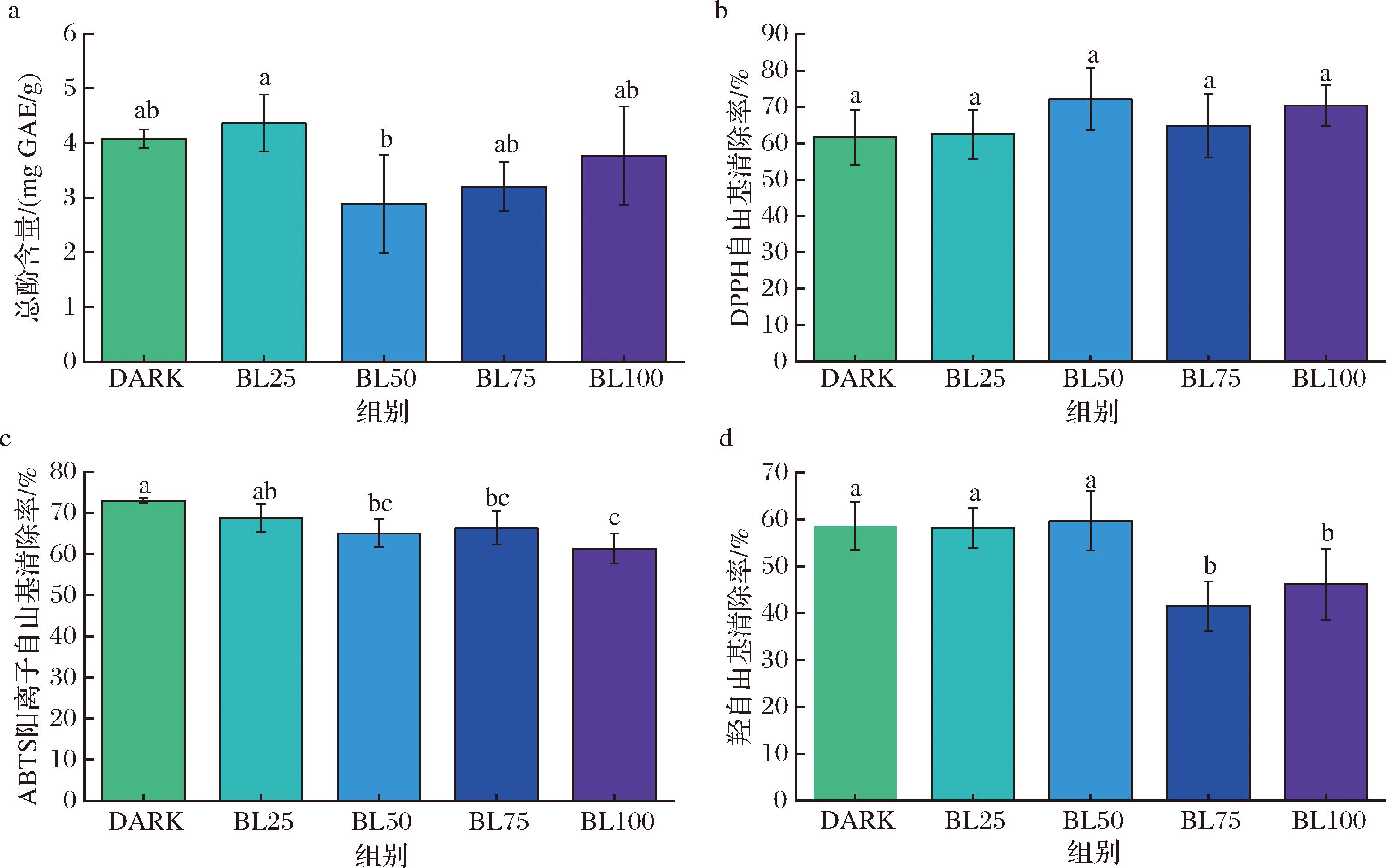
a-总酚含量;b-DPPH自由基清除率;c-ABTS阳离子自由基清除率;d-羟自由基清除率
图8 蓝光对辣椒总酚含量和自由基清除能力的影响
Fig.8 Effect of LED blue light on TPC and free radical scavenging activity of dried red chilies
3 结论
本研究中,LED蓝光对黄曲霉菌的孢子萌发、菌丝生长以及黄曲霉毒素的产生具有显著抑制作用。蓝光通过诱导黄曲霉微观结构的改变,造成菌丝体非正常发育。细胞膜通透性的增加、细胞膜的损伤和膜脂过氧化增加,导致细胞膜功能异常,从而诱导细胞内ROS积累和氧化应激,抗氧化防御系统失衡,最终造成黄曲霉细胞内生理活性的不可修复的氧化损伤甚至细胞死亡。此外,蓝光在干红辣椒基质上对防控黄曲霉及黄曲霉毒素污染具有良好效果,进一步证实了蓝光的抗真菌活性。由于蓝光对干红辣椒的品质影响较小,因此LED蓝光可以作为一种控制干红辣椒中黄曲霉生长和产毒的有效工具。
[1] SHABEER S, ASAD S, JAMAL A, et al.Aflatoxin contamination, its impact and management strategies:An updated review[J].Toxins, 2022, 14(5):307.
[2] CASTELLS M, MAR N S, SANCHIS V, et al.Distribution of fumonisins and aflatoxins in corn fractions during industrial cornflake processing[J].International Journal of Food Microbiology, 2008, 123(1-2):81-87.
N S, SANCHIS V, et al.Distribution of fumonisins and aflatoxins in corn fractions during industrial cornflake processing[J].International Journal of Food Microbiology, 2008, 123(1-2):81-87.
[3] YU J N, HENNESSY D A, WU F.The impact of Bt corn on aflatoxin-related insurance claims in the United States[J].Scientific Reports, 2020, 10(1):10046.
[4] KRSKA R, LESLIE J F, HAUGHEY S, et al.Effective approaches for early identification and proactive mitigation of aflatoxins in peanuts:An EU-China perspective[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(4):3227-3243.
[5] SHARMA K K, POTHANA A, PRASAD K, et al.Peanuts that keep aflatoxin at bay:A threshold that matters[J].Plant Biotechnology Journal, 2018, 16(5):1024-1033.
[6] YANG F, BERMAN J.Beyond resistance:Antifungal heteroresistance and antifungal tolerance in fungal pathogens[J].Current Opinion in Microbiology, 2024, 78:102439
[7] 李昱涵, 付瑞燕.利用贝莱斯芽孢杆菌提高红曲米发酵生产中抗黄曲霉污染的能力[J].食品与发酵工业, 2022, 48(20):204-209.LI Y H, FU R Y.Improvement of the resistance to Aspergillus flavus contamination in the fermentation of red fermented rice using Bacillus velezensis[J].Food and Fermentation Industries, 2022, 48(20):204-209.
[8] GOMAA E Z, ABDELALL M F, EL-MAHDY O M.Detoxification of aflatoxin B1 by antifungal compounds from Lactobacillus brevis and Lactobacillus paracasei, isolated from dairy products[J].Probiotics and Antimicrobial Proteins, 2018, 10(2):201-209.
[9] 李春玲, 贺婧, 王立元, 等.淡豆豉炮制过程中拮抗菌对黄曲霉毒素B1的拮抗能力考察[J].中草药, 2021, 52(12):3544-3551.LI C L, HE J, WANG L Y, et al.Antagonistic ability of aflatoxin B1 antagonistic microorganism in processing of Sojae Semen Praeparatum[J].Chinese Traditional and Herbal Drugs, 2021, 52(12):3544-3551.
[10] ORLANDI V T, BOLOGNESE F, TRIVELLIN N, et al.Antimicrobial blue light (aBL) as a potential tool to reduce bacterial spoilage in the fishery chain[J].Food Control, 2024, 158:110254.
[11] JUSUF S, ZHAN Y W, ZHANG M, et al.Blue light deactivation of catalase suppresses Candida hyphae development through lipogenesis inhibition[J].Photochemistry and Photobiology, 2023, 99(3):936-946.
[12] ZHU R Y, WANG W L, LUO Z S, et al.Blue LED light treatment inhibits virulence and patulin biosynthesis in Penicillium expansum[J].Postharvest Biology and Technology, 2023, 200:112340.
[13] LI B, WANG Z R, YANG G, et al.Biocontrol potential of 1-pentanal emitted from lactic acid bacteria strains against Aspergillus flavus in red pepper (Capsicum annuum L.)[J].Food Control, 2022, 142:109261.
[14] 谢一嘉, 李晓凤, 余以刚, 等.茴香醛对黄曲霉菌的抑制作用[J].现代食品科技, 2024, 40(1):128-136.XIE Y J, LI X F, YU Y G, et al.Inhibitory effect of p-anisaldehyde against Aspergillus flavus growth[J].Modern Food Science and Technology, 2024, 40(1):128-136.
[15] HU Z Y, YUAN K, ZHOU Q, et al.Mechanism of antifungal activity of Perilla frutescens essential oil against Aspergillus flavus by transcriptomic analysis[J].Food Control, 2021, 123:107703.
[16] LI S F, ZHANG S B, LV Y Y, et al.Heptanal inhibits the growth of Aspergillus flavus through disturbance of plasma membrane integrity, mitochondrial function and antioxidant enzyme activity[J].LWT, 2022, 154:112655.
[17] GANH O R, ESTÉVEZ M, MORCUENDE D.Suitability of the TBA method for assessing lipid oxidation in a meat system with added phenolic-rich materials[J].Food Chemistry, 2011, 126(2):772-778.
O R, ESTÉVEZ M, MORCUENDE D.Suitability of the TBA method for assessing lipid oxidation in a meat system with added phenolic-rich materials[J].Food Chemistry, 2011, 126(2):772-778.
[18] ALMUSALLAM I A, MOHAMED AHMED I A, BABIKER E E, et al.Optimization of ultrasound-assisted extraction of bioactive properties from date palm (Phoenix dactylifera L.) spikelets using response surface methodology[J].LWT, 2021, 140:110816.
[19] LI Y H, JIANG B, ZHANG T, et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J].Food Chemistry, 2008, 106(2):444-450.
[20] WANG N, LI Q.Study on extraction and antioxidant activity of polysaccharides from Radix Bupleuri by natural deep eutectic solvents combined with ultrasound-assisted enzymolysis[J].Sustainable Chemistry and Pharmacy, 2022, 30:100877.
[21] BAAZEEM A, GARCIA-CELA E, MEDINA A, et al.Interacting abiotic factors affect growth and aflatoxin B1 production profiles of Aspergillus flavus strains on pistachio-based matrices and pistachio nuts[J].Frontiers in Microbiology, 2021, 11:624007.
[22] ![]() T,
T, ![]() B, CREVAR B, et al.Aspergillus flavus NRRL 3251 growth, oxidative status, and aflatoxins production ability in vitro under different illumination regimes[J].Toxins, 2018, 10(12):528.
B, CREVAR B, et al.Aspergillus flavus NRRL 3251 growth, oxidative status, and aflatoxins production ability in vitro under different illumination regimes[J].Toxins, 2018, 10(12):528.
[23] QU S, YANG K L, CHEN L, et al.Cinnamaldehyde, a promising natural preservative against Aspergillus flavus[J].Frontiers in Microbiology, 2019, 10:2895.
[24] PANG J L, ZHANG F, WANG Z R, et al.Inhibitory effect and mechanism of curcumin-based photodynamic inactivation on patulin secretion by Penicillium expansum[J].Innovative Food Science &Emerging Technologies, 2022, 80:103078.
[25] HYUN J E, LEE S Y.Antibacterial effect and mechanisms of action of 460-470 nm light-emitting diode against Listeria monocytogenes and Pseudomonas fluorescens on the surface of packaged sliced cheese[J].Food Microbiology, 2020, 86:103314.
[26] CHU Z J, HU X Q, WANG X Y, et al.Inactivation of Cronobacter sakazakii by blue light illumination and the resulting oxidative damage to fatty acids[J].Canadian Journal of Microbiology, 2019, 65(12):922-929.
[27] KIM D K, KANG D H.Efficacy of light-emitting diodes emitting 395, 405, 415, and 425 nm blue light for bacterial inactivation and the microbicidal mechanism[J].Food Research International, 2021, 141:110105.
[28] CHEN Z, LIU J H, TIAN L J, et al.Raman micro-spectroscopy monitoring of cytochrome c redox state in Candida utilis during cell death under low-temperature plasma-induced oxidative stress[J].Analyst, 2020, 145(11):3922-3930.
[29] ERGÜNE G, TARHAN S.Color retention of red peppers by chemical pretreatments during greenhouse and open sun drying[J].Journal of Food Engineering, 2006, 76(3):446-452.
G, TARHAN S.Color retention of red peppers by chemical pretreatments during greenhouse and open sun drying[J].Journal of Food Engineering, 2006, 76(3):446-452.
[30] SHOQAIRAN Y I, MOHAMED AHMED I A, ALMAIMAN S A, et al.Effect of microwave, ultraviolet and pulsed electric field treatments on ochratoxin A level and physicochemical quality attributes of paprika powder[J].LWT, 2023, 188:115397.