等离子体是继固体、液体和气体之后的第4种物质状态——即一种呈现电中性的电离气体[1],其一般是通过对气体施加足够高的电压,在强电场的作用下,部分气体中的分子发生碰撞、电离、激发等而形成[2]。根据体系温度的不同,可将等离子体分为热等离子体和非热等离子体(non-thermal plasma,NTP)[3]。因NTP中含有极其丰富的物理/化学因子,尤其是各种活性氧/氮基团(reactive oxygen/nitrogen species,ROS/RNS),而引起了人们广泛的关注[4],目前已被证实可用于医学[5]、食品加工[6]等多方面的研究和应用。
当NTP与水接触时,各种气相活性粒子可与水发生系列复杂反应,包括部分ROS/RNS由气相向液相迁移,从而使得水中生成各种ROS/RNS,如过氧化氢(H2O2)、亚硝酸盐![]() 和硝酸盐
和硝酸盐![]() 等[7-8]。NTP处理后的水溶液被称为等离子体活化水(plasma-activated water,PAW),其中含有的各种ROS/RNS具有很强的杀菌能力,因此PAW被认为是一种具有广阔应用前景的新型食品减菌方法[9]。
等[7-8]。NTP处理后的水溶液被称为等离子体活化水(plasma-activated water,PAW),其中含有的各种ROS/RNS具有很强的杀菌能力,因此PAW被认为是一种具有广阔应用前景的新型食品减菌方法[9]。
目前相关研究多以纯水为介质,对其进行NTP处理后制备PAW,考察了各种PAW生成和处理条件对其杀菌能力的影响[10-11],如工作气体、电压、等离子体与液面之间的距离、水溶液的成分、处理时间、反应温度、贮藏温度等。实际上,除了可以纯水为介质制备PAW以外,还可以海水为介质制备等离子体活化海水(plasma-activated seawater,PASW),后者特别适宜于各种海洋食品的减菌保鲜应用。但是,据调研,目前尚无关于PASW杀菌能力的研究报道。鉴于此,本文以海产品的典型腐败菌—腐败希瓦氏菌(S.putrefaciens)为研究对象,探究了各种生成和处理条件对PASW对S.putrefaciens杀灭作用的影响。相关研究成果对推动PASW在海产品中的减菌保鲜应用有一定的参考和指导意义。
1 材料与方法
1.1 材料与试剂
实验试剂:腐败希瓦氏菌(Shewanella putrefaciens) JCM 20190,中国科学院微生物研究所,将菌种粉末经过活化后,传代培养,保存于-80 ℃;高纯氧气(O2)、氮气(N2)、氩气(Ar),杭州今特科技有限公司;氯化钠,杭州邦易化工有限公司;胰酪大豆蛋白胨液体(tryptic soy broth,TSB)培养基、琼脂,杭州微生物有限公司;所有试剂均为分析级。
实验材料:养殖专用海盐,江西盐通科技有限公司,在30.00 g TSB培养基粉末中加入15 g琼脂,再溶于1 L纯水制备胰酪大豆胨琼脂培养基(tryptose soy agar,TSA),灭菌倾倒于无菌90 mm平板。
1.2 仪器与设备
CTP-2000KP低温等离子体发生器,南京苏曼等离子体有限公司;AR213电子精密天平,上海力衡仪器仪表有限公司;HYJD超纯水仪,杭州永洁达净化科技有限公司;SCB-VF2A超净工作台,苏州西班泰克净化设备有限公司;IMJ-54A高压灭菌锅,上海施都凯仪器设备有限公司;LRH-250F生化培养箱,上海一恒科学仪器有限公司;ZHWY-200B恒温振荡摇床,上海智城分析仪器制造有限公司;CR21-GⅡ高速冷冻离心机,日本日立公司。
1.3 实验方法
1.3.1 PASW的制备
本实验采用气液界面电晕放电(corona discharge,CD)处理海水(35 g/L),制备得到PASW,电晕放电的示意图如图1所示。PASW的生成装置为一个柱状树脂有机玻璃反应器(高:200 mm,直径:100 mm),将一个直径小于1 mm的不锈钢针状阳极置于其中,并连接到高压等离子体发生器上。参考KE等[12]的方法并稍作修改,将体积为100 mL的35 g/L海水泵入反应器中,高压电极(阳极)置于液面上方10 mm,在电极尖端与液面之间产生NTP。气体导入反应器中的流速为6 L/min。对海水进行一定时间(300、600、900、1 200 s)的NTP处理,以制备PASW。
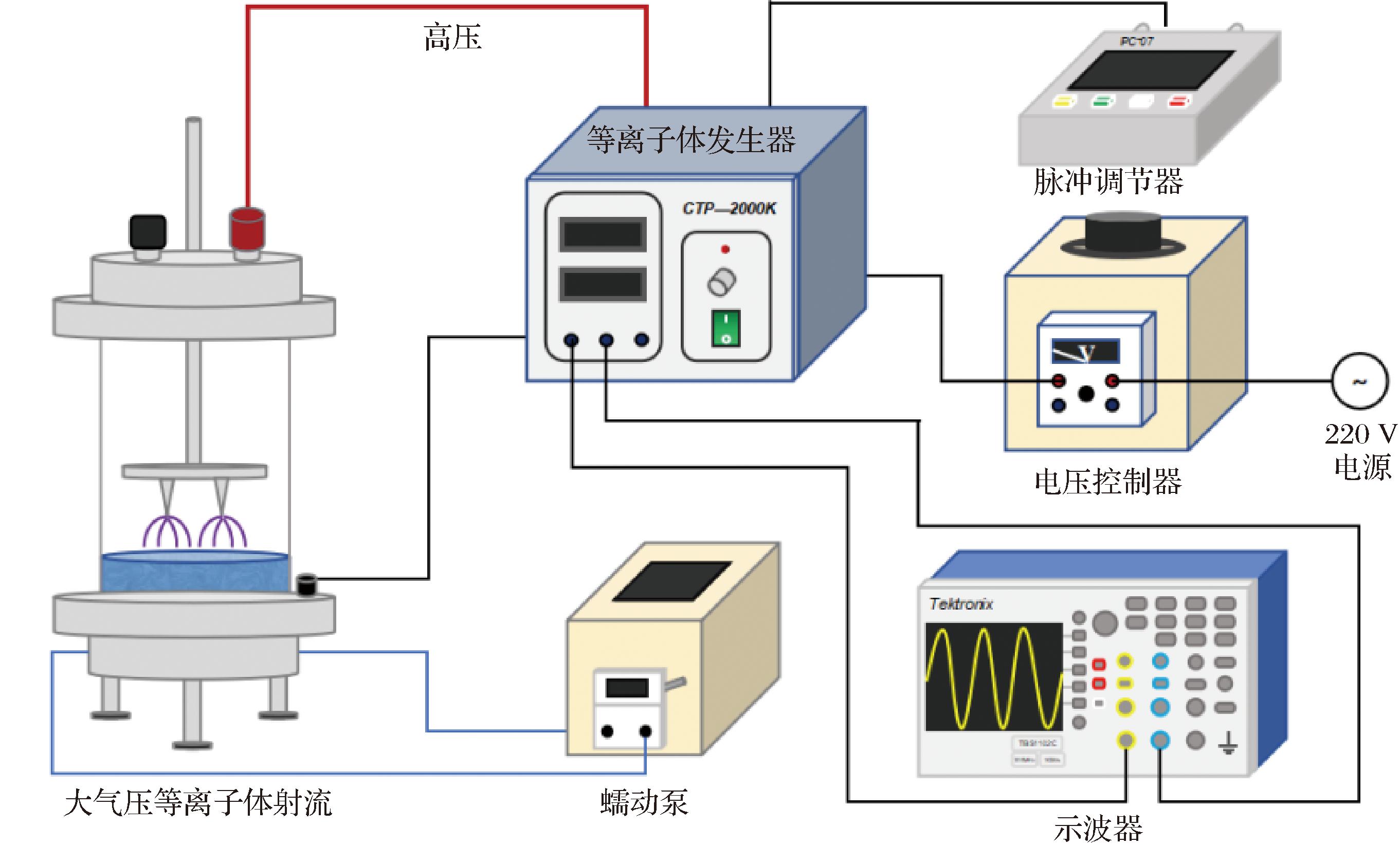
图1 电晕-放电设备生成等离子体活化海水的原理图
Fig.1 The schematic diagram of the CD-NTP device generating the PASW
1.3.2 菌液样品的制备
将活化后的S.putrefaciens在TSA平板上进行划线培养后,采用无菌接种环挑取单个菌落,接种于20 mL TSB液体培养基中,置于30 ℃、120 r/min下振荡培养10 h。培养结束后取1 mL菌液,在10 000 r/min条件下离心3 min。将所得的细菌团块悬浮于1 mL无菌生理盐水(9 g/L)中,洗涤和离心过程重复3次。然后用无菌生理盐水(9 g/L)将菌悬液稀释至10 mL,浓度约为8 lg CFU/mL~9 lg CFU/mL。
1.3.3 生成条件对PASW杀灭S.putrefaciens效果的影响
将体积为100 mL 的35 g/L海水泵入反应器中后,调节不锈钢针状阳极与液面之间的距离(5、10、15、20 mm)然后对样品分别进行不同气体(空气、O2、N2、Ar)、不同时间(300、600、900、1 200 s)、不同电压(5、10、15、20、25、30 kV)、不同频率(2.5、5、7.5、10 kHz)的NTP处理。参考QI等[13]的方法并稍作修改,取900 μL 的PASW与100 μL S.putrefaciens菌液(1.3.2节制备)充分混匀,并置于室温下孵育30 min,用无菌生理盐水(9 g/L)进行10倍梯度稀释,吸取稀释后的菌悬液100 μL在TSA平板上涂板。30 ℃孵育48 h后,通过计数CFU数来检测PASW的减菌效果。
1.3.4 反应条件对PASW杀灭S.putrefaciens效果的影响
1.3.3.1 反应温度对PASW杀菌效果的影响
在空气条件下,将体积为100 mL盐含量为35 g/L的海水泵入反应器中后,调节不锈钢针状阳极与液面之间的距离为10 mm,控制峰值电压和频率的数值为25 kV、10 kHz不变,进行300 s的电晕放电处理,制备得到PASW。取900 μL与100 μL稀释后的S.putrefaciens菌液混匀后于4、16、25、30、37 ℃条件下孵育30 min,减菌实验方法与1.3.3节相同。
1.3.3.2 贮藏时间、贮藏温度对PASW杀菌效果的影响
用与1.3.3.1节相同的处理参数对35 g/L的海水进行300 s的电晕放电处理,得到PASW。将PASW于4、25 ℃下贮藏72 h,每隔一定时间取样并对其杀菌能力检测分析,减菌实验方法与1.3.3节相同。
1.4 数据分析
采用Excel 2010对数据进行整理,采用IBM SPSS Statistics 26(Chicago,IL,USA)对数据进行单因素方差分析(ANOVA),P值采用Duncan’s Multiple Range Test,P<0.05为显著性。使用Origin 2024(OriginLab Corporation,USA)进行绘图。每个实验进行3次重复。
2 结果与分析
2.1 生成条件对PASW杀灭S.putrefaciens效果的影响
2.1.1 工作气体组成对PASW杀灭S.putrefaciens效果的影响
工作气体组成会影响NTP的诸多特性,包括放电特性、发射光谱和化学特性等,从而产生不同种类和浓度的活性物质,进而影响了PAW中ROS/RNS种类及其含量,最终影响了PAW的杀菌效果[11]。同样,工作气体组成对PASW的杀菌能力也可能有重要影响。不同气体NTP处理后生成的PASW对S.putrefaciens的杀灭作用如图2所示。由图2可知,Air-NTP处理的PASW杀菌能力最强,其后依次为O2、Ar、N2。当NTP处理时间为300 s时,Air、O2、Ar、N2-NTP处理处理生成的PASW分别减少了(5.12±0.14) lg CFU/mL、(4.29±0.16) lg CFU/mL、(3.77±0.18) lg CFU/mL、(0.23±0.07) lg CFU/mL的S.putrefaciens。当NTP处理时间延长到1 200 s,Air和O2-NTP处理的PASW可以将S.putrefaciens完全杀灭,Ar-NTP处理的PASW减菌数可以达到(6.63±0.17) lg CFU/mL,但是N2-NTP处理的PASW的效果较差,仅能减少(2.84±0.09) lg CFU/mL的S.putrefaciens。
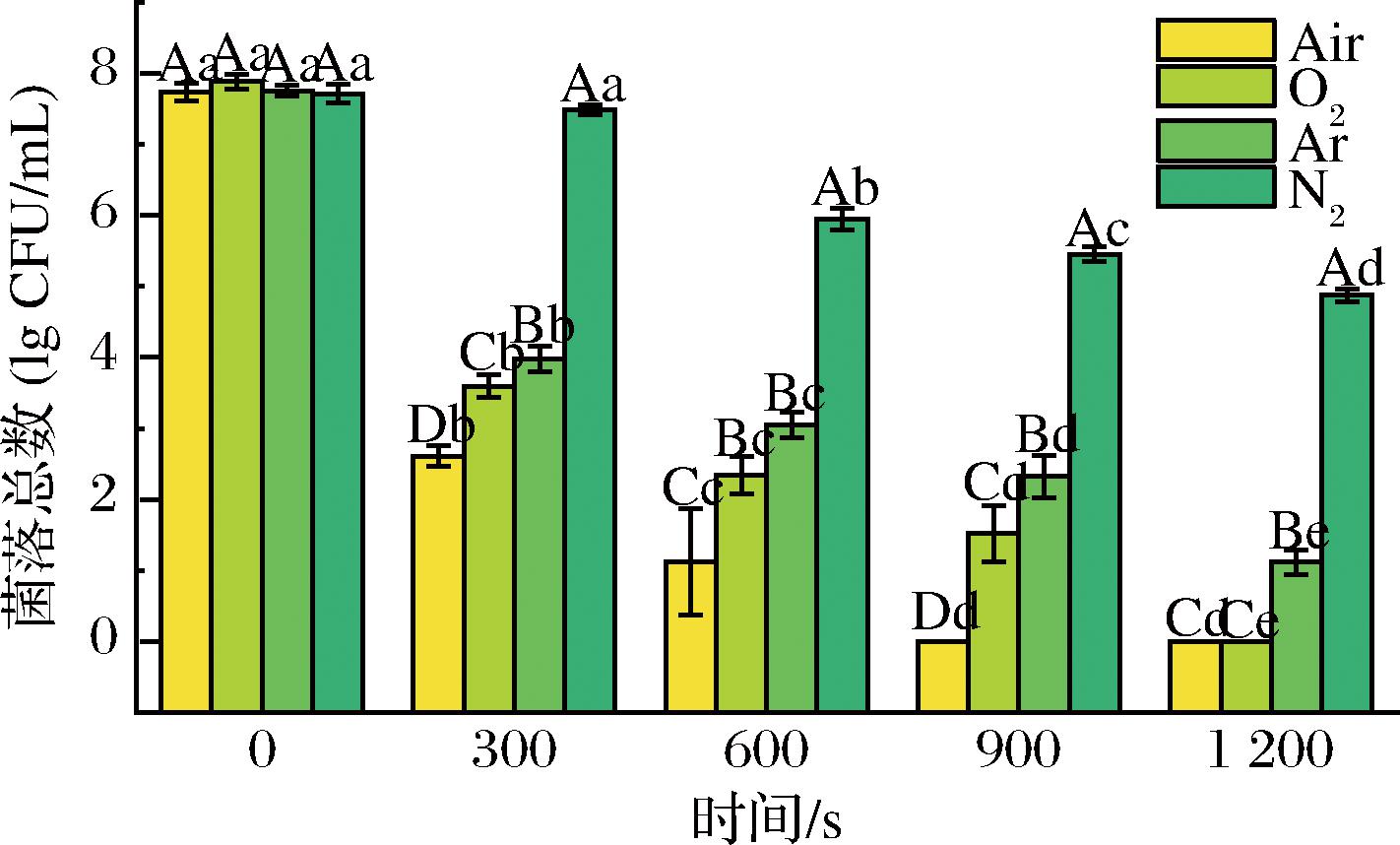
图2 NTP工作气体对PASW杀灭S.putrefaciens的影响
Fig.2 Effect of NTP produced by working gas on PASW against S.putrefaciens
注:放电条件为峰值电压25 kV、放电频率10 kHz、放电距离10 mm;大写字母(A~D)表示同一时间不同气体,小写字母(a~e)表示不同时间同一气体,均有统计学意义(P<0.05)。
已有研究显示,PAW中ROS/RNS的种类与含量是影响其杀菌效果的主要原因。ROS/RNS可引起微生物的膜脂过氧化、蛋白质氧化、膜电位变化、膜完整性破坏、细胞内容物流失等,进而引起微生物的死亡[11]。气体组成可显著影响PAW中ROS/RNS种类及其含量,进而影响其杀菌能力。当以空气为工作气体时,会生成较高浓度的![]() 并引起PAW的pH值降低,前者与等离子体处理时生成的H2O2在酸性条件下反应生成具有强氧化能力的过氧化亚硝酸盐,后者可引起微生物的死亡,这也是Air-NTP处理的PASW杀菌能力最强的原因[14]。在O2条件下,PASW中也会生成较多的ROS,其也有较强的灭菌能力。不同气体条件下生成的PASW的ROS/RNS不仅会直接影响PASW的杀菌能力,其也会影响PASW中氯离子、溴离子等的活化,进而影响PASW的杀菌能力。本研究中,工作气体组成影响PASW杀菌机制还需进一步深入研究。
并引起PAW的pH值降低,前者与等离子体处理时生成的H2O2在酸性条件下反应生成具有强氧化能力的过氧化亚硝酸盐,后者可引起微生物的死亡,这也是Air-NTP处理的PASW杀菌能力最强的原因[14]。在O2条件下,PASW中也会生成较多的ROS,其也有较强的灭菌能力。不同气体条件下生成的PASW的ROS/RNS不仅会直接影响PASW的杀菌能力,其也会影响PASW中氯离子、溴离子等的活化,进而影响PASW的杀菌能力。本研究中,工作气体组成影响PASW杀菌机制还需进一步深入研究。
2.1.2 放电电压对PASW杀灭S.putrefaciens效果的影响
不同NTP处理电压所产生的PASW对S.putrefaciens减菌效果的结果如图3所示。在5~30 kV电压范围内,随着电压的增大,PASW的减菌能力越来越强。当NTP电压为0~10 kV时,PASW的减菌能力变化不显著(P>0.05)。经5、10 kV处理得到的PASW处理后,S.putrefaciens菌落数从初始的(7.43±0.11) lg CFU/mL分别减少到(7.05±0.09) lg CFU/mL和(6.82±0.16) lg CFU/mL。如果NTP电压进一步增加到15、20、25 kV时,PASW处理后菌落数分别显著降低至(5.24±0.14) lg CFU/mL、(4.46±0.11) lg CFU/mL和(2.45±0.22) lg CFU/mL(P<0.05)。而当NTP电压增加到30 kV时,PASW的减菌能力逐渐趋于稳定。在一定程度上,NTP的电子密度受到NTP电压的影响,二者呈正相关。电压的增加会导致气体电离程度的提高,从而增加气相中各种化学活性基团的含量,进而增加了PASW中生成的各种ROS/RNS的浓度,而后者是细菌灭活的关键因子[15]。当电压到达25~30 kV时,PASW杀菌率开始逐渐趋于稳定状态,这可能是因为随着电压的升高,气相中各种成分的碰撞加剧,各类粒子出现更加多变的聚合或消耗,从而使得总体有效杀菌成分不再增加[16]。
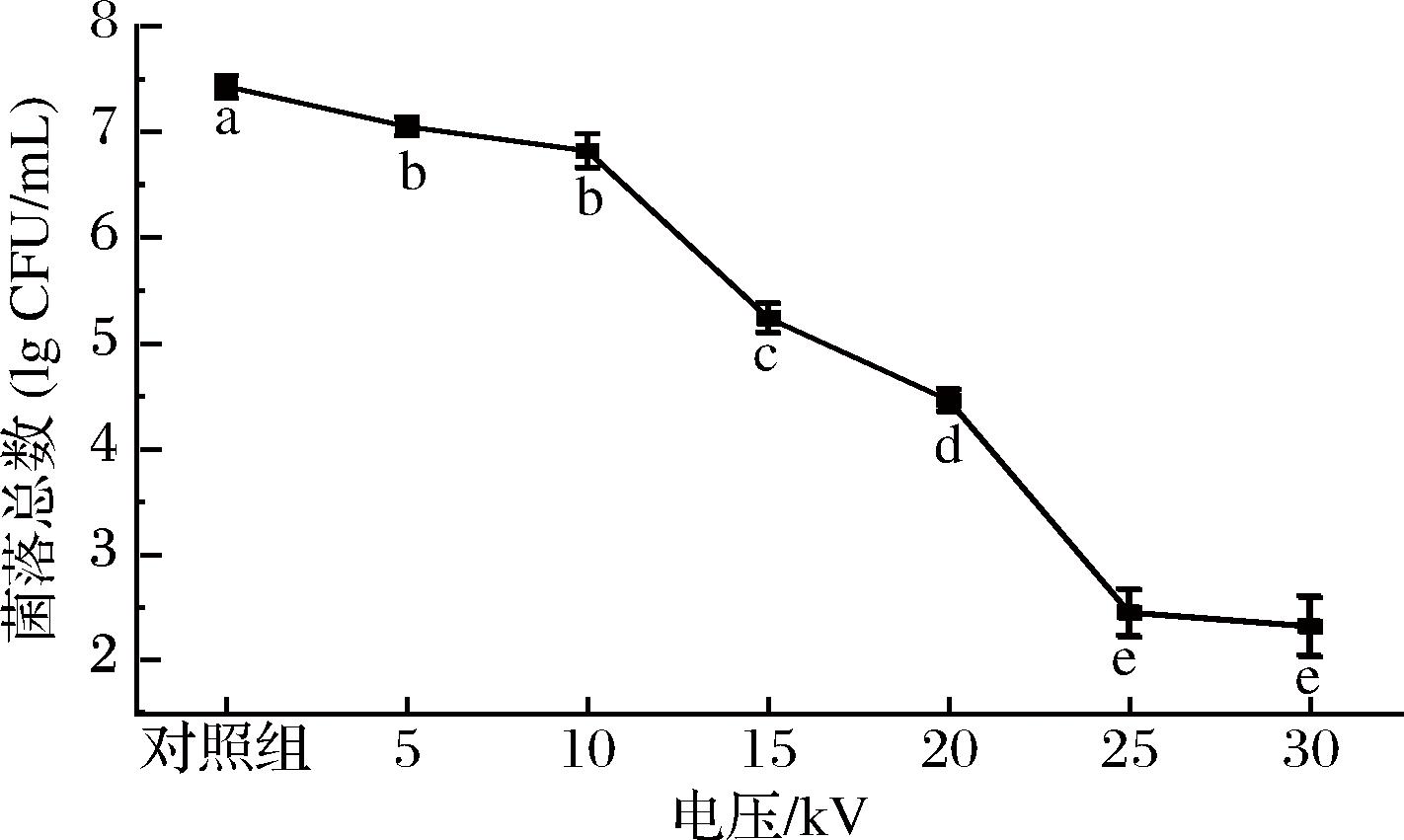
图3 NTP处理电压对PASW杀灭S.putrefaciens的影响
Fig.3 Effect of NTP produced by treatment voltages on PASW against S.putrefaciens
注:放电条件为放电频率10 kHz、放电距离10 mm、放电时间300 s;小写字母(a~e)表示差异有统计学意义(P<0.05)。
2.1.3 放电频率对PASW杀灭S.putrefaciens效果的影响
当控制放电峰值电压在25 kV时,仅改变NTP的处理频率,生成的PASW对S.putrefaciens的杀灭作用也有显著变化,结果如图4所示。在2.5~10 kHz范围内,随着NTP频率的逐渐增大,PASW的减菌能力呈线性增强(P<0.05)。当频率为2.5 kHz时,PASW未表现出显著的杀菌作用,处理后S.putrefaciens菌落数目仅从(7.38±0.04) lg CFU/mL减少到(7.27±0.12) lg CFU/mL。当频率进一步增加至5、7.5、10 kHz时,PASW的减菌能力显著增强,处理后S.putrefaciens菌落数分别显著降低至(6.17±0.11) lg CFU/mL、(4.19±0.11) lg CFU/mL和(2.31±0.26) lg CFU/mL。放电频率的升高会加剧“电子-气体分子-水分子”之间的碰撞,从而诱导更多ROS/RNS的生成,进而增强了PASW的杀菌能力[17]。
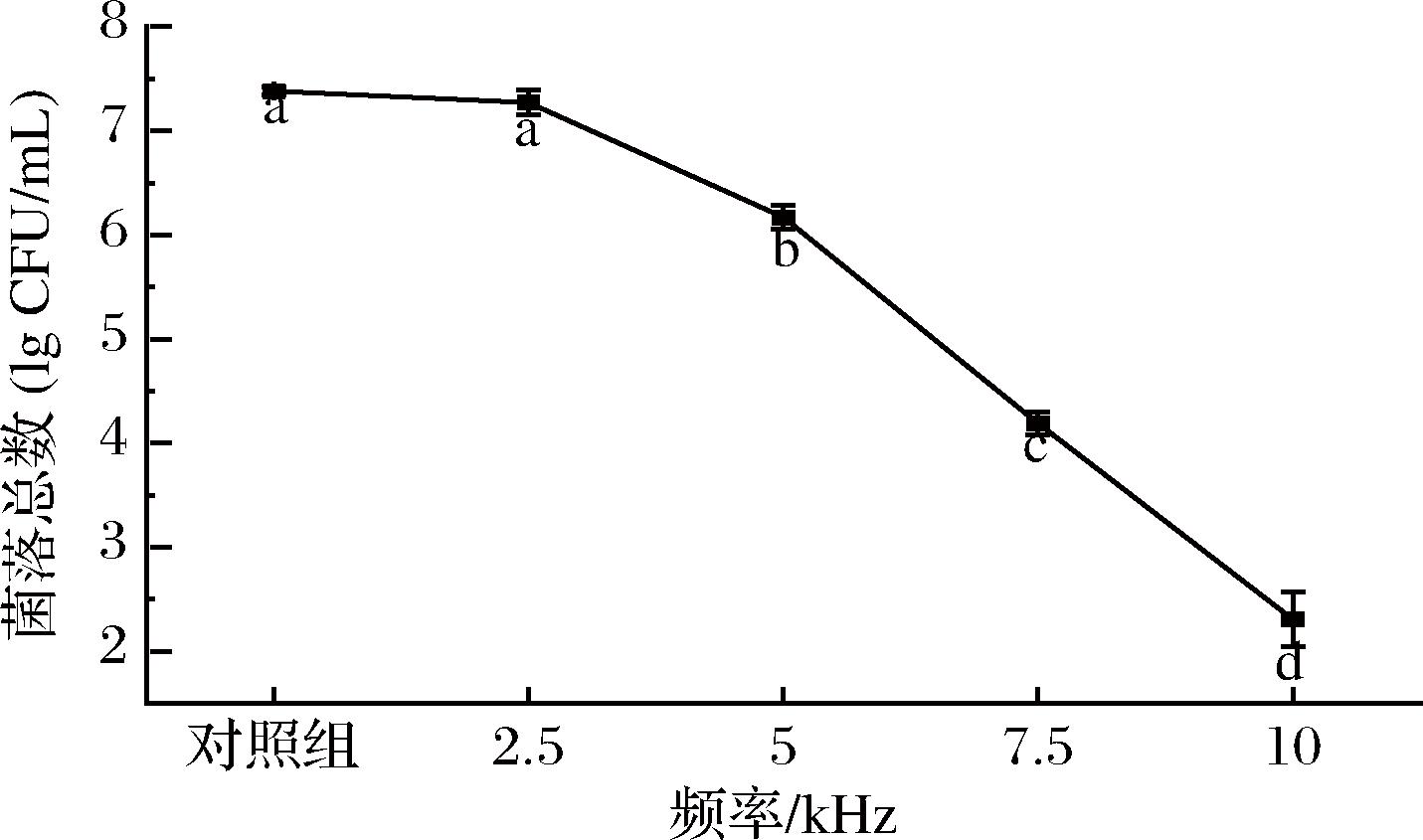
图4 NTP处理频率对PASW杀灭S.putrefaciens的影响
Fig.4 Effect of NTP produced by treatment frequency on PASW against S.putrefaciens
注:放电条件为峰值电压25 kV、放电距离10 mm、放电时间300 s;小写字母(a~d)表示差异有统计学意义(P<0.05)。
2.1.4 放电距离对PASW杀灭S.putrefaciens效果的影响
当控制放电峰值电压和频率在25 kV、10 kHz时,仅改变NTP的放电距离(即针尖和液面间的距离),PASW的杀菌能力也呈显著变化,结果如图5所示。当放电距离为10 mm时,NTP处理生成的PASW杀菌效果最佳,可减小S.putrefaciens菌落数达(5.16±0.18) lg CFU/mL。放电距离<10 mm或>10 mm都会使生成的PASW减菌能力显著降低(P<0.05)。放电距离会影响NTP处理时气相中各种ROS/RNS间的反应,从而影响了PASW中ROS/RNS的含量,进而影响其杀菌能力。如果放电距离过大,会加剧各种气相ROS/RNS与空气的反应,从而减小了PASW中气相ROS/RNS向水中迁移及溶解的量,进而减小了PASW的杀菌能力。如果放电距离过小,会导致更多的水分蒸发,湿度增加,从而可能影响PASW中ROS/RNS的浓度[18-19]。
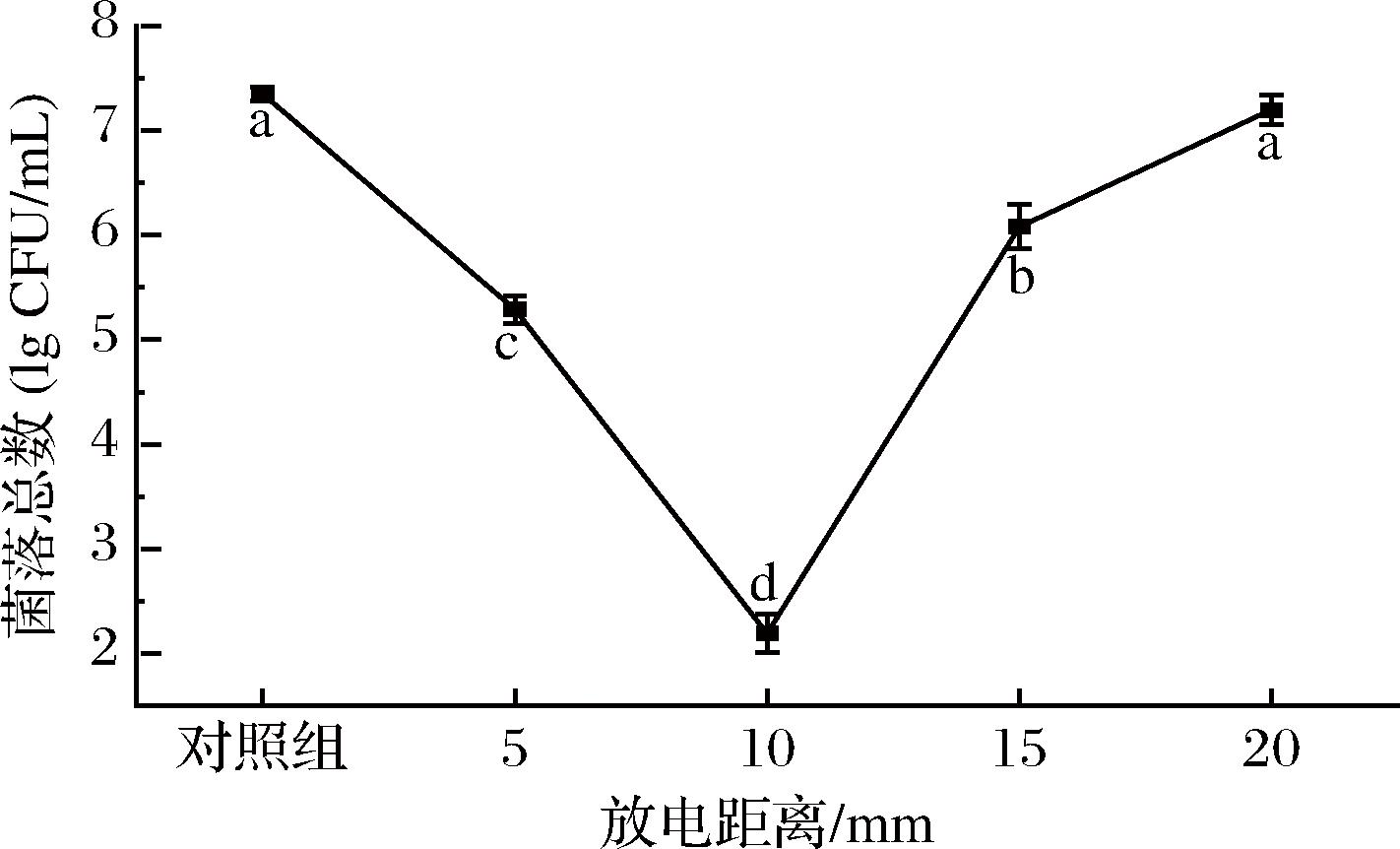
图5 NTP放电距离对PASW杀灭S.putrefaciens的影响
Fig.5 Effect of NTP produced by discharge distance on PASW against S.putrefaciens
注:放电条件为峰值电压25 kV、放电频率10 kHz、放电时间300 s;小写字母(a~d)表示差异有统计学意义(P<0.05)。
2.2 处理条件对PASW杀灭S.putrefaciens效果的影响
2.2.1 反应温度对PASW杀灭S.putrefaciens效果的影响
为了探究反应温度对PASW杀菌能力的影响,研究比较了5种温度(4、16、25、30、37 ℃)下NTP处理300 s的PASW杀灭S.putrefaciens效果的差异,结果如图6所示。随着反应温度的升高,PASW的杀菌能力显著增强。在4 ℃下,PASW仅能杀灭(2.38±0.16) lg CFU/mL的S.putrefaciens,而在25 ℃下,PASW-300可杀灭(5.32±0.18) lg CFU/mL的S.putrefaciens。当反应温度进一步提升至30 ℃和37 ℃时,菌落数分别减少了(5.78±0.22) lg CFU/mL和(6.04±0.10) lg CFU/mL。温度的变化,会影响到反应速率常数,导致活性物质的反应能力发生变化,最终影响活性物质的杀菌能力[20]。
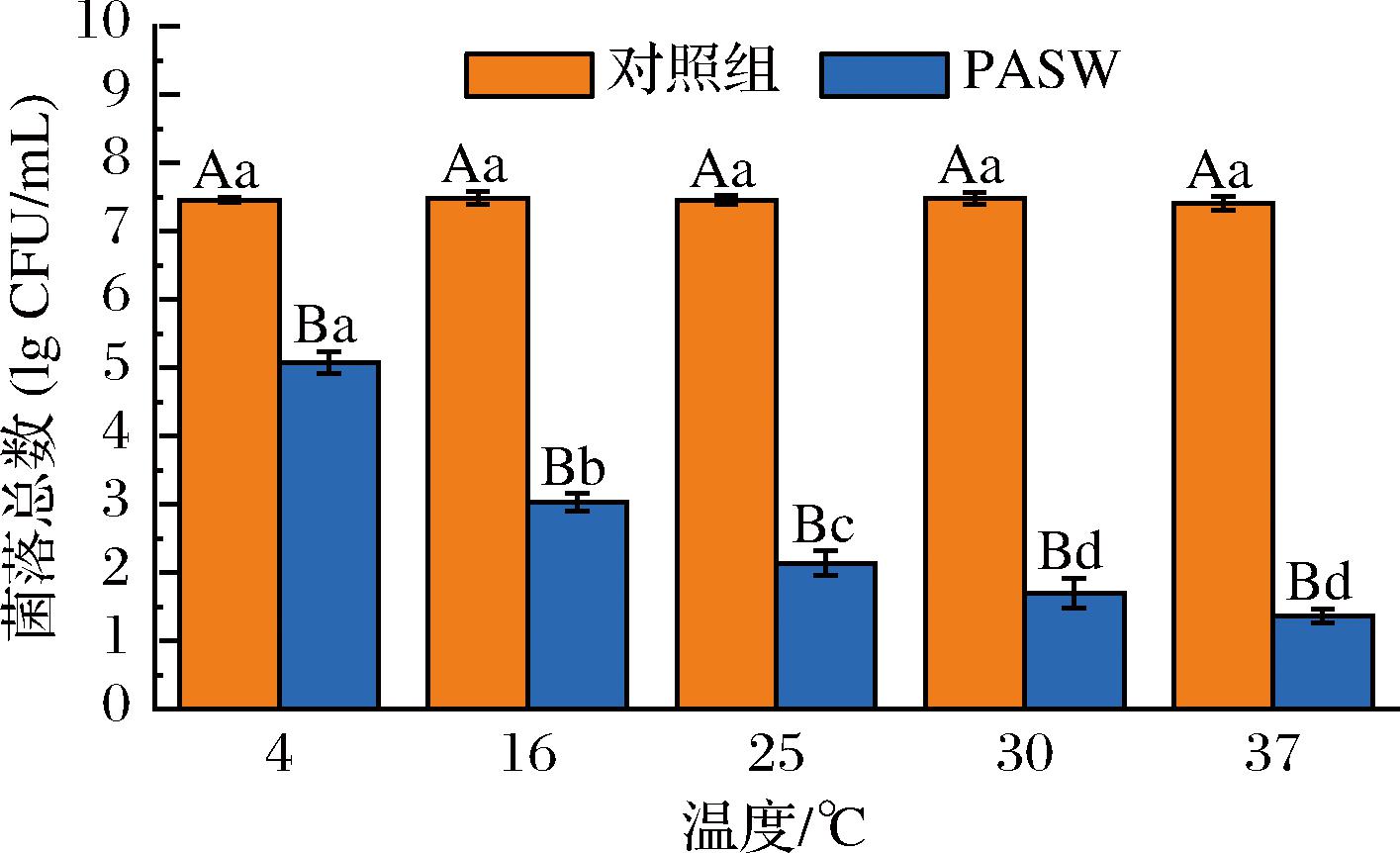
图6 反应温度对PASW杀灭S.putrefaciens的影响
Fig.6 Effect of reaction temperature on PASW against S.putrefaciens
注:放电条件为峰值电压25 kV、放电频率10 kHz、放电距离10 mm、放电时间300 s;大写字母(A,B)表示同一温度不同组别,小写字母(a~d)表示不同温度同一组别,均有统计学意义(P<0.05)。
2.2.2 贮藏时间、贮藏温度对PASW杀灭S.putrefaciens效果的影响
贮藏温度和贮藏时间对PASW杀菌能力的影响如图7所示。PASW的减菌能力随着贮藏时间的延长而逐渐减小。在4 ℃下贮藏0、4、8、12 h后,PASW在室温(25 ℃)下分别可杀灭(5.20±0.17) lg CFU/mL、(4.49±0.30) lg CFU/mL、(3.34±0.15) lg CFU/mL和(2.63±0.10) lg CFU/mL的S.putrefaciens。若贮藏时间进一步延长至24、48和72 h,菌落数减小值进一步减小至(1.57±0.16) lg CFU/mL、(0.68±0.23) lg CFU/mL和(0.17±0.07) lg CFU/mL。在25 ℃下也得到相似结论,即贮藏0、4、8、12 h后,PASW在室温(25 ℃)下分别可杀灭(5.51±0.26) lg CFU/mL、(4.21±0.18) lg CFU/mL、(3.09±0.12) lg CFU/mL和(2.51±0.16) lg CFU/mL的S.putrefaciens。若贮藏时间进一步延长至24、48和72 h,菌落数减小值进一步减小至(1.31±0.12) lg CFU/mL、(0.42±0.23) lg CFU/mL和(0.06±0.10) lg CFU/mL。上述结果表明,PASW的杀菌能力与贮藏时间呈负相关性,但与贮藏温度的关系不大。SHEN等[21]的研究也发现,随着贮藏时间的延长,PAW的杀菌效果明显下降。这是因为随着时间的推移,PAW中主要的杀菌因子(过氧化氢、亚硝酸根)的含量减少。该研究者还观察到,在4 ℃和25 ℃下,PAW的杀菌能力下降程度相似,两者没有显著差异,与本文的结论一致。然而,在-80 ℃下,PAW的杀菌能力保持得较好。这是因为在低温条件下,PAW中的杀菌因子衰减速度较慢。
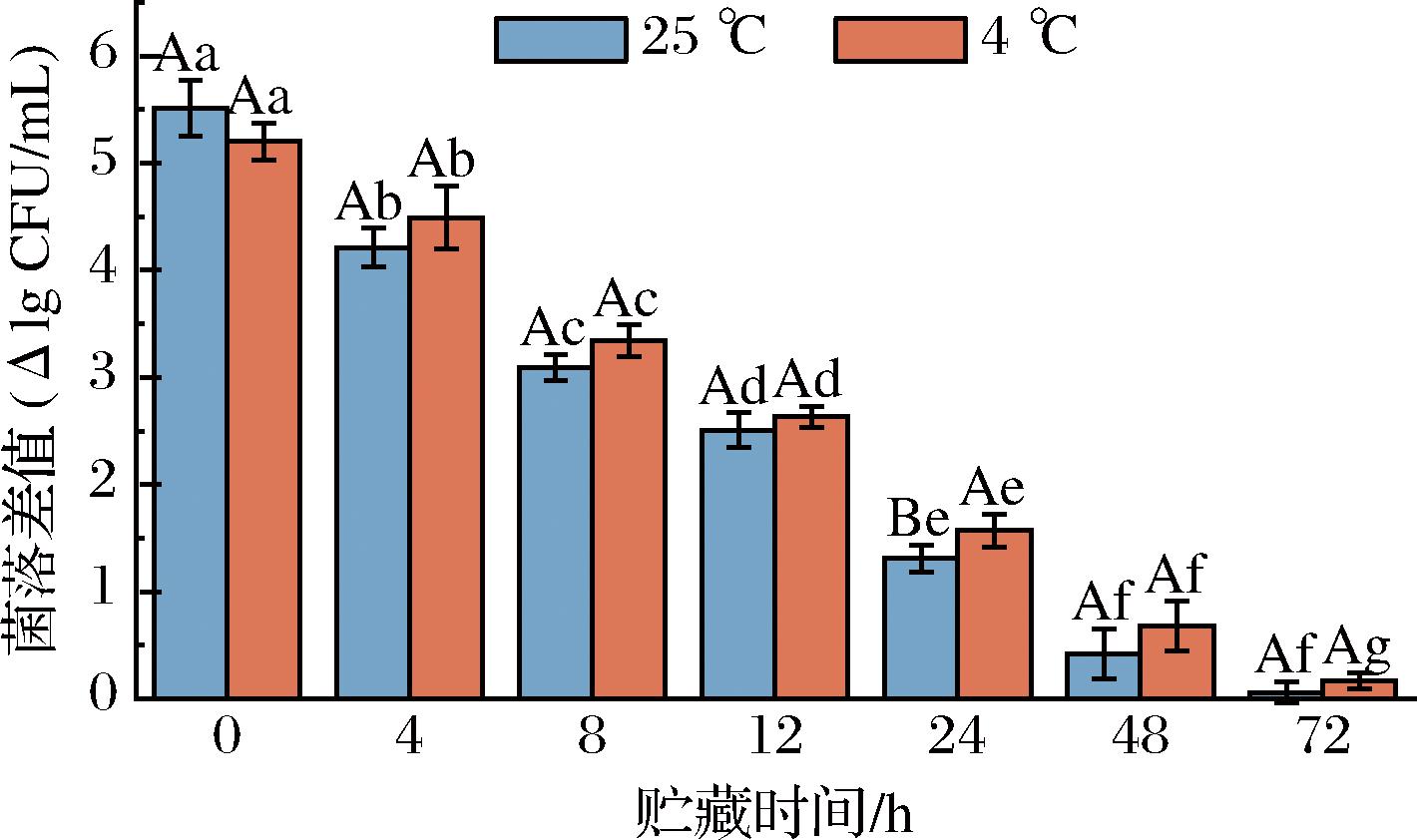
图7 贮藏时间、温度对PASW杀灭S.putrefaciens的影响
Fig.7 Effect of storage time and temperature on PASW against S.putrefaciens
注:放电条件为峰值电压25 kV、放电频率10 kHz、放电距离10 mm、放电时间300 s;大写字母(A,B)表示同一时间不同温度,小写字母(a~g)表示不同温度同一时间,均有统计学意义(P<0.05)。
3 结论
本文对不同生成条件和处理条件对PASW的减菌效果进行研究,结论如下:
a)对不同的生成条件进行研究发现,NTP处理时的气体组成、处理电压、处理频率、放电距离等对PASW杀灭S.putrefaciens的效果产生显著影响。在以空气为工作气体、峰值电压为25 kV、频率为10 kHz、放电距离为10 mm、放电300 s条件下得到的PASW杀菌能力最强,可杀灭(5.12±0.14) lg CFU/mL的S.putrefaciens。
b)对不同的反应条件进行研究发现,反应温度和贮藏时间对PASW的杀菌能力有显著影响,而贮藏温度对其杀菌能力的影响不显著。随着反应温度的升高,PASW的杀菌能力显著增强,而随着贮藏时间的延长,其杀菌能力显著降低。
[1] LANGMUIR I.Oscillations in ionized gases[J].Proceedings of the National Academy of Sciences of the United States of America, 1928, 14(8):627-637.
[2] GOMEZ E, RANI D A, CHEESEMAN C R, et al.Thermal plasma technology for the treatment of wastes:A critical review[J].Journal of Hazardous Materials, 2009, 161(2-3):614-626.
[3] MOREAU M, ORANGE N, FEUILLOLEY M G J.Non-thermal plasma technologies:New tools for bio-decontamination[J].Biotechnology Advances, 2008, 26(6):610-617.
[4] ELG D T, YANG I W, GRAVES D B.Production of TEMPO by O atoms in atmospheric pressure non-thermal plasma-liquid interactions[J].Journal of Physics D:Applied Physics, 2017, 50(47):475201.
[5] KIM J, GHIMIRE B, LIM S, et al.Coagulation, deformability, and aggregation of RBCs and platelets following exposure to dielectric barrier discharge plasma with the use of different feeding gases[J].Journal of Physics D:Applied Physics, 2019, 52(15):155202.
[6] 贾思曈, 张子迪, 陈存坤, 等.低温等离子体处理对冬枣贮藏品质及风味物质的影响[J].食品与发酵工业, 2024,50(15):231-240.JIA S T, ZHANG Z D, CHENG C K, et al.Effects of different transportation packaging on growth and physiological indexes of inoculated apples with Trichothecium roseum[J].Food and Fermentation Industries, 2024,50(15):231-240.
[7] ZHOU R W, ZHOU R S, WANG P Y, et al.Plasma-activated water:Generation, origin of reactive species and biological applications[J].Journal of Physics D:Applied Physics, 2020, 53(30):303001.
[8] AGUS R, AVINO F, IBBA L, et al.Implementing water recirculation in a novel portable plasma-activated water reactor enhances antimicrobial effect against Escherichia coli[J].Chemical Engineering Journal, 2024, 486:149915.
[9] HERIANTO S, HOU C Y, LIN C M, et al.Nonthermal plasma-activated water:A comprehensive review of this new tool for enhanced food safety and quality[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):583-626.
[10] HAN Q Y, WEN X, GAO J Y, et al.Application of plasma-activated water in the food industry:A review of recent research developments[J].Food Chemistry, 2023, 405:134797.
[11] ZHAO Y M, PATANGE A, SUN D W, et al.Plasma-activated water:Physicochemical properties, microbial inactivation mechanisms, factors influencing antimicrobial effectiveness, and applications in the food industry[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3951-3979.
[12] KE Z G, BAI Y W, YI Y Q, et al.Why plasma-activated water treatment reduced the malonaldehyde content in muscle foods[J].Food Chemistry, 2023, 403:134387.
[13] QI Z H, TIAN E Q, SONG Y, et al.Inactivation of Shewanella putrefaciens by plasma activated water[J].Plasma Chemistry and Plasma Processing, 2018, 38(5):1035-1050.
[14] ZHOU R W, ZHOU R S, PRASAD K, et al.Cold atmospheric plasma activated water as a prospective disinfectant:The crucial role of peroxynitrite[J].Green Chemistry, 2018, 20(23):5276-5284.
[15] HU M, GUO Y.The effect of air plasma on sterilization of Escherichia coli in dielectric barrier discharge[J].Plasma Science and Technology, 2012, 14(8):735-740.
[16] 乔维维, 黄明明, 王佳媚, 等.低温等离子体对生鲜牛肉杀菌效果及色泽的影响[J].食品科学, 2017, 38(23):237-242.QIAO W W, HUANG M M, WANG J M, et al.Effect of cold plasma on sterilization and color of fresh beef[J].Food Science, 2017, 38(23):237-242.
[17] HADINOTO K, ASTORGA J B, MASOOD H, et al.Efficacy optimization of plasma-activated water for food sanitization through two reactor design configurations[J].Innovative Food Science &Emerging Technologies, 2021, 74:102867.
[18] WINTER J, WENDE K, MASUR K, et al.Feed gas humidity:A vital parameter affecting a cold atmospheric-pressure plasma jet and plasma-treated human skin cells[J].Journal of Physics D:Applied Physics, 2013, 46(29):295401.
[19] OH J S, SZILI E J, OGAWA K, et al.UV-vis spectroscopy study of plasma-activated water:Dependence of the chemical composition on plasma exposure time and treatment distance[J].Japanese Journal of Applied Physics, 2017, 57(1):0102B9.
[20] BAI Y, IDRIS MUHAMMAD A, HU Y Q, et al.Inactivation kinetics of Bacillus cereus spores by plasma activated water (PAW)[J].Food Research International, 2020, 131:109041.
[21] SHEN J, TIAN Y, LI Y L, et al.Bactericidal effects against S.aureus and physicochemical properties of plasma activated water stored at different temperatures[J].Scientific Reports, 2016, 6(1):28505.